Method Article
Anticancerosos complejos metálicos: Síntesis y Evaluación de la citotoxicidad por el ensayo MTT
* Estos autores han contribuido por igual
En este artículo
Resumen
Un método para la síntesis de agentes de titanio y vanadio contra el cáncer sensibles al aire se describe, junto con la evaluación de su actividad citotóxica hacia línea celular de cáncer humano por el ensayo MTT.
Resumen
Complejos de titanio (IV) y vanadio (V) son agentes anticancerígenos altamente potentes. Un reto en su síntesis se refiere a su inestabilidad hidrolítica, por lo tanto su preparación debe llevarse a cabo bajo una atmósfera inerte. Evaluación de la actividad contra el cáncer de estos complejos se puede lograr mediante el ensayo de MTT.
El ensayo MTT es un ensayo de viabilidad colorimétrico basado en la reducción enzimática de la molécula de MTT a formazán cuando se expone a las células viables. El resultado de la reducción es un cambio de color de la molécula MTT. Las mediciones de absorbancia relativos a un control determinan el porcentaje restante de las células cancerosas viables después de su tratamiento con concentraciones variables de un compuesto ensayado, que se traduce a la actividad contra el cáncer compuesto y sus valores de CI 50. El ensayo MTT es ampliamente común en estudios de citotoxicidad debido a su precisión, rapidez y relativa sencillez.
En esto nos preenviado un protocolo detallado para la síntesis de los fármacos basados en metales sensibles al aire y mediciones de viabilidad celular, incluyendo la preparación de las placas de células, la incubación de los compuestos con las células, las mediciones de viabilidad utilizando el ensayo de MTT, y la determinación de los valores de IC50.
Introducción
La quimioterapia es todavía uno de los platos principales de los tratamientos empleados en la clínica para varias enfermedades de cáncer, por lo que gran cantidad de investigación se lleva a cabo en todo el mundo con el objetivo de desarrollar nuevos y mejores medicamentos contra el cáncer. Estos estudios comienzan principalmente a nivel químico, con el diseño y la preparación de los compuestos, seguido de evaluación biológica de las propiedades citotóxicas in vitro. La viabilidad celular puede evaluarse mediante diversos ensayos que proporcionan información sobre la actividad celular 1-2.
El cisplatino es un ejemplo de un complejo de platino que se utiliza ampliamente como un fármaco quimioterapéutico, que se considera un tratamiento eficaz principalmente para los cánceres testiculares y ováricos 3-4. Sin embargo, su estrecho rango de actividad y los efectos secundarios graves se activan los estudios de otros complejos de metales de transición potente 5-8. Entre otros, de titanio (IV) y vanadio complejos (V) mostraron resultados prometedores de alta actividad y reducentoxicidad 9-16. Ti (IV) fueron los primeros en entrar en ensayos clínicos después de cisplatino debido a estas propiedades, sin embargo, han fallado los ensayos debido a las dificultades de formulación y la inestabilidad hidrolítica. Hay así una necesidad actual para desarrollar mejores derivados de estos complejos metálicos que pueden combinar alta actividad contra el cáncer con resistencia al agua 15,17-21.
Un reto en la preparación de Ti (IV) y V (V) se refiere a complejos de la inestabilidad hidrolítica de los reactivos precursores, por lo tanto, la atmósfera inerte debe mantenerse. La preparación de Ti (IV) y V (V) compuestos se lleva a cabo en atmósfera de N2 o Ar condiciones en una caja de guantes o utilizando técnicas de línea Schlenk.
Un método común para la evaluación de la actividad anti-cáncer se basa en el MTT (3 - (4,5-dimetiltiazolil) -2,5-difeniltetrazolio) de ensayo. Este ensayo es un ensayo de viabilidad colorimétrico que se presentó en 1983 por Mosmann22. Está muy bien estudiado y caracterizado, y se considera altamente eficiente en la evaluación de la eficacia de nuevos compuestos citotóxicos debido a su precisión, rapidez, y su capacidad para ser aplicada en la variedad de líneas celulares. Este ensayo de viabilidad se basa en el cambio de color de la molécula MTT cuando se expone a las células viables. Medición de la absorbancia, que es proporcional al número de células viables, y la comparación con los controles no tratados, permite la evaluación de las capacidades de inhibición del crecimiento celular del compuesto ensayado.
El ensayo colorimétrico de MTT se lleva a cabo en un formato de 96 pocillos placa 23. Las células pueden requerir la preincubación en los pocillos antes de la adición del fármaco probado. Los tiempos de preincubación puede variar desde 0 hasta 24 horas de acuerdo con las propiedades de la línea celular. Las células están normalmente expuestas a la droga durante 24-96 horas, dependiendo de la actividad del fármaco. Solución de MTT se añade entonces a las células tratadas, en el que el gritanOW MTT se reduce a formazán púrpura por una variedad de enzimas mitocondriales y citosólicas que están en funcionamiento en las células viables (Figura 1) 24. La molécula de MTT no se reduce por las células muertas o células rojas de la sangre (células metabólicamente inactivos), células de bazo (células en reposo) y concanavalina A linfocitos estimulada (células activadas) 22. Después de 3-4 horas de incubación con MTT formazan los precipitados. La formación del formazano comienza después de 0,5 horas de incubación, pero para obtener resultados óptimos es mejor para exponer las células a MTT durante al menos 3 h 22. En consecuencia, se elimina el medio de cultivo y el formazán se disuelve en un disolvente orgánico, preferentemente isopropanol 25, aunque DMSO también se puede utilizar 26. La eliminación del medio es crucial para la consecución de resultados precisos desde rojo de fenol, que es ampliamente común en medio de crecimiento, y la precipitación de las proteínas pueden interferir con la medición de la absorbancia 25. Cuando la formaciónsolución Zan alcanza homogénea, la absorbancia de la solución se mide utilizando un espectrofotómetro lector de microplacas. La absorbancia a 550 nm es directamente proporcional al número de células en el rango de 200-50,000 células por pocillo, y por lo tanto muy pequeñas cantidades de células se puede detectar 22. La absorbancia indica la cantidad de células viables que se mantuvo después del tratamiento con el fármaco, y se compara con la absorbancia de células de control que no fueron expuestos a la droga. Análisis de los resultados por el software adecuado proporciona la IC50 (concentración de inhibición, el 50%) los valores y los errores estadísticos basados en varias repeticiones de la medición.
El ensayo MTT es ampliamente común en estudios de citotoxicidad para la selección de nuevos compuestos contra el cáncer, debido a su precisión y simplicidad relativa. Sin embargo, cuando se utiliza el ensayo MTT, que se dependía de la reacción enzimática, se debe considerar que varios inhibidores de la enzima pueden afectar a la reducción de MTT und conducir a falsos resultados 27. Además, el ensayo de MTT no proporciona ninguna información sobre el mecanismo molecular de la actividad citotóxica del fármaco 2.
Protocolo
- Preparación de la V (V) complejo (Figura 2); 18 conducta pasos 1.1 a 1.4 en una caja de guantes, si una caja de guante no está disponible, vaya a la alternativa pasos 2 (2.1 a 2.6).
- Disolver 0,42 mmol de los ligandos H 2 L en THF seco y agregarlo a una solución en agitación de cantidades equivalentes de VO (O i Pr) 3 en THF.
- Se agita la mezcla de reacción a temperatura ambiente durante 15 min, y eliminar los volátiles a vacío.
- Añadir hexano frío y quitarlo al vacío. Un polvo de color púrpura oscuro se debe obtener en un rendimiento cuantitativo.
- Pesar 8 mg del compuesto obtenido en un vial Eppendorf. Vaya directamente al paso 3.
- Preparar el complejo V (V) utilizando una línea Schlenk.
- Disolver 0,42 mmol del ligando H 2 L en THF seco en un matraz de Schlenk seco con una tapa de septo, se unen a una línea de Schlenk y se aplica entornos de vacío / gas inerte (N 2 o Ar) alterna; se recomienda aplicar tres sUCH rondas y esperar 2-5 minutos en las etapas de vacío.
- Añadir THF seco mediante una jeringa a través del tapón de septo.
- Añadir cantidades equivalentes de VO (O i Pr) 3 en una solución de THF, que había sido preparado de manera similar enganchando un matraz de Schlenk seco adecuado a la línea, la aplicación de un entorno inerte y la adición de los reactivos a través de una jeringa de la solución de vanadio a la de el ligando.
- Se agita la mezcla de reacción a temperatura ambiente durante 15 min y eliminar los volátiles a vacío, y si no es una preocupación de los productos inestables, tipo Schlenk de realizar la destilación de los volátiles bajo atmósfera inerte, el uso de flujo de gas inerte para unir el material de vidrio se requiere que había sido secado previamente .
- Añadir hexano frío y quitarlo al vacío. Un polvo de color púrpura oscuro se debe obtener en un rendimiento cuantitativo.
- Pesar 8 mg del compuesto obtenido en un vial Eppendorf.
- Preparación de Ti (IV) complejo (Figura 2); 28 conducta pasos 3.1 a 3.3 en una caja de guantes, si una caja de guantes no está disponible, ajustar las medidas alternativas analizadas para el análogo de vanadio (paso 2), que emplean una línea Schlenk lugar.
- Disolver 0,35 mmol del ligando H 2 L en THF seco y agregarlo a una solución en agitación de cantidades equivalentes de Ti (O i Pr) 4 en THF.
- Se agita la mezcla de reacción a temperatura ambiente durante 2 h. Eliminar los compuestos volátiles a vacío para dar un producto amarillo con un rendimiento cuantitativo.
- Pesar 8 mg del compuesto obtenido en el vial Eppendorf.
- Preparación de las células HT-29 placa de 96 pocillos
- Cultura HT-29 células en un matraz de 75 cm 2 con medio RPMI-1640 que contiene 1% de penicilina / antibióticos estreptomicina, 1% de L-glutamina, y suero bovino fetal al 10% (FBS), a 37 ° C con 5% de CO 2 .
- Retire el medio cuando las células HT-29 alcanzan la confluencia máxima (90-100%, cada 3-4 días sin subcultura). Lavar con 1 mlde tripsina (0,25%) / EDTA (0,05%) solución y retírela.
- Añadir 1 ml de tripsina (0,25%) / EDTA (0,05%) de la solución e incubar durante 5 min.
- Separar las células HT-29 del matraz y añadir 10 ml del medio para desactivar la actividad de la tripsina. Transferir 5 ml de la mezcla de células a un tubo.
- Use la pipeta para transferir unas gotas de la mezcla de las células en la cámara de mostrador. La cámara de contador incluye 5 x 5 plazas.
- Contar las células en 5 cuadrados representativos usando un microscopio: los 4 cuadrados en las esquinas y la que está en el medio.
- Calcula el importe estimado de las células presentes. Suma las celdas en las 5 plazas representativas y dividir por 20.
- Divida 0.6 por el resultado de la etapa 4.7. El número recibido es la cantidad de mezcla de células requerido por placa. Este cálculo se refiere a una placa que contiene 0,6 x 10 6 células (9000 células por pocillo).
- Use la pipeta para transferir la cantidad de mezcla de células requerido por ptarde (tal como se calcula en la sección 4.8) y añadir 13,2 ml del medio (200 l por pocillo × 66 pozos).
- Añadir la mezcla a placas de 96 pocillos con una pipeta de 11 canales (200 l por pocillo, 6 líneas, 66 pozos en total). Un pozo de cada línea debe permanecer vacío para el control blanco.
- Incubar la placa a 37 ° C con 5% de CO 2 durante 24 horas para permitir que las células se unan a la placa.
- La inserción de los compuestos
- Añadir 200 l (o diferente cantidad de acuerdo con el intervalo de concentración deseada) de THF seco a 8 mg de cada compuesto pesado como se describe en el paso 1.4 (o 2.6) o 3.3. Pesar 8 mg del ligando H 2 L, también.
- Diluir cada solución de compuesto adicional mediante la adición de 60 l de THF en 9 viales Eppendorf diferentes.
- Con una pipeta de 60 l de la mezcla en la sección 5.1 a la primera vial Eppendorf, se resuspende y la transferencia de 60 l al siguiente vial, y así sucesivamente hasta 10 concentraciones diferentes son Obtained (incluyendo la mezcla de los padres en la sección 5.1).
- Diluir 20 l de cada concentración en THF con 180 l de medio.
- Preparar una solución de control con sólo THF; 20 l de THF con 180 l de medio en cada medición.
- Añadir 10 l de la solución resultante (incluyendo el control de THF), a cada pocillo que ya contiene 200 l de la solución antes mencionada de las células en el medio para dar concentraciones finales de compuesto de hasta 200 mg / L (el intervalo de concentración puede ser cambiado de acuerdo con la actividad del compuesto).
- Usted puede observar algo de precipitación a la concentración más alta aplicada en función de la solubilidad del compuesto.
- Repita cada medición de los compuestos (3x 3 líneas en la placa del mismo compuesto); cada línea contiene: células tratadas con el compuesto en 10 concentraciones diferentes, 1 pocillo que contiene células tratadas con disolvente solo para el control y 1 bien sin células para blanco de control.
- Incubar la placa cargada durante 3 días a 37 ° C en el 5% atmósfera de CO 2.
- Medición de la citotoxicidad utilizando el ensayo MTT
- Preparar la solución de MTT mediante la adición de 1 g de polvo de MTT a una solución de medio RPMI-1640 200 ml sin rojo de fenol. La solución madre se pueden dividir para tubos de 15 ml y se almacenan en -20 ° C.
- Añadir 20 l de solución de MTT a cada pocillo con una pipeta de 11 canales (excepto a los pocillos de control de blanco sin las células de la etapa 4.10), e incubar la placa durante 3 h adicionales.
- Retire la solución del medio de cada pocillo.
- Añadir 200 l de isopropanol a cada pocillo para disolver el formazano. Agitar la placa durante 0,5 horas hasta que se alcanza la homogeneidad.
- Medir la absorbancia a 550 nm para 200 l de la solución mencionada anteriormente mediante un espectrofotómetro lector de microplacas.
- Repita cada medición (que incluye 3 repeticiones, consulte el paso 5.8) en 3 días diferentes.
- Calcular tél porcentaje de viabilidad celular mediante la deducción del valor de absorbancia de control en blanco del valor medido, dividiendo el resultado por la absorbancia del valor de control de disolvente THF y multiplicando por 100%.
- Calcular los valores de CI50 usando el software GraphPad Prism (o equivalente).
- El IC 50 reportado es el promedio de todos los valores de CI50 recogidos en al menos tres días diferentes, y el valor de error es la desviación estándar.
Resultados
Los complejos se prepararon sobre la base de los procedimientos establecidos 18,28 y su pureza se puede evaluar mediante análisis de RMN y elemental.
Los datos recibidos desde el ensayo de MTT se analizaron para evaluar la citotoxicidad del compuesto 18,21. En primer lugar, se realiza la resta del valor de absorbancia de control en blanco de todos los otros valores. En segundo lugar, el valor de control de disolvente de THF se establece en 100% de viabilidad, como no se añadió ningún compuesto inhibidor de crecimiento. Todos los demás valores se transformaron en porcentaje de viabilidad de acuerdo con el control. Las concentraciones aplicadas y el porcentaje de viabilidad relativa calculada se insertan entonces en el software GraphPad Prism (o equivalente) para determinar los valores de CI 50 sobre la base de una regresión no lineal de una pendiente variable (cuatro parámetros) modelo (Figura 4, Tabla 1) 29.
Las mediciones deben realizarse en un rangode concentraciones que producirán un gráfico que muestra una distribución de puntos, incluso: al menos tres puntos en cada meseta y tres puntos para definir la pendiente (figura 3, gráfico A). Mediciones insuficientes en concentraciones altas o bajas concentraciones (Figura 3, el gráfico B) se deteriorar el ajuste de regresión no lineal de la curva requerida para la determinación de valores de CI 50, y como consecuencia, disminuir su exactitud.
Relativos valores de CI 50, según lo determinado por el ajuste de regresión no lineal 29, corresponden a las concentraciones que conducen a 50% de la inhibición posible el crecimiento celular por el compuesto ensayado, que se calcula como el punto medio entre la máxima y la viabilidad celular mínima medida (no necesariamente 100% y 0%, respectivamente, véase la Figura 3, el gráfico C, a). Por ejemplo, si un compuesto inhibe sólo el 60% del crecimiento celular con respecto al control (0% y a baja concentracións), su relativa IC 50 es la concentración que conduce al 30% de inhibición con respecto al control. Los valores de error deben reflejar la desviación de los resultados obtenidos para las diferentes repeticiones de la media de valor de IC50 a conocer, como las enfermedades de transmisión sexual. Además, deben ser reportados valores de inhibición del crecimiento celular máxima (%), como se calculará restando del 100% mide la viabilidad mínima.
Un análisis alternativo puede incluir la determinación de los absolutos IC 50 valores. Estos corresponden a las concentraciones que conducen al crecimiento de células 50% de inhibición con respecto al control 100%, independientemente de la viabilidad celular máxima y mínima medida. Estos valores también pueden ser derivados por un modelo de regresión no lineal. Como estos valores son absolutos, informar de los valores de inhibición de crecimiento celular máxima es opcional. Como se representa en la Figura 3, el gráfico C, un compuesto puede tener una actividad relativamente baja en términos de célula máxima gpropiedades de inhibición de recimiento (curva A), y aún exhibir un pariente valor de CI 50 que no sólo es más bajo que su uno absolutos, sino también que la de un compuesto que alcanza cerca de inhibición del crecimiento de 100% (curva b). Por lo tanto, es muy importante para presentar la curva junto con los reportados IC 50 valores de ningún tipo.
Cuando la inspección de los resultados de los experimentos descritos en el protocolo (Figura 4, Tabla 1), es evidente que el cisplatino y complejos de LTi (O i Pr) 2 y VO (O i Pr) son muy activos. También se observa que cuanto más cerca del valor de inhibición máxima de un compuesto dado es de 100%, la más cerca de la relación valor de CI 50 es el absoluto. Al comparar los valores de CI 50 entre los diferentes compuestos, el Ti (IV) complejo tiene la mayor citotoxicidad y sus valores de IC50 son inferiores a los del cisplatino y el (V) V complejo. Sin embargo, la frecuencialigando exposiciones e marcadamente menor actividad, ya que después de la adición del ligando a diferentes concentraciones, la viabilidad celular no baja tan significativa como lo hace con sus complejos. Esto asegura que la alta actividad anticancerígena de los complejos se basa en los centros metálicos. Dado que el ligando libre apenas llega a la inhibición del crecimiento celular del 50%, un valor absoluto de CI 50 no se puede deducir con precisión. De hecho, un valor relativo también podría no haber sido calculado adecuadamente por el software debido a la menor actividad y los correspondientes valores de error alta. Sin embargo, está claro que incluso si un pariente valor de CI 50 podría haber sido derivado para H 2 L, no habría reflejado una actividad apreciable, haciendo por lo tanto el informe del valor a lo largo de la inhibición máxima con relativa IC 50 valores (y la representación de la curva) esencial.
| Relativa IC 50 (M) | Absoluto IC 50 (M) | La inhibición máxima (%) | |
| LVO (O i Pr) | 13 ± 3 | 19 ± 8 | 81% |
| LTi (O i Pr) 2 | 3 ± 1 | 5 ± 3 | 87% |
| H 2 L | - | - | 47% |
| Cisplatino | 14 ± 5 | 13 ± 6 | 91% |
Tabla 1. Resultados de citotoxicidad para los compuestos ensayados: relativa y absoluta de IC 50 (M) y los valores de inhibición de crecimiento celular máximos hacia células HT-29 después de un período de incubación de tres días con el V (V) LVO complejo (O i Pr), Ti (IV ) complejo LTi (O i Pr) 2, el ligando libre de H 2 L y cisplatino; 18,21 IC 50 valores se expresan como media de al l oriente tres veces tres repeticiones con los valores de error como las enfermedades de transmisión sexual.

Figura 1. La reducción de MTT por las enzimas mitocondriales y citosólicas de formazán. Haz clic aquí para ver más grande la figura .
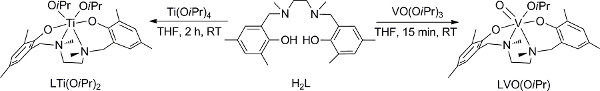
Figura 2. Preparación de V (V) y Ti (IV) 18,28. Haga clic aquí para ver más grande la figura .
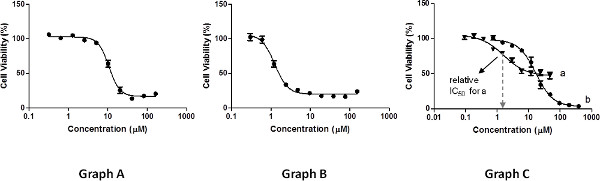
Figura 3. Ejemplos de resultados de las mediciones de viabilidad celular. Haga clic aquí para ver más grande la figura .

Figura 4. Dosis curvas de citotoxicidad dependientes de los compuestos ensayados: Dependencia de HT-29 la viabilidad celular en la concentración administrada de la V (V) LVO complejo (O i Pr) (azul), el Ti (IV) complejo LTi (O i Pr) 2 ( rojo), ligando libre H 2 L (negro) y cisplatino (verde), después de un período de incubación de tres días como Obtained a partir de al menos tres veces tres repeticiones como se refleja por el error de valores de 18,21.
Discusión
El método descrito en este manuscrito combina síntesis química con ensayo de viabilidad celular biológica. Al igual que con cualquiera de los métodos biológicos relativos a las células viables, es de vital importancia para trabajar en una campana laminar, y mantener las condiciones estériles, incluyendo el uso de disolventes orgánicos estériles. También, la preparación y el almacenamiento de los medicamentos basados en metales hidrolíticamente inestable deben llevarse a cabo bajo condiciones inertes, para los que las técnicas de caja de guantes o línea Schlenk se deben utilizar.
La selección de la técnica para trabajar en ambiente inerte depende principalmente de la disponibilidad de una caja de guantes. Si uno está disponible, todas las síntesis que requieren condiciones de temperatura ambiente son muy convenientes para llevar a cabo el mismo. Las síntesis que requieren calefacción se toman normalmente fuera de la caja en un matraz de Schlenk y se unen a la línea de Schlenk. Cuando una caja de guantes no está disponible, todas las manipulaciones se pueden llevar a cabo con material de vidrio cuidadosamente seleccionado en un schlenk línea, durante el uso de la / gas inerte vacío (N2 o Ar) manipulaciones para mantener la atmósfera seca.
En el proceso de evaluación de la citotoxicidad, es necesario observar el aspecto de las células de todo el experimento. Antes del comienzo del experimento, el medio de crecimiento de células adherentes sanos debe ser clara. Un cultivo contaminado aparecerá turbia. Además, después de la incubación de las células con tripsina-EDTA, las células deben separar del matraz y se sumerja en el medio. Si la mayoría de las células quedan adheridas al matraz, el matraz se debe incubó adicionalmente durante varios minutos.
La longitud de una dicha medición es de cinco días. Nos permitimos de un día para las células adherentes para sujetar y aclimatarse a la placa de células, y tres días de la incubación de las células con los fármacos probados con el fin de permitir a las células para proceder a la apoptosis. Se requiere un día adicional para incubación con MTT. Todo este MeasureMeNT debe repetirse al menos dos veces más en diferentes días a partir de cultivos de células diferentes, a fin de que las mediciones sean independientes.
La técnica tal como se describe en el presente documento se aplica en tipos de células adherentes. Para la aplicación de este método en los tipos de células no adherentes se deben hacer varios ajustes. Ya no se requiere dedicar un día para las células se unan y se aclimatan a la placa de células, y por lo tanto la preparación de la placa y el suplemento de los fármacos probados se pueden realizar en el mismo día. Además, en la etapa final de la medición, justo después de la incubación de las células con MTT, la solución debe ser centrifugado antes de la eliminación del medio y la adición de isopropanol.
También es posible sustituir la utilización de MTT como el marcador de células vitales con un ensayo alternativo para la inhibición del crecimiento celular, en el que el tiempo de incubación de las células con el marcador es más corto que tsombrero con MTT 30. Otro factor a considerar al elegir el marcador es el posible mecanismo de acción del fármaco probado 27. El ensayo de MTT proporciona información sobre las mitocondrias de la actividad metabólica, y puesto que es dependiente de las reacciones enzimáticas, que puede ser influenciado por inhibidores de la enzima.
La combinación de la preparación de la droga con la evaluación de su citotoxicidad mediante el ensayo de MTT representa un método eficaz para el desarrollo de nuevos fármacos citotóxicos a base de metal. Sin embargo, este método no proporciona ninguna información sobre el mecanismo de la muerte celular, la fase en el ciclo celular que se ve afectado por el fármaco y sus posibles dianas biológicas. Para estos propósitos métodos adicionales, tales como yoduro de propidio (PI) Ensayo de absorción y análisis del ciclo celular se deben realizar 31.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Se ha recibido financiación del Consejo Europeo de Investigación dentro del Séptimo Programa Marco de la Comunidad Europea (FP7/2007-2013) / acuerdo de subvención del CEI no [239603]
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Fetal bovine serum (FBS) | Biological Industries | 04-007-1A | |
| Hexane AR | Gadot | 830122313 | Dried using a solvent drying system |
| HT-29 cell line | ATCC | HTB-38 | |
| Isopropanol AR | Gadot | 830111370 | |
| L-glutamine | Biological Industries | 03-020-1B | |
| MTT | Sigma-Aldrich | M5655-1G | |
| Penicillin/streptomycin antibiotics | Biological Industries | 03-031-1B | |
| RPMI-1640 with phenol red with L-glutamine | Sigma-Aldrich | R8758 | |
| RPMI without phenol red | Biological Industries | 01-103-1A | |
| Tetrahydrofuran (THF) AR | Gadot | 830156391 | dried using a solvent drying system |
| Ti(OiPr)4 | Sigma-Aldrich | 205273-500ML | moisture sensitive |
| Trypsin/EDTA | Biological Industries | 03-052-1B | |
| VO(OiPr)3 | Sigma-Aldrich | 404926-10G | moisture sensitive |
| Equipment | |||
| 12-channel pipette 30-300 μl | Thermo Scientific | ||
| 12-channel pipette 5-50 μl | Finnpipette | ||
| 75 cm2 flask | NUNC | 156472 | |
| 96-well plate with lid (flat bottom) | NUNC | 167008 | |
| CO2 Incubator | Binder | APT.line C150 | |
| Counter chamber | Marienfeld-Superior | 650030 | |
| Eppendorf vial | KARTELL | ||
| Glove box | M. Braun | ||
| Laminar flow hood | ADS LAMINAIRE | OPTIMALE 12 | |
| Microplate reader spectrophotometer | Bio-Tek | El-800 | |
| Microscope | Nikon | Eclipse TS100 | |
| Pipette 20-200 μl | Finnpipette | ||
| Pipette 5-50 μl | Finnpipette | ||
Referencias
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opinion on Drug Discovery. 3, 655-669 (2008).
- Hatok, J., et al. In vitro assays for the evaluation of drug resistance in tumor cells. Clinical and Experimental Medicine. 9, 1-7 (2009).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4, 307-320 (2005).
- Muggia, F. Platinum compounds 30 years after the introduction of cisplatin: Implications for the treatment of ovarian cancer. Gynecologic Oncology. 112, 275-281 (2009).
- Bruijnincx, P. C., Sadler, P. J. New trends for metal complexes with anticancer activity. Current Opinion in Chemical Biology. 12, 197-206 (2008).
- Ott, I., Gust, R. Non platinum metal complexes as anti-cancer drugs. Archiv der Pharmazie (Weinheim. 340, 117-126 (2007).
- Desoize, B. Metals and metal compounds in cancer treatment. Anticancer Research. 24, 1529-1544 (2004).
- Jakupec, M. A., Galanski, M., Arion, V. B., Hartinger, C. G., Keppler, B. K. Antitumour metal compounds: more than theme and variations. Dalton Transactions. , 183-194 (2008).
- Meléndez, E. Titanium complexes in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 309-315 (2002).
- Evangelou, A. M. Vanadium in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 249-265 (2002).
- Djordjevic, C. Antitumor activity of vanadium compounds. Metal ions in biological systems. 31, 595-616 (1995).
- Caruso, F., Rossi, M., Pettinari, C. Anticancer titanium agents. Expert Opinion on Therapeutic Patents. 11, 969-979 (2001).
- Caruso, F., Rossi, M. Antitumor titanium compounds. Mini-Review in Medicinal Chemistry. 4, 49-60 (2004).
- Kostova, I. Titanium and vanadium complexes as anticancer agents. Anti-Cancer Agents in Medicinal Chemistry. 9, 827-842 (2009).
- Tshuva, E. Y., Ashenhurst, J. A. Cytotoxic Titanium(IV) Complexes: Renaissance. European Journal of Inorganic Chemistry. , 2203-2218 (2009).
- Buettner, K. M., Valentine, A. M. Bioinorganic Chemistry of Titanium. Chemical Reviews. 112, 1863-1881 (2012).
- Meker, S., Margulis-Goshen, K., Weiss, E., Magdassi, S., Tshuva, E. Y. High antitumor activity of highly resistant salan-titanium(IV) complexes in nanoparticles: an identified active species. Angewandte Chemie International Edition in English. 51, 10515-10517 (2012).
- Reytman, L., Braitbard, O., Tshuva, E. Y. Highly cytotoxic vanadium(V) complexes of salan ligands; insights on the role of hydrolysis. Dalton Transactions. 41, 5241-5247 (2012).
- Tzubery, A., Tshuva, E. Y. Cytotoxicity and Hydrolysis of trans-Ti(IV) Complexes of Salen Ligands: Structure-Activity Relationship Studies. Inorganic Chemistry. 51, 1796-1804 (2012).
- Tshuva, E. Y., Peri, D. Modern cytotoxic titanium(IV) complexes; Insights on the enigmatic involvement of hydrolysis. Coordination Chemistry Reviews. 253, 2098-2115 (2009).
- Shavit, M., Peri, D., Manna, C. M., Alexander, J. S., Tshuva, E. Y. Active cytotoxic reagents based on non-metallocene non-diketonato well-defined C-2-symmetrical titanium complexes of tetradentate bis(phenolato) ligands. Journal of the American Chemical Society. 129, 12098-12099 (2007).
- Mosmann, T. Rapid Colorimetric Assay for Cellular Growth and Survival - Application to Proliferation and Cyto-Toxicity Assays. Journal of Immunological Methods. 65 (83), 55-63 (1983).
- Ahmadian, S., Barar, J., Saei, A. A., Fakhree, M. A. A., Omidi, Y. Cellular Toxicity of Nanogenomedicine in MCF-7 Cell Line: MTT assay. Journal of Visualized Experiments. (26), e1191(2009).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology in Vitro. 15, 257-259 (2001).
- Denizot, F., Lang, R. Rapid Colorimetric Assay for Cell-Growth and Survival - Modifications to the Tetrazolium Dye Procedure Giving Improved Sensitivity and Reliability. Journal of Immunological Methods. 89, 271-277 (1986).
- Alley, M. C., et al. Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Research. 48, 589-601 (1988).
- Weyermann, J., Lochmann, D., Zimmer, A. A practical note on the use of cytotoxicity assays. International Journal of Pharmaceutics. 288, 369-376 (2005).
- Chmura, A. J., et al. Group 4 complexes with aminebisphenolate ligands and their application for the ring opening polymerization of cyclic esters. Macromolecules. 39, 7250-7257 (2006).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10, 128-134 (2011).
- Yung, W. K. A. In vitro Chemosensitivity Testing and its Clinical-Application in Human Gliomas. Neurosurgical Review. 12, 197-203 (1989).
- McCarthy, N. J., Evan, G. I. Current Topics in Developmental Biology. 36, 259-278 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados