Method Article
Um
Neste Artigo
Resumo
Estamos apresentando um In vivo Ensaio para testar a permeabilidade dos vasos sanguíneos. Este ensaio baseia-se na injecção intravenosa de uma visualização do corante e subsequente da sua difusão para os espaços intersticiais.
Resumo
Este método baseia-se na injecção intravenosa de azul de Evans nos ratinhos como modelo animal de teste. Azul de Evans é um corante que se liga a albumina. Sob condições fisiológicas o endotélio é impermeável à albumina, de modo do azul de Evans encadernados restos de albumina restrito dentro dos vasos sanguíneos. Em condições patológicas que promovem o aumento da permeabilidade vascular células endoteliais parcialmente perder seus contatos próximos e com o endotélio torna-se permeável a pequenas proteínas, como a albumina. Esta condição permite o extravasamento de azul de Evans dos tecidos. Um endotélio saudável impede o extravasamento do corante nos tecidos vizinhos vascularizados. Órgãos com aumento da permeabilidade irá mostrar um aumento significativo em comparação com coloração azul órgãos com endotélio intacto. O nível de permeabilidade vascular pode ser avaliado por simples visualização ou por medição quantitativa do corante incorporado por miligrama de tecido de controlo versus animal experimental / tecido. Dois powerful aspectos deste ensaio são a simplicidade e características quantitativas. O Evans Blue, podem ser extraídos a partir de tecidos por incubação de uma quantidade específica de tecido em formamida. Evans Blue é a absorvância máxima a 620 nm e a absorvência é mínima a 740 nm. Utilizando uma curva padrão para o azul de Evans, medições da densidade óptica pode ser convertida em miligrama de corante capturado por miligrama de tecido. A análise estatística deve ser usado para avaliar diferenças significativas na permeabilidade vascular.
Introdução
Formação e manutenção de barreiras permeáveis selectivos são essenciais para o desenvolvimento do órgão apropriado e 1,2 desempenho. Linha de células endoteliais do lúmen do vaso sanguíneo e formar uma barreira semi-permeável, que é essencial para o transporte selectivo entre o sangue e o espaço intersticial de todos os órgãos. Uma barreira de permeabilidade adequada é mantida através apertados célula-a-célula junções que são estritamente controladas por factores de crescimento, citoquinas e moléculas de stress outros produtos 3. O rompimento da barreira de células endoteliais pode resultar em aumento da permeabilidade vascular e de fuga. Estes efeitos são observados em vários estados de doença e a compreensão da sinalização sublinhado molecular requer métodos multidisciplinares 4,5. Neste artigo, descreve um método in vivo para medir a permeabilidade vascular utilizando um modelo de rato.
O ensaio que se descreve, também conhecido como ensaio de Miles, é uma bem establtada método para testar a permeabilidade vascular in vivo. O ensaio baseia-se no facto de que, sob condições fisiológicas basais, a albumina não atravessa a barreira endotelial. Azul de Evans, um corante azóico com elevada afinidade para a albumina, é injectado na corrente sanguínea de um animal experimental e, sob condições fisiológicas, é esperado para ser restringida dentro dos vasos sanguíneos. Quando um estímulo permeabilidade vascular é adicionado, quer por aplicação tópica ou sistemicamente, os vasos sanguíneos começar a vazar proteína e, assim, também o azul de Evans, que se liga à albumina. Isto resulta numa coloração rápida azulada dos tecidos que têm vasos permeáveis.
Injecção com êxito do corante na veia da cauda do rato lateral é crítica para o bom resultado do experimento. Técnica de injecção da veia da cauda requer prática extensiva e deverá ser dominadas antes de se iniciar a experiência.
Permeabilidade vascular é altamente dependente da idade e do peso do umImal, então quando comparando diferentes linhagens de camundongos, é imperativo que os ratos ou outros assuntos de teste têm perto de datas de nascimento e peso idênticos. Outros factores que influenciam a permeabilidade da barreira endotelial são condições ambientais, tais como temperatura, humidade, e muito importante, o stress manuseamento do rato. Devido ao grande número de fatores que podem influenciar o resultado do experimento, é sempre aconselhável que o experimento é repetido pelo menos três vezes e análise estatística realizada.
Este ensaio pode ser utilizado para comparar a permeabilidade ou vaso de ratos que foram geneticamente modificadas, bem como os ratos com diferentes antecedentes genéticos. A permeabilidade pode ser determinada na presença ou na ausência de um estímulo, dependendo da função do gene, que é modulada. Este ensaio também pode ser usado ou para testar o efeito de diferentes compostos sobre a permeabilidade do vaso.
Protocolo
1. Injecção intravenosa de azul de Evans na veia da cauda do rato Lateral
- Prepara-se uma solução de 0,5% de azul de Evans estéril em PBS. Se necessário, esterilizar por filtração da solução para remover qualquer matéria particulada que não se dissolveu.
- Aspirar 200 ul solução azul de Evans para uma seringa. Evitar as bolhas de ar que possam ter escapado para a seringa.
- Coloque ratos que são de 8-12 semanas de idade para um dispositivo de retenção de modo a que o animal não seja livremente móvel, mas a cauda podem ser manipulados.
- Colocar o dispositivo de retenção do rato sobre o seu lado, de modo a veia lateral da cauda é facilmente visível e está virada para cima.
- Segure a cauda com a mão não-dominante entre o polegar eo dedo indicador.
- Inserir a agulha (calibre pequeno, 27-30) a uma antecedência 10-15 graus de ângulo, bisel para cima, para dentro da veia lateral da cauda na direcção da cabeça. Manter o paralelo agulha e seringa para a cauda.
- Do não aplicar pressão para trás para confirmar a colocação correta, pois isso poderia entrar em colapso da veia.
- Lentamente injetar 200 ul Evans solução azul na veia da cauda do rato.
- Observar a facilidade com que os avanços de êmbolo, tal como esta é a prova da correcta colocação da agulha na veia.
- Coloque o mouse em sua gaiola e observá-lo durante 30 minutos.
2. Recolha de órgãos e Extração de azul de Evans dos Órgãos
- Sacrificar os animais por deslocamento cervical. Para fins de ensaio Miles deslocamento cervical é recomendada, uma vez que limita a interferência significativa com a permeabilidade vascular. Sacrificar todos os ratinhos, ao mesmo tempo, tão rápido quanto possível. Trabalhar com grupos de 6 ratinhos ou menos, porque logo após os vasos sanguíneos se tornam mais permeáveis morte.
- Coloque os ratos em suas costas e fixar os pés em uma placa branca.
- Abra a cavidade abdominal e torácica para expor thorórgãos Acic e abdominal.
- Tire fotos representativas para mostrar diferenças em Evans extravasamento Azul. Incluir todos os ratos no mesmo campo, a fim de ter condições de iluminação idênticas para todos os ratos.
- Coletar órgãos de interesse e colocá-los em tubos de 1,5 ml
- Pesar um tubo vazio e levar o valor do equilíbrio de zero.
- Transfira a amostra de tecido e peso,. Repetir para todas as amostras de tecido. Os tecidos podem ser secos ao ar para eliminar a variabilidade teor de água entre os diferentes órgãos.
- . Adicionar 500 ul de formamida a cada tubo de amostra de tecido.
- Transferir todos os tubos para um banho de água 55 ° C ou bloco de calor. Incubar durante 24-48 h, para extrair Azul de Evans do tecido.
3. Quantificação de azul de Evans extravasado no tecido intersticial
- Centrifugar a formamida / azul de Evans mistura a pelota quaisquer fragmentos de tecido remanescentes.
- Medir a absorvância a 610nm. Use 500 Formamida ul como em branco.
- Calcular ng Azul de Evans extravasado por mg de tecido.
- Traçar todos os dados em um gráfico.
- Realizar a análise estatística para determinar diferenças significativas.
Resultados
Foi utilizado um ensaio in vivo para testar a permeabilidade vazamento navio em ratinhos de 8-12 semanas de idade. Este teste é útil para comparar a permeabilidade vascular relativa entre animais de fundo genético diferente ou em uma única estirpe de ratos submetidos a tratamentos que afectam a vasculatura. Os nossos resultados mostram que a estirpe de murganhos geneticamente modificados, criados no nosso laboratório tem um endotélio mais permeável em comparação com ratinhos de tipo selvagem. Estas alterações são evidentes ao nível macroscópico em vários órgãos (Figura 1).
Fomos capazes de quantificar a diferença de permeabilidade vascular por spectophotometricaly medir o azul de Evans que foi capturado por grama de tecido em diferentes órgãos. Como observamos na Figura 2 mostram diferentes órgãos resposta diferente a sinais indutores de permeabilidade e, assim, mostrar acúmulo corante diferente. Esta é também uma função dos níveis de vascularização em tecidos diferentes.
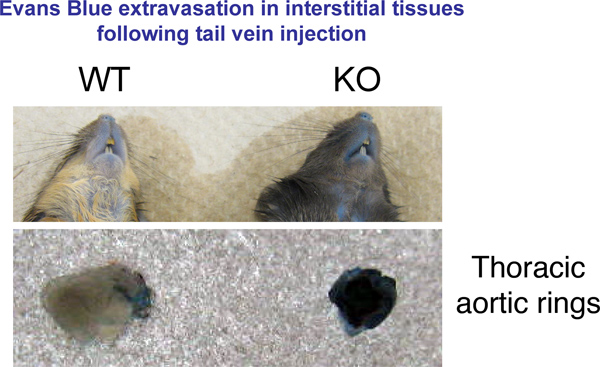
Figura 1. Evans extravasamento azul em tecidos. 30 minutos após injeção de azul de Evans ratos foram sacrificados por deslocamento cervical. Imagens representativas de órgãos de interesse foram tomadas.
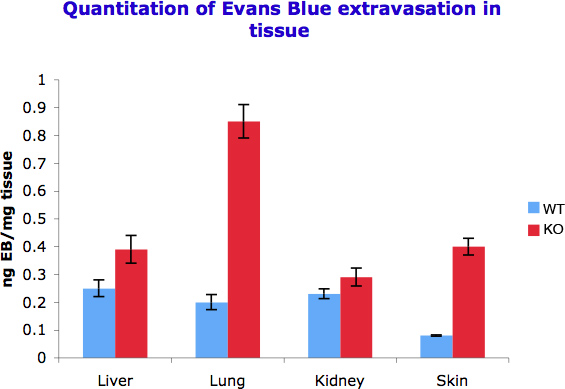
A Figura 2. A determinação quantitativa de extravasamento de Evans Blue em diferentes tecidos. 50-100 mg de tecido foi incubado com 500 ul de formamida para extrair Evans Blue extravasado. A densidade óptica foi medida a 610 nm e as medidas convertidas em corante extravasado ng por mg de tecido. A experiência foi repetida três vezes.
Discussão
Permeabilidade vascular é um marcador para o estado fundamental do vaso sanguíneo. Aumento da permeabilidade vascular tem mostrado estar presente em várias doenças sistémicas, incluindo a diabetes, a hipertensão, e doenças auto-imunes 6,7,8. Aumento da permeabilidade vascular tem sido mostrado para ser mediada por tensão de corte, os factores de crescimento tais como o factor de crescimento endotelial vascular e factor de crescimento de fibroblastos, os mediadores inflamatórios tais como histamina, serotonina e bradicinina 9. Extravasamento de água e de moléculas pequenas é pensado para ocorrer através de pequenas aberturas entre as células endoteliais. A força de adesão célula-a-célula junções é estritamente regulado por interacção entre as moléculas de 10.
Em condições fisiológicas endotélio é permeável à água e iões, e impermeável a proteínas. Assim, na ausência de estímulos inflamatórios, a albumina é restrito para o fluxo sanguíneo e não se desloca para o fluido extracelular. Ao injetar Evans Blue, um corante que se liga a albumina, pode-se controlar o grau de vazamento de proteína a partir da corrente sanguínea para dentro do tecido intersticial.
Uma versão modificada deste ensaio utiliza fluorescente marcado com microesferas. Usando diferentes tamanhos de microesferas ou de peso molecular diferente fluorescente marcada com dextrano (4-70 kDa), pode-se avaliar melhor a extensão de lesão endotelial. No entanto, esta opção elimina a facilidade de visualização e exige a fixação dos tecidos e de imagem de microscopia de fluorescência, ou medição utilizando um leitor de placas de fluorescência.
Nos estudos in vitro da permeabilidade navio têm sido utilizados com sucesso na literatura 11. Um ingrediente essencial de qualquer estudo in vitro a permeabilidade é uma intacta, monocamada de células confluentes. Estes ensaios usam uma câmara clássica dupla, onde as células endoteliais foram cultivadas em monocamadas sobre uma membrana permeável localizado na câmara superior. A tinta é aplicada à parte superiorcâmara e da permeabilidade das células endoteliais é determinada medindo a quantidade de corante que atinge a câmara inferior. Os resultados imitar na maioria dos casos a nos resultados do ensaio in vivo. No entanto, falta-lhes o contexto fisiológico apropriado e são, assim, complicado pela complexidade dos resultados. A abordagem in vitro elimina também o papel de pericitos, células que, em tecidos vivos, estão em estreito contacto com as células endoteliais e envia sinais para a proliferação de células endoteliais, o crescimento de vasos e de ramificação.
Os resultados do teste de Miles devem, idealmente, ser acompanhada por estudos moleculares que continuar a analisar a hipótese de que está a ser testado. Conforme mencionado, em um organismo inteiro, permeabilidade vascular depende de muitas variáveis, e assim, os resultados de um ensaio de permeabilidade in vivo têm de ser interpretados em conta a complexidade do sistema de análise.
Divulgações
Os autores não têm nenhum conflito ou concorrentes interesses financeiros.
Agradecimentos
Este trabalho foi financiado por uma doação do Instituto Nacional de Saúde, R01CA142928.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENTES | |||
| Azul de Evans | SIGMA | E2129 | |
| FORMAMIDA | INVITROGEN | 15515-026 | |
| PBS | Fosfato 0,2 M 1,5 M NaCl pH 7,4 | ||
| EQUIPAMENTOS | |||
| ESPECTROFOTÔMETRO | EPPENDORF | 952000006 | |
| Dispositivo de retenção MOUSE | Harvard Apparatus | 340012 | |
| SERINGA | BD | 309659 | |
| AGULHAS | BD | 305106 | O calibre da agulha depende do tamanho do animal. |
| BALANÇO | Denver Instrument | TP-64 |
Referências
- Beck, K. F., et al. Inducible NO synthase: role in cellular signaling. J. Exp. Biol. 202, 645-653 (1999).
- Bertglia, S., Giusti, A. Role of nitric oxide in capillary perfusion and oxygen delivery regulation during systemic hypoxia. Am. J. Physiol. Heart Circ. Physiol. 288, H525-H531 (2005).
- Miles, A. A., Miles, E. M. Vascular reactions to histamine, histamine-liberator and leutaxine in the skin of guinea pigs. J. Physiol. (London). 118, 228-257 (1952).
- Weis, S. M. Vascular permeability in cardiovascular disease and cancer. Curr. Opin. Hematol. 15, 243-249 (2008).
- Kumar, P., Shen, Q., Pivetii, C. D., Lee, E. S., We, M. H., Yuan, S. Y. Molecular mechanisms of endothelial hyperpermeability: implications in inflammation. Expert Rev. Mol. Med. 30, 11-19 (2009).
- Viazzi, F., et al. Vascular permeability, blood pressure, and organ damage in primary hypertension. Hypertens. Res. 31, 873-879 (2008).
- Scheppke, ., et al. Retinal vascular permeability suppression by topical application of a novel VEGFR2/Src kinase inhibitor in mice and rabbits. J. Clin. Invest. 118, 2337-2346 (2008).
- Blanchet, M. R., et al. Loss of CD34 Leads To Exacerbated Autoimmune Arthritis through Increased Vascular Permeability. J. Immunol. 184, 1292-1299 (2010).
- Dvorak, A. M. Mast cell-derived mediators of enhanced microvascular permeability, vascular permeability factor/vascular endothelial growth factor, histamine, and serotonin, cause leakage of macromolecules through a new endothelial cell permeability organelle, the vesiculo-vacuolar organelle. Chem. Immunol. Allergy. 85, 185-204 (2005).
- Le Guelte, A., Gavard, J. Role of endothelial cell-cell junctions in endothelial permeability. Methods Mol. Biol. 763, 265-279 (2011).
- Martins-Green, M., Petreaca, M., Yao, M. An assay system for in vitro detection of permeability in human "endothelium". Methods Enzymol. 443, 137-153 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados