Method Article
一个
摘要
我们提出检测测试血管通透性。此测定是基于其扩散到间隙空间的染料和随后的可视化的静脉注射。
摘要
这种方法是基于对小鼠作为试验动物模型中的伊文思蓝的静脉注射。伊文思蓝的染料结合白蛋白。在生理条件下血管内皮细胞是不透水的白蛋白,所以伊文思蓝结合蛋白在血管内仍然受到限制。在病理条件,促进血管通透性增加的内皮细胞部分失去他们的密切接触和内皮变得可渗透的小蛋白质如白蛋白。这种情况使组织中伊文思蓝外渗。一个健康的内皮防止在相邻的血管化组织的染料外渗。相比与内皮完整血管的器官,器官通透性增加,将呈现显着增加的蓝色着色。血管通透性的水平,可通过简单的可视化,或通过引入每毫克组织的控制,相对于实验动物/组织的定量测量的染料评估。两个鲍威此法的RFUL方面是它的简单和数量特征。伊文思蓝染料可以从组织中提取,通过孵育在甲酰胺中的特定数量的组织。伊文思蓝的最大吸光度是在620nm和最小值是在740 nm处的吸光度。通过使用伊文思蓝的标准曲线,可以被转换成光密度测量毫克染料捕获每毫克组织。统计分析应该用来评估血管通透性的显着差异。
引言
选择性渗透屏障的形成和维持所必需的适当的器官发育和性能1,2。内皮细胞系的血管管腔,形成一个半渗透的屏障,在血液和所有器官的间隙空间之间的选择性传输是必不可少的。通过紧的细胞-细胞间的交界处,严格控制的生长因子,细胞因子和其他应力相关分子3保持一个足够的渗透性屏障。内皮细胞屏障的破坏可导致增加的渗透性和血管渗漏。这些效果在各种疾病状态和下划线的分子信号的理解,需要多学科方法4,5。在这篇文章中,我们描述了一个在血管通透性使用的小鼠模型体内的方法来衡量。
我们所描述的测定法,也称为作为万里测定,是一种良好的established 在体内血管通透性的方法来测试。该测定是基于这样的事实,基底的生理条件下,白蛋白不穿过内皮屏障。对于白蛋白具有高亲和力,伊文思蓝,偶氮染料被注入在实验动物的血液流,并在生理条件下,它是预期要限制在血管内。当刺激血管通透性增加,无论是局部或全身,血管开始泄漏蛋白质,因此,也,伊文思蓝白蛋白结合。这样的结果在有可渗透的血管的组织,快速的蓝色着色。
在小鼠尾静脉注射成功的染料是关键的良好的实验结果。尾静脉注射技术需要广泛的实践,并在实验开始前应掌握。
血管通透性的年龄和体重的一个是高度依赖于IMAL,所以当比较不同小鼠品系是非常重要的,老鼠或其他考试科目相同的出生日期和重量有着密切的。其他因素影响的渗透性的内皮屏障的环境条件,如温度,湿度,和非常重要的是,在处理应力的鼠标。由于许多因素可以影响的实验的结果,它始终是可取的,该实验被重复执行至少三次和统计分析。
此法可用于或要比较的血管通透性已被转基因的小鼠,以及不同的遗传背景的小鼠。渗透性可以在存在或不存在刺激评估,根据调制的基因,该基因的功能。本试剂盒也可用于或血管通透性上测试不同的化合物的效果。
研究方案
1。在小鼠尾静脉静脉注射伊文思蓝
- 准备在PBS中0.5%伊文思蓝的无菌溶液。如果需要,过滤器的消毒溶液,以去除任何不溶解的颗粒物质。
- 吸200微升伊文思蓝溶液注入注射器。避免到注射器中的气泡,就有可能逃出。
- 8-12周龄的小鼠,限制装置,使动物是不能自由移动,但它的尾巴可以处理。
- 在其一侧,将鼠标固定装置的尾静脉很容易看到,正面临着向上。
- 与非优势手的拇指和食指之间保持到尾。
- 将针小计,(27-30)在10-15度角,斜面向上,尾静脉向头的方向挺进。保持针头和注射器平行的尾部。
- ð不申请确认正确的位置,因为这可能会崩溃静脉的压力。
- 缓慢注入200μl的伊文思蓝溶液的小鼠的尾静脉中。
- 观察的难易程度,在柱塞前进,因为这是正确放置的针在静脉的证明。
- 将鼠标到它的笼子里,并观察30分钟。
2。从机关的器官收集和提取的伊文思蓝
- 通过颈椎脱臼牺牲的老鼠。万里试验的目的颈椎脱位建议,因为它限制了显着的干扰血管通透性。牺牲所有的小鼠在相同的时间,尽可能快。与同伙6小鼠或更少的工作,因为死亡后不久血管变得更具渗透性的。
- 将小鼠在他们的后面,他们的脚和脚在白板上。
- 打开腹腔和胸腔,暴露雷神阿西克和腹部器官。
- 采取代表人图片伊文思蓝外渗,以示区别。包括所有的小鼠在同一领域,才能有相同的光照条件下,所有的老鼠。
- 收集器官的兴趣,并把它们在1.5毫升管
- 称取空管和带来的平衡值为零。
- 转移的组织样本和加权它。所有的组织样本重复上述步骤。组织可以是在空气中干燥,以消除不同器官的水含量之间的变异。
- 。加入500μl甲酰胺每个组织样品管的。
- 所有管转移到55℃的水浴或加热块。孵育24-48小时,从组织中提取伊文思蓝。
3。伊文思蓝渗出的定量间质组织
- 甲酰胺/伊文思蓝的混合物离心沉淀任何剩余的组织碎片。
- 测量吸光度在610纳米。使用500微升甲酰胺为空白。
- 计算纳克每毫克组织伊文思蓝外渗。
- 绘制图表中的所有数据。
- 进行统计分析,以确定显着的差异。
结果
我们使用了一个在8-12周龄小鼠体内的渗透性试验,试验容器中泄漏。在比较的相对在不同遗传背景的动物之间,或在一个单一的应变影响血管的治疗方法,进行小鼠的血管通透性此测试是有用的。我们的研究结果显示的菌株,我们在我们的实验室中创建的转基因小鼠与野生型小鼠相比,有更多的渗透内皮细胞。这些变化是显而易见的,在许多器官的宏观水平( 图1)。
我们能够量化血管通透性的差异在不同的器官被抓获的每克组织伊文思蓝spectophotometricaly测量。我们观察图2中的不同器官不同的反应,透气性诱导信号,从而表现出不同的染料积累。这也是在不同的组织中血管生成的水平的函数。
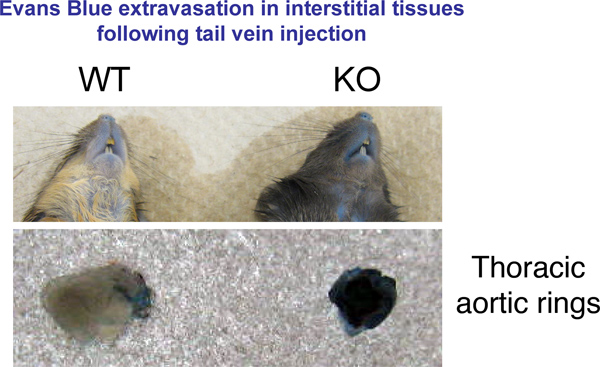
图1。组织中伊文思蓝外渗。30分钟后,伊文思蓝注射小鼠颈椎脱位处死。代表图片器官的兴趣。
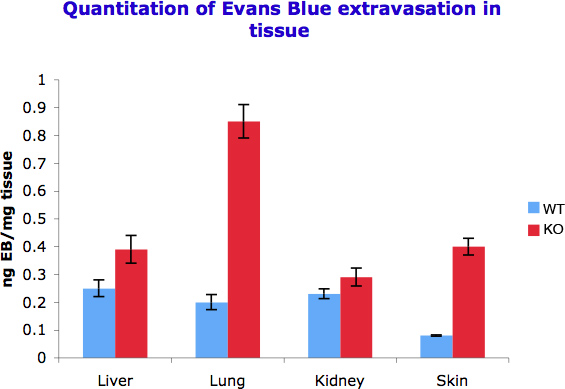
图2。在不同的组织中伊文思蓝外渗定量。50-100 mg组织培养用500μl甲酰胺提取外渗伊文思蓝。测定在610 nm和每毫克组织纳克染料外渗的测量值转换成光学密度。实验重复三次。
讨论
血管通透性是一个关键的血管状态的标记。血管通透性增加已被证明存在于几个全身性疾病,包括糖尿病,高血压,和自身免疫性疾病6,7,8。血管通透性增加已被证明是介导的剪切应力,生长因子,如血管内皮生长因子,成纤维细胞生长因子,炎症介质,如5 -羟色胺,组胺,缓激肽9。外渗的水和小分子被认为是发生通过血管内皮细胞之间的小开口。细胞-细胞间的交界处的强度有严格的规定相互作用分子间10。
在生理条件下,血管内皮细胞是可渗透水和离子,和不透的蛋白质。因此,在炎症刺激的情况下,白蛋白被限制到的血液流,不会移动到细胞外流体。通过注入Ë客货车蓝色,白蛋白结合的染料,我们可以监视的范围内的蛋白质泄漏从进入间质组织的血液流。
此法的修改后的版本使用荧光标记的微球。通过使用不同大小的微球或不同的荧光标记的葡聚糖的分子量(4-70 KDA),可以更好地评估血管内皮损伤的程度。但是,此选项的可视化和消除的难易程度,它需要固定的组织和荧光显微成像,或使用荧光酶标仪测量。
血管通透性的体外研究已成功地用于在文献中11。 在体外渗透性研究的一个重要成分是一个完整的,融合的单层细胞。这些测定法使用一个典型的双室位于上部腔室上的半透膜,内皮细胞在单层培养。甲染料施加到上部室和内皮细胞的通透性评估通过测量的染料量,到达下部腔室。结果模仿在大多数情况下, 在体内的测定结果。然而,他们缺乏适当的生理环境,由此复杂的结果的复杂性。 在体外的方法还消除了作用周细胞,细胞,在生物体组织中,与内皮细胞紧密接触,并发送信号的内皮细胞增殖,血管生长和分支。
万里测试的结果最好应伴随分子生物学研究,进一步检查被测试的假设。正如所提到的,在整个有机体,血管通透性是取决于许多变量,从而在光分析的系统的复杂性的体内渗透率测定结果需要被解释。
披露声明
作者有没有冲突或竞争的金融利益。
致谢
这项工作是由美国国立卫生研究院,R01CA142928的资助。
材料
| Name | Company | Catalog Number | Comments |
| 试剂 | |||
| 伊文思蓝 | SIGMA | E2129 | |
| 甲酰胺 | INVITROGEN | 15515-026 | |
| PBS | 0.2M磷酸 1.5M的NaCl pH值7.4 | ||
| 设备 | |||
| 分光光度计 | EPPENDORF | 952000006 | |
| MOUSE约束装置 | 哈佛器具 | 340012 | |
| SYRINGE | BD | 309659 | |
| NEEDLES | BD | 305106 | 针的量规的取决于动物的大小。 |
| 资产负债 | 丹佛仪器 | TP-64 |
参考文献
- Beck, K. F., et al. Inducible NO synthase: role in cellular signaling. J. Exp. Biol. 202, 645-653 (1999).
- Bertglia, S., Giusti, A. Role of nitric oxide in capillary perfusion and oxygen delivery regulation during systemic hypoxia. Am. J. Physiol. Heart Circ. Physiol. 288, H525-H531 (2005).
- Miles, A. A., Miles, E. M. Vascular reactions to histamine, histamine-liberator and leutaxine in the skin of guinea pigs. J. Physiol. (London). 118, 228-257 (1952).
- Weis, S. M. Vascular permeability in cardiovascular disease and cancer. Curr. Opin. Hematol. 15, 243-249 (2008).
- Kumar, P., Shen, Q., Pivetii, C. D., Lee, E. S., We, M. H., Yuan, S. Y. Molecular mechanisms of endothelial hyperpermeability: implications in inflammation. Expert Rev. Mol. Med. 30, 11-19 (2009).
- Viazzi, F., et al. Vascular permeability, blood pressure, and organ damage in primary hypertension. Hypertens. Res. 31, 873-879 (2008).
- Scheppke, ., et al. Retinal vascular permeability suppression by topical application of a novel VEGFR2/Src kinase inhibitor in mice and rabbits. J. Clin. Invest. 118, 2337-2346 (2008).
- Blanchet, M. R., et al. Loss of CD34 Leads To Exacerbated Autoimmune Arthritis through Increased Vascular Permeability. J. Immunol. 184, 1292-1299 (2010).
- Dvorak, A. M. Mast cell-derived mediators of enhanced microvascular permeability, vascular permeability factor/vascular endothelial growth factor, histamine, and serotonin, cause leakage of macromolecules through a new endothelial cell permeability organelle, the vesiculo-vacuolar organelle. Chem. Immunol. Allergy. 85, 185-204 (2005).
- Le Guelte, A., Gavard, J. Role of endothelial cell-cell junctions in endothelial permeability. Methods Mol. Biol. 763, 265-279 (2011).
- Martins-Green, M., Petreaca, M., Yao, M. An assay system for in vitro detection of permeability in human "endothelium". Methods Enzymol. 443, 137-153 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。