Method Article
Un
Dans cet article
Résumé
Nous présentons une In vivo Test afin de tester la perméabilité des vaisseaux sanguins. Ce test est basé sur l'injection intraveineuse d'un colorant et visualisation ultérieure de sa diffusion dans les espaces interstitiels.
Résumé
Cette méthode est basée sur l'injection intraveineuse de bleu d'Evans dans la souris comme modèle animal d'essai. Bleu Evans est un colorant qui se lie albumine. Dans les conditions physiologiques de l'endothélium est imperméable à l'albumine, de sorte Evans bleus assortis de restes d'albumine limitée dans les vaisseaux sanguins. Dans des conditions pathologiques qui favorisent l'augmentation des cellules endothéliales vasculaires perméabilité partiellement perdent leurs contacts étroits et l'endothélium devient perméable à de petites protéines comme l'albumine. Cette condition permet d'extravasation de bleu d'Evans dans les tissus. Un endothélium sain empêche extravasation du colorant dans les tissus vascularisés voisins. Organes ayant une perméabilité accrue montrera nettement augmenté par rapport à coloration bleue des organes avec endothélium intact. Le niveau de perméabilité vasculaire peut être évaluée par simple visualisation ou par mesure quantitative du colorant constituée par milligramme de tissu de contrôle par rapport à des animaux d'expérimentation / tissu. Deux PoweRFUL aspects de ce test sont sa simplicité et caractéristiques quantitatives. Colorant bleu Evans peut être extrait à partir de tissus en incubant une quantité spécifique d'un tissu en le formamide. Maximale d'absorbance Evans Blue est à 620 nm et un minimum d'absorption est à 740 nm. À l'aide d'une courbe d'étalonnage pour le bleu Evans, mesures de densité optique peut être transformé en colorant milligramme capturé par milligramme de tissu. L'analyse statistique doit être utilisée pour évaluer des différences significatives dans la perméabilité vasculaire.
Introduction
Formation et le maintien des barrières perméables sélectives sont essentiels pour le développement des organes appropriée et 1,2 performance. Les cellules endothéliales tapissent la lumière des vaisseaux sanguins et de former une barrière semi-perméable qui est essentiel dans le transport sélectif entre le sang et l'espace interstitiel de tous les organes. Une barrière de perméabilité suffisante est maintenue par serrées cellule à cellule jonctions qui sont strictement contrôlées par des facteurs de croissance, des cytokines et des molécules de stress autres produits 3. Rupture de la barrière de cellules endothéliales peut entraîner une plus grande perméabilité et une fuite vasculaire. Ces effets sont observés dans divers états pathologiques et la compréhension de la signalisation moléculaire souligner nécessite des méthodes pluridisciplinaires 4,5. Dans cet article, nous décrivons une méthode in vivo pour mesurer la perméabilité des vaisseaux en utilisant un modèle de souris.
Le test que nous décrivons, également connu sous le nom d'analyse Miles, est un bien établMINE Procédé pour tester la perméabilité vasculaire in vivo. Le test est basé sur le fait que, dans des conditions physiologiques basales, l'albumine ne traverse pas la barrière endothéliale. Bleu d'Evans, un colorant azoïque avec une forte affinité pour l'albumine, est injecté dans le flux sanguin d'un animal expérimental, et dans des conditions physiologiques, il est prévu d'être limité à l'intérieur des vaisseaux sanguins. Lorsqu'un stimulus perméabilité vasculaire est ajouté, par voie topique ou systémique, les vaisseaux sanguins commencent à couler protéine et donc, aussi le bleu Evans qui est lié à l'albumine. Cela se traduit par une coloration bleutée des tissus rapide dont les navires perméables.
Injection réussie du colorant dans la veine de la queue de la souris latéral est essentiel pour la bonne réussite de l'expérience. Technique d'injection queue veine exige de la pratique approfondie et doivent être maîtrisées avant de commencer l'expérience.
La perméabilité des vaisseaux est fortement dépendante de l'âge et du poids de l'unimal, donc lorsque l'on compare différentes souches de souris, il est impératif que les souris ou les sujets de test ont d'autres proches de la date de naissance et le poids identiques. Parmi les autres facteurs qui influent sur la perméabilité de la barrière endothéliale sont des conditions environnementales comme la température, l'humidité, et c'est très important, le stress de manipulation de la souris. En raison de la multitude de facteurs qui peuvent influencer le résultat de l'expérience, il est toujours conseillé que l'expérience est répétée au moins trois fois et l'analyse statistique effectuée.
Ce test peut être utilisé ou pour comparer la perméabilité des vaisseaux de souris qui ont été génétiquement modifiés, ainsi que les souris de différentes origines génétiques. On peut évaluer la perméabilité à la présence ou l'absence d'un stimulus, en fonction de la fonction du gène qui est modulé. Ce test peut également être utilisé ou pour tester l'effet de différents composés sur la perméabilité des vaisseaux.
Protocole
1. Injection intraveineuse de bleu d'Evans dans la veine de la queue de la souris latéral
- Préparer une solution à 0,5% stérile de bleu d'Evans dans du PBS. Si nécessaire, stériliser par filtration la solution pour éliminer toute particule qui n'a pas dissous.
- Aspirer 200 pi Bleu Evans solution dans une seringue. Évitez toutes les bulles d'air qui auraient échappé dans la seringue.
- Placer les souris qui sont de 8-12 semaines vieux dans un dispositif de retenue pour que l'animal n'est pas librement mobile, mais sa queue peut être manipulé.
- Placez le dispositif de retenue de la souris sur le côté afin de la veine latérale de la queue est facilement visible et sont tournées vers le haut.
- Tenez la queue avec la main non dominante entre le pouce et l'index.
- Insérer l'aiguille (petit calibre, 27-30) à une avance 10-15 degrés d'angle, biseau vers le haut, dans la veine latérale de la queue dans la direction de la tête. Gardez l'aiguille et la seringue parallèlement à la queue.
- Do ne s'applique pas contre-pression pour confirmer le placement approprié car cela pourrait réduire la veine.
- Injecter lentement 200 pi Bleu Evans solution dans la veine de la queue de la souris.
- Observez la facilité avec laquelle les progrès piston, car c'est la preuve de la mise en place correcte de l'aiguille dans la veine.
- Placez la souris de nouveau dans sa cage et l'observer pendant 30 min.
2. Collection d'organes et d'extraction de Bleu d'Evans des organes
- Sacrifier les souris par dislocation cervicale. Pour Miles fins de dosage dislocation cervicale est recommandée car elle limite l'interférence significative avec la perméabilité vasculaire. Sacrifier toutes les souris en même temps, aussi vite que possible. Travailler avec les cohortes de 6 souris ou moins, car peu de temps après la mort vaisseaux sanguins deviennent plus perméables.
- Placez la souris sur le dos et la broche leurs pieds sur un tableau blanc.
- Ouvrir la cavité abdominale et thoracique pour exposer thorACIC et organes abdominaux.
- Prenez des photos représentatives de montrer les différences dans l'extravasation du bleu d'Evans. Inclure toutes les souris dans le même domaine afin d'avoir des conditions d'éclairage identiques pour toutes les souris.
- Recueillir des organes d'intérêts et de les mettre dans des tubes de 1,5 ml
- Peser un tube vide et apporter la valeur d'équilibre à zéro.
- Transférer l'échantillon de tissu et il pondérer. Répétez l'opération pour tous les échantillons de tissus. Les tissus peuvent être séchés à l'air pour éliminer la variabilité de la teneur en eau entre les différents organes.
- . Ajouter 500 ul de formamide dans chaque tube échantillon de tissu.
- Transférez tous les tubes à un bain d'eau à 55 ° C ou du bloc chauffant. Incuber pendant 24-48 heures pour extraire Evans Blue à partir de tissu.
3. Quantification de Evans Blue extravasé dans le tissu interstitiel
- Centrifuger le formamide / Bleu Evans mélange de granulés tous les fragments de tissus restants.
- Mesurer l'absorbance à 610nm. Utiliser 500 ul formamide comme vide.
- Calculer ng extravasation du bleu Evans par mg de tissu.
- Tracer toutes les données dans un graphique.
- Effectuer une analyse statistique pour déterminer les différences significatives.
Résultats
Nous avons utilisé un test de perméabilité in vivo pour tester les fuites navire dans des souris âgées de 8-12 semaines. Ce test est utile pour comparer la perméabilité relative vasculaire entre les animaux de fond génétique différent ou dans une seule souche de souris soumises à des traitements qui affectent le système vasculaire. Nos résultats montrent que la souche de souris génétiquement modifiées, nous avons créé dans notre laboratoire dispose d'un endothélium plus perméable par rapport aux souris de type sauvage. Ces changements sont évidents au niveau macroscopique dans de nombreux organes (Figure 1).
Nous avons pu quantifier la différence de perméabilité des vaisseaux par spectophotometricaly mesurer le Bleu Evans qui a été capturé par gramme de tissu dans différents organes. Comme nous l'avons observé dans la figure 2 montre les différents organes réponse différente aux signaux inducteurs de perméabilité et de montrer ainsi l'accumulation de colorant différent. Ceci est également une fonction des niveaux de vascularisation dans différents tissus.
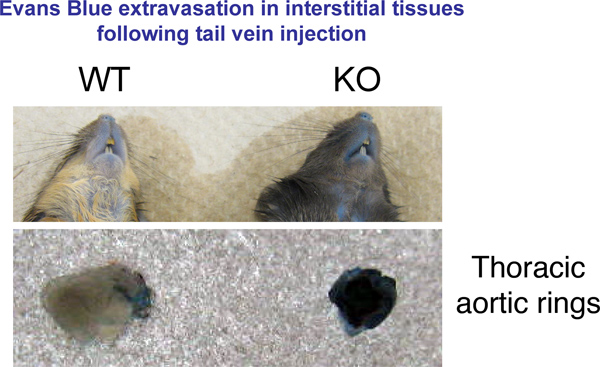
Figure 1. Evans Blue extravasation dans les tissus. 30 min après injection de bleu Evans souris ont été sacrifiées par dislocation cervicale. Photos représentatives des organes d'intérêt ont été prises.
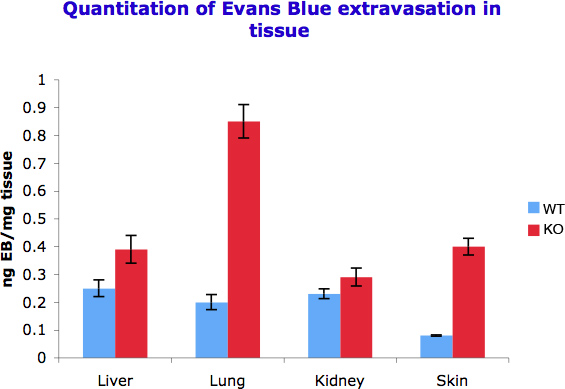
Figure 2. La quantification de l'extravasation du bleu d'Evans dans différents tissus. 50-100 mg de tissu a été incubé avec 500 ul de formamide pour extraire extravasation du bleu d'Evans. La densité optique a été mesurée à 610 nm et les mesures converties en ng colorant extravasé par mg de tissu. L'expérience a été répétée trois fois.
Discussion
La perméabilité vasculaire est un marqueur essentiel pour l'état des vaisseaux sanguins. Augmentation de la perméabilité vasculaire a été montré pour être présent dans plusieurs maladies systémiques telles que le diabète, l'hypertension et les maladies auto-immunes 6,7,8. Augmentation de la perméabilité vasculaire a été montré pour être médiée par la contrainte de cisaillement, des facteurs de croissance tels que le facteur de croissance endothélial vasculaire et le facteur de croissance des fibroblastes, des médiateurs inflammatoires comme la sérotonine, l'histamine et la bradykinine 9. L'extravasation de l'eau et de petites molécules est supposée se produire dans les petites ouvertures entre les cellules endothéliales. La résistance de la cellule à cellule jonctions est strictement réglementé par l'interaction entre les molécules 10.
Dans des conditions physiologiques endothélium est perméable à l'eau et des ions, et imperméable aux protéines. Ainsi, en l'absence de stimuli inflammatoires, l'albumine est limité à la circulation sanguine et ne se déplace pas dans le fluide extracellulaire. En injectant de l'Ecamionnettes bleu, un colorant qui lie l'albumine, on peut contrôler le degré de fuite de protéines à partir du flux sanguin dans le tissu interstitiel.
Une version modifiée de ce test utilise marqué par fluorescence microsphères. En utilisant différentes tailles de microsphères ou de poids moléculaire différent marquage fluorescent dextrane (4-70 kDa), on peut mieux évaluer l'étendue de la lésion de l'endothélium. Toutefois, cette option élimine la facilité de visualisation et il faut fixer les tissus et l'imagerie microscopie à fluorescence, ou mesure à l'aide d'un lecteur de plaque à fluorescence.
Des études in vitro de la perméabilité des vaisseaux ont été utilisés avec succès dans la littérature 11. Un ingrédient essentiel de toute étude de perméabilité in vitro est une intact, monocouche de cellules confluentes. Ces tests utilisent une chambre double classique où les cellules endothéliales sont cultivées en monocouche sur une membrane perméable située dans la chambre supérieure. Un colorant est appliqué sur la partie supérieurechambre et de la perméabilité des cellules endothéliales est évaluée par mesure de la quantité de colorant qui atteint la chambre inférieure. Les résultats imiter dans la plupart des cas, les résultats d'analyse dans vivo. Toutefois, ils n'ont pas le contexte physiologique appropriée et sont ainsi compliquée par la complexité des résultats. L'approche in vitro élimine également le rôle des péricytes, des cellules qui, dans les tissus vivants, sont en contact étroit avec les cellules endothéliales et envoyer des signaux de prolifération des cellules endothéliales, la croissance des vaisseaux et la ramification.
Les résultats d'essais Miles devrait idéalement être accompagné par des études moléculaires examiner plus en détail l'hypothèse qui est testée. Comme mentionné précédemment, dans un organisme entier, la perméabilité vasculaire dépend de nombreuses variables, et donc les résultats d'une analyse de la perméabilité in vivo doivent être interprétés à la lumière de la complexité du système analysé.
Déclarations de divulgation
Les auteurs n'ont aucun conflit ou en concurrence intérêts financiers.
Remerciements
Ce travail a été soutenu par une subvention de la National Institutes of Health, R01CA142928.
matériels
| Name | Company | Catalog Number | Comments |
| REACTIF | |||
| Evans Blue | SIGMA | E2129 | |
| FORMAMIDE | INVITROGEN | 15515-026 | |
| PBS | Phosphate 0,2 M 1,5 M de NaCl pH 7,4 | ||
| ÉQUIPEMENT | |||
| SPECTROPHOTOMÈTRE | EPPENDORF | 952000006 | |
| DISPOSITIF DE RETENUE SOURIS | HARVARD APPARATUS | 340012 | |
| SERINGUE | BD | 309659 | |
| AIGUILLES | BD | 305106 | La jauge de l'aiguille dépend de la taille de l'animal. |
| SOLDE | Denver Instrument | TP-64 |
Références
- Beck, K. F., et al. Inducible NO synthase: role in cellular signaling. J. Exp. Biol. 202, 645-653 (1999).
- Bertglia, S., Giusti, A. Role of nitric oxide in capillary perfusion and oxygen delivery regulation during systemic hypoxia. Am. J. Physiol. Heart Circ. Physiol. 288, H525-H531 (2005).
- Miles, A. A., Miles, E. M. Vascular reactions to histamine, histamine-liberator and leutaxine in the skin of guinea pigs. J. Physiol. (London). 118, 228-257 (1952).
- Weis, S. M. Vascular permeability in cardiovascular disease and cancer. Curr. Opin. Hematol. 15, 243-249 (2008).
- Kumar, P., Shen, Q., Pivetii, C. D., Lee, E. S., We, M. H., Yuan, S. Y. Molecular mechanisms of endothelial hyperpermeability: implications in inflammation. Expert Rev. Mol. Med. 30, 11-19 (2009).
- Viazzi, F., et al. Vascular permeability, blood pressure, and organ damage in primary hypertension. Hypertens. Res. 31, 873-879 (2008).
- Scheppke, ., et al. Retinal vascular permeability suppression by topical application of a novel VEGFR2/Src kinase inhibitor in mice and rabbits. J. Clin. Invest. 118, 2337-2346 (2008).
- Blanchet, M. R., et al. Loss of CD34 Leads To Exacerbated Autoimmune Arthritis through Increased Vascular Permeability. J. Immunol. 184, 1292-1299 (2010).
- Dvorak, A. M. Mast cell-derived mediators of enhanced microvascular permeability, vascular permeability factor/vascular endothelial growth factor, histamine, and serotonin, cause leakage of macromolecules through a new endothelial cell permeability organelle, the vesiculo-vacuolar organelle. Chem. Immunol. Allergy. 85, 185-204 (2005).
- Le Guelte, A., Gavard, J. Role of endothelial cell-cell junctions in endothelial permeability. Methods Mol. Biol. 763, 265-279 (2011).
- Martins-Green, M., Petreaca, M., Yao, M. An assay system for in vitro detection of permeability in human "endothelium". Methods Enzymol. 443, 137-153 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon