Method Article
Síntese em Fase Sólida de um funcionalizada Bis Peptide-Usando o "Safety Catch" Metodologia
Neste Artigo
Resumo
A síntese de péptidos em fase sólida eficiente de um trímero bis péptido-funcionalizado utilizando um "fecho de segurança" procedimento de clivagem a partir de resina de HMBA é descrito.
Resumo
Em 1962, RB Merrifield publicado o primeiro procedimento em fase sólida utilizando síntese de péptidos como uma nova via para sintetizar eficientemente péptidos. Esta técnica rapidamente mostrou-se vantajoso em relação ao antecessor fase de solução em termos de tempo e trabalho. Melhorias relativamente à natureza do suporte sólido, os grupos protectores utilizados e os métodos de acoplamento utilizados nos últimos cinco décadas têm só aumentou a utilidade do sistema original Merrifield. Hoje em dia, a utilização de uma protecção Boc-base e base / estratégia resina nucleófilo clivável ou Fmoc de protecção de base e da estratégia resina acídica clivável, iniciada por RC Sheppard, são mais comumente utilizado para a síntese de péptidos 1.
Inspirado por estratégia sólida de Merrifield suportado, nós desenvolvemos uma Boc / terc-butil estratégia de síntese de fase sólida para a montagem de funcionalizados bis-péptidos 2, que é aqui descritos. A utilização de síntese em fase sólida em comparação tO metodologia de solução de fase não é apenas vantajoso em termos de tempo e de trabalho, tal como descrito por Merrifield 1, mas também permite que uma maior facilidade na síntese de bis-peptídicos bibliotecas. A síntese que demonstram aqui incorpora uma fase de clivagem final que utiliza um de dois passos "fecho de segurança" mecanismo para libertar o funcionalizado bis-péptido a partir da resina por formação de dicetopiperazina.
Bis-péptidos são rígidas, espiro-escada com oligómeros de bis-aminoácidos que são capazes de posicionar a funcionalidade de uma forma previsível e projetáveis, controlada pelo tipo e estereoquímica das unidades monoméricas e da conectividade entre cada monómero. Cada ácido bis-amino é um estereoquimicamente puro, andaime cíclico que contém dois aminoácidos (um ácido carboxílico com um α-amina) 3,4. Nosso laboratório está atualmente investigando o potencial de funcionais bis-peptídeos em uma ampla variedade de áreas, incluindo catálise, interações proteína-proteína e nanomaterials.
Protocolo
1. Instalação
- A reacção de configuração para a síntese em fase sólida é um polipropileno cartucho de filtro ou reactor de vidro que está ligado por meio da tubagem de polipropileno para um balão fechado filtragem sob vácuo, como mostrado na Figura 1. A reacção pode ser misturado por uma barra de agitação magnética ou fazendo borbulhar azoto através do reactor.
- Um colector de gás ligado a um cilindro de árgon equipado com um tubo de secagem e borbulhador de óleo é também recomendado porque permite que o recipiente de reacção a ser contido sob uma atmosfera inerte e permite a remoção de reagentes a partir de recipientes selados.
- Todas as operações são realizadas em um exaustor e equipamento de proteção individual (óculos de segurança, jaleco e luvas de borracha nitrílica) é necessária.
2. Primeiro a carregar Bis-Peptide Onto Resina
- Pesar 114 mg de HMBA-AM Resina (0,88 mmol / g de carregamento, 100 mmol) em 8 mL vaso de reacção e adicionar uma barra de agitação magnética. Tapar o topo da thnavio e com um septo de borracha e de purga do tubo com árgon durante pelo menos 5 minutos.
- Entretanto, a pesar 117,3 mg do composto 1 da Figura 3 (586,63 g / mol, 2eq) e 59,2 mg de 1 - (mesitileno-2-sulfonil)-3-nitro-1 ,2,4-triazol (MSNT, 296,0 g / mol, 2eq) em um tubo de centrífuga de 15 mL descartável e dissolver em 2 mL de diclorometano anidro (DCM). Adicionar 24 ul de 1-metilimidazole (NMI, 80,81 mL / mol, 3eq) à solução e mistura até ficar completamente dissolvida.
- Transferir a solução activado para o vaso de reacção através de uma seringa e deixa-se agitar sob árgon durante a noite (aprox. 10 horas).
- Remover o septo e drenar-se a mistura de reacção. Lavar a resina com DCM (5x) e dimetilformamida (DMF) (5x). Realizar o "teste vermelho de metila", descrito na seção 10.1 para avaliar o grau de carga de resina. Se a resina permanece vermelho durante o teste de vermelho de metilo, em seguida, os passos de 2,2 e 2,3 deve ser repetido. Uma cor amarela, indicativa de um negativo de teste vermelho de metilo, é preferido;no entanto, uma vez que quaisquer grupos hidroxilo remanescentes será tapado no próximo passo, um resultado ligeiramente positivo (cor de resina laranja claro) pode ser aceitável.
3. A desprotecção da resina Bis-péptido e simultânea Primeiro capping
- Adicionar 1 mL de DCM para o vaso de reacção, em seguida, adicionar 1 mL de brometo de hidrogénio 33% em ácido acético gota a gota durante 30 segundos (borbulhamento ocorre) e agita-se durante 15 minutos. Escorrer e lavar a resina com DCM (5x), em seguida, repetir processar mais uma vez.
- Lavar a resina com DCM (5x), em seguida, DMF (5x). Neutralizar a resina por lavagem duas vezes com uma solução a 5% v / v de N, N-diisopropiletilamina (DIPEA) em DMF, em seguida, lava-se com DCM (5x) e DMF (5x) novamente. Realizar o "teste de vermelho de metilo" e "teste cloranil" discutido na seção 10.1 e 10.2. Os resultados devem ser negativa para o teste de vermelho de metilo e positiva para o teste de cloranil.
4. Acoplamento Boc / tBu-Protegido funcionalizada Bis-Aminenhum ácido
- Reintroduzir uma atmosfera inerte para a resina contendo vaso de reacção por lavagem três vezes com DCM anidro, em seguida, anexar um septo e uma linha de árgon. Limpar e lavar o vaso, adicionando mL 1-2 de DCM anidro e deixando agitar por 30 segundos, em seguida, a drenagem do reservatório até que o argônio linha borbulhador começa a subir. Faça isso pelo menos mais uma vez.
- Prepara-se uma solução de 0,15 M funcionalizado bis-amino ácido (3eq) e 245 mg de 1-hidroxi-7-azabenzotriazole (HOAt, 136,11 g / mol, 18eq) em 2 mL de 2:1 DCM: DMF num ensaio à chama secas tubo sob atmosfera de árgon. Adicionar 47 ul de diisopropilcarbodiimida (DIC, 156,6 mL / mol, 3eq) e agita-se durante 90 minutos.
- Adicionar 35 DIPEA uL (174,19 mL / mol, 2eq) em 666 uL de DMF anidro à resina e agita-se durante 5 minutos.
- Transferir o pré-activada de solução de ácido bis-amino para o vaso de reacção através de uma seringa e deixa-se agitar durante a noite.
- Drenar-se a mistura reaccional e lava-se duas vezes com DCM anidro enquanto sob árgon.
- Para promover o encerramento da dicetopiperazina, adicionar uma solução 0,25 M de HOAt (136,11 g / mol, 10eq) e DIC (156,6 mL / mol, 10eq) num 4 mL de 1:1 DCM: DMF e deixa-se agitar sob atmosfera de árgon durante 1 hora.
- Remover o septo e drenar-se a mistura de reacção. Lavar a resina com DCM (5x) e DMF (5x). Se desejar, realizar o "teste de cloranil" discutido na seção 10.2.
5. A desprotecção do Boc / tBu-protegido Ácido Bis-Amino funcionalizado
- Adicionar 2 mL de uma solução de ácido trifluororacetic 95:5 (TFA): triisopropylsilane (TIPS) para o vaso de reacção e permitir que ele a agitar durante 1 hora. Escorra e lave a resina para cerca de 30 segundos com DCM (5x), em seguida, repita o processo mais uma vez.
- Lavar a resina com DCM (5x), em seguida, DMF (5x). Neutralizar a resina por lavagem duas vezes com uma solução a 5% v / v de DIPEA em DMF, em seguida, lavar DCM (5x) e DMF (5x) novamente. Se desejar, realizar o "teste de cloranil" discutido na seção 10.2.
7. Funcionalização do Fim Prolidine Bis-Peptide
- A extremidade prolidine do crescimento bis-péptido pode ser acilado independentemente ou em conjunto através de uma dicetopiperazina. Além disso, este fim pode ser deixado protegido, o qual será clivado último, obtendo-se o aminoácido livre. Se desejar, realizar o "teste de cloranil" discutido na seção 10,2 para avaliar a eficiência de acoplamento.
8. A desprotecção de Fmoc e acilação do Fim Quaternário do Bis-Peptide
- Uma solução de 2 ml de piperidina a 20% em DMF é adicionada ea reacção é misturada durante 20 minutos. Escorrer e lavar a resina com DMF (5x), em seguida, repita o processo mais uma vez.
- Lavar a resina com DCM (5x), em seguida, DMF (5x).
- Preparar uma solução de 0,15 M de aminoácido (3eq) em 2 mL de N-metilpirrolidona (NMP) com 114 mg 2 - (7-aza-1H-benzotriazol-1-il) -1,1,3,3-tetrametilurónio hexafluorofosfato (HATU, 380,2 g / mol, 3eq) e 104,5 DIPEA uL (174,19 mL / mol, 6eq) e misturar bem. Adicionar à vaso de reacção e agita-se durante 6 horas.
- Lavar a resina com DCM (5x), em seguida, DMF (5x).
9. Remover o grupo Boc da resina de Ligação de aminoácidos e Cleave a partir de resina
- Adicionar 2 mL de uma TFA 1:1: solução DCM para o vaso de reacção e deixa-se agitar durante 30 minutos. Escorrer e lavar a resina com DCM (5x), em seguida, repetir processar mais uma vez.
- Lavar e drenar a resina durante 30 segundos com DCM (5x), em seguida, DMF (5x).
- Adicionar 2 mL de uma solução de DIPEA a 10% em DMF anidro e deixa-se agitar de 24-48 horas.
- Colete mistura de reacção em pré-pesado balão de fundo redondo. Transferir 30 uL desta solução a 450 uL de THF em um frasco de LC-MS e submete para análise. Lava-se a resina com alíquotas adicionais de DMF e recolher para o balão de fundo redondo, em seguida, remover o solvente sob vácuo.
10. Purificação de Bis-Peptide
- Dissolver em bruto bis-péptido numa quantidade mínima de sulfóxido de dimetilo (100-250 uL) e transferência para HPLC de inserção do frasco. Inserto lugar em amostrador automático de HPLC semi-prepitive sistema (Hewlett Packard 1100 Série) equipado com um MS Prep XTerra C18 5 micrómetros coluna milímetros 7.8x150 e um circuito 100 de injecção uL.
- Executar múltiplas injecções de 50 ul da amostra, utilizando um programa de gradiente de acetonitrilo 5-95% em água com 0,1% de ácido fórmico durante 30 minutos enquanto monitorando a 274 nm. Recolher o pico do produto num tubo de centrífuga de pré-pesado descartável e congelar seca utilizando um liofilizador. Devem ser tomadas precauções com a primeira execução como uma ligeira mudança no tempo de retenção do pico em comparação com LCMS analíticos é tipicamente observado.
11. Métodos de Avaliação
- METHYL TEST RED 7: Remover ~ 1 mg de resina seca através de uma pipeta descartável e enxaguar em 4 mL vaso de reacção. Adicionar uma solução de 20 mg de vermelho de metilo, 50 N ul, N'-diisopropilcarbodiimida (DIC), e 5 mg de 4-dimetilaminopiridina (DMAP) em 500 uL DCM anidro e agita-se durante 5-10 min. Escorra e lave resina com DCM até que o filtrado se torne incolor. Indicação positiva é as pérolas de resina restantes laranja ou vermelha.
- Cloranil ENSAIO 12: Transferência ~ 1 mg de resina seco para um pequeno frasco através de uma pipeta descartável. Adicionar 3 gotas de ambos cloranil mM um 0,8 em solução de DMF e acetaldeído 2% em solução de DMF e deixar repousar à temperatura ambiente durante 5-10 minutos. Indicação positiva é a resina, transformando azul / roxa.
- Teste de activação TRAP: compostos activado durante a síntese pode ser avaliada através da transferência de uma pequena quantidade (uL 5-10) da solução activada para uma espectrometria de massa de cromatografia-líquida (LC-MS) frasco contendo 50 uL de pirrolidina. Misture com a mão por alguns segundos (solutiem deve tornar-se amarela), em seguida, dilui-se com 450 ul de tetra-hidrofurano (THF) e submete para LC-MS análise.
- ANÁLISE LC-MS: O produto final e intermediários activados podem ser avaliados através de uma série HP 1200 sistema LC-MS equipado com um Xterra Waters C18 MS 3,5 uM 4,6 mm x 150 mm coluna e um sistema de gradiente de acetonitrilo 5-95% em água com 0,1% de ácido fórmico durante 30 minutos.
12. Os resultados representativos
Um exemplo de ambos em bruto (Figura 4) e purificado (Figura 5) vestígios LCMS são fornecidos. Rendimento purificadas de cerca de 10% são esperados utilizando os métodos descritos acima.

Figura 1. Diagrama do conjunto experimental para síntese em fase sólida.
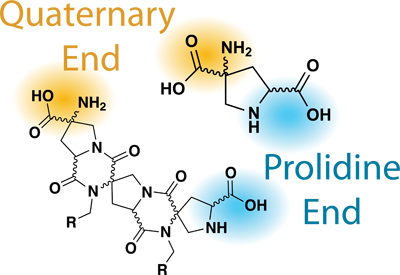
Figura 2.Nomenclatura relevante de Bis-aminoácidos / Bis-peptídeos.

Figura 3. Esquema de síntese geral. Clique aqui para ver maior figura .

A Figura 4a. HPLC de rastreamento do produto bruto em 274 nm.
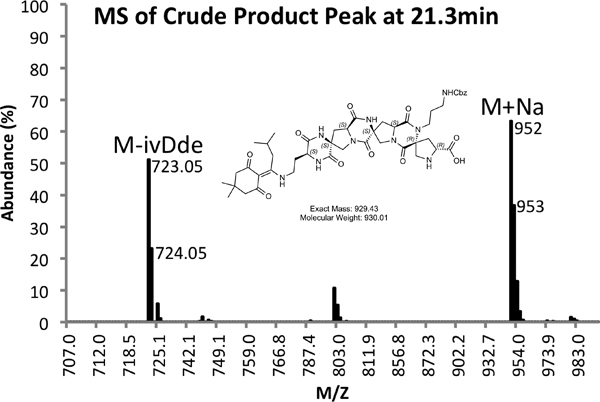
Figura 4b. MS Espectro de pico de produto bruto.
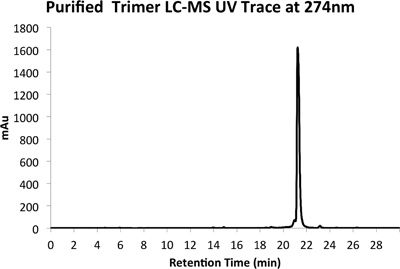
Figura 5a. HPLC Rastreamento de produto purificado em 274 nm.
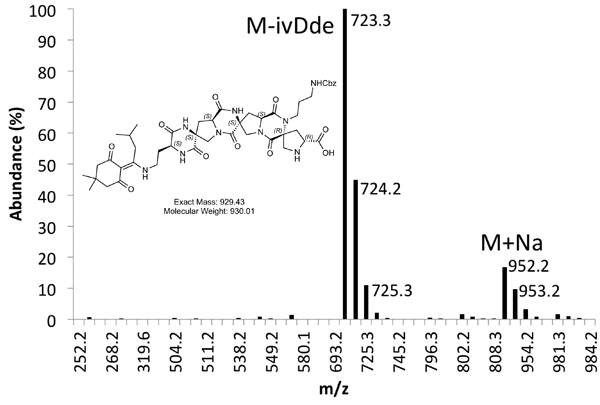
Figura 5b. Espectro de MS purificada Product Pico.
Discussão
A abordagem sintética aqui apresentada fornece um método para a síntese de bis-funcionalizados péptidos a partir de bis-amino blocos de construção de ácido usando comuns em fase sólida técnicas de síntese de péptidos. A síntese destes monômero "Pro4" blocos de construção de trans-4-hidroxiprolina 3 é altamente escalável e foi concluída com êxito para o palco hidantoína em mmol 600 (234 g) escala (não publicado). Uma vez que os monómeros são dadas, a utilização de técnicas de fase sólida proporciona um método mais rápido de bis-péptido síntese do que a nossa metodologia solução de fase corrente 4, eliminando a necessidade de reacção de trabalho-ups e purificações intermédios.
O desafio primário na síntese em fase sólida é diagnosticar o progresso sintético e resolução de problemas uma vez que não intermediários são isolados. Isto levou ao desenvolvimento de muitos testes colorimétricos incluindo aqueles para identificar se aminas livres (o teste de Kaiser 10) ou livre HydroxYLS (Metil Teste vermelho 7) estão expostos na resina. Infelizmente, o comumente usado teste de Kaiser 10 não é geralmente aplicável no nosso síntese em fase sólida, devido à utilização quase exclusiva de aminas secundárias ou aminas ligados a um carbono quaternário. Outras opções para avaliação de resina HMBA incluem clivagens teste usando um nucleófilo como hidrazina 11, clivagem Fmoc quantitativa monitorado por UV / Vis 1,11, e captura e análise de compostos de entrada ativados.
Outra questão ignorado no síntese em fase sólida é a natureza repetitiva de passos sintéticos exigidas pelo operador. Com isto em mente, os autores recomendamos fortemente o uso de uma planilha ou lista de verificação quando efectuar qualquer manual de síntese de peptídeos em fase sólida.
A dificuldade na utilização de bis-péptidos em fase sólida para a síntese em comparação com comuns α-aminoácidos inclui o potencial para acoplamentos mais difícil devido à Hin estéricoDrance, a necessidade de fechos em resina-dicetopiperazina, e deprotections simultâneas (Boc / tBu; Cbz / tBu). Outra dificuldade reside na obtenção de libertação quantitativo a partir da resina usando este "fecho de segurança" método quando comparado com meios mais convencionais. Com esses fatores em mente, é muito possível que uma maior otimização desse método pode ser alcançado e os esforços atuais estão em andamento em nosso grupo para melhorar o método aqui apresentado.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Zachary Z. Brown e Jennifer Alleva para o desenvolvimento inicial desta técnica em fase sólida e síntese FL Matthew Parker para discussões úteis. Este trabalho é suportado pela Agência de Redução de Defesa ameaça (DOD-DTRA) (HDTRA1-09-1-0009) eo Horst Witzel Award Fellowship suportado por Cephalon, Inc.
Materiais
| Nome | Companhia | Número de Catálogo | Comentários |
| HMBA-Am Resina | NovaBiochem | 855018 | |
| MSNT | NovaBiochem | 851011 | |
| NMI | Sigma-Aldrich | 336092 | Tóxico, Corrosivo |
| DCM | Sigma-Aldrich | D65100 | Carcinogênico |
| DCM anidro | Acros | 34846 | Carcinogênico |
| Brometo de hidrogénio 33% em ácido acético | Sigma-Aldrich | 248630 | Tóxico, Corrosive, Fumes quando aberto |
| DIPEA | Sigma-Aldrich | 387649 | Inflamável, tóxico, corrosivo |
| DMF | Fisher Scientific | AC27960 | Inflamável, tóxico |
| DMF anidra | Acros | 34843 | Inflamável, tóxico |
| HOAt | GenScript | C01568 | |
| DIC | Acros | BP590 | Inflamável, tóxico, corrosivo |
| TFA | Sigma-Aldrich | T6508 | Tóxico, Corrosivo |
| DICAS | Acros | 21492 | Inflamável, tóxico |
| Piperidina | Sigma-Aldrich | 104094 | Inflamável, tóxico, corrosivo |
| HATU | GenScript | C01566 | Toxic |
| NMP | Acros | 36438 | Tóxico |
| DMAP | NovaBiochem | 851055 | Tóxico |
| Vermelho de metilo | Sigma-Aldrich | 250198 | |
| THF | Sigma-Aldrich | 401757 | Inflamável, peróxido, Toxic Formando |
| Pirrolidina | Sigma-Aldrich | P73803 | Inflamável, tóxico, corrosivo |
| Sulfóxido de dimetilo | Pescador | D1281 | |
| Vasos de reacção SPPS | Graça | 211108 | |
| LCMS | Agilent | Série 1200 | |
| Semi-Prep LC | Hewlett Packard | Série 1100 | |
| Liofilizador | Labconco | 7934027 | |
| Rotovapor | Buchi | R-210 Series | |
| Argon | Airgas | AR PP300CT |
Referências
- Atherton, E., Sheppard, R. C. . Solid Phase Peptide Synthesis: A Practical Approach. , (1989).
- Brown, Z. Z., Alleva, J., Schafmeister, C. E. Solid-Phase Synthesis of Functionalized Bis-Peptides. Biopolymers. 96, 578-585 (2010).
- Schafmeister, C. E., Brown, Z. Z., Gupta, S. Shape-Programmable Macromolecules. Acc. Chem. Res. 41, 1387-1398 (2008).
- Brown, Z. Z., Schafmeister, C. E. Synthesis of Hexa- and Pentasubstituted Diketopiperazines from Sterically Hindered Amino Acids. Org. Let. 12, 1436-1439 (2010).
- Nielson, J., Lyngso, L. O. Combinatorial Solid-Phase Synthesis of Balanol Analogues. Tet. Lett. 37, 8439-8442 (1996).
- Blankemeyer-Menge, B., Nimtz, M., Frank, R. An Efficient Method for Anchoring Fmoc-Amino Acids to Hydroxyl-Functionalized Solid Supports. Tet. Lett. 31, 1701-1704 (1990).
- Komba, S., Sasaki, S., Machida, S. A New Colorimetric Test for Detection of Hydroxyl Groups in Solid-Phase Synthesis. Tet. Lett. 48, 2075-2078 (2007).
- Demner, O., Dijkgraaf, I., Schottelius, M., Wester, H. J., Kessler, H. Introduction of Functional Groups into Peptides via N-Alkylation. Org. Lett. 10, 2015-2018 (2008).
- Plas, S. E. V. a. n. d. e. r., Van Hoeck, E., Lynen, F., Sandra, P., Madder, A. Toward a New SPE Material for EDCs: Fully Automated Synthesis of a Library of Tripodal Receptors Followed by Fast Screening by Affinity LC. Eur. J. Org. Chem. 11, 1796-1805 (2009).
- Kaiser, E., Colescot, R. L., Bossinger, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34, 595-598 (1970).
- Chan, W. C., White, P. D. . Fmoc Solid Phase Peptide Synthesis: A Practical Approach. , (2000).
- Vojkovsky, T. Detection of Secondary Amines on Solid-Phase. Peptide Research. 71, 236-237 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados