Method Article
Sintesi in fase solida di un funzionalizzato Bis-Peptide Uso di "Sicura del fucile" Metodologia
In questo articolo
Riepilogo
L'efficiente sintesi in fase solida di un peptide funzionalizzato bis-peptide trimero di utilizzare un "sicura" procedura clivaggio dalla resina HMBA descritto.
Abstract
Nel 1962, RB Merrifield pubblicato la prima procedura utilizzando sintesi in fase solida del peptide come un nuovo percorso per sintetizzare in modo efficiente peptidi. Questa tecnica subito dimostrato la sua soluzione più vantaggiosa in fase predecessore in termini di tempo e lavoro. Miglioramenti relativi alla natura del supporto solido, i gruppi di protezione impiegati e dei metodi di attacco utilizzati nel corso degli ultimi cinque decenni hanno solo aumentato l'utilità del sistema originale di Merrifield. Oggi, l'uso di un Boc e protezione basato su base / nucleofilo strategia di resina scindibile o Fmoc e protezione basato su resina acida strategia scindibile, introdotta da RC Sheppard, sono più comunemente utilizzati per la sintesi di peptidi 1.
Ispirato strategia solido supportato Merrifield, abbiamo sviluppato un Boc / terz-butil fase solida strategia di sintesi per l'assemblaggio di funzionalizzati bis-peptidi 2, che è qui descritti. L'uso di sintesi in fase solida rispetto to soluzione fase metodologia non è solo vantaggiosa in termini di tempo e di lavoro come descritto da Merrifield 1, ma consente anche una maggiore facilità nella sintesi del bis-peptide librerie. La sintesi qui dimostrano che incorpora una fase finale di scissione che utilizza due step "sicura" meccanismo per liberare il funzionalizzato bis-peptide dalla resina mediante formazione dichetopiperazina.
Bis-peptidi sono rigidi, spiro-scala oligomeri di bis-amminoacidi in grado di posizionare la funzionalità in modo prevedibile e progettabili, controllato dal tipo e la stereochimica delle unità monomeriche e la connettività tra ogni monomero. Ogni bis-amminoacido è un stereochimicamente puro, ciclico scaffold che contiene due aminoacidi (un acido carbossilico con una α-ammina) 3,4. Il nostro laboratorio sta attualmente indagando le potenzialità funzionali del bis-peptidi attraverso una vasta gamma di settori tra cui catalisi, interazioni proteina-proteina e nanomaterials.
Protocollo
1. Setup
- La reazione set-up per la sintesi in fase solida è una cartuccia filtro di polipropilene o reattore di vetro che è collegato mediante un tubo di polipropilene ad un pallone chiuso filtrazione sotto vuoto, come mostrato nella Figura 1. La reazione può essere miscelato con un agitatore magnetico o da gorgogliare azoto attraverso il reattore.
- Un collettore gas collegato ad una bombola Argon dotato di un tubo di essiccazione e di gorgogliamento olio è inoltre consigliabile in quanto permette il recipiente di reazione deve essere contenuta in atmosfera inerte e permette la rimozione di reagenti da contenitori sigillati.
- Tutte le operazioni vengono eseguite in una cappa aspirante e proprio dispositivo di protezione individuale (occhiali, camice e guanti di nitrile) è obbligatorio.
2. Primo caricamento Bis-Peptide Onto Resina
- Pesare 114 mg di HMBA-AM Resina (0,88 mmol / g di carico, 100 mmol) in 8 ml di reazione recipiente e aggiungere barra magnetica di agitazione. Chiudere la parte superiore del secolorecipiente e con un setto di gomma e il tubo di spurgo con argon per almeno 5 minuti.
- Nel frattempo, pesano 117,3 mg del composto 1 della figura 3 (586,63 g / mol, 2 eq) e 59,2 mg di 1 - (mesitilene-2-solfonil)-3-nitro-1 ,2,4-triazolo (MSNT, 296,0 g / mol, 2 eq) in una provetta da centrifuga 15 mL monouso e sciogliere in 2 mL di diclorometano anidro (DCM). Aggiungere 24 microlitri di 1-metilimidazolo (NMI, 80,81 mL / mol, 3eq) alla soluzione e mescolare fino a completo scioglimento.
- Trasferire la soluzione attivata al recipiente di reazione attraverso una siringa e consentono di mescolare sotto argon notte (circa 10 ore).
- Rimuovere il setto e drenare la miscela di reazione. Lavare la resina con DCM (5x) e dimetilformammide (DMF) (5x). Eseguire il "test rosso metile" descritto nel paragrafo 10.1 per valutare il grado di carico resina. Se la resina rimane rosso durante il test rosso metile passi poi 2.2 e 2.3 deve essere ripetuto. Un colore giallo, indicativo di un test negativo rosso di metile, è preferito;Tuttavia, poiché tutti i gruppi ossidrilici rimanenti saranno limitati nel passaggio successivo, un risultato leggermente positivo (colore luce resina arancione) può essere accettabile.
3. Deprotezione della prima resina Bis-peptide e simultanea Capping
- Aggiungere 1 mL di DCM al recipiente di reazione si aggiunge 1 ml di acido bromidrico 33% in acido acetico a gocce nell'arco di 30 secondi (bolle verifica) e permettono a mescolare per 15 minuti. Scolare e lavare la resina con DCM (5x) e poi ripetere il procedimento una volta di più.
- Lavare la resina con DCM (5x) quindi DMF (5x). Neutralizzare il resina mediante lavaggio due volte con un 5% v / v soluzione di N, N-diisopropiletilammina (DIPEA) in DMF, poi lavare con DCM (5x) e DMF (5x) nuovamente. Eseguire il "test rosso metile" e "test cloranile" discusso nella sezione 10.1 e 10.2. I risultati dovrebbero essere negativo per il rosso metile, test e positivo per il test cloranile.
4. Giunto Boc / tBu-Protetto funzionalizzato Bis-Amino Acid
- Reintrodurre un'atmosfera inerte alla resina contenente recipiente di reazione mediante lavaggio tre volte con DCM anidro poi attaccare un setto e linea di argon. Spurgare e lavare il contenitore con l'aggiunta di 1-2 mL di DCM anidro e lasciare che si agita per 30 secondi, quindi lo scarico della nave fino a quando la linea di argon gorgogliatore comincia a salire. Fate questo almeno una volta di più.
- Preparare una soluzione di 0,15 M funzionalizzata bis-amminoacido (3eq) e 245 mg di 1-idrossi-7-azabenzotriazole (HOAT, 136,11 g / mol, 18eq) in 2 mL di 2:1 DCM: DMF in un test fiamma essiccata Tubo in atmosfera di argon. Aggiungere 47 microlitri di diisopropilcarbodiimmide (DIC, 156,6 mL / mol, 3eq) e mescolare per 90 minuti.
- Aggiungere 35 microlitri DIPEA (174,19 ml / mol, 2 eq) in 666 pl DMF anidra di resina e consentire in agitazione per 5 minuti.
- Trasferire la pre-attivato bis-ammino soluzione acida recipiente di reazione attraverso una siringa e consentono di agitazione per una notte.
- Scolare la miscela di reazione e lavare due volte con DCM anidro mentre sotto argon.
- Per promuovere la chiusura del dichetopiperazina, aggiungere una soluzione 0,25 M di HOAT (136,11 g / mol, 10eq) e DIC (156,6 mL / mol, 10eq) in uno 4 mL di 1:1 DCM: DMF e permettono di mescolare sotto argon per 1 ora.
- Rimuovere il setto e drenare la miscela di reazione. Lavare la resina con DCM (5x) e DMF (5x). Se lo si desidera, eseguire il "test cloranile" discusso nella sezione 10.2.
5. Deprotezione di Boc / tBu-Protetto funzionalizzato Bis-Amino Acid
- Aggiungere 2 mL di una soluzione di acido trifluororacetic 95:5 (TFA): triisopropilsilano (TIPS) al recipiente di reazione e permettono di mescolare per 1 ora. Scolare e lavare la resina per circa 30 secondi con DCM (5x) e poi ripetere il procedimento una volta di più.
- Lavare la resina con DCM (5x) quindi DMF (5x). Neutralizzare il resina mediante lavaggio due volte con un 5% v / v soluzione di DIPEA in DMF, poi lavare DCM (5x) e DMF (5x) nuovamente. Se lo si desidera, eseguire il "test cloranile" discusso nella sezione 10.2.
7. Funzionalizzazione del Bis-Peptide End Prolidine
- La fine prolidine del crescente bis-peptide può essere acilati indipendentemente o insieme attraverso un dichetopiperazina. Inoltre, tale fine può essere omesso protetto, che sarà clivato quest'ultimo, offrendo l'amminoacido libero. Se lo si desidera, eseguire il "test cloranile" discusso nel paragrafo 10.2 per valutare l'efficienza di accoppiamento.
8. La deprotezione del Fmoc e Acilazione della fine quaternario del Bis-Peptide
- Una soluzione 2 ml di 20% piperidina in DMF viene aggiunto e la reazione viene mescolata per 20 minuti. Scolare e lavare la resina con DMF (5x) e poi ripetere il procedimento una volta di più.
- Lavare la resina con DCM (5x) quindi DMF (5x).
- Preparare una soluzione 0,15 M di amminoacido (3eq) in 2 mL di N-metilpirrolidone (NMP) con 114 mg 2 - (7-aza-1H-benzotriazolo-1-il) -1,1,3,3-tetrametiluronio esafluorofosfato (HATU, 380,2 g / mol, 3eq) e 104,5 ul DIPEA (174,19 mL / mol, 6EQ) e mescolare bene. Aggiungere al recipiente di reazione e permettono di agitare per 6 ore.
- Lavare la resina con DCM (5x) quindi DMF (5x).
9. Rimuovere il gruppo Boc dalla resina Bound Amino Acid e Cleave in resina
- Aggiungere 2 mL di TFA 1:1: soluzione DCM al recipiente di reazione e permettono di agitare per 30 minuti. Scolare e lavare la resina con DCM (5x) e poi ripetere il procedimento una volta di più.
- Lavare e asciugare la resina per 30 secondi con DCM (5x) e poi DMF (5x).
- Aggiungere 2 mL di una soluzione al 10% DIPEA in DMF anidra e permettono di mescolare 24-48 ore.
- Raccogliere miscela di reazione in pre-pesato pallone a fondo tondo. Trasferire 30 pl di questa soluzione a 450 pl di THF in un flacone LC-MS per l'analisi e presentare. Lavare la resina con ulteriori aliquote di DMF e raccogliere nel pallone a fondo tondo quindi rimuovere il solvente sotto vuoto.
10. Purificazione di Bis-Peptide
- Sciogliere grezzo bis-peptide in una quantità minima di dimetilsolfossido (100-250 mL) e trasferimento nell'inserto flaconcino HPLC. Inserire luogo in autocampionatore di semi-prepitive sistema HPLC (Hewlett Packard serie 1100) equipaggiato con un Prep XTerra MS C18 5 um 7.8x150 colonna mm e 100 pl ciclo di iniezione.
- Eseguire più di 50 iniezioni ul del campione utilizzando un programma di pendenza 5-95% acetonitrile in acqua con 0,1% di acido formico in 30 minuti durante il monitoraggio a 274 nm. Raccogliere il picco prodotto in pre-pesato monouso provetta da centrifuga e congelare a secco utilizzando una liofilizzatore. Attenzione deve essere assunto con la prima esecuzione, come un leggero cambiamento nel tempo di ritenzione di picco rispetto al LCMS analitici si osserva tipicamente.
11. Metodi di valutazione
- METILE ROSSO TEST 7: Rimuovere ~ 1 mg di resina a secco tramite pipetta monouso e lavare in 4 mL recipiente di reazione. Aggiungere una soluzione di 20 mg rosso di metile, 50 microlitri N, N'-diisopropilcarbodiimmide (DIC), 5 mg e 4-dimetilamminopiridina (DMAP) in 500 pl DCM anidro e permettono a mescolare per 5-10 min. Scolare e lavare resina con DCM fino a quando il filtrato diventa incolore. L'indicazione è positiva le gocce di resina restanti arancione o rosso.
- Cloranile TEST 12: Transfer ~ 1 mg di resina a secco in una piccola fiala tramite pipetta monouso. Aggiungere 3 gocce di sia cloranile 0,8 mM in DMF e la soluzione al 2% in soluzione acetaldeide DMF e lasciate riposare a temperatura ambiente per 5-10 minuti. L'indicazione è positiva le gocce di resina di tornitura blu / viola.
- TRAP TEST ATTIVAZIONE: composti attivati durante la sintesi può essere valutata trasferendo una piccola quantità (pl 5-10) della soluzione attivata per un liquido cromatografia-spettrometria di massa (LC-MS) flacone contenente 50 pl di pirrolidina. Mescolare a mano per pochi secondi (SOLUZIOdovrebbe diventare il giallo) e poi diluire con 450 microlitri di tetraidrofurano (THF) e sottoporre LC-MS.
- ANALITICA LC-MS: Il prodotto finale e intermedi attivati possono essere valutato utilizzando un HP 1200 serie LC-MS impianto dotato di Waters XTerra MS C18 3,5 micron 4,6 mm x 150 mm di colonna ed un sistema gradiente 5-95% di acetonitrile in acqua con 0,1% di acido formico in 30 minuti.
12. Risultati rappresentativi
Un esempio di entrambi grezzo (Figura 4) e purificata (Figura 5) tracce LCMS sono fornite. Purificati rese di circa il 10% si aspetta con le modalità sopra descritte.

Figura 1. Schema di set-up sperimentale per la sintesi in fase solida.
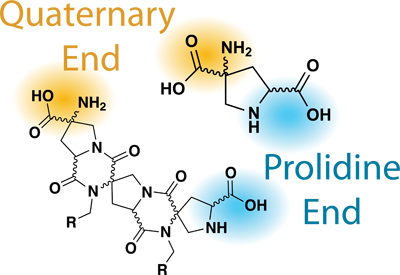
Figura 2.Nomenclature rilevanti del Bis-aminoacidi / bis-peptidi.

Figura 3. Complesso schema sintetico. Clicca qui per ingrandire la figura .

Figura 4a. Trace HPLC del prodotto grezzo a 274 nm.
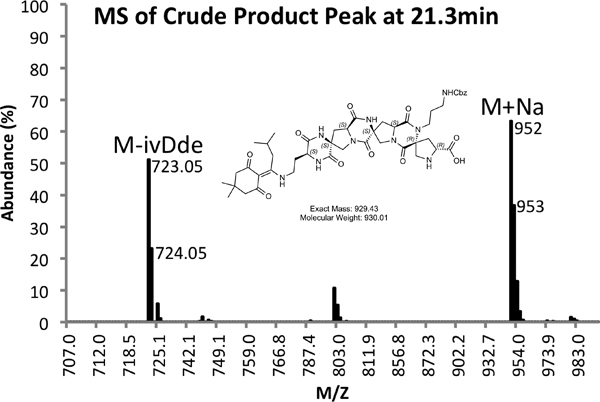
Figura 4b. Spettro di MS Peak prodotto grezzo.
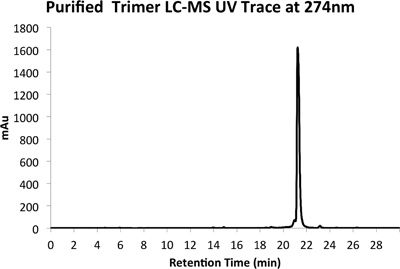
Figura 5a. HPLC Trace di prodotto purificato a 274 nm.
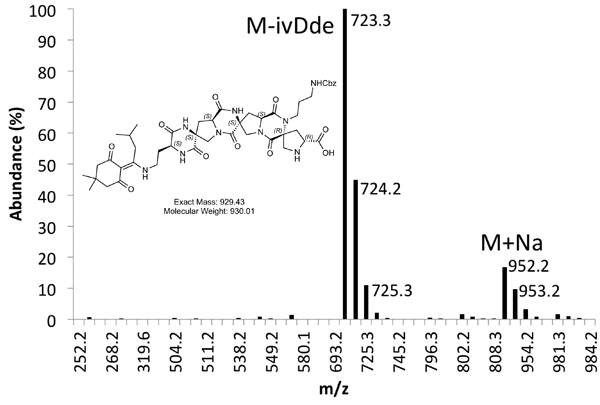
Figura 5b. Spettro di MS purificato Product Peak.
Discussione
L'approccio sintetico qui presentato fornisce un metodo per la sintesi di funzionalizzati bis-peptidi da blocchi acido bis-ammino costruzione utilizzando comuni tecniche in fase solida di sintesi peptidica. La sintesi di monomeri di questi "mattoni" PRO4 di trans-4-idrossiprolina 3 è altamente scalabile ed è stato completato con successo alla fase idantoina a 600 mmol (234 g) scala (non pubblicato). Una volta che i monomeri sono in mano, l'uso di tecniche in fase solida fornisce un metodo più rapido di bis-peptide sintesi del nostro attuale soluzione fase metodologia 4 eliminando la necessità di reazione work-up e purificazioni intermedi.
La sfida primario in sintesi in fase solida viene diagnosi progressi sintetico e risolvere problemi in quanto non intermedi sono isolati. Questo ha portato allo sviluppo di numerosi test colorimetrici comprese quelle per identificare se ammine libere (Kaiser Test 10) o senza idrossidoYLS (Methyl Red Test 7), sono esposti su resina. Sfortunatamente, il test comunemente usato Kaiser 10 non è generalmente applicabile nel nostro sintesi in fase solida per l'utilizzo quasi esclusivo di ammine secondarie o ammine attaccati ad un carbonio quaternario. Altre opzioni per la valutazione di resina HMBA includono divisioni di prova utilizzando un nucleofilo quale idrazina 11, quantitativa scissione Fmoc monitorato da UV / Vis 1,11, e la cattura e l'analisi in arrivo composti attivati.
Un altro problema trascurato in sintesi in fase solida è la natura ripetitiva di passaggi sintetici richieste dall'operatore. Cosciente di questo, gli autori consiglia vivamente l'uso di un foglio di calcolo o lista di controllo durante l'esecuzione di qualsiasi manuale in fase solida sintesi peptidica.
La difficoltà nell'utilizzare bis-peptidi per sintesi in fase solida rispetto alle comuni α-amminoacidi include il potenziale per accoppiamenti più difficile a causa sterico hinDrance, la necessità di on-resina chiusure dichetopiperazina e deprotections simultanee (Boc / tBu; Cbz / tBu). Un altro difficilmente è quello di conseguire rilascio quantitativa dalla resina utilizzando questa "sicura" metodo rispetto a mezzi più convenzionali. Con questi fattori in mente, è molto probabile che un'ulteriore ottimizzazione di questo metodo può essere realizzato e le iniziative attuali sono in corso nel nostro gruppo per migliorare il metodo presentato qui.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Zachary Z. Brown e Jennifer Alleva per lo sviluppo iniziale di questa tecnica di sintesi in fase solida e Matthew Parker FL utili per le discussioni. Questo lavoro è supportato dalla Defense Threat Reduction Agency (DOD-DTRA) (HDTRA1-09-1-0009) e Horst Witzel Fellowship Award supportato da Cephalon, Inc.
Materiali
| Nome | Azienda | Numero di catalogo | Comments |
| HMBA-Am Resina | Novabiochem | 855018 | |
| MSNT | Novabiochem | 851011 | |
| NMI | Sigma-Aldrich | 336092 | Tossico, Corrosivo |
| DCM | Sigma-Aldrich | D65100 | Cancerogeno |
| DCM anidro | Acros | 34846 | Cancerogeno |
| Acido bromidrico 33% in acido acetico | Sigma-Aldrich | 248630 | Tossico, Corrosive, fumi quando è aperto |
| DIPEA | Sigma-Aldrich | 387649 | Infiammabile, tossico, corrosivo |
| DMF | Fisher Scientific | AC27960 | Infiammabili, tossici |
| DMF anidra | Acros | 34843 | Infiammabili, tossici |
| HOAT | GenScript | C01568 | |
| DIC | Acros | BP590 | Infiammabile, tossico, corrosivo |
| TFA | Sigma-Aldrich | T6508 | Tossico, Corrosivo |
| CONSIGLI | Acros | 21492 | Infiammabili, tossici |
| Piperidina | Sigma-Aldrich | 104094 | Infiammabile, tossico, corrosivo |
| HATU | GenScript | C01566 | Toxic |
| NMP | Acros | 36438 | Tossico |
| DMAP | Novabiochem | 851055 | Tossico |
| Methyl Red | Sigma-Aldrich | 250198 | |
| THF | Sigma-Aldrich | 401757 | Infiammabile, tossico, perossido di Formazione |
| Pirrolidina | Sigma-Aldrich | P73803 | Infiammabile, tossico, corrosivo |
| Dimetilsolfossido | Pescatore | D1281 | |
| SPPS recipienti per reazioni | Grazia | 211108 | |
| LCMS | Agilent | Serie 1200 | |
| Semi-Prep LC | Hewlett Packard | Serie 1100 | |
| Liofilizzatore | Labconco | 7934027 | |
| Rotovapor | Buchi | R-210 Series | |
| Argo | Airgas | AR PP300CT |
Riferimenti
- Atherton, E., Sheppard, R. C. Solid Phase Peptide Synthesis: A Practical Approach. , Oxford University Press. (1989).
- Brown, Z. Z., Alleva, J., Schafmeister, C. E. Solid-Phase Synthesis of Functionalized Bis-Peptides. Biopolymers. 96, 578-585 (2010).
- Schafmeister, C. E., Brown, Z. Z., Gupta, S. Shape-Programmable Macromolecules. Acc. Chem. Res. 41, 1387-1398 (2008).
- Brown, Z. Z., Schafmeister, C. E. Synthesis of Hexa- and Pentasubstituted Diketopiperazines from Sterically Hindered Amino Acids. Org. Let. 12, 1436-1439 (2010).
- Nielson, J., Lyngso, L. O. Combinatorial Solid-Phase Synthesis of Balanol Analogues. Tet. Lett. 37, 8439-8442 (1996).
- Blankemeyer-Menge, B., Nimtz, M., Frank, R. An Efficient Method for Anchoring Fmoc-Amino Acids to Hydroxyl-Functionalized Solid Supports. Tet. Lett. 31, 1701-1704 (1990).
- Komba, S., Sasaki, S., Machida, S. A New Colorimetric Test for Detection of Hydroxyl Groups in Solid-Phase Synthesis. Tet. Lett. 48, 2075-2078 (2007).
- Demner, O., Dijkgraaf, I., Schottelius, M., Wester, H. J., Kessler, H. Introduction of Functional Groups into Peptides via N-Alkylation. Org. Lett. 10, 2015-2018 (2008).
- Plas, S. E. V. ander, Van Hoeck, E., Lynen, F., Sandra, P., Madder, A. Toward a New SPE Material for EDCs: Fully Automated Synthesis of a Library of Tripodal Receptors Followed by Fast Screening by Affinity LC. Eur. J. Org. Chem. 11, 1796-1805 (2009).
- Kaiser, E., Colescot, R. L., Bossinger, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34, 595-598 (1970).
- Chan, W. C., White, P. D. Fmoc Solid Phase Peptide Synthesis: A Practical Approach. , Oxford University Press. (2000).
- Vojkovsky, T. Detection of Secondary Amines on Solid-Phase. Peptide Research. 71, 236-237 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon