Method Article
Autólogas progenitoras endoteliais Cell Technology Semear e Teste de biocompatibilidade para dispositivos Cardiovascular em Modelo Animal Grande
Neste Artigo
Resumo
Um método para semeadura de titânio de sangue entrar em contato com biomateriais com células autólogas e biocompatibilidade teste é descrito. Este método utiliza células progenitoras endoteliais e tubos de titânio, semeadas em poucos minutos de implante cirúrgico em suínos as cavas. Esta técnica é adaptável a muitas outras implantáveis dispositivos biomédicos.
Resumo
Implantáveis cardiovasculares são fabricados a partir de materiais artificiais (por exemplo, titânio (Ti), politetrafluoroetileno expandido), que representam o risco de formação tromboêmbolos 1,2,3. Nós desenvolvemos um método para a linha de superfície interna de tubos de Ti com autólogo derivados do sangue humano ou de suíno células progenitoras endoteliais (EPCs) 4. Através da implantação de tubos de Ti contendo uma camada confluente de EPCs suína na veia cava inferior (VCI) de porcos, testamos a biocompatibilidade melhorada da superfície da célula-semeado no ambiente pró-trombótico de um modelo animal de grande porte e comparou-a inalterada superfícies de metal nu 5,6,7 (Figura 1). Este método pode ser usado para endothelialize dispositivos dentro de poucos minutos de implantação e teste sua função antitrombótica in vivo.
Sangue periférico foi obtido a partir de 50 kg Yorkshire suína e sua fração de células mononucleares de cultura para isolar EPCs 4,8. Ti tubos (9,4 mm de diâmetro) foram pré-cortados em três seções 4,5 centímetro longitudinal e remontado com calor-encolhem a tubulação. Um dispositivo de semeadura foi construído, que permite a rotação lenta dos tubos de Ti.
Foi realizada uma laparotomia na porcos e exteriorizada do intestino e bexiga urinária. Dissecção cortante e contundente foi usado para esqueletizar da VCI de sua bifurcação distal à artéria renal direita proximal. Os tubos de Ti foram então enchidos com fluorescente marcado autólogo suspensão EPC e rodado em 10 RPH x 30 min para alcançar uniforme de células de revestimento-9. Após a administração de heparina 100 USP / kg, ambas as extremidades do IVC e uma veia lombar foram presos. A veinotomy 4 cm foi realizada eo dispositivo inserido e preenchido com tampão fosfato. Como o veinotomy foi fechada com uma sutura Prolene 4-0, um grampo foi removido para o IVC de-ar. No final do procedimento, a fáscia foi aproximado com 0-PDS (polidioxanona sutura), o espaço subcutâneo fechado com Vicryl 2-0 ea pele fechados com grampos.
Após 3-21 dias, os porcos foram sacrificados, o dispositivo explantado en-bloco e fixa. Os tubos foram desmontados Ti e as superfícies internas fotografada com um microscópio de fluorescência.
Descobrimos que os tubos de metal simples Ti totalmente ocluído enquanto os tubos EPC-semeado permaneceu patente. Além disso, fomos capazes de demonstrar uma camada confluente de EPCs na superfície de sangue entrar em contato com seu interior.
Concluindo, a nossa tecnologia pode ser usada para endothelialize tubos de Ti em poucos minutos de implantação com EPCs autólogo para prevenir a trombose do dispositivo. Nosso método cirúrgico permite testar a biocompatibilidade melhorada de tais dispositivos modificados com a perda de sangue mínima e EPC-semeado interrupção superfície.
Protocolo
1. Isolamento de células progenitoras endoteliais
- Trinta dias antes da EPC-semeado implante de tubo, prepare uma seringa de 60 ml com 15 ml de solução anticoagulante de citrato dextrose e seguro com uma torneira de 3 vias para o isolamento de EPC de sangue de porco periféricos. 24 horas antes da coleta de sangue, duas de 12 pré-revestimento bem pratos com colágeno tipo de rato 1 (50 mg / ml, dissolvido em 0,02 N solução de ácido acético) 4.
- Realizar todos os cuidados com animais de experimentação e de acordo com o Instituto Nacional de Saúde Diretrizes para o Cuidado e Uso de Animais de Laboratório e somente após a aprovação do Animal Care supervisionar Institucional e Comitê de uso.
- Sedar uma fêmea Yorkshire porco (45 kg) com acepromazina (1,1 mg / kg) e ketamina (22 mg / kg) intramuscular através de uma agulha 19 G borboleta.
- Entubar o porco com um tubo endotraqueal (30 cm de comprimento, 8 mm de diâmetro) e anestesiar porco com isoflurano (4,5% do volume corrente pela máscara).
- Monitorar o porco durante o procedimento através da medição da saturação de oxigênio, freqüência cardíaca e temperatura. Manter a termorregulação usando uma mesa de operação automatizada aquecida e manta de aquecimento e pelo aquecimento dos líquidos infundidos.
- Coloque o porco na posição supina na mesa de operação, assegurar a sua caudolaterally membros posteriores, e limpo com clorexidina seguido por DuraPrep esterilização. Então prossiga com draping a área pélvica.
- Inserir uma agulha 21 G x 7 cm a partir de um kit 5 F micro-medial introdutor apenas a um pulso palpável femoral (medial do vasto medial e lateral do músculo gracilis) na veia femoral e canulação da veia utilizando a técnica de Seldinger. Conectar a seringa preparada ml 60 ao cateter intravascular e tirar 45 ml de sangue.
- Segurar a pressão no local da punção navio para realização da hemostasia (5 min), interromper a anestesia e recuperar o porco. O animal é monitorado até a recuperação completa e voltou para sua gaiola.
- Diluir o sangue solução 1:1 com solução de Hank sal tamponada (sem CaCl 2, MgCl 2, MgSO 4) e camada em volumes iguais de Histopaque para criar camadas bem definidas. Centrifugação (30 min, 740 g, configuração quebrar baixo) e coletar células mononucleares (MNC) de camadas. Ressuspender e lavar as multinacionais x 3 com Fosfato de Dulbecco Buffered Saline (DPBS) (10 min, 515 g) antes do plaqueamento em dois 12-lamelas em meio de crescimento total (EBM-2 média com 2% Porcina soro (PS) e EGM-2 SingleQuots) a 37 ° C, 5% de CO 2.
- Mudar lentamente média a cada 24 horas durante os primeiros 7 dias, então a cada dois dias. Identificar colônias EPC após um tempo médio
de 7 dias (Figura 2). - Expandir EPCs na cultura, uma vez que cobrem ¼ da área de superfície de 12 também. Confirmar a identidade EPC com citometria de fluxo por meio de testes para a presença de marcadores de superfície CD31 e ausência de CD14, CD45. Outros ensaios que podem ser realizados incluem a morfologia das células e do óxido nítrico atividade III após a exposição ao fluxo de 4.
2. Conjunto de tubos de titânio
- Seção de um tubo de Ti longitudinalmente em 3 igual 120 graus unidades (4,5 cm de comprimento) com 72 dentes HHS corte viu mantida no lugar por um mandril viu em uma fresadora vertical. Executá-lo em 300 RPM e manter a área de corte saturado com fluido de corte Toque Mágico em todos os momentos durante o corte (Figura 3).
- Polonês a superfície interna com um moedor de banco e uma roda de metalurgia Scotch-Brite. Em seguida, manualmente polonês com a 3M lixa para a superfície mais lisa e uniforme para remover qualquer pits visível.
- Limpe as peças com Ti Alconox solução de sabão, seguido por 5 min de submersão em água régia (1:3 ácido nítrico concentrado ao ácido clorídrico concentrado), seguido por lavagem com vários litros de água 10. Tenha cuidado extremo como água régia é altamente corrosivo e potencialmente explosiva!
- Seções sonicate Ti x min 16 em Alconox solução de sabão, a ascensão x 30 em água deionizada e novamente sonicate x 16 min em água deionizada. Deixe secar em capela de fluxo laminar.
- Cortar tubos PVC termoretrácteis a 4,5 cm de comprimento e limpe por 2.4.
- Use uma pinça para colocar as 3 secções limpas Ti em um mandril de suporte (fabricado a partir de alumínio, 8,5 mm de diâmetro externo) e manga lugar de PVC tubulação do calor encolhe cerca de seções Ti (Figura 4). Tubos com uma pistola de calor ao girar o mandril para uniformemente wrap seções Ti firmemente junto.
3. Dispositivo de semeadura e montagem de componentes
- Corte o tubo de silicone para um comprimento de 2,5 cm e 3,5 cm.
- Seção de seringa 5 cc de plástico na marca de 0,8 ml e manter 'pedaço cabeça "com o fim luer.
- Limpe cuidadosamente duas seções silicone x, 'parte principal' seringa e uma tampa luer por sonicação como descrito em 2.4.
- Adicionar tubo de silicone em cada extremidade do tubo de Ti montados a partir de 2.5, extensãoding por 5 mm em tubos de PVC.
- Inserir corte final de "parte principal" da seringa no tubo de silicone curto, de modo que confina Ti tubo (Figura 5).
- Seal terminou Ti conjunto de tubo com uma tampa luer em bolsa de Tyvek e gás-esterilização com óxido de etileno (18 horas a 55 ° C).
- Montar um motor síncrono de tempo (10 RPH) em uma plataforma de acrílico e ligar o seu eixo a um suporte de seringa (usinados em alumínio, se encaixa seringa de 5 cc) (Figura 6).
4. EPC-semeadura de Ti superfície do tubo interno
- Expandir EPCs isoladas como em 1. Confluentes a 3 T-75 balões (ou, pelo menos, 9 x 10 6 células).
- No dia da cirurgia, as células fluorescente etiqueta com longo prazo de corante (PKH26) 11. Comece lavando EPCs cultivadas duas vezes em meio livre de soro. Cuidado para limitar a exposição à luz para proteger as células durante e após a rotulagem.
- Cobrir as células com 4 mm de PKH26 em Diluente C (solução de corante) em temperatura ambiente por 4 minutos.
- Parar de rotular reacção adicionando soro suíno em volume igual a tintura solução. Um min depois, diluir 1:1 com solução combinada de médio pleno crescimento.
- Aspirar líquidos e enxaguar células x 3, com crescimento médio completo.
- Lavar duas vezes em DPBS EPCs (sem CaCl 2, MgCl 2).
- Cobrir células em tripsina e incubar a 37 ° C por 3 minutos e confirmar o desapego em microscópio de luz. Adicionar Tripsina Solução de Neutralização em dobro do volume de tripsina usada.
- Combine soluções célula em um único tubo e misturar por pipetagem. Adicionar 10 ml de solução de células em cada lado de um hemocitômetro para a contagem.
- Solução centrífuga celular (1500 RPH, 5 min.). Contagem de células e ressuspender pellet em 2-2,5 x 10 6 EPCs / ml em meio livre de soro. Observe o volume mínimo para preencher o conjunto dos tubos é de 4,5 ml.
- Lay out toalha estéril na capa biológica para o campo estéril. Abra gás esterilizados Ti conjunto de tubos e seringas cc extra 5 em campo estéril.
- Com luvas estéreis, remover o êmbolo da seringa de 5 cc e manter em campo para uso posterior. Apor tampa luer a esta seringa.
- Pipeta de 4,5 - 5 ml de suspensão EPC em 4,9 para o corpo da seringa aberta. Inserir êmbolo de forma segura na extremidade aberta de seringa.
- Segure a seringa com tampa para cima e retire a tampa. Inserir seringa com luer primeira final em tubo de silicone aberto de Ti conjunto de tubos até confortável, não avançam dentro do tubo Ti.
- Antecedência êmbolo da seringa lentamente até solução da célula atinge topo de cortar seringa 'parte da cabeça ", removendo as bolhas do sistema. Fechar com tampa luer e inserir conjunto inteiro em bainha estéril, selando extremidade aberta com fita adesiva.
- Insira este conjunto inteiro no suporte usinado seringa de 3,7. Colocar em estufa a 37 ° C e ajuste da plataforma de modo que parte do tubo de Ti câmara de semeadura é em nível, utilizando medidor de nível de água (Figura 6).
- Permitir Ti conjunto de tubos para rodar 30 minutos antes da implantação.
5. Implantação de Ti tubo suína veia cava inferior
- Vinte e quatro horas antes da cirurgia, premedicate o porco (a partir do qual foram isolados EPCs) com um patch fentanil (100 mcg / hr transdérmica; manter remendo no lugar x 72 horas).
- Mantenha porco NPO durante a noite e administrar Baytril (enrofloxacina) no pré-operatório no dia da cirurgia (5 mg / kg, IM) e por 7 dias seguintes, a cada 24 horas como profilaxia antibiótica.
- Sedar, entubar e anestesiar o porco, como descrito no ponto 1.3 (volume corrente de 10 -15 ml / kg) e segura o porco em decúbito dorsal na mesa da sala de operação. Monitorar o porco durante o procedimento através da medição da saturação de oxigênio, freqüência cardíaca e temperatura. Manter a termorregulação usando uma mesa de operação automatizada aquecida e manta de aquecimento e pelo aquecimento dos líquidos infundidos.
- Inserir um cateter 18 G IV na veia do porco orelha e proteger os olhos de porco com colírio Vetropolycin.
- Limpar, preparar e armar o abdômen do porco como em 1.6. Inciso linha média com uma lâmina de bisturi # 15 do conjunto 2 de glândulas mamárias cranial ao segundo ao último set caudalmente.
- Realizar a dissecção até a fáscia abdominal com eletrocautério.
- Elevador do peritoneu com uma pinça mosquito e, cuidadosamente, inseri-lo com uma tesoura Metzenbaum.
- Externalizar a bexiga e coloque um 3-O Vicryl sutura em bolsa na parede da bexiga. Coloque uma incisão em seu meio e inserir um cateter de Foley 16 F. Administrar fluidos intravenosos (Ringer Lactato) para titular a saída de urina para> / = 1 ml / kg / h durante a cirurgia.
- Seguinte, exteriorizar o intestino pequeno e grande porte e colocar dois afastadores Balfour cirúrgica para expor o aspecto posterior da cavidade peritoneal e identificar a veia cava inferior (VCI).
- Usando dissecção aguda e sem corte, com cuidado livre do IVC e do tecido circundante esqueletizar o navio da artéria renal proximal à bifurcação da VCI distal. Exercício extremo cuidado durante a dissecção IVC como até mesmo um defeito muito pequeno na VCI pode levar a hemorragia rápida e sangria do animal.
- Ligadura de todos os ramos laterais do segmento da VCI para garantir que não haverá sangramento em torno do tubo de Ti para ser implantado. Observe o geralmente grandes posterior duas veias lombares que requerem muito cuidado dissecção e ligadura. Além disso, observe que imediatamente proximal à bifurcação do IVC, uma grande veia lombar é comumente encontrado no lado póstero-medial e deve ser dissecado livre e controlada com loops navio em preparação para a colocação de grampo.
- Prosseguir com a semeadura do tubo de Ti, simultaneamente, como descrito no ponto 4.
- Administrar 100 USP / kg de heparina imediatamente antes da fixação da VCI. Coloque 45 grampos grau ângulo cirúrgico distalmente no IVC e veia lombar, e depois proximalmente.
- Criar um veinotomy longitudinal (4 cm) entre as pinças proximal e distal utilizando uma lâmina de bisturi # 11 seguido por extensão com Potts tesoura.
- Evacuar todo o sangue da veia cava inferior e lave sua luz interior com DPBS estéril.
- Agora insira o EPC-Ti semeado tubo (ou um controle de nu metal) no IVC e preenchê-lo com DPBS (com CaCl 2, MgCl 2) para evitar que as células de secagem e para evacuar o ar.
- Feche a veinotomy com uma sutura Prolene 4-0 e remover uma braçadeira proximal para o IVC de-ar através de uma pequena quantidade de sangramento de volta. Coloque um 'ficar de sutura "através da parede da veia para os tubos de PVC para evitar a migração do implante ao longo do tempo.
- Feche a fascia com O-PDS em uma agulha CT eo espaço subcutâneo com Vicryl 2-O (sutura contínua). Feche a pele com agrafos.
- Administrar até 20 ml de Marcaine 0,25% (Bupivacaína) por via subcutânea ao longo do local da incisão e cobrir a ferida com gaze e Tegaderm. Também dar Flunixina (2,2 mg / kg Q 24 hr) e Oximorfona (0,15 mg / kg Q 3-4 hr) por via subcutânea, necessário para a dor.
- Interromper a anestesia, monitor do porco, até acordar e voltar à gaiola. Monitor de porco duas vezes por dia para sinais de sofrimento / dor de pé, e deambulação, fezes e de urina, e cor da pele, indicando perfusão normal.
6. Explante de Ti tubo
- Após 3 semanas, sedar, entubar e anestesiar o porco como descrito no 1,3-1,4.
- Prosseguir com uma laparotomia, conforme descrito no 5,5-5,8.
- Note que irá esconder cicatrizes no local do implante, mas você pode palpar o tubo de Ti rígida in situ.
- Dissecar o IVC, conforme descrito no 5,9-5,11 e explante do tubo de Ti em bloco com o IVC envolvente, com uma tesoura pesada.
- Eutanásia do animal com solução Euthasol eutanásia (390 mg Sódio / ml Pentobarbital e 50 mg / ml de sódio Fenitoína em 1 ml / 10 lbs).
7. Fixação e de imagem em superfície Ti interior
- Lavar o segmento de veia retirado com tubo de Ti em solução DPBS e fotografar seu lúmen (patente ou ocluído), com uma alta resolução da câmera digital (Figura 7).
- A seguir, corrigir o espécime por submersão em paraformaldeído 3,7% para um mínimo de 15 minutos. Enxágüe de amostra em solução DPBS.
- Com muito cuidado inciso veia circundante e tubulação de PVC para abrir o tubo de Ti. Coloque as 3 seções sob um microscópio de fluorescência com as superfícies internas de frente para o objectivo / fonte de luz e imagem em 550 nm de comprimento de onda de excitação para visualizar PKH26 marcado EPCs em vermelho / cor laranja (Figura 8A). Se desejado, as células podem ser ainda mais manchado (por exemplo, a adesão plaquetária marcador de células endoteliais (PECAM) mancha de visualizar os contornos das células (Figura 8B), DAPI-mancha para visualizar núcleos, etc.)
8. Resultados representativos:
Após a execução deste protocolo, os médicos e os cientistas são capazes de endothelialize estruturas tubo sólido, com derivados do sangue autólogo de células progenitoras endoteliais em um modelo animal de grande porte. Figura 2 mostra que EPCs isoladas com nosso método aparecem como colônias com morfologia de calçada após aproximadamente 7 dias cultura. Nosso dispositivo de semeadura ilustrados nas Figuras 5 e 6 permite a rotação lenta de tubos de Ti cheia com a suspensão do CPE e resulta em uma cobertura uniforme da superfície interior do tubo em condições estéreis 9.
Nosso cirurgia de implante permite testar a propensão de biomateriais, tais como Ti, para trombose em um modelo animal de grande porte. Descobrimos que os porcos tolerar este procedimento bem e que este implante pode ser alcançado apenas com a perda de sangue mínima e sem interrupção EPC camada.
t "> Figura 7 mostra que um tubo de Ti completamente nua oclui, enquanto que o nosso tubo de EPC-lined permanece patente, mesmo no ambiente de cisalhamento protrombótico baixo da veia cava inferior. Além disso, a presença de uma camada confluente de células fluorescentes marcado confirma a sucesso deste método, como mostrado na Figura 8.
Figura 1. Esquemático de autólogo de células endoteliais progenitoras experimento semeadura (EPC). Primeiro, sangue periférico é retirado de um porco. Em seguida, EPCs são isoladas do sangue e expandido em cultura. EPCs são então utilizados para uma linha de titânio dispositivo de tubo (Ti), que depois é implantado cirurgicamente na veia cava inferior do porco mesmo a partir do qual as células foram isoladas.

Figura 2. Colônia Representante da CPE na cultura, cerca de 7 dias após procedimento de isolamento (fotografada com um microscópio invertido Leica DMIL com imagens da câmera e software QCapture).

Figura 3. Ti seções de tubo antes da montagem. Tubo de Ti é cortado em três partes iguais no sentido longitudinal, e depois cortar a 4,5 cm de comprimento. Superfícies internas das seções Ti são polidos utilizando um moedor de banco e lixa para remover pits visível.

Figura 4. Assembléia de seções de tubo PVC com tubo de Ti termoretrácteis (azul) e pistola de calor. Ti seções são suportados em um mandril de alumínio usinado que se estende através de seções e partidas de Ti as dimensões do diâmetro do tubo Ti interior.

Figura 5 Titanium conjunto de tubos, mostrando todos os componentes:. Luer cap, 'parte da cabeça, que a seringa tubo de silicone, e Ti tubo de PVC com wrap (azul). Assembléia é reunir antes da esterilização para uso cirúrgico.

Figura 6. Ti configuração semeadura tubo dentro da incubadora, mostrando motor, plataforma, usinados em alumínio titular seringa, Ti conjunto de tubos, seringas e 5 cc. Nota: A montagem é mostrado sem bainha protetora estéril para fins de visualização.
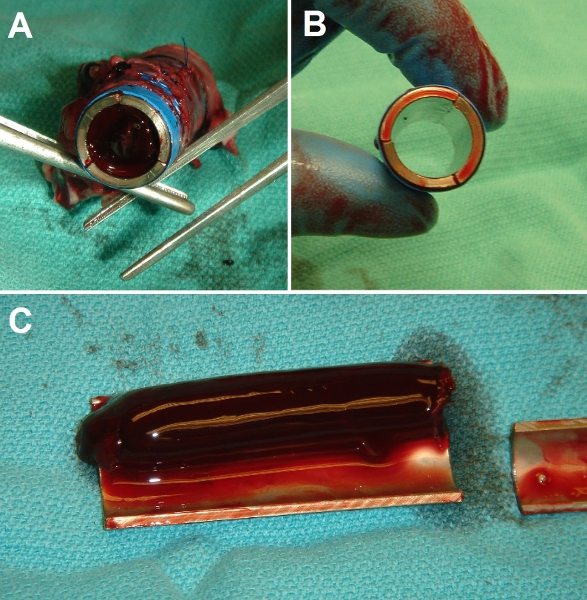
Figura 7. Representante resultados brutos da cirurgia de implante. (A) Fim-vista do controle nua tubo de metal Ti após o implante no suína veia cava inferior (VCI). Tubo de lúmen é totalmente ocluído com um coágulo sólido. (B) Fim-view da EPC-semeado tubo de Ti após o implante. Tubo de lúmen é totalmente patente e claro. (C) vista Dissecada de controle (nu) tubo de Ti após o implante três dias, mostrando extensão da trombose (experimentos foram realizados até 3 semanas de duração, com resultados idênticos).

Figura 8. EPCs em Ti superfície do tubo após a implantação 3 dias (fotografada com um microscópio vertical DMRB Leica com um QICAM QImaging monocromática câmera digital e Image Pro Plus). (A) células confluentes na superfície mostrando PKH26 rotulagem pré-cirurgia. (B) camada confluente de EPCs. Vermelho: PKH26 rotulagem pré-cirurgia. Verde: EPC PECAM-mancha.
Discussão
O método de tubos das células de semeadura de Ti aqui apresentada permite que médicos e cientistas de forma rápida e uniformemente endothelialize sangue entrar em contato com as superfícies dos dispositivos implantáveis. Desde que isolar e expandir EPCs a partir de amostras de sangue periférico, nenhum procedimento invasivo principais é necessária para a colheita destas células. Além disso, o CPE são autólogos e, portanto, o risco de qualquer reação imunológica ao implante de células-semeada é eliminado. Os princípios demonstrados em seu protocolo pode ser utilizado não só para os tubos de Ti, mas para muitos outros biomateriais, que são utilizados na medicina cardiovascular.
Passos críticos neste protocolo são a limpeza meticulosa dos tubos de Ti, como descobrimos que qualquer filme aderente de adesão de contaminantes compromissos celular. Além disso, uma velocidade de rotação lenta (inversamente proporcional ao diâmetro do tubo) é essencial durante o processo de semeadura, de modo que EPCs pode lentamente se estabelecer e aderir à superfície como o tubo de Ti está se movendo.
Nosso método de semeadura imediatamente antes da implantação evita impraticável ex tempos de cultivo in vivo, as células aderem individualmente e, posteriormente, formar uma folha confluentes in vivo, evitando a possibilidade de embolização como uma folha imediatamente após o restabelecimento do fluxo. Nossos estudos anteriores mostram que uma vez que o CPE tem crescido a uma camada confluente, eles fazem uma matriz extra-celular para o qual eles aderem firmemente, adicionalmente, minimizando qualquer sloughing possível de uma folha endoteliais. Embora a possibilidade de descolamento embólicos não pode ser inteiramente descartada, parece ser de risco multifold inferior trombose da superfície dispositivo inteiro, o problema que esta terapia é projetado para impedir.
Nossa abordagem de implantação na corte baixo, o ambiente pró-trombótico da veia cava inferior utiliza um dos mais confiáveis modelos animais de grande porte para a pesquisa de compatibilidade de sangue e trombose de dispositivos de 5,6. Note-se que todos os cuidados com animais de experimentação e foi conduzido de acordo com o Instituto Nacional de Saúde Diretrizes para o Cuidado e Uso de Animais de Laboratório e somente após a aprovação do Animal Care Duke University Institucional e Comitê de uso.
A fim de conseguir utilizar este método para testar o implante de biomateriais e dispositivos, é importante pacientemente esqueletizar o segmento da VCI e ligar todos os vasos venosos filial em preparação para a inserção do dispositivo, tal que nenhum sangramento em torno do dispositivo tem origem em uma "falsa luz". Outro passo fundamental é a adição de DPBS no lúmen dispositivo de tal forma que as células na superfície do tubo dentro de permanecer úmida durante o fechamento do veinotomy e antes da reperfusão é iniciada. Se o dispositivo não pode ser encontrado no local onde foi implantado, ele pode ter migrado 'upstream' na VCI. Isto pode ser evitado colocando uma sutura (Prolene 4-O), através da parede da veia e através de um 2-3 mm de seção da tubulação de PVC de modo que o tubo está firmemente ancorada em sua posição atual. O pesquisador deve ter dificuldade em encontrar as células fluorescente pré-rotulados mostrado na Figura 8, após explante em um tubo de outra forma patente, é provável que as células têm descascada como uma folha coerente. Isto pode ser evitado por meio de dissecção muito gentil da veia circundante e dis-montagem das três secções tubulares Ti, depois da fixação da veia juntamente com o tubo.
Nossa tecnologia fornece a prova de conceito para prevenção de trombose dispositivo cardiovascular através de EPC-semeadura. Esta tecnologia pode ser usada no desenvolvimento de "biogênicos" implantes alinhados com os próprios pacientes, as células progenitoras endoteliais. O estudo de viabilidade em nosso modelo animal porcino prevê os primeiros passos em direção a tradução deste "medicina personalizada" na prática clínica.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Leica Microsystems para os seus conselhos valiosos sobre seções de imagens de titânio e Gemini Bio Produtos para fornecer o soro de suínos utilizados neste estudo. Temos também de agradecer aos NIH para o seu apoio através de Grant "forro autólogo EPC para melhorar a biocompatibilidade de dispositivos de assistência circulatória", RC1HL099863-01. Além disso, estamos gratos pelo apoio da National Science Foundation Graduate Research Fellowship de Alexandra Jantzen. Também gostaria de agradecer George rápida, Mike Lowe e Ianthia Parker para ajudar com muitos aspectos do procedimento cirúrgico e manipulação dos animais de nossa pesquisa. Steven Owen tem sido inestimável para usinagem de peças muitas das nossas dispositivo semeadura e corte de tubos de titânio.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Nome da Empresa | Número Catálogo | Comentários |
| Acepromazina | Boehringer-Ingelheim | BIC670025 | NAC # 10280002 |
| Alconox Cleaner Precision Produzido | Alconox | 1104 | |
| Balfour Retractor Cirúrgica | Adler | N / A | |
| Baytril | Bayer | APVMA 46028/0705 | |
| Borboleta Needle (19G) | Terumo | SV19CLK | |
| Clorexidina | 3M | 9200 | |
| Grampos (45 graus) | Aesculap | FC339T | |
| DPBS (-/-) | Gibco | 14190-144 | |
| DPBS (+/+) | Gibco | 14040-133 | |
| DuraPrep | 3M | 8635 | |
| EBM-2 Medium | Lonza | CC-3156 | Base para as médias de crescimento sérico livre e pleno |
| EGM-2 SingleQuots | Lonza | CC-3162 | Usado com EBM-2 para ambos meio de crescimento sérico livre e pleno |
| Ferramenta de eletrocautério | Valleylab | SurgII-20 | |
| Lixa de esmeril | 3M | 60-0700-0425-8 | 240 grit |
| Euthasol Solução Eutanásia | Virback Saúde Animal | Anada #: 200-071 | |
| Fentanilo | Actavis | NDC # 67767-120-18 | |
| Flunixin | Schering-Plough | NAC #: 10470183 | |
| Foley Cateter (16F) | Bardo | 730116 | |
| HBSS | Sigma | H8264-500ML | |
| Heat Gun | Milwaukee | 8988-20 | |
| Heparina | NDC #: 25021 | ||
| Histopaque-1077 | Sigma | H8889-500ML | |
| Tubo de intubação | Mallinckrodt | 86113 | |
| Isoflurano | MWI, Meridian | NDC # 13985-030 | |
| IV cateter (18G) | Becton-Dickinson | 381547 | |
| Ketamina | Fort Dodge | NDC # 0856-2013 | |
| Nível | Swanson | LLA001 | |
| Luer-Lock ponta cap | CML Abastecimento | 909-001 | |
| Marcaine | Hospira | NDC #: 0409-1560-10 | |
| Tesoura Metzenbaum | Adler | N / A | |
| Micro-introdutor (5F) | Galt | KIT 002-01 | |
| Pinça Mosquito | Adler | N / A | |
| Motor | Herbach e Rademan | H1-08 | |
| Oximorfona | Endo Labs | NDC: 63481-624-10 | |
| PKH26 Dye Kit | Sigma | PKH26GL-1KT | |
| Serum suína | Gémeos Bio-Products | 100-115 | Concentração de 2% em meio de crescimento total |
| Tesoura Potts | Adler | N / A | |
| Pele precisa Vista grampeador | 3M | 3998 | |
| Tubos de PVC | McMaster-Carr/Insultab | 7132K117 | expandiu 15,88 mm de diâmetro, ID recuperado 7,95 milímetros |
| Tamanho Médio direito Angle | Adler | N / A | |
| Bisturi Blade (# 10-15) | Bardo | 373910 | |
| Tubulação de silicone | McMaster-Carr | 51735K26 | 16,64 milímetros OD, 9,52 mm de diâmetro |
| Seringa (5 ml) | Becton-Dickinson (BD) | 309603 | |
| Tegaderm | 3M | 90001 | |
| Torneira de três vias | Kendall | 170060 | |
| Tubo de Ti | Tico Titanium | N / A | Especificado como ½ "OD, 0,065" de parede, 0,370 ID ", £ 0,1737 / ft |
| Tripsina | Lonza | CC-5012 | |
| Tripsina solução neutralizante (TNS) | Lonza | CC-5002 | 0,03% |
| Vetropolycin | Pharmaderm Saúde Animal | NAC #: 12920110 | |
| Vicryl sutura (3-0) | Ethicon | J808T | |
| Aparelho de ultrasons de água | Branson | B200 |
Referências
- Achneck, H. E. Pathophysiology of bleeding and clotting in the cardiac surgery patient: from vascular endothelium to circulatory assist device surface. Circulation. 122, 2068-2077 (2010).
- Achneck, H. E., Sileshi, B., Lawson, J. H. Review of the biology of bleeding and clotting in the surgical patient. Vascular. 16, 6-13 (2008).
- Arvidsson, S., Askendal, A., Tengvall, P. Blood plasma contact activation on silicon, titanium and aluminium. Biomaterials. 28, 1346-1354 (2007).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Kang, C., Bonneau, M., Brouland, J. P., Bal dit Sollier, C., Drouet, L. In vivo pig models of venous thrombosis mimicking human disease. Thromb Haemost. 89, 256-263 (2003).
- Ueberrueck, T. Comparison of the ovine and porcine animal models for biocompatibility testing of vascular prostheses. J Surg Res. 124, 305-311 (2005).
- Velik-Salchner, C. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thromb Res. 117, 597-602 (2006).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc Res Tech. 73, 71-76 (2010).
- Ford, J. W., Welling, T. H., Stanley, J. C., Messina, L. M. PKH26 and 125I-PKH95: characterization and efficacy as labels for in vitro and in vivo endothelial cell localization and tracking. J Surg Res. 62, 23-28 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados