Method Article
Autologo di cellule progenitrici endoteliali-Seeding Tecnologie e test di biocompatibilità per dispositivi cardiovascolari in un modello animale di grandi dimensioni
In questo articolo
Riepilogo
Un metodo per il titanio semina sangue a contatto con le cellule autologhe biomateriali e biocompatibilità test è descritta. Questo metodo utilizza cellule progenitrici endoteliali e tubi in titanio, teste di serie in pochi minuti di impianto chirurgico nelle cave cavae suina. Questa tecnica è adattabile a molti altri dispositivi biomedici impiantabili.
Abstract
Dispositivi impiantabili cardiovascolari sono realizzati con materiali artificiali (per esempio in titanio (Ti), politetrafluoroetilene espanso), che comportano il rischio di formazione di tromboembolie 1,2,3. Abbiamo sviluppato un metodo per allineare la superficie interna dei tubi Ti con cellule umane autologhe o suina emoderivati progenitrici endoteliali (EPC) 4. Mediante l'impianto di tubi di titanio contenente uno strato confluente di EPC suina nella vena cava inferiore (IVC) di suini, abbiamo testato la biocompatibilità miglioramento della cellula-superficie seminata in ambiente protrombotico di un modello animale di grandi dimensioni e non modificato rispetto a superfici di metallo nudo 5,6,7 (Figura 1). Questo metodo può essere utilizzato per endothelialize dispositivi in pochi minuti di impianto e testare la loro funzione antitrombotica in vivo.
Sangue periferico è stato ottenuto da 50 kg Yorkshire suina e la sua frazione di cellule mononucleate in coltura per isolare EPC 4,8. Ti tubi (9,4 mm ID) sono stati pre-tagliati in tre sezioni 4,5 centimetri longitudinale e riassemblati con una guaina termoretraibile. Un dispositivo di semina è stata costruita, che consente la rotazione lenta dei tubi Ti.
Abbiamo eseguito una laparotomia sui maiali e esteriorizzato dell'intestino e della vescica urinaria. Dissezione acuto e schietto è stato utilizzato per skeletonize l'IVC dalla sua biforcazione distale dell'arteria renale destra prossimale. I tubi Ti sono stati poi riempiti con fluorescenza marcata autologo sospensione EPC e ruotato di 10 RPH x 30 minuti per raggiungere uniforme delle cellule di rivestimento 9. Dopo la somministrazione di 100 USP / kg di eparina, entrambe le estremità della IVC e una vena lombare sono stati bloccati. A 4 veinotomy centimetri è stata effettuata e il dispositivo inserito e pieno di PBS. Mentre il veinotomy è stata chiusa con una sutura Prolene 4-0 in esecuzione, un morsetto è stato rimosso a de-air la IVC. Al termine della procedura, la fascia è stata approssimata con 0-PDS (polidiossanone sutura), lo spazio sottocutaneo chiuso con Vicryl 2-0 e la pelle cucito con punti metallici chiusi.
Dopo 3 - 21 giorni, i maiali sono stati sottoposti ad eutanasia, il dispositivo espiantato en-blocco e fissi. I tubi Ti sono stati smontati e le superfici interne ripreso con un microscopio a fluorescenza.
Abbiamo scoperto che il metallo nudo tubi Ti completamente occluso considerando che la SPE-teste di serie tubi rimasti brevetto. Inoltre, siamo stati in grado di dimostrare uno strato confluente di EPC all'interno del sangue a contatto della superficie.
Concludendo, la nostra tecnologia può essere usata per endothelialize tubi Ti pochi minuti di impianto con EPC autologhe per prevenire la trombosi del dispositivo. Il nostro metodo chirurgico consente di testare la biocompatibilità miglioramento di tali dispositivi modificati con minima perdita di sangue ed EPC-seminato distruzione di superficie.
Protocollo
1. Isolamento delle cellule progenitrici endoteliali
- Trenta giorni prima della EPC, testa di serie impianto tubo, preparare una siringa da 60 ml con 15 ml di soluzione anticoagulante citrato destrosio e sicuro con un 3-way rubinetto per l'isolamento EPC dal sangue periferico di maiale. 24 ore prima del prelievo di sangue, prerivestimento due 12-pozzetti con collagene di tipo 1 ratto (50 mg / ml, 0,02 N sciolti in soluzione di acido acetico) 4.
- Condurre tutte la cura degli animali e la sperimentazione in conformità con l'Istituto Nazionale della Salute Linee guida per la cura e l'uso di animali da laboratorio e solo dopo l'approvazione di vigilare Cura degli animali e del Comitato Istituzionale Usa.
- Sedare una femmina Yorkshire maiale (45 kg) con Acepromazine (1,1 mg / kg) e ketamina (22 mg / kg) per via intramuscolare attraverso un ago 19 G farfalla.
- Intubare il maiale con un tubo endotracheale (30 cm di lunghezza, 8 mm ID) e anestetizzare maiale con isoflurano (4,5% del volume corrente da maschera).
- Monitorare il maiale durante la procedura attraverso la misurazione della saturazione di ossigeno, frequenza cardiaca e temperatura. Mantenere la termoregolazione mediante una tabella di funzionamento automatico riscaldata e coperta di riscaldamento e riscaldando i liquidi infuso.
- Mettere il maiale in posizione supina sul tavolo operatorio, assicurarne la caudolaterally arti posteriori, e pulire con clorexidina seguita da DuraPrep sterilizzazione. Quindi procedere con drappeggio zona pelvica.
- Inserire un G 21 x 7 ago cm da un F 5 micro-introduttore kit mediale solo ad un impulso palpabile femorale (mediale al vasto mediale e laterale del muscolo gracile) nella vena femorale e la vena cannulate con tecnica di Seldinger. Collegare il preparato siringa da 60 ml al catetere intravascolare e disegnare 45 ml di sangue.
- Mantenere la pressione sul sito della puntura nave per raggiungere l'emostasi (5 min), interrompere l'anestesia e recuperare il maiale. L'animale è monitorato fino pieno recupero ed è tornato alla sua gabbia.
- Diluire il sangue soluzione 1:1 con soluzione salina tampone di Hank (senza CaCl 2, MgCl 2, MgSO 4) e lo strato di volumi uguali di HISTOPAQUE per creare livelli ben definiti. Centrifuga (30 min, 740 g, impostazione pausa basso) e raccogliere cellule mononucleate (MNC) strato. Risospendere e lavare multinazionali x 3 con fosfato Dulbecco Buffered Saline (DPBS) (10 min, 515 g) prima di placcatura in due da 12 pozzetti in terreno di crescita completa (EBM-2 di media con il 2% suina siero (PS) e EGM-2 SingleQuots) a 37 ° C, 5% di CO 2.
- Lentamente il cambiamento medio ogni 24 ore per i primi 7 giorni, poi a giorni alterni. Identificare le colonie EPC dopo un tempo medio
di 7 giorni (Figura 2). - Espandere EPC nella cultura, una volta che coprono ¼ della 12-ben superficie. Confermare l'identità EPC con citometria a flusso da test per la presenza di marcatori di superficie CD31 e l'assenza di CD14, CD45. Altri test che possono essere eseguite comprendono morfologia cellulare e l'attività dell'ossido nitrico III dopo l'esposizione al flusso 4.
2. Gruppo del tubo di titanio
- Sezione di un tubo Ti longitudinalmente in 3 pari 120 gradi unità (4,5 cm di lunghezza) con un 72 denti di taglio HHS visto tenuti in posizione da un pergolato visto in una fresatrice verticale. Eseguirlo a 300 RPM e mantenere l'area di taglio saturato con fluido di taglio Tap magia in qualsiasi momento durante il taglio (Figura 3).
- Lucidare la superficie interna con una smerigliatrice e una panchina Scotch-Brite ruota lavorazione dei metalli. Poi manualmente lucidare con un panno 3M smeriglio a superficie liscia e ulteriormente anche di togliere qualunque fosse visibile.
- Pulire i pezzi Ti con soluzione Alconox sapone, seguito da 5 minuti immersione in acqua regia (1:3 acido nitrico concentrato di acido cloridrico concentrato), seguita da risciacquo con diversi litri di acqua 10. Fare attenzione estrema come acqua regia è altamente corrosivo e potenzialmente esplosive!
- Sonicare sezioni Ti x 16 min in soluzione Alconox sapone, aumento x 30 in acqua deionizzata e sonicare ancora x 16 min in acqua deionizzata. Lasciare asciugare in cappa a flusso laminare.
- Taglio PVC guaina termoretraibile a 4,5 cm di lunghezza e ben puliti per 2.4.
- Utilizzare una pinzetta per posizionare il 3 sezioni pulita Ti su un mandrino di supporto (lavorati in alluminio, 8,5 mm di diametro) e il manicotto posto del PVC guaina termoretraibile intorno sezioni Ti (Figura 4). Termorestringente con una pistola di calore durante l'accensione mandrino per avvolgere in modo uniforme sezioni Ti strettamente insieme.
3. Semina dispositivo e l'assemblaggio dei componenti
- Tagliare tubi in silicone per una lunghezza di 2,5 cm e 3,5 cm.
- Sezione siringa da 5 cc di plastica a marchio 0,8 ml e mantenere 'pezzo testa' con estremità luer.
- Pulire accuratamente 2 sezioni di silicone x, 'pezzo testa' siringa e un tappo luer mediante ultrasuoni indicate al punto 2.4.
- Aggiungi tubo in silicone a ogni estremità del tubo assemblato Ti da 2,5, estensioneding di 5 mm su tubi in PVC.
- Inserire tagliato fine del 'pezzo testa' siringa nel tubo di silicone brevi, in modo che confina Ti tubo (Figura 5).
- Terminato il montaggio guarnizione del tubo Ti con un tappo luer nella busta Tyvek e gas sterilizzare con ossido di etilene (18 ore a 55 ° C).
- Montare un motore sincrono tempi (10 RPH) su una piattaforma di plexiglas e collegare il suo asse al titolare della siringa (lavorati in alluminio, adatta siringa da 5 cc) (Figura 6).
4. EPC-semina di superficie Ti camera d'aria
- Espandere EPC come isolati sotto 1. Confluenti a 3 T-75 palloni (o almeno 9 x 10 6 cellule).
- Il giorno della chirurgia, le cellule fluorescenti etichetta a lungo termine colorante (PKH26) 11. Cominciate con il risciacquo EPC colto due volte nel siero di media liberi. Attenzione per limitare l'esposizione alla luce per proteggere le cellule durante e dopo l'etichettatura.
- Coprire le celle con 4 mM PKH26 in Diluente C (soluzione colorante) a temperatura ambiente per 4 minuti.
- Smettere di etichettatura reazione aggiungendo siero suina in volume pari a tingere soluzione. Un minuti dopo, diluire 1:1 con soluzione combinata di media piena crescita.
- Aspirare il liquido e lavare le cellule x 3 con medie piena crescita.
- Lavare due volte in DPBS EPC (senza CaCl 2, MgCl 2).
- Coprire le cellule in tripsina e incubare a 37 ° C per 3 minuti e confermare il distacco sotto un microscopio ottico. Aggiungi soluzione Neutralizzazione tripsina a raddoppiare il volume di tripsina utilizzati.
- Combina le soluzioni cella in un unico tubo e mescolare pipettaggio. Aggiungere 10 ml di soluzione di cella in ogni lato di una emocitometro per il conteggio.
- Centrifuga soluzione cellula (1500 RPH, 5 min.). Contare le celle e risospendere pellet a 2 - 2,5 x 10 6 EPC / ml nel siero di media liberi. Si noti il volume minimo per riempire il gruppo del tubo è di 4,5 ml.
- Stendere telo sterile in cappa biologica per il campo sterile. Aperto a gas sterilizzato assemblaggio tubo Ti ed extra siringa da 5 cc sul campo sterile.
- Con i guanti sterili, rimuovere lo stantuffo della siringa da 5 cc e mantenere sul campo per un uso successivo. Apporre luer tappo a questo siringa.
- Pipetta da 4,5 - 5 ml sospensione EPC sotto 4,9 nel cilindro della siringa aperto. Inserire stantuffo saldamente indietro nel lato aperto del siringa.
- Impugni la siringa con tappo verso l'alto e rimuovere il tappo. Inserire la siringa con estremità luer prima in tubi in silicone aperta del gruppo del tubo Ti fino a fissarla, non avanzare all'interno del tubo Ti.
- Anticipo stantuffo della siringa lentamente fino a quando la soluzione di cellule raggiunge cima siringa taglio 'la testa pezzo,' eliminando le bolle dal sistema. Chiudere con tappo luer e inserire intera assemblea in guaina sterile, di tenuta lato aperto con nastro.
- Inserire in questa assemblea l'intero titolare siringa lavorati del 3,7. Posto in incubatore a 37 ° C e regolare piattaforma in modo che parte Ti tubo della camera di semina è di livello, con indicatore di livello dell'acqua (Figura 6).
- Ti permettono gruppo del tubo di ruotare 30 minuti prima dell'impianto.
5. Impianto di Ti tubo nel suina vena cava inferiore
- Ventiquattro ore prima dell'intervento, Premedicare il maiale (da cui sono stati isolati EPC) con una patch fentanyl (100 mcg / transdermico h; tenere cerotto al posto x 72 ore).
- Tenere maiale NPO durante la notte e amministrare Baytril (Enrofloxacin) prima dell'intervento al giorno dell'intervento (5 mg / kg, IM) e per 7 giorni successivi, ogni 24 ore come profilassi antibiotica.
- Sedare, intubare e anestetizzare il maiale come descritto al punto 1.3 (volume corrente di 10 -15 ml / kg) e fissare il maiale in posizione supina sul tavolo della sala operativa. Monitorare il maiale durante la procedura attraverso la misurazione della saturazione di ossigeno, frequenza cardiaca e temperatura. Mantenere la termoregolazione mediante una tabella di funzionamento automatico riscaldata e coperta di riscaldamento e riscaldando i liquidi infuso.
- Inserire un G 18 catetere nella vena IV orecchio del maiale e proteggere maiale occhi con un collirio Vetropolycin.
- Pulito, preparazione e drappo addome del maiale come in 1.6. Incise la linea mediana con una lama da bisturi n. 15 del 2 ° set di ghiandole mammarie cranialmente al 2 per ultimo set caudalmente.
- Portare la dissezione verso il basso per la fascia addominale con elettrocauterizzazione.
- Sollevare il peritoneo con una pinza Mosquito, e con attenzione vi entrano con le forbici Metzenbaum.
- Esternare la vescica urinaria e mettere un 3-O Vicryl borsa di tabacco nella parete della vescica. Inserire una incisione nel mezzo, e inserire un catetere di Foley F 16. Somministrare liquidi per via endovenosa (Ringer lattato) di titolare la produzione di urina di> / = 1 ml / kg / ora durante l'intervento.
- In seguito, esternare il piccolo intestino e di grandi dimensioni e posto due divaricatori Balfour chirurgico per esporre la parte posteriore della cavità peritoneale e identificare la vena cava inferiore (IVC).
- Utilizzando dissezione tagliente e smussato, con attenzione liberare la IVC dal tessuto circostante e skeletonize la nave dalla arteria renale destra in prossimità della biforcazione della porzione distale IVC. Esercitare la massima cura durante la dissezione IVC come anche un difetto molto piccolo nella IVC può portare a una rapida emorragia e dissanguamento dell'animale.
- Legare tutti i rami laterali del segmento IVC per garantire che non ci sarà alcun sanguinamento attorno al tubo Ti da impiantare. Si noti il solito due grandi vene posteriori lombari che richiedono una dissezione molto attenti e legatura. Inoltre, si noti che immediatamente prossimale alla biforcazione della IVC, una grossa vena lombare è comunemente riscontrati sul versante postero-e deve essere sezionato libero e controllato con i loop nave in preparazione per il posizionamento morsetto.
- Procedere con la semina del tubo Ti simultaneamente come indicato al 4.
- Amministrare 100 USP / kg di eparina immediatamente prima del bloccaggio IVC. Posto 45 pinze chirurgiche angolo gradi distalmente sulla IVC e la vena lombare, e poi prossimalmente.
- Creare un veinotomy longitudinale (4 cm) tra i morsetti prossimale e distale con una lama di bisturi # 11 seguita dalla estensione con le forbici Potts.
- Evacuare il sangue dal IVC e svuotamento del lume interno con DPBS sterile.
- Ora inserire la testa di serie EPC-Ti tubo (o un controllo di metallo nudo) nella IVC e riempirlo con DPBS (con CaCl 2, MgCl 2) per evitare che le cellule si secchi e per evacuare l'aria.
- Chiudere il veinotomy con una sutura Prolene 4-0 in esecuzione e rimuovere un morsetto prossimale al de-air la IVC attraverso una piccola quantità di back-sanguinamento. Mettere un 'soggiorno-sutura' attraverso la parete venosa nel tubo in PVC per prevenire la migrazione dell'impianto nel tempo.
- Chiudere la fascia con O-Pds su un ago CT e lo spazio sottocutaneo con 2-O Vicryl (in esecuzione sutura). Chiudere la pelle con punti metallici.
- Gestire fino a 20 ml di 0,25% Marcaine (bupivacaina) per via sottocutanea lungo il sito di incisione e coprire la ferita con garza e Tegaderm. Anche dare Flunixin (2,2 mg / kg Q 24 ore) e Ossimorfone (0,15 mg / kg Q 3-4 ore) per via sottocutanea come necessario per il dolore.
- Interrompere l'anestesia, monitorare il maiale fino sveglio e tornare alla gabbia. Monitor maiale due volte al giorno per i segni di sofferenza / dolore, in piedi e la deambulazione, feci e urina, e il colore della pelle indicando perfusione normale.
6. Espianto di Ti tubo
- Dopo 3 settimane, sedare, intubare e anestetizzare il maiale, come descritto in 1.3 - 1.4.
- Procedere ad una laparotomia, come descritto nella 5,5-5,8.
- Si noti che si nascondono cicatrici del sito implantare, ma si può palpare il tubo rigido Ti in situ.
- Sezionare la IVC, come descritto nella 5,9-5,11 espianto e il tubo Ti en-blocco con l'ambiente circostante IVC con le forbici pesanti.
- Euthanize l'animale con la soluzione eutanasia Euthasol (390 mg / ml di sodio pentobarbital e di 50 mg / ml di sodio Fenitoina a 1 ml / 10 lbs).
7. Fissazione e di immagini di superficie Ti interna
- Sciacquare il segmento di vena asportata con tubo titanio in soluzione DPBS e fotografare il suo lume (brevetto o occluso) con una fotocamera digitale ad alta risoluzione (Figura 7).
- In seguito, fissare il campione di immersione in paraformaldeide 3,7% per un minimo di 15 minuti. Sciacquare campione in soluzione DPBS.
- Molto attentamente incidere la vena circostante e tubi in PVC per aprire il tubo di Ti. Posizionare il 3 sezioni al microscopio a fluorescenza con le superfici interne di fronte l'obiettivo / sorgente di luce e l'immagine sotto lunghezza d'onda di 550 nm di eccitazione per visualizzare PKH26 marcato EPC in rosso / arancione (Figura 8A). Se lo si desidera, le cellule possono essere ulteriormente colorato (ad esempio piastrinica endoteliale Marker Adesione cellulare (PECAM)-macchia di visualizzare i bordi delle celle (Figura 8B), DAPI-macchia di visualizzare nuclei, ecc.)
8. Rappresentante dei risultati:
A seguito di esecuzione di questo protocollo, i medici e gli scienziati sono in grado di endothelialize strutture tubo solido con autologo derivati dal sangue umano le cellule progenitrici endoteliali in un modello animale di grandi dimensioni. La figura 2 mostra che EPC isolate con il nostro metodo appaiono come colonie con morfologia ciottoli dopo circa 7 giorni in cultura. Il nostro dispositivo semina illustrato nelle figure 5 e 6 consente la rotazione lenta dei tubi Ti riempiti con la sospensione EPC e si traduce in una copertura uniforme della superficie interna del tubo in condizioni sterili 9.
Il nostro intervento chirurgico di impianto permette di testare la propensione dei biomateriali, quali Ti, per la trombosi in un modello animale di grandi dimensioni. Abbiamo trovato che i maiali tollerare questa procedura bene e che questo impianto può essere raggiunto solo con minima perdita di sangue e senza interruzioni strato EPC.
t "> Figura 7 mostra che un tubo nudo Ti occlude completamente, mentre il nostro EPC alberato tubo rimane brevetto anche in ambiente protrombotico taglio basso della vena cava inferiore. Inoltre, la presenza di uno strato di cellule confluenti fluorescenza marcato conferma la successo di questo metodo, come mostrato nella Figura 8.
Figura 1. Schema del trapianto autologo di cellule endoteliali esperimento semina progenitrici (EPC). In primo luogo, sangue periferico è prelevato da un maiale. Successivamente, EPC sono isolate dal sangue ed espanse in coltura. EPC sono poi utilizzati per la linea A (Ti) dispositivo tubo di titanio, che viene poi impiantato chirurgicamente nella vena cava inferiore dello stesso maiale da cui sono state isolate cellule.

Figura 2. Colonia rappresentante di EPC nella cultura, circa 7 giorni successivi alla procedura di isolamento (ripreso con un microscopio invertito Leica DMIL con immagini della fotocamera e il software QCapture).

Figura 3. Ti sezioni del tubo prima del montaggio. Tubi ti viene tagliato in 3 sezioni uguali longitudinalmente, e poi tagliati a 4,5 cm di lunghezza. Superfici interne delle sezioni Ti sono lucidati utilizzando una smerigliatrice da banco e tela smeriglio per rimuovere fosse visibile.

Figura 4. Assemblea di spezzoni di tubo in PVC Ti con una guaina termoretraibile (blu) e pistola ad aria calda. Sezioni ti sono supportati su un mandrino in alluminio lavorato che si estende attraverso le sezioni Ti e corrisponde alle dimensioni del diametro del tubo Ti interno.

Figura 5 gruppo del tubo di titanio, che mostra tutti i componenti:. Luer cap, 'pezzo testa,' siringa tubi di silicone, e Ti con tubo in PVC avvolgere (blu). Il montaggio è mettere insieme prima della sterilizzazione per uso chirurgico.

Figura 6. Configurazione tubo Ti semina all'interno dell'incubatore, mostrando motore, piattaforma, lavorati siringa supporto in alluminio, gruppo del tubo Ti, e siringa da 5 cc. Nota: Il montaggio è mostrata senza guaina protettiva sterile ai fini di visualizzazione.
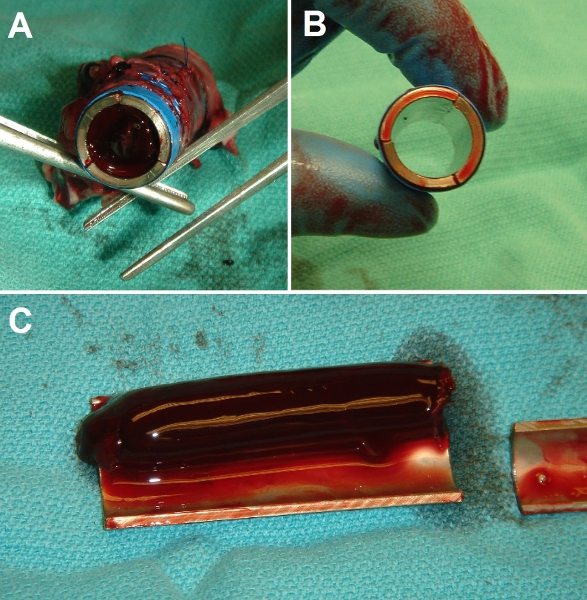
Figura 7. Rappresentante risultati lordi di un intervento chirurgico di impianto. (A) Fine-vista del tubo di metallo nudo Ti controllo dopo l'impianto in vena cava suina (IVC). Tubo lume è completamente occluso con un grumo solido. (B) Fine-vista della testa di serie EPC-Ti tubo dopo l'impianto. Tubo lume è completamente brevetto e chiaro. (C) vista Dissected di controllo (nudo) Ti tubo dopo tre giorni l'impianto, mostrando estensione della trombosi (esperimenti sono stati condotti durati fino a 3 settimane con risultati identici).

EPC Figura 8. Sulla superficie del tubo Ti seguenti tre giorni l'impianto (ripreso con un montante microscopio Leica DMRB con un QICAM QImaging monocromatica fotocamera digitale e Image Pro Plus software). (A), le cellule confluenti sulla superficie mostrando PKH26 pre-intervento etichettatura. (B) strato confluenti di EPC. Rosso: PKH26 pre-intervento etichettatura. Verde: EPC PECAM-macchia.
Discussione
Il metodo di cellule semina tubi Ti presentato qui permette ai medici e agli scienziati di endothelialize rapidamente e in modo uniforme il sangue a contatto superfici di dispositivi impiantabili. Dal momento che abbiamo isolare ed espandere EPC da campioni di sangue periferico, nessuna procedura di grandi invasiva è necessaria per sfruttare queste cellule. Inoltre, l'EPC sono autologhe, quindi, il rischio di reazione immunitaria alla cella testa di serie impianto viene eliminato. I principi dimostrato nel suo protocollo può essere utilizzato non solo per i tubi di titanio, ma per molti altri biomateriali, che vengono utilizzate nella medicina cardiovascolare.
Passaggi critici in questo protocollo sono la pulizia meticolosa dei tubi Ti, come abbiamo scoperto che ogni pellicola aderente di contaminante cellule aderenza compromessi. Inoltre, una velocità di rotazione lenta (inversamente proporzionale al diametro del tubo) è essenziale durante il processo di semina, in modo che lentamente EPC possono stabilirsi e aderire alla superficie del tubo Ti è in movimento.
Il nostro metodo di semina immediatamente prima dell'impianto evitando impraticabile ex tempi cultura vivo; cellule aderire individualmente e in seguito forma un foglio confluenti in vivo, evitando la possibilità di embolizzazione come un foglio subito dopo il ristabilimento del flusso. I nostri studi precedenti mostrano che una volta che l'EPC sono cresciuti a un livello confluenti, fanno un matrice extracellulare a cui aderire, in aggiunta al minimo ogni possibile mutare di un foglio endoteliale. Anche se la possibilità di distacco embolico non può essere completamente escluso, sembra essere molteplici rischio inferiore trombosi della superficie intero dispositivo, il problema che questa terapia è stato progettato per prevenire.
Il nostro approccio di impianto nel taglio basso, l'ambiente protrombotici della vena cava inferiore utilizza uno dei modelli più affidabili grande animale per la ricerca di compatibilità del sangue e trombosi dei dispositivi di 5,6. Si noti che tutti la cura degli animali e la sperimentazione è stata condotta in conformità con l'Istituto Nazionale della Salute Linee guida per la cura e l'uso di animali da laboratorio e solo dopo l'approvazione dei prodotti per animali Duke University e del Comitato Istituzionale Usa.
Al fine di utilizzare con successo questo metodo per testare l'impianto biomateriali e dispositivi, è importante skeletonize pazientemente il segmento IVC e legare tutte le navi ramo venoso in preparazione per l'inserimento dispositivo, tale che nessun sanguinamento intorno al dispositivo originario di un 'falso lume'. Un altro passo fondamentale è l'aggiunta di DPBS nel lume dispositivo in modo che le cellule sulla superficie interna del tubo rimanere umido durante la chiusura del veinotomy e prima di riperfusione è iniziata. Se il dispositivo non può essere trovato nella posizione in cui è stato impiantato, può avere migrato 'a monte' nella IVC. Questo può essere evitato mettendo una sutura (4-O Prolene) attraverso la parete venosa e attraverso un 2-3 mm di sezione del tubo in PVC in modo che il tubo sia saldamente ancorata nella sua posizione attuale. Qualora il ricercatore hanno difficoltà a trovare le cellule fluorescenza pre-etichettati mostrato nella Figura 8, dopo espianto in un tubo di brevetto in caso contrario, è probabile che le cellule hanno staccata come un foglio coerente. Questo può essere impedito da dissezione molto delicato della vena circostante e smontaggio delle 3 sezioni del tubo Ti, dopo aver fissato la vena insieme con il tubo.
La nostra tecnologia fornisce proof-of-concept per prevenire la trombosi cardiovascolare dispositivo attraverso EPC-semina. Questa tecnologia può essere utilizzata per lo sviluppo di 'biogene' impianti fiancheggiata da cellule dei pazienti 'progenitrici endoteliali. Lo studio di fattibilità nel nostro modello animale della specie suina prevede i primi passi verso la traduzione di questa 'medicina personalizzata' nella pratica clinica.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Leica Microsystems per i loro preziosi consigli su immagini sezioni titanio e Gemini Bio-Prodotti per la fornitura del siero suina utilizzati in questo studio. Ci piace anche ringraziare i NIH per il loro sostegno attraverso Grant "rivestimento autologo EPC per migliorare la biocompatibilità dei dispositivi di assistenza circolatoria", RC1HL099863-01. Inoltre, siamo grati per il supporto della National Science Foundation Graduate Research Fellowship di Alexandra Jantzen. Ci piace anche ringraziare George rapida, Mike Lowe e Ianthia Parker per assistere con molti aspetti della procedura chirurgica e la gestione dei nostri animali di ricerca. Steven Owen è stato prezioso per la lavorazione di pezzi molti dei nostri dispositivi semina e taglio di tubi in titanio.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Nome Azienda | Numero di catalogo | Commenti |
| Acepromazina | Boehringer-Ingelheim | BIC670025 | NAC # 10280002 |
| Alconox Pulitore di precisione Powered | Alconox | 1104 | |
| Balfour Retrattore chirurgica | Adler | N / A | |
| Baytril | Bayer | APVMA 46028/0705 | |
| Farfalla ago (19G) | Terumo | SV19CLK | |
| Clorexidina | 3M | 9200 | |
| Morsetti (45 gradi) | Aesculap | FC339T | |
| DPBS (-/-) | Gibco | 14190-144 | |
| DPBS (+/+) | Gibco | 14040-133 | |
| DuraPrep | 3M | 8635 | |
| EBM-2 Media | Lonza | CC-3156 | Base per la crescita di medio siero libero e pieno |
| EGM-2 SingleQuots | Lonza | CC-3162 | Utilizzato con EBM-2 sia per la crescita media del siero libero e pieno |
| Strumento elettrocauterizzazione | Valleylab | SurgII-20 | |
| Panno smeriglio | 3M | 60-0700-0425-8 | Grana 240 |
| Euthasol Eutanasia Soluzione | Virback Animal Health | ANADA #: 200-071 | |
| Fentanil Patch | Actavis | NDC # 67767-120-18 | |
| Flunixin | Schering-Plough | NAC #: 10470183 | |
| Foley Catheter (16F) | Vate | 730116 | |
| HBSS | Sigma | H8264-500ML | |
| Pistola di calore | Milwaukee | 8988-20 | |
| Eparina | NDC #: 25021 | ||
| HISTOPAQUE-1077 | Sigma | H8889-500ML | |
| Intubazione del tubo | Mallinckrodt | 86113 | |
| Isoflurano | MWI, Meridian | NDC # 13985-030 | |
| IV catetere (18G) | Becton Dickinson- | 381547 | |
| Ketamina | Fort Dodge | NDC # 0856-2013 | |
| Livello | Swanson | LLA001 | |
| Luer-Lock cappuccio | CML di alimentazione | 909-001 | |
| Marcaine | Hospira | NDC #: 0409-1560-10 | |
| Metzenbaum Forbici | Adler | N / A | |
| Micro-introduttore (5F) | Galt | KIT 002-01 | |
| Pinza Mosquito | Adler | N / A | |
| Motore | Herbach e Rademan | H1-08 | |
| Ossimorfone | Endo Labs | NDC: 63481-624-10 | |
| PKH26 Dye Kit | Sigma | PKH26GL-1KT | |
| Suini Siero | Gemini Bio-Prodotti | 100-115 | Concentrazione del 2% nel medio piena crescita |
| Potts Forbici | Adler | N / A | |
| Preciso Vista pelle pinzatrice | 3M | 3998 | |
| Tubi in PVC | McMaster-Carr/Insultab | 7132K117 | ampliato ID 15,88 millimetri, recuperato ID 7,95 millimetri |
| Diritto grandezza media in angolo | Adler | N / A | |
| Scalpel Blade (# 10-15) | Vate | 373910 | |
| Tubi in silicone | McMaster-Carr | 51735K26 | 16,64 millimetri OD, 9.52 mm ID |
| Siringa (5 cc) | Becton-Dickinson (BD) | 309603 | |
| Tegaderm | 3M | 90001 | |
| Rubinetto a tre vie | Kendall | 170060 | |
| Ti tubo | Tico titanio | N / A | Specificato come ½ "OD, 0,065" muro, 0,370 "ID, 0,1737 £ / ft |
| Tripsina | Lonza | CC-5012 | |
| Tripsina soluzione neutralizzante (TNS) | Lonza | CC-5002 | 0,03% |
| Vetropolycin | Pharmaderm Animal Health | NAC #: 12920110 | |
| Suture Vicryl (3-0) | Ethicon | J808T | |
| Acqua bagno Sonicator | Branson | B200 |
Riferimenti
- Achneck, H. E. Pathophysiology of bleeding and clotting in the cardiac surgery patient: from vascular endothelium to circulatory assist device surface. Circulation. 122, 2068-2077 (2010).
- Achneck, H. E., Sileshi, B., Lawson, J. H. Review of the biology of bleeding and clotting in the surgical patient. Vascular. 16, 6-13 (2008).
- Arvidsson, S., Askendal, A., Tengvall, P. Blood plasma contact activation on silicon, titanium and aluminium. Biomaterials. 28, 1346-1354 (2007).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Kang, C., Bonneau, M., Brouland, J. P., Bal dit Sollier, C., Drouet, L. In vivo pig models of venous thrombosis mimicking human disease. Thromb Haemost. 89, 256-263 (2003).
- Ueberrueck, T. Comparison of the ovine and porcine animal models for biocompatibility testing of vascular prostheses. J Surg Res. 124, 305-311 (2005).
- Velik-Salchner, C. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thromb Res. 117, 597-602 (2006).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc Res Tech. 73, 71-76 (2010).
- Ford, J. W., Welling, T. H., Stanley, J. C., Messina, L. M. PKH26 and 125I-PKH95: characterization and efficacy as labels for in vitro and in vivo endothelial cell localization and tracking. J Surg Res. 62, 23-28 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon