Method Article
Autólogo de células progenitoras endoteliales-Siembra Tecnología y las pruebas de biocompatibilidad para dispositivos cardiovasculares en el modelo animal de gran
En este artículo
Resumen
Un método para la siembra de titanio contacto con la sangre de biomateriales con células autólogas y las pruebas de biocompatibilidad se describe. Este método utiliza células progenitoras endoteliales y los tubos de titanio, cabeza de serie en cuestión de minutos de implantación quirúrgica en porcino venas cavas. Esta técnica se puede adaptar a muchos otros dispositivos biomédicos implantables.
Resumen
Dispositivos implantables cardiovasculares son fabricadas con materiales artificiales (por ejemplo, el titanio (Ti), politetrafluoroetileno expandido), que plantean el riesgo de formación de tromboembolias 1,2,3. Hemos desarrollado un método para la línea de la superficie interior de los tubos de Ti con autólogos derivados de la sangre las células progenitoras humanas o porcinas endoteliales (CPE) 4. Mediante la implantación de tubos de Ti contiene una capa confluente de EPCs porcina en la vena cava inferior (VCI) de los cerdos, hemos probado la biocompatibilidad mejorada de la superficie de las células sembradas en el medio ambiente protrombótico de un modelo animal de gran tamaño y lo comparó con modificar las superficies de metal desnudo 5,6,7 (Figura 1). Este método puede ser usado para endothelialize dispositivos en cuestión de minutos de la implantación y prueba de su función antitrombótica in vivo.
Sangre periférica se obtuvo a partir de 50 kg Yorkshire porcina y su fracción de células mononucleares de cultivo para aislar CPE 4,8. Ti tubos (9,4 mm de diámetro) se pre-cortado en tres secciones 4,5 cm longitudinal y vuelto a montar con bomba de calor tubo retráctil. Un dispositivo de siembra fue construido, que permite la rotación lenta de las trompas de Ti.
Se realizó una laparotomía en los cerdos y exterioriza el intestino y la vejiga urinaria. Disección cortante y contundente fue utilizado para esqueletizar el IVC desde su bifurcación distal de la arteria renal derecha proximal. Los tubos de Ti se rellenaron con fluorescencia marcado autólogo suspensión del CPE y gira a 10 RPH x 30 min para conseguir células de revestimiento uniforme 9. Después de la administración de 100 USP / kg de heparina, ambos extremos de la vena cava inferior y la vena lumbar se sujetaron. A veinotomy de 4 cm se realizó y se inserta el dispositivo y lleno de tampón fosfato salino. A medida que el veinotomy se cerró con una sutura de Prolene 4-0 en funcionamiento, una pinza fue trasladado a al aire de la VCI. Al final del procedimiento, la fascia se aproximó con 0-PDS (sutura de polidioxanona), el espacio subcutáneo cierra con Vicryl 2-0 y la piel con grapas cerrado.
Después de 3 a 21 días, los cerdos fueron sacrificados, el dispositivo explantado en bloque y fija. Los tubos de Ti fueron desmontados y las superficies internas de imágenes con un microscopio de fluorescencia.
Hemos encontrado que el metal desnudo tubos Ti completamente oculto, mientras que los tubos de EPC cabeza de serie, quedó patente. Además, hemos sido capaces de demostrar una capa confluente de EPC en el interior de la superficie de contacto con la sangre.
En conclusión, nuestra tecnología se puede utilizar para endothelialize tubos Ti minutos después de la implantación de EPC autólogos para prevenir la trombosis del dispositivo. Nuestro método quirúrgico permite probar la biocompatibilidad mejorada de estos dispositivos modificados con mínima pérdida de sangre y EPC cabeza de serie, la interrupción de la superficie.
Protocolo
1. Progenitoras endoteliales aislamiento de células
- Treinta días antes de la implantación del tubo EPC cabeza de serie, preparar una jeringa de 60 ml con 15 ml de la solución anticoagulante citrato dextrosa y seguro con una llave de paso de 3 vías para el aislamiento de EPC de la sangre periférica de cerdos. 24 horas antes de la extracción de sangre, precapa dos placas de 12 pocillos con colágeno tipo 1 ratas (50 mg / ml, se disolvieron en 0,02 N solución de ácido acético) 4.
- Llevar a cabo todos los cuidados de los animales y la experimentación de acuerdo con el Instituto Nacional de Pautas de Salud para el Cuidado y Uso de Animales de Laboratorio y sólo después de la aprobación de la supervisión de Cuidado de Animales institucional y el empleo.
- Sedar a una hembra de cerdo Yorkshire (45 kg) con acepromazina (1,1 mg / kg) y ketamina (22 mg / kg) por vía intramuscular a través de una aguja de 19 G de la mariposa.
- Intubar al cerdo con un tubo endotraqueal (30 cm de largo, 8 mm de diámetro) y anestesia de cerdos con isoflurano (4,5% del volumen corriente por la máscara).
- Monitorear el cerdo durante el procedimiento mediante la medición de la saturación de oxígeno, frecuencia cardíaca y la temperatura. Mantener la termorregulación mediante el uso de una tabla de funcionamiento automático con calefacción y una manta de calefacción y el calentamiento del líquido infundido.
- Colocar el cerdo en la posición en decúbito supino sobre la mesa de operaciones, asegurar sus extremidades traseras caudolaterally, y limpiar con clorhexidina seguido por DuraPrep esterilización. A continuación, proceder con drapeado en el área pélvica.
- Insertar un G 21 x 7 cm a partir de una aguja de 5 F micro-introductor kit medial a un pulso palpable femoral (medial al vasto medial y lateral al músculo recto interno) en la vena femoral y canular la vena utilizando la técnica de Seldinger. Conecte la jeringa de 60 ml preparada para el catéter intravascular y extraer 45 ml de sangre.
- Mantenga la presión en el sitio de punción buque para lograr la hemostasia (5 min), suspender la anestesia y la recuperación del cerdo. El animal se controla hasta la recuperación completa y devuelto a su jaula.
- Diluir la solución de la sangre 1:1 con solución salina tamponada de Hank (sin CaCl 2, MgCl 2, MgSO4) y la capa de volúmenes iguales de Histopaque para crear capas bien definidas. Centrífuga (30 min, 740 g, el establecimiento de ruptura bajo) y recolectar células mononucleares (MNC) de la capa. Resuspender y lavar las multinacionales x 3 con fosfato de Dulbecco solución salina tamponada (DPBS) (10 min, 515 g) de las placas, en dos placas de 12 pocillos en medio de cultivo completo (EBM-2 medianas con porcino 2% de suero (PS) y el EGM-2 SingleQuots) a 37 ° C, 5% de CO 2.
- Poco a poco cambio de medio cada 24 horas durante los primeros 7 días, y luego cada dos días. Identificar las colonias de EPC después de un tiempo medio
de 7 días (Figura 2). - Ampliar EPC en la cultura una vez que cubren una cuarta parte de la superficie de 12 pocillos. Confirmar la identidad de EPC con la citometría de flujo mediante el análisis de la presencia de marcadores de superficie CD31 y la ausencia de CD14, CD45. Otros ensayos que pueden realizarse son la morfología celular y la actividad del óxido nítrico III después de la exposición al flujo 4.
2. Conjunto de tubo de titanio
- Sección de un tubo de Ti longitudinalmente en tres iguales de 120 grados unidades (4,5 cm de largo) con 72 dientes HHS corte vio en su lugar por una glorieta vio en una fresadora vertical. Dejar que funcione a 300 RPM y mantener la zona de corte saturado de fluido de corte Toque Mágico en todo momento durante el corte (Figura 3).
- Pulir la superficie interior con una amoladora de banco y una rueda de metales Scotch-Brite. A continuación, pulir manualmente con lija 3M a la superficie más suave y uniforme para eliminar los hoyos visible.
- Limpiar las piezas Ti con Alconox solución de jabón, seguido de 5 min de inmersión en agua regia (1:3 ácido nítrico concentrado al ácido clorhídrico concentrado), seguido de un enjuague con varios litros de agua 10. Tenga precaución extrema como el agua regia es altamente corrosivo y con riesgo de explosión!
- Sonicar secciones Ti x 16 min en una solución de jabón Alconox, aumento x 30 en agua destilada y sonicar nuevo x 16 min en agua desionizada. Deje que se seque en la campana de flujo laminar.
- Corte de PVC al calor tubo retráctil de 4,5 cm de longitud y limpiar a fondo por 2,4.
- Use pinzas para colocar el 3 limpiar secciones Ti sobre un mandril de soporte (mecanizado de aluminio, 8,5 mm de diámetro exterior) y el manguito de PVC lugar de calor tubo retráctil alrededor de las secciones Ti (Figura 4). Tubo retráctil con una pistola de calor mientras se gira el mandril para envolver uniformemente secciones Ti estrechamente.
3. La siembra de dispositivos y montaje de componentes
- Corte el tubo de silicona con una longitud de 2,5 cm y 3,5 cm.
- Sección 5 cc jeringa de plástico en la marca de 0,8 ml y mantener 'pieza de la cabeza "con el extremo luer.
- Limpiar a fondo dos secciones de silicona x ', pieza de la cabeza "jeringa y un tapón luer por ultrasonidos como se describe en el apartado 2.4.
- Añadir un tubo de silicona en cada extremo del tubo montado Ti de 2,5, extensiónding de 5 mm sobre la tubería de PVC.
- Inserte corte final de 'pieza de la cabeza "de la jeringa en el tubo de silicona corta, por lo que colinda con Ti tubo (Figura 5).
- Sello de la Asamblea terminó Ti tubo con un tapón luer en la bolsa de Tyvek y gas a esterilizar con óxido de etileno (18 horas a 55 ° C).
- Montar un motor síncrono de tiempo (10 RPH) a una plataforma de plexiglás y conectar su eje a un soporte de jeringa (mecanizado de aluminio, se adapta una jeringa de 5 cc) (Figura 6).
4. EPC-siembra de Ti superficie interna del tubo
- Ampliar EPC como aislados, en 1. A 3 confluentes T-75 frascos (o por lo menos 9 x 10 células de 6).
- En el día de la cirugía, con fluorescencia células etiqueta a largo plazo medio de contraste (PKH26) 11. Empezar por aclarar EPCs cultivadas en dos ocasiones en medio libre de suero. Precaución para limitar la exposición a la luz para proteger las células durante y después del marcaje.
- Cubrir las celdas con 4 M PKH26 en diluyente C (solución de colorante) a temperatura ambiente durante 4 minutos.
- Dejar de etiquetado reacción mediante la adición de suero porcino en un volumen igual al medio de solución. Un minuto más tarde, diluir solución combinada 1:1 con medio de cultivo completo.
- Aspirar el contenido y aclarar las células x 3 con medio de cultivo completo.
- Lavar dos veces en DPBS EPC (sin CaCl 2, MgCl 2).
- Cubrir las células de la tripsina y se incuba a 37 ° C durante 3 minutos y confirmar destacamento bajo un microscopio de luz. Añadir solución de tripsina neutralización en el doble del volumen de la tripsina utilizada.
- Combinar las soluciones de células en un solo tubo y se mezcla con la pipeta. Añadir 10 l de solución de células en cada lado de un hemocitómetro para contar.
- Centrífuga solución de células (1500 RPH, 5 min.). Recuento de células y el precipitado se resuspende en 2 a 2,5 x 10 6 EPC / ml en medio libre de suero. Tenga en cuenta el volumen mínimo para cubrir el conjunto del tubo es de 4,5 ml.
- Coloque una toalla estéril en la campana biológica de campo estéril. Abrir gas-esterilizados montaje Ti tubo y una jeringa de 5 cc adicionales en campo estéril.
- Con guantes estériles, retire el émbolo de la jeringa de 5 cc y mantener en el campo para su uso posterior. Ponga tapa luer a la jeringa.
- Pipeta de 4,5 - 5 ml de suspensión EPC en 4,9 en la jeringa abierta. Inserte el émbolo un respaldo seguro en el extremo abierto de la jeringa.
- Sujete la jeringa con la tapa hacia arriba y quite la tapa. Inserte la jeringa con punta luer por primera vez en un tubo de silicona del conjunto del tubo abierto Ti hasta que quede apretado, no avanzan dentro del tubo Ti.
- Avance émbolo de la jeringa lentamente hasta que la solución de células llega a la parte superior de la jeringa corte "pieza de la cabeza," la eliminación de las burbujas del sistema. Cerrar con la tapa luer e insertar todo el conjunto en la funda estéril, sellando el extremo abierto con cinta adhesiva.
- Inserte este conjunto completo en soporte de jeringa de 3,7 a máquina. Lugar en la incubadora a 37 ° C y ajustar la plataforma de manera que parte del tubo de la cámara de Ti es el nivel de la siembra, con indicador de nivel de agua (Figura 6).
- Permitir el montaje Ti tubo para girar 30 minutos antes de la implantación.
5. Implantación de Ti tubo en la vena cava inferior porcina
- Veinticuatro horas antes de la cirugía, premedicación del cerdo (de los cuales fueron aislados EPC) con un parche de fentanilo (100 mg / hr transdérmica, mantener el parche en su lugar x 72 horas).
- Mantenga cerdo NPO durante la noche y administrar Baytril (enrofloxacina) antes de la operación en el día de la cirugía (5 mg / kg, IM) y durante los 7 días siguientes, cada 24 horas como profilaxis antibiótica.
- Sedar, anestesiar a intubar y el cerdo como se describe en el apartado 1.3 (volumen corriente de 10 -15 ml / kg) y asegurar el cerdo en decúbito supino sobre la mesa de operaciones. Monitorear el cerdo durante el procedimiento mediante la medición de la saturación de oxígeno, frecuencia cardíaca y la temperatura. Mantener la termorregulación mediante el uso de una tabla de funcionamiento automático con calefacción y una manta de calefacción y el calentamiento del líquido infundido.
- Insertar un catéter de 18 G IV en la vena de la oreja del cerdo y proteger los ojos de cerdo con gotas para los ojos Vetropolycin.
- Limpio, preparación y cubra el abdomen del cerdo como en 1.6. Incisión en la línea media con una hoja de bisturí # 15 de la 2 ª serie de glándulas mamarias craneal a la segunda al último conjunto de caudal.
- Realizar la disección hasta la fascia abdominal con electrobisturí.
- Levantar el peritoneo con una pinza mosquito, y cuidadosamente entrar en él con las tijeras Metzenbaum.
- Externalizar la vejiga urinaria y el lugar de 3-O Vicryl sutura en bolsa de tabaco en la pared de la vejiga. Coloque una pequeña incisión en la parte media e insertar un catéter de Foley 16 F. Administrar líquidos por vía intravenosa (Ringer lactato) para valorar la producción de orina de> / = 1 ml / kg / h durante la cirugía.
- Siguientes, externalizar el intestino delgado y grueso y colocar dos separadores Balfour quirúrgico para exponer la cara posterior de la cavidad peritoneal e identificar la vena cava inferior (VCI).
- Utilizando disección cortante y contundente, con cuidado libre de la vena cava inferior del tejido circundante y esqueletizar el buque de la arteria renal derecha proximal a la bifurcación distal de la vena cava inferior. Tenga mucho cuidado durante la disección de vena cava inferior, ya que incluso un defecto muy pequeño en la IVC puede conducir a una hemorragia rápida y desangrado del animal.
- Ligar todas las ramas laterales del segmento de vena cava inferior para asegurar que no habrá sangrado alrededor del tubo de Ti para ser implantados. Nota de la general, dos grandes venas lumbar posterior que requieren una disección muy cuidadosa y ligadura. Además, tenga en cuenta que inmediatamente proximal a la bifurcación de la vena cava inferior, una vena lumbar grande se encuentra comúnmente en la parte postero-y debe ser disecado libre y controlado con bucles nave en preparación para la colocación de la abrazadera.
- Proceder a la siembra del tubo de Ti mismo tiempo como se describe en 4.
- Administrar 100 USP / kg de heparina inmediatamente antes de la fijación de la VCI. Coloque las abrazaderas 45 grados de ángulo quirúrgico distal en la vena cava inferior y la vena lumbar, y luego proximal.
- Crear un veinotomy longitudinal (4 cm) entre las abrazaderas proximal y distal con una hoja de bisturí # 11 seguido de la extensión con unas tijeras Potts.
- Evacuar la sangre de la vena cava inferior y de color de su luz interior con DPBS estéril.
- Ahora insertar el EPC cabeza de serie Ti tubo (o un control de metal) en la vena cava inferior y rellenar con DPBS (con CaCl 2, MgCl 2) evitar que las células se sequen y para evacuar el aire.
- Cierre la veinotomy con una sutura de Prolene 4-0 correr y quitar una pinza proximal de aire de la VCI a través de una pequeña cantidad de copias de sangrado. Coloque una estancia de sutura a través de la pared de la vena en la tubería de PVC para evitar la migración de los implantes en el tiempo.
- Cerrar la fascia con O-PDS en una aguja CT y el espacio subcutáneo con 2-O Vicryl (sutura continua). Cerca de la piel con grapas.
- Administrar hasta 20 ml de bupivacaína al 0,25% (bupivacaína) por vía subcutánea a lo largo del sitio de la incisión y cubrir la herida con una gasa y Tegaderm. También dan flunixino (2,2 mg / kg Q 24 h) y oximorfona (0,15 mg / kg Q 3 - 4 horas) por vía subcutánea, según sea necesario para el dolor.
- Deje de anestesia, el monitor del cerdo hasta que despierta y volver a la jaula. Monitor de cerdo dos veces al día para detectar signos de, angustia / dolor de pie y caminar, las heces y de orina, y el color de la piel que indica una perfusión normal.
6. Explantación de Ti tubo
- Después de 3 semanas, intubar sedar, anestesiar y el cerdo como se describe en 1.3 - 1.4.
- Proceder a una laparotomía como se describe en 5,5 a 5,8.
- Tenga en cuenta que las cicatrices se ocultan el sitio del implante, pero se puede palpar el tubo rígido Ti in situ.
- Diseccionar la vena cava inferior como se describe en 5,9 a 5,11 y el tubo de explante Ti en bloque con el entorno IVC con tijeras fuertes.
- Sacrificar al animal con una solución de la eutanasia Euthasol (390 mg / ml de pentobarbital sódico y 50 mg / ml de sodio fenitoína a 1 ml / 10 libras).
7. Fijación y de imágenes de superficie Ti interior
- Enjuague el segmento de la vena extirpada con un tubo de Ti en solución DPBS y una fotografía de su lumen (patente o de oclusión) con una cámara digital de alta resolución (Figura 7).
- A continuación, fijar la muestra por inmersión en el 3,7% de paraformaldehído durante un mínimo de 15 minutos. Enjuague muestra en una solución de DPBS.
- Con mucho cuidado una incisión alrededor de la vena y el tubo de PVC para abrir el tubo de Ti. Coloque las 3 secciones en un microscopio de fluorescencia con la superficie interior hacia el objetivo / fuente de luz y la imagen en 550 nm de longitud de onda de excitación para visualizar PKH26 marcado con EPC en color rojo / naranja (Figura 8A). Si lo desea, las células pueden ser aún más manchado (por ejemplo, las plaquetas de marcadores endoteliales de adhesión celular (PECAM)-tinción para visualizar bordes de la celda (Figura 8B), DAPI mancha para visualizar los núcleos, etc.)
8. Los resultados representativos:
Después de la ejecución de este protocolo, los médicos y los científicos son capaces de endothelialize estructuras sólidas tubo con derivados de la sangre autóloga de células progenitoras endoteliales en un modelo animal de gran tamaño. Figura 2 muestra que las CPE aisladas con nuestro método aparecen como colonias con morfología de adoquines, después de 7 días la cultura. Nuestro dispositivo de siembra se ilustra en las figuras 5 y 6 permite la rotación lenta de tubos llenos de Ti con la suspensión del CPE y los resultados de la cobertura uniforme de la superficie interna del tubo en condiciones estériles 9.
Nuestra cirugía de implante permite probar la propensión de los biomateriales, tales como Ti, por la trombosis en un modelo animal de gran tamaño. Hemos encontrado que los cerdos toleran este procedimiento bien y que esta implantación se puede lograr con una pérdida mínima de sangre, y sin perturbar la capa de EPC.
t "> Figura 7 muestra que un desnudo completo ocluye el tubo Ti, mientras que nuestro EPC-alineado tubo queda patente incluso en el medio ambiente protrombótico corte bajo de la vena cava inferior. Además, la presencia de una capa confluente de células con fluorescencia marcado confirma la éxito de este método como se muestra en la Figura 8.
Figura 1. Esquema de autólogo de células progenitoras endoteliales experimento de siembra (EPC). En primer lugar, la sangre periférica se extrae de un cerdo. A continuación, EPCs están aislados de la sangre y se expandió en la cultura. EPC se utilizan para la línea de titanio (Ti) dispositivo de tubo, que luego se implantan quirúrgicamente en la vena cava inferior del mismo cerdo de la que las células fueron aisladas.

Figura 2. Colonia representante de CPE en la cultura, de aproximadamente 7 días después del procedimiento de aislamiento (fotografiado con un microscopio invertido Leica DMIL con imágenes de cámara y el software QCapture).

Figura 3. Ti secciones del tubo antes de la asamblea. Tubo de Ti se corta en tres partes iguales en sentido longitudinal, y luego se corta a la longitud de 4,5 cm. Superficies internas de las secciones de Ti se pulen con una amoladora de banco y lija para eliminar los hoyos visible.

Figura 4. Asamblea de las secciones de tubo de PVC Ti con el calor tubo retráctil (azul) y una pistola de calor. Secciones Ti son compatibles con un mandril de aluminio mecanizado, que se extiende a través de secciones de Ti y coincide con las dimensiones del diámetro del tubo interior Ti.

Figura 5 de la Asamblea de titanio tubo, mostrando todos los componentes:. Luer gorra, "pieza de la cabeza," jeringa tubo de silicona, y el tubo de PVC con envoltura de Ti (azul). Asamblea se junta antes de la esterilización para uso quirúrgico.

Figura 6. Tubo de Ti configuración de siembra dentro de la incubadora, mostrando motor, plataforma, soporte de aluminio mecanizado jeringa, montaje Ti tubo y una jeringa de 5 cc. Nota: La Asamblea se muestra, sin cubierta protectora estéril para fines de visualización.
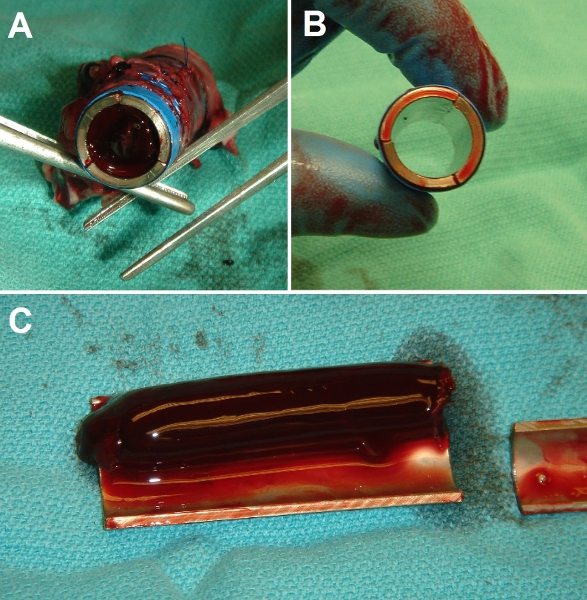
Figura 7. Representante de los resultados brutos de la cirugía de implantación. (A) Fin de vista del control de tubo de metal desnudo Ti después de la implantación en la especie porcina la vena cava inferior (VCI). Tubo de luz está totalmente ocluido con un coágulo sólido. (D) Fin de vista de la EPC cabeza de serie, tubo de Ti después de la implantación. Tubo de luz es totalmente patente y claro. (C) vista diseccionada de control (desnudo) tubo de Ti después de tres días de la implantación, que muestran la extensión de la trombosis (los experimentos se llevaron a cabo un máximo de 3 semanas de duración, con idénticos resultados).

EPCs la Figura 8. En la superficie del tubo Ti siguientes tres días de implantación (con imágenes de un microscopio Leica DMRB vertical con un QICAM QImaging blanco y negro cámara digital y el software Image Pro Plus). (A) las células confluentes en la superficie que muestra PKH26 antes de la cirugía de etiquetado. (B) de la capa confluente de CPE. Red: PKH26 antes de la cirugía de etiquetado. Verde: EPC PECAM-manchas.
Discusión
El método de los tubos de siembra de células-Ti que aquí se presenta permite a los médicos y científicos de forma rápida y uniforme endothelialize contacto con la sangre de las superficies de los dispositivos implantables. Ya que aislar y expandir las CPE a partir de muestras de sangre periférica, procedimiento invasivo no es importante para la cosecha de estas células. Además, el EPC son autólogas, por lo tanto, el riesgo de una reacción inmune al implante de células cabeza de serie, se elimina. Los principios que demostró en su protocolo se puede utilizar no sólo para los tubos de Ti, pero para muchos otros biomateriales, que se utilizan en la medicina cardiovascular.
Los pasos críticos de este protocolo son la limpieza minuciosa de los tubos de Ti, como se comprueba que una película adherente de la adhesión celular contaminante compromisos. Además, una baja velocidad de rotación (inversamente proporcional al diámetro del tubo) es esencial durante el proceso de siembra, de manera que poco a poco EPCs pueden resolver y se adhieren a la superficie como el tubo de Ti está en movimiento.
Nuestro método de siembra inmediatamente antes de la implantación evita práctico ex casos la cultura vivo, las células se adhieran de forma individual y luego formar una hoja confluente en vivo, evitando la posibilidad de la embolización como una hoja inmediatamente después de la re-establecimiento del flujo. Nuestros estudios previos muestran que una vez que el EPC ha crecido a una capa confluente, hacen una matriz extracelular a la que se adhieren firmemente, además, reducir al mínimo cualquier posible desprendimiento de una capa de endotelio. Aunque la posibilidad de desprendimiento de embólicos no se puede descartar del todo, parece ser múltiple riesgo menor que la trombosis de la superficie del dispositivo completo, el problema de que esta terapia está diseñada para prevenir.
Nuestro enfoque de implantación en el corte bajo, el medio ambiente protrombótico de la vena cava inferior utiliza uno de los modelos animales más grandes de confianza para la investigación de la compatibilidad de sangre y la trombosis de los dispositivos de 5,6. Tenga en cuenta que todo el cuidado de los animales y la experimentación se llevó a cabo de acuerdo con el Instituto Nacional de Pautas de Salud para el Cuidado y Uso de Animales de Laboratorio y sólo después de la aprobación de la Universidad de Duke Cuidado de Animales institucional y el empleo.
Con el fin de utilizar con éxito este método para probar la implantación de biomateriales y dispositivos, es importante esqueletizar pacientemente el segmento de vena cava inferior y ligar todos los buques de rama venosa en la preparación para la inserción del dispositivo, de forma que no presente sangrado alrededor del dispositivo se origina en una "falsa luz. Otro paso importante es la adición de DPBS en el lumen del dispositivo de tal manera que las células en la superficie interior del tubo permanecer húmeda durante el cierre de la veinotomy y antes de la reperfusión se inicia. Si el dispositivo no se puede encontrar en el lugar donde se implantó, que pueden haber migrado "hacia arriba" en la vena cava inferior. Esto se puede prevenir mediante la colocación de una sutura (4-O Prolene) a través de la pared de la vena ya través de un 2 a 3 mm de sección de la tubería de PVC para que el tubo está firmemente anclada en su actual ubicación. En caso de que el investigador tiene dificultades para encontrar las células con fluorescencia pre-etiquetados se muestra en la Figura 8 después de la explantación en un tubo de otro modo patente, es probable que las células se han pelado como una hoja coherente. Esto se puede prevenir mediante la disección muy suave alrededor de la vena o desmontaje de las tres secciones del tubo del Ti, después de la fijación de la vena junto con el tubo.
Nuestra tecnología ofrece una prueba de concepto para el dispositivo de prevención de la trombosis cardiovascular a través de EPC-siembra. Esta tecnología se puede utilizar en el desarrollo de "biogénico" alineado con los implantes de los pacientes propias células progenitoras endoteliales. El estudio de viabilidad de nuestro modelo animal porcino establece los primeros pasos para la traducción de esta "medicina personalizada" en la práctica clínica.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Leica Microsystems por sus valiosos consejos sobre la imagen de las secciones de titanio y Gemini Bio-Productos para la prestación del suero porcino utilizado en este estudio. También agradecer a los NIH, por su apoyo a través de subvenciones "forro autólogo EPC para mejorar la biocompatibilidad de los dispositivos de asistencia circulatoria", RC1HL099863-01. Además, estamos agradecidos por el apoyo de la Fundación Nacional de Ciencias de Postgrado de Becas de Investigación de Alexandra Jantzen. También agradecer a George rápido, Mike Lowe y Parker Ianthia por su ayuda en muchos aspectos de la intervención quirúrgica y el manejo de los animales de nuestra investigación. Steven Owen ha sido muy valioso para el mecanizado de piezas que muchos de nuestros dispositivos de siembra y corte de tubos de titanio.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Nombre de compañía | Número de catálogo | Comentarios |
| Acepromacina | Boehringer-Ingelheim | BIC670025 | NAC # 10280002 |
| Alconox limpiador de precisión Desarrollado | Alconox | 1104 | |
| Balfour quirúrgica Retractor | Adler | N / A | |
| Baytril | Bayer | APVMA 46028/0705 | |
| Mariposa con aguja (19G) | Terumo | SV19CLK | |
| Clorhexidina | 3M | 9200 | |
| Abrazaderas (45 grados) | Aesculap | FC339T | |
| DPBS (-/-) | Gibco | 14190-144 | |
| DPBS (+/+) | Gibco | 14040-133 | |
| DuraPrep | 3M | 8635 | |
| EBM-2 medianas | Lonza | CC-3156 | Base para los medio de cultivo libre de suero y completa |
| EGM-2 SingleQuots | Lonza | CC-3162 | Se utiliza con EBM-2, tanto para el medio de cultivo libre de suero y completa |
| Herramienta de electrocauterio | Valleylab | SurgII-20 | |
| Materia esmeril | 3M | 60-0700-0425-8 | Grano 240 |
| Euthasol solución de la eutanasia | Virback Sanidad Animal | ANADÁ #: 200-071 | |
| Fentanilo parche | Actavis | NDC 67767-120-18 # | |
| Flunixina | Schering-Plough | NAC #: 10470183 | |
| Sonda Foley (16F) | Bardo | 730116 | |
| HBSS | Sigma | H8264-500ML | |
| Pistola de aire caliente | Milwaukee | 8988-20 | |
| Heparina | NDC #: 25021 | ||
| Histopaque-1077 | Sigma | H8889-500ML | |
| Intubación Tubo | Mallinckrodt | 86113 | |
| Isoflurano | MWI, Meridian | NDC # 13985-030 | |
| IV catéter (18G) | Becton-Dickinson | 381547 | |
| La ketamina | Fort Dodge | NDC # 0856-2013 | |
| Nivel | Swanson | LLA001 | |
| Luer-Lock tapón en el extremo | CML suministro | 909-001 | |
| Bupivacaína | Hospira | NDC #: 0409-1560-10 | |
| Metzenbaum | Adler | N / A | |
| Micro-introductor (5F) | Galt | KIT 002-01 | |
| Pinzas mosquito | Adler | N / A | |
| Motor | Herbach y Rademan | H1-08 | |
| Oximorfona | Endo Laboratorios | NDC: 63481-624-10 | |
| PKH26 tinte Kit | Sigma | PKH26GL-1KT | |
| Suero porcino | Gemini Bio-Productos | 100-115 | 2% de concentración en el medio de cultivo completo |
| Potts Tijeras | Adler | N / A | |
| Vista la piel precisa de la grapadora | 3M | 3998 | |
| Tubo de PVC | McMaster-Carr/Insultab | 7132K117 | ampliado ID 15,88 mm, recuperado ID 7,95 mm |
| Tamaño medio del ángulo derecho | Adler | N / A | |
| Hoja de bisturí (# 10-15) | Bardo | 373910 | |
| Tubo de silicona | McMaster-Carr | 51735K26 | 16,64 mm OD, 9,52 mm de diámetro |
| Jeringa (5 cc) | Becton-Dickinson (BD) | 309603 | |
| Tegaderm | 3M | 90001 | |
| Llave de tres vías | Kendall | 170060 | |
| Ti tubo | Tico de titanio | N / A | Especifica como ½ "OD, .065" de pared, 0.370 ID ", 0,1737 libras / pie |
| Tripsina | Lonza | CC-5012 | |
| Neutralizar la solución de tripsina (TNS) | Lonza | CC-5002 | 0,03% |
| Vetropolycin | Pharmaderm Sanidad Animal | NAC #: 12920110 | |
| Sutura Vicryl (3-0) | Ethicon | J808T | |
| Agua baño de ultrasonido | Branson | B200 |
Referencias
- Achneck, H. E. Pathophysiology of bleeding and clotting in the cardiac surgery patient: from vascular endothelium to circulatory assist device surface. Circulation. 122, 2068-2077 (2010).
- Achneck, H. E., Sileshi, B., Lawson, J. H. Review of the biology of bleeding and clotting in the surgical patient. Vascular. 16, 6-13 (2008).
- Arvidsson, S., Askendal, A., Tengvall, P. Blood plasma contact activation on silicon, titanium and aluminium. Biomaterials. 28, 1346-1354 (2007).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Kang, C., Bonneau, M., Brouland, J. P., Bal dit Sollier, C., Drouet, L. In vivo pig models of venous thrombosis mimicking human disease. Thromb Haemost. 89, 256-263 (2003).
- Ueberrueck, T. Comparison of the ovine and porcine animal models for biocompatibility testing of vascular prostheses. J Surg Res. 124, 305-311 (2005).
- Velik-Salchner, C. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thromb Res. 117, 597-602 (2006).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc Res Tech. 73, 71-76 (2010).
- Ford, J. W., Welling, T. H., Stanley, J. C., Messina, L. M. PKH26 and 125I-PKH95: characterization and efficacy as labels for in vitro and in vivo endothelial cell localization and tracking. J Surg Res. 62, 23-28 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados