Method Article
Autologue de cellules progénitrices endothéliales-ensemencement de la technologie et les tests de biocompatibilité pour les appareils de cardio-vasculaires dans le modèle des grands animaux
Dans cet article
Résumé
Une méthode pour le titane ensemencement du sang en contact avec des biomatériaux et la biocompatibilité des cellules autologues tests sont décrits. Cette méthode utilise des cellules progénitrices endothéliales et tubes en titane, tête de série dans les minutes de l'implantation chirurgicale dans porcine veines caves. Cette technique est adaptable à de nombreux autres dispositifs implantables biomédicale.
Résumé
Implantables cardiovasculaires sont fabriqués à partir de matériaux artificiels (par exemple le titane (Ti), le polytétrafluoroéthylène expansé), qui présentent le risque de formation de 1,2,3 thromboembolies. Nous avons développé une méthode pour la ligne de la surface intérieure des tubes Ti avec autologues dérivées du sang humain ou porcin cellules progénitrices endothéliales (EPC) 4. En implantant des tubes Ti contenant une couche confluente de EPC porcine dans la veine cave inférieure (VCI) de porcs, nous avons testé la biocompatibilité améliorée de la surface de la cellule-ensemencées dans l'environnement prothrombotique d'un modèle de grand animal et l'a comparé aux surfaces métalliques nues non modifiés 5,6,7 (figure 1). Cette méthode peut être utilisée pour endothelialize périphériques à quelques minutes de l'implantation et de tester leur fonction antithrombotique in vivo.
Le sang périphérique a été obtenu à partir de 50 kg Yorkshire porcine et de sa fraction de cellules mononucléaires cultivés pour isoler EPC 4,8. Ti tubes (9,4 mm ID) ont été pré-découpée en trois sections 4.5 cm longitudinale et remonté avec gaine thermorétractable. Un dispositif d'ensemencement a été construit, ce qui permet une rotation lente des tubes Ti.
Nous avons effectué une laparotomie sur les porcs et externalisés de l'intestin et la vessie. Dissection fine et émoussée a été utilisé pour squelettisent la VCI par sa bifurcation distale de l'artère rénale droite proximale. Les tubes Ti ont ensuite été remplis marqués à la fluorescence autologue de suspension CBE et pivoté à 10 x RPH 30 min pour atteindre uniformes cell-coating 9. Après administration de 100 USP / kg d'héparine, les deux extrémités de la VCI et une veine lombaire ont été serrées. Un veinotomy 4 cm a été réalisée et le dispositif inséré et rempli de tampon phosphate salin. Comme le veinotomy a été fermé par une suture Prolène 4-0 course, une pince a été retiré pour de l'air la VCI. A la fin de la procédure, le fascia a été approchée par 0-PDS (polydioxanone de suture), l'espace sous-cutané fermée avec 2-0 Vicryl et la peau agrafé fermé.
Après 3 - 21 jours, les porcs ont été euthanasiés, le dispositif de explantés en-bloc et fixe. Les tubes Ti ont été démontées et les surfaces intérieures imagées avec un microscope à fluorescence.
Nous avons trouvé que les tubes métalliques nus Ti totalement occluse alors que les tubes EPC-ensemencé est resté brevet. En outre, nous avons été en mesure de démontrer une couche confluente de CPE à l'intérieur du sang en contact avec la surface.
En conclusion, notre technologie peut être utilisée pour endothelialize tubes Ti quelques minutes de l'implantation des CPE autologues pour prévenir la thrombose de l'appareil. Notre méthode chirurgicale permet de tester la biocompatibilité améliorée de ces dispositifs modifiés avec une perte de sang minime et les perturbations de surface EPC-ensemencés.
Protocole
1. Endothéliales progénitrices des cellules d'isolement
- Trente jours avant l'implantation du tube CBE graines, préparer une seringue de 60 ml avec 15 ml de solution de citrate dextrose anticoagulant et sécurisé avec un robinet d'arrêt à 3 voies pour l'isolement du EPC du sang de porc périphériques. 24 heures avant le prélèvement sanguin, précouche deux plaques de 12 puits avec du collagène de type 1 chez le rat (50 pg / ml, dissous dans 0,02 N solution d'acide acétique) 4.
- Effectuer toutes les soins aux animaux et à l'expérimentation en conformité avec l'Institut national de lignes directrices de Santé pour les soins et l'utilisation des animaux de laboratoire et seulement après l'approbation de la protection des animaux et du Comité institutionnel superviser l'utilisation.
- Sedate une femelle Yorkshire de porc (45 kg) avec de l'acépromazine (1,1 mg / kg) et la kétamine (22 mg / kg) par voie intramusculaire par une aiguille 19 G papillon.
- Intuber le cochon avec un tube endotrachéal (30 cm de longueur, 8 mm de diamètre) et anesthésier cochon avec l'isoflurane (4,5% du volume courant par masque).
- Surveiller le cochon lors de la procédure par la mesure de la saturation en oxygène, la fréquence cardiaque et la température. Maintenir la thermorégulation en utilisant une table d'opération automatisée chauffée et une couverture de chauffage et par le réchauffement des fluides perfusé.
- Placer le porc dans la position couchée sur la table opératoire, sécuriser ses membres postérieurs caudolaterally, et propre à la chlorhexidine suivie par DuraPrep stérilisation. Puis procéder à draper la région pelvienne.
- Insérer une aiguille de 21 G x 7 cm à partir d'un micro-5 F introducteur kit juste en dedans de pouls palpable fémorale (en dedans de la vaste médial et latéral vers le muscle gracilis) dans la veine fémorale et cathétériser la veine à l'aide technique de Seldinger. Branchez le 60 seringues préparées ml au cathéter intravasculaire et tirer 45 ml de sang.
- Tenir la pression sur le site de ponction navire pour obtenir l'hémostase (5 min), arrêter l'anesthésie et de récupérer le cochon. L'animal est surveillé jusqu'à guérison complète et est retourné dans sa cage.
- Diluer la solution avec une solution de sang 01:01 Hank saline tamponnée (sans CaCl 2, MgCl 2, MgSO 4) et la couche sur les volumes égaux de Histopaque de créer des couches bien définies. Centrifugeuse de cellules (30 min, 740 g, la mise briser basse) et de recueillir des mononucléaires (MNC) couche. Resuspendre et laver les multinationales x 3 avec du phosphate de Dulbecco saline tamponnée (DPBS) (10 min, 515 g) avant plaquage en deux plaques de 12 puits dans un milieu de pleine croissance (EBM-2 moyennes avec 2% sérum porcin (PS) et EGM-2 SingleQuots) à 37 ° C, 5% de CO 2.
- Lentement changement de milieu toutes les 24 heures pendant les 7 premiers jours, puis tous les autres jours. Identifier les colonies CBE, après un temps moyen
de 7 jours (figure 2). - Développer EPC dans la culture une fois qu'ils couvrent ¼ de la superficie de 12 puits. Confirmer l'identité EPC avec la cytométrie de flux par des tests pour la présence de marqueurs de surface CD31 et l'absence de CD14, CD45. D'autres essais qui peuvent être effectués comprennent la morphologie cellulaire et de l'oxyde nitrique III activité après l'exposition au flux 4.
2. Tube de titane
- Section d'un tube Ti longitudinalement en trois égale à 120 degrés unités (4,5 cm de long) avec un 72 dents HHS fraise-scie maintenu en place par une tonnelle vu dans une machine de fraisage verticale. Lancez-le à 300 RPM et de garder la zone de coupe saturé de fluide de coupe du robinet magique à tout moment pendant la coupe (figure 3).
- Polonaise de la surface intérieure d'un touret et une roue métallurgie Scotch-Brite. Ensuite manuellement polir avec 3M d'une toile émeri à la surface encore lisse et même de supprimer tout fosses visibles.
- Nettoyer les pièces avec Ti Alconox solution savonneuse, suivi par 5 minutes de submersion dans l'eau régale (1:3 d'acide nitrique concentré à l'acide chlorhydrique concentré), suivi d'un rinçage avec plusieurs litres d'eau 10. Soyez prudent extrême que l'eau régale est très corrosif et potentiellement explosive!
- Soniquer sections Ti x 16 min dans du savon Alconox solution, élévation x 30 dans de l'eau déminéralisée et soniquer nouveau x 16 min dans de l'eau déminéralisée. Laisser sécher dans une hotte à flux laminaire.
- Couper en PVC gaine thermorétractable à 4,5 cm de longueur et nettoyer soigneusement par 2,4.
- Utilisez une pince à épiler pour placer les 3 sections nettoyées Ti sur un mandrin de soutien (usiné à partir d'aluminium, 8,5 mm de diamètre extérieur) et le manchon lieu de PVC gaine thermorétractable autour des sections Ti (figure 4). Gaine thermorétractable avec un pistolet thermique tout en tournant pour bien envelopper mandrin sections Ti étroitement ensemble.
3. Dispositif d'ensemencement et d'assemblage des composants
- Couper des tubes de silicone pour une longueur de 2,5 cm et 3,5 cm.
- Seringue en plastique cc section 5 à la marque de 0,8 ml et de garder «pièce de tête» avec embout Luer.
- Bien nettoyer 2 sections de silicone x, 'pièce de tête »seringue et un bouchon Luer par sonication comme décrit sous 2.4.
- Ajouter tube en silicone à chaque extrémité du tube à partir assemblés Ti 2.5, extensionDing de 5 mm sur le tube en PVC.
- Insérez l'extrémité coupée de la «pièce de tête» de la seringue dans tube en silicone courte, de sorte qu'il jouxte Ti tube (figure 5).
- Seal a terminé l'assemblage du tube Ti avec un bouchon luer dans une pochette en Tyvek et gaz stériliser à l'oxyde d'éthylène (18 heures à 55 ° C).
- Monter un moteur de synchronisation synchrone (10 RPH) sur une plateforme en plexiglas et de connecter son axe à un porte-seringue (usiné en aluminium, s'adapte seringue de 5 cc) (figure 6).
4. EPC-ensemencement de Ti surface intérieure du tube
- Développer EPC comme isolés sous 1. Confluentes à 3 flacons T-75 (ou au moins de 9 x 10 6 cellules).
- Le jour de la chirurgie, marquer les cellules par fluorescence à long terme de teinture (PKH26) 11. Commencez par rincer EPC cultivés deux fois dans un milieu sans sérum. Attention à limiter l'exposition de lumière pour protéger les cellules pendant et après l'étiquetage.
- Couverture des cellules avec 4 pM PKH26 dans le diluant C (solution de colorant) à température ambiante pendant 4 minutes.
- Arrêtez étiquetage réaction en ajoutant du sérum de porc dans un volume égal à teindre solution. Une minute plus tard, une solution diluée 1:1 avec combinée milieu de croissance complet.
- Aspirer le liquide et rincer les cellules x 3 avec support pleine croissance.
- Laver deux fois dans DPBS EPC (sans CaCl 2, MgCl 2).
- Couverture des cellules dans la trypsine et incuber à 37 ° C pendant 3 minutes et confirmer le détachement sous un microscope optique. Ajouter la solution de neutralisation de la trypsine du double du volume de la trypsine utilisée.
- Combinez des solutions cellulaires dans un seul tube et mélanger par pipetage. Ajouter 10 ul d'une solution de cellules dans chaque côté d'un hémocytomètre pour le comptage.
- Solution cellulaire Centrifugeuse (1500 RPH, à 5 min.). Compter les cellules et resuspendre granulés à 2 - 2,5 x 10 6 EPC / ml dans un milieu sans sérum. Notez le volume minimum pour remplir le tube est de 4,5 ml.
- Disposez une serviette stérile hotte biologique pour le champ stérile. Ouvrez gaz stérilisée tube Ti et extra seringue de 5 cc sur un champ stérile.
- Avec des gants stériles, retirer le piston de seringue de 5 cc et de garder sur le terrain pour une utilisation ultérieure. Apposez Luer bouchon à cette seringue.
- Pipet les 4,5 - 5 ml suspension en vertu du CBE 4.9 dans la seringue ouverte. Insérez le piston solidement retour dans l'extrémité ouverte de la seringue.
- Tenez la seringue avec bouchon vers le haut et retirez le capuchon. Insérer la seringue avec embout Luer première dans des tubes en silicone ouverte tube Ti jusqu'au serré, ne pas avancer dans le tube Ti.
- Seringue Advance plongeur lentement jusqu'à ce que la solution cellulaire atteint haut de la seringue coupé "pièce de tête,« éliminer les bulles du système. Fermer avec bouchon Luer et insérez assemblée entière dans la gaine stérile, étanchéité extrémité ouverte avec du ruban adhésif.
- Insérez cette assemblée entière en porte-seringue usiné de 3,7. Placer dans un incubateur à 37 ° C et ajuster la plate-forme de telle sorte que partie de tube Ti de la chambre de semis est de niveau, utilisant l'indicateur de niveau d'eau (figure 6).
- Autoriser tube Ti pour tourner 30 minutes avant l'implantation.
5. Implantation de Ti tube dans la veine cave inférieure porcine
- Vingt-quatre heures avant la chirurgie, le cochon prémédication (à partir de laquelle ont été isolés EPC) avec un patch de fentanyl (100 pg / hr transdermique; garder timbre en place x 72 heures).
- Gardez cochon NPO nuit et administrer Baytril (enrofloxacine) en préopératoire à la journée de la chirurgie (5 mg / kg, IM) et pour 7 jours suivants, toutes les 24 heures en tant que prophylaxie antibiotique.
- Sedate, intuber et anesthésier le porc comme décrit sous 1.3 (volume courant de 10 -15 ml / kg) et sécuriser le cochon dans la position couchée sur la table de salle d'opération. Surveiller le cochon lors de la procédure par la mesure de la saturation en oxygène, la fréquence cardiaque et la température. Maintenir la thermorégulation en utilisant une table d'opération automatisée chauffée et une couverture de chauffage et par le réchauffement des fluides perfusé.
- Insérer une 18 G IV cathéter dans la veine d'oreille de porc et de protéger les yeux de cochon avec des gouttes oculaires Vetropolycin.
- Nettoyer, préparer et drapé abdomen du porc comme dans 1.6. Inciser la ligne médiane avec une lame de bistouri n ° 15 de la 2e série de glandes mammaires crânialement à la 2e à la dernière mis caudalement.
- Réaliser la dissection jusqu'à l'aponévrose abdominale avec électrocoagulation.
- Soulevez le péritoine avec une pince Mosquito et soigneusement avec des ciseaux entrent Metzenbaum.
- Externaliser la vessie et place d'un 3-O Vicryl bourse chaîne de suture dans la paroi vésicale. Placez une incision dans son milieu et insérer une sonde de Foley 16 F. Administrer des fluides par voie intraveineuse (Ringer lactate) pour titrer la production d'urine à> / = 1 ml / kg / h pendant la chirurgie.
- Après, externaliser l'intestin grêle et grandes entreprises et placer deux écarteurs chirurgicaux Balfour pour exposer la face postérieure de la cavité péritonéale et d'identifier la veine cave inférieure (VCI).
- Utiliser dissection fine et contondants, soigneusement sans la VCI à partir des tissus environnants et squelettisent le navire de l'artère rénale proximale de la bifurcation de l'extrémité distale IVC. Faire extrêmement attention lors de la dissection IVC que même un défaut très faible dans la VCI peut conduire à une hémorragie rapide et exsanguination de l'animal.
- Ligaturer toutes les branches latérales du segment IVC pour assurer qu'il n'y aura pas de saignement autour du tube Ti pour être implantés. Notez les deux grandes généralement postérieure veines lombaires qui nécessitent une dissection très prudent et de ligature. En outre, notez que, immédiatement en amont de la bifurcation de la VCI, une grosse veine lombaire est fréquemment rencontrés sur le côté postéro-interne et doit être disséqué et contrôlée avec des boucles navire en préparation pour le placement de serrage.
- Procéder à l'ensemencement du tube Ti simultanément comme indiqué au paragraphe 4.
- Administrer 100 USP / kg d'héparine immédiatement avant serrage de la VCI. Placer 45 pinces angle de degré chirurgicales distalement sur la VCI et la veine lombaire, puis proximalement.
- Créer un veinotomy longitudinales (4 cm) entre les brides proximales et distales à l'aide d'une lame de bistouri n ° 11 puis, par extension, avec des ciseaux de Potts.
- Evacuer toute de sang de la veine cave inférieure et rincer sa lumière intérieure avec DPBS stérile.
- Maintenant, insérez le CPE-ensemencé Ti tube (ou un contrôle en métal nu) dans la VCI et le remplir avec du DPBS (avec CaCl 2, MgCl 2) pour empêcher les cellules de séchage et d'évacuer l'air.
- Fermez le veinotomy avec une suture Prolène 4-0 course et enlever un clamp proximal à de l'air grâce à la VCI une petite quantité de back-saignements. Placez un "séjour de suture" à travers la paroi de la veine dans le tube en PVC pour empêcher la migration de l'implant avec le temps.
- Fermer l'aponévrose avec un O-PDS sur une aiguille CT et l'espace sous-cutanée avec 2-O Vicryl (course sutures). Fermer la peau avec des agrafes.
- Administrer à 20 ml de marcaïne 0,25% (bupivacaïne) sous-cutanée le long du site d'incision et de recouvrir la plaie avec de la gaze et Tegaderm. Donnez aussi Flunixine (2,2 mg / kg Q 24 h) et oxymorphone (0,15 mg / kg Q 3 - 4 heures) sous-cutanée au besoin pour la douleur.
- Cesser d'anesthésie, de surveiller le porc jusqu'à ce éveillé et retour à la cage. Moniteur de porc deux fois par jour pour des signes de détresse / douleur, debout et la marche, les selles et la production d'urine, et la couleur de peau indiquant perfusion normale.
6. Explantation de Ti tubes
- Après 3 semaines, calme, intuber et anesthésier le porc comme décrit au paragraphe 1.3 - 1.4.
- Procéder à une laparotomie comme décrit dans 05/05 au 05/08.
- Notez que la cicatrisation se dissimuler le site de l'implant, mais vous pouvez palper le tube rigide Ti in situ.
- Disséquer la VCI comme décrit dans 5.9 à 5.11 et le tube Ti explant en-bloc avec l'entourant avec des ciseaux IVC lourds.
- Euthanasier l'animal avec une solution d'euthanasie Euthasol (390 mg / ml de pentobarbital de sodium et 50 mg / ml phénytoïne sodique à 1 ml / 10 lb).
7. Fixation et imagerie Ti surface intérieure
- Rincez le segment de veine excisée avec tube Ti dans une solution de DPBS et de photographier sa lumière (brevet ou occlus) avec un appareil photo numérique haute résolution (figure 7).
- Après, fixer le spécimen à l'immerger dans paraformaldéhyde 3,7% pour un minimum de 15 minutes. Rincez spécimen en solution DPBS.
- Très soigneusement inciser la veine environnantes et tuyaux en PVC d'ouvrir le tube Ti. Placer les 3 sections sous un microscope à fluorescence avec les surfaces intérieures face à l'objectif / source de lumière et de l'image sous 550 nm de longueur d'onde d'excitation de visualiser PKH26 marqué EPC en rouge / orange (figure 8A). Si désiré, les cellules peuvent être encore tachées (par exemple des plaquettes marqueur endothélial adhésion cellulaire (PECAM)-coloration de visualiser les bordures de cellule (figure 8B), DAPI-taches de visualiser les noyaux, etc.)
8. Les résultats représentatifs:
Après l'exécution de ce protocole, les médecins et les scientifiques sont capables de endothelialize structures tube solide avec des dérivés du sang autologue les cellules progénitrices endothéliales dans un modèle de grand animal. La figure 2 montre que les PEC isolés avec notre méthode apparaissent comme des colonies de morphologie pavées après environ 7 jours à de la culture. Notre dispositif d'ensemencement illustré dans les figures 5 et 6 permet une rotation lente de tubes remplis de Ti avec la suspension CBE et les résultats dans une couverture uniforme de la surface intérieure du tube dans des conditions stériles 9.
Notre chirurgie d'implantation permet de tester la propension des biomatériaux, tels que Ti, de la thrombose dans un modèle de grand animal. Nous avons trouvé que les porcs tolèrent cette procédure bien et que cette implantation peut être atteint avec seulement une perte de sang minime et sans interruption de la couche CBE.
t "> La figure 7 montre que le tube nu Ti obstrue complètement, alors que notre EPC-alignés tube reste de brevet, même dans l'environnement à faible cisaillement prothrombotique de la veine cave inférieure. De plus, la présence d'une couche confluente de cellules marqué par fluorescence confirme le succès de cette méthode comme le montre la Figure 8.
Figure 1. Schéma de l'autogreffe de cellules progénitrices endothéliales expérience d'ensemencement (CPE). Tout d'abord, le sang périphérique est tiré d'un cochon. Ensuite, EPC sont isolés du sang et multipliées en culture. EPC sont ensuite utilisés pour la ligne un dispositif de titane tube (Ti), qui est ensuite implanté chirurgicalement dans la veine cave inférieure du même porc à partir de laquelle les cellules ont été isolées.

Figure 2. Colonie Représentant des EPC dans la culture, à environ 7 jours après la procédure d'isolement (imagé avec un microscope inversé Leica DMIL avec l'imagerie par caméra et un logiciel QCapture).

Figure 3. Sections de tube Ti avant l'assemblage. Tube Ti est découpé en trois sections égales longitudinalement, puis couper à 4,5 cm de longueur. Surfaces intérieures des sections Ti sont polis en utilisant une meuleuse d'établi et de toile émeri pour enlever les noyaux visibles.

Figure 4. Assemblée des sections de tube PVC Ti avec gaine thermorétractable (bleu) et un pistolet thermique. Ti sections sont appuyés sur un mandrin en aluminium usiné qui s'étend à travers des sections Ti et correspond aux dimensions du diamètre du tube Ti intérieure.

Figure 5 tube en titane, en montrant tous les composants:. Luer casquette, «pièce de tête,« seringue tube en silicone, et un tube de PVC Ti wrap (bleu). Assemblée est mis en place avant la stérilisation à usage chirurgical.

Figure 6. Setup Ti ensemencement tube intérieur incubateur, montrant à moteur, plateforme, porte-seringue usinées en aluminium, tube Ti, et 5 seringues cc. Remarque: l'Assemblée est montré sans gaine protectrice stérile à des fins de visualisation.
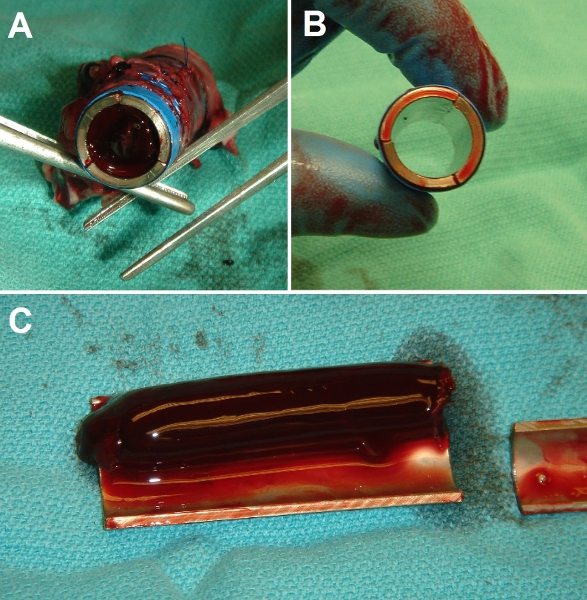
Figure 7. Représentant résultats bruts de la chirurgie d'implantation. (A) Fin-vue du contrôle strict tube métallique Ti après l'implantation dans porcine veine cave inférieure (VCI). Tube lumière est complètement obstruée par un caillot solide. (B) Fin de vue de l'EPC-ensemencé le tube Ti après l'implantation. Tube lumière est entièrement brevets et clair. (C) Vue disséquées de contrôle (à nu) du tube Ti après l'implantation de 3 jours, montrant l'étendue de la thrombose (expériences ont été menées durée allant jusqu'à 3 semaines avec des résultats identiques).

EPC Figure 8. Sur la surface du tube Ti après l'implantation 3 jours (imagées avec un microscope droit Leica DMRB avec un QICAM QImaging monochrome appareil photo numérique et Pro Image Plus de logiciels). (A) Les cellules confluentes sur la surface montrant PKH26 pré-chirurgie étiquetage. (B) couche confluente de CPE. Rouge: PKH26 pré-chirurgie étiquetage. Vert: CBE PECAM-tache.
Discussion
La méthode des tubes Ti cellule ensemencement présentée ici permet aux médecins et aux scientifiques de rapidement et uniformément endothelialize sang surfaces en contact avec des dispositifs implantables. Puisque nous isoler et d'élargir EPC à partir d'échantillons de sang périphérique, aucune procédure envahissante majeure est nécessaire pour récolter ces cellules. Par ailleurs, l'EPC sont autologues, par conséquent, le risque de réaction immunitaire à toute l'implant cellule ensemencée est éliminé. Les principes démontré dans son protocole peut être utilisé non seulement pour les tubes de Ti, mais pour beaucoup d'autres biomatériaux, qui sont utilisés dans la médecine cardiovasculaire.
Les étapes critiques dans ce protocole sont un nettoyage méticuleux des tubes Ti, comme nous avons trouvé que tout film adhérent de l'adhérence cellulaire contaminant compromis. En outre, une vitesse de rotation lente (inversement proportionnelle au diamètre du tube) est essentielle pendant le processus d'ensemencement, tels que les PEC peuvent se déposent lentement et adhèrent à la surface comme le tube Ti est en mouvement.
Notre méthode d'ensemencement immédiatement avant l'implantation évite impraticable fois ex vivo la culture, les cellules adhèrent individuellement et plus tard de former une feuille confluente in vivo, en évitant la possibilité d'embolisation comme une feuille, immédiatement après le rétablissement du flux. Nos études antérieures montrent que, une fois l'EPC ont grandi à une couche confluente, ils font une matrice extra-cellulaire à laquelle ils adhèrent fermement, de plus en minimisant toute mue possibles d'une feuille endothéliales. Bien que la possibilité de détachement embolique ne peut pas être totalement exclue, il semble être le risque de thrombose multifold inférieur de la surface périphérique en entier, le problème que cette thérapie est conçue pour prévenir.
Notre approche de l'implantation dans le faible taux de cisaillement, de l'environnement prothrombotique de la veine cave inférieure utilise l'un des modèles les plus fiables des grands animaux pour la recherche et la thrombose artérielle compatibilité des périphériques 5,6. Notez que tous les soins des animaux et d'expérimentation a été menée en conformité avec l'Institut national de lignes directrices de Santé pour les soins et l'utilisation des animaux de laboratoire et seulement après l'approbation de l'Université Duke de soins des animaux et du Comité institutionnel d'utilisation.
Pour réussir à utiliser cette méthode pour tester l'implantation de biomatériaux et d'appareils, il est important de patience squelettisent le segment IVC et ligaturer la branche veineuse tous les navires en préparation pour l'insertion de périphérique, de telle sorte que pas de saignement autour de l'appareil provient d'une «fausse lumière». Une autre étape critique est l'ajout de DPBS dans le lumen dispositif tel que les cellules sur la surface du tube intérieur restent humides pendant la fermeture de l'veinotomy et avant la reperfusion est initiée. Si l'appareil ne peut être trouvé à l'endroit où il était implanté, il peut avoir migré «en amont» dans la VCI. Ceci peut être évité en plaçant un fil de suture (4-O Prolène) à travers la paroi veineuse et à travers un 2 à 3 mm de section du tuyau en PVC afin que le tube est solidement ancrée dans son emplacement actuel. Si le chercheur a du mal à trouver les cellules pré-étiquetées par fluorescence montre la figure 8 après explantation dans un tube sinon brevet, il est probable que les cellules ont décollé comme une feuille cohérente. Ceci peut être évité par une dissection très doux de la veine environnante et le démontage des 3 sections de tube Ti, après fixation de la veine avec le tube.
Notre technologie apporte la preuve de concept pour le dispositif de prévention de la thrombose cardiovasculaire par EPC-ensemencement. Cette technologie peut être utilisée dans le développement de «biogéniques» implants bordée de patients propres cellules progénitrices endothéliales. L'étude de faisabilité dans notre modèle animal porcin prévoit les premières étapes vers la traduction de cette «médecine personnalisée» dans la pratique clinique.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier Leica Microsystems pour leurs précieux conseils sur des sections de titane d'imagerie et des Gémeaux Bio-Produits pour fournir le sérum de porc utilisée dans cette étude. Nous avons aussi à remercier les NIH pour leur soutien par le biais de subvention "doublure autologue CBE afin d'améliorer la biocompatibilité des dispositifs d'assistance circulatoire", RC1HL099863-01. En outre, nous sommes reconnaissants pour le soutien de la National Science Foundation Graduate Research Fellowship de Alexandra Jantzen. Nous avons aussi à remercier George rapide, Mike Lowe et Ianthia Parker pour aider de nombreux aspects de la procédure chirurgicale et le traitement de nos animaux de recherche. Steven Owen a été inestimable dans l'usinage de pièces beaucoup de notre dispositif d'ensemencement et la coupe des tubes de titane.
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs | Nom de l'entreprise | Numéro de catalogue | Commentaires |
| Acépromazine | Boehringer-Ingelheim | BIC670025 | NAC # 10280002 |
| Nettoyant Alconox précision Propulsé | Alconox | 1104 | |
| Balfour écarteur chirurgical | Adler | N / A | |
| Baytril | Bayer | APVMA 46028/0705 | |
| Papillon aiguille (19G) | Terumo | SV19CLK | |
| Chlorhexidine | 3M | 9200 | |
| Pinces (45 degrés) | Aesculap | FC339T | |
| DPBS (-/-) | Gibco | 14190-144 | |
| DPBS (+/+) | Gibco | 14040-133 | |
| DuraPrep | 3M | 8635 | |
| EBM-2 moyennes | Lonza | CC-3156 | Base pour un milieu de croissance à la fois libre et plein de sérum |
| EGM-2 SingleQuots | Lonza | CC-3162 | Utilisé avec l'EBM-2 pour les deux moyennes de croissance sérique libre et plein |
| Outil Electrocautérisation | Valleylab | SurgII-20 | |
| Toile émeri | 3M | 60-0700-0425-8 | Grain 240 |
| Solution Euthanasie Euthasol | Santé Animale Virback | ANADA #: 200-071 | |
| Patch de fentanyl | Actavis | NDC # 67767-120-18 | |
| Flunixine | Schering-Plough | NAC #: 10470183 | |
| Sonde de Foley (16F) | Barde | 730116 | |
| HBSS | Sigma | H8264-500ML | |
| Heat Gun | Milwaukee | 8988-20 | |
| Héparine | NDC #: 25021 | ||
| Histopaque-1077 | Sigma | H8889-500ML | |
| Tube d'intubation | Mallinckrodt | 86113 | |
| L'isoflurane | MWI, Meridian | NDC # 13985-030 | |
| Cathéter IV (18G) | Becton-Dickinson | 381547 | |
| La kétamine | Fort Dodge | NDC # 0856-2013 | |
| Niveau | Swanson | LLA001 | |
| Luer-Lock un capuchon | CML Supply | 909-001 | |
| Marcaïne | Hospira | NDC #: 0409-1560-10 | |
| Ciseaux Metzenbaum | Adler | N / A | |
| Micro-introducteur (5F) | Galt | KIT 002-01 | |
| Pince Mosquito | Adler | N / A | |
| Moteur | Herbach et Rademan | S1-08 | |
| Oxymorphone | Endo Labs | NDC: 63481-624-10 | |
| PKH26 Dye kit | Sigma | PKH26GL-1KT | |
| Sérum porcin | Gemini Bio-Produits | 100-115 | Concentration de 2% en milieu pleine croissance |
| Ciseaux Potts | Adler | N / A | |
| Précis Peau Vista agrafeuse | 3M | 3998 | |
| Tuyaux en PVC | McMaster-Carr/Insultab | 7132K117 | élargi ID 15,88 mm, ID récupéré 7,95 mm |
| Right Angle Medium Size | Adler | N / A | |
| Scalpel Blade (# 10-15) | Barde | 373910 | |
| Tubes en silicone | McMaster-Carr | 51735K26 | 16,64 mm de diamètre extérieur, 9,52 mm ID |
| Seringue (5 cc) | Becton-Dickinson (BD) | 309603 | |
| Tegaderm | 3M | 90001 | |
| Robinet à trois voies | Kendall | 170060 | |
| Ti Tube | Tico Titane | N / A | Spécifié comme ½ "OD, 0.065" mur, 0.370 "ID, £ 0,1737 / pi |
| Trypsine | Lonza | CC-5012 | |
| Trypsine solution neutralisante (TNS) | Lonza | CC-5002 | 0,03% |
| Vetropolycin | Santé Animale Pharmaderm | NAC #: 12920110 | |
| Vicryl Suture (3-0) | Ethicon | J808T | |
| Sonicator bain d'eau | Branson | B200 |
Références
- Achneck, H. E. Pathophysiology of bleeding and clotting in the cardiac surgery patient: from vascular endothelium to circulatory assist device surface. Circulation. 122, 2068-2077 (2010).
- Achneck, H. E., Sileshi, B., Lawson, J. H. Review of the biology of bleeding and clotting in the surgical patient. Vascular. 16, 6-13 (2008).
- Arvidsson, S., Askendal, A., Tengvall, P. Blood plasma contact activation on silicon, titanium and aluminium. Biomaterials. 28, 1346-1354 (2007).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Kang, C., Bonneau, M., Brouland, J. P., Bal dit Sollier, C., Drouet, L. In vivo pig models of venous thrombosis mimicking human disease. Thromb Haemost. 89, 256-263 (2003).
- Ueberrueck, T. Comparison of the ovine and porcine animal models for biocompatibility testing of vascular prostheses. J Surg Res. 124, 305-311 (2005).
- Velik-Salchner, C. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood. Thromb Res. 117, 597-602 (2006).
- Yoder, M. C. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109, 1801-1809 (2007).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc Res Tech. 73, 71-76 (2010).
- Ford, J. W., Welling, T. H., Stanley, J. C., Messina, L. M. PKH26 and 125I-PKH95: characterization and efficacy as labels for in vitro and in vivo endothelial cell localization and tracking. J Surg Res. 62, 23-28 (1996).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon