Method Article
Imagem interações proteína-proteína In vivo
Neste Artigo
Resumo
Este protocolo descreve como imagem de interações proteína-proteína através de um ensaio de proximidade FRET-based.
Resumo
Interações proteína-proteína são uma marca registrada de todos os processos essenciais celular. No entanto, muitas dessas interações são transitórias, ou energeticamente fracos, impedindo a sua identificação e análise através de métodos bioquímicos tradicionais, tais como co-imunoprecipitação. A este respeito, as proteínas geneticamente codificável fluorescente (GFP, RFP, etc) e seus associados se sobrepõem espectro de fluorescência revolucionaram a nossa capacidade de monitorar interações fracas in vivo utilizando Förster transferência de energia de ressonância (FRET) 1-3. Aqui, detalhe que o uso de um ensaio de proximidade FRET baseado receptor para o monitoramento de interações receptor na superfície das células endoteliais.
Protocolo
O protocolo consiste em três etapas principais. A clonagem, primeira etapa do seu gene de interesse em um vetor de expressão de mamífero amino-terminais para as versões monoméricas de PCP e / ou YFP só será discutido brevemente. A segunda e terceira etapas; transfecção de DNA vetor em EA.hy926 células endoteliais, e de imagem confocal com FRET, são descritos com mais profundidade a seguir.
1. Construção de PCP e YFP Receptores Quimérico
Receptores de interesse devem ser clonado amino-terminal para monomérica versões aprimoradas do PCP e YFP. Determinação da FRET é empírica e é extremamente dependente do comprimento de vinculador entre os transmembrana abrangendo região e início do fluoróforo 1. Por conseguinte, várias diferentes comprimentos de linker deve ser explorado para cada par receptor novo sob investigação.
- No pcDNA3.1 R higrómetro ou vetor contendo R neo-C ou monomérico YFP (este vetor pode ser obtido em nosso laboratório), clone seu receptor de interesse para os sites NheI / EcoRI. * Nota-Se necessário, NheI é compatível várias outras enzimas incluindo SPEI e XbaI.
- Transformar a sua reação em uma ligadura recA endA1 apropriado linha de células competentes (que usam rotineiramente Mach1). Colônias de tela para a presença de inserção seguida por seqüenciamento de DNA para verificar a ausência de mutações.
- Após a obtenção de conformação de clonagem molecular de sucesso, prepare-transfecção grade DNA vetor em água esterilizada ou TE usando Qiagen, ou similar kits, DNA. Avaliar a concentração e pureza usando espectroscopia UV. Rendimentos típicos de DNA deve ser na faixa de 100-200 mg, que é rotineiramente diluída para um estoque de trabalho de 1 mg / mL.
2. Transfecção de células EA.hy 926
- Dividir EA.hy 926 células 4, cultivadas em DMEM completo-(DMEM +10% soro fetal bovino + Pen. / Strep.) Em Mattek lamela (n º 0) 35 mm com dois pratos médio mL. Você pode obter conservadora ~ 15 pratos (~ 90% confluentes no dia seguinte) de um prato de 15 centímetros confluentes. Prepare um prato para avaliar a expressão de cada receptor individual, bem como um prato para cada par receptor.
- Permitir que as células para incubar durante a noite em atmosfera de 5% CO 2 a 37 ° C. No dia seguinte, as culturas devem ser confluentes ~ 70-90%.
- No dia da transfecção, preparar os complexos nucleolipid pela mistura de 2 mg de DNA quiméricos receptor vector (2 mL) com 8 mL de Fugene6 em 200 mL de pré-aquecido OptiMEM. Para pares receptor, transfecção com 1 mg de cada receptor, para um total de 2 mg (Veja também a discussão abaixo).
- Misture delicadamente por inversão.
- Continuam a incubar a temperatura ambiente por 30 minutos.
- Durante o período de incubação, preparar as células para transfecção. Aspirar off mídia fresco e lavar cada placa com cuidado e brevemente com PBS quente antes da adição de 2 mL pré-aquecido complete-DMEM sem antibióticos (DMEM + FBS). É importante evitar a presença de penicilina e estreptomicina, como eles são consideravelmente mais tóxico para as células durante o tratamento com Fugene6.
- Adicionar a queda complexo sábio células e incubar por um adicional de 20-24 horas a 37 ° C em uma atmosfera de 5% CO 2.
- Após 24 horas, aspirar cuidadosamente os meios de comunicação das células e pipeta fresco complete-DMEM com antibióticos. Após transfecção, viabilidade celular deverá permanecer relativamente alta, ou seja, pouco ou nenhum células de flutuação devem ser observadas.
- Expressão do gene é tipicamente máxima após um adicional de 48-60 horas após a transfecção. No entanto, imaging é normalmente possível em tão curto quanto 24 horas. Experimentos o tempo do curso para a expressão do gene ideal deve ser realizada.
3. Imagem confocal e FRET Análise
Ao vivo imagens de células é realizada em um TCS-SP2 AOBS Leica microscópio laser confocal equipados com diodo azul (405 nm), Argon (458, 476, 488, 514 nm). HeNe verde (543 nm), laranja HeNe (594 nm) e vermelho HeNe (633 nm) lasers, um HCX PI Apo 63x/1.3 nd lente objetiva de imersão de glicerina, uma motorizada XY palco (Märzhäuser), e um ambiente controlado ( temperatura, umidade e CO 2) estágio incubadora (Pecon). Controles experimentais são fundamentais para eliminar fluoróforo cross-talk entre os canais de emissão, bem como para avaliar as questões de expressão e não-específica multimerization fluoróforo. Como tal, transfections fluoróforo única são utilizados para a criação de cada sessão de imagem. Negativos FRET controles (usando conhecida receptores não interagem) terá de ser realizada, a fim de determinar o fundo FRET que ocorre devido à expressão mais.
- Para eliminar a interferência entre os canais de emissão de PCP e YFP, coloque o controle de expressão PCP na incubadora palco. Usando luz branca, ajustar o Z-prato para se concentrar empara as células.
- Definir as configurações de janela de SP para a detecção de emissão de PCP para 465-505 nm e 525-600 nm para YFP.
- Enquanto monitora dois canais de emissão, excitar o PCP em 458 nm. Usando o AOTF, defina a potência do laser para eliminar sangrar apreciável ao longo do PCP para o canal de emissão YFP. Salvar esta configuração.
- Realizar o mesmo controle para YFP crosstalk (usando o controle de expressão YFP) no canal PCP, ajustando a força de excitação a 514 nm para células que expressam somente YFP. Salvar esta configuração.
- Células próximo lugar co-expressando PCP e YFP na incubadora palco. Utilizando a definição de seqüência para o software Leica confocal, localizar células que expressam níveis semelhantes de PCP e YFP com localização adequada da membrana.
- Usando o software Leica aceitador foto-branqueamento programa, definir as configurações de doador e receptor para o PCP salvos e configurações YFP, respeitável.
- Zoom para a célula, destaque um ROI (região de interesse) em que a foto-destruição de YFP deve ocorrer na membrana celular e iniciar o programa.
- Para a foto-destruição do aceitante, ajustar o AOTF a 100% a 514 nm e permitir que o clareamento a laser para continuar até 70% da emissão YFP foi esgotado. Para acelerar o branqueamento, ROIs escolhidos são tipicamente no eixo de varredura do laser (eixo X).
- Durante foto-branqueamento, monitorar o movimento celular e rejeitar medidas obtidas com o movimento apreciável no plano XY, uma vez que estas medidas podem relatório falso FRET eficiências.
- Imagens pré e pós-bleach são registrados tanto para doadores (PCP) e receptor (YFP) e FRET eficiência é calculado como: FRET Eff = post (D pós-D pre) / D para todos os pós-D> D, onde D pré pre e D pós é a intensidade dos doadores antes e depois fotobranqueamento respectivamente.
- JMP Software (SAS) é usado para determinar a extensão da variabilidade experimental.
4. Resultados representante
Eficiências de transfecção são geralmente entre 30 a 40%. Apesar de descobertas anteriores por outros, não temos visto que a transfecção e expressão de um vetor de favores que do outro. De fato, é freqüente a observação expressão exclusiva de um fluoróforo quimera ou outro. Típico FRET eficiências variam entre os sistemas de receptor. Para o sistema receptor Tie, valores típicos são 20-28% para células epiteliais e 19-23% em células endoteliais. Dos controlos negativos, as eficiências típicas estão abaixo de 2-3%. A extensão da variabilidade irá diminuir consideravelmente com a experiência.
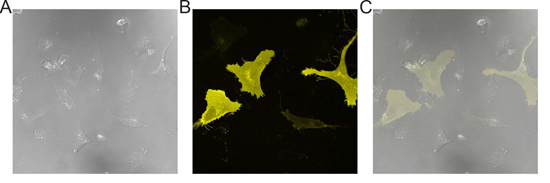
Figura 1. Imagens representativas de 926 células transfectadas EA.hy. Uma imagem) DIC de EA.hy monocamada de células 926. B) imagem de fluorescência de células exibido em (A). C) Sobreposição de (A) e (B) demonstrando a eficiência de transfecção ~ 20-30%.

Figura 2. Aceitador representante foto-branqueamento análise de FRET ocorrendo entre PCP e YFP em uma célula EA.hy926. O PCP de emissão do canal (painéis superiores) e YFP emissão canal (bottom dois painéis) foram monitorados em separado, antes e pós fotobranqueamento aceitador. Fotobranqueamento experimentos foram restritas a, e FRET valores calculados a partir, a região dentro da caixa verde. FRET eficiência é apresentado como uma gama absoluta de alta (red-1.0) para baixo (roxo-0.0) em um overlay ampliado de um CFP / YFP fusão de imagens para fins de orientação apenas.
Discussão
Há várias etapas que são críticos para o sucesso. O mais proeminente entre eles é os níveis relativos de expressão entre os dois receptores quiméricos. Para contornar esse problema, pode-se fazer linhas celulares estáveis expressando ambas as proteínas de interesse, ou identificar média ideal de DNA de vetor para permitir a expressão equivalente. Da mesma forma, devido à não-uniforme transfecção através de um prato, os níveis de proteína raramente será equivalente entre as células. Portanto, a atenção deve ser dada para distinguir 'alta' expressors de 'low'. Aqueles que os níveis "médio" exibição de proteínas normalmente produzem confiável e reprodutível FRET eficiências. Um método nosso laboratório tem desenvolvido para aliviar este problema é o uso de adeno e lenti-vírus para o 'mesmo' a expressão do gene. Além disso, um método alternativo para foto-clareamento aceitador para determinar FRET eficiência é a emissão sensibilizados. Embora, apesar do potencial de emissão sensibilizados para monitorar as células individuais em tempo real, temos encontrado foto-branqueamento aceitador a ser mais sensíveis e mais confiável.
Finalmente, usando FRET para monitorar interações proteína pode ser um desafio, e requer cuidadosa seleção de comprimentos de vinculador para os receptores de membrana ligados. Além disso, a adição de C / YFP muitas vezes influencia os níveis de proteína expressão e de resultados na agregação no retículo endoplasmático e complexo de Golgi. No entanto, para interações transitório ou instável, FRET é a metodologia ideal para utilizar.
Divulgações
Agradecimentos
Gostaríamos de agradecer o Dr. Scott Henderson para ajudar com microscopia confocal. Esta pesquisa foi suportada por concessões do National Institutes of Health 1RO1CA127501 de WAB, bem como o financiamento de projectos-piloto a partir do Centro de Câncer Massey e Faculdade de Medicina (VCU) para Microscopia WAB foi realizada na VCU-Dept. Facilidade de Neurobiologia e Anatomia Microscopia, apoiado, em parte, com financiamento do Centro de NIHNINDS núcleo conceder 5P30NS047463.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11960-069 | |
| Penicillin- Streptomycin | Invitrogen | 15070-063 | |
| Fetal Bovine Serum | Hyclone | N/A | |
| Opti-MEM | Invitrogen | 11058-021 | |
| FUGENE 6 | Roche Group | 11814443001 | |
| Coverslip Dishes | MatTek Corp. | P35G014C | |
| pcDNA3.1(+) | Invitrogen | V790‐20 | |
| Mach 1 Competent Cells | Invitrogen | C862003 |
Referências
- Kim, M., Carman, C. V., Springer, T. A. Bidirectional transmembrane signaling by cytoplasmic domain separation in integrins. Science. 301, 1720-1725 (2003).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipidmodified monomeric GFPs into membrane microdomains of live cells. Science. 296, 913-916 (2002).
- Seegar, T. C. M., Eller, B., Tzvetkova-Robev, D., Kolev, M., Henderson, S. C., Nikolov, D. B., Barton, W. A. Tie1-Tie2 interactions mediate functional differences between angiopoietin ligands. Molecular Cell. 37 (5), 643-655 (2010).
- Edgell, C. J., McDonald, C. C., Graham, J. B. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc Natl Acad Sci U S A. 80 (12), 3734-3737 (1983).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados