Method Article
イメージングタンパク質間相互作用 in vivoで
要約
このプロトコルは、FRETに基づく近接アッセイを使用してどのようにイメージタンパク質間相互作用について説明します。
要約
タンパク質 - タンパク質相互作用はすべての本質的な細胞プロセスの特徴です。しかし、これらの相互作用の多くはそのような共免疫沈降法などの従来の生化学的手法でその識別と分析を防止する、一過性、または精力的に弱いです。この点では、遺伝的にコード化可能蛍光タンパク質(GFP、RFPなど)とそれに関連付けられた重複する蛍光スペクトルは、フェルスター共鳴エネルギー移動(FRET)1-3を用いて生体内で弱い相互作用を監視するために我々の能力に革命をもたらしています。ここで、我々は詳細内皮細胞表面上の受容体 - 受容体相互作用を監視するためのFRETに基づく近接アッセイの使用量を。
プロトコル
プロトコルは、次の3つの主要手順で構成されています。 CFP及び/またはYFPの単量体のバージョンへのアミノ末端哺乳類発現ベクターに目的遺伝子の最初の、ステップクローニングにのみ簡単に説明します。 2番目と3番目の手順は、FRETを持つEA.hy926内皮細胞へのベクターのDNAのトランスフェクション、および共焦点イメージング、以下でもっと詳しく説明されています。
1。 CFPとYFPキメラ受容体の構築
興味の受容体は、CFPとYFPの単量体の強化バージョンにアミノ末端クローニングすることがあります。 FRETの決定は経験的であり、蛍光体1の膜貫通領域と開始の間のリンカーの長さに大きく依存です。したがって、リンカのいくつかの異なる長さを調査中のそれぞれの新しい受容体のペアのために検討する必要があります。
- 単量体のC -またはYFPを(このベクトルは私たちの研究室から入手可能)を含むであるpcDNA3.1 hygro RまたはネオRベクターに 、NheI部位/ EcoRI部位に興味のある受容体のクローンを作成する。 *注:必要に応じて、NheI部位をSpeIとXbaIでを含む互換性のあるいくつかの他の酵素である。
- 適切なendA1 recAのコンピテントセルの行(我々が日常的にMACH1を使用する)にあなたのライゲーション反応を変換する。変異の有無を確認するためにDNA配列決定に続いて、挿入の有無を画面のコロニー。
- 成功した分子クローニングのコンフォメーションを取得後、キアゲン社、または類似の、DNAのキットを使用して滅菌水やTEでトランスフェクショングレードのベクターDNAを準備する。 UV分光法を用いて濃縮し、純度を評価する。 DNAの典型的な収量は、日常の1μg/μLの作業用ストックに希釈して100から200μgの範囲内でなければなりません。
2。 EA.hy 926細胞のトランスフェクション
- マテックカバースリップ(№0)を2mLの培地で35 mmディッシュに完全な- DMEM(DMEM +10%ウシ胎児血清+ Pen. /連鎖球菌。)で成長させたEA.hy 926セル4を 、分割。あなたは控えめに15センチメートルコンフルエント皿から〜15皿(〜90%コンフルエントに翌日)を取得することができます。個々の受容体の発現だけでなく、各受容体のペアのための一皿を評価するための一皿を準備します。
- 細胞は37℃、5%CO 2雰囲気下で一晩インキュベートすることができます℃に翌日、培養物は、〜70〜90%コンフルエントにする必要があります。
- トランスフェクション当日に、予め温めておいたOPTIMEM 200μLのFugene6 8μLでキメラ受容体のベクターDNA(2μL)2μgを混合することによりnucleolipid複合体を準備する。受容体のペアの場合は、2μgの(また、以下の説明を参照)の合計については、各受容体の1μgのフェ。
- 静かに転倒混和します。
- 30分間室温でインキュベートし続ける。
- 潜伏期間中に、トランスフェクションのためにセルを準備します。新鮮な培地をオフに吸引し、抗生物質を含まない2mLの予め温めておいた完全な- DMEM(DMEM + FBS)を添加する前に温かいPBSで穏やかにし、簡単に各プレートを洗浄する。彼らはFugene6による治療中にかなり多くの有毒な細胞になるとして、ペニシリンとストレプトマイシンの存在を避けることが重要です。
- 細胞への賢明な複雑なドロップを追加し、37℃で、追加の20〜24時間インキュベート℃、5%CO 2雰囲気でCを。
- 24時間後、慎重に抗生物質を持つ細胞とピペット新鮮な完全な- DMEMから培地を吸引除去する。トランスフェクション後、細胞生存率が比較的高いままにする、無浮遊細胞にはほとんどが観察されるべきである、すなわち。
- 遺伝子発現は、追加の48から60時間後にトランスフェクション後、通常は最大です。しかし、画像は24時間可能な限り短く、一般的に実現可能です。最適な遺伝子発現のタイムコース実験を実行する必要があります。
3。共焦点イメージングとFRETの解析
ライブセルイメージングは青色ダイオード(波長405nm)、アルゴン(458、476、488、514 nm)を装備したライカTCS - SP2 AOBS共焦点レーザー走査型顕微鏡で実行されます。グリーンHeNeレーザ(543 nm)を、オレンジ色のヘリウムネオン(594 nm)、および赤色ヘリウムネオン(633 nm)のレーザー、HCX PIアポ63x/1.3 NAグリセリン浸対物レンズ、電動XYステージ(Märzhäuser)、及び環境制御(温度、湿度、およびCO 2)ステージインキュベーター(PeCon)。実験的なコントロールには、蛍光体の発光チャネルと同様に評価する式の問題や非特異的蛍光体の多量体間のクロストークを除去するために重要です。このように、単一の蛍光体のトランスフェクションは、すべての画像のセッションをセットアップするために利用されています。負の(既知のnoninteracting受容体を使用して)コントロールをFRETは、過剰発現が原因で発生するそのFRETのバックグラウンドを決定するために、実行する必要があります。
- CFPとYFPの排出チャンネル間のクロストークを排除するために、ステージインキュベーターにCFP発現のコントロールを配置します。白色光を使用して、に焦点を当てるZ -プレートを調整細胞へ。
- 465から505 nmおよび525から600 nmのYFPへのCFPの発光検出のためにSPのウィンドウの設定を行います。
- 両方の放出チャネルを監視しながら、458 nmのCFPを励起する。 AOTFを使用し、YFPの放出チャネルにCFPの上のかなりの出血を除去するためにレーザパワーを設定します。この設定を保存します。
- のみYFPを発現する細胞は514 nmで励起パワーを調整することによって、CFPのチャネルでYFPクロストーク(YFPの発現制御を使用して)に対して同じ制御を行います。この設定を保存します。
- 次の場所細胞ステージインキュベーターにCFPとYFPを共発現。ライカ共焦点のソフトウェアのための順序設定を使用して、適切な膜局在化とCFPとYFPの同様なレベルを発現する細胞を見つけます。
- ライカのソフトウェアのアクセプターフォトブリーチングプログラムを使用して、立派に、保存したCFPとYFPの設定にドナーとアクセプターの設定を設定します。
- セルにドラッグズーム、YFPの写真破壊が細胞膜で発生し、プログラムを開始することになっているROI(関心領域)を強調表示します。
- アクセプターの光破壊の場合は、514 nmで100%にAOTFを調整し、YFPの排出量の70%が枯渇されるまで継続する漂白レーザーを許可する。漂白加速させるために、ROIは通常、レーザーのラスターの軸(X軸)に選ばれている。
- これらの測定値が偽のFRETの効率を報告できるように光退色時には、細胞の動きを監視し、XY平面でかなりの運動で得られた測定値を拒否する。
- 事前事後の漂白剤のイメージはドナー(CFP)とアクセプター(YFP)の両方に記録し、効率は次のように計算されますFRETがされています:すべてのD のポスト > D プリ D より前のためEffが =(D 後 D プリ )/ D 後のFRETとD のポストは前に、それぞれ光退色後のドナーの強度です。
- JMPソフトウェア(SAS)は、実験的なばらつきの程度を決定するために使用されます。
4。代表的な結果
トランスフェクション効率は30〜40%の間、通常です。他のユーザーがこれまでの知見にもかかわらず、我々は一つのベクターのトランスフェクションと発現が、他のことを支持すること見ていない。実際、我々は頻繁にキメラまたはもう一つ蛍光団の排他的な発現を観察。典型的には効率が受容体のシステム間で異なるFRETの。タイ受容体システムの場合、典型的な値は、上皮細胞のための20から28パーセントと内皮細胞の19から23パーセントです。陰性コントロールの場合、典型的な効率は以下の2から3パーセントです。ばらつきの程度は、経験を大幅に減少します。
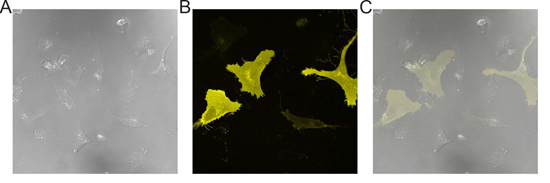
図1。トランスフェクトEA.hy 926細胞の代表的な画像。EA.hy 926細胞単層の)DIC画像。 B)に表示されているセル()の蛍光画像を。のC)オーバーレイ()と(B)〜20-30%のトランスフェクション効率を実証。

図2。代表的な受容体は、EA.hy926セルにCFPとYFPの間で発生するFRETの解析を光退色。CFP放出チャネル(上部パネル)とYFP放出チャネル(下の2パネル)には、事前に別々に監視し、後のアクセプターが退色した。退色実験に限定され、緑色のボックス内の領域、から計算された値のFRETていた。 FRETの効率は、オリエンテーションの目的のために画像をマージCFP / YFPの拡大オーバーレイの低(紫- 0.0)に高いから絶対的な範囲(赤- 1.0)として表示されます。
ディスカッション
成功への重要ないくつかのステップがあります。その中で最も顕著には2つのキメラ受容体間の発現の相対的なレベルです。この問題を回避するためには、関心の両方のタンパク質を発現する安定細胞株を作る、または同等の発現を可能にするベクターDNAの最適な比率を識別することができる。同様に、料理全体で不均一なトランスフェクションのために、タンパク質レベルではほとんどの細胞の間で同等できなくなります。そのため、注目は"低"から"ハイ"expressorsを区別するために支払わなければなりません。タンパク質の表示"平均的"レベルは、通常、信頼性と再現性が得られること、それらは効率のFRET。私たちの研究室ではこの問題を緩和するために追求してきた一つの方法は、'even'は遺伝子発現へのアデノとレンティ-ウイルスの使用です。また、アクセプターフォトブリーチングを決定するための代替方法では効率が感作された排出であるFRETの。されているとはいえ、リアルタイムで単一のセルを監視するために増感発光の可能性にもかかわらず、我々はアクセプターフォトブリーチングより高感度と信頼性が高いことがを発見した。
最後に、タンパク質相互作用を監視するためのFRETの使用は困難な場合、および膜結合型受容体のためのリンカーの長さを慎重に選択する必要がありますすることができます。さらに、C / YFPの加算は、しばしば非常に小胞体とゴルジ体に集約におけるタンパク質の発現レベルとの結果に影響を与えます。しかし、一時的な、または不安定な相互作用のために、FRETは、利用することが理想的な方法論です。
開示事項
謝辞
我々は、共焦点顕微鏡との助けのために博士スコットヘンダーソンの認知を行う予定。この研究は、医学のマジーがんセンターと学校(VCU)からWABの顕微鏡へのWABへの保健1RO1CA127501の国立研究所からの補助金だけでなく、パイロットプロジェクトの資金調達によってサポートされていましたVCU - DEPTで行われました。 NIHNINDSセンターコアグラント5P30NS047463からの資金で、一部では、サポートされている神経生物学と解剖顕微鏡施設、の。
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11960-069 | |
| Penicillin- Streptomycin | Invitrogen | 15070-063 | |
| Fetal Bovine Serum | Hyclone | N/A | |
| Opti-MEM | Invitrogen | 11058-021 | |
| FUGENE 6 | Roche Group | 11814443001 | |
| Coverslip Dishes | MatTek Corp. | P35G014C | |
| pcDNA3.1(+) | Invitrogen | V790‐20 | |
| Mach 1 Competent Cells | Invitrogen | C862003 |
参考文献
- Kim, M., Carman, C. V., Springer, T. A. Bidirectional transmembrane signaling by cytoplasmic domain separation in integrins. Science. 301, 1720-1725 (2003).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipidmodified monomeric GFPs into membrane microdomains of live cells. Science. 296, 913-916 (2002).
- Seegar, T. C. M., Eller, B., Tzvetkova-Robev, D., Kolev, M., Henderson, S. C., Nikolov, D. B., Barton, W. A. Tie1-Tie2 interactions mediate functional differences between angiopoietin ligands. Molecular Cell. 37 (5), 643-655 (2010).
- Edgell, C. J., McDonald, C. C., Graham, J. B. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc Natl Acad Sci U S A. 80 (12), 3734-3737 (1983).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved