Method Article
Imaging interazioni proteina-proteina In vivo
In questo articolo
Riepilogo
Questo protocollo descrive come immagine interazioni proteina-proteina mediante un saggio basato su FRET prossimità.
Abstract
Interazioni proteina-proteina sono una caratteristica di tutti i processi cellulari fondamentali. Tuttavia, molte di queste interazioni sono transitori, o energeticamente deboli, impedendo la loro identificazione e analisi attraverso i tradizionali metodi biochimici come la co-immunoprecipitazione. A questo proposito, le proteine geneticamente codificabili fluorescente (GFP, RFP, ecc) e le loro associate sovrapposizione spettro di fluorescenza hanno rivoluzionato la nostra capacità di monitorare le interazioni deboli in vivo, utilizzando Förster trasferimento di energia di risonanza (FRET) 1-3. Qui, noi dettaglio il nostro uso di un saggio basato su FRET di prossimità per il monitoraggio recettore-recettore sulla superficie delle cellule endoteliali.
Protocollo
Il protocollo si compone di tre fasi principali. Il primo, la clonazione fase del gene di interesse in un vettore di espressione mammifero amino-terminale per le versioni monomerico della PCP e / o YFP sarà solo discusso brevemente. I passi secondo e terzo; trasfezione di DNA vettore in EA.hy926 cellule endoteliali, e di imaging confocale con FRET, sono descritti più approfonditamente di seguito.
1. Costruzione di recettori PCP e YFP Chimerico
Recettori di interesse dovrebbero essere clonato amino-terminale di monomerico versioni avanzate dei CFP e YFP. Determinazione del FRET è empirica e critica è dipende dalla lunghezza del linker tra i transmembrana spanning regione e inizio del fluoroforo 1. Pertanto diverse lunghezze differenti linker deve essere esplorata per ogni coppia recettore nuovo sotto inchiesta.
- Nel hygro pcDNA3.1 R o neo vettore R contenente monomerica C o YFP (questo vettore può essere ottenuto dal nostro laboratorio), il tuo clone del recettore di interesse nel NheI / EcoRI siti. * Nota: se necessario, NheI è compatibile enzimi diversi altri tra cui SpeI e XbaI.
- Trasforma la tua reazione legatura in una appropriata linea cellulare endA1 recA competenti (si usano abitualmente Mach1). Colonie schermo per la presenza di inserire seguita da sequenziamento del DNA per verificare l'assenza di mutazioni.
- All'ottenimento conformazione di successo della clonazione molecolare, preparare trasfezione-grade vettore di DNA in acqua sterilizzata o TE utilizzando Qiagen, o simili, kit del DNA. Valutare la concentrazione e la purezza utilizzando la spettroscopia UV. Le rese del DNA dovrebbe essere nel range di 100-200 mg, che viene normalmente diluito a uno stock di lavoro di 1 mg / mL.
2. Trasfezione delle cellule EA.hy 926
- Split EA.hy 926 celle 4, coltivate in DMEM completo-(DMEM +10% siero fetale bovino + Pen. / Strep.) In MatTek coprioggetto (n. 0) 35 piatti mm con 2 ml di mezzo. Si può ottenere conservativo ~ 15 piatti (~ 90% confluenti del giorno successivo) da un piatto di 15 centimetri confluenti. Preparare un piatto di valutare l'espressione del recettore di ogni individuo, così come un piatto per ogni coppia recettore.
- Permettono alle cellule di incubare una notte in 5% CO 2 nell'atmosfera a 37 ° C. Il giorno seguente, le colture dovrebbero essere confluenti ~ 70-90%.
- Il giorno della transfezione, preparare i complessi nucleolipid mescolando 2 mg di DNA chimerico vettore recettore (2 mL) con 8 ml di Fugene6 in 200 ml di pre-riscaldato OptiMEM. Per le coppie di recettori, trasfezione con 1 mg di ogni recettore, per un totale di 2 mg (Vedi anche la discussione sotto).
- Mescolare delicatamente per inversione.
- Continuare a incubare a temperatura ambiente per 30 minuti.
- Durante il periodo di incubazione, preparare le cellule per la trasfezione. Aspirare off mezzi freschi e lavare ogni piastra delicatamente e brevemente con PBS caldo prima l'aggiunta di 2 ml preriscaldata completa-DMEM senza antibiotici (DMEM + FBS). E 'importante evitare la presenza di penicillina e streptomicina, in quanto sono molto più tossici per le cellule durante il trattamento con Fugene6.
- Aggiungere la goccia complesso saggio cellule e incubare per ulteriori 20-24 ore a 37 ° C in un 5% di CO 2 nell'atmosfera.
- Dopo 24 ore, con attenzione ai media di aspirare le cellule e pipetta fresca completa-DMEM con antibiotici. A seguito di trasfezione, la vitalità cellulare dovrebbe rimanere relativamente alti, cioè poco o nessun cellule galleggianti devono essere osservati.
- L'espressione genica è tipicamente massima dopo un ulteriore 48-60 ore dopo la trasfezione. Tuttavia, l'imaging è solitamente possibile nel più breve di 24 ore. Esperimenti di durata del corso per l'espressione genica ottimale dovrebbe essere eseguita.
3. Imaging confocale e analisi FRET
Vivere l'imaging cellulare è eseguita su un TCS-SP2 laser Leica AOBS microscopio confocale a scansione dotato di diodo blu (405 nm), argon (458, 476, 488, 514 nm). HeNe verde (543 nm), arancio HeNe (594 nm), e rosso HeNe (633 nm), un HCX PI Apo 63x/1.3 na glicerina-immersion lente dell'obiettivo, un motorizzato XY (Märzhäuser), e un ambiente controllato ( temperatura, umidità e CO 2) fase di incubatore (Pecon). Controlli sperimentali sono fondamentali per eliminare fluoroforo cross-talk tra i canali di emissione, nonché per valutare i problemi di espressione e non specifici multimerization fluoroforo. Come tale, trasfezioni fluoroforo singole sono utilizzate per l'impostazione di ogni sessione di immagine. Negativo FRET controlli (con nota recettori non interagenti) dovranno essere eseguite, al fine di determinare lo sfondo FRET che si verifica a causa di espressione oltre.
- Per eliminare le interferenze tra i canali di emissione per PCP e YFP, posizionare il controllo della PCP espressione nell'incubatore palco. Utilizzando luce bianca, regolare la Z-piastra di concentrarsi sullaalle cellule.
- Impostare la finestra delle impostazioni SP per il rilevamento delle emissioni di PCP a 465-505 nm e YFP di 525-600 nm.
- Tenendo sotto controllo i due canali di emissione, eccitare la PCP a 458 nm. Utilizzando il AOTF, impostare la potenza del laser per eliminare sanguinare apprezzabile rispetto della politica comune della pesca nel canale di emissione YFP. Salva questa impostazione.
- Eseguire lo stesso controllo per YFP crosstalk (utilizzando il controllo YFP espressione) nel canale PCP regolando la potenza di eccitazione a 514 nm per le cellule che esprimono YFP solo. Salva questa impostazione.
- Cellule prossimo luogo co-esprimono PCP e YFP nell'incubatore palco. Utilizzando l'impostazione sequenza per il software Leica confocale, individuare cellule che esprimono livelli simili di PCP e YFP con la localizzazione di membrana adeguato.
- Utilizzando il software Leica accettore fotometabolismo programma, configurare le impostazioni di donatore e accettore al CFP salvate e le impostazioni YFP, rispettabile.
- Zoom sul cellulare, evidenzia un ROI (regione di interesse) in cui la foto-distruzione di YFP deve avvenire sulla membrana cellulare e avviare il programma.
- Per foto-distruzione del accettore, regolare il AOTF al 100% a 514 nm e consentono il laser sbiancante per continuare fino al 70% delle emissioni di YFP è stato impoverito. Per accelerare il candeggio, ROI sono scelti tipicamente nell'asse raster del laser (asse X).
- Durante fotometabolismo, monitorare il movimento cellulare e rifiutare misurazioni ottenute con il movimento apprezzabile nel piano XY, in quanto tali misure possono rapporto falso FRET efficienza.
- Immagini pre-e post-candeggina sono registrati sia per i donatori (PCP) e accettore (YFP) e FRET efficienza viene calcolata come: FRET Eff = (D post-D pre) / D post per tutti i messaggi D> D dove D pre pre e D post è l'intensità donatore prima e dopo photobleaching rispettivamente.
- Software JMP (SAS) è usato per determinare il grado di variabilità sperimentale.
4. Rappresentante Risultati
Efficienze di trasfezione sono di solito tra il 30 e il 40%. Nonostante i risultati precedenti da altri, non abbiamo visto che la trasfezione ed espressione di un vettore favorisce quella degli altri. Anzi, spesso ci osservano espressione esclusiva di una fluoroforo chimera o l'altro. Tipico FRET efficienze variano tra sistemi recettoriali. Per il sistema recettore Tie, valori tipici sono 20-28% per le cellule epiteliali e 19-23% nelle cellule endoteliali. Per i controlli negativi, l'efficienza tipica sono al di sotto del 2-3%. Il grado di variabilità si riduce notevolmente con l'esperienza.
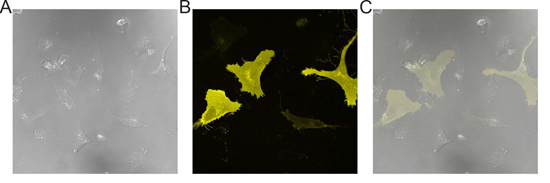
Figura 1. Immagini rappresentative del transfettate EA.hy 926 cellule. A) immagine DIC di EA.hy 926 monostrato cellulare. B) l'immagine di fluorescenza di cellule visualizzati in (A). C) Sovrapposizione di (A) e (B) che dimostrano l'efficienza di trasfezione ~ 20-30%.

Figura 2. Accettore rappresentante fotometabolismo analisi di FRET si verificano tra CFP e YFP in una cella EA.hy926. La PCP emissione canale (pannelli in alto) e YFP emissione di canale (in basso due pannelli) sono stati monitorati separatamente, prima e dopo photobleaching accettore. Fotodecolorazione esperimenti sono stati limitati a, e FRET valori calcolati da, la regione all'interno della scatola verde. FRET efficienza viene visualizzato come un campo da assoluto alto (rosso-1.0) a bassa (viola-0.0) su una sovrapposizione ingrandita di una PCP / YFP fusa immagine a scopo orientativo solo.
Discussione
Ci sono diversi passaggi che sono cruciali per il successo. Il più importante tra questi è il livello relativo di espressione tra i due recettori chimerici. Per aggirare questo problema, si può fare linee cellulari stabili che esprimono entrambe le proteine di interesse, o identificare i rapporti ottimali di DNA vettore per consentire l'espressione equivalente. Allo stesso modo, a causa della non uniforme transfezione in un piatto, i livelli di proteina sarà raramente equivalente tra le cellule. Pertanto, si deve fare attenzione a distinguere 'alta' expressors dal 'basso'. Quelli che i livelli di 'medio' di visualizzazione di proteine tipicamente resa affidabile e riproducibile FRET efficienza. Un metodo nostro laboratorio ha perseguito per alleviare questo problema è l'uso di adeno-virus e Lenti a 'anche' l'espressione genica. Inoltre, un metodo alternativo per accettore fotometabolismo per determinare l'efficienza FRET è emissione sensibilizzata. Anche se, nonostante il potenziale di emissione sensibilizzati a controllare singole cellule in tempo reale, abbiamo trovato accettore fotometabolismo ad essere più sensibili e più affidabile.
Infine, utilizzando FRET di monitorare le interazioni proteina può essere impegnativo, e richiede una attenta selezione delle lunghezze linker per i recettori di membrana legato. Inoltre, l'aggiunta di C / YFP spesso influenza notevolmente i livelli di espressione della proteina e si traduce in aggregazione nel reticolo endoplasmatico e apparato di Golgi. Tuttavia, per le interazioni transitori o instabile,, FRET è la metodologia ideale da utilizzare.
Divulgazioni
Riconoscimenti
Vogliamo riconoscere il dottor Scott Henderson per un aiuto con microscopia confocale. Questa ricerca è stata sostenuta dalle concessioni dal National Institutes of Health 1RO1CA127501 a WAB, nonché al progetto di finanziamento pilota della Massey Cancer Center e la Scuola di Medicina (VCU) a Microscopia WAB è stato eseguito presso il VCU-Dipartimento. di Neurobiologia e Microscopia Fondo Anatomia, sostenuta, in parte, con il finanziamento NIHNINDS Centro nucleo concedere 5P30NS047463.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11960-069 | |
| Penicillin- Streptomycin | Invitrogen | 15070-063 | |
| Fetal Bovine Serum | Hyclone | N/A | |
| Opti-MEM | Invitrogen | 11058-021 | |
| FUGENE 6 | Roche Group | 11814443001 | |
| Coverslip Dishes | MatTek Corp. | P35G014C | |
| pcDNA3.1(+) | Invitrogen | V790‐20 | |
| Mach 1 Competent Cells | Invitrogen | C862003 |
Riferimenti
- Kim, M., Carman, C. V., Springer, T. A. Bidirectional transmembrane signaling by cytoplasmic domain separation in integrins. Science. 301, 1720-1725 (2003).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipidmodified monomeric GFPs into membrane microdomains of live cells. Science. 296, 913-916 (2002).
- Seegar, T. C. M., Eller, B., Tzvetkova-Robev, D., Kolev, M., Henderson, S. C., Nikolov, D. B., Barton, W. A. Tie1-Tie2 interactions mediate functional differences between angiopoietin ligands. Molecular Cell. 37 (5), 643-655 (2010).
- Edgell, C. J., McDonald, C. C., Graham, J. B. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc Natl Acad Sci U S A. 80 (12), 3734-3737 (1983).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon