Method Article
Imágenes de interacciones proteína-proteína In vivo
En este artículo
Resumen
Este protocolo describe cómo la imagen de interacciones proteína-proteína mediante un ensayo basado en la proximidad FRET.
Resumen
Interacciones proteína-proteína son un sello distintivo de todos los procesos celulares esenciales. Sin embargo, muchas de estas interacciones son transitorios, o débil energía, la prevención de su identificación y el análisis a través de tradicionales métodos bioquímicos, como co-inmunoprecipitación. En este sentido, las proteínas fluorescentes genéticamente codificable (GFP, RFP, etc) y sus asociados se superponen espectro de fluorescencia han revolucionado nuestra capacidad de monitorear las interacciones débiles en vivo con la transferencia de energía por resonancia de Förster (FRET) 1-3. Aquí, le detallamos el uso de un ensayo de proximidad FRET para el monitoreo del receptor de los receptores de las interacciones en la superficie de las células endoteliales.
Protocolo
El protocolo consta de tres pasos principales. La primera clonación, los pasos de su gen de interés en un vector de expresión de mamíferos amino-terminal de las versiones de monómero de la PPC y / o YFP sólo se discutirán brevemente. Los pasos segundo y tercero, la transfección de ADN vector en EA.hy926 las células endoteliales, y la imagen confocal con FRET, se describen con más detalle a continuación.
1. La construcción de los receptores PPC y YFP quiméricos
Receptores de interés debe ser clonado amino-terminal de monómero versiones mejoradas de la PPC y YFP. Determinación de FRET es empírica y depende fundamentalmente de la longitud del enlazador entre la transmembrana que abarca la región y el inicio de la fluoróforo 1. Por lo tanto, diferentes longitudes de enlazador debe ser explorado para cada par de receptores de nuevo bajo investigación.
- En la R pcDNA3.1 Hygro o neo vector R que contiene monómero C-o YFP (este vector se puede obtener de nuestro laboratorio), el clon de su receptor de interés en los sitios NheI / EcoRI. * Nota: Si es necesario, NheI es compatible varias enzimas incluyendo otros SpeI y XbaI.
- Transforme su reacción de ligación en una adecuada línea de células endA1 Reca competente (nosotros usamos Mach1). Colonias de detectar la presencia de Insert seguida de la secuenciación del ADN para verificar la ausencia de las mutaciones.
- Tras la obtención de la conformación de la clonación molecular éxito, preparar la transfección de grado vector de ADN en agua esterilizada o TE utilizando Qiagen, o kits similares, el ADN. Evaluar la concentración y la pureza utilizando espectrometría UV. Los rendimientos típicos de ADN debe estar en el rango de 100-200 mg, que es habitualmente diluida a una solución de trabajo de 1 mg / mL.
2. La transfección de células EA.hy 926
- Dividir EA.hy 926 células 4, que se cultiva en total-DMEM (DMEM +10% de suero fetal bovino + pen. / Strep.) En MatTek cubreobjetos (N º 0) 35 mm platos con 2 ml de medio. Usted puede obtener de forma conservadora ~ 15 platos (~ 90% confluentes al día siguiente) de un plato de 15 cm confluente. Preparar un plato para evaluar la expresión de cada receptor individual, así como un plato para cada par de los receptores.
- Permitir que las células se incuban durante la noche en el 5% atmósfera de CO 2 a 37 ° C. Al día siguiente, las culturas deben ser confluentes ~ 70-90%.
- En el día de la transfección, preparar los complejos nucleolipid mediante la mezcla de 2 g de ADN de los receptores de vectores quiméricos (2 l) con 8 L de Fugene6 en 200 l de pre-calentado OptiMEM. Para los pares de receptores, transfectar con 1 g de cada receptor, para un total de 2 mg (ver también más adelante).
- Mezclar suavemente por inversión.
- Continuar a incubar a temperatura ambiente durante 30 minutos.
- Durante el período de incubación, preparar las células para la transfección. Aspirar fuera de los medios de comunicación fresca y lave cada plato suave y brevemente con PBS caliente antes de la adición de 2 ml precalentado completa-DMEM sin antibióticos (DMEM + FBS). Es importante evitar la presencia de penicilina y estreptomicina, ya que son mucho más tóxicos para las células durante el tratamiento con Fugene6.
- Añadir la caída complejo sabio a las células e incubar durante otros 20 a 24 horas a 37 ° C en un 5% de CO2 la atmósfera.
- Después de 24 horas, con cuidado aspirar los medios de comunicación de las células y pipeta nueva completa-DMEM con antibióticos. Después de la transfección, la viabilidad celular se mantienen relativamente altos, es decir, poco o nada de las células flotantes deben ser observados.
- La expresión de genes es por lo general después de un máximo adicional de 48-60 horas después de la transfección. Sin embargo, la imagen suele ser factible en tan corto como 24 horas. Experimentos de tiempo de los cursos de la expresión génica óptima debe ser realizada.
3. Imagen confocal y análisis de FRET
En vivo de imágenes de células se realiza en una Leica TCS-SP2 microscopio láser confocal de barrido AOBS equipada con diodo azul (405 nm), argón (458, 476, 488, 514 nm). verde HeNe (543 nm), naranja HeNe (594 nm) y rojo HeNe (633 nm), un HCX PI Apo 63x/1.3 na glicerina lente objetivo de inmersión, una motorizada XY etapa (Märzhäuser), y un control del medio ambiente ( temperatura, humedad y CO 2) incubadora (PECON). Controles experimentales son fundamentales para eliminar fluoróforo diafonía entre los canales de emisión, así como para evaluar los problemas de expresión y no específicos multimerización fluoróforo. Como tal, transfecciones único fluoróforo se utilizan para la creación de cada sesión de imagen. FRET controles negativos (no interactúan con los receptores conocidos) tendrá que llevarse a cabo, con el fin de determinar el fondo, temen que se produce debido a la sobre-expresión.
- Para eliminar la diafonía entre los canales de emisión de la PPC y YFP, coloque el control de la expresión política pesquera común en la incubadora etapa. Con luz blanca, ajustar la placa Z-para centrarse ena las células.
- Establecer la configuración de SP ventana para la detección de emisión de 465-505 nm para PPC y YFP a 525-600 nm.
- Durante la supervisión de los dos canales de emisión, excitar la PPC a 458 nm. Utilizando el AOTF, ajustar la potencia de láser para eliminar el sangrado apreciable sobre la PPC en el canal de emisión de YFP. Guardar esta configuración.
- Realizar el mismo control para YFP crosstalk (usando el control de la expresión YFP) en el canal de la PPC mediante el ajuste de la potencia de excitación a 514 nm de las células que expresan sólo YFP. Guardar esta configuración.
- Celdas contiguas a cabo co-expresando PPC y YFP en la incubadora etapa. Uso de la secuencia de configuración para el software de Leica confocal, localizar las células que expresan niveles similares de la PPC y YFP con la localización de la membrana apropiada.
- Utilizando el software Leica aceptor foto-blanqueamiento del programa, establecer la configuración de donante y el receptor de la PPC guardados y las configuraciones YFP, respetable.
- Zoom de las células, resalte un ROI (región de interés) en el que la foto-destrucción de YFP se va a producir en la membrana celular y comenzar el programa.
- Para la foto-destrucción del aceptante, ajustar el AOTF al 100% a 514 nm y permitir que el blanqueamiento con láser para continuar hasta el 70% de la emisión YFP se ha agotado. Para acelerar la decoloración, rendimiento de la inversión son por lo general elegido en el eje de la trama láser (eje X).
- En la foto-blanqueamiento, vigilar el movimiento celular y rechazar las mediciones obtenidas con el movimiento apreciable en el plano XY, ya que estas medidas pueden reportar falsos FRET eficiencia.
- Imágenes pre-y post-cloro-se registran para el donante (PPC) y aceptor (YFP) y FRET eficiencia se calcula como: FRET Ef = (D post-D pre) / D después de todos los mensajes D> D donde D pre pre y D no está en la intensidad de los donantes antes y después de photobleaching respectivamente.
- El software JMP (SAS) se utiliza para determinar el grado de variabilidad experimental.
4. Resultados representante
Eficiencia de transfección son por lo general entre 30 a 40%. A pesar de los resultados anteriores por otros, no hemos visto que la transfección y la expresión de un vector a favor de la otra. De hecho, es frecuente observar la expresión exclusiva de un fluoróforo quimera o la otra. FRET eficiencia típica varían entre los sistemas de receptor. Para que el sistema receptor Tie, valores típicos son 20-28% de las células epiteliales y 19-23% en las células endoteliales. Para los controles negativos, las eficiencias típicas están por debajo de 2.3%. El grado de variabilidad se reducirá considerablemente con la experiencia.
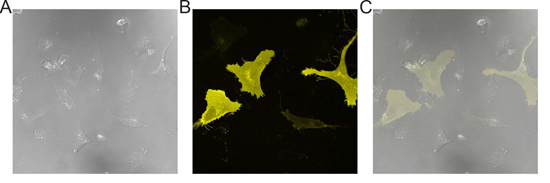
Figura 1. Imágenes representativas de las células transfectadas EA.hy 926. A la imagen) DIC de monocapa celular EA.hy 926. B) Imagen de fluorescencia de células se muestra en (A). C) Superposición de (A) y (B) que demuestra la eficiencia ~ 20-30% de transfección.

Figura 2. Aceptor representante foto-blanqueamiento análisis de FRET se produce entre PPC y YFP en una celda de EA.hy926. El PPC de emisión del canal (paneles superiores) y YFP emisión de canales (dos paneles inferiores) se efectuará por separado antes y después de photobleaching aceptor. Photobleaching experimentos se limitaron a, y FRET valores calculados de la región dentro de la caja verde. FRET eficiencia se muestra como un rango absoluto de alta (rojo-1.0) a baja (púrpura-0.0) en una plantilla ampliada de un PPC / YFP fusión de imágenes con fines de orientación únicamente.
Discusión
Hay varios pasos que son críticos para el éxito. El más destacado entre ellos es el nivel relativo de expresión entre los dos receptores quiméricos. Para evitar este problema, uno puede hacer que las líneas celulares estables que expresan tanto las proteínas de interés, o identificar proporciones óptimas de vector de ADN para permitir la expresión equivalente. Del mismo modo, debido a la falta de uniformidad de la transfección a través de una antena, los niveles de proteína rara vez será equivalente entre las células. Por lo tanto, se debe prestar atención para distinguir "alto" expresores de "baja". Los que los niveles "promedio" de visualización de proteínas por lo general el rendimiento fiable y reproducible FRET eficiencia. Uno de los métodos nuestro laboratorio ha llevado a cabo para aliviar este problema es el uso de adenovirus y los virus lenti-a la expresión génica ", incluso". Además, un método alternativo para la foto-receptor de blanqueo para la determinación de la eficiencia de FRET es la emisión sensibilizada. Aunque, a pesar del potencial de la emisión de sensibilización para controlar las células individuales en tiempo real, hemos encontrado aceptor foto-blanqueamiento a ser más sensibles y más confiable.
Por último, utilizando FRET para controlar las interacciones de proteínas puede ser difícil, y requiere de una cuidadosa selección de las longitudes enlazador para los receptores unidos a la membrana. Además, la adición de C / YFP a menudo una gran influencia en los niveles de expresión de la proteína y los resultados de la agregación en el retículo endoplasmático y el aparato de Golgi. Sin embargo, para las interacciones transitorias o inestable, FRET es la metodología ideal para utilizar.
Divulgaciones
Agradecimientos
Deseamos agradecer a la Dra. Scott Henderson en busca de ayuda con la microscopía confocal. Esta investigación fue financiada por becas de los Institutos Nacionales de Salud 1RO1CA127501 de WAB, así como la financiación del proyecto piloto del Centro de Cáncer de Massey y la Facultad de Medicina (UCV) de Microscopía WAB se llevó a cabo en la UCV-Dept. de Neurobiología y Anatomía Servicio de Microscopía, apoyada, en parte, con fondos del Centro de NIHNINDS núcleo conceder 5P30NS047463.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11960-069 | |
| Penicillin- Streptomycin | Invitrogen | 15070-063 | |
| Fetal Bovine Serum | Hyclone | N/A | |
| Opti-MEM | Invitrogen | 11058-021 | |
| FUGENE 6 | Roche Group | 11814443001 | |
| Coverslip Dishes | MatTek Corp. | P35G014C | |
| pcDNA3.1(+) | Invitrogen | V790‐20 | |
| Mach 1 Competent Cells | Invitrogen | C862003 |
Referencias
- Kim, M., Carman, C. V., Springer, T. A. Bidirectional transmembrane signaling by cytoplasmic domain separation in integrins. Science. 301, 1720-1725 (2003).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipidmodified monomeric GFPs into membrane microdomains of live cells. Science. 296, 913-916 (2002).
- Seegar, T. C. M., Eller, B., Tzvetkova-Robev, D., Kolev, M., Henderson, S. C., Nikolov, D. B., Barton, W. A. Tie1-Tie2 interactions mediate functional differences between angiopoietin ligands. Molecular Cell. 37 (5), 643-655 (2010).
- Edgell, C. J., McDonald, C. C., Graham, J. B. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc Natl Acad Sci U S A. 80 (12), 3734-3737 (1983).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados