액상 반응기: 자당 반전
Overview
출처: 케리 M. 둘리와 마이클 G. 벤턴, 화학 공학부, 루이지애나 주립 대학, 배턴 루지, LA
배치 및 연속 유량 반응모두 촉매 반응에 사용됩니다. 고체 촉매와 연속 흐름을 사용하는 포장 된 침대가 가장 일반적인 구성입니다. 광범위한 재활용 스트림이 없는 경우 이러한 포장된 침대 반응기는 일반적으로 "플러그 흐름"으로 모델링됩니다. 다른 가장 일반적인 연속 반응기는 교반 탱크이며, 이는 완벽하게 혼합된 것으로 추정됩니다. 1 포장된 침대 반응기의 보급에 대한 한 가지 이유는 대부분의 교반 탱크 설계와 달리 반응기 부피 비율에 대한 큰 벽 면적이 더 빠른 열 전달을 촉진하기 때문입니다. 거의 모든 반응기의 경우 원하는 반응의 온도를 제어하기 위해 열을 추가하거나 철회해야 합니다.
촉매 반응의 역학은 종종 교과서에서 발견되는 간단한 1st 순서, 2nd 순서 등보다 더 복잡합니다. 반응 속도는 또한 질량 전송의 비율에 의해 영향을 받을 수 있습니다 - 반응은 반응이 표면에 공급되는 속도 또는 제품이 제거되는 속도보다 더 빨리 일어날 수 없습니다 - 및 열 전달. 이러한 이유로 대규모 장비를 설계하기 전에 반응 역학을 결정하기 위해 실험이 거의 항상 필요합니다. 이 실험에서는 이러한 실험을 수행하는 방법과 반응 속도 표현과 명백한 속도 상수를 찾아 해석하는 방법을 살펴봅시다.
이 실험은 자당 반전의 운동을 결정하기 위해 포장 된 침대 반응기의 사용을 탐구한다. 이 반응은 액체 상 반응제 및 제품을 가진 고체 촉매를 특징으로 하는 이들의 전형입니다.
자당 → 포도당 (덱스트로스) + 과당 (1)
포장된 침대 반응기는 체류 시간과 관련이 있으며 배치 반응기의 경과 시간과 유사한 시공간을 제어하기 위해 서로 다른 유량으로 작동합니다. 촉매, 고체 산, 먼저 존재하는 다른 양이온에 대한 양성자를 교환하여 준비됩니다. 이어서, 반응기는 반응제의 흐름과 함께 원하는 온도(isothermal operation)로 가열될 것이다. 온도가 평형되면 제품 샘플링이 시작됩니다. 샘플은 광학 회전을 측정하는 극지계에 의해 분석됩니다. 혼합물의 광학 회전은 자당의 변환과 관련될 수 있으며, 이는 반응의 순서를 결정하기 위해 표준 운동 학 분석에 사용될 수 있으며, 반응성 자당및 명백한 속도 상수에 대하여. 유체 역학의 효과 - 축 혼합 (플러그 흐름) 대 일부 축 혼합 (연렬한 탱크)- 운동학에 또한 분석될 것입니다.
Principles
연속 교반 탱크 반응기 (CSTRs)에 비해, 플러그 흐름 반응기 (PfR)는 일반적으로 빠른 반응과 큰 열 효과에 더 적합합니다. 2 그러나 압력 강하및 "핫스팟"의 개발은 문제가 될 수 있습니다. 따라서 촉매 입자 크기가 너무 작을 수 없으며 신중한 시작 절차를 따라야 합니다.
PFR은 총 부피 또는 촉매 가중치가 시스템의 무게와 일치하는 시리즈의 많은 소형 동급 CSTR과 수학적으로 동일합니다. 축 방향으로 혼합이 발생하면 원자로 작동을 설명하는 데 필요한 탱크 N의 수가 감소합니다. 이 모델을 "시리즈의 탱크" 모델이라고 합니다. 모델의 파라미터 N 및 θ(space time)는 반응기의 체류 시간 분포(E-곡선)의 평균 및 분산으로부터 얻을 수 있다. PFR의 경우 평균을 정확하게 계산할 수 있으며 분산은 0입니다. 실제 반응기의 경우 θ는 일반적으로 추정되며 N은 모델에서 회귀됩니다(수학식 2).
 (2)
(2)
여기서"i"는반응기 수이고, CAo는 제한 반응제(이 경우, 자크로오스)의 사료 농도이며, ΔfAi는 i교탱크에서 "A"의 분수 변환의 변화이며,rAi는 탱크 출구 농도에서 평가된 반응의 속도이다. 이 비율은 긍정적이어야 합니다. 동급 CSTR의 질량 저울을 연재하여 해결하는 것은 실제 반응기의 데이터를 사용하여 "A"에 대한 반응 순서를 결정하고 온도를 합리적으로 일정하게 유지될 수 있으며 N이 알려져 있다고 가정하는 데 사용할 수 있습니다.
촉매 반응에 대한 전방 속도 방정식은 촉매 농도에서 거의 항상 1st 순서이며 반응성 농도에서 ≤2. 제품은 때때로 촉매를 억제 할 수 있습니다, 반응의 순서가 실제로보다 적게 나타나는 원인이. 반응제조차도 촉매를 억제하여 반응제의 주문이 0에 가까워질 수 있습니다. 이러한 이유로 촉매 반응은 종종 "권력법"모델에 의해 표현됩니다 :2
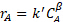 (3)
(3)
 여기서 제한 반응의 농도는, k'는 명백한 속도 상수이며,
여기서 제한 반응의 농도는, k'는 명백한 속도 상수이며,  명백한 반응 순서이다. 이 모델은 촉매 농도가 일정하다는 것을 전제로 합니다(k'를주기 위해 상수로 흡수됩니다). 실제 생활에서 촉매는 종종 비활성화, 즉, C고양이 [mmol 산 사이트 / gcat에서] 촉매 독의 축적으로 인해 감소. 이러한 이유로 비활성화(C고양이를 온스트림의 함수로 표현) 또는 촉매가 상대적으로 안정된 기간 동안 데이터를 수집해야 합니다.
명백한 반응 순서이다. 이 모델은 촉매 농도가 일정하다는 것을 전제로 합니다(k'를주기 위해 상수로 흡수됩니다). 실제 생활에서 촉매는 종종 비활성화, 즉, C고양이 [mmol 산 사이트 / gcat에서] 촉매 독의 축적으로 인해 감소. 이러한 이유로 비활성화(C고양이를 온스트림의 함수로 표현) 또는 촉매가 상대적으로 안정된 기간 동안 데이터를 수집해야 합니다.
자당 반전의 운동은 일반적으로 자당 농도및 촉매 부위의 농도에서 첫 번째 순서로 발견된다. Lifshutz 및 Dranoff는 이러한 촉매의 활성화 에너지로 60°C에서 사용되는 촉매에 대해 ~0.029 mL/(mmol acid sites • min)의 2차 속도 상수 k를 보고합니다. 4 k의 중요한 차이는 여러 가지 요인에서 발생할 수 있습니다: (a) 운동학에 열및 질량 전달의 효과; (b) 불량 한 흐름 분포; (c) 열악한 온도 조절; 및 (d) 촉매 활성화의 다양한 상태.
촉매 반응기의 시공간(거주 시간과 유사)은 일반적으로  W가 촉매의 중량인 =W/Q로 표현되며, 여기서 W는 공급의 체적 유량이다. 속도 상수의 단위는 시공간의 단위를 고려하여 조정됩니다(즉, 1st 주문 반응의 경우 k'의 단위는 1/와
W가 촉매의 중량인 =W/Q로 표현되며, 여기서 W는 공급의 체적 유량이다. 속도 상수의 단위는 시공간의 단위를 고려하여 조정됩니다(즉, 1st 주문 반응의 경우 k'의 단위는 1/와  동일합니다). 도 1은 PFR과 두 개의 탱크로 구성된 탱크-인-시리즈 모델 모두에서 다양한 운동 성 주문의 반응의 동작을 보여 줍니다. 양수 주문의 경우 PFR은 항상 우수합니다.
동일합니다). 도 1은 PFR과 두 개의 탱크로 구성된 탱크-인-시리즈 모델 모두에서 다양한 운동 성 주문의 반응의 동작을 보여 줍니다. 양수 주문의 경우 PFR은 항상 우수합니다.
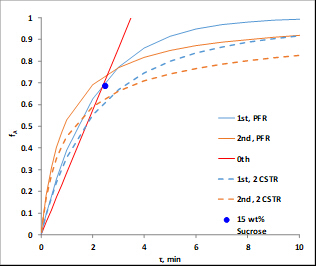
그림 1. 60°C에서 여러 자당 피드에 대한 데이터에서 파생된 속도 상수를 사용하여 자당의 분수 변환(대 공간 시간).
설탕의 양을 결정하기 위해 분석화합물에 의해 편광된 빛의 회전 정도를 측정하는 극광계가 사용된다. 설탕은 광활성, 광회전 능력으로 분화할 수 있는 엔안티오머를 가진 화합물의 예입니다. 편광계는 반응성 자당이 오른쪽으로 빛을 회전하기 때문에 이 실험에서 농도 측정에 특히 적합하지만(양수 광학 회전), 제품 포도당 및 과당은 왼쪽으로 회전(음의 광학 회전).
Procedure
촉매 특성은 : 크기 = 20 - 40 메쉬; 중량 = 223 g; 수분 함량 = 30 wt. %; 명백한 (대량) 밀도 = 1.01 g/mL; 산 부위 농도 = 4.6 mmol 산 사이트/g 건조 중량; 표면적 = 50m2/g; 거시성 (대거포어 부피 /고양이의 총 부피.) = 0.34; 평균 거시 화 크기 = 80 nm. 장치의 P&ID 다이어그램은 그림 2에표시됩니다. 이 실험을 위해 침대 #1, 유기 탱크, 펌프 및 로타미터만 사용됩니다. 샘플은 상부 드레인에서 수집됩니다. T505는 온도 컨트롤러입니다.
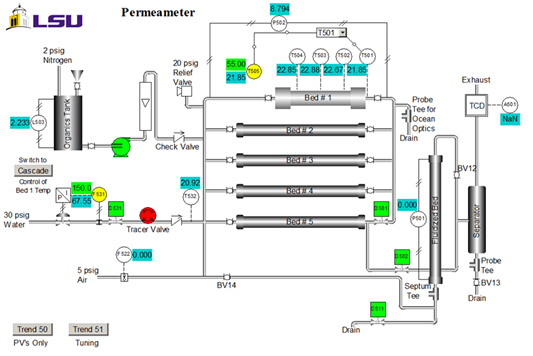
그림 2. 장치의 P&ID 표현(제어 시스템 인터페이스).
1. 원자로 시작
- 분산 제어 시스템 인터페이스에 액세스합니다. 메뉴의 단위 항목에서 파마를 선택합니다. 파마 P&ID 회로도(그림2)가나타납니다. 모든 데이터는 Excel 스프레드시트로 수집할 수 있습니다. 인터페이스에서 "추세 50"을 클릭하여 시간에 대한 주요 프로세스 변수를 가져옵니다.
- 촉매 반응기 침대(베드 #1)에 입구 및 출구 밸브를 엽니다. 다른 침대에 있는 입구 및 출구 밸브가 닫혀 있는지 확인하고, 도시 급수의 제어 밸브(F531) 및 온-오프 밸브(D531)도 폐쇄되어 있는지 확인하십시오.
- 공급 탱크 (2 L)에 희석산 (0.25 M H2SO4)을추가합니다.
- 피드 펌프를 일정한 속도(다이얼에서 최소 3개 이상)로 켜고 로타미터를 설정하여 원하는 유량(40~70mL/min)을 제공합니다. 로타미터가 이 범위의 흐름을 제어할 수 없는 경우 펌프 속도를 다음 더 높은 설정으로 늘립니다.
- 산이 공급되면, 공급 탱크에 200 mL 이상의 DI 물을 추가하십시오. 산 양성자는 다른 이온 (Na+,Ca2 +)이설포닉 산 음이온에 부착되어 있는지 교환합니다. DI 워터에도 불순물이 포함되어 있고 도시용물이 더 많이 포함되어 있기 때문입니다. 이를 촉매를 "재생"이라고 합니다.
- DI 물에서 15w% 자당으로 최소 10L의 사료 용액을 준비하십시오. 자당 용액을 준비할 때, 실온에서 저어주면서 자당을 물에 천천히 넣습니다. 마그네틱 교반기와 패들을 모두 사용하십시오.
- 사료를 유기물 탱크에 넣습니다.
2. 포장 된 침대 반응기 작동
- 자크로오스 피드 흐름을 시작하려면 펌프를 켜고 펌프의 속도 컨트롤러와 로타미터를 사용하여 원하는 대로 흐름을 조정합니다. 속도 제어기는 총 조정을 위한 반면 로타미터는 미세 조정을 위한 것입니다.
- T505 ~ 50°C의 설정점을 프로그래밍하고 AUTO로 설정합니다. 이 시스템은 침대 온도가 90°C에 도달하면 히터를 차단하도록 프로그램되거나 d/p 송신기로 측정한 압력 강하가 H2O 열 압력에서 1in 아래로 떨어지면 공급이 없음을 나타냅니다.
- 반응에 대한 일반적인 온도는 60 °C입니다. 반응기 온도가 먼저 50°C를 초과하면 세트 점을 원하는 최종 온도로 이동합니다. 온도 프로파일은 열전대 T502 및 T503을 검사하여 시각화될 수 있는 촉매 단면도를 통해 관찰될 수 있다.
- 테스트 튜브 또는 샘플 병10 분 간격으로 상부 드레인에서 반응 제품의 25 mL 샘플을 수집합니다. 적어도 두 개의 침대 거주 시간 (침대 오픈 볼륨은 ~ 1.2 L)가 통과 될 때까지 샘플을 수집하지 마십시오.
3. 시스템 종료
- T-505, 침대 #1 온도 제어를 수동에서 제로 출력으로 설정합니다.
- 온도가 감소하기 시작하면 반응기로의 흐름을 차단합니다.
- 베드 #1 블록 밸브를 닫습니다.
4. 폴라리미터 사용
반응 제품 샘플과 극지계로 초기 피드를 분석합니다. 15 wt. % 자당 피드의 경우 변환은 80 ~ 120 mL / 분의 범위에 있어야합니다. 순수한 자당, 포도당 및 과당은 교정 표준으로 사용되어야합니다. 편광에 대한 자세한 내용은 부록을 참조하십시오.
- 나트륨 램프를 켜고 약 5~10분 동안 따뜻하게 해보세요. 노란색 표시등이 표시됩니다.
- 다이얼의 0 위치를 확인합니다. 0에서는 어두운/밝은 프린지가 없는 균일한 다크 필드를 관찰해야 합니다.
- 초기 피드 솔루션의 25mL를 깨끗한 튜브에 추가합니다. 튜브가 완전히 채워졌는지 확인합니다. 판독값이 경로 길이에 따라 달라지므로 교정 및 측정 모두에 동일한 튜브를 사용합니다.
- 튜브를 극광계에 놓습니다. 튜브는 시야에서 갇힌 공기를 제거하기 위해 최대 향해야하며 전구는 접안렌즈 근처에 있어야합니다.
- 덮개를 닫습니다. 용액이 편광광을 회전하는 경우 렌즈를 통해 어두운/빛 프린지를 관찰해야 합니다.
- 프린지가 사라지고 균일한 암장이 관찰될 때까지 다이얼을 회전합니다.
- vernier 스케일을 사용하여 돋보기를 통해 회전 각도를 읽습니다. 다이얼 분할은 각각 1도이고 각 버니어 분할은 0.05°입니다. 초점을 조정하려면 접면 아래에 있는 검은색 다이얼을 회전시합니다.
- 각 샘플에 대해 반복합니다. DI 물을 사용하여 각 측정 전에 튜브를 청소하십시오.
Results
극광계는 포장된 침대 반응기에서 반응한 후 자당의 분수 변환을 결정합니다. 세 가지 다른 자크로오스 피드에 대한 이전 편광계 교정은 도 3에도시된다.
그림 3. 다른 공급 농도에 대한 회전 정도와 자당의 분수 변환 사이의 관계.
샘플 데이터는 다양한 자당 사료 농도에서 60°C에서 반응하기 위해 도 4에 제시된다. 분수 변환은 다음 방정식을 사용하여 극지 보정 곡선에서 직접 계산되었으며, 여기서 D는 극지계에서 회전하는 정도입니다.
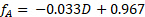 (4)
(4)
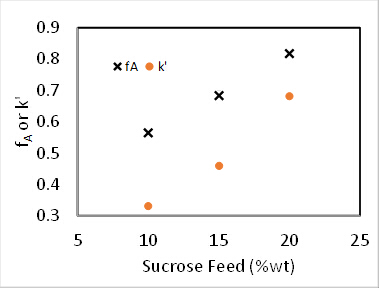
그림 4. 60°C에서 자당 반전 반응, 100 mL/min 이송 속도.
0th 및 1st 순서 반응 모두에 대해, PFR에서의 변환은 사료 농도와 무관하다. 2 또한, k'는 1st 주문 운동학에 대한 불변이어야한다. 반응기를 PFR으로 가정하면,2nd 주문 속도 상수, k2(mL/mmol 사이트 • min),촉매1st 주문 의존성을 고려하여 결정하였으며, 의사-1 st 주문 속도 상수 k'(mL/g cat • min)는 촉매의1st 주문 의존성을 무시함으로써 결정되었다. 의사-k 계산의 결과는 그림 4에플롯됩니다. 그리고 k2의 값은 이전에 주어진 촉매(mmol acid sites/g고양이)의농도에 의해 k'를 분할하여 발견되었다.
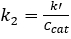 (5)
(5)
반응 역학이 자당에서 0, 0.5, 1, 1.5 또는2nd 순서에 근접했는지 여부를 결정하기 위해 질량 균형의 비선형 회귀가 사용되었으며, 세 런 모두에 대해 제곱 오차의 합계가 최소화되었습니다. 비선형 회귀를 사용하기 위해 통합된 PFR 질량 균형 및 각각의 반응 순서를 기반으로 객관적인 기능이 공식화되었습니다. 예를 들어, 다음은 자당 농도에서 1.5 운동 순서에 대한 객관적인 함수입니다.
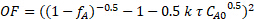 (6)
(6)
다른 객관적인 기능은 모든 운동 교과서에서 찾을 수있는 표준 PFR 질량 균형 솔루션에서 공식화 될 수있다. 2 도 4의 실험 데이터는 자당에 대하여 1, 1.5 및 2 주문에 대한 통합 된 PFR 질량 저울에 적합했다. 3개의 반응 주문에 대한 제곱 오차합계는 각각 0.39, 0.16 및 1.3으로 결정되었습니다. 따라서 가장 적합한 것은 n = 1.5 주문으로 나타났습니다. 이것은 35 (mL / g 고양이• 분)의 k값으로 이어집니다.
처음에는 운동학이 자당에 관한 1st 순서라고 생각되었습니다. 2-3 이 가정을 사용하면 이 반응기를 모델링하는 데 필요한 계열로 동일한 볼륨 CSTR, N의 수를 결정할 수 있습니다. 다시 말하지만, 세 번의 실행 모두에 대한 질량 균형의 제곱 오차 합계는 N과 k를모두 결정하기 위해 최소화되었습니다. 데이터는 1st 주문 반응에 대한 탱크 인 시리즈 모델에 적합했습니다.
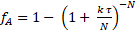 (7)
(7)
N = 2.1 "탱크"와 k' = 0.62 mL/g고양이 • 최소 것으로 나타났습니다. 반응 순서가 정확히 1이 아니기 때문에 이것은 적합하지 않습니다. 데이터는 1> 자당 주문을 제안합니다. fA의 상대적인 표준 편차는 온도(9°C)의 변화에 의해 쉽게 차지하는 2%에 있었다. 촉매 비활성화의 증거는 없었다. PFR과 시리즈의 두 CSTR 탱크에 대한 분수 변환은 비선형 회귀에서 k를 사용하여 계산하고 그림 1에플롯하였다. 제로 순서의 경우, 속도는 자당 농도와 독립적이기 때문에 연속PFR과 CSTR 사이에 차이가 없었다. 6개 이상 CSTR의 커브가 플롯된 경우 PFR 곡선과 밀접하게 일치했을 것입니다. 시리즈2CSTR 탱크에 대한 예측 된 분수 변환은 모든 반응 주문에 대한 PFR보다 느립니다. 15 wt% 자당에 대한 실험 데이터는 실제로 PFR의 1차 반응에 가깝습니다.
k'의 오차는 평균 온도 편차(4.5°C)에서 의 평균 온도에서 계산된 k값의 차이를 반응의 온도, 60°C, 아레니우스 방정식을 이용하여 2개의 문헌 활성화 에너지를 평균화하여 추정할 수 있다. 64.5 °C에서 1.5 주문 역학에 대한 추정 k'는 52 (mL / mol)0.5 mL • gcat -1 • min-1이며, 이는 35 (mL / mol)0.5 mL의 회귀 값보다 거의 50 % 더 높습니다 • gcat-1 •1• 1 . 온도의 약간의 변화는 k'에 크게 영향을 미칠 수 있습니다.
Application and Summary
명백한 순서 n이 1 > 때문에 반응은 예상대로 정확하게 작동하지 않습니다. 실제 반응기에서 이러한 편차를 일으킬 수있는 모든 현상 중, 축 혼합으로 인한 이상적인 PFR 동작에서 편차는 탱크 에서 시리즈 모델에 피팅하면 탱크의 소수만 제공한다는 사실에 의해 제안된다 - 완벽한 PFR을 위해, N은 적어도 6이어야한다. 이러한 편차는 종종 상대적으로 짧은 침대에서 발견, 흐름이 다단계 인 경우 특히 (일부 물은 반응기에서 기화된다). 그러나 편차의 또 다른 원인은 덜 명백하지만 아마도 더 중요할 것입니다. 반응은 매우 외동적이며, 언급했듯이 온도는 9°C(주로 설정 점 위)로 진동합니다. 피드에 더 많은 자당, 생성 됩니다 더 많은 열. 예상대로 진동은 20 wt% 피드로 가장 중요했습니다. 이는 명백한 순서 n > 1에 대한 또 다른 이유를 시사한다: 더 높은 농도의 사료에서 발생하는 열은 반응기 온도를 더 많이 증가시켜, 이는 차례로 실제 순서를 > 파생 된 명백한 순서의 결과로 반응 속도를 증가시킨다. 온도가 부적절하게 제어되면 반응기 온도가 아디아바틱 제한으로 증가할 수 있습니다. 유동과 온도 모두에서 이상적인 PFR 거동에서 의편은 실제 반응기에서 파생된 명백한 운동학에 영향을 미칠 수 있으며, 신중한 원자로 스케일업에 프리미엄을 두어 유체 흐름 및 열 전달의 파일럿 플랜트 조건을 복제할 수 있습니다.
포장 된 침대 원자로는 화학 산업에서 많은 용도를 가지고 있습니다. 황산, 다른 제품의 수백을 만드는 데 사용되는 화학 물질, 일반적으로 일련의 포장 침대 화학 반응기를 사용하여 부분적으로 제조된다. 매년 2억 톤 이상이 생산됩니다. 이 반응에서, 이산화황과 공기는 고온에서 지원되는 바나듐 산화물 촉매를 포함하는 일련의 고정 침대 반응기 (열 제거를위한 중간 열 교환기 포함)를 통과합니다. 4 SO2는 SO3로산화되어 물에 흡수되면 황산을 만듭니다.
포장 된 침대 반응기의 최근 사용은 메탄올과 트리글리세라이드를 번역하거나 지방산을 에스테르화하여 바이오 디젤을 생산합니다. 바이오 디젤은 다양한 방식으로 생산되지만 포장 된 침대 반응기는 지속적인 생산에 유리할 수 있습니다. 바이오 디젤은 조류 또는 폐기물 식품에서 생산되기 때문에 재생 에너지원으로 간주되며 생분해성 및 비독성이기 때문입니다. 사용되는 촉매에 관계없이 소량이라도 연료를 사용할 수 없게 만들 수 있기 때문에 반응 후 제품에서 철저히 제거해야합니다. 5
부록 A – 극지계 사용
편광량은 물질이 비행기 편광과 상호 작용하는 정도를 측정합니다 (한 평면에서만 진동하는 파도로 구성된 빛). 편광된 빛을 왼쪽, 오른쪽으로 회전하거나 전혀 회전할 수 있습니다. 편광광을 왼쪽 또는 오른쪽으로 회전하면 "광학활성"입니다. 화합물에 키랄 센터가 없는 경우 편광광이 회전하지 않습니다. 관측된 회전을 주기 위해 도 수와 회전 방향을 측정합니다. 관찰된 회전은 사용되는 셀의 길이와 용액 농도에 대해 다음 방정식을 사용하여 수정됩니다.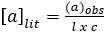 (A1)
(A1)
위치: = 특정 회전(도) (문헌 값), l = 경로 길이(dm), c =농도(g/mL).
보정된 관찰된 회전을 문헌 값과 비교하면 알 수 없는 화합물을 식별하는 데 도움이 될 수 있습니다. 그러나 화합물이 공지되면, 미지의 교정 표준을 준비하고 관찰된 회전을 농도로 상호 연관시키는 것이 더 일반적이다.
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
액상 반응기: 자당 반전
Chemical Engineering
9.7K Views

핀 튜브 열교환기의 열전달 효율 테스트
Chemical Engineering
18.0K Views

트레이 건조기를 사용한 대류 및 전도열 전달 조사
Chemical Engineering
44.0K Views

프로필렌 글리콜 용액의 점도
Chemical Engineering
33.2K Views

실리카 알루미나 분말의 다공성 측정
Chemical Engineering
9.7K Views

압출을 통한 멱 법칙 모델 시연
Chemical Engineering
10.3K Views

가스 흡착 장치
Chemical Engineering
36.9K Views

증기-액체 평형
Chemical Engineering
89.5K Views

환류비가 트레이 증류 효율에 미치는 영향
Chemical Engineering
77.9K Views

액체-액체 추출의 효율성
Chemical Engineering
48.6K Views

화학적 변형을 통한 살리실산의 결정화
Chemical Engineering
24.3K Views

충전 층 반응기의 단상 및 2상 흐름
Chemical Engineering
19.0K Views

폴리디메틸실록산에 대한 부가 중합의 반응 속도
Chemical Engineering
16.4K Views

촉매 반응기 에틸렌의 수소화
Chemical Engineering
30.5K Views

스핀 앤 칠의 열전달 평가
Chemical Engineering
7.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유