촉매 반응기 에틸렌의 수소화
Overview
출처: 케리 M. 둘리와 마이클 G. 벤턴, 화학 공학부, 루이지애나 주립 대학, 배턴 루지, LA
에틸렌(C2H4)의에탄(C2H6)의수소화는 종종 새로운 금속 촉매를 특성화하는 모델 감소 반응으로 연구되고 있다. 1-2 지원되는 니켈은 이 반응에 가장 능동적인 금속 촉매는 아니지만, < 200°C에서 반응이 일어날 수 있을 만큼 충분히 활성화되어 있다.
반응은 전형적으로 흡착, 해리된 수소 (H2)흡착 에틸렌으로 반응하는 관련시킵니다. 즉, 수소 원자와 에틸렌 분자 모두 금속 부위와 결합을 형성합니다(여기서 "S"라고 표시). S와 에틸렌의 강한 결합은 수소 원자가 에틸렌에 추가 할 수 있도록 충분히 이중 결합을 약화, 흡착되지 않은 에탄을 형성.
이 실험의 목적은 먼저 원시 조성 측정을 환원 분수 변환으로 변환하는 것입니다. 3 이러한 변환은 "통합 방법"에 의해 표준 전력법 역학 모델에 데이터를 맞추기 위해 PFR(플러그 흐름 반응기)에 사용될 수 있습니다. 3 이론적 명령과 에틸렌과 수소 모두에 대한 실험적 반응 순서를 비교하면 이 경우 질량 전달 제어가 아닌 반응이 기네틱하게 제어된다는 것을 알 수 있다.
Principles
반응(A = 에틸렌, E= 에탄 및 S = 금속 부위)을 위한 메커니즘은 다음과 같이 작성할 수 있습니다:2
A + S  AS (1)
AS (1)
H2 + 2 S  HS + HS (2)
HS + HS (2)
AS + HS  AHS + S (3)
AHS + S (3)
AHS + HS  E + S + S (4)
E + S + S (4)
세 번째 반응이 속도 제한 단계이고 S 사이트의 총 양이 일정하다는 것을 가정하는 경우(So),대략질량 균형을 사용할 수 있습니다.
(So)~ (S) + (AS) + (HS) (5)
및 단계 (1) - (2)에 대한 준 평형 가정은 이론적 운동 적 표현을 얻습니다.
r = k (H2)1/2 (A) (So)2 [1 + K1 (A) + K21/2 (H2)1/2]-2 (6)
여기서 K는 일정한 속도이고, K는 평형 상수, "1"은 제1 반응에 대해 "2"를 나타내고,(H2),(A) 및 (So)는각각의 성분의 농도이다. 대략적인 질량 균형에서 우리는 (S), (HS) 및 (AS) >> 가정합니다(AHS). 또한 (So)는금속 사이트의 총 수가 동일하게 유지되는 한 일정합니다. 금속 부위의 수가 시간에 따라 감소하면 촉매가 "비활성화"라고 말합니다. 증가하면 촉매가 "활성화"됩니다. 이 반응에서 비활성화는 이 stoichiometry를 가진 측 반응에 기인할 수 있습니다:
A C2H4  (CH)2a + A H2 (7)
(CH)2a + A H2 (7)
폴리머 생성물(CH) 2a("콜라")는 금속 부위로부터 탈석하기에 너무 무겁고("a"는 크다)가 므로 이러한 금속 부위는 촉매에서 효과적으로 제거된다. 4, 후속 반응 조건은 콜라가 분해되어 촉매를 "활성화"시킬 수 있다.
이러한 역학의 경우, 에틸렌의 낮은 농도의 경우 속도가 에틸렌에서 일차이며, 에틸렌의 고농도의 경우 반응 속도가 -1 순서인 것이 분명합니다. 수소 주문에 대한 비교 값은 0.5 ~ -0.5입니다. 이 모형의 속도 발현 (또한 효소 촉매 반응에서 일반적) "Langmuir-Hinshelwood"에게 불립니다. 평형 상수 K1은 온도에 따라 달라지므로 이 속도 표현은 유형의 "전력법" 속도 표현에서 에틸렌의 순서 m을 알려줍니다.
r = k (A)m (H2)n (8)
온도로 변경됩니다. 실험 데이터에서 회귀된 대부분의 속도 표현은 화학 역학에 대한 표준 교과서에서 볼 수 있듯이 "권력법" 유형입니다. 5
반응기 시스템의 단순화된 회로도(도 1)는 다음과 같습니다. 밸브와 부품의 대부분은 반응기에 레이블이 지정됩니다. 원자로는 모래탕 안에 들어 있는 강철 튜브입니다. 모래목욕은 공기를 사용하여 유동화되고 금속 저항 히터에 의해 가열됩니다. 많은 양의 열을 파일럿 플랜트 원자로로 빠르게 옮길 수 있습니다.
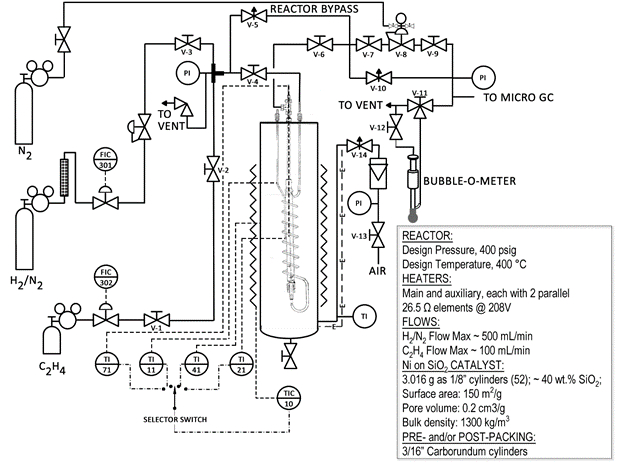
그림 1: 촉매 반응기 시스템의 회로도
이 시스템을 안전한 시스템으로 만들기 위해 예방 조치가 취해졌습니다. 시스템에 릴리프 밸브가 있으며, 고온 셧다운, 희석수소(실린더의 사양 시트 참조)만 사용됩니다. 그러나 반응 시스템을 사용하면 안전 절차에 대한 엄격한 준수가 필요합니다. 공기 중 수소의 폭발 한계가 4.0%입니다. 6 이러한 이유로 원자로가 주변 모래탕에 수소를 누출하지 않도록 하는 것이 중요하다. 이를 위해 CGD900 가연성 가스 누출 검출기를 사용할 수 있습니다.
본 데모(2.0 g)에 사용되는 촉매는 니켈을 활성 성분으로 사용하지만 약 40wt% 실리카(SiO2)이다. 실리카는 니켈에 대한 "지지"라고하며, 그 목적은 니켈이 커버할 수 있는 넓은 표면적을 제공하는 것입니다. 불활성 물질인 실리콘 카바이드(SiC)는 나머지 반응기를 채우는 데 사용됩니다. 촉매는 표면적 = 150 m2/g, 공공 부피 = 0.2 cm3/g, ~ 1300 kg /m3의벌크 밀도를 갖는다.
포장 된 침대 촉매 반응기에 가장 가까운 이상적인 원자로는 PFR입니다. 비이상적 반응기 분석은 이 실험의 범위를 벗어납니다. 촉매 중량을 종속 변수로 독립 변수 및 분별 변환으로 사용하는 PFR 질량 균형은 다음과 같이 됩니다.
 (9)
(9)
여기서 fA는 제한 반응제의 분수 변환, "f"는 최종 (exit) 조건을 의미하며, W는 촉매 중량, F Ao의 공급 어금량Ao, 및 r'은 wt 기준으로 속도 발현이다. 이상적인 가스에 대해서만 fA의 관점에서 r'을 넣는 방법은 표준 운동 참조중 에서 다룹니다. 3 에틸렌 제한이 있는 한 클래스와 수소 제한이 있는 한 클래스의 데이터 클래스가 있지만 일반적인 속도 표현은 하나만 있을 수 있습니다. 분수 변환은 가스 크로마토그래프를 사용하여 공급 및 제품 가스를 모두 분석하여 찾을 수 있습니다. 질량 균형을 닫는 것을 통해, 반응의 속도는 촉매 반응의 이 모형을 위한 명목 활성화 에너지에 비교될 수 있습니다. 하나는 또한 반응의 순서를 비교할 수 있습니다.
Procedure
시스템은 상용 분산 제어 시스템을 통해 제어됩니다. 하나의 연산자 인터페이스만 있습니다.
1. 원자로 시작
- 실시간 프로세스 기록 보기를 시작하려면 > 델타V > 운영자 > 프로세스 기록 보기를 시작한 다음 CATUnitOverview를 엽니다. 메뉴 표시줄의 단추를 클릭하여 차트 스케일을 압축하거나 확장할 수 있습니다. 제어 시스템에서 Excel 스프레드시트로 데이터를 다운로드하는 절차는 컴퓨터에서 사용할 수 있습니다.
- 모래 목욕에 공기가 켜지고 있는지 확인하십시오. 로타미터는 ≈5 이상을 읽고 일관된 가열을 제공하기 위해 달리기에서 일정하게 유지되어야 합니다.
- CAT 장치의 패널 보드의 검은 색 START 버튼을 눌러 모래 목욕 히터에 주 전원을 공급하십시오.
- 원하는 초기 설정점으로 온도 컨트롤러(TIC-10, 모래목욕)를 자동 모드로 설정합니다. 실험 의 시작 부분에 급속 한 가열을 사용 하려면 부록 A를 참조 하십시오.
- 차트에서 온도를 모니터링할 수 있습니다. 원자로 유출유량은 주기적으로 점검해야 한다. 유량 손실 이나 런어웨이 온도 등의 문제가 발생하면 적절한 차단 밸브를 사용하여 반응 흐름을 모두 차단하고 모든 히터를 끕니다. 모래 목욕 공기를 그대로 둡니다.
2. 유량 설정
가열하기 전에 유량 설정합니다. 수소질소 혼합물을 위한 FIC-301 및 에틸렌용 FIC-302-두 유량 컨트롤러에 대한 교정이 제공될 것이다.
- 컴퓨터 사용을 나타내기 위해 컴퓨터 또는 패널 보드를 1로 사용할지 여부를 지정하는 인터페이스에서 디지털 값을 설정합니다.
- GC 샘플 라인을 차단합니다.
- 버블 미터에서 두 부피 사이의 단일 버블 상승 속도를 타이밍하여 체적 유량을 결정합니다. 버블 미터는 졸업 볼륨유리 부레입니다. 버블 미터가 흐름을 측정하는 데 적극적으로 사용될 때 GC 샘플 라인이 차단되었는지 확인합니다(교정, 출구 유량 확인).
- 바이패스(빈 샘플)를 통해 피드의 적어도 하나의 샘플을 사용하여 컴포지션을 확인합니다. 원자로를 우회하지 않고 비행 중 유량을 변경하는 것은 괜찮습니다. 유량을 변경하면 공급의 상대 농도(압력이 일정함)가 변경되므로 유량은 자주 변경되어야 합니다.
- GC 샘플 라인을 차단 해제하고 반응기를 우회하여 GC 입구 포트로 흘릴 수 있습니다.
- 가스 크로마토그래프를 사용하여 가스 제품 구성을 분석합니다. 추가 지침은 GC를 작동하고 컴포지션을 결정하는 방법에 대한 부록 B에 포함되어 있습니다.
3. 원자로 가동 중단
- 빨간색 EMERG를 밀어 모래 목욕 히터에 주요 전원을 종료합니다. CAT 장치의 패널 보드에서 정지 버튼.
- MAN 모드에 TIC-10을 배치하고 출력을 0%로 설정합니다. 보조 전력(켜기)을 0%로 설정합니다.
- 컨트롤러를 MAN에 넣고 출력을 0%로 설정하여 에틸렌 흐름을 0%로 설정합니다.
- 혼합 티 전에 에틸렌 블록 밸브를 모두 차단하고 메인 가스 실린더 밸브를 차단합니다.
- 종료하기 전에 ~ 2 분 동안 수소 / 질소 흐름을 보자; 이것은 촉매의 수명을 연장할 것입니다.
- 혼합 티 전에 두 밸브를 차단합니다. 그런 다음 수소 /질소 혼합물의 주요 밸브를 차단합니다.
- 유동된 침대에 공기를 두십시오.
Results
비선형 회귀는 반응 주문 m 및 n의 최상의 추정치(Eqs. 8 -9를 사용하여)를 획득하고, 속도 상수 k는 지루할 수 있다. 이러한 솔루션 알고리즘에는 m 및 n의 반복당 데이터 요소당 하나의 숫자 통합이 필요하며 수천 개의 수치 통합이 가능합니다. 거의 좋은 대안 기술, 하지만 훨씬 적은 계산 비싼, m의 평가판 쌍을 공식화 하는 것입니다., n Eq. 6의 구조에 따라. 이론적 주문 범위 내의 모든 값은 확실히 가능합니다. 그런 다음 형식의 객관적인 함수를 공식화합니다.
 (10)
(10)
각 m에 대한 이러한 객관적인 함수는, n 쌍을 계산할 수 있으며, 부분 압력의 함수로서 Eq.10의 오차 임의성과 같은 다른 표준 적합성 기준과 함께 최소 또는 거의 최소한을 사용하여 결정된 최상의 적합성을 계산할 수 있다. 또한 Eq. 9는 왼쪽 일체형("Y"라고 부르며)과 1/F Ao("X"라고 부르기)의 플롯이 최적의 m, n에서 선형이어야 한다고 예측합니다. 이 제제의 오차의 선형도 및 임의성을 확인하는 것도 적합성의 장점을 결정하는 유효한 방법입니다.
P = 1 atm, T = 80 °C, PC2H4 = 0.17-0.42 atm, PH2 = 0.23-0.33 atm (희석제질소)에서 취한 일부 데이터는 전술한 바와 같이 분석되었다. "가장 적합"역학의 선형 플롯은 그림 2에표시됩니다. 다른 여러 m, n 쌍도 같은 방식으로 검사하 였고 더 가난한 선형 적합을 제공하는 것으로 나타났습니다. m과 n의 가장 적합한 값은 에틸렌이 니켈 촉매에 약하게 흡착되어 있음을 시사합니다 (Eq. 6의 분모의 억제는 없음), 수소가 강하게 흡착되는 동안 (음수 순서는 억제를 나타냅니다). 대부분의 촉매 반응의 경우 흡착량이 너무 약하기 때문에 흡착이 너무 나빠서 "너무 강하다"는 부정적인 반응 순서에 반영되지만 "너무 약한"은 낮은 변환 및 작은 속도 상수 K에 반영됩니다.

그림 2. 80°C에서 에틸렌 수소화의 역학 분석, 60 wt% Ni 촉매에 대한 1 atm. "a"는 C2H4가 제한 반응제인 데이터를 나타내고 "b"는 H2를 제한 반응제로 나타냅니다.
m과 n의 가장 적합한 값은 모두 방정식(6)을 기반으로 하는 기대치 범위 내에 있습니다. "m"의 값은 최대이므로 반응은 확산 제어되지 않습니다. 확산 제어 반응의 경우 "m"과 "n"모두 0에 가깝습니다. 실험 주문은 때때로 kinetically 제어 대 확산 제어의 질문에 대답 할 수 있지만, 0 방정식 (6)에 따라 가능한 주문의 범위 내에 있기 때문에 두 주문이 제로에 가까운 경우 아무것도 입증 할 수 없습니다. 위의 진술의 증거는 이 실험의 범위를 벗어납니다.
Application and Summary
여기에 설명된 방법은 운동 및 반응기 설계에 대한 대부분의 책에서 "통합 방법"이라고합니다. 3 차동 방법보다 적용하기가 수학적으로 훨씬 더 어렵지만, 대부분의 파일럿 스케일 반응기 시스템에서 쉽게 얻을 수 있는 데이터의 종류를 분석하는 것이 더 좋으며, 이는 반응제 및 제품 부분 압력 및 분수 변환이 넓은 범위에 따라 다를 수 있습니다. 배치 반응기 나 낮은 반응 변환에 의존하지 않기 때문에 이러한 "통합 데이터"도 스케일업에 더 정확하고 관련이 있습니다. 이 방법의 첫 번째 부분은 흐름 및 조성 측정의 원시 데이터를 분수 변환 대 공간 시간으로 변환하는 것입니다(수학식 9의 오른쪽은 종종 시공간이라고 합니다). 다음 단계는 속도에 영향을 미치는 반응물질(때로는 제품)에 대한 합리적인 반응 주문을 추정하는 것입니다. 마지막 단계는 방정식(10) 또는 방정식(9)의 선형 관계(9)를 사용하여 가능한 한 많은 주문 집합을 비교하고 모든 데이터에 가장 잘 맞는 세트를 선택하는 것입니다.
거의 모든 지원금속 촉매는 일부 온도 범위에서 에틸렌의 수소화를 촉매할 수 있으며, 촉매 활성, 선택성(에탄) 및 안정성(코킹 저항)은 잠재적 금속 촉매의 유용성의 중요한 설명자이다. 반응의 운동 순서는 또한 중요한 설명자입니다. 그들은 탄화수소 대 수소의 상대적 흡착 강도를 나타내며 촉매의 속도가 반응또는 제품 확산에 의해 제한 될 수 있는지 여부 (이 경우 0 에 가까운 주문이 발견됩니다). 주문은 또한 방정식 6을 파생시키는 가정이 (예를 들어, 표면 반응인 단일 속도 제한 단계)에서 이루어진 가정이 처음부터 올바른지 제안 할 수 있습니다. 일반적으로 실험 속도 표현을 아는 것은 자체적으로 올바른 메커니즘을 결정하기에 충분하지 만 실험 속도 표현이 제안된 반응 메커니즘과 일치하지 않으면 후자는 확실히 올바르지 않습니다. 여기에 주어진 예에서 관찰된 운동학은 제안된 메커니즘 및 금리 제한 단계와 일치하며 메커니즘에 대한 일부 신빙성을 부여합니다.
약간의 적응만으로, 여기에 설명된 "통합적인 방법"은 많은 중요한 산업 촉매 반응에 대한 속도 표현을 결정하는 데 사용되었습니다. 그런 다음 이러한 속도 표현식을 사용하여 이러한 프로세스를 톤수 스케일로 확장했습니다. 몇몇 잘 알려진 예는H2를생성하는 메탄의 증기 개혁, 프탈릭 무수화물에 o-자일렌의 산화, 및 암모니아 합성을 포함한다. 6 이러한 경우 수백 개의 후보 촉매에 대한 속도 표현식이 여러 온도에서 계산될 수 있습니다.
지원되는 금속에 대한 촉매 반응에 관해서는 자동차 배기 촉매(일산화탄소 산화, 탄화수소 산화 및 산화 질소 감소의 조합)를 포함하여 가장 중요한 산업 촉매 반응중 일부를 구성하며, 다양한 연료의 옥탄 수를 늘리기 위해 분기 체인 탄화수소로선형을 개혁하고 증기 개혁을 합니다. 이들 중 첫 번째 활성 금속은 일반적으로 백금 팔라듐 합금이며, 두 번째는 백금 또는 백금-레늄과 같은 백금 합금이며, 세 번째는 니켈이다. 7 구리, 은, 금 및 로듐과 같은 다른 금속도 자체적으로 또는 다른 금속합금으로 응용 프로그램을 찾습니다.
부록 A – 보조 히터 지침
급속한 가열의 경우 보조 히터를 켜십시오 (출력 ≤ 90%), 피부 또는 외부 벽 온도가 원하는 반응기 온도에 근접할 때 해제해야합니다. 보조 히터는 이 때 제어되지 않고 냉각 (≈10 °C / hr)은 가열보다 훨씬 오래 걸립니다. 반응기 온도는 히터 온도를 크게 지연시킬 수 있습니다. 피부 열전대는 TIC-10에 입력으로 선택할 수 있다. 모든 실험에서 사용할 가장 높은 온도는 200°C입니다. "중요" 경고등은 사용자에게 고온으로 경고합니다. 제어 시스템은 모래탕과 반응기 온도를 모두 모니터링하고 둘 다 너무 높을 때 히터를 경보하고 차단하도록 프로그래밍됩니다.
부록 B – 크로마토그래프 작동 지침
MicroGC는 컴퓨터 제어입니다. 기본 GC 메서드는 "냉각-1"입니다. 실험의 경우 로드 메서드 "PH-CAT4"입니다. 다운로드 메서드를 → 제어를 클릭합니다. 악기 상태 → 컨트롤을 클릭하여 계측기 상태를 표시합니다. 계측기 상태의 모든 매개 변수가 설정된 점 근처에 있을 때까지 실행을 수행할 수 없습니다.
실행을 수행할 준비가 되면 단일 실행 → 컨트롤을 클릭합니다. 팝업 메뉴는 샘플 ID, 데이터 파일 및 결과 이름을 입력하라는 메시지가 표시됩니다. "데이터 파일"의 경우 오른쪽 화살표 머리를 클릭하고 날짜와 시간을 선택합니다. 이렇게 하면 화면이 필드에 있고 날짜와 시간이 파일 이름에 첨부됩니다. "결과"의 경우 오른쪽 화살표 머리를 클릭하고 샘플 ID를 선택한 다음 날짜와 시간을 선택한 다음 증분 번호 선택을 반복합니다. 필드로 돌아가 첫 번째 항목과 두 번째 항목 과 세 번째 항목 사이에 빈 공백을 삽입합니다. "담당자 수'의 경우 원하는 순차 반복 분석 수를 입력합니다. 이제 "시작"을 클릭합니다. 채널 A와 B모두에 대한 라이브 플롯이 나타나생성되는 크로마토그램을 보여 주어 표시됩니다. H2와 N2는 채널 A에서 검출되고,H2,CH4,C2H 4,C2H4,C2H6은 채널 B에서 검출된다. 모든 담당자가 완료되면 메서드를 저장하지 마십시오. 결과 시퀀스 창이 열리므로 결과에 액세스할 수 있습니다.
결과를 보려면 결과 시퀀스 창을 선택하고 첫 번째 실행 번호 셀(예:)을 마우스 오른쪽 단추로 클릭하고 레코드 선택선택을 선택합니다. 상단 메뉴에서 보고서 → → 영역 %를 볼 수 있습니다. 알려진 화합물이 있는 보고서가 나타납니다.
GC는 영역 %에 기록됩니다. 변환(A = 영역%)을 계산하려면 다음을 수행합니다. (11)
(11)
또한 버블 미터로 제품 유량을 측정하여 변환을 계산할 수 있으며, 이는 GC 결과에 대한 검사역할을 할 수 있다. 이상적인 가스와 에틸렌 수소화 이외의 반응이 없다고 가정하면, 다음 방정식은 스토이치오메트릭 테이블을 사용하여 파생될 수 있습니다:3 (12)
(12)
여기서 FT0은 사료의 총 체적 유량인 경우, FT는 버블 미터에 의해 측정된 제품 스트림의 총 체적 유량이며, 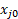 어느 중 한도제한 반응제중 몰 또는 부피 분획이다.
어느 중 한도제한 반응제중 몰 또는 부피 분획이다.
References
- O. Beeck, Discuss. Faraday Soc.8, 118 (1950).
- J.B. Butt, AIChE J22, 1 (1976).
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- B. Peri, Discuss. Faraday Soc., 41, 121 (1966).
- Basic chemical kinetics - Fogler, Ch. 3, Levenspiel, Ch. 2, Hill and Root, Ch. 3.
- N. Bartknecht, "Explosions: Course, Prevention, Protection", Springer-Verlag, 1981.
- G.F. Froment, K.B. Bischoff and J. De Wilde, "Chemical Reactor Analysis and Design," 3rd Ed., John Wiley, Hoboken, Ch. 11.
- J.R.H. Ross, "Heterogeneous Catalysis: Fundamentals and Applications," Elsevier, Amsterdam, 2012, Ch. 8.
건너뛰기...
이 컬렉션의 비디오:

Now Playing
촉매 반응기 에틸렌의 수소화
Chemical Engineering
30.5K Views

핀 튜브 열교환기의 열전달 효율 테스트
Chemical Engineering
17.9K Views

트레이 건조기를 사용한 대류 및 전도열 전달 조사
Chemical Engineering
44.0K Views

프로필렌 글리콜 용액의 점도
Chemical Engineering
33.1K Views

실리카 알루미나 분말의 다공성 측정
Chemical Engineering
9.6K Views

압출을 통한 멱 법칙 모델 시연
Chemical Engineering
10.2K Views

가스 흡착 장치
Chemical Engineering
36.8K Views

증기-액체 평형
Chemical Engineering
89.4K Views

환류비가 트레이 증류 효율에 미치는 영향
Chemical Engineering
77.9K Views

액체-액체 추출의 효율성
Chemical Engineering
48.5K Views

액상 반응기: 자당 반전
Chemical Engineering
9.7K Views

화학적 변형을 통한 살리실산의 결정화
Chemical Engineering
24.3K Views

충전 층 반응기의 단상 및 2상 흐름
Chemical Engineering
19.0K Views

폴리디메틸실록산에 대한 부가 중합의 반응 속도
Chemical Engineering
16.2K Views

스핀 앤 칠의 열전달 평가
Chemical Engineering
7.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유