Method Article
상처 드레싱 재료와 음압 상처 치료 시스템의 호환성을 평가하기 위한 벤치탑 모델 개발
요약
이 연구는 연속 및 간헐적 압력 설정에서 72시간 동안 압력 및 체액 수집을 평가하여 음압 상처 치료 시스템과 상처 드레싱 재료의 호환성을 평가하도록 설계된 벤치탑 모델을 제시합니다.
초록
음압 상처 치료(NPWT) 시스템은 상처 부위에 대기압 이하의 압력을 가하여 육아 조직 형성을 촉진하고 염증을 줄임으로써 상처 치유를 촉진합니다. 상처 드레싱은 치유를 향상시키기 위해 이러한 시스템과 함께 사용할 수 있습니다. 그러나 드레싱이 NPWT 장치 성능에 미치는 영향은 평가하기 어렵습니다. 이 연구의 목적은 상처 드레싱 재료와 NPWT 장치의 호환성을 테스트하기 위한 벤치탑 살형 아날로그 모델을 개발하는 것이었습니다. 본 연구에서는 키토산 기반의 첨단 상처 치료 기기가 최대 및 최소 치료 압력에서 NPWT 성능에 미치는 영향을 평가했습니다. 목표는 이 모델을 사용하여 키토산 상처 치료 장치가 있는 경우와 없는 경우의 샘플에 대한 압력 판독값과 체액 채취를 비교하는 것이었습니다. 벤치탑 모델은 여러 압력 게이지에 연결된 플라스틱 상자를 사용하여 구성되었습니다. 삼겹살 조각에 원형 결함이 생성되어 육류 유사체로 사용되어 상자에 삽입되었습니다. 결함은 표준 NPWT 폼 또는 상처 드레싱과 결합된 폼으로 채워졌습니다. 소 혈청을 함유한 시뮬레이션된 체액을 상자에 첨가한 다음 72시간 동안 최대(-200mmHg) 또는 최소(-25mmHg) 압력에서 테스트했습니다. 압력 및 체액 수집은 12시간마다 기록되었습니다. NPWT 시스템은 테스트 드레싱을 사용하거나 사용하지 않은 상태에서 72시간의 테스트 기간 동안 압력을 성공적으로 유지했습니다. 상처 드레싱의 추가는 체액 채취에 영향을 미치지 않았습니다. 테스트 박스는 72시간의 테스트 기간 동안 밀봉하고 진공 상태를 유지할 수 있기 때문에 벤치탑 모델로서 효과적인 것으로 입증되었습니다. 이 모델은 상처 드레싱 재료와 NPWT 시스템의 호환성을 평가하는 데 유용성을 성공적으로 입증했습니다.
서문
상처의 관리와 치유 과정을 돕기 위해 다양한 치료법이 존재합니다. 이러한 치료 접근법에는 첨단 상처 드레싱, 성장 인자, 고압 산소 요법, 피부 대체물 및 음압 상처 치료(NPWT)가 포함됩니다1. NPWT는 시스템에 지속적 또는 간헐적으로 대기압 이하의 압력을 가하여 상처 표면에 음압을 제공하는 상처 드레싱 시스템을 말합니다. NPWT는 급성 또는 만성 상처 관리를 위한 인기 있는 치료 방법이 되었습니다2. NPWT 시스템은 오픈 셀 폼, 접착성 상처 드레싱, 유체 채취 시스템 및 흡입 펌프3로 구성됩니다. 흡입 펌프 또는 진공 청소기는 상처에 일정한 압력을 유지하는 데 사용되며, 이는 혈류를 증가시키고 감염 위험을 줄이는 데 도움이 됩니다4. NPWT는 상처에서 체액을 제거하고 부기를 줄여 육아 조직 형성을 촉진합니다1. 임상적으로 상처에 사용되는 흡입 압력의 양은 -20mmHg에서 -200mmHg 사이이지만 테스트된 가장 관련성이 높은 압력은 -125mmHg입니다5.
NPWT의 생체 외 실험은 테스트를 위한 적절한 벤치탑 모델이 없기 때문에 어려운 과제입니다. 현재 NPWT 시스템을 테스트하는 방법에는 유한 요소 분석(FEA) 컴퓨터 시뮬레이션이 포함되며, 이는 NPWT가 절개 부위에 미치는 영향을 테스트하는 데 사용되었습니다6. 다른 모델에는 유체 흡수7을 테스트하는 데 사용할 수 있는 탁상용 한천 기반 상처 모델이 포함됩니다. 생체 내에서는 돼지 모델도 상처 치유를 조사하는 데 사용되었다8. 이러한 모델은 이론적으로 상처가 어떻게 치유되어야 하는지 예측하기 위해 컴퓨터에서 쉽게 시뮬레이션할 수 있을 뿐만 아니라 모델 재료를 통해 끌어당기는 유체를 테스트하는 등의 장점이 있습니다. 생체 내 검사는 시스템이 살아있는 피험자에서 작동하는지 여부를 결정하는 데 결정적인 역할을 합니다8. 이러한 모델에는 모두 단점도 있습니다. 컴퓨터 시뮬레이션은 상처가 실생활에서 어떻게 치유되는지 정확하게 나타내지 않을 수 있습니다. 한천 기반 모델은 상처를 통해 체액이 잘 모이는 것을 보여줄 수 있지만, 조직과 근육을 통해 체액이 어떻게 당겨지는지는 나타내지 않을 수 있다7. In vivo 모델은 비용이 많이 들고 연구를 완료하는 데 상당한 리소스가 필요합니다. 또한 동물을 반쯤 움직이지 못하게 유지하는 것이 어려울 수 있으므로 동물이 시스템을 당기는 데 문제가 있을 수 있으며, 이는 혼란스러운 결과를 초래할 수 있습니다.
NPWT에는 실제 조직을 사용하여 시스템에 사용하기 위해 새로운 재료를 테스트할 수 있도록 벤치탑 모델이 필요합니다. 새로운 모델은 체액 수집이 조직과 근육에 의해 어떻게 영향을 받는지를 반영할 수 있어야 합니다. 또한 새 모델은 진공 펌프가 공급하는 압력만큼 상처가 압력을 받고 있는지 여부를 확인하기 위해 상처 부위 내부의 압력 판독값을 제공할 수 있어야 합니다. 추가 상처 드레싱, 다양한 유형의 폼 및 상처 위에 있는 다양한 접착 드레싱과 같은 새로운 재료/장치를 테스트할 수도 있습니다.
특정 상처는 감염 위험을 줄여 치유 과정을 돕기 위해 추가 상처 드레싱이 필요합니다. 추가적인 상처 드레싱 재료가 필요할 수 있는 또 다른 이유는 상처 부위 표면과 오픈 셀 폼 사이의 조직 성장을 방지하기 위해서입니다. 이 추가 드레싱은 상처 부위가 오픈 셀 폼에 달라붙는 위험을 줄여 NPWT 시스템9을 정지시킬 때 손상과 통증을 줄이는 데 도움이 됩니다. 이러한 추가 드레싱은 오픈 셀 폼 주위에 배치하여 상처 베드와 폼 사이의 장벽 멤브레인 역할을 할 수 있습니다. 파라핀 또는 바셀린이 내장된 거즈와 같은 특정 물질이 상처 부위와 거품 사이의 인터페이스로 사용되었습니다. 파라핀은 시스템에서 ound9로의 압력 전달에 영향을 미치지 않음으로써 상처 드레싱으로서 긍정적인 잠재력을 보여주었습니다. 그러나 바셀린이 함유된 거즈는 체액 수집을 억제하는 것으로 보고되었기 때문에 적절한 추가 물질로 간주되지 않았다9.
키토산 기반 상처 드레싱은 항균 효과와 생체 적합성으로 인해 NPWT 중에 추가할 수 있는 좋은 추가 드레싱이 될 수 있습니다10,11. 키토산은 키틴의 N-탈아세틸화 유도체로, 곰팡이와 절지동물에서 발견되는 천연 다당류입니다12,13. 키토산은 광범위한 그람 음성 및 그람 양성 박테리아에서 고유한 항균 특성을 나타내었습니다14. 따라서 키토산 멤브레인은 쉽게 생산할 수 있고, 유통 기한이 길며, 타고난 항균 효과를 나타내기 때문에 상처 치료에 널리 사용되고 있다10. 이 멤브레인은 또한 우수한 생체 적합성 생분해를 나타내며 무독성입니다10.
이 연구에서는 키토산 및 글리코사미노글리칸 고급 상처 치료 장치인 Foundation DRS를 조사하여 NPWT와의 생체 적합성을 확인했습니다. Foundation DRS는 상처의 세포 침입 및 신혈관 신생을 촉진하기 위해 이상적인 핸들링 특성과 다공성을 위해 제조된 생분해성 피부 재생 골격입니다. 이 장치는 다양한 부상 및 용도의 치유에 유리합니다. 욕창, 당뇨병성 족부 궤양, 1도 화상, 외상 상처, 탈피 상처 및 외과 상처와 같은 광범위한 상처에 사용하기 위해 만들어졌습니다10,11. Foundation DRS는 장치가 젖었을 때 하이드로겔로 변하는 것을 방지하는 제조 공정으로 인해 NPWT에 사용하기에 좋은 옵션입니다. 이 장치는 젖었을 때 열린 기공 구조를 유지하므로 NPWT12,13을 적용하는 동안 유체가 흐를 수 있습니다.
이 연구의 목적은 상처 드레싱 재료와 NPWT 장치의 호환성을 테스트하는 데 사용할 수 있는 벤치탑 살점 아날로그 모델을 개발하는 것이었습니다. 임상적으로 대부분의 NPWT 응용 분야에서 압력 범위는 -80mmHg에서 -125mmHg 사이입니다4. 최악의 임상 사용 조건을 시뮬레이션하기 위해 더 높은 압력 및 더 낮은 압력 설정(-25mmHg 및 -200mmHg)을 사용했습니다. 이 연구의 또 다른 목적은 키토산 상처 치료 장치의 추가가 NPWT의 압력 판독 및 체액 수집을 방해하는지 확인하는 것이었습니다. NPWT 투여 중 체액 채취가 중단되거나 압력이 손실되면 상처 치유 및 임상 결과가 저하될 수 있습니다. 수액 채취는 키토산 상처 치료 장치가 있거나 없는 테스트 그룹과 유사해야 합니다. 압력 판독값은 72시간 동안 테스트 그룹 전체에서 유사해야 합니다. 임상 환경에서 상처 드레싱은 48-72시간마다 교체되므로 본 연구에서는 각 샘플에서 72시간 동안 테스트되었습니다3. 테스트하는 동안 압력 강하가 없는지 확인하기 위해 압력 판독값을 관찰해야 합니다.
프로토콜
이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 테스트 박스 생성
- 3.2컵 플라스틱 용기를 구합니다.
- 용기 뚜껑 중앙에 직경 2인치의 구멍을 만듭니다. 또한 가장자리 씰에서 약 3/8인치 떨어진 용기 뚜껑의 두 모서리에 두 개의 1/1 구멍을 만듭니다. 구멍 톱을 사용하여 구멍을 만듭니다.
참고: 실험실에서 제작한 탁상형 살점 아날로그 상자에 연결된 상업용 NPWT 기계를 사용한 전체 테스트 설정을 보여주는 회로도가 그림 1에 나와 있습니다. 이 회로도는 상자가 실험에 사용되는 방법을 간략하게 설명합니다. 이 실험을 위해 만든 상자는 그림 2에 나와 있습니다. - 3/8 구멍 중 첫 번째 구멍에서 압력 게이지를 구멍에 직접 연결합니다.
알림: 이 게이지는 조직의 누출을 나타내는 테스트 조직 외부의 압력 강하를 모니터링하는 데 사용되었습니다. - 두 번째 3/8 구멍에서 외경이 3/8 미만인 작고 유연한 IV 튜브를 구멍을 통해 뚜껑 안쪽의 7인치 길이까지 공급합니다. 그런 다음 압력 튜브를 용기 외부의 저압 게이지에 끼웁니다.
알림: 테스트 중에 압력 튜브를 상처 부위에 넣었습니다.
2. 육체 아날로그 준비
- 시중에서 판매되는 소금에 절인 삼겹살(이하 조직이라고 함)을 사용하여 NPWT 테스트를 위해 근육 및 지방 조직을 시뮬레이션합니다.
- 너비 약 1.5인치, 깊이 0.75인치인 #21 블레이드 메스를 사용하여 조직 표면에 원형 상처 결함을 만듭니다. 그런 다음 #21 블레이드 메스로 양쪽의 지방을 통해 조직을 천공합니다.
- 상처 결손이 생긴 후에는 조직을 닦아내어 피부의 과도한 지방을 제거한 다음 탈이온수에 하룻밤 담가 과도한 염분을 제거합니다.
3. 테스트 챔버의 로딩
- 테스트 챔버 바닥을 1.5인치 두께의 오픈 셀 폼으로 채웁니다. 그런 다음 거품 위에 티슈를 놓습니다.
알림: 조직 샘플을 수동으로 중앙에 배치하여 생성된 상처 결함이 뚜껑 상단의 구멍 바로 아래에 있도록 합니다. - 실험군의 경우, 상처 결손 내부에 키토산 상처 치료 장치를 추가하여 결함의 바닥과 측면이 덮이도록 합니다. 그런 다음 나머지 결함을 오픈 셀 폼으로 채웁니다.
- 테스트 챔버의 압력 게이지에 연결된 압력 튜브를 결함을 채우는 데 사용되는 개방형 셀 폼에 삽입합니다. 이 튜브가 상처 결함 표면에서 대략 절반 아래에 위치하는지 확인하십시오.
- 접착성 상처 드레싱으로 조직을 덮습니다. 그런 다음 오픈 셀 폼의 중간 바로 위에 접착 드레싱을 작게 잘라 상처 결함을 채웁니다.
- 진공 노즐을 테스트 챔버의 뚜껑을 통해 끼우고 작은 절단이 이루어진 접착 드레싱 위에 놓습니다. 진공 노즐을 배치한 후 테스트 챔버의 뚜껑을 닫아 접착 상처 드레싱과 진공 노즐을 아래로 눌러 밀봉을 만드는 데 도움이 됩니다.
- 500mL 유체 수집 캐니스터를 진공 펌프에 연결한 다음 진공 노즐을 액체 수집 캐니스터에 연결합니다.
4. 시뮬레이션된 체액의 생성
- Marques et al.15에 따라 시뮬레이션된 체액을 만듭니다.
- NaCl 8.035g, NaHCO3 0.355g, KCl 0.225g, K2HPO43H2O0.231g,Cl2Mg6H2O0.311g, CaCl 0.292g,NaSO42-0.072g, (HOCH2)3CNH2 6.118g을 조합하여 모의 체액을 만들고, 및 960mL의 탈이온수에 39mL의 1M HCl을 주입하여 총 용액을 1L로 만듭니다.
참고: 시뮬레이션된 체액의 조성은 표 1에 나와 있습니다. - 그런 다음 시뮬레이션된 체액과 소 혈청을 3:1 비율로 결합합니다. 미생물 제어를 위해 5%의 10x 항생제/항진균제로 최종 용액을 보충합니다. 소 혈청과 항생제/항진균제를 첨가한 후 용액을 저어 냉장고에 보관합니다.
참고: 최종 솔루션을 완전한 솔루션이라고 합니다. 이 용액은 멸균 상태로 유지되어서는 안 되며 각 샘플을 테스트하기 전에 새로 만들어야 합니다.
5. 테스트 조건
- 테스트 조건에 따라 샘플에 대한 진공 펌프의 설정을 조정합니다.
참고 : 테스트 그룹은 다음과 같습니다 : 그룹 1 제어 (n = 3) : -200 mmHg에서 연속 흡입으로 거품 만로; 그룹 2 제어 (n = 3) : 0에서 -200 mmHg까지 간헐적 인 흡입으로 거품 만; 그룹 3 (n = 3) : -200 mmHg에서 연속 흡입으로 거품 아래의 키토산 상처 치료 장치; 그룹 4 (n = 3) : 0에서 -200 mmHg까지 간헐적 인 흡입력을 가진 폼 아래의 키토산 상처 치료 장치; 그룹 5 제어 (n = 3) : -25 mmHg에서 연속 흡입으로 거품 단독; 그룹 6 제어 (n = 3) : 0에서 -25 mmHg까지 간헐적 인 흡입으로 거품 단독; 그룹 7 (n = 3) : -25 mmHg에서 연속 흡입으로 거품 아래의 키토산 상처 치료 장치; 그룹 8 (n = 3) : 0에서 -25 mmHg까지 간헐적 흡입하는 폼 아래의 키토산 상처 치료 장치. - 최대 압력 테스트 그룹의 경우 압력을 -200mmHg로 설정합니다. 최소 압력 테스트 그룹의 경우 압력을 -25mmHg로 설정합니다. 그런 다음 진공 펌프 설정을 간헐적 또는 연속 압력으로 설정합니다. 모든 샘플을 72시간 동안 실행합니다.
알림: 연속 설정은 72시간 동안 지속적으로 압력을 가했습니다. 간헐적 설정은 72시간 동안 5/2 비율(5분 압력 후 압력 없이 2분)로 압력을 가했습니다. 최대값과 최소값은 임상 NPWT 시스템이 사용할 수 있는 압력 범위에 따라 선택되었습니다. 붕대 교체를 시행하기 전에 NPWT를 일반적으로 임상적으로 사용하는 시간에 따라 72시간 주기가 선택되었습니다3. - 테스트하는 동안 압력 게이지의 압력과 유체 수집 캐니스터의 유체 양을 12시간 동안 72시간마다 기록합니다.
- 육안으로 관찰된 바와 같이 체액 아날로그의 양이 테스트 챔버 상단의 75% 미만으로 떨어지면 보조 압력 게이지를 제거하고 챔버에 완전한 솔루션을 추가합니다.
참고: 샘플 준비 및 테스트 설정은 그림 3에서 볼 수 있습니다. - 72시간 후 진공 펌프를 끄고 진공 노즐에서 유체 수집 캐니스터를 분리합니다. 진공 펌프에서 유체 수집 캐니스터를 제거합니다.
- 테스트 챔버에서 조직을 제거하고 접착 상처 드레싱을 당겨 제거합니다. 그런 다음 오픈 셀 폼을 꺼내 키토산 상처 치료 장치가 아직 손상되지 않았는지 관찰합니다. 깨지거나 찢어지거나 찢어지지 않고 제거할 수 있는 경우 손상되지 않은 것으로 간주됩니다. 그러나 멤브레인을 완전히 제거할 수 있는 경우 경미한 찢어짐이나 얇아짐이 허용됩니다.
6. 통계 분석
- 통계 분석을 위해 테스트 조건당 3개의 테스트 표본에서 테스트 기간 동안 12시간마다 기록된 압력 값을 사용합니다. 통계 분석을 위해 3개의 테스트 표본의 최종 유체 수집 값이 테스트 조건별로 사용되었습니다.
참고: 모든 통계 분석에서 유의 수준은 α = 0.05로 설정되었습니다. - 각 시점에서 평균과 표준편차(n = 3/그룹)를 계산합니다. 통계 분석을 수행하기 전에 Shapiro-Wilk 검정(예: -200mmHg에서 연속 흡입, -25mmHg에서 연속 흡입, -200mmHg에서 간헐적 흡입, -25mmHg에서 간헐적 흡인)을 사용하여 각 그룹에 대해 정규성 검정을 수행하여 ANOVA 또는 Kruskal-Wallis 검정이 적절한지 확인합니다.
- 멤브레인 유형과 시간을 주요 요인으로 사용하는 양방향 ANOVA 또는 Kruskal Wallis 검정을 사용하여 동일한 압력 테스트 조건(예: -200mmHg에서 연속 흡입, -25mmHg에서 연속 흡입, -200mmHg에서 간헐적 흡입 또는 -25mmHg에서 간헐적 흡입)을 받은 실험 및 대조군에 대한 데이터를 분석합니다.
- 통계적 차이가 확인되면 사후 분석을 수행합니다. 분산 분석 후 Tukey의 HSD 사후 검정 또는 Kruskal-Wallis 검정 후 Dunn 사후 검정을 사용하여 어떤 그룹이 다른지 확인합니다.
- 대조군 및 실험군의 각 샘플에 대한 최종 유체 채취 값을 사용하여 불균등 분산을 가정하여 양측 t-검정을 수행합니다.
참고: 테스트 기간 동안 압력이 크게 떨어지지 않았는지 확인하기 위해 각 시점에서 압력을 분석했습니다. 수액 포집은 매번 검사되었지만 최종 시점에서만 분석되었습니다. 이는 각 조직의 지방과 근육 프로필이 다르기 때문에 체액 수집 속도가 달라 시점별 체액 수집보다 전체 체액 수집이 분석에 더 유용하기 때문입니다.
결과
이 연구의 목표는 조직 유사체를 사용하는 NPWT용 벤치탑 모델을 개발하고, 이 모델을 사용하여 상처 드레싱 재료와 음압 상처 치료 기계의 호환성을 조사하는 것이었습니다. 이 모델은 NPWT 기계가 상처 치료 장치를 추가하여 시간이 지나도 압력을 유지할 수 있는지 연구하는 데 사용되었습니다. 이 모델은 또한 상처 치료 장치가 있는 상태에서 NPWT 기계에 의해 생성된 압력과 유체가 장치가 없는 경우와 다른지 확인하는 데 사용되었습니다.
표준 편차 압력± 평균은 각 대조군 및 실험 그룹에 대해 72시간 테스트의 각 시점에서 계산되었습니다. 각 그룹에 대해 압력 판독값을 비교하여 시간이 지남에 따라 압력 강하 또는 압력 증가가 있는지 확인했습니다. 최대 및 최소 압력에서 4가지 테스트 조건 모두와 대조군 및 실험군 모두에 대해 72시간의 테스트 기간 동안 압력의 통계적 변화는 없었습니다(p > 0.7). 72시간의 테스트 기간 동안 어떤 그룹 내에서도 압력 강하가 보이지 않았기 때문에 키토산 멤브레인의 추가는 테스트 중 진공 펌프의 성능에 영향을 미치지 않았습니다.
최대 압력(그림 4)에서 연속 테스트 조건에 대한 대조군과 실험군의 압력 판독값 사이에는 차이가 없었지만 간헐적 테스트 조건에는 차이가 있었습니다. 연속 테스트 조건의 경우, 실험군은 대조군(-172.9mmHg ±± 2.18mmHg)과 유사한 압력 판독값(-169.6mmHg 1.56mmHg)을 보였다(p = 0.27).
최소 압력(그림 5)에서 연속 테스트 조건에 대해 대조군과 실험 그룹의 압력 판독값 간에 차이가 보였지만 간헐적 테스트 조건에는 차이가 없었습니다. 연속 테스트 조건의 경우, 실험군은 대조군(-27.1 mmHg ±± 1.75 mmHg)에 비해 낮은 압력 판독값(-21.8 mmHg 0.7 mmHg)을 보였다(p = 6 x 10-7). 간헐적 테스트 조건의 경우, 실험군은 대조군(-23.4mmHg + 1.83mmHg)과 비교하여 유사한 압력 판독값(-20.6mmHg ± 1.45mmHg)을 보였습니다(p = 0.29). 체액 포집은 모든 그룹에서 유사한 것으로 관찰되었습니다(그림 6 및 그림 7).
테스트 표본 간에 압력 판독값에 차이가 있었습니다. 이러한 차이는 주로 각 조직에 있는 지방의 양과 테스트 전에 조직이 얼마나 천공되었는지에 기인하며, 누출 여부를 정기적으로 점검하고 감지된 경우 샘플 테스트 전에 누출을 수정했기 때문에 테스트 챔버가 아닙니다.
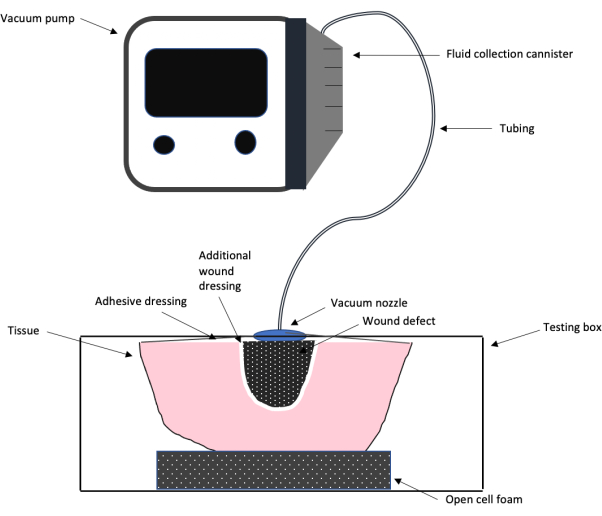
그림 1: NPWT 테스트 셋업의 개략도. 진공 펌프, 튜브, 접착 상처 드레싱 및 폼, 추가 상처 드레싱 및 상처 결함을 포함하여 이 작업에 사용된 음압 상처 치료 시스템의 전반적인 테스트 설계 설정을 보여주는 회로도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: NPWT 벤치탑 모델 설계. NPWT 벤치탑 모델을 위해 제작된 플라스틱 상자 디자인의 대표 이미지입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 시편을 준비하고 테스트를 위한 구성 요소를 조립하는 단계. 샘플 준비, 테스트 챔버 로딩 및 전체 설정과 같은 샘플을 테스트하기 위해 수행된 단계. 이 실험의 테스트 챔버 설정은 두 개의 압력 게이지를 보여줍니다: 하나는 압력을 읽기 위해 측면에 연결되고(왼쪽) 다른 하나는 안전 장치로 사용되며 챔버에 더 많은 유체를 추가하기 위해 제거됩니다(오른쪽). 테스트 챔버는 또한 거품으로 채워진 조직의 위치, 상처 드레싱 및 상단에 배치된 진공 노즐을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 최대 압력 비교. 평균 ± 72시간 동안 최대 압력(-200mmHg)에서 대조군 및 실험군(그룹 1-4, n = 3/그룹)에 대한 표준 편차 압력 판독값. 파란색 점선과 회색 파선은 연속적인 압력 그룹을 나타냅니다. 주황색 점선과 노란색 점선 및 점선은 간헐적인 압력 그룹을 나타냅니다. 압력 판독 값은 각 그룹의 3 개 샘플에서 0-72 시간 동안 12 시간 단위로 평균화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
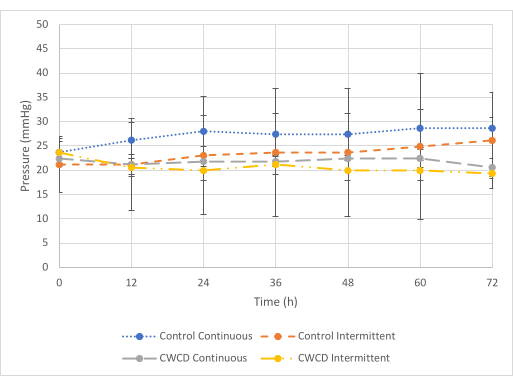
그림 5: 최소 압력 비교. 72시간 동안 최소 압력(-25mmHg)에서 대조군 및 실험군(그룹 5-8, n = 3/그룹)에 대한 평균 ± 표준 편차 압력 판독값. 파란색 점선과 회색 파선은 연속적인 압력 그룹을 나타냅니다. 주황색 점선과 노란색 점선 및 점선은 간헐적인 압력 그룹을 나타냅니다. 압력 판독 값은 각 그룹의 3 개 샘플에서 0-72 시간 동안 12 시간 단위로 평균화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 그룹 1에서 4까지의 최종 유체 수취의 대표 이미지. (A) 최대 압력에서 연속 흡입 하에서 그룹 1 대조 샘플에 대한 72시간 후 유체 회수의 대표 이미지. (B) 최대 압력에서 간헐적 흡입 하에서 그룹 2 대조 샘플에 대한 72시간 후 유체 회수의 대표 이미지. (C) 최대 압력에서 연속 흡입 하에서 그룹 3 테스트 샘플에 대한 72시간 후 유체 수집의 대표 이미지. (D) 최대 압력에서 간헐적 흡입 하에서 그룹 4 테스트 샘플에 대한 72시간 후 유체 회수의 대표 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 그룹 5에서 8까지의 최종 유체 수취의 대표 이미지. (A) 최소 압력에서 연속 흡입 하에서 그룹 5 대조군 샘플에 대한 72시간 후 유체 회수의 대표적인 이미지. (B) 최소 압력에서 간헐적 흡입 하에서 그룹 6 대조군에 대한 72시간 후 유체 회수의 대표 이미지. (C) 최소 압력에서 연속 흡입 하에서 그룹 7 테스트 샘플에 대한 72시간 후 유체 회수의 대표 이미지. (D) 최소 압력에서 간헐적 흡입 하에서 Group 8 테스트 샘플에 대한 72시간 후 유체 회수의 대표 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시약 | 분량 |
| 소금 | 8.035 지 |
| 중탄산나트륨 | 0.355 지 |
| 염화칼륨 | 0.225 지 |
| 인산칼륨 이염기성 삼수화물 | 0.231 지 |
| 염화마그네슘 육수화물 | 0.311 지 |
| 1M 염산 | 39 밀리리터 |
| 염화칼슘 | 0.292 지 |
| 황산나트륨 | 0.072 지 |
| 트리스(하이드록시메틸) 아미노메탄 | 6.118 지 |
표 1: 1L의 DI 워터에서 시뮬레이션된 체액을 준비하는 데 필요한 시약.
토론
NPWT를 위한 몇 가지 벤치탑 모델이 있지만, 여기에는 상당한 한계가 있습니다. Loveluck 등은 NPWT가 봉합된 절개 부위에 어떤 영향을 미치는지 확인하기 위해 FEA 컴퓨터 모델을 개발했지만 추가적인 상처 드레싱 재료는 고려하지 않았습니다6. Rycerz 등은 NPWT7 시행 중 상처에 대한 점안 용액 분포를 평가하기 위해 한천 기반 모델을 개발했습니다. 한천은 서로 다른 모델에서 수용성 물질/염료의 분포를 평가하기 위한 매개체를 제공했지만, NPWT에 노출된 근육 및 지방 조직을 포함하는 상처의 복잡한 이질적인 구조를 복제하지 않는 단순한 균질한 물질입니다. 또한, 이러한 검사는 최대 3.5시간의 비교적 짧은 시간 동안 수행되었으며, 임상 조건에서는 상처 드레싱을 교체하기 전에 48-72시간 동안 진공을 켜두는 것이 일반적입니다3. 또는 in vivo, 돼지 모델을 사용할 수 있지만 비용이 많이 들고 사용 전에 특별한 감독 및 승인 절차가 필요합니다7. 다양한 실험 조건에서 진공 펌프와 관련된 상처 베드 내부의 체액 수집 및 압력을 평가하기 위해 사실적인 조직 구성 및 구조를 사용하는 현재 벤치탑 모델은 존재하지 않습니다.
이러한 한계를 해결하기 위해 벤치탑 모델은 상처 결함 내부에서 72시간 동안의 압력을 판독하여 진공 펌프 판독값을 기준으로 상처에 얼마나 많은 압력이 가해지고 있는지 확인할 수 있도록 설계 및 제작되었습니다. 이것은 폼의 중앙을 통과하는 압력 튜브에 연결된 압력 게이지를 사용하여 달성되었습니다. 테스트 중 용기의 유체를 보충하고 진공에 영향을 주지 않기 위해 두 번째 압력 게이지가 추가되었으며, 이는 추가 유체를 피펫팅하기 위해 제거할 수 있습니다. 이 두 번째 압력계는 0을 읽어야 하기 때문에 안전 장치 역할도 했으며, 0을 읽지 않으면 조직 샘플 대신 테스트 챔버에 압력이 가해져 테스트가 무효화됩니다. 이 시스템이 해결한 또 다른 문제는 샘플에 충분한 밀봉이 있는지 확인하는 것이었습니다. 이것은 테스트 챔버의 뚜껑이 닫혔을 때 샘플 아래에 거품 조각을 배치하여 그런 식으로 들어 올렸고, 추가 공간없이 챔버를 닫을 수있을만큼 조직을 아래로 밀어 넣었습니다.
삼겹살은 상처 조직 유사체의 필요성을 해결하기 위해 사용되었습니다. 돼지 위 아래쪽에서 나오는 삼겹살이 사용된 이유는 복잡한 인간의 근육과 지방 조직을 모방하고 상처 조직의 특성을 더 잘 시뮬레이션할 수 있는 지방과 근육층이 있기 때문입니다. 또한 삼겹살은 저렴하게 쉽게 구할 수 있으며 사용하기 전에 경화염을 제거하기 위해 최소한의 조작만 필요합니다. 사용된 조직 샘플의 다양한 구성으로 인해 그룹 간에 나타나는 일부 압력 차이가 발생했을 수 있습니다. 다른 지방과 조직 구성 또는 거품이 조직에 배치되는 방식은 기계가 끌어당길 수 있는 압력에 영향을 미쳤을 수 있습니다. 임상적으로 환자는 근육, 지방 및 조직의 변화도 나타내므로 삼겹살 구성으로 인해 보이는 차이는 환자에서 장치가 작동하는 방식의 변화를 나타낼 수 있습니다.
이 벤치탑 모델 설계는 또한 NPWT의 새로운 응용 분야에서 다양한 압력에서 다양한 상처 드레싱 재료에 이르기까지 체외에서 테스트할 수 있도록 합니다. 또한 진공 펌프의 압력 판독값만 관찰하는 대신 폼이 있는 상처 베드 내부에서 압력을 기록할 수 있습니다. 이것은 펌프에서 가해지는 압력이 상처 내부에 가해지고 있는지 여부를 보여줍니다. 이 연구에서 만든 모델은 컴퓨터 시뮬레이션이나 생체 내 테스트를 사용하지 않고도 유체 수집 및 압력을 기록할 수 있기 때문에 유용합니다. 마찬가지로, 이 벤치탑 모델은 한천 기반 재료가 아닌 임상 상태를 더 가깝게 모방한 근육 및 지방 조직에서 NPWT 기계가 어떻게 작동하는지 확인할 수 있기 때문에 유리합니다. 이 모델은 살아있는 동물을 사용할 필요가 없고 저렴한 품목으로 만들어지기 때문에 생체 내 테스트보다 저렴합니다.
이 모델은 시판되는 키토산 상처 치료 장치가 있는 경우와 없는 경우, NPWT 기계에서 생성된 압력과 수집된 유체를 비교하는 데 사용되었습니다. NPWT 기계는 키토산 첨단 상처 치료 장치의 유무에 관계없이 72시간 동안 압력을 유지할 수 있었습니다. NPWT 기계를 상처 치료 장치와 함께 또는 없이 사용했을 때, 최대 및 최소 압력 테스트 조건에서 72시간 동안 대조군(상처 치료 장치 없음)과 테스트(상처 치료 장치 포함) 그룹 간의 압력 판독값에는 차이가 없거나 미미한 차이만 있었습니다. 그러나 처리군 전반에 걸쳐 대조막과 시험막 사이의 체액 수거에는 차이가 없었습니다.
프로토콜의 특정 단계는 각 샘플에 대한 압력 및 유체 채취 판독값이 정확한지 확인하는 데 중요했습니다. 테스트 프로세스에서 가장 중요한 단계는 1단계에서 찾을 수 있습니다. 정확한 압력 판독값을 기록하기 위해 생성된 테스트 상자에는 누출이 없어야 했습니다. 그렇지 않으면 압력 게이지가 제대로 작동하지 않습니다. 이 프로세스의 다른 중요한 단계에는 2.2 및 3.1단계가 포함됩니다. 2.2단계는 상처 결손이 샘플의 최종 지방층을 관통할 수 있을 만큼 충분히 깊어야 하고 체액 채취를 위해 조직을 천공해야 했기 때문에 매우 중요했습니다. 3.1단계는 결함을 열린 기공 폼으로 채워야 했기 때문에 매우 중요했습니다. 거품은 전체 상처 결함을 채우고 꼭 맞아야 합니다. 그렇지 않으면 진공과 적절한 밀봉이 생성되지 않아 압력 판독 문제가 발생합니다. 3.4단계는 접착성 상처 드레싱이 전체 샘플을 덮어야 했기 때문에 매우 중요했습니다. 접착 상처 드레싱이 전체 샘플을 덮지 않으면 테스트 챔버 내부에 압력 누출이 있을 수 있습니다.
이 작업의 한계는 비교할 수 있는 모델이 없다는 것입니다. 다른 사람이 모델을 복제하고 사용하면 모델의 유용성을 확인하는 데 도움이 됩니다. 이 모델의 또 다른 한계는 압력 튜브를 압력 게이지에 연결하여 공기 누출이 발생할 수 있다는 것입니다. 다른 연결 접근 방식을 사용하여 공기 누출 위험을 최소화하는 더 나은 방법은 향후 연구에 도움이 될 수 있습니다.
이 벤치탑 모델은 추가적인 상처 드레싱이 NPWT 시스템의 성능을 변경하지 않는지 확인하기 위해 체액 수집 및 압력 생성을 검사하여 새로운 소재의 호환성을 테스트할 수 있도록 NPWT에 필요했습니다. 생성된 모델은 NPWT에서 많은 잠재적 응용 프로그램을 가지고 있습니다. 상처 드레싱 재료에서 다양한 상처 드레싱 재료 및 국소 약물 전달 옵션을 테스트하는 데 사용할 수 있습니다. 이 모델을 사용하여 절개 상처, 터널 형성 또는 화상 상처와 같은 여러 유형의 상처를 만들고 테스트할 수 있습니다. 다양한 상처 유형에 대해 압력 및 체액 수집을 검사하여 최적의 NPWT 설정을 결정할 수 있습니다. 이 모델은 또한 피부 샘플에서 NPWT를 테스트하는 방법을 결정할 수 있는 다른 길을 열어주었지만, 이전에는 모델이 대부분 다른 재료나 시뮬레이션 테스트에 국한되었습니다. 결론적으로, 설계된 벤치탑 모델은 상처 드레싱을 위한 상처 침대 내부의 압력을 성공적으로 평가하여 NPWT 시스템과 호환되는지 확인할 수 있었습니다.
전반적으로, 테스트된 키토산 상처 치료 장치는 테스트된 조건에서 NPWT 시스템의 압력이나 체액 수집을 억제하지 않는 것으로 나타났습니다. 이 연구에서는 조직 유사체를 사용하여 장기간에 걸친 테스트를 허용하고 상처 드레싱 재료의 사용을 수용할 수 있는 기능을 통해 현재 벤치탑 모델의 한계를 극복하기 위해 벤치탑 모델을 개발했습니다.
공개
이 작업은 Bionova Medical, Inc.(테네시주 저먼타운)의 보조금으로 지원되었습니다.
감사의 말
이 연구는 멤피스 대학교 의생명공학과와 바이오노바 메디컬의 도움으로 가능했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
참고문헌
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20 (2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유