Method Article
تطوير نموذج منضدة لتقييم توافق مواد تضميد الجروح مع أنظمة علاج الجروح ذات الضغط السلبي
In This Article
Summary
تقدم هذه الدراسة نموذجا على الطاولة مصمما لتقييم توافق مواد تضميد الجروح مع أنظمة علاج الجروح ذات الضغط السلبي من خلال تقييم الضغط وجمع السوائل على مدار 72 ساعة في ظل إعدادات الضغط المستمر والمتقطع.
Abstract
تعمل أنظمة علاج الجروح بالضغط السلبي (NPWT) على تسهيل التئام الجروح عن طريق تطبيق ضغط تحت الغلاف الجوي على فراش الجرح ، مما يعزز تكوين الأنسجة الحبيبية ويقلل من الالتهاب. يمكن استخدام ضمادات الجروح مع هذه الأنظمة لتعزيز الشفاء. ومع ذلك ، فإن تأثيرات الضمادات على أداء جهاز NPWT يصعب تقييمها. كان الغرض من هذه الدراسة هو تطوير نموذج تناظري للحوم على الطاولة لاختبار توافق مواد تضميد الجروح مع أجهزة NPWT. في هذه الدراسة ، تم تقييم جهاز العناية بالجروح المتقدم القائم على الشيتوزان لتأثيراته على أداء NPWT تحت ضغوط العلاج القصوى والصغرى. كان الهدف هو استخدام النموذج لمقارنة قراءات الضغط وجمع السوائل للعينات مع وبدون جهاز العناية بالجروح الشيتوزان. تم بناء نموذج الطاولة باستخدام صندوق بلاستيكي متصل بمقاييس ضغط متعددة. تم إنشاء عيب دائري على قطعة من بطن الخنزير ، واستخدمها كنظير للحوم ، وتم إدخالها في الصندوق. تم ملء العيب برغوة أو رغوة NPWT القياسية جنبا إلى جنب مع ضمادة الجرح. تمت إضافة سائل الجسم المحاكي الذي يحتوي على مصل البقر إلى الصندوق ، والذي تم اختباره بعد ذلك إما بضغط أقصى (-200 مم زئبق) أو الحد الأدنى (-25 مم زئبق) لمدة 72 ساعة. تم تسجيل الضغط وجمع السوائل كل 12 ساعة. نجح نظام NPWT في الحفاظ على الضغط خلال فترة الاختبار التي استمرت 72 ساعة ، مع ضمادات الاختبار وبدونها. لم تؤثر إضافة ضمادات الجرح على جمع السوائل. أثبت صندوق الاختبار فعاليته كنموذج على الطاولة ، حيث يمكن إغلاقه والحفاظ عليه في ظروف الفراغ خلال فترة الاختبار التي تبلغ 72 ساعة. أظهر هذا النموذج بنجاح فائدته في تقييم توافق مواد تضميد الجروح مع أنظمة NPWT.
Introduction
توجد مناهج علاجية مختلفة للمساعدة في إدارة الجروح وعملية التئامها. تشمل هذه الأساليب العلاجية ضمادات الجروح المتقدمة ، وعوامل النمو ، والعلاج بالأكسجين عالي الضغط ، وبدائل الجلد ، وعلاج الجروح بالضغط السلبي (NPWT) 1. يشير NPWT إلى أنظمة تضميد الجروح التي تطبق ضغطا شبه جوي بشكل مستمر أو متقطع على النظام ، مما يوفر ضغطا سلبيا على سطح الجرح. أصبح NPWT طريقة علاج شائعة لإدارة الجروح الحادة أو المزمنة2. يتكون نظام NPWT من رغوة خلية مفتوحة ، وتضميد جروح لاصقة ، ونظام تجميع السوائل ، ومضخة شفط3. تستخدم مضخة الشفط ، أو الفراغ ، للحفاظ على ضغط ثابت على الجرح ، مما يساعد على زيادة تدفق الدم وتقليل خطر الإصابةبالعدوى 4. يعزز NPWT تكوين الأنسجة الحبيبية عن طريق إزالة السوائل من الجرح وتقليل التورم1. سريريا ، يتراوح مقدار ضغط الشفط المستخدم للجروح من -20 مم زئبق إلى -200 مم زئبق ، ولكن الضغط الأكثر صلة الذي تم اختباره هو -125 مم زئبق5.
تمثل تجارب Ex vivo ل NPWT تحديا بسبب عدم وجود نماذج مناسبة على الطاولة للاختبار. تشمل الطرق الحالية لاختبار أنظمة NPWT المحاكاة الحاسوبية لتحليل العناصر المحدودة (FEA) ، والتي تم استخدامها لاختبار كيفية تأثير NPWT على مواقع الشق6. تشمل النماذج الأخرى نماذج الجروح القائمة على أجار ، والتي يمكن استخدامها لاختبار امتصاص السوائل7. في الجسم الحي ، تم استخدام نماذج الخنازير أيضا لفحص التئام الجروح8. تتمتع هذه النماذج بمزايا مثل سهولة المحاكاة على الكمبيوتر للتنبؤ بكيفية التئام الجرح من الناحية النظرية ، بالإضافة إلى اختبار السائل الذي يتم سحبه من خلال مادة نموذجية. يعد اختبار in vivo نهائيا لتحديد ما إذا كان النظام يعمل في الأشخاصالمباشرين 8. هذه النماذج كلها لها عيوب أيضا. قد لا تمثل المحاكاة الحاسوبية بدقة كيف يلتئم الجرح في الحياة الواقعية. قد يظهر النموذج القائم على أجار تجنيفا جيدا للسوائل يتم سحبه من خلال الجرح ولكنه قد لا يمثل كيفية سحب السوائل من خلال الأنسجة والعضلات7. نماذج In vivo باهظة الثمن وتتطلب موارد كبيرة لإكمال الدراسة. أيضا ، قد يكون من الصعب إبقاء شبه غير متحركة ، لذلك قد تكون هناك تحديات في سحبها للنظام ، مما قد يكون له نتائج مربكة.
هناك حاجة إلى نموذج منضدة ل NPWT بحيث يمكن اختبار مواد جديدة لاستخدامها مع النظام باستخدام الأنسجة الفعلية. يجب أن يكون النموذج الجديد قادرا على عكس كيفية تأثر تجمع السوائل بالأنسجة والعضلات. يجب أن يكون النموذج الجديد قادرا أيضا على توفير قراءات الضغط داخل قاع الجرح لتحديد ما إذا كان الجرح يتلقى نفس القدر من الضغط الذي توفره مضخة التفريغ. يمكن أيضا اختبار مواد / أجهزة جديدة ، مثل ضمادات الجروح الإضافية ، وأنواع مختلفة من الرغوة ، والضمادات اللاصقة المختلفة فوق الجرح.
تتطلب بعض الجروح ضمادات جروح إضافية للمساعدة في عملية الشفاء عن طريق تقليل خطر الإصابة بالعدوى. سبب آخر قد تكون هناك حاجة إلى مواد تضميد جروح إضافية هو منع نمو الأنسجة بين سطح قاع الجرح ورغوة الخلية المفتوحة. يقلل هذا الضمادة الإضافية من خطر التصاق فراش الجرح برغوة الخلية المفتوحة ، مما يساعد على تقليل الضرر والألم عند إيقاف نظام NPWT9. يمكن وضع هذه الضمادات الإضافية حول رغوة الخلية المفتوحة لتكون بمثابة غشاء حاجز بين قاع الجرح والرغوة. تم استخدام مواد معينة كواجهة بين فراش الجرح والرغوة ، مثل البارافين أو الشاش المدمج في الفازلين. أظهر البارافين إمكانات إيجابية كضمادة للجروح من خلال عدم التأثير على نقل الضغط من النظام إلىالطابق 9. ومع ذلك ، تم الإبلاغ عن أن الشاش المدمج في الفازلين يمنع جمع السوائل وبالتالي لم يعتبر مادة إضافيةمناسبة 9.
قد تكون ضمادات الجروح القائمة على الشيتوزان ضمادة إضافية جيدة لإضافتها أثناء NPWT نظرا لآثارها المضادة للميكروبات والتوافق الحيوي10،11. الشيتوزان هو مشتق N-deacetylated من الكيتين ، وهو عديد السكاريد الطبيعي الموجود في الفطريات والمفصليات12،13. أظهر الشيتوزان خصائص مضادة للبكتيريا متأصلة في مجموعة واسعة من البكتيريا سالبة الجرام وموجبةالجرام 14. لذلك ، أصبحت أغشية الشيتوزان شائعة في علاج الجروح لأنه يمكن إنتاجها بسهولة ، ولها عمر افتراضي طويل ، وتظهر تأثيرات فطرية مضادةللميكروبات 10. تظهر هذه الأغشية أيضا تحلل حيوي جيد للتوافق الحيوي ، وهي غير سامة10.
في هذه الدراسة ، تم فحص Foundation DRS ، وهو جهاز متقدم للعناية بالجروح للشيتوزان والجليكوزامينوجليكان ، لتحديد توافقه الحيوي مع NPWT. Foundation DRS عبارة عن سقالة تجديد جلدية قابلة للتحلل الحيوي تم تصنيعها لخصائص المناولة المثالية والمسامية لتعزيز الغزو الخلوي وتكوين الأوعية الجديدة في الجروح. هذا الجهاز مفيد للشفاء في مجموعة من الإصابات والاستخدامات المختلفة. تم إنشاؤه للاستخدام المقصود في مجموعة واسعة من الجروح ، مثل تقرحات الضغط ، وتقرحات القدم السكرية ، والحروق من الدرجة الأولى ، وجروح الصدمات ، والجروح المفككة ، والجروح الجراحية10،11. يعد Foundation DRS خيارا جيدا للاستخدام في NPWT نظرا لعملية التصنيع الخاصة به ، والتي تمنع الجهاز من التحول إلى هيدروجيل عندما يكون مبللا. يحافظ هذا الجهاز على بنية مسام مفتوحة عند ترطيبها ، مما يسمح للسوائل بالتدفق أثناء تطبيق NPWT12،13.
كان الهدف من هذه الدراسة هو تطوير نموذج تناظري للحوم على الطاولة يمكن استخدامه لاختبار توافق مواد تضميد الجروح مع أجهزة NPWT. سريريا ، تتراوح الضغوط من -80 مم زئبق إلى -125 مم زئبق لمعظم تطبيقات NPWT4. لمحاكاة ظروف الاستخدام السريري في أسوأ الحالات ، تم استخدام إعداد ضغط أعلى وأقل (-25 مم زئبق و -200 مم زئبق). كان الهدف الآخر لهذه الدراسة هو تحديد ما إذا كانت إضافة جهاز العناية بالجروح الشيتوزان تتداخل مع قراءات الضغط وجمع السوائل ل NPWT. يمكن أن تؤدي الاضطرابات في تجميع السوائل أو فقدان الضغط أثناء NPWT إلى ضعف التئام الجروح والنتائج السريرية. يجب أن يكون جمع السوائل مشابها لمجموعات الاختبار مع جهاز العناية بالجروح الشيتوزان وبدونه. يجب أن تكون قراءات الضغط متشابهة أيضا عبر مجموعات الاختبار على مدار 72 ساعة. في الإعدادات السريرية ، يتم تغيير ضمادة الجرح كل 48-72 ساعة ، لذلك تم اختبار كل عينة لمدة 72 ساعة في هذه الدراسة3. أثناء الاختبار ، يجب مراعاة قراءات الضغط لضمان عدم وجود انخفاض في الضغط.
Protocol
تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. إنشاء صندوق الاختبار
- احصل على وعاء بلاستيكي سعة 3.2 كوب.
- قم بإنشاء ثقب قطره 2 بوصة في وسط غطاء الحاوية. أيضا ، قم بعمل فتحتين 3/8 في زاويتين من غطاء الحاوية على بعد حوالي 1/2 بوصة من ختم الحافة. استخدم منشار ثقب لإنشاء الثقوب.
ملاحظة: يظهر في الشكل 1 مخطط يوضح إعداد الاختبار الكلي باستخدام آلة NPWT تجارية متصلة بصندوق تناظري من اللحم على الطاولة مصمم في المختبر. يوضح هذا التخطيطي كيفية استخدام المربع للتجارب. يظهر المربع الذي تم إنشاؤه لهذه التجربة في الشكل 2. - في أول الفتحات 3/8 ، قم بتوصيل مقياس الضغط مباشرة بالفتحة.
ملاحظة: تم استخدام هذا المقياس لمراقبة انخفاض الضغط خارج أنسجة الاختبار ، مما يشير إلى حدوث تسرب في الأنسجة. - في الفتحة الثانية 3/8 ، قم بتغذية أنبوب IV مرن صغير بقطر خارجي أقل من 3/8 من خلال الفتحة بطول 7 بوصات على الجانب الداخلي من الغطاء. بعد ذلك ، قم بتركيب أنبوب الضغط على مقياس ضغط منخفض خارج الحاوية.
ملاحظة: تم وضع أنبوب الضغط في سرير الجرح أثناء الاختبار.
2. تحضير اللحم التناظرية
- استخدم بطن لحم الخنزير المملح المتاح تجاريا ، والمعروف باسم الأنسجة ، لمحاكاة العضلات والأنسجة الدهنية لاختبار NPWT.
- قم بإنشاء عيب دائري في الجرح في سطح الأنسجة باستخدام مشرط شفرة # 21 يبلغ عرضه حوالي 1.5 بوصة وعمق 0.75 بوصة. بعد ذلك ، قم بتقطيع الأنسجة من خلال الدهون على كل جانب بمشرط شفرة # 21.
- بعد حدوث عيب الجرح ، امسح الأنسجة لإزالة الدهون الزائدة من الجلد ، ثم انقعها طوال الليل في ماء منزوع الأيونات لإزالة الملح الزائد.
3. تحميل غرفة الاختبار
- املأ الجزء السفلي من غرفة الاختبار برغوة مفتوحة الخلية بسمك 1.5 بوصة. ثم ضع المنديل فوق الرغوة.
ملاحظة: قم بتوسيط عينة الأنسجة يدويا بحيث يكون عيب الجرح الناتج أسفل الفتحة الموجودة أعلى الغطاء مباشرة. - بالنسبة للمجموعات التجريبية ، أضف جهاز العناية بجروح الشيتوزان داخل عيب الجرح بحيث يتم تغطية الجزء السفلي وجوانب العيب. ثم املأ باقي العيب برغوة الخلية المفتوحة.
- أدخل أنبوب الضغط المتصل بمقياس الضغط الموجود في غرفة الاختبار في رغوة الخلية المفتوحة المستخدمة لملء العيب. تأكد من وضع هذا الأنبوب في منتصف الطريق تقريبا من سطح عيب الجرح.
- قم بتغطية الأنسجة بضمادة الجرح اللاصقة. بعد ذلك ، قم بعمل قطع صغير على الضمادة اللاصقة ، مباشرة أعلى منتصف رغوة الخلية المفتوحة ، لملء عيب الجرح.
- قم بربط فوهة التفريغ من خلال غطاء غرفة الاختبار وضعها فوق الضمادة اللاصقة ، حيث تم إجراء القطع الصغير. بعد وضع فوهة التفريغ ، أغلق غطاء غرفة الاختبار للضغط على ضمادة الجرح اللاصقة وفوهة التفريغ لأسفل ، مما يساعد على إنشاء ختم.
- قم بتوصيل علبة تجميع السوائل سعة 500 مل بمضخة التفريغ ثم قم بتوصيل فوهة التفريغ بعلبة تجميع السوائل.
4. إنشاء سائل الجسم المحاكاة
- قم بإنشاء سائل محاكاة للجسم وفقا ل Marques et al.15.
- اصنع سائل الجسم المحاكي عن طريق الجمع بين 8.035 جم من كلوريد الصوديوم ، 0.355 جم من NaHCO3 ، 0.225 جم من KCl ، 0.231 جم من K2HPO43H2O ، 0.311 جم من Cl2Mg6H2O ، 0.292 جم من CaCl ، 0.072 جم من NaSO42- ، 6.118 جم من (HOCH2) 3CNH2 ، و 39 مل من 1 م حمض الهيدروكلوريك في 960 مل من الماء منزوع الأيونات ليصل المحلول الكلي إلى 1 لتر.
ملاحظة: يظهر تكوين سائل الجسم المحاكي في الجدول 1. - بعد ذلك ، امزج سائل الجسم المحاكي مع مصل الأبقار بنسبة 3: 1. استكمل المحلول النهائي بنسبة 5٪ من 10x مضادات حيوية / مضادات الفطريات للتحكم في الميكروبات. قلب المحلول بعد إضافة مصل الأبقار والمضادات الحيوية / مضادات الفطريات ، ثم قم بتخزينه في الثلاجة.
ملاحظة: سيشار إلى الحل النهائي على أنه الحل الكامل. لا ينبغي أن يظل هذا المحلول معقما ويجب أن يكون طازجا قبل اختبار كل عينة.
5. شروط الاختبار
- اضبط الإعدادات على مضخة التفريغ للعينات حسب حالة الاختبار.
ملاحظة: مجموعات الاختبار هي: المجموعة 1 التحكم (ن = 3): الرغوة وحدها مع شفط مستمر عند -200 مم زئبق ؛ المجموعة 2 التحكم (ن = 3): الرغوة وحدها مع شفط متقطع من 0 إلى -200 مم زئبق؛ المجموعة 3 (ن = 3): جهاز العناية بالجروح الشيتوزان تحت الرغوة مع شفط مستمر عند -200 مم زئبق ؛ المجموعة 4 (ن = 3): جهاز العناية بالجروح الشيتوزان تحت الرغوة مع شفط متقطع من 0 إلى -200 مم زئبق ؛ المجموعة 5 التحكم (ن = 3): الرغوة وحدها مع شفط مستمر عند -25 مم زئبق ؛ المجموعة 6 التحكم (ن = 3): الرغوة وحدها مع شفط متقطع من 0 إلى -25 مم زئبق ؛ المجموعة 7 (ن = 3): جهاز العناية بالجروح الشيتوزان تحت الرغوة مع شفط مستمر عند -25 مم زئبق ؛ المجموعة 8 (ن = 3): جهاز العناية بالجروح الشيتوزان تحت الرغوة مع شفط متقطع من 0 إلى -25 مم زئبق. - بالنسبة لمجموعات اختبار الضغط الأقصى ، اضبط الضغط على -200 مم زئبق. بالنسبة لمجموعات اختبار الضغط الأدنى ، اضبط الضغط على -25 مم زئبق. بعد ذلك ، ضع إعدادات مضخة التفريغ على ضغط متقطع أو مستمر. قم بتشغيل جميع العينات لمدة 72 ساعة.
ملاحظة: الإعداد المستمر يطبق الضغط بشكل مستمر لمدة 72 ساعة. طبق الإعداد المتقطع ضغطا بنسبة 5/2 (5 دقائق من الضغط ، متبوعا بدقيقتين بدون ضغط) لمدة 72 ساعة. تم اختيار القيم القصوى والدنيا بناء على نطاق الضغط الذي يمكن أن تستخدمه أنظمة NPWT السريرية. تم اختيار دورة مدتها 72 ساعة بناء على طول الفترة الزمنية التي يتم فيها استخدام NPWT سريريا قبل إجراء تغيير الضمادة3. - أثناء الاختبار ، سجل الضغط على مقياس الضغط وكمية السائل في علبة تجميع السوائل كل 12 ساعة لمدة 72 ساعة.
- إذا انخفضت كمية التناظرية لسائل الجسم إلى أقل من 75٪ من الجزء العلوي من غرفة الاختبار ، كما لوحظ بصريا ، فقم بإزالة مقياس الضغط الثانوي وإضافة محلول كامل إلى الغرفة.
ملاحظة: يمكن رؤية إعداد العينات وإعداد الاختبار في الشكل 3. - بعد 72 ساعة ، قم بإيقاف تشغيل مضخة التفريغ وافصل علبة تجميع السوائل عن فوهة التفريغ. قم بإزالة علبة تجميع السوائل من مضخة التفريغ.
- قم بإزالة الأنسجة من غرفة الاختبار واسحب ضمادة الجرح اللاصقة. بعد ذلك ، أخرج رغوة الخلية المفتوحة ولاحظ ما إذا كان جهاز العناية بجروح الشيتوزان لا يزال سليما. يعتبر سليما إذا كان من الممكن إزالته دون كسر أو تمزيق أو تمزق ؛ ومع ذلك ، فإن التمزقات الطفيفة أو التخفيف مقبولة إذا كان من الممكن إزالة الغشاء تماما.
6. التحليل الإحصائي
- استخدم قيم الضغط التي تم تسجيلها كل 12 ساعة خلال فترة الاختبار من عينات الاختبار الثلاث لكل حالة اختبار للتحليل الإحصائي. للتحليل الإحصائي ، تم استخدام القيمة النهائية لجمع السوائل من عينات الاختبار الثلاث لكل حالة اختبار.
ملاحظة: بالنسبة لجميع التحليلات الإحصائية ، تم تحديد مستوى الدلالة عند α = 0.05. - احسب المتوسط والانحرافات المعيارية (ن = 3 / مجموعة) في كل نقطة زمنية. قبل إجراء التحليل الإحصائي ، قم بإجراء اختبار طبيعي لكل مجموعة باستخدام اختبار Shapiro-Wilk (على سبيل المثال ، الشفط المستمر عند -200 مم زئبق ، والشفط المستمر عند -25 مم زئبق ، والشفط المتقطع عند -200 مم زئبق ، والشفط المتقطع عند -25 مم زئبق) لتحديد ما إذا كان اختبار ANOVA أو Kruskal-Wallis مناسبا.
- تحليل البيانات للمجموعات التجريبية والضابطة الخاضعة لنفس ظروف اختبار الضغط (على سبيل المثال ، الشفط المستمر عند -200 مم زئبق ؛ الشفط المستمر عند -25 مم زئبق ؛ الشفط المتقطع عند -200 مم زئبق أو الشفط المتقطع عند -25 مم زئبق) باستخدام اختبار ANOVA ثنائي الاتجاه أو Kruskal Wallis باستخدام نوع الغشاء والوقت كعوامل رئيسية.
- إذا تم تحديد الفروق الإحصائية، فقم بإجراء تحليلات لاحقة. استخدم اختبار Tukey's HSD اللاحق بعد ANOVA أو اختبار Dunn اللاحق بعد اختبار Kruskal-Wallis لتحديد المجموعات المختلفة.
- باستخدام قيم تجميع السوائل النهائية لكل عينة في المجموعات الضابطة والتجريبية ، قم بإجراء اختبار t ثنائي الذيل بافتراض الفروق غير المتساوية.
ملاحظة: تم تحليل الضغط في كل نقطة زمنية للتأكد من عدم وجود انخفاض كبير في الضغط طوال فترة الاختبار. بينما تم فحص جمع السوائل في كل مرة ، تم تحليله فقط في النقطة الزمنية النهائية. وذلك لأن كل نسيج يحتوي على ملامح مختلفة للدهون والعضلات ، مما أدى إلى معدلات مختلفة لجمع السوائل ، مما يجعل جمع السوائل بشكل عام أكثر فائدة للتحليل من جمع السوائل حسب النقاط الزمنية.
النتائج
كان الهدف من الدراسة هو تطوير نموذج منضدة ل NPWT يستخدم نظيرا للأنسجة واستخدام النموذج للتحقيق في توافق مواد تضميد الجروح مع آلة علاج الجروح ذات الضغط السلبي. تم استخدام النموذج لدراسة ما إذا كانت آلة NPWT قادرة على الحفاظ على الضغط بمرور الوقت مع إضافة جهاز للعناية بالجروح. تم استخدام النموذج أيضا لتحديد ما إذا كان الضغط المتولد والسوائل التي تم جمعها بواسطة آلة NPWT في وجود جهاز للعناية بالجروح مختلفين مقارنة بغياب الجهاز.
تم حساب متوسط ضغوط الانحراف المعياري ± في كل نقطة زمنية خلال اختبار 72 ساعة لكل مجموعة ضابطة وتجريبية. لكل مجموعة ، تمت مقارنة قراءات الضغط لتحديد ما إذا كان هناك أي انخفاض في الضغط أو زيادات في الضغط بمرور الوقت. بالنسبة لجميع ظروف الاختبار الأربعة عند الضغط الأقصى والحد الأدنى ولكل من المجموعات الضابطة والتجريبية ، لم يكن هناك تغيير إحصائي في الضغط خلال فترة الاختبار التي استمرت 72 ساعة (ص > 0.7). نظرا لعدم وجود انخفاض في الضغط داخل أي مجموعة خلال فترة الاختبار التي استمرت 72 ساعة ، فإن إضافة غشاء الشيتوزان لم تؤثر على أداء مضخة التفريغ أثناء الاختبار.
عند الضغط الأقصى (الشكل 4) ، لم يكن هناك فرق بين قراءات الضغط من المجموعات الضابطة والتجريبية لظروف الاختبار المستمر ، ولكن كان هناك اختلاف في حالة الاختبار المتقطع. بالنسبة لحالة الاختبار المستمر ، أظهرت المجموعة التجريبية قراءات ضغط مماثلة (-169.6 مم زئبق ± 1.56 مم زئبق) مقارنة بالتحكم (-172.9 مم زئبق ± 2.18 مم زئبق) (p = 0.27).
عند الحد الأدنى للضغط (الشكل 5) ، لوحظ اختلاف بين قراءات الضغط من المجموعات الضابطة والتجريبية لحالة الاختبار المستمر ، ولكن لم يكن هناك فرق في حالة الاختبار المتقطع. بالنسبة لحالة الاختبار المستمر ، أظهرت المجموعة التجريبية قراءات ضغط أقل (-21.8 مم زئبق ± 0.7 مم زئبق) مقارنة بالمجموعة الضابطة (-27.1 مم زئبق ± 1.75 مم زئبق) (p = 6 × 10-7). بالنسبة لحالة الاختبار المتقطع، أظهرت المجموعة التجريبية قراءات ضغط مماثلة (-20.6 مم زئبق ± 1.45 مم زئبق) مقارنة بالتحكم (-23.4 مم زئبق + 1.83 مم زئبق) (p = 0.29). لوحظ أن جمع السوائل متشابه عبر جميع المجموعات (الشكل 6 والشكل 7).
كان هناك تباين في قراءات الضغط بين عينات الاختبار. يعزى الاختلاف إلى حد كبير إلى كمية الدهون التي يحتوي عليها كل نسيج وكيفية تصفيف الأنسجة قبل الاختبار وليس إلى غرفة الاختبار حيث تم فحصها بشكل روتيني بحثا عن التسريبات ، وإذا تم اكتشافها ، فقد تم إصلاح التسرب قبل اختبار العينة.
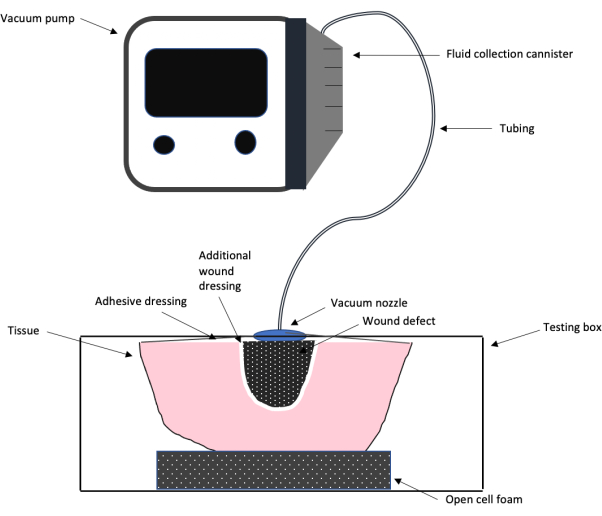
الشكل 1: تخطيطي لإعداد اختبار NPWT. رسم تخطيطي يوضح إعداد تصميم الاختبار العام لنظام علاج الجروح بالضغط السلبي المستخدم في هذا العمل ، بما في ذلك مضخة التفريغ ، والأنابيب ، وتضميد الجروح اللاصقة والرغوة ، وتضميد الجروح الإضافي ، وعيب الجرح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تصميم نموذج NPWT على المنضدة. صورة تمثيلية لتصميم الصندوق البلاستيكي الذي تم إنشاؤه لنموذج NPWT على المنضدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: خطوات تحضير العينات وتجميع المكونات للاختبار. الخطوات المتخذة لاختبار العينة مثل تحضير العينة وتحميل غرفة الاختبار والإعداد العام. يظهر إعداد غرفة الاختبار في هذه التجربة مقياسي ضغط: أحدهما متصل على جانبه لقراءة الضغط (يسار) والآخر يستخدم كآمن من الفشل وإزالته لإضافة المزيد من السوائل إلى الغرفة (يمين). تظهر غرفة الاختبار أيضا وضع الأنسجة المملوءة بالرغوة وتضميد الجروح وفوهة التفريغ الموضوعة في الأعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مقارنات الضغط الأقصى. ± متوسط قراءات ضغط الانحراف المعياري للمجموعات الضابطة والتجريبية (المجموعات 1-4 ، ن = 3 / المجموعة) عند أقصى ضغط (-200 مم زئبق) لمدة 72 ساعة. يظهر الخط الأزرق المنقط والخط الرمادي المتقطع مجموعات الضغط المستمرة. يظهر الخط البرتقالي المتقطع الصغير والخطوط الصفراء المتقطعة والمنقطة مجموعات الضغط المتقطعة. تم حساب متوسط قراءات الضغط من العينات الثلاث في كل مجموعة من 0-72 ساعة بزيادات قدرها 12 ساعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
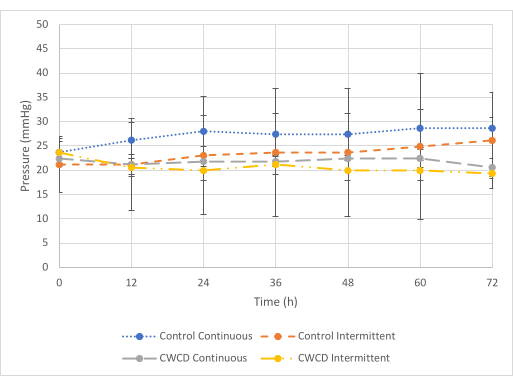
الشكل 5: مقارنات الحد الأدنى للضغط. ± المتوسط قراءات ضغط الانحراف المعياري للمجموعات الضابطة والتجريبية (المجموعات 5-8 ، ن = 3 / المجموعة) عند الحد الأدنى للضغط (-25 مم زئبق) لمدة 72 ساعة. يظهر الخط الأزرق المنقط والخط الرمادي المتقطع مجموعات الضغط المستمرة. يظهر الخط البرتقالي المتقطع الصغير والخطوط الصفراء المتقطعة والمنقطة مجموعات الضغط المتقطعة. تم حساب متوسط قراءات الضغط من العينات الثلاث في كل مجموعة من 0-72 ساعة بزيادات قدرها 12 ساعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: صور تمثيلية لمجموعة السوائل النهائية للمجموعات من 1 إلى 4. (أ) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة التحكم من المجموعة 1 تحت الشفط المستمر عند أقصى ضغط. (ب) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة التحكم من المجموعة 2 تحت شفط متقطع عند أقصى ضغط. (ج) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة اختبار المجموعة 3 تحت شفط مستمر عند أقصى ضغط. (د) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة اختبار المجموعة 4 تحت شفط متقطع عند أقصى ضغط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: صور تمثيلية لمجموعة السوائل النهائية للمجموعات من 5 إلى 8. (أ) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة التحكم من المجموعة 5 تحت شفط مستمر عند الحد الأدنى للضغط. (ب) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة المراقبة من المجموعة 6 تحت شفط متقطع عند الحد الأدنى من الضغط. (ج) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة اختبار المجموعة 7 تحت شفط مستمر عند الحد الأدنى من الضغط. (د) صورة تمثيلية لتجميع السوائل بعد 72 ساعة لعينة اختبار المجموعة 8 تحت شفط متقطع عند الحد الأدنى من الضغط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | مبلغ |
| كلوريد الصوديوم | 8.035 جرام |
| بيكربونات الصوديوم | 0.355 جرام |
| كلوريد البوتاسيوم | 0.225 جرام |
| فوسفات البوتاسيوم ثنائي القاعدة ثلاثي الهيدرات | 0.231 جرام |
| سداسي هيدرات كلوريد المغنيسيوم | 0.311 جرام |
| 1 م حمض الهيدروكلوريك | 39 مل |
| كلوريد الكالسيوم | 0.292 جرام |
| كبريتات الصوديوم | 0.072 جرام |
| تريس (هيدروكسي ميثيل) أمينوميثان | 6.118 جرام |
الجدول 1: الكواشف المطلوبة لتحضير سائل الجسم المحاكي في 1 لتر من ماء DI.
Discussion
هناك عدد قليل من النماذج التي توضع على مقاعد البدلاء ل NPWT ، لكن لها قيودا كبيرة. طور Loveluck et al. نموذجا حاسوبيا FEA لتحديد كيفية تأثير NPWT على مواقع الشقوق المخيطة ولكنه لم يأخذ في الحسبان مواد تضميد الجروح الإضافية6. طور Rycerz et al. نماذج قائمة على أجار لتقييم توزيع محلول التقطير على الجروح خلال NPWT7. في حين أن الأجار يوفر وسيطا لتقييم توزيع المواد / الأصباغ القابلة للذوبان في الماء في النماذج المختلفة ، إلا أنها مادة متجانسة بسيطة لا تكرر البنية المعقدة غير المتجانسة للجروح التي تشمل الأنسجة العضلية والدهنية المعرضة ل NPWT. أيضا ، تم إجراء هذه الاختبارات لفترات زمنية قصيرة نسبيا تصل إلى 3.5 ساعة ، بينما في الظروف السريرية ، من الشائع أن يكون الفراغ قيد التشغيل لمدة 48-72 ساعة قبل تغيير ضمادة الجرح3. بدلا من ذلك ، في الجسم الحي ، يمكن استخدام نماذج الخنازير ولكنها باهظة الثمن وتتطلب عمليات إشراف وموافقة خاصة قبل الاستخدام7. لا توجد نماذج حالية على الطاولة تستخدم تركيبة وهياكل أنسجة واقعية لتقييم تجمع السوائل والضغوط داخل فراش الجرح بالنسبة لمضخة التفريغ في ظل ظروف تجريبية مختلفة.
لمعالجة هذا القيد ، تم تصميم نموذج منضدة وبناؤه ليكون قادرا على قراءة الضغط على مدار 72 ساعة من داخل عيب الجرح لمعرفة مقدار الضغط الذي تم تطبيقه على الجرح بالنسبة لقراءة مضخة التفريغ. تم تحقيق ذلك باستخدام مقياس الضغط المتصل بأنبوب الضغط الذي يمر عبر منتصف الرغوة. لتجديد السوائل في الحاوية أثناء الاختبار وعدم التأثير على الفراغ ، تمت إضافة مقياس ضغط ثان ، والذي يمكن إزالته لسحب العينات في سائل إضافي. كان مقياس الضغط الثاني هذا بمثابة أمان من الفشل لأنه يجب أن يقرأ الصفر ، وإذا لم يحدث ذلك ، ضغط غرفة الاختبار بدلا من عينة الأنسجة ، مما يجعل الاختبار غير صالح. هناك مشكلة أخرى تناولها النظام وهي التأكد من وجود ما يكفي من الختم على العينة. تم تحقيق ذلك عن طريق وضع قطعة من الرغوة تحت العينة لرفعها بهذه الطريقة عندما يتم إغلاق غطاء غرفة الاختبار ، تم دفع الأنسجة لأسفل بما يكفي لإغلاق الغرفة دون وجود مساحة إضافية.
تم استخدام بطن الخنزير لتلبية الحاجة إلى نظير أنسجة الجرح. تم استخدام بطن الخنزير ، الذي يأتي من الجانب السفلي من معدة الخنزير ، لأنه يحتوي على طبقات من الدهون والعضلات ، والتي تحاكي العضلات البشرية المعقدة والأنسجة الدهنية وتحاكي خصائص أنسجة الجرح بشكل أفضل. بالإضافة إلى ذلك ، يمكن الحصول على بطن الخنزير بسهولة بتكلفة زهيدة ، ولا يلزم سوى الحد الأدنى من التلاعب لإزالة أملاح المعالجة قبل الاستخدام. قد تكون التركيبات المختلفة لعينات الأنسجة المستخدمة قد تسببت في بعض اختلافات الضغط التي شوهدت عبر المجموعات. قد تكون تركيبات الدهون والأنسجة المختلفة ، أو كيفية وضع الرغوة في الأنسجة ، قد أثرت على الضغط الذي تمكنت الآلة من سحبه. سريريا ، سيظهر المرضى أيضا اختلافات في العضلات والدهون والأنسجة ، لذا فإن الاختلافات التي تظهر بسبب تكوين بطن الخنزير قد تكون ممثلة للاختلاف في كيفية عمل الجهاز لدى المرضى.
يسمح تصميم النموذج الذي يوضع على الطاولة أيضا باختبار تطبيقات جديدة ل NPWT في المختبر ، من الضغوط المختلفة إلى مواد تضميد الجروح المختلفة. كما يسمح بتسجيل الضغط من داخل قاع الجرح حيث توجد الرغوة مقابل مراقبة قراءات الضغط فقط من مضخة التفريغ. يوضح هذا ما إذا كان الضغط المطبق من المضخة يتم تطبيقه داخل الجرح. النموذج الذي تم إنشاؤه في هذه الدراسة مفيد لأنه يسمح بتسجيل جمع السوائل والضغط دون استخدام المحاكاة الحاسوبية أو الاختبار في الجسم الحي . وبالمثل ، يعد هذا النموذج المفضل لأنه يسمح بإلقاء نظرة على كيفية عمل آلة NPWT على الأنسجة العضلية والدهنية التي تحاكي الحالة السريرية عن كثب بدلا من المواد القائمة على أجار. هذا النموذج ميسور التكلفة أكثر من الاختبار في الجسم الحي لأنه لا يتطلب استخدام الحية ، ويتم إنشاؤه من عناصر منخفضة التكلفة.
تم استخدام هذا النموذج لمقارنة الضغوط المتولدة والسوائل التي تم جمعها بواسطة آلة NPWT مع وبدون جهاز العناية بجروح الشيتوزان التجاري. تمكنت آلة NPWT من الحفاظ على الضغوط على مدار 72 ساعة في وجود أو عدم وجود جهاز العناية بالجروح المتقدم من الشيتوزان. عند استخدام جهاز NPWT مع أو بدون جهاز العناية بالجروح ، لم تكن هناك اختلافات صغيرة أو صغيرة فقط في قراءات الضغط بين مجموعات التحكم (لا يوجد جهاز للعناية بالجروح) والاختبار (مع جهاز العناية بالجروح) على مدى فترة 72 ساعة في ظل ظروف اختبار الضغط الأقصى والدنيا. ومع ذلك ، لم تكن هناك فروق في تجمع السوائل بين أغشية التحكم والاختبار عبر مجموعات العلاج.
كانت بعض الخطوات في البروتوكول حاسمة في ضمان دقة قراءات الضغط وجمع السوائل لكل عينة. تم العثور على أهم الخطوات في عملية الاختبار في الخطوة 1. لضمان تسجيل قراءات الضغط الدقيقة ، يجب أن يظهر صندوق الاختبار الذي تم إنشاؤه عدم وجود تسريبات. خلاف ذلك ، لن تعمل مقاييس الضغط بشكل صحيح. تشمل الخطوات الحاسمة الأخرى في هذه العملية الخطوتين 2.2 و 3.1. كانت الخطوة 2.2 حاسمة لأن عيب الجرح يجب أن يكون عميقا بما يكفي لاختراق الطبقة النهائية من الدهون في العينة ، ويجب أن تكون الأنسجة محسوسة لجمع السوائل. كانت الخطوة 3.1 حاسمة لأن العيب يحتاج إلى ملؤه برغوة مفتوحة المسام. يجب أن تملأ الرغوة عيب الجرح بالكامل وتتناسب بشكل مريح ؛ خلاف ذلك ، لن يخلق ختما مناسبا مع الفراغ ، مما يسبب مشكلات في قراءة الضغط. كانت الخطوة 3.4 حاسمة لأن ضمادة الجرح اللاصقة كانت بحاجة إلى تغطية العينة بأكملها. إذا لم تغطي ضمادة الجرح اللاصقة العينة بأكملها ، فقد يكون هناك تسرب للضغط داخل غرفة الاختبار.
أحد قيود هذا العمل هو أنه لا يوجد نموذج مماثل للمقارنة. سيساعد النسخ المتماثل للنموذج واستخدامه من قبل الآخرين في تأكيد فائدة النموذج. هناك قيود أخرى لهذا النموذج وهي احتمال تسرب الهواء عن طريق توصيل أنبوب الضغط بمقياس الضغط. يمكن أن تكون الطريقة الأفضل لتقليل مخاطر تسرب الهواء باستخدام نهج اتصال مختلف مفيدة في الدراسات المستقبلية.
كان هذا النموذج الموجود على الطاولة ضروريا ل NPWT بحيث يمكن اختبار مادة جديدة للتأكد من التوافق من خلال فحص جمع السوائل وتوليد الضغط للتأكد من أن تضميد الجروح الإضافي لم يغير أداء نظام NPWT. يحتوي النموذج الذي تم إنشاؤه على العديد من التطبيقات المحتملة في NPWT. يمكن استخدامه لاختبار مواد تضميد الجروح المختلفة وخيارات توصيل الأدوية المحلية في مواد تضميد الجروح. يمكن إنشاء عدة أنواع من الجروح واختبارها باستخدام هذا النموذج ، مثل الجروح الجراحية أو الأنفاقية أو الحروق. بالنسبة لأنواع الجروح المختلفة ، يمكن فحص الضغط وجمع السوائل لتحديد إعدادات NPWT المثلى. يفتح هذا النموذج أيضا طرقا أخرى لتحديد كيفية اختبار NPWT في عينات الجلد ، بينما في السابق ، كانت النماذج تقتصر في الغالب على مواد أخرى أو اختبارات محاكاة. في الختام ، تمكن النموذج المصمم على الطاولة بنجاح من تقييم الضغوط داخل سرير الجرح لضمادات الجروح لتحديد ما إذا كانت متوافقة مع نظام NPWT.
بشكل عام ، لا يبدو أن جهاز العناية بالجروح الشيتوزان الذي تم اختباره يثبط الضغط أو تجمع السوائل في نظام NPWT للظروف التي تم اختبارها. في هذا العمل ، تم تطوير نموذج منضدة للتغلب على قيود النماذج الحالية على الطاولة من خلال السماح بالاختبار على مدى فترات طويلة من الزمن ، باستخدام نظير الأنسجة ، والقدرة على استيعاب استخدام مواد تضميد الجروح.
Disclosures
تم دعم هذا العمل بمنحة من شركة Bionova Medical، Inc. (جيرمانتاون ، تينيسي).
Acknowledgements
أصبح هذا البحث ممكنا بمساعدة قسم الهندسة الطبية الحيوية بجامعة ممفيس و Bionova Medical.
Materials
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
References
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20(2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved