Method Article
Sviluppo di un modello da banco per la valutazione della compatibilità dei materiali per la medicazione delle ferite con i sistemi di terapia delle ferite a pressione negativa
In questo articolo
Riepilogo
Questo studio presenta un modello da banco progettato per valutare la compatibilità dei materiali per la medicazione delle ferite con i sistemi di terapia delle ferite a pressione negativa, valutando la pressione e la raccolta di liquidi nell'arco di 72 ore con impostazioni di pressione continua e intermittente.
Abstract
I sistemi di terapia delle ferite a pressione negativa (NPWT) facilitano la guarigione delle ferite applicando una pressione subatmosferica al letto della ferita, che favorisce la formazione di tessuto di granulazione e riduce l'infiammazione. Le medicazioni per ferite possono essere utilizzate con questi sistemi per migliorare la guarigione; tuttavia, gli effetti delle medicazioni sulle prestazioni del dispositivo NPWT sono difficili da valutare. Lo scopo di questo studio è stato quello di sviluppare un modello analogo di carne da banco per testare la compatibilità dei materiali per la medicazione delle ferite con i dispositivi NPWT. In questo studio, un dispositivo avanzato per la cura delle ferite a base di chitosano è stato valutato per i suoi effetti sulle prestazioni della NPWT sotto pressioni terapeutiche massime e minime. L'obiettivo era quello di utilizzare il modello per confrontare le letture della pressione e la raccolta di liquidi per campioni con e senza il dispositivo per la cura delle ferite al chitosano. Il modello da banco è stato costruito utilizzando una scatola di plastica collegata a più manometri. Un difetto circolare è stato creato su un pezzo di pancetta di maiale, usato come analogo della carne, e inserito nella scatola. Il difetto è stato riempito con schiuma NPWT standard o schiuma combinata con la medicazione della ferita. Alla scatola è stato aggiunto un fluido corporeo simulato contenente siero bovino, che è stato poi testato alla pressione massima (-200 mmHg) o minima (-25 mmHg) per 72 ore. La pressione e la raccolta dei fluidi sono state registrate ogni 12 ore. Il sistema NPWT ha mantenuto con successo la pressione per il periodo di prova di 72 ore, sia con che senza le medicazioni di prova. L'aggiunta delle medicazioni per ferite non ha influito sulla raccolta dei liquidi. La scatola di prova si è dimostrata efficace come modello da banco, in quanto poteva essere sigillata e mantenuta in condizioni di vuoto per il periodo di prova di 72 ore. Questo modello ha dimostrato con successo la sua utilità nella valutazione della compatibilità dei materiali per la medicazione delle ferite con i sistemi NPWT.
Introduzione
Esistono diversi approcci terapeutici per aiutare nella gestione e nel processo di guarigione delle ferite. Tali approcci terapeutici includono medicazioni avanzate per ferite, fattori di crescita, ossigenoterapia iperbarica, sostituti cutanei e terapia delle ferite a pressione negativa (NPWT)1. NPWT si riferisce a sistemi di medicazione della ferita che applicano in modo continuo o intermittente una pressione sub-atmosferica al sistema, che fornisce una pressione negativa alla superficie della ferita. La NPWT è diventata una modalità di trattamento popolare per la gestione delle ferite acute o croniche2. Il sistema NPWT è costituito da una schiuma a celle aperte, una medicazione adesiva per ferite, un sistema di raccolta dei fluidi e una pompa di aspirazione3. La pompa di aspirazione, o vuoto, viene utilizzata per mantenere una pressione costante sulla ferita, che aiuta ad aumentare il flusso sanguigno e ridurre il rischio di infezione4. La NPWT favorisce la formazione del tessuto di granulazione rimuovendo il fluido dalla ferita e riducendo il gonfiore1. Clinicamente, la quantità di pressione di aspirazione utilizzata per le ferite varia da -20 mmHg a -200 mmHg, ma la pressione più rilevante testata è -125 mmHg5.
Gli esperimenti ex vivo di NPWT rappresentano una sfida a causa della mancanza di adeguati modelli da banco per i test. Gli attuali metodi per testare i sistemi NPWT includono simulazioni al computer di analisi degli elementi finiti (FEA), che sono state utilizzate per testare come la NPWT influisce sui siti di incisione6. Altri modelli includono modelli di ferite da banco basati su agar, che possono essere utilizzati per testare l'assorbimento del fluido7. In vivo, sono stati utilizzati anche modelli suini per esaminare la guarigione delle ferite8. Questi modelli hanno vantaggi come la facilità di simulazione su un computer per prevedere come dovrebbe guarire una ferita in teoria, oltre a testare il fluido che viene tirato attraverso un materiale del modello. I test in vivo sono definitivi per determinare se il sistema funziona in soggetti vivi8. Questi modelli hanno anche degli svantaggi. Una simulazione al computer potrebbe non rappresentare accuratamente come guarirebbe una ferita nella vita reale. Un modello basato sull'agar può mostrare una buona raccolta di liquidi che viene tirata attraverso la ferita, ma potrebbe non rappresentare il modo in cui il fluido verrebbe tirato attraverso i tessuti e i muscoli7. I modelli in vivo sono costosi e richiedono risorse significative per completare uno studio. Inoltre, può essere difficile mantenere gli animali semi-immobili, quindi potrebbero esserci sfide con loro che tirano il sistema, il che potrebbe avere risultati confondenti.
Per NPWT è necessario un modello da banco in modo che i nuovi materiali possano essere testati per l'uso con il sistema utilizzando tessuto reale. Il nuovo modello dovrebbe essere in grado di riflettere il modo in cui la raccolta dei liquidi è influenzata dai tessuti e dai muscoli. Il nuovo modello dovrebbe anche essere in grado di fornire letture della pressione all'interno del letto della ferita per determinare se la ferita stava ricevendo la stessa pressione fornita dalla pompa del vuoto. Possono anche essere testati nuovi materiali/dispositivi, come medicazioni aggiuntive per ferite, diversi tipi di schiuma e diverse medicazioni adesive sulla parte superiore della ferita.
Alcune ferite richiedono medicazioni aggiuntive per favorire il processo di guarigione riducendo il rischio di infezione. Un altro motivo per cui potrebbero essere necessari ulteriori materiali per la medicazione della ferita è prevenire la crescita dei tessuti tra la superficie del letto della ferita e la schiuma a celle aperte. Questa medicazione aggiuntiva riduce il rischio che il letto della ferita aderisca alla schiuma a celle aperte, il che aiuta a ridurre i danni e il dolore quando si arresta il sistema NPWT9. Queste medicazioni aggiuntive possono essere posizionate attorno alla schiuma a celle aperte per fungere da membrana barriera tra il letto della ferita e la schiuma. Alcuni materiali sono stati utilizzati come interfaccia tra il letto della ferita e la schiuma, come la paraffina o la garza incorporata nella vaselina. La paraffina ha mostrato un potenziale positivo come medicazione per ferite non influenzando il trasferimento di pressione dal sistema all'ound9. Tuttavia, è stato segnalato che la garza inclusa nella vaselina inibisce la raccolta di liquidi e quindi non è stata considerata un materiale aggiuntivo appropriato9.
Le medicazioni per ferite a base di chitosano possono essere una buona medicazione aggiuntiva da aggiungere durante la NPWT grazie ai loro effetti antimicrobici e alla biocompatibilità10,11. Il chitosano è un derivato N-deacetilato della chitina, che è un polisaccaride naturale presente nei funghi e negli artropodi12,13. Il chitosano ha mostrato proprietà antibatteriche intrinseche in un ampio spettro di batteri gram-negativi e gram-positivi14. Pertanto, le membrane di chitosano sono diventate popolari nel trattamento delle ferite perché possono essere facilmente prodotte, hanno una lunga durata e mostrano effetti antimicrobici innati10. Queste membrane mostrano anche una buona biocompatibilità, biodegradazione e non sono tossiche10.
In questo studio, Foundation DRS, un dispositivo avanzato per la cura delle ferite a base di chitosano e glicosaminoglicano, è stato esaminato per determinarne la biocompatibilità con NPWT. Foundation DRS è un'impalcatura biodegradabile per la rigenerazione dermica prodotta per caratteristiche di manipolazione e porosità ideali per promuovere l'invasione cellulare e la neo-angiogenesi nelle ferite. Questo dispositivo è vantaggioso per la guarigione in una vasta gamma di lesioni e usi diversi. È stato creato per l'uso previsto in un'ampia gamma di ferite, come ulcere da pressione, ulcere del piede diabetico, ustioni di primo grado, ferite da trauma, ferite deiscite e ferite chirurgiche10,11. Foundation DRS è una buona opzione per l'uso in NPWT grazie al suo processo di produzione, che impedisce al dispositivo di trasformarsi in un idrogel quando è bagnato. Questo dispositivo mantiene una struttura a pori aperti quando viene bagnato, il che dovrebbe consentire al fluido di fluire durante l'applicazione di NPWT12,13.
L'obiettivo di questo studio era quello di sviluppare un modello analogo di carne da banco che potesse essere utilizzato per testare la compatibilità dei materiali di medicazione delle ferite con i dispositivi NPWT. Dal punto di vista clinico, le pressioni variano da -80 mmHg a -125 mmHg per la maggior parte delle applicazioni NPWT4. Per simulare le condizioni di utilizzo clinico peggiori, sono state utilizzate un'impostazione di pressione più alta e più bassa (-25 mmHg e -200 mmHg). Un altro obiettivo di questo studio era determinare se l'aggiunta del dispositivo per la cura delle ferite al chitosano interferisse con le letture della pressione e la raccolta di liquidi della NPWT. Interruzioni nella raccolta dei liquidi o perdite di pressione durante la NPWT potrebbero portare a una scarsa guarigione delle ferite e a scarsi risultati clinici. La raccolta dei liquidi dovrebbe essere simile a quella dei gruppi di test con e senza il dispositivo per la cura delle ferite al chitosano. Anche le letture della pressione dovrebbero essere simili tra i gruppi di prova nell'arco di 72 ore. In ambito clinico, la medicazione della ferita viene cambiata ogni 48-72 ore, quindi ogni campione è stato testato per 72 ore in questo studio3. Durante il test, è necessario osservare le letture della pressione per assicurarsi che non vi sia un calo di pressione.
Protocollo
I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella tabella dei materiali.
1. Creazione della scatola di test
- Procurati un contenitore di plastica da 3,2 tazze.
- Crea un foro di 2 pollici di diametro al centro del coperchio del contenitore. Inoltre, praticare due fori da 3/8 in due angoli del coperchio del contenitore a circa 1/2 pollice dalla guarnizione del bordo. Usa una sega a tazza per creare i fori.
NOTA: Nella Figura 1 è mostrato uno schema che mostra la configurazione generale del test utilizzando una macchina NPWT commerciale collegata a una scatola analogica da banco costruita in laboratorio. Questo schema illustra come la scatola viene utilizzata per gli esperimenti. La casella creata per questo esperimento è illustrata nella Figura 2. - Sul primo dei fori da 3/8, collegare un manometro direttamente al foro.
NOTA: Questo manometro è stato utilizzato per monitorare le cadute di pressione al di fuori del tessuto di prova, che indicavano perdite nel tessuto. - Sul secondo foro da 3/8, inserire un piccolo tubo flessibile per flebo con un diametro esterno inferiore a 3/8 attraverso il foro fino a una lunghezza di 7 pollici sul lato interno del coperchio. Quindi, montare il tubo di pressione su un manometro di bassa pressione all'esterno del contenitore.
NOTA: Il tubo di pressione è stato posizionato nel letto della ferita durante il test.
2. Preparazione analoga della carne
- Utilizzare la pancetta di maiale salata disponibile in commercio, nota come tessuto, per simulare il tessuto muscolare e adiposo per il test NPWT.
- Crea un difetto circolare della ferita sulla superficie del tessuto usando un bisturi a lama #21 largo circa 1,5 pollici e profondo 0,75 pollici. Quindi, fenestra il tessuto attraverso il grasso su ciascun lato con un bisturi a lama #21.
- Dopo che il difetto della ferita è stato creato, pulire il tessuto per rimuovere il grasso in eccesso dalla pelle, quindi immergerlo per una notte in acqua deionizzata per rimuovere il sale in eccesso.
3. Caricamento della camera di prova
- Riempi il fondo della camera di prova con schiuma a celle aperte spessa 1,5 pollici. Quindi, posiziona il fazzoletto sopra la schiuma.
NOTA: Centrare manualmente il campione di tessuto in modo che il difetto della ferita creato sia direttamente sotto il foro nella parte superiore del coperchio. - Per i gruppi sperimentali, aggiungere il dispositivo per la cura delle ferite al chitosano all'interno del difetto della ferita in modo che il fondo e i lati del difetto siano coperti. Quindi, riempire il resto del difetto con la schiuma a celle aperte.
- Inserire il tubo di pressione collegato al manometro sulla camera di prova nella schiuma a celle aperte che viene utilizzata per riempire il difetto. Assicurarsi che questo tubo sia posizionato a circa metà della superficie del difetto della ferita.
- Coprire il fazzoletto con la medicazione adesiva per ferite. Quindi, creare un piccolo taglio sulla medicazione adesiva, direttamente sopra il centro della schiuma a celle aperte, riempiendo il difetto della ferita.
- Infilare l'ugello del vuoto attraverso il coperchio della camera di prova e posizionarlo sopra la medicazione adesiva, dove è stato eseguito il piccolo taglio. Dopo aver posizionato l'ugello di aspirazione, chiudere il coperchio della camera di prova per premere la medicazione adesiva della ferita e l'ugello di aspirazione verso il basso, il che aiuta a creare una tenuta.
- Collegare la bombola di raccolta del fluido da 500 ml alla pompa del vuoto, quindi collegare l'ugello del vuoto alla bombola di raccolta del fluido.
4. Creazione del fluido corporeo simulato
- Crea un fluido corporeo simulato secondo Marques et al.15.
- Realizzare il fluido corporeo simulato combinando 8,035 g di NaCl, 0,355 g di NaHCO3, 0,225 g di KCl, 0,231 g di K2HPO43H2O, 0,311 g di Cl2Mg6H2O, 0,292 g di CaCl, 0,072 g di NaSO42-, 6,118 g di (HOCH2)3CNH2, e 39 mL di 1 M HCl in 960 mL di acqua deionizzata per portare la soluzione totale a 1 L.
NOTA: La composizione del fluido corporeo simulato è mostrata nella Tabella 1. - Quindi, combinare il fluido corporeo simulato con il siero bovino in un rapporto 3:1. Integrare la soluzione finale con il 5% di antibiotici/antimicotici 10x per il controllo microbico. Mescolare la soluzione dopo aver aggiunto il siero bovino e gli antibiotici/antimicotici, quindi conservarla in frigorifero.
NOTA: La soluzione finale sarà indicata come soluzione completa. Questa soluzione non deve essere mantenuta sterile e deve essere preparata fresca prima di ogni campione.
5. Condizioni di prova
- Regolare le impostazioni sulla pompa a vuoto per i campioni in base alle condizioni di test.
NOTA: I gruppi di prova sono: Gruppo 1 Controllo (n = 3): Schiuma da sola con aspirazione continua a -200 mmHg; Gruppo 2 Controllo (n = 3): Schiuma da sola con aspirazione intermittente da 0 a -200 mmHg; Gruppo 3 (n = 3): Dispositivo per la cura delle ferite al chitosano sotto schiuma con aspirazione continua a -200 mmHg; Gruppo 4 (n = 3): Dispositivo per la cura delle ferite al chitosano sotto schiuma con aspirazione intermittente da 0 a -200 mmHg; Gruppo 5 Controllo (n = 3): Schiuma da sola con aspirazione continua a -25 mmHg; Gruppo 6 Controllo (n = 3): Schiuma da sola con aspirazione intermittente da 0 a -25 mmHg; Gruppo 7 (n = 3): Dispositivo per la cura delle ferite al chitosano sotto schiuma con aspirazione continua a -25 mmHg; Gruppo 8 (n = 3): Dispositivo per la cura delle ferite al chitosano sotto schiuma con aspirazione intermittente da 0 a -25 mmHg. - Per i gruppi di prova a pressione massima, impostare la pressione a -200 mmHg. Per i gruppi di prova a pressione minima, impostare la pressione a -25 mmHg. Quindi, posizionare le impostazioni della pompa del vuoto su pressione intermittente o continua. Eseguire tutti i campioni per 72 ore.
NOTA: L'impostazione continua ha applicato la pressione in modo continuo per 72 ore. L'impostazione intermittente ha applicato la pressione a un rapporto 5/2 (5 min di pressione, seguiti da 2 min senza pressione) per 72 h. I valori massimo e minimo sono stati scelti in base all'intervallo di pressione che i sistemi NPWT clinici possono utilizzare. Un ciclo di 72 ore è stato scelto in base al periodo di tempo in cui la NPWT viene tipicamente utilizzata clinicamente prima di eseguire un cambio di bendaggio3. - Durante il test, registrare la pressione sul manometro e la quantità di fluido nel contenitore di raccolta del fluido ogni 12 ore per 72 ore.
- Se la quantità di fluido corporeo analogico scende al di sotto del 75% della parte superiore della camera di prova, come osservato visivamente, rimuovere il manometro secondario e aggiungere una soluzione completa alla camera.
NOTA: La preparazione dei campioni e l'impostazione del test possono essere visti nella Figura 3. - Dopo 72 ore, spegnere la pompa del vuoto e scollegare il contenitore di raccolta del fluido dall'ugello del vuoto. Rimuovere il contenitore di raccolta del fluido dalla pompa del vuoto.
- Rimuovere il tessuto dalla camera di prova e rimuovere la medicazione adesiva per la ferita. Quindi, estrai la schiuma a celle aperte e osserva se il dispositivo per la cura delle ferite al chitosano era ancora intatto. È considerato integro se può essere rimosso senza rompersi, strapparsi o strapparsi; Tuttavia, piccoli strappi o assottigliamenti sono accettabili se la membrana può essere rimossa completamente.
6. Analisi statistica
- Utilizzare i valori di pressione registrati ogni 12 ore durante il periodo di prova dai tre provini per condizione di prova per l'analisi statistica. Per l'analisi statistica, è stato utilizzato il valore finale di raccolta dei fluidi dai tre campioni di prova per condizione di prova.
NOTA: Per tutte le analisi statistiche, il livello di significatività è stato fissato a α = 0,05. - Calcola la media e le deviazioni standard (n = 3/gruppo) in ogni punto temporale. Prima di eseguire l'analisi statistica, eseguire il test di normalità per ciascun gruppo utilizzando il test di Shapiro-Wilk (ad esempio, aspirazione continua a -200 mmHg, aspirazione continua a -25 mmHg, aspirazione intermittente a -200 mmHg e aspirazione intermittente a -25 mmHg) per determinare se il test ANOVA o Kruskal-Wallis è appropriato.
- Analizzare i dati per gruppi sperimentali e di controllo sottoposti alle stesse condizioni di prova di pressione (ad esempio, aspirazione continua a -200 mmHg; aspirazione continua a -25 mmHg; aspirazione intermittente a -200 mmHg o aspirazione intermittente a -25 mmHg) utilizzando un ANOVA a due vie o un test di Kruskal Wallis utilizzando il tipo di membrana e il tempo come fattori principali.
- Se sono state identificate differenze statistiche, eseguire analisi post-hoc. Utilizzare il test post-hoc HSD di Tukey dopo l'ANOVA o il test post-hoc di Dunn dopo il test di Kruskal-Wallis per determinare quali gruppi sono diversi.
- Utilizzando i valori finali di raccolta dei fluidi per ciascun campione nei gruppi di controllo e sperimentale, eseguire un test t a due code assumendo varianze disuguali.
NOTA: La pressione è stata analizzata in ogni momento per garantire che non vi fosse un calo significativo della pressione per tutta la durata del periodo di test. Mentre la raccolta dei fluidi è stata esaminata in ogni momento, è stata analizzata solo nel punto temporale finale. Questo perché ogni tessuto aveva profili adiposi e muscolari diversi, con conseguenti diversi tassi di raccolta dei fluidi, rendendo la raccolta complessiva dei fluidi più utile per l'analisi rispetto alla raccolta dei fluidi per punti temporali.
Risultati
L'obiettivo dello studio era quello di sviluppare un modello da banco per NPWT che utilizza un analogo tissutale e di utilizzare il modello per studiare la compatibilità dei materiali per la medicazione delle ferite con una macchina per la terapia delle ferite a pressione negativa. Il modello è stato utilizzato per studiare se la macchina NPWT fosse in grado di mantenere la pressione nel tempo con l'aggiunta di un dispositivo per la cura delle ferite. Il modello è stato utilizzato anche per determinare se la pressione generata e il fluido raccolto dalla macchina NPWT in presenza di un dispositivo per la cura delle ferite fossero diversi rispetto all'assenza del dispositivo.
Le pressioni medie ± di deviazione standard sono state calcolate in ogni punto temporale durante il test di 72 ore per ciascun gruppo di controllo e sperimentale. Per ogni gruppo, le letture della pressione sono state confrontate per determinare se ci sono state cadute di pressione o aumenti di pressione nel tempo. Per tutte e quattro le condizioni di prova alla pressione massima e minima e per i gruppi di controllo e sperimentali, non vi è stata alcuna variazione statistica della pressione durante il periodo di prova di 72 ore (p > 0,7). Poiché non è stata osservata alcuna caduta di pressione all'interno di nessun gruppo durante il periodo di prova di 72 ore, l'aggiunta della membrana in chitosano non ha influito sulle prestazioni della pompa per vuoto durante il test.
Alla massima pressione (Figura 4), non è stata osservata alcuna differenza tra le letture della pressione dei gruppi di controllo e sperimentali per le condizioni di test continuo, ma c'è stata una differenza per la condizione di test intermittente. Per la condizione di test continuo, il gruppo sperimentale ha mostrato letture di pressione simili (-169,6 mmHg ± 1,56 mmHg) rispetto al controllo (-172,9 mmHg ± 2,18 mmHg) (p = 0,27).
Alla pressione minima (Figura 5), c'era una differenza tra le letture della pressione del gruppo di controllo e del gruppo sperimentale per la condizione di test continuo, ma non c'era differenza per la condizione di test intermittente. Per la condizione di test continuo, il gruppo sperimentale ha mostrato letture di pressione inferiori (-21,8 mmHg ± 0,7 mmHg) rispetto al controllo (-27,1 mmHg ± 1,75 mmHg) (p = 6 x 10-7). Per la condizione di test intermittente, il gruppo sperimentale ha mostrato letture di pressione simili (-20,6 mmHg ± 1,45 mmHg) rispetto al controllo (-23,4 mmHg + 1,83 mmHg) (p = 0,29). È stato osservato che la raccolta di liquidi è simile in tutti i gruppi (Figura 6 e Figura 7).
C'è stata una variazione nelle letture della pressione tra i campioni di prova. La variazione è stata in gran parte attribuita alla quantità di grasso che ciascun tessuto aveva e a quanto fosse fenestrato il tessuto prima del test e non alla camera di prova poiché veniva controllata di routine per rilevare eventuali perdite e, se rilevata, la perdita veniva riparata prima del test del campione.
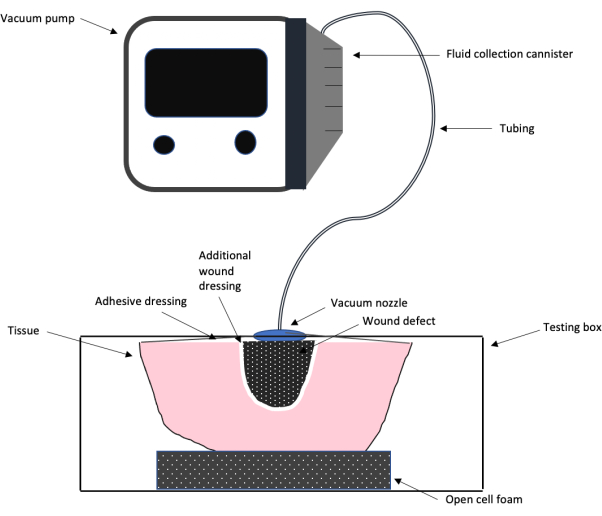
Figura 1: Schema della configurazione del test NPWT. Uno schema che mostra la configurazione generale del progetto di test del sistema di terapia delle ferite a pressione negativa utilizzato in questo lavoro, inclusa la pompa del vuoto, il tubo, la medicazione adesiva e la schiuma, la medicazione aggiuntiva e il difetto della ferita. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Progettazione del modello da banco NPWT. Un'immagine rappresentativa del design della scatola di plastica creata per il modello da banco NPWT. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Fasi della preparazione dei campioni e dell'assemblaggio dei componenti per i test. I passaggi eseguiti per testare il campione, come la preparazione del campione, il caricamento della camera di prova e la configurazione generale. La configurazione della camera di prova in questo esperimento mostra due manometri: uno collegato su un lato per leggere la pressione (a sinistra) e uno utilizzato come sistema di sicurezza e da rimuovere per aggiungere più fluido alla camera (a destra). La camera di prova mostra anche il posizionamento del tessuto riempito di schiuma, la medicazione della ferita e l'ugello a vuoto posizionato sopra. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Confronti della pressione massima. La media ± le letture della pressione di deviazione standard per i gruppi di controllo e sperimentali (gruppi 1-4, n = 3/gruppo) alla pressione massima (-200 mmHg) per 72 ore. La linea blu tratteggiata e la linea grigia tratteggiata mostrano i gruppi di pressione continui. La piccola linea arancione tratteggiata e le linee gialle tratteggiate e tratteggiate mostrano i gruppi di pressione intermittenti. Le letture della pressione sono state calcolate in media dai tre campioni di ciascun gruppo da 0 a 72 ore con incrementi di 12 ore. Clicca qui per visualizzare una versione più grande di questa figura.
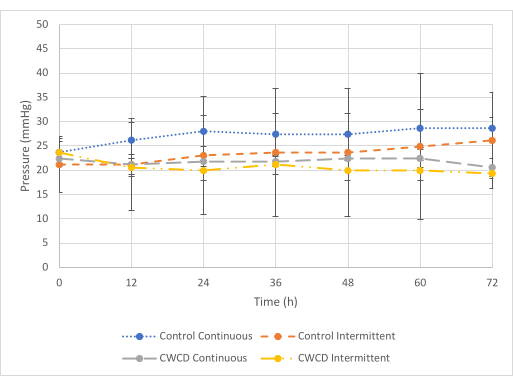
Figura 5: Confronti della pressione minima. La media ± le letture della pressione di deviazione standard per i gruppi di controllo e sperimentali (Gruppi 5-8, n = 3/gruppo) alla pressione minima (-25 mmHg) per 72 ore. La linea blu tratteggiata e la linea grigia tratteggiata mostrano i gruppi di pressione continui. La piccola linea arancione tratteggiata e le linee gialle tratteggiate e tratteggiate mostrano i gruppi di pressione intermittenti. Le letture della pressione sono state calcolate in media dai tre campioni di ciascun gruppo da 0 a 72 ore con incrementi di 12 ore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Immagini rappresentative della raccolta finale del fluido per i gruppi da 1 a 4. (A) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di controllo del Gruppo 1 in aspirazione continua alla massima pressione. (B) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di controllo del Gruppo 2 in aspirazione intermittente alla massima pressione. (C) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di prova del gruppo 3 in aspirazione continua alla massima pressione. (D) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di prova del gruppo 4 in aspirazione intermittente alla massima pressione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Immagini rappresentative della raccolta finale dei fluidi per i gruppi da 5 a 8. (A) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di controllo del Gruppo 5 in aspirazione continua alla pressione minima. (B) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di controllo del Gruppo 6 sottoposto ad aspirazione intermittente alla pressione minima. (C) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di prova del gruppo 7 in aspirazione continua alla pressione minima. (D) Un'immagine rappresentativa della raccolta del fluido dopo 72 ore per il campione di prova del gruppo 8 sottoposto ad aspirazione intermittente alla pressione minima. Clicca qui per visualizzare una versione più grande di questa figura.
| Reagente | Importo |
| Cloruro di sodio | 8,035 grammi |
| Bicarbonato di sodio | 0,355 g |
| Cloruro di potassio | 0,225 g |
| Fosfato di potassio bibasico triidrato | 0,231 g |
| Cloruro di magnesio esaidrato | 0,311 g |
| 1 M di acido cloridrico | 39 ml |
| Cloruro di calcio | 0,292 g |
| Solfato di sodio | 0,072 grammi |
| Tris(idrossimetil) amminometano | 6.118 grammi |
Tabella 1: I reagenti necessari per preparare il fluido corporeo simulato in 1 L di acqua deionizzata.
Discussione
Esistono alcuni modelli da banco per NPWT, ma presentano limitazioni significative. Loveluck et al. hanno sviluppato un modello computerizzato FEA per determinare in che modo la NPWT ha influenzato i siti di incisione suturati, ma non hanno tenuto conto di ulteriori materiali per la medicazione delle ferite6. Rycerz et al. hanno sviluppato modelli basati su agar per valutare la distribuzione della soluzione di instillazione alle ferite durante la NPWT7. Sebbene l'agar abbia fornito un mezzo per valutare la distribuzione di materiali/coloranti idrosolubili nei diversi modelli, è un materiale omogeneo semplice che non replica la complessa struttura eterogenea delle ferite che coinvolgono tessuti muscolari e adiposi sottoposti a NPWT. Inoltre, questi test sono stati eseguiti per periodi di tempo relativamente brevi, fino a 3,5 ore, mentre in condizioni cliniche è comune che il vuoto rimanga acceso per 48-72 ore prima di cambiare la medicazione della ferita3. In alternativa, è possibile utilizzare modelli suini in vivo, ma sono costosi e richiedono speciali processi di supervisione e approvazione prima dell'uso7. Non esistono attualmente modelli da banco che utilizzino una composizione e strutture tissutali realistiche per valutare la raccolta di fluidi e le pressioni all'interno del letto della ferita rispetto alla pompa del vuoto in diverse condizioni sperimentali.
Per ovviare a questa limitazione, è stato progettato e costruito un modello da banco in grado di leggere la pressione nell'arco di 72 ore dall'interno del difetto della ferita per vedere quanta pressione veniva applicata alla ferita rispetto alla lettura della pompa del vuoto. Ciò è stato ottenuto utilizzando il manometro collegato al tubo di pressione che attraversava il centro della schiuma. Per reintegrare il fluido nel contenitore durante i test e non influire sul vuoto, è stato aggiunto un secondo manometro, che poteva essere rimosso per il pipettaggio in ulteriore fluido. Questo secondo manometro fungeva anche da sistema di sicurezza perché doveva leggere zero e, in caso contrario, la camera di prova veniva pressurizzata al posto del campione di tessuto, il che avrebbe reso il test non valido. Un altro problema che il sistema ha affrontato è stato garantire che ci fosse una tenuta sufficiente sul campione; Ciò è stato ottenuto posizionando un pezzo di schiuma sotto il campione per sollevarlo in questo modo, quando il coperchio della camera di prova è stato chiuso, il tessuto è stato spinto verso il basso abbastanza da chiudere la camera senza che ci fosse spazio aggiuntivo.
La pancetta di maiale è stata utilizzata per soddisfare la necessità di un analogo del tessuto della ferita. La pancetta di maiale, che proviene dalla parte inferiore dello stomaco del maiale, è stata utilizzata perché ha strati di grasso e muscoli, che imitano i complessi muscoli umani e i tessuti adiposi e simulano meglio le caratteristiche del tessuto della ferita. Inoltre, la pancetta di maiale è facilmente ottenibile a buon mercato ed è necessaria solo una manipolazione minima per rimuovere i sali di stagionatura prima dell'uso. Le diverse composizioni dei campioni di tessuto utilizzati potrebbero aver causato alcune delle differenze di pressione osservate tra i gruppi. Le diverse composizioni di grasso e tessuto, o il modo in cui la schiuma è stata posizionata nel tessuto, possono aver influenzato la pressione che la macchina è stata in grado di tirare. Clinicamente, i pazienti mostreranno anche variazioni di muscoli, grasso e tessuto, quindi le differenze osservate a causa della composizione della pancetta di maiale potrebbero essere rappresentative della variazione nel modo in cui il dispositivo funziona nei pazienti.
Il design di questo modello da banco consente inoltre di testare in vitro nuove applicazioni per NPWT, da diverse pressioni a diversi materiali di medicazione delle ferite. Consente inoltre di registrare la pressione dall'interno del letto della ferita, dove si trova la schiuma, rispetto alla sola osservazione delle letture della pressione dalla pompa del vuoto. Questo mostra se la pressione applicata dalla pompa viene applicata all'interno della ferita. Il modello creato in questo studio è utile perché consente di registrare la raccolta e la pressione dei fluidi senza l'utilizzo di simulazioni al computer o test in vivo . Allo stesso modo, questo modello da banco è vantaggioso perché consente di osservare come la macchina NPWT lavora sui tessuti muscolari e adiposi che imitano più da vicino la condizione clinica rispetto ai materiali a base di agar. Questo modello è più conveniente rispetto ai test in vivo poiché non richiede l'uso di animali vivi ed è creato da articoli a basso costo.
Questo modello è stato utilizzato per confrontare le pressioni generate e il fluido raccolto da una macchina NPWT con e senza un dispositivo commerciale per la cura delle ferite con chitosano. La macchina NPWT è stata in grado di mantenere le pressioni per un periodo di 72 ore in presenza o in assenza del dispositivo avanzato per la cura delle ferite al chitosano. Quando la macchina NPWT è stata utilizzata con o senza il dispositivo per la cura delle ferite, non c'erano o c'erano solo piccole differenze nelle letture della pressione tra i gruppi di controllo (nessun dispositivo per la cura delle ferite) e di test (con dispositivo per la cura delle ferite) per un periodo di 72 ore nelle condizioni di test di pressione massima e minima. Tuttavia, non ci sono state differenze nella raccolta dei liquidi tra le membrane di controllo e di prova tra i gruppi di trattamento.
Alcuni passaggi del protocollo sono stati fondamentali per garantire che le letture della pressione e della raccolta dei fluidi fossero accurate per ciascun campione. Le fasi più importanti del processo di test sono state individuate nella fase 1. Per garantire la registrazione precisa delle letture della pressione, la scatola di prova creata non doveva mostrare perdite; In caso contrario, i manometri non funzionerebbero correttamente. Altri passaggi critici in questo processo includono i passaggi 2.2 e 3.1. La fase 2.2 è stata fondamentale perché il difetto della ferita doveva essere abbastanza profondo da penetrare attraverso lo strato finale di grasso nel campione e il tessuto doveva essere fenestrato per la raccolta del fluido. Il passaggio 3.1 era fondamentale perché il difetto doveva essere riempito con schiuma a pori aperti. La schiuma deve riempire l'intero difetto della ferita e adattarsi perfettamente; In caso contrario, non creerà una tenuta adeguata con il vuoto, causando problemi di lettura della pressione. La fase 3.4 era fondamentale perché la medicazione adesiva della ferita doveva coprire l'intero campione. Se la medicazione adesiva non copriva l'intero campione, potrebbero verificarsi perdite di pressione all'interno della camera di prova.
Un limite di questo lavoro è che non esiste un modello comparabile da confrontare. La replica e l'uso del modello da parte di altri contribuiranno a confermare l'utilità del modello. Un'altra limitazione di questo modello è la possibilità di perdite d'aria collegando il tubo di pressione al manometro. Un modo migliore per ridurre al minimo i rischi di perdite d'aria utilizzando un diverso approccio di connessione potrebbe essere utile negli studi futuri.
Questo modello da banco era necessario per NPWT in modo che il nuovo materiale potesse essere testato per verificarne la compatibilità esaminando la raccolta del fluido e la generazione di pressione per garantire che la medicazione aggiuntiva della ferita non alterasse le prestazioni del sistema NPWT. Il modello creato ha molte potenziali applicazioni in NPWT. Può essere utilizzato per testare diversi materiali per la medicazione delle ferite e le opzioni di somministrazione locale dei farmaci nei materiali per la medicazione delle ferite. Diversi tipi di ferite possono essere creati e testati utilizzando questo modello, come ferite incisionali, tunneling o ustioni. Per i diversi tipi di ferite, è stato possibile esaminare la pressione e la raccolta dei fluidi per determinare le impostazioni ottimali di NPWT. Questo modello apre anche altre strade per decidere come testare la NPWT in campioni di pelle, mentre prima i modelli erano per lo più limitati ad altri materiali o test simulati. In conclusione, il modello da banco progettato è stato in grado di valutare con successo le pressioni all'interno di un letto di ferita per le medicazioni per determinare se fossero compatibili con il sistema NPWT.
Nel complesso, il dispositivo per la cura delle ferite al chitosano testato non sembra inibire la pressione o la raccolta di liquidi nel sistema NPWT per le condizioni testate. In questo lavoro, è stato sviluppato un modello da banco per superare i limiti degli attuali modelli da banco, consentendo test per periodi di tempo prolungati, utilizzando un analogo tissutale e la capacità di adattarsi all'uso di materiali per la medicazione delle ferite.
Divulgazioni
Questo lavoro è stato supportato da una sovvenzione di Bionova Medical, Inc. (Germantown, TN).
Riconoscimenti
Questa ricerca è stata resa possibile con l'aiuto del Dipartimento di Ingegneria Biomedica dell'Università di Memphis e di Bionova Medical.
Materiali
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
Riferimenti
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20 (2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon