Method Article
Développement d’un modèle de paillasse pour évaluer la compatibilité des matériaux de pansement avec les systèmes de traitement des plaies par pression négative
Dans cet article
Résumé
Cette étude présente un modèle de paillasse conçu pour évaluer la compatibilité des matériaux de pansement avec les systèmes de traitement des plaies à pression négative en évaluant la pression et la collecte de liquide sur 72 h sous des réglages de pression continus et intermittents.
Résumé
Les systèmes de traitement des plaies par pression négative (TPN) facilitent la cicatrisation des plaies en appliquant une pression subatmosphérique sur le lit de la plaie, ce qui favorise la formation de tissu de granulation et réduit l’inflammation. Des pansements peuvent être utilisés avec ces systèmes pour améliorer la cicatrisation ; cependant, les effets des pansements sur le rendement des dispositifs de TPN sont difficiles à évaluer. Le but de cette étude était de développer un modèle analogique de chair de paillasse pour tester la compatibilité des matériaux de pansement avec les dispositifs de TPN. Dans cette étude, un dispositif avancé de traitement des plaies à base de chitosane a été évalué pour ses effets sur la performance du TPN sous des pressions thérapeutiques maximales et minimales. L’objectif était d’utiliser le modèle pour comparer les lectures de pression et la collecte de liquide pour des échantillons avec et sans dispositif de soins des plaies au chitosane. Le modèle de paillasse a été construit à l’aide d’une boîte en plastique reliée à plusieurs manomètres. Un défaut circulaire a été créé sur un morceau de poitrine de porc, utilisé comme analogue de la chair, et inséré dans la boîte. Le défaut a été comblé avec de la mousse NPWT standard ou de la mousse combinée au pansement. Du liquide corporel simulé contenant du sérum de bovin a été ajouté à la boîte, qui a ensuite été testée à des pressions maximale (-200 mmHg) ou minimale (-25 mmHg) pendant 72 h. La pression et la collecte de liquide ont été enregistrées toutes les 12 h. Le système TPN a réussi à maintenir la pression pendant la période d’essai de 72 heures, avec et sans les pansements d’essai. L’ajout de pansements n’a pas eu d’impact sur la collecte de liquide. La boîte de test s’est avérée efficace en tant que modèle de paillasse, car elle a pu être scellée et maintenue dans des conditions de vide pendant la période de test de 72 heures. Ce modèle a démontré avec succès son utilité dans l’évaluation de la compatibilité des matériaux de pansement avec les systèmes TPN.
Introduction
Différentes approches thérapeutiques existent pour aider au processus de gestion et de cicatrisation des plaies. Ces approches thérapeutiques comprennent des pansements avancés, des facteurs de croissance, l’oxygénothérapie hyperbare, des substituts cutanés et le traitement des plaies par pression négative (TPN)1. Le TPN fait référence aux systèmes de pansement qui appliquent en continu ou par intermittence une pression subatmosphérique au système, ce qui fournit une pression négative à la surface de la plaie. Le TPN est devenu une modalité de traitement populaire pour la prise en charge des plaies aiguës ou chroniques2. Le système NPWT se compose d’une mousse à cellules ouvertes, d’un pansement adhésif, d’un système de collecte de fluide et d’une pompe d’aspiration3. La pompe d’aspiration, ou vide, est utilisée pour maintenir une pression constante sur la plaie, ce qui aide à augmenter le flux sanguin et à réduire le risque d’infection4. Le TPN favorise la formation de tissu de granulation en éliminant le liquide de la plaie et en réduisant l’enflure1. Cliniquement, la pression d’aspiration utilisée pour les plaies varie de -20 mmHg à -200 mmHg, mais la pression la plus pertinente testée est de -125 mmHg5.
Les expériences ex vivo de TPN constituent un défi en raison du manque de modèles de paillasse adéquats pour les essais. Les méthodes actuelles pour tester les systèmes de TPN comprennent des simulations informatiques d’analyse par éléments finis (FEA), qui ont été utilisées pour tester comment le TPN affecte les sites d’incision6. D’autres modèles incluent des modèles de plaies à base d’agar-gélose de paillasse, qui peuvent être utilisés pour tester l’absorption de liquide7. In vivo, des modèles porcins ont également été utilisés pour examiner la cicatrisation des plaies8. Ces modèles présentent des avantages tels que la facilité de simulation sur un ordinateur pour prédire comment une plaie devrait guérir en théorie, ainsi que pour tester le fluide tiré à travers un matériau modèle. Les tests in vivo sont définitifs pour déterminer si le système fonctionne chez des sujets vivants8. Ces modèles ont tous des inconvénients également. Une simulation informatique peut ne pas représenter avec précision la façon dont une blessure guérirait dans la vie réelle. Un modèle basé sur la gélose peut montrer une bonne collecte de liquide à travers la plaie, mais peut ne pas représenter comment le liquide serait tiré à travers les tissus et les muscles7. Les modèles in vivo sont coûteux et nécessitent des ressources importantes pour mener à bien une étude. De plus, il peut être difficile de garder les animaux semi-immobiles, de sorte qu’il peut être difficile qu’ils tirent sur le système, ce qui peut avoir des résultats confondants.
Un modèle de paillasse est nécessaire pour le TPN afin que les nouveaux matériaux puissent être testés en vue de leur utilisation avec le système en utilisant du tissu réel. Le nouveau modèle devrait être en mesure de refléter comment l’accumulation de liquide est affectée par les tissus et les muscles. Le nouveau modèle devrait également être en mesure de fournir des lectures de pression à l’intérieur du lit de la plaie pour déterminer si la plaie recevait autant de pression que la pompe à vide fournissait. De nouveaux matériaux/dispositifs peuvent également être testés, tels que des pansements supplémentaires, différents types de mousse et différents pansements adhésifs sur le dessus de la plaie.
Certaines plaies nécessitent des pansements supplémentaires pour faciliter le processus de cicatrisation en réduisant le risque d’infection. Une autre raison pour laquelle des pansements supplémentaires peuvent être nécessaires est d’empêcher la croissance de tissu entre la surface du lit de la plaie et la mousse à cellules ouvertes. Ce pansement supplémentaire réduit le risque d’adhésion du lit de la plaie à la mousse à cellules ouvertes, ce qui contribue à réduire les dommages et la douleur lors de l’arrêt du système TPN9. Ces pansements supplémentaires peuvent être placés autour de la mousse à cellules ouvertes pour agir comme une membrane barrière entre le lit de la plaie et la mousse. Certains matériaux ont été utilisés comme interface entre le lit de la plaie et la mousse, tels que la paraffine ou la gaze enrobée de vaseline. La paraffine a montré un potentiel positif en tant que pansement en n’affectant pas le transfert de pression du système à l’ound9. Cependant, il a été signalé que la gaze incrustée dans de la vaseline inhibait l’accumulation de liquide et n’était donc pas considérée comme un matériau supplémentaire approprié9.
Les pansements à base de chitosane peuvent être un bon pansement supplémentaire à ajouter pendant le TPN en raison de leurs effets antimicrobiens et de leur biocompatibilité10,11. Le chitosane est un dérivé N-désacétylé de la chitine, qui est un polysaccharide naturel présent dans les champignons et les arthropodes12,13. Le chitosane a montré des propriétés antibactériennes inhérentes dans un large éventail de bactéries à Gram négatif et à Gram positif14. Par conséquent, les membranes de chitosane sont devenues populaires dans le traitement des plaies car elles peuvent être facilement produites, ont une longue durée de conservation et présentent des effets antimicrobiens innés10. Ces membranes présentent également une bonne biocompatibilité, une biodégradation et sont non toxiques10.
Dans cette étude, Foundation DRS, un dispositif avancé de traitement des plaies à base de chitosane et de glycosaminoglycane, a été examiné pour déterminer sa biocompatibilité avec le TPN. Foundation DRS est un échafaudage de régénération cutanée biodégradable fabriqué pour des caractéristiques de manipulation et une porosité idéales afin de favoriser l’invasion cellulaire et la néo-angiogenèse dans les plaies. Cet appareil est avantageux pour la guérison dans une gamme de blessures et d’utilisations différentes. Il a été créé pour être utilisé dans un large éventail de plaies, telles que les escarres, les ulcères du pied diabétique, les brûlures au premier degré, les plaies traumatiques, les plaies déhiscentes et les plaies chirurgicales10,11. Foundation DRS est une bonne option pour une utilisation dans le TPN en raison de son processus de fabrication, qui empêche l’appareil de se transformer en hydrogel lorsqu’il est mouillé. Cet appareil maintient une structure à pores ouverts lorsqu’il est mouillé, ce qui devrait permettre au fluide de s’écouler pendant l’application de NPWT12,13.
L’objectif de cette étude était de développer un modèle analogique de chair de paillasse qui pourrait être utilisé pour tester la compatibilité des matériaux de pansement avec les dispositifs de TPN. Cliniquement, les pressions varient de -80 mmHg à -125 mmHg pour la plupart des applications de TPN4. Pour simuler les pires conditions d’utilisation clinique, un réglage de pression plus élevé et plus bas a été utilisé (-25 mmHg et -200 mmHg). Un autre objectif de cette étude était de déterminer si l’ajout du dispositif de traitement des plaies au chitosane interférait avec les lectures de pression et la collecte de liquide du TPN. Des perturbations dans la collecte de liquide ou des pertes de pression pendant le TPN pourraient entraîner une mauvaise cicatrisation des plaies et des résultats cliniques. La collecte de liquide doit être similaire à celle des groupes de test avec et sans le dispositif de soin des plaies au chitosane. Les lectures de pression doivent également être similaires dans tous les groupes d’essai sur 72 h. En milieu clinique, le pansement est changé toutes les 48 à 72 heures, de sorte que chaque échantillon a été testé pendant 72 heures dans cette étude3. Pendant les essais, les lectures de pression doivent être observées pour s’assurer qu’il n’y a pas de chute de pression.
Protocole
Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Création de la boîte de test
- Procurez-vous un récipient en plastique de 3,2 tasses.
- Créez un trou de 2 pouces de diamètre au centre du couvercle du récipient. Faites également deux trous de 3/8 dans deux coins du couvercle du récipient à environ 1/2 pouce du joint de bord. Utilisez une scie cloche pour créer les trous.
REMARQUE : La figure 1 montre un schéma montrant la configuration globale des tests à l’aide d’une machine TPN commerciale connectée à une boîte analogique de chair de paillasse fabriquée en laboratoire. Ce schéma décrit comment la boîte est utilisée pour les expériences. La boîte créée pour cette expérience est illustrée à la figure 2. - Sur le premier des trous 3/8, connectez un manomètre directement au trou.
REMARQUE : Ce manomètre a été utilisé pour surveiller les chutes de pression à l’extérieur du tissu d’essai, ce qui indiquerait des fuites dans le tissu. - Sur le deuxième trou 3/8, faites passer un petit tube IV flexible d’un diamètre extérieur inférieur à 3/8 à travers le trou sur une longueur de 7 pouces sur le côté intérieur du couvercle. Ensuite, montez le tube de force sur un manomètre basse pression à l’extérieur du récipient.
REMARQUE : Le tube de force a été placé dans le lit de la plaie pendant le test.
2. Préparation analogique de la chair
- Utilisez de la poitrine de porc salée disponible dans le commerce, connue ci-après sous le nom de tissu, pour simuler les tissus musculaires et adipeux pour le test de TPN.
- Créez un défaut de plaie circulaire à la surface du tissu à l’aide d’un scalpel à lame #21 d’environ 1,5 pouce de large sur 0,75 pouce de profondeur. Ensuite, fenestrez le tissu à travers la graisse de chaque côté avec un scalpel à lame #21.
- Une fois le défaut de la plaie créé, essuyez le tissu pour éliminer l’excès de graisse de la peau, puis trempez toute la nuit dans de l’eau désionisée pour éliminer l’excès de sel.
3. Chargement de la chambre d’essai
- Remplissez le fond de la chambre d’essai avec de la mousse à cellules ouvertes de 1,5 pouce d’épaisseur. Ensuite, placez le mouchoir sur la mousse.
REMARQUE : Centrez manuellement l’échantillon de tissu de sorte que le défaut de la plaie créé se trouve directement sous le trou en haut du couvercle. - Pour les groupes expérimentaux, ajoutez le dispositif de soin des plaies au chitosane à l’intérieur du défaut de la plaie afin que le fond et les côtés du défaut soient couverts. Ensuite, remplissez le reste du défaut avec la mousse à cellules ouvertes.
- Insérez le tube de force relié au manomètre de la chambre d’essai dans la mousse à cellules ouvertes utilisée pour combler le défaut. Assurez-vous que ce tube est placé à peu près à mi-chemin de la surface du défaut de la plaie.
- Couvrez le tissu avec le pansement adhésif. Ensuite, créez une petite entaille sur le pansement adhésif, directement sur le milieu de la mousse à cellules ouvertes, en remplissant le défaut de la plaie.
- Enfilez la buse d’aspiration à travers le couvercle de la chambre d’essai et placez-la sur le pansement adhésif, là où la petite coupe a été effectuée. Après avoir placé la buse d’aspiration, fermez le couvercle de la chambre d’essai pour appuyer sur le pansement adhésif et la buse d’aspiration vers le bas, ce qui permet de créer une étanchéité.
- Connectez le récipient de collecte de fluide de 500 ml à la pompe à vide, puis connectez la buse à vide au réservoir de collecte de fluide.
4. Création du fluide corporel simulé
- Créer un fluide corporel simulé selon Marques et al.15.
- Produisez le liquide corporel simulé en combinant 8,035 g de NaCl, 0,355 g de NaHCO3, 0,225 g de KCl, 0,231 g de K2HPO43H2O, 0,311 g de Cl2Mg6H2O, 0,292 g de CaCl, 0,072 g de NaSO42-, 6,118 g de (HOCH2)3CNH2, et 39 mL de HCl 1 M dans 960 mL d’eau désionisée pour porter la solution totale à 1 L.
REMARQUE : La composition du liquide corporel simulé est indiquée dans le tableau 1. - Ensuite, combinez le liquide corporel simulé avec du sérum bovin dans un rapport de 3:1. Complétez la solution finale avec 5 % d’antibiotiques/antimycosiques 10x pour le contrôle microbien. Remuez la solution après avoir ajouté le sérum bovin et les antibiotiques/antimycosiques, puis conservez-la dans un réfrigérateur.
REMARQUE : La solution finale sera appelée solution complète. Cette solution ne doit pas être conservée stérile et doit être fraîche avant l’analyse de chaque échantillon.
5. Conditions d’essai
- Ajustez les paramètres de la pompe à vide pour les échantillons en fonction des conditions de test.
REMARQUE : Les groupes d’essai sont : Groupe 1 Contrôle (n = 3) : Mousse seule avec aspiration continue à -200 mmHg ; Groupe 2 Contrôle (n = 3) : Mousse seule avec aspiration intermittente de 0 à -200 mmHg ; Groupe 3 (n = 3) : Dispositif de traitement des plaies au chitosane sous mousse avec aspiration continue à -200 mmHg ; Groupe 4 (n = 3) : Dispositif de traitement des plaies au chitosane sous mousse avec aspiration intermittente de 0 à -200 mmHg ; Groupe 5 Contrôle (n = 3) : Mousse seule avec aspiration continue à -25 mmHg ; Groupe 6 Contrôle (n = 3) : Mousse seule avec aspiration intermittente de 0 à -25 mmHg ; Groupe 7 (n = 3) : Dispositif de traitement des plaies au chitosane sous mousse avec aspiration continue à -25 mmHg ; Groupe 8 (n = 3) : Dispositif de soin des plaies au chitosane sous mousse avec aspiration intermittente de 0 à -25 mmHg. - Pour les groupes d’essai de pression maximale, réglez la pression à -200 mmHg. Pour les groupes d’essai à pression minimale, réglez la pression à -25 mmHg. Ensuite, placez les réglages de la pompe à vide sur une pression intermittente ou continue. Analysez tous les échantillons pendant 72 h.
REMARQUE : Le réglage continu a appliqué une pression continue pendant 72 h. Le réglage intermittent a appliqué une pression à un rapport de 5/2 (5 min de pression, suivi de 2 min sans pression) pendant 72 h. Les valeurs maximales et minimales ont été choisies en fonction de la plage de pression que les systèmes cliniques de TPN peuvent utiliser. Un cycle de 72 heures a été choisi en fonction de la durée d’utilisation clinique du TPN avant d’effectuer un changement de pansement3. - Pendant l’essai, notez la pression sur le manomètre et la quantité de liquide dans le bidon de récupération de liquide toutes les 12 h pendant 72 h.
- Si la quantité de liquide corporel analogue tombe en dessous de 75 % du haut de la chambre d’essai, comme observé visuellement, retirez le manomètre secondaire et ajoutez une solution complète dans la chambre.
REMARQUE : La préparation des échantillons et la configuration des tests peuvent être illustrées à la figure 3. - Après 72 h, éteignez la pompe à vide et débranchez le réservoir de collecte de liquide de la buse à vide. Retirez le réservoir de récupération de liquide de la pompe à vide.
- Retirez le tissu de la chambre d’essai et retirez le pansement adhésif. Ensuite, retirez la mousse à cellules ouvertes et observez si l’appareil de soin des plaies au chitosane était toujours intact. Il est considéré comme intact s’il peut être retiré sans se casser, se déchirer ou se déchirer ; Cependant, des déchirures ou un amincissement mineurs sont acceptables si la membrane peut être complètement retirée.
6. Analyse statistique
- À des fins d’analyse statistique, utilisez les valeurs de pression enregistrées toutes les 12 h pendant la période d’essai à partir des trois échantillons par condition d’essai. Pour l’analyse statistique, la valeur finale de collecte de liquide des trois échantillons d’essai a été utilisée par condition d’essai.
REMARQUE : Pour toutes les analyses statistiques, le niveau de signification a été fixé à α = 0,05. - Calculez la moyenne et les écarts-types (n = 3/groupe) à chaque point temporel. Avant d’effectuer l’analyse statistique, effectuez un test de normalité pour chaque groupe à l’aide du test de Shapiro-Wilk (p. ex., aspiration continue à -200 mmHg, aspiration continue à -25 mmHg, aspiration intermittente à -200 mmHg et aspiration intermittente à -25 mmHg) pour déterminer si l’ANOVA ou le test de Kruskal-Wallis sont appropriés.
- Analyser les données pour les groupes expérimentaux et témoins soumis aux mêmes conditions d’essai de pression (p. ex., aspiration continue à -200 mmHg, aspiration continue à -25 mmHg, aspiration intermittente à -200 mmHg ou aspiration intermittente à -25 mmHg) à l’aide d’une ANOVA à deux voies ou d’un essai de Kruskal Wallis en utilisant le type de membrane et le temps comme facteurs principaux.
- Si des différences statistiques ont été identifiées, effectuer des analyses a posteriori. Utilisez le test post-hoc HSD de Tukey après l’ANOVA ou le test post-hoc de Dunn après le test de Kruskal-Wallis pour déterminer quels groupes sont différents.
- À l’aide des valeurs finales de collecte de liquide pour chaque échantillon dans les groupes témoin et expérimental, effectuez un test t bilatéral en supposant des variances inégales.
REMARQUE : La pression a été analysée à chaque point temporel pour s’assurer qu’il n’y avait pas de baisse significative de la pression pendant la durée de la période d’essai. Bien que la collecte de liquide ait été examinée à chaque fois, elle n’a été analysée qu’au point temporel final. En effet, chaque tissu avait des profils de graisse et de muscle différents, ce qui entraînait des taux de collecte de liquide différents, ce qui rend la collecte globale de liquide plus utile pour l’analyse que la collecte de liquide par points temporels.
Résultats
L’objectif de l’étude était de mettre au point un modèle de paillasse pour le TPN qui utilise un analogue tissulaire et d’utiliser ce modèle pour étudier la compatibilité des matériaux de pansement avec un appareil de traitement des plaies à pression négative. Le modèle a été utilisé pour étudier si la machine TPN était capable de maintenir la pression dans le temps avec l’ajout d’un dispositif de soin des plaies. Le modèle a également été utilisé pour déterminer si la pression générée et le liquide recueilli par l’appareil de TPN en présence d’un dispositif de soins des plaies étaient différents par rapport à l’absence de l’appareil.
Les pressions moyennes ± l’écart-type ont été calculées à chaque point temporel au cours de l’essai de 72 h pour chaque groupe témoin et groupe expérimental. Pour chaque groupe, les lectures de pression ont été comparées afin de déterminer s’il y avait eu des chutes de pression ou des augmentations de pression au fil du temps. Pour les quatre conditions d’essai à la pression maximale et minimale et pour les groupes témoin et expérimental, il n’y a pas eu de changement statistique de la pression au cours de la période d’essai de 72 h (p > 0,7). Étant donné qu’aucune chute de pression n’a été observée dans aucun groupe au cours de la période d’essai de 72 heures, l’ajout de la membrane de chitosane n’a pas affecté le rendement de la pompe à vide pendant l’essai.
À la pression maximale (figure 4), il n’y avait pas de différence entre les lectures de pression du groupe témoin et du groupe expérimental pour les conditions d’essai continu, mais il y avait une différence pour la condition d’essai intermittente. Pour la condition d’essai continu, le groupe expérimental a montré des lectures de pression similaires (-169,6 mmHg ± 1,56 mmHg) par rapport au témoin (-172,9 mmHg ± 2,18 mmHg) (p = 0,27).
À la pression minimale (figure 5), il y avait une différence entre les lectures de pression du groupe témoin et du groupe expérimental pour la condition d’essai continu, mais il n’y avait pas de différence pour la condition d’essai intermittente. Pour la condition d’essai continu, le groupe expérimental a montré des lectures de pression inférieures (-21,8 mmHg ± 0,7 mmHg) par rapport au témoin (-27,1 mmHg ± 1,75 mmHg) (p = 6 x 10-7). Pour la condition d’essai intermittente, le groupe expérimental a montré des lectures de pression similaires (-20,6 mmHg ± 1,45 mmHg) par rapport au témoin (-23,4 mmHg + 1,83 mmHg) (p = 0,29). La collecte de liquide était similaire dans tous les groupes (figures 6 et 7).
Il y avait des variations dans les lectures de pression entre les échantillons d’essai. La variation a été largement attribuée à la quantité de graisse contenue dans chaque tissu et à la façon dont le tissu était fenêtré avant le test et non à la chambre de test puisqu’elle était régulièrement vérifiée pour détecter les fuites, et si elle était détectée, la fuite était réparée avant le test de l’échantillon.
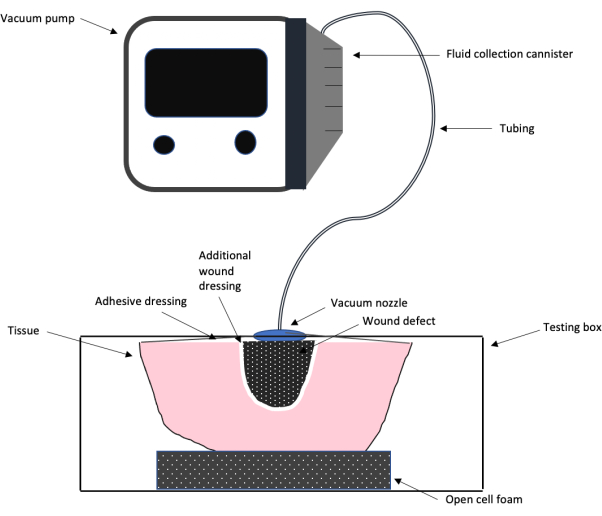
Figure 1 : Schéma de la configuration d’essai du TPN. Un schéma montrant la configuration globale de la conception des tests du système de traitement des plaies par pression négative utilisé dans ce travail, y compris la pompe à vide, la tubulure, le pansement adhésif et la mousse, le pansement supplémentaire et le défaut de la plaie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Conception du modèle de paillasse du TPN. Une image représentative de la conception de la boîte en plastique créée pour le modèle de paillasse NPWT. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Étapes de préparation des éprouvettes et d’assemblage des composants pour les essais. Les étapes prises pour tester l’échantillon, telles que la préparation de l’échantillon, le chargement de la chambre d’essai et la configuration globale. La configuration de la chambre d’essai dans cette expérience montre deux manomètres : l’un connecté sur son côté pour lire la pression (à gauche) et l’autre utilisé comme sécurité intégrée et à retirer pour ajouter plus de fluide à la chambre (à droite). La chambre d’essai montre également l’emplacement du tissu rempli de mousse, du pansement et de la buse d’aspiration placés sur le dessus. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Comparaisons de pression maximale. La moyenne ± valeurs de l’écart-type de pression pour les groupes témoins et expérimentaux (groupes 1-4, n = 3/groupe) à la pression maximale (-200 mmHg) pendant 72 h. La ligne bleue pointillée et la ligne grise pointillée indiquent les groupes de pression continus. La petite ligne pointillée orange et les lignes pointillées et pointillées jaunes indiquent les groupes de pression intermittents. La moyenne des lectures de pression a été calculée à partir des trois échantillons de chaque groupe de 0 à 72 h par incréments de 12 heures. Veuillez cliquer ici pour voir une version agrandie de cette figure.
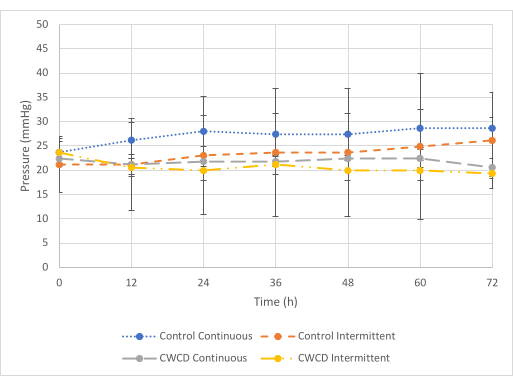
Figure 5 : Comparaisons de pression minimale. La moyenne ± les lectures de l’écart-type de pression pour les groupes témoins et expérimentaux (groupes 5-8, n = 3/groupe) à la pression minimale (-25 mmHg) pendant 72 h. La ligne bleue pointillée et la ligne grise pointillée indiquent les groupes de pression continus. La petite ligne pointillée orange et les lignes pointillées et pointillées jaunes indiquent les groupes de pression intermittents. La moyenne des lectures de pression a été calculée à partir des trois échantillons de chaque groupe de 0 à 72 h par incréments de 12 heures. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Images représentatives de la collection finale de liquide pour les groupes 1 à 4. (A) Une image représentative de la collecte de fluide après 72 h pour l’échantillon témoin du groupe 1 sous aspiration continue à la pression maximale. (B) Une image représentative de la collecte de liquide après 72 h pour l’échantillon témoin du groupe 2 sous aspiration intermittente à la pression maximale. (C) Une image représentative de la collecte de fluide après 72 h pour l’échantillon d’essai du groupe 3 sous aspiration continue à la pression maximale. (D) Une image représentative de la collecte de fluide après 72 h pour l’échantillon d’essai du groupe 4 sous aspiration intermittente à la pression maximale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Images représentatives de la collection finale de liquide pour les groupes 5 à 8. (A) Une image représentative de la collecte de fluide après 72 h pour l’échantillon témoin du groupe 5 sous aspiration continue à pression minimale. (B) Une image représentative de la collecte de liquide après 72 h pour l’échantillon témoin du groupe 6 sous aspiration intermittente à pression minimale. (C) Une image représentative de la collecte de fluide après 72 h pour l’échantillon d’essai du groupe 7 sous aspiration continue à pression minimale. (D) Une image représentative de la collecte de liquide après 72 h pour l’échantillon d’essai du groupe 8 sous aspiration intermittente à la pression minimale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Quantité |
| Chlorure de sodium | 8,035 grammes |
| Bicarbonate de sodium | 0,355 gramme |
| Chlorure de potassium | 0,225 g |
| Phosphate de potassium dibasique trihydraté | 0,231 g |
| Chlorure de magnésium hexahydraté | 0,311 gramme |
| 1 M d’acide chlorhydrique | 39 ml |
| Chlorure de calcium | 0,292 g |
| Sulfate de sodium | 0,072 gramme |
| Tris(hydroxyméthyl) aminométhane | 6,118 grammes |
Tableau 1 : Les réactifs nécessaires à la préparation du liquide corporel simulé dans 1 L d’eau DI.
Discussion
Il existe quelques modèles de paillasse pour le TPN, mais ils présentent des limites importantes. Loveluck et al. ont développé un modèle informatique FEA pour déterminer comment le TPN affectait les sites d’incision des sutures, mais n’ont pas tenu compte des matériaux de pansement supplémentaires6. Rycerz et al. ont développé des modèles basés sur la gélose pour évaluer la distribution de la solution d’instillation sur les plaies pendant le TPN7. Bien que la gélose ait fourni un support pour évaluer la distribution des matériaux/colorants solubles dans l’eau dans les différents modèles, il s’agit d’un matériau homogène simple qui ne reproduit pas la structure hétérogène complexe des plaies impliquant des tissus musculaires et adipeux soumis au TPN. De plus, ces tests ont été effectués pendant des périodes relativement courtes, allant jusqu’à 3,5 h, alors que dans des conditions cliniques, il est courant que le vide reste allumé pendant 48 à 72 heures avant de changer le pansement3. Par ailleurs, in vivo, des modèles porcins peuvent être utilisés, mais ils sont coûteux et nécessitent des processus spéciaux de surveillance et d’approbation avant d’être utilisés7. Il n’existe actuellement aucun modèle de paillasse qui utilise une composition tissulaire et des structures réalistes pour évaluer l’accumulation de liquide et les pressions à l’intérieur du lit de la plaie par rapport à la pompe à vide dans différentes conditions expérimentales.
Pour remédier à cette limitation, un modèle de paillasse a été conçu et construit pour être capable de lire la pression sur une période de 72 h à partir de l’intérieur du défaut de la plaie afin de voir combien de pression était appliquée à la plaie par rapport à la lecture de la pompe à vide. Cela a été réalisé en utilisant le manomètre relié au tube de pression qui traversait le milieu de la mousse. Pour réapprovisionner le liquide dans le récipient pendant les tests et ne pas affecter le vide, un deuxième manomètre a été ajouté, qui pouvait être retiré pour être pipeté dans du liquide supplémentaire. Ce deuxième manomètre a également agi comme une sécurité intégrée car il devait indiquer zéro, et si ce n’était pas le cas, la chambre d’essai était pressurisée au lieu de l’échantillon de tissu, ce qui rendait le test invalide. Un autre problème que le système a résolu était de s’assurer qu’il y avait suffisamment d’étanchéité sur l’échantillon ; Cela a été réalisé en plaçant un morceau de mousse sous l’échantillon pour le soulever de cette façon que lorsque le couvercle de la chambre d’essai était fermé, le tissu était suffisamment poussé vers le bas pour fermer la chambre sans qu’il y ait d’espace supplémentaire.
La poitrine de porc a été utilisée pour répondre au besoin d’un analogue du tissu de la plaie. La poitrine de porc, qui provient du dessous de l’estomac du porc, a été utilisée parce qu’elle comporte des couches de graisse et de muscle, qui imitent les tissus musculaires et adipeux humains complexes et simulent mieux les caractéristiques des tissus de la plaie. De plus, la poitrine de porc est facile à obtenir à peu de frais, et seule une manipulation minimale est nécessaire pour éliminer les sels de salaison avant utilisation. Les différentes compositions des échantillons de tissus utilisés pourraient avoir causé certaines des différences de pression observées entre les groupes. Différentes compositions de graisse et de tissus, ou la façon dont la mousse a été placée dans le tissu, peuvent avoir affecté la pression que la machine était capable de tirer. Cliniquement, les patients présenteront également des variations de muscles, de graisse et de tissus, de sorte que les différences observées en raison de la composition de la poitrine de porc pourraient être représentatives de la variation du fonctionnement de l’appareil chez les patients.
Cette conception de modèle de paillasse permet également de nouvelles applications pour le TPN à tester in vitro, à partir de différentes pressions et de différents matériaux de pansement. Il permet également d’enregistrer la pression à l’intérieur du lit de la plaie où se trouve la mousse, au lieu de simplement observer les lectures de pression de la pompe à vide. Cela montre si la pression appliquée par la pompe est appliquée à l’intérieur de la plaie. Le modèle créé dans cette étude est utile car il permet d’enregistrer la collecte de fluides et la pression sans utiliser de simulations informatiques ou d’essais in vivo . De même, ce modèle de paillasse est avantageux car il permet d’examiner comment la machine TPN fonctionne sur les tissus musculaires et adipeux qui imitent plus étroitement l’état clinique que les matériaux à base de gélose. Ce modèle est plus abordable que les tests in vivo car il ne nécessite pas l’utilisation d’animaux vivants et il est créé à partir d’articles à faible coût.
Ce modèle a été utilisé pour comparer les pressions générées et le liquide recueilli par un appareil TPN avec et sans dispositif commercial de traitement des plaies au chitosane. L’appareil NPWT a été capable de maintenir des pressions pendant la période de 72 heures en présence ou en l’absence du dispositif avancé de traitement des plaies au chitosane. Lorsque l’appareil TPN a été utilisé avec ou sans l’appareil de soin des plaies, il n’y avait pas ou seulement de petites différences dans les lectures de pression entre les groupes témoin (aucun appareil de soins des plaies) et d’essai (avec appareil de soins des plaies) sur une période de 72 h dans les conditions d’essai de pression maximale et minimale. Cependant, il n’y avait pas de différences dans la collecte de liquide entre les membranes de contrôle et d’essai dans les groupes de traitement.
Certaines étapes du protocole étaient essentielles pour garantir que les lectures de pression et de collecte de liquide étaient exactes pour chaque échantillon. Les étapes les plus importantes du processus de test ont été trouvées à l’étape 1. Pour garantir l’enregistrement précis des relevés de pression, le boîtier de test créé ne devait montrer aucune fuite ; Sinon, les manomètres ne fonctionneraient pas correctement. Les autres étapes critiques de ce processus comprennent les étapes 2.2 et 3.1. L’étape 2.2 était cruciale car le défaut de la plaie devait être suffisamment profond pour pénétrer à travers la dernière couche de graisse de l’échantillon, et le tissu devait être fenestré pour la collecte de liquide. L’étape 3.1 était critique car le défaut devait être rempli avec de la mousse à pores ouverts. La mousse doit remplir tout le défaut de la plaie et s’adapter parfaitement ; Sinon, il ne créera pas une bonne étanchéité avec le vide, ce qui entraînera des problèmes de lecture de la pression. L’étape 3.4 était cruciale, car le pansement adhésif devait couvrir l’ensemble de l’échantillon. Si le pansement adhésif ne couvrait pas l’ensemble de l’échantillon, il pouvait y avoir des fuites de pression à l’intérieur de la chambre d’essai.
L’une des limites de ce travail est qu’il n’existe pas de modèle comparable à comparer. La réplication et l’utilisation du modèle par d’autres personnes aideront à confirmer l’utilité du modèle. Une autre limitation de ce modèle est le risque de fuites d’air en connectant le tube de force au manomètre. Une meilleure façon de minimiser les risques de fuites d’air en utilisant une approche de connexion différente pourrait être utile dans les études futures.
Ce modèle de paillasse était nécessaire pour le TPN afin que la compatibilité du nouveau matériau puisse être testée en examinant la collecte de liquide et la génération de pression pour s’assurer que le pansement supplémentaire ne modifiait pas les performances du système de TPN. Le modèle créé a de nombreuses applications potentielles dans le TPN. Il peut être utilisé pour tester différents matériaux de pansement et les options locales d’administration de médicaments dans les matériaux de pansement. Plusieurs types de plaies peuvent être créées et testées à l’aide de ce modèle, telles que les plaies incisionnelles, tunnelières ou les brûlures. Pour les différents types de plaies, la pression et la collecte de liquide ont pu être examinées afin de déterminer les réglages optimaux de TPN. Ce modèle ouvre également d’autres voies pour décider comment tester le TPN dans des échantillons de peau, alors qu’auparavant, les modèles étaient principalement limités à d’autres matériaux ou à des tests simulés. En conclusion, le modèle de paillasse conçu a réussi à évaluer les pressions à l’intérieur d’un lit de plaie pour les pansements afin de déterminer s’ils étaient compatibles avec le système TPN.
Dans l’ensemble, le dispositif de traitement des plaies au chitosane testé n’a pas semblé inhiber la pression ou l’accumulation de liquide dans le système de TPN dans les conditions testées. Dans le cadre de ce travail, un modèle de paillasse a été mis au point pour surmonter les limites des modèles de paillasse actuels en permettant des tests sur de longues périodes, en utilisant un analogue tissulaire et en permettant l’utilisation de matériaux de pansement.
Déclarations de divulgation
Ce travail a été soutenu par une subvention de Bionova Medical, Inc. (Germantown, TN).
Remerciements
Cette recherche a été rendue possible grâce à l’aide du département de génie biomédical de l’Université de Memphis et de Bionova Medical.
matériels
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
Références
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20 (2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon