Method Article
开发用于评估伤口敷料材料与负压伤口治疗系统相容性的台式模型
摘要
本研究提出了一个台式模型,旨在通过评估在连续和间歇压力设置下 72 小时内的压力和液体收集来评估伤口敷料材料与负压伤口治疗系统的相容性。
摘要
负压伤口治疗 (NPWT) 系统通过对创面床施加低于大气压的压力来促进伤口愈合,从而促进肉芽组织形成并减少炎症。伤口敷料可与这些系统一起使用,以促进愈合;然而,敷料对 NPWT 设备性能的影响很难评估。本研究的目的是开发一个台式肉体模拟模型,用于测试伤口敷料材料与 NPWT 设备的兼容性。在这项研究中,评估了一种基于壳聚糖的高级伤口护理装置在最大和最小治疗压力下对 NPWT 性能的影响。目标是使用该模型比较有和没有壳聚糖伤口护理装置的样品的压力读数和液体收集。台式模型是使用连接到多个压力表的塑料盒构建的。在一块五花肉上形成一个圆形缺陷,用作肉类类似物,并插入盒子中。用标准 NPWT 泡沫或泡沫与伤口敷料混合填充缺损。将含有牛血清的模拟体液加入盒子中,然后在最大 (-200 mmHg) 或最小 (-25 mmHg) 压力下测试 72 小时。每 12 小时记录一次压力和液体收集。NPWT 系统在 72 小时的测试期间成功地保持了压力,无论有没有测试敷料。添加伤口敷料不会影响液体收集。事实证明,该测试箱作为台式模型是有效的,因为它可以在 72 小时的测试期间密封并保持真空条件。该模型成功地证明了它在评估伤口敷料材料与 NPWT 系统的兼容性方面的实用性。
引言
存在不同的治疗方法来帮助伤口的管理和愈合过程。此类治疗方法包括高级伤口敷料、生长因子、高压氧疗法、皮肤替代物和负压伤口疗法 (NPWT)1。NPWT 是指连续或间歇性地向系统施加低于大气压的压力的伤口敷料系统,从而向伤口表面提供负压。NPWT 已成为管理急性或慢性伤口的流行治疗方式2。NPWT 系统由开孔泡沫、粘性伤口敷料、液体收集系统和抽吸泵3 组成。抽吸泵或真空用于保持伤口上的稳定压力,这有助于增加血流量并降低感染风险4。NPWT 通过去除伤口中的液体和减少肿胀来促进肉芽组织的形成1。临床上,用于伤口的抽吸压力范围为 -20 mmHg 至 -200 mmHg,但测试的最相关压力为 -125 mmHg5。
由于缺乏足够的台式模型进行测试,NPWT 的离体实验是一项挑战。目前测试 NPWT 系统的方法包括有限元分析 (FEA) 计算机模拟,这些模拟已被用于测试 NPWT 如何影响切口部位6。其他模型包括基于琼脂的台式伤口模型,可用于测试液体摄取7。在体内,猪模型也被用于检查伤口愈合8。这些模型具有一些优点,例如易于在计算机上模拟,以预测伤口在理论上应该如何愈合,以及测试流体被拉过模型材料。体内测试对于确定该系统是否在活体受试者中起作用是决定性的8。这些模型也有缺点。计算机模拟可能无法准确表示伤口在现实生活中的愈合情况。基于琼脂的模型可能显示通过伤口拉出良好的液体收集,但可能无法代表液体如何被拉过组织和肌肉7。体内模型价格昂贵,并且需要大量资源才能完成研究。此外,让动物半不动可能很困难,因此它们拉扯系统可能会遇到挑战,这可能会产生令人困惑的结果。
NPWT 需要一个台式模型,以便可以使用实际组织测试新材料以与系统一起使用。新模型应该能够反映组织和肌肉如何影响液体收集。新型号还应该能够提供伤口床内的压力读数,以确定伤口承受的压力是否与真空泵提供的压力相同。还可以测试新的材料/设备,例如额外的伤口敷料、不同类型的泡沫和伤口顶部的不同粘合剂敷料。
某些伤口需要额外的伤口敷料,以降低感染风险来帮助愈合过程。可能需要额外的伤口敷料材料的另一个原因是防止组织在伤口床表面和开孔泡沫之间向内生长。这种额外的敷料降低了创面床粘附在开孔泡沫上的风险,这有助于减少停止 NPWT 系统时的损伤和疼痛9.这些额外的敷料可以放置在开孔泡沫周围,以充当伤口床和泡沫之间的屏障膜。某些材料已用作伤口床和泡沫之间的界面,例如石蜡或凡士林包埋纱布。石蜡已显示出作为伤口敷料的积极潜力,因为它不会影响从系统到 ound9 的压力传递。然而,据报道,凡士林包埋的纱布会抑制液体收集,因此不被认为是合适的附加材料9。
基于壳聚糖的伤口敷料可能是在 NPWT 期间添加的良好附加敷料,因为它们具有抗菌作用和生物相容性10,11。壳聚糖是甲壳素的 N-脱乙酰衍生物,甲壳素是一种存在于真菌和节肢动物中的天然多糖12,13。壳聚糖在广谱革兰氏阴性菌和革兰氏阳性菌中表现出固有的抗菌特性14。因此,壳聚糖膜在伤口治疗中越来越受欢迎,因为它们很容易生产,保质期长,并显示出与生俱来的抗菌作用10。这些膜还显示出良好的生物相容性、生物降解性,并且无毒10.
在这项研究中,检查了壳聚糖和糖胺聚糖高级伤口护理装置 Foundation DRS,以确定其与 NPWT 的生物相容性。Foundation DRS 是一种可生物降解的真皮再生支架,具有理想的处理特性和孔隙率,可促进伤口中的细胞侵袭和新血管生成。该设备有利于一系列不同伤害和用途的愈合。它旨在用于各种伤口,例如压疮、糖尿病足溃疡、一度烧伤、创伤伤口、裂开伤口和手术伤口10,11。Foundation DRS 是 NPWT 的不错选择,因为它的制造工艺可以防止设备在潮湿时变成水凝胶。该装置在润湿时保持开孔结构,这应该允许流体在 NPWT12,13 的应用过程中流动。
本研究的目的是开发一种台式肉体模拟模型,可用于测试伤口敷料材料与 NPWT 装置的相容性。临床上,大多数 NPWT 应用的压力范围为 -80 mmHg 至 -125 mmHg4。为了模拟最坏情况下的临床使用条件,使用了更高和更低的压力设置(-25 mmHg 和 -200 mmHg)。本研究的另一个目的是确定添加壳聚糖伤口护理装置是否会干扰 NPWT 的压力读数和液体收集。NPWT 期间液体收集中断或压力损失可能导致伤口愈合不良和临床结果不佳。积液应与有和没有壳聚糖伤口护理装置的试验组相似。在 72 小时内,测试组的压力读数也应相似。在临床环境中,伤口敷料每 48-72 小时更换一次,因此在本研究中每个样品测试了 72 小时3。在测试过程中,应观察压力读数以确保压力没有下降。
研究方案
本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 创建测试框
- 获取一个 3.2 杯塑料容器。
- 在容器盖的中心创建一个直径为 2 英寸的孔。此外,在容器盖的两个角上开两个 3/8 孔,距离边缘密封约 1/2 英寸。使用孔锯创建孔。
注意: 图 1 显示了使用连接到实验室构建的台式 Flesh 模拟盒的商用 NPWT 机器的整体测试设置的示意图。该示意图概述了如何将盒子用于实验。为该实验创建的框如图 2 所示。 - 在 3/8 个孔的第一个孔上,将压力表直接连接到孔中。
注意:该压力表用于监测测试组织外部的压降,这表明组织中存在泄漏。 - 在第二个 3/8 孔上,将外径小于 3/8 的小柔性静脉输液管穿过孔,将盖子内侧的长度为 7 英寸。然后,将压力管安装到容器外的低压表上。
注意:在测试过程中,压力管被放置在伤口床中。
2. 肉体类似物制备
- 使用市售的咸五花肉(此处称为组织)来模拟用于 NPWT 测试的肌肉和脂肪组织。
- 使用大约 21 英寸宽 x 1.5 英寸深的刀片手术刀在组织表面创建一个圆形伤口缺损。然后,用 #21 刀片手术刀穿过每一侧的脂肪给组织开孔。
- 形成伤口缺损后,擦拭组织以去除皮肤上多余的脂肪,然后在去离子水中浸泡过夜以去除多余的盐分。
3. 测试室的加载
- 用 1.5 英寸厚的开孔泡沫填充测试室的底部。然后,将纸巾放在泡沫上。
注意:手动将组织样品居中,使产生的伤口缺损位于盖子顶部的孔正下方。 - 对于实验组,在伤口缺损内添加壳聚糖伤口护理装置,以覆盖缺损的底部和侧面。然后,用开孔泡沫填充缺陷的其余部分。
- 将连接到测试室压力表的压力管插入用于填充缺陷的开孔泡沫中。确保该管子放置在距离伤口缺损表面大约一半的位置。
- 用粘性伤口敷料覆盖组织。然后,在粘性敷料上,直接在开孔泡沫的中间顶部做一个小切口,填充伤口缺损。
- 将真空喷嘴穿过测试室的盖子,并将其放在粘合剂敷料的顶部,在那里进行小切口。放置真空吸嘴后,合上检测室的盖子,将粘接伤口敷料和真空吸嘴向下压,这有助于形成密封。
- 将 500 mL 液体收集罐连接到真空泵,然后将真空喷嘴连接到液体收集罐。
4. 创建模拟体液
- 根据 Marques 等人 15 创建模拟体液。
- 通过混合 8.035 g NaCl、0.355 g NaHCO3、0.225 g KCl、0.231 g K2HPO43H2O、0.311 g Cl2Mg6H2O、0.292 g CaCl、0.072 g NaSO42-、6.118 g (HOCH2)3CNH2 来制备模拟体液, 和 39 mL 1 M HCl 的 960 mL 去离子水溶液,使总溶液达到 1 L。
注意:模拟体液的成分如 表 1 所示。 - 然后,将模拟体液与牛血清以 3:1 的比例混合。用 5% 的 10 倍抗生素/抗真菌剂补充最终溶液以进行微生物控制。加入牛血清和抗生素/抗真菌药后搅拌溶液,然后存放在冰箱中。
注意:最终解决方案将称为完整解决方案。该溶液不应保持无菌,应在测试每个样品之前保持新鲜。
5. 测试条件
- 根据测试条件调整样品真空泵的设置。
注意:测试组是: 第 1 组对照 (n = 3):单独泡沫,以 -200 mmHg 连续抽吸;第 2 组对照 (n = 3):单独使用泡沫,间歇性抽吸 0 至 -200 mmHg;第 3 组 (n = 3):泡沫下的壳聚糖伤口护理装置,以 -200 mmHg 的速度连续抽吸;第 4 组 (n = 3):泡沫下的壳聚糖伤口护理装置,间歇性抽吸 0 至 -200 mmHg;第 5 组对照 (n = 3):单独泡沫,以 -25 mmHg 连续抽吸;第 6 组对照 (n = 3):单独泡沫,间歇性抽吸 0 至 -25 mmHg;第 7 组 (n = 3):泡沫下的壳聚糖伤口护理装置,以 -25 mmHg 连续抽吸;第 8 组 (n = 3):泡沫下的壳聚糖伤口护理装置,间歇性抽吸 0 至 -25 mmHg。 - 对于最大压力测试组,将压力设置为 -200 mmHg。对于最小压力测试组,将压力设置为 -25 mmHg。然后,将真空泵设置置于间歇或连续压力下。运行所有样品 72 小时。
注意:连续设置连续施加压力 72 小时。间歇设置以 5/2 的比率施加压力(5 分钟的压力,然后 2 分钟无压力)持续 72 小时。最大值和最小值是根据临床 NPWT 系统可以使用的压力范围选择的。根据在进行绷带更换之前临床上通常使用 NPWT 的时间长度选择 72 小时的周期3。 - 在测试过程中,每 12 小时记录一次压力表上的压力和液体收集罐中的液体量,持续 72 小时。
- 如果肉眼观察到的体液模拟量低于测试室顶部的 75%,请取下辅助压力表并向测试室中添加完整的溶液。
注意:样品的制备和测试设置如图 3 所示。 - 72 小时后,关闭真空泵并断开液体收集罐与真空喷嘴的连接。从真空泵中取出液体收集罐。
- 从检测室中取出组织,然后拉下粘性伤口敷料。然后,取出开孔泡沫,观察壳聚糖伤口护理装置是否仍然完好无损。如果它可以在不断裂、撕裂或撕裂的情况下被移除,则认为它是完整的;但是,如果膜可以完全去除,则轻微撕裂或变薄是可以接受的。
6. 统计分析
- 使用在测试期间每个测试条件的三个试样中每 12 小时记录的压力值进行统计分析。对于统计分析,根据测试条件使用三个测试样本的最终液体收集值。
注:对于所有统计分析,显著性水平设置为 α = 0.05。 - 计算每个时间点的平均值和标准差(n = 3/组)。在进行统计分析之前,使用 Shapiro-Wilk 检验(例如,-200 mmHg 连续抽吸、-25 mmHg 连续抽吸、-200 mmHg 间歇抽吸和 -25 mmHg 间歇抽吸)对每组进行正态性检验,以确定方差分析或 Kruskal-Wallis 检验是否合适。
- 使用双向方差分析或 Kruskal Wallis 检验分析承受相同压力测试条件(例如,-200 mmHg 连续抽吸;-25 mmHg 连续抽吸;-200 mmHg 间歇抽吸或 -25 mmHg 间歇抽吸)的实验组和对照组的数据膜类型和时间作为主要因素。
- 如果发现统计差异,则进行事后分析。在方差分析之后使用 Tukey 的 HSD 事后检验或在 Kruskal-Wallis 检验之后使用 Dunn 事后检验来确定哪些组不同。
- 使用对照组和实验组中每个样品的最终液体收集值,在假设方差不等的情况下执行双尾 t 检验。
注:在每个时间点分析压力,以确保在整个测试期间压力没有显着下降。虽然每次都检查了液体收集,但仅在最终时间点进行了分析。这是因为每个组织具有不同的脂肪和肌肉特征,导致不同的液体收集速率,这使得整体液体收集比按时间点收集液体更适用于分析。
结果
该研究的目标是开发一个使用组织类似物的 NPWT 台式模型,并使用该模型研究伤口敷料材料与负压伤口治疗机的兼容性。该模型用于研究 NPWT 机器是否能够在添加伤口护理设备的情况下随着时间的推移保持压力。该模型还用于确定 NPWT 机器在存在伤口护理设备的情况下产生的压力和收集的液体是否与没有该设备时不同。
计算每个对照组和实验组在 72 h 测试的每个时间点的平均±标准差压力。对于每组,比较压力读数以确定随着时间的推移是否有任何压力下降或压力升高。对于最大和最小压力下的所有四种测试条件以及对照组和实验组,在 72 小时测试期间压力没有统计学变化 (p > 0.7)。由于在 72 小时的测试期间,任何组内都没有看到压降,因此在测试期间添加壳聚糖膜不会影响真空泵的性能。
在最大压力下(图 4),在连续测试条件下,对照组和实验组的压力读数没有差异,但在间歇测试条件下存在差异。对于连续测试条件,实验组与对照组 (-172.9 mmHg ± 2.18 mmHg) 显示相似的压力读数 (-169.6 mmHg ± 1.56 mmHg) (p = 0.27)。
在最小压力下(图 5),在连续测试条件下,对照组和实验组的压力读数之间存在差异,但在间歇测试条件下没有差异。对于连续测试条件,与对照组 (-27.1 mmHg ± 1.75 mmHg) 相比,实验组显示较低的压力读数 (-21.8 mmHg ± 0.7 mmHg) (p = 6 x 10-7)。对于间歇性测试条件,与对照组 (-23.4 mmHg + 1.83 mmHg) 相比,实验组显示出相似的压力读数 (-20.6 mmHg ± 1.45 mmHg) (p = 0.29)。观察到所有组的液体收集相似(图 6 和 图 7)。
测试样本之间的压力读数存在差异。这种变化主要归因于每个组织的脂肪量和测试前组织的开孔程度,而不是测试室,因为它会定期检查是否有泄漏,如果检测到,则会在样品测试之前修复泄漏。
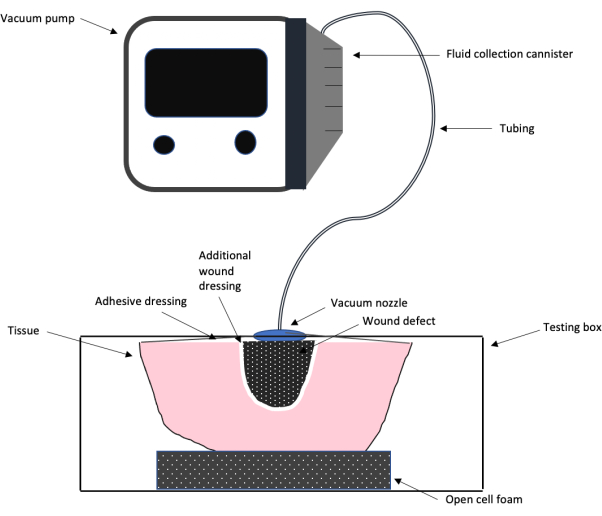
图 1:NPWT 测试设置示意图。 示意图显示了本研究中使用的负压伤口治疗系统的整体测试设计设置,包括真空泵、管道、粘性伤口敷料和泡沫、额外的伤口敷料和伤口缺损。 请单击此处查看此图的较大版本。

图 2:NPWT 台式模型设计。 为 NPWT 台式模型创建的塑料盒设计的代表性图像。 请单击此处查看此图的较大版本。

图 3:准备试样和组装测试组件的步骤。 测试样品所采取的步骤,例如样品制备、测试室的加载和整体设置。本实验中的测试室设置显示了两个压力表:一个侧面连接以读取压力(左),另一个用作故障保护装置并移除以向腔室添加更多液体(右)。测试室还显示了装满泡沫的组织、伤口敷料和放置在顶部的真空喷嘴的位置。 请单击此处查看此图的较大版本。

图 4:最大压力比较。 对照组和实验组 (第 1-4 组,n = 3/组) 在最大压力 (-200 mmHg) 下 72 小时的平均值±标准差压力读数。蓝色虚线和灰色虚线表示连续压力组。橙色小虚线和黄色虚线表示间歇性压力组。以 12 小时的增量从每组 0-72 小时对每组三个样品的压力读数进行平均。 请单击此处查看此图的较大版本。
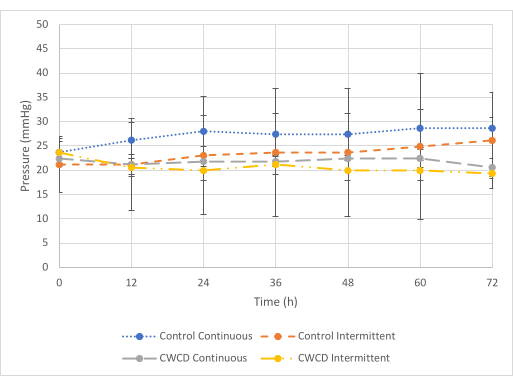
图 5:最小压力比较。 对照组和实验组 (第 5-8 组,n = 3/组) 在最小压力 (-25 mmHg) 下 72 小时的平均值±标准差压力读数。蓝色虚线和灰色虚线表示连续压力组。橙色小虚线和黄色虚线表示间歇性压力组。以 12 小时的增量从每组 0-72 小时对每组三个样品的压力读数进行平均。 请单击此处查看此图的较大版本。

图 6:第 1 组至第 4 组最终液体收集的代表性图像。 (A) 第 1 组对照样品在最大压力下连续抽吸 72 小时后液体收集的代表性图像。(B) 在最大压力下间歇抽吸下第 2 组对照样品 72 小时后液体收集的代表性图像。(C) 第 3 组测试样品在最大压力下连续抽吸 72 小时后液体收集的代表性图像。(D) 在最大压力下间歇抽吸下第 4 组测试样品 72 小时后液体收集的代表性图像。 请单击此处查看此图的较大版本。

图 7:第 5 组至第 8 组最终液体收集的代表性图像。 (A) 第 5 组对照样品在最小压力下连续抽吸 72 小时后液体收集的代表性图像。(B) 第 6 组对照样品在最小压力下间歇抽吸 72 小时后液体收集的代表性图像。(C) 第 7 组测试样品在最小压力下连续抽吸 72 小时后液体收集的代表性图像。(D) 在最小压力下间歇抽吸下第 8 组测试样品 72 小时后液体收集的代表性图像。 请单击此处查看此图的较大版本。
| 试剂 | 量 |
| 氯化钠 | 8.035 克 |
| 碳酸氢钠 | 0.355 克 |
| 氯化钾 | 0.225 克 |
| 磷酸氢二钾三水合物 | 0.231 克 |
| 氯化镁六水合物 | 0.311 克 |
| 1 M 盐酸 | 39 毫升 |
| 氯化钙 | 0.292 克 |
| 硫酸钠 | 0.072 克 |
| 三(羟甲基)氨基甲烷 | 6.118 克 |
表 1:在 1 L 去离子水中制备模拟体液所需的试剂。
讨论
NPWT 有一些台式模型,但它们有很大的局限性。Loveluck 等人开发了一个 FEA 计算机模型来确定 NPWT 如何影响缝合切口部位,但没有考虑额外的伤口敷料材料6。Rycerz 等人开发了基于琼脂的模型来评估 NPWT7 期间滴注溶液对伤口的分布。虽然琼脂为评估水溶性材料/染料在不同模型中的分布提供了一种媒介,但它是一种简单的均质材料,不会复制涉及受 NPWT 的肌肉和脂肪组织的伤口的复杂异质结构。此外,这些测试进行了相对较短的时间,长达 3.5 小时,而在临床条件下,在更换伤口敷料之前,通常会先进行真空 48-72 小时3。或者,在 体内,可以使用猪模型,但价格昂贵,并且在使用前需要特殊的监督和批准程序7.目前尚无台式模型使用真实的组织成分和结构来评估在不同实验条件下相对于真空泵的伤口床内的液体收集和压力。
为了解决这一限制,设计并构建了一个台式模型,该模型能够在 72 小时内从伤口缺损内部读取压力,以查看相对于真空泵读数施加到伤口上的压力。这是通过使用连接到穿过泡沫中间的压力管的压力表来实现的。为了在测试期间补充容器中的液体而不影响真空,我们添加了第二个压力表,可以将其取下以移液额外的液体。第二个压力表也起到了故障保险的作用,因为它的读数应该为零,如果没有,则测试室而不是组织样本被加压,这将使测试无效。该系统解决的另一个问题是确保样品上有足够的密封;这是通过在样品下方放置一块泡沫将其抬高来实现的,当测试室的盖子关闭时,组织被向下推到足以关闭腔室而不会有额外的空间。
五花肉用于满足对伤口组织类似物的需求。使用来自猪胃底部的五花肉,因为它有多层脂肪和肌肉,可以模拟复杂的人体肌肉和脂肪组织,更好地模拟伤口组织的特征。此外,五花肉很容易获得,而且在使用前只需进行最少的作即可去除腌制盐。所用组织样本的不同成分可能导致各组之间的一些压力差异。不同的脂肪和组织成分,或者泡沫在组织中的放置方式,都可能影响了机器能够拉动的压力。在临床上,患者还会表现出肌肉、脂肪和组织的变化,因此由于五花肉成分而看到的差异可能代表了该装置在患者中工作方式的变化。
这种台式模型设计还允许在 体外测试 NPWT 的新应用,从不同的压力到不同的伤口敷料材料。它还允许从泡沫所在的伤口床内部记录压力,而不是仅观察真空泵的压力读数。这显示从泵施加的压力是否施加在伤口内部。本研究中创建的模型很有帮助,因为它允许在不使用计算机模拟或 体内 测试的情况下记录液体收集和压力。同样,这种台式模型是有利的,因为它可以了解 NPWT 机器如何在更接近临床状况的肌肉和脂肪组织上工作,而不是基于琼脂的材料。这种模型比 体内 测试更实惠,因为它不需要使用活体动物,并且它是由低成本物品制成的。
该模型用于比较有和没有商用壳聚糖伤口护理装置的 NPWT 机器产生的压力和收集的液体。NPWT 机器能够在存在或不存在壳聚糖高级伤口护理装置的情况下保持 72 小时的压力。当 NPWT 机器与或没有伤口护理装置一起使用时,在最大和最小压力测试条件下,对照组(无伤口护理装置)和测试组(有伤口护理装置)在 72 小时内的压力读数没有或只有很小的差异。然而,不同治疗组的对照膜和测试膜之间的液体收集没有差异。
方案中的某些步骤对于确保每个样品的压力和液体采集读数准确至关重要。测试过程中最重要的步骤在第 1 步中找到。为了确保记录精确的压力读数,创建的测试盒必须显示无泄漏;否则,压力表将无法正常工作。此过程中的其他关键步骤包括步骤 2.2 和 3.1。步骤 2.2 至关重要,因为伤口缺损必须足够深才能穿透样品中的最后一层脂肪,并且需要对组织进行开孔以收集液体。步骤 3.1 很关键,因为缺陷需要用开孔泡沫填充。泡沫必须填充整个伤口缺损并紧密贴合;否则,它不会与真空产生适当的密封,从而导致压力读数问题。步骤 3.4 很关键,因为粘性伤口敷料需要覆盖整个样品。如果粘性伤口敷料没有覆盖整个样品,则测试室内可能存在压力泄漏。
这项工作的一个局限性是没有可比较的模型。其他人复制和使用模型将有助于确认模型的效用。该型号的另一个限制是将压力管连接到压力表时可能会发生漏气。通过使用不同的连接方法将漏气风险降至最低的更好方法可能有助于未来的研究。
NPWT 需要这种台式模型,以便通过检查液体收集和压力产生来测试新材料的兼容性,以确保额外的伤口敷料不会改变 NPWT 系统的性能。创建的模型在 NPWT 中具有许多潜在的应用。它可用于测试不同的伤口敷料材料和伤口敷料中的局部药物输送选项。使用此模型可以创建和测试多种类型的伤口,例如切口、隧道或烧伤伤口。对于不同的伤口类型,可以检查压力和液体收集以确定最佳 NPWT 设置。该模型还为决定如何在皮肤样本中测试 NPWT 开辟了其他途径,而以前,模型大多局限于其他材料或模拟测试。总之,设计的台式模型能够成功评估伤口敷料的伤口床内部的压力,以确定它们是否与 NPWT 系统兼容。
总体而言,在测试条件下,测试的壳聚糖伤口护理装置似乎不会抑制 NPWT 系统中的压力或液体收集。在这项工作中,开发了一种台式模型,通过允许长时间测试、使用组织类似物以及适应伤口敷料材料的能力来克服当前台式模型的局限性。
披露声明
这项工作得到了 Bionova Medical, Inc.(田纳西州日耳曼敦)的资助。
致谢
这项研究是在孟菲斯大学生物医学工程系和 Bionova Medical 的帮助下实现的。
材料
| Name | Company | Catalog Number | Comments |
| 100x antibiotics/mycotics | Gibco | 15240062 | This is the 100X antibiotics/antimycotics used in the simulated body fluid |
| 3 M KCI ACTIV.A.C Therapy System | KCI Mdical Products | VFTR006619 | This is the vacuum pump used in the study. |
| 3 M KCI InfoV.A.C Canister w/Gel 500 mL | eSutures.com | M8275063 | These are the fluid collection canisters used in the study |
| 3 M KCI V.A.C GranuFoam Medium Dressing Kit, SensaT.R.A.C | eSutures.com | M8275052 | These are the wound dressing packs with the vacuum nozzle including the open cell foam. |
| Bovine Serum | Gibco | 16170086 | This was used to mix with the simulated body fluid and the antibiotics/antimycotics |
| Calcium Chloride | Fisher Scientific | C614-500 | This was used to create the simulated body fluid |
| Excel/Powerpoint | Microsoft Office | N/A | This was used to run the statistics and create the schematic for Figure 1 |
| Foundation DRS Solo | BioNova Medical | N/A | This is the advanced chitosan wound care device used in the study. |
| Hydrochloric Acid | Fisher Scientific | SA54-1 | This was used to create the simulated body fluid |
| Magensium Chloride | Fisher Scientific | M33-500 | This was used to create the simulated body fluid |
| Phosphate buffered saline | Thermo Scientific | J62036.K3 | This was used to dilute the 100x antibiotic/antimycotic to 10x |
| Potassium Chloride | SIGMA | P-3911 | This was used to create the simulated body fluid |
| Potassium Phosphate Dibasic | Fisher BioReagents | BP363-500 | This was used to create the simulated body fluid |
| PRM Vacuum Gauge 0 to -10 in Hg | PRM Filtration | PGCNBTY630652J10HG | Two pressure gauges are needed for the testing chamber. |
| Salted Pork Belly | Hormel Food Corporations | UPC: 0003760037988 | Salted pork belly can be bought from Kroger. It cannot be sliced. It is best to pick samples that have less fat, and more muscle. |
| Sodium Bicarbonate | SIGMA | S5761-500G | This was used to create the simulated body fluid |
| Sodium Chloride | Fisher Scientific | S640-500 | This was used to create the simulated body fluid |
| Sodium Sulfate | Fisher Scientific | BP166-100 | This was used to create the simulated body fluid |
| Tris(hydroxymethyl) aminomethane | Fisher Scientific | BP152-500 | This was used to create the simulated body fluid |
| Tupperware Brands Corp, Kissimmee , FL | Tupperware | N/A | This is the box used as the testing chamber. |
参考文献
- Liu, S., et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: Systematic review and meta-analysis. Ther Clin Risk Manag. 13, 133-142 (2017).
- Capobianco, C. M., Zgonis, T. An overview of negative pressure wound therapy for the lower extremity. Clin Podiatr Med Surg. 26 (4), 619-629 (2009).
- Venturi, M. L., Attinger, C. E., Mesbahi, A. N., Hess, C. L., Graw, K. S. Mechanisms and clinical applications of the vacuum-assisted closure (VAC) device: A review. Am J Clin Dermatol. 6 (3), 185-194 (2005).
- Ren, Y., Chang, P., Sheridan, R. L. Negative wound pressure therapy is safe and useful in pediatric burn patients. Int J Burns Trauma. 7 (2), 15-23 (2017).
- Argenta, L. C., Morykwas, M. J. Vacuum-assisted closure: A new method for wound control and treatment: Clinical experience. Ann Plast Surg. 38 (6), 563-576 (1997).
- Loveluck, J., Copeland, T., Hill, J., Hunt, A., Martin, R. Biomechanical modeling of the forces applied to closed incisions during single-use negative pressure wound therapy. Eplasty. 16, e20 (2016).
- Rycerz, A. M., Allen, D., Lessing, C. M. Science supporting negative pressure wound therapy with instillation. Int Wound J. 10 (S1), 25-31 (2013).
- Hodge, J. G., et al. Novel insights into negative pressure wound healing from an in situ porcine perspective. Wound Repair Regen. 30 (1), 64-81 (2022).
- Birke-Sorensen, H., et al. Evidence-based recommendations for negative pressure wound therapy: Treatment variables (pressure levels, wound filler and contact layer) - Steps towards an international consensus. J Plast Reconstr Aesthet Surg. 64 (Suppl. 1), S1-S16 (2011).
- Burkatovskaya, M., et al. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials. 27 (22), 4157-4164 (2006).
- Noel, S. P., Courtney, H., Bumgardner, J. D., Haggard, W. O. Chitosan films: A potential local drug delivery system for antibiotics. Clin Orthop Relat Res. 466 (6), 1377-1382 (2008).
- Chen, S., Hao, Y., Cui, W., Chang, J., Zhou, Y. Biodegradable electrospun PLLA/chitosan membrane as guided tissue regeneration membrane for treating periodontitis. J Mater Sci. 48 (19), 6560-6568 (2013).
- Guo, S., et al. Enhanced effects of electrospun collagen-chitosan nanofiber membranes on guided bone regeneration. J Biomater Sci Polym Ed. 31 (2), 106-118 (2020).
- Qasim, S. B., Najeeb, S., Delaine-Smith, R. M., Rawlinson, A., Rehman, I. U. Potential of electrospun chitosan fibers as a surface layer in functionally graded GTR membrane for periodontal regeneration. Dent Mater. 33 (1), 71-83 (2017).
- Marques, M. R. C., Loebenberg, R., Almukainzi, M. Simulated biological fluids with possible application in dissolution testing. Dissolut Technol. 18 (3), 15-28 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。