Method Article
실험적 급성 발작을 위한 동물 모델로서의 플라나리아
요약
발작은 다양한 기능과 삶의 질에 부정적인 영향을 미칩니다. 플라나리아 벌레는 발작 표현형과 파괴적인 운동성을 평가하기 위해 다양한 농도의 화학경련제에 노출되었습니다. 본 연구는 플라나리아 기생충을 인간의 급성 발작 모델로 사용할 것을 제안하며, 뇌전증 치료제 개발에 의의를 갖는다.
초록
간질은 반복되는 자연 발작을 특징으로 하는 가장 흔한 신경 질환 중 하나입니다. 발작은 통제되지 않고 과도하게 동기화된 신경 세포 활동의 임상적 징후를 나타냅니다. 발작으로 인한 뇌 손상의 정도는 발작의 지속 기간과 강도에 따라 다릅니다. 유감스럽게도, 간질에 대한 효과적인 치료법은 없습니다. 이 연구의 목적은 플라나리아 기생충 Dugesia dorotocephala 가 급성 발작을 표적으로 할 수 있는 간질 치료법을 식별하고 개발하는 데 도움이 되는 모델 역할을 할 수 있는지 여부를 평가하는 것입니다. 현재 항경련제(ASM)를 평가하기 위해 해양 모델과 같은 다양한 모델이 사용되고 있습니다. 그러나 비용이 많이 들고 윤리적 문제가 있습니다. 또는 무척추동물 모델은 ASM의 약물 발견 과정에서 비용 효율적인 연구 기회를 제공합니다. 플라나리아는 편형동물과에 속하며 해양 담수 및 육상 환경에 서식합니다. Dugesia dorotocephala 북미 전역의 수생 플라나리아의 지배적인 종입니다. D. dorotocephala 는 다른 무척추동물이나 더 큰 동물과 달리 비용 효율성, 척추동물과 유사한 뉴런 및 정량화 가능한 행동으로 인해 간질 연구를 위한 실행 가능한 무척추동물 모델로 제시됩니다. 그들은 나이, 기억 및 재생과 관련된 다양한 약리학 및 환경 독성학 연구에 사용되었습니다. 이 연구에서 플라나리아는 노출 시 행동을 연구하기 위해 일반적인 화학경련제인 필로카르핀의 다양한 농도에 노출되었습니다. 관찰 후, 플라나리아는 안락사되어 신경 조직학적 평가를 위해 포름알데히드 또는 골지체에 보존되었습니다. 플라나리아에서는 6가지 뚜렷한 행동 표현형이 관찰되었습니다: 등쪽 진동, 머리 진동, 꼬리 등쪽 확장, C자형, 머리 튕기기, 꼬리 튕기기. 등쪽 진동 주파수는 대조군에 비해 실험군에서 유의하게 증가했으며 선량 의존성을 나타냈습니다. 또한 필로카르핀은 플라나리아의 운동성을 방해했습니다. 플라나리아에서 필로카르핀에 의한 발작은 급성 발작과 항경련제를 평가하는 모델이 될 수 있으며, 이는 간질을 앓고 있는 인간 환자를 위한 치료 개입을 개발하는 데 필수적입니다.
서문
뚜렷한 원인 없이 24시간 이내에 두 번 이상의 발작을 특징으로 하는 간질은 전 세계적으로 ~5천만 명에게 영향을 미칩니다1. 그 중 1,000만-1,500만 명이 약물 내성 간질을 앓고 있는 것으로 보고되고 있다2. 따라서 간질 약물 조사가 중요합니다. 이 질환은 멍한 응시에서부터 몸이 뻣뻣해지고 떨리는 것에 이르기까지 부분적 또는 일반화된 비자발적 움직임의 짧은 에피소드를 수반하며, 뇌의 전기 활동의 급증과 관련이 있습니다3.
역사적으로 간질 연구는 인간과의 진화적 유사성 때문에 설치류 및 기타 포유류에 의존해 왔습니다. 그러나 이러한 방법은 시간과 비용이 많이 소요될 수 있으므로 다른 접근 방식이 필요합니다 4,5. 초파리, 거머리, 올챙이, 제브라피시, 회충과 같은 비포유류 생물이 연구에 활용되었으며 유망한 결과를 보여주었습니다6. 또한, 플라나리아는 무척추동물과 인간 게놈 간의 비교 유전체 연구 모델을 제공할 수 있으며, 경련제, 항발작 약물(ASM) 및 행동 패턴을 테스트할 수 있는 능력을 제공할 수 있는 것으로 나타났습니다6. 편형동물과 Turbellaria 부류의 구성원으로 알려진 플라나리아(Phylum Platyhelminthes)는 주로 재생 능력으로 유명합니다. 그러나 이 조사는 발작 유발 물질에 대한 반응에 집중합니다.
플라나리아는 세로토닌과 도파민에 대한 반응과 같은 기본적인 신경학적 메커니즘을 인간과 공유하며, 포유류 뇌의 신경계 관련 유전자와 95% 유사성을 보이며 알아볼 수 있는 뇌 구조를 가지고 있습니다7. 또한 실험실 조건에서 관찰 가능한 움직임을 보이며 설치류나 다른 포유류에 비해 비용 효율적이고 시간 효율적이며 윤리적입니다. 나사 모양, C 모양 및 호두 모양의 움직임과 같은 이러한 관찰 가능한 행동은 수십 년 동안 광범위하게 문서화되어 왔으며 코카인, 니코틴, 도파민 및 필로카르핀과 같은 물질과 관련이 있습니다 7,8,9,10,11,12,13,14. 따라서 플라나리아는 인간을 대상으로 한 간질 약물 연구를 위한 실행 가능한 모델로 부상하고 있습니다.
이 방법은 골지체(Golgi) 염색을 사용하여 필로카핀(pilocarpine)에 노출된 플라나리아의 뉴런을 특성화하는 것을 목표로 합니다. 골지체 염색은 광학 현미경으로 뉴런을 시각화하는 데 사용되며 형태의 변화가 발작 15,16,17과 관련이 있는지 조사하는 데 사용되었습니다. 현재의 문헌에는 플라나리아의 뇌에서 골지체 염색이 수행되었다는 증거가 없다. 이전 연구에서는 행동 표현형을 관찰하여 약리학적 효과를 문서화했지만, 이 원고는 골지 염색11,18을 사용하여 필로카르핀에 노출된 플라나리아의 뉴런을 특성화한 최초의 원고입니다. 이 기술은 발작과 관련된 형태학적 변화를 시각화하고 이해하는 데 유용한 것으로 입증되었습니다. 이 연구는 필로카르핀의 농도가 증가함에 따라 플라나리아 벌레에서 진동하는 등쪽 진동 행동의 빈도가 크게 증가했다는 점에 주목했습니다.
프로토콜
참고: 전체 실험 설계는 그림 1에 설명되어 있습니다.
1. 행동 표현형 분석
- 샘물에 용해된 1 mM 및 2 mM 필로카르핀의 농도를 준비하고 샘물로만 대조합니다.
- 각 용액 3mL를 4 x 3 웰 플레이트에 피펫팅하며, 각 행은 서로 다른 필로카르핀 농도를 나타냅니다.
- 팁이 잘린 상태에서 이송 피펫을 사용하여 12개의 웰 각각에 약 2주 된 실험실에서 기른 Dugesia dorotocephala 하나를 놓습니다.
참고: 끝을 잘라 끝이 플라나리아를 손상시키지 않고 들어갈 수 있을 만큼 충분히 커지도록 합니다. - 정상적인 실내 조명 조건에서 4 x 3 웰 플레이트 위에 위치하여 인간의 눈으로 관찰할 수 있는 동작을 잘 기록하고 사람의 눈으로 관찰할 수 있는 카메라를 사용하여 1시간 동안 플라나리아의 동작을 기록합니다.
- 샘물에 3mM, 4mM 및 6mM 필로카르핀 농도로 1.1-1.4단계를 반복합니다.
2. 운동성 분석
참고: 플라나리아 행동은 직경 2.5cm의 우물에서 기록되었습니다. 1시간 길이의 비디오 녹화는 30분 분량으로 분할되고 상용 소프트웨어를 사용하여 플라나리아를 개별적으로 분석하기 위해 잘렸습니다.
- 자동화된 행동 분석 소프트웨어를 사용하여 새로운 실험을 시작합니다. 향상된 자동 행동 추적 시스템을 엽니다. 새 실험에서 새로 만들기를 클릭합니다. 실험의 이름을 지정합니다.
- 아래 설명된 대로 실험 설정을 지정합니다.
- 메뉴 프롬프트에서 Experiment Settings 를 클릭합니다. 설정이 기본값으로 설정되어 있는지 확인합니다: 비디오 소스(비디오 파일에서), 아레나 수(1), 추적된 기능(중심점 감지), 바디 포인트 감지 기술(윤곽 기반), 분석 옵션(없음), 단위(cm, s, deg).
- 아래 설명된 대로 경기장 설정을 지정합니다.
- 왼쪽 상단의 설정 패널에 있는 아레나 설정 탭에서 아레나 설정을 클릭합니다. 비디오를 업로드하라는 메시지가 표시되면 저장된 파일 위치에서 플라나리아의 녹화된 영상을 선택합니다. 동영상이 선택되면 캡처를 클릭합니다.
- 화면의 오른쪽 상단 패널에 있는 지시를 따릅니다. 1을 클릭합니다 . 눈금을 그려 보정합니다. 우물의 비디오 이미지에서 표본 우물의 가장자리에서 가장자리로 축척 선을 드래그합니다. 우물의 실제 거리(2.5cm)를 입력합니다.
- 2를 클릭합니다 . 모양을 선택하고 아레나를 그립니다. 오른쪽 패널에서 Arena 1이 선택되어 있는지 확인합니다. 마우스 커서를 화면 상단 중앙으로 이동하고 서클 아이콘을 클릭합니다.
- 업로드된 비디오 이미지에 경기장의 한 주변에서 다른 주변으로 드래그하여 원을 만듭니다. 경기장이 주황색 영역에 있는지 확인하십시오. 경기장에 맞게 모양을 조정합니다. Arena 1 레이블이 경기장 경계 내에 있는지 확인합니다.
- 오른쪽 패널 하단에서 모양, 크기 및 위치(너비:2.75, 높이:2.75, X:0, Y:0)를 원하는 측정값으로 변경합니다.
- 3을 클릭합니다. Shape 및 Draw 영역(선택 사항)을 선택합니다. 이제 오른쪽 패널 내의 영역 그룹 1이 선택됩니다. 마우스 커서를 화면 상단 중앙으로 이동하고 서클 아이콘을 선택합니다. 경기장 이미지 내에서 드래그하여 더 작은 원을 만듭니다.
- 오른쪽 하단 패널에서 모양, 크기 및 위치를 원하는 측정값(너비:1.75, 높이:1.75, X:0, Y:0)으로 변경합니다.
- 원과 같은 메뉴 표시줄에 있는 Add Zone Label(영역 레이블 추가 ) 버튼을 클릭합니다. 작은 원의 중심 안을 클릭합니다. 오른쪽 패널에서 Zone 1 태그를 마우스 오른쪽 버튼으로 클릭하여 Zone Center의 이름을 바꿉니다.
- Add Zone Label(영역 레이블 추가) 버튼을 다시 클릭합니다. 중앙 구역 바깥쪽에 있는 아레나 주변을 클릭합니다. 오른쪽 패널에서 Zone 2를 마우스 오른쪽 버튼으로 클릭하여 영역 Perimeter의 이름을 바꿉니다.
- 4를 클릭합니다. 유효한 아레나 설정을 확인하기 위해 설정을 확인합니다.
- 아래 설명된 대로 평가판 제어 설정을 지정합니다.
- 왼쪽 상단 설정 패널의 Trial Control Settings 탭에서 Trial Control Settings 를 클릭합니다. 6개의 구성 요소 상자가 나타납니다. 시간(1) 및 무한 시간(조건이 충족되지 않음)을 포함하는 조건이라고 표시된 네 번째 상자 내에서 설정을 클릭합니다.
- After 옆에 있는 거품을 클릭한 다음 오른쪽 텍스트 상자에 기간(30분)을 입력합니다. 또한 시간 텍스트 상자 오른쪽에 h, min 및 s 중에서 선택할 수 있는 드롭다운 메뉴가 있습니다.
참고: 녹화된 foo에 대한 감지 설정은 foo에 따라 다릅니다.tage 품질. 다음 방법을 조작하여 개별 푸티지에 특정한 최상의 결과를 관찰할 수 있습니다.
- 아래 설명된 대로 감지 설정을 지정합니다.
- 왼쪽 상단의 설정 패널에 있는 감지 설정 탭에서 감지 설정을 클릭합니다. 오른쪽 상단 패널에 있는 비디오 선택 버튼을 클릭합니다. 원하는 비디오를 기본 감지 설정에 업로드합니다.
- 같은 오른쪽 패널에서 고급 탭을 클릭합니다. 이제 Method 탭에서 Gray Scaling으로 설정되어 있는지 확인합니다. 범위(0 - 100)를 변경합니다.
- 오른쪽 패널의 Smoothing(매끄럽게 하기) 탭에서 Video pixel smoothing(비디오 픽셀 다듬기)이 None(없음), Dropped frames correction(드롭된 프레임 보정)이 Off(끄기), Track noise reduction(트랙 노이즈 감소)이 Off(끄기)인지 확인합니다.
- 오른쪽 패널의 Subject Contour 탭에서 시퀀스 설정을 조정하고 Erosion, Dilation 및 Erosion을 각각 1, 1, 0으로 변경합니다.
- 제목 크기 탭에서 최소(0) 및 최대(125000)를 변경합니다. 오른쪽 하단에서 저장을 클릭합니다.
- 아래 설명된 대로 관찰을 위한 비디오 시도 순서를 설정합니다.
- 왼쪽 상단의 설정 패널에서 체험판 목록을 클릭합니다. System Video file 열 아래의 줄임표를 클릭하여 원하는 순서로 표본의 비디오 영상을 업로드합니다. 체험판을 더 추가하려면 체험판 목록 패널의 왼쪽 상단에 있는 체험판 추가를 클릭합니다.
- 획득 설정을 지정합니다.
- 왼쪽 상단의 Acquisition 탭에서 Acquisition 을 클릭합니다. 오른쪽 패널의 획득 설정에서 계획된 모든 평가판 추적을 클릭합니다.
- 획득을 시작하려면 Ready for Start 옆에 있는 화면 하단 중앙에 있는 빨간색 버튼을 클릭합니다. 이제 비디오 획득이 시작되며 업로드된 비디오 평가판의 양과 길이에 따라 일정 시간이 걸립니다.
- 아래 설명된 대로 해석 설정을 지정합니다.
- 왼쪽 패널 Analysis(분석) 탭에서 Analysis Profile(분석 프로필 )을 클릭합니다. 기본적으로 선택된 종속 변수인 Velocity 및 Distance Moved를 클릭하고 삭제합니다.
- 종속 변수(dependent variables) 패널의 위치(Location) 탭에서 영역(In)을 클릭합니다. Center 및 Perimeter Zone 상자를 클릭하여 확인 표시를 합니다.
- In Zone 상자 내에서 Trial Statistics 탭을 클릭합니다. Latency to First(첫 번째 대기 시간)를 클릭하여 선택을 취소합니다. 추가를 클릭합니다.
- Body(바디) 탭에서 Rotation( 회전) 버튼을 클릭합니다. 시계 방향을 클릭하고 임계값(50.00도)과 최소 이동 거리(2.00cm)를 기본값으로 둡니다. 추가를 클릭합니다.
- 회전 버튼을 다시 클릭하고 시계 반대 방향을 클릭합니다. 추가를 클릭합니다.
- 아래 설명된 대로 트랙을 분석합니다.
- Results 탭에서 Track Visualization을 클릭합니다. 오른쪽 패널의 Filter(필터)에서 Last(마지막)를 선택 취소합니다. 화면의 하단 중간 패널에 있는 재생 제어 표시줄은 특정 관찰 시간 동안 표본의 추적 시각화를 나타냅니다.
- 결과를 분석하고 내보냅니다. 결과는 왼쪽 하단 패널 탭의 나머지 부분에서 찾을 수 있습니다. 데이터를 내보내려면 왼쪽 패널의 Export(내보내기)에서 Raw Data(원시 데이터 ) 또는 Statistics(통계 )를 클릭합니다.
3. 안락사
- 샘물에 22mM 용량의 유제놀 용액을 준비합니다. cut transfer 피펫을 사용하여 9mL의 22mM eugenol 용액과 함께 플라나리아를 페트리 접시에 넣고 각 농도를 별도로 유지합니다. 3분 동안 또는 모든 움직임이 멈출 때까지 안락사시킵니다.
- 플라나리아를 9mL의 샘물을 채운 신선한 페트리 접시에 넣고 1x-2x를 헹구고 아래에 설명된 골지 용액(골지 염색) 또는 4% 파라포름알데히드(면역형광 염색)에 넣습니다.
4. 조직학적 분석
- 골지 염색
- 플라나리아를 안락사시킨 후, Golgi Stain Kit의 용액 A와 B를 1:1로 혼합하여 채워진 비커나 페트리 접시에 넣습니다. 다음 날 용액 A와 B를 용액 A와 B의 혼합물로 채워진 새 비커에 플라나리아를 넣어 용액 A와 B를 교체하십시오.
- 플라나리아를 용액 A와 B에서 1주일 동안 그대로 둡니다.
- 용액 A와 B에서 플라나리아를 제거하고 다른 비커의 용액 C에 놓습니다. 다음 날 용액 C를 교체하십시오. 플라나리아를 용액 C에서 최소 72시간, 최대 1주일 동안 방치합니다.
- 전사 피펫으로 용액 C에서 플라나리아를 제거하고 척에 소량의 OCT 화합물을 놓고 플라나리아를 첨가한 다음 OCT 화합물로 플라나리아를 둘러싸서 포함합니다. -24°C에서 저온 유지 장치 기계로 플라나리아를 5μM 절편으로 가로로 절단합니다.
- 전사 피펫과 용액 C를 사용하여 젤라틴으로 코팅된 슬라이드에 플라나리아를 장착하고 최대 3일 동안 RT에서 암흑 속에서 건조시킵니다.
- 염색 용액(1부 용액 D, 1부 용액 E, 2부 샘물)을 사용하여 슬라이드를 비커에 다음과 같은 용액으로 담그십시오. 염색 용액을 10분 동안 사용한 다음 샘물에 2배 각각 4분, 50% 에탄올에 4분 동안 투여한 다음 75% 에탄올에 4분 동안 투여한 다음 95% 에탄올을 4분 동안 투여한 다음 95% 에탄올을 4분 동안 투여하고, 그런 다음 100% 에탄올 4배에서 4분 동안, 마지막으로 자일렌 3배에서 4분 동안 넣습니다.
- 커버슬립은 조직학적 장착 매체로 슬라이드하고 명시야 현미경 검사에서 조직을 관찰합니다.
- 면역형광 염색
- 플라나리아를 안락사시킨 후 최소 24시간 동안 4% 파라포름알데히드에 넣습니다. 이 단계가 끝나면 냉장고에 보관할 수도 있습니다.
- 플라나리아를 4% PFA에서 20% 슈크로오스로 옮기고 1일 동안 그대로 둡니다. 자당에서 플라나리아를 제거하고 PBS 버퍼에 5분 동안 넣습니다.
- PBS 완충액으로 3-4회 세척하여 헹구고 염색할 준비가 될 때까지 보관하기 위해 20% 자당으로 옮깁니다.
- 70%, 95%, 100% 알코올 용액에 각각 1분씩 넣습니다. 자일렌에 1분 동안 넣습니다.
- 95%와 70% 알코올을 각각 1분씩 넣습니다. PBS 버퍼에 각각 3분씩 5회 넣습니다. 60:40 메탄올과 과산화수소 용액에 10-15분 동안 넣습니다.
- PBS에서 각각 5분씩 3회 헹굽니다. 이전에 4.2.1에서 사용된 4% 파라포름알데히드 부피를 이 PBS 완충액에 추가합니다.
- PBS에서 각각 5분씩 3회 헹굽니다. 분유로 1시간 동안 플라나리아를 덮어 차단합니다.
- PBS로 1차 항체(1H6)를 5μg/mL로 희석하고 항체 용액에서 4°C에서 밤새 슬라이드를 배양합니다. 다음 날, PBS에서 플라나리아를 10분 동안 헹굽니다.
- PBS에서 2차 항체(염소 항-마우스 IgG)를 1μg/mL로 희석하고 항체 용액에서 RT로 밤새 슬라이드를 배양합니다. 다음 날, PBS에서 15분 동안 플라나리아를 헹굽니다.
참고: 항체마다 최적 농도가 다릅니다. 실험을 시작하기 전에 이를 확인하십시오. - 슬라이드에 전체 플라나리아를 장착하고, 커버 슬립으로 덮고, 수성 장착 매체로 밀봉하고, 형광 현미경으로 조직을 관찰합니다.
5. 이미지 분석
- 오픈 소스 이미지 분석 소프트웨어 응용 프로그램을 엽니다. colour_deconvolution2.jar 플러그인을 애플리케이션으로 드래그하여 오픈 소스 이미지 분석 소프트웨어 애플리케이션에 설치합니다.
- 분석할 이미지를 선택하고 오픈 소스 이미지 분석 소프트웨어 애플리케이션으로 드래그합니다. 이미지 탭으로 이동합니다. 색상을 클릭합니다. 색상 디콘볼루션2 v2.1을 클릭합니다.
- 벡터 옵션에서 H DAB를 클릭합니다. 출력 옵션에서 8bit_Transmittance 클릭합니다. Simulated LUTs, Cross product for Colour 3, Show matrices, Hide legend가 모두 선택되어 있는지 확인합니다. 확인을 클릭합니다.
- 오픈 소스 이미지 분석 소프트웨어 응용 프로그램이 이미지를 효과적으로 분석할 수 있도록 흑백으로 이미지를 선택합니다.
- 이미지 탭으로 이동합니다. 조정을 클릭합니다. 임계값을 클릭합니다. DAB 염색 또는 전경이 흰색 배경에 빨간색이 되도록 임계값을 조정합니다. 여러 이미지를 정량화하는 경우 각 이미지에 대해 임계값이 동일한지 확인합니다.
- 분석을 클릭합니다. 측정 설정을 클릭합니다. Area(영역), Min & max gray value(최소 및 최대 회색 값), Limit to threshold(임계값 제한), Display label(디스플레이 레이블), Median(중앙값) 및 Mean gray value(평균 회색 값)를 선택합니다. 확인을 클릭합니다. 분석을 클릭합니다. 측정을 클릭합니다. 결과를 얻습니다.
- 1.2-1단계를 반복합니다. U6ntil 모든 이미지가 정량화됩니다. 결과 이미지를 클릭합니다. 파일을 클릭합니다. Save As(다른 이름으로 저장)를 클릭합니다. 파일을 스프레드시트로 저장하고 스프레드시트 소프트웨어에서 데이터를 봅니다.
6. 통계 분석
- 분산 분석(Analysis of Variance, ANOVA)과 통계적 유의성에 대한 스튜던트 t-검정(p < 0.05)을 사용하여 플라나리아의 동작에 대한 평균의 평균과 표준 오차(SEM)를 계산합니다.
결과
다음과 같은 행동은 다양한 농도의 필로카르핀에 노출된 플라나리아에 의해 관찰되었습니다.
등쪽 진동(Dorsal oscillations): 플라나리아 몸의 두개골 끝에서 꼬리 끝까지 이동하는 거품 같은 형성물.
머리 진동(Head oscillations): 올챙이와 같은 모습을 형성하는 플라나리아의 머리에 의한 거품 같은 형성.
C-Shape: 머리는 시계 방향으로 움직이고 꼬리는 시계 반대 방향으로 움직여 C를 형성합니다.
머리 튕기기: 플라나리아의 머리가 갑자기 왼쪽이나 오른쪽으로 휙휙 움직입니다.
꼬리 등쪽 진동(Tail dorsal oscillation): 올챙이와 같은 모습을 형성하는 플라나리아의 꼬리에 의한 거품 같은 형성.
꼬리 튕기기: 플라나리아의 꼬리가 갑자기 왼쪽이나 오른쪽으로 휙 움직입니다.
우리는 필로카르핀 농도가 증가함에 따라 행동의 빈도가 증가하는 것을 관찰했습니다. 결과는 전체 기록에서 발견된 특정 동작의 수입니다. 6mM 필로카르핀(평균 = 16 ± 4.10, p < 0.0001) 및 4mM(평균 = 11.25 ± 2.17, p < 0.0001)에서 등쪽 진동은 대조군(평균 = 0; 그림 2A). 이 움직임은 용량 의존적 행동을 보였다(R2 = 0.87; 그림 2G). 또한, 플라나리아가 다른 농도에 비해 6mM의 필로카르핀에 노출되었을 때 이러한 행동을 보이는 데 시간이 덜 걸렸습니다.
두부 진동의 경우, 6mM와 대조군(평균=10.25 ± 3.57, p=0.0070), 3mM과 대조군(평균=1.50 ± 0.96, p=0.0187), 1mM과 대조군(평균=2.75 ± 1.80, p=0.0405) 간에 유의한 차이가 관찰되었다. 4mM 필로카르핀에서는 통계적 차이가 관찰되지 않았습니다(평균 = 6.75 ± 3.4004; 그림 2B).
대조군과 6mM(평균=8.50 ± 2.47, p=0.0034), 1mM(평균=5.75± 0.48, p=0.0368), 6mM과 2mM(평균=3.75 ± 1.28, p=0.0454) 사이에서 C-형상 표현형의 유의한 차이가 관찰되었다. 3mM 필로카르핀(평균 = 3.50 ± 1.8484)과 4mM 필로카르핀(평균 = 5.00 ± 2.6771; 그림 2D).
6mM과 대조군(평균 = 6.50 ± 1.19, p = 0.0072) 및 6mM과 4mM(평균 = 1.75 ± 0.85, p = 0.0416) 사이에서 헤드 플릭 표현형의 유의한 차이가 관찰되었습니다. 1mM 필로카르핀(평균=4.250 ± 1.2500), 2mM 필로카르핀(평균=3.8750 ± 1.6630), 3mM 필로카르핀(평균=2.75000 ± 1.0308; 그림 2E).
꼬리 등쪽 진동 표현형에서 4mM과 대조군(평균=5.50 ± 2.63, p=0.0087), 2mM(평균=0.50 ± 0.19, p=0.0063), 6mM과 대조군(평균=5.00 ± 2.45, p=0.0157), 2mM(평균=0.50 ± 0.19, p=0.0125) 및 1mM(평균=0.75 ± 0.48, p=0.0366) 사이에서 유의한 차이가 관찰되었다. 3mM 필로카르핀에서는 통계적 차이가 없었다(평균 = 1.7500 ± 0.250; 그림 2C).
꼬리 플릭 표현형의 경우, 6mM과 대조군(평균 = 15.25 ± 7.20, p = 0.0037), 4mM(평균 = 2.50 ± 0.87, p = 0.0125), 1mM(평균 = 4.50 ± 1.55, p = 0.0318) 및 2mM 필로카르핀(평균 = 4.63 ± 1.67, p = 0.0158) 간에 유의한 차이가 관찰되었습니다. 3mM 필로카르핀에서는 통계적 차이가 없었다(평균 = 7.2500 ± 3.5444; 그림 2F)
이러한 결과는 필로카르핀이 플라나리아에서 다양한 유형의 행동을 유도한다는 것을 뒷받침합니다. 등쪽 진동은 필로카르핀에 노출된 후 신뢰할 수 있는 행동을 나타내는 것으로 알려져 있습니다.
운동성에 대한 자동 추적을 사용하여(그림 3A), 3mM 용액의 플라나리아가 대조군에 비해 웰 중앙에서 더 많은 시간을 보내는 것을 관찰했습니다(대조군, 평균 = 101.938 ± 32.219; 3mM 필로카르핀, 평균 = 187.966 ± 24.908, 6mM 필로카르핀, 평균 = 176.467 ± 22.980; 그림 3B).
6mM 용액의 플라나리아는 3mM 그룹과 대조군 모두보다 우물 주변에서 더 많은 시간을 보냈으며, 6mM와 대조군 사이에는 유의한 차이가 있었다(대조군, 평균 = 708.958 ± 59.506; 3mM 필로카르핀, 평균 = 881.562 ± 80.604; 평균 = 968.712 ± 84.267, p = 0.0241; 그림 3C).
3 mM 및 6 mM 필로카르핀으로 처리된 플라나리아는 대조군보다 중앙 대 주변 구역에 더 자주 진입했다(대조군, 평균 = 104.250 ± 11.436; 3 mM 필로카르핀, 평균 = 159.625 ± 13.368; 6 mM 필로카르핀, 평균 = 132.500 ± 28.126; 그림 3D).
표본 크기가 작지만 통계 분석 소프트웨어를 사용하여 생성된 정규 분위수 플롯은 대부분의 데이터 값이 빨간색 실선 근처에 있음을 보여줍니다. 데이터 값도 빨간색 점선 신뢰한계 내에 속하며, 이는 정규 분포를 나타냅니다. 이 분석을 위해 통계 분석 소프트웨어가 선택된 이유는 데이터 시각화와 통계 도구의 강력한 조합을 제공하기 때문입니다. 이 소프트웨어는 작은 데이터셋에서 정규성을 시각적으로 평가하는 데 필수적인 분위수 플롯을 생성하는 데 특히 효과적입니다. 직관적인 인터페이스와 ANOVA와 같은 내장 통계 테스트는 분석을 신속하게 실행하고 그래픽 표현의 정확성을 보장하는 데 이상적이며, 이는 강력한 데이터 해석 9,13,14,19에 도움이 됩니다.
대조군과 6mM 그룹 사이의 평균 둘레 지속 시간에서 상당한 차이가 관찰되었습니다. 이 연구는 다양한 용액 농도에 노출되었을 때 플라나리아의 운동성 변화에 대한 귀중한 통찰력을 제공합니다. 통계 분석은 대조군과 6mM 그룹 간의 평균 둘레 지속 시간에 상당한 차이를 보여주었으며, 이는 서로 다른 용액 농도에 노출되었을 때 플라나리아의 운동성 변화에 대한 통찰력을 제공합니다.
행동 분석을 지원하기 위해 두 가지 방법을 사용하여 조직학적 분석을 수행했습니다. 골지 염색은 플라나리아 신경계의 뉴런을 시각화하는 데 사용되었으며, 발작과 같은 행동이 뉴런의 존재 또는 형태에 영향을 미치는지 여부를 확인했습니다. 둘째, 관찰되고 있는 것이 실제로 뉴런인지 확인하기 위해, 감각 뉴런의 축삭돌기에서 발견된 항원을 인식하는 항체를 사용하여 면역형광 분석을 수행했습니다20. anti-1H6을 사용한 골지 염색 및 면역 형광을 사용한 조직학적 연구는 횡단면과 전체 마운트 제제를 모두 사용하여 신경을 식별하고 정량화할 수 있는 잠재력을 보여주었습니다(그림 4)21. 필로카르핀(6mM) 치료는 대조군(대조군(n=3): 평균=764.14 ± 260.46; 필로카르핀(n=3): 평균=162.12 ± 86.22; p < 0.05)에 비해 신경구조의 수를 감소시켰다.

그림 1: Dugesia dorotocephala에 대한 실험 절차 개요. 이 연구의 전반적인 절차. 플라나리아는 다양한 농도의 필로카르핀에 배치되고 그들의 행동이 기록되고 분석됩니다. 그 다음에는 골지체(Golgi) 염색과 면역형광 분석을 사용한 조직학적 분석이 이어집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 필로카르핀에 의한 플라나리아 움직임 및 진동의 변화. (아프) 필로카르핀 농도 증가에 따른 플라나리아 움직임의 변화, *로 통계적으로 유의한 값 표시. 개별 값(검은색 점), 평균(녹색 선), 표준 오차 평균(SEM, 파란색 막대), 표준 편차(파란색 선) 및 사분위수(빨간색 상자)가 표시됩니다. (G) 필로카르핀 농도가 증가함에 따라 등쪽 진동의 빈도와 개별 값(녹색 점) 및 최적 맞춤선(검은색)을 나타냅니다. R = 상관 계수. 유의성을 계산하기 위해 분산 분석을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
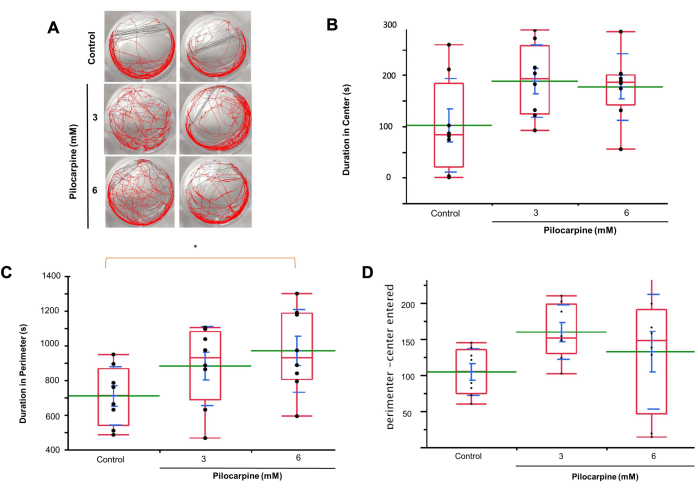
그림 3: 모션 추적 분석을 사용한 제어 및 pilocarpine 솔루션에서의 Planaria 거동. (A) 제어, 3mM 및 6mM 솔루션에서 플라나리아 거동 관찰. (B) 플라나리아가 대조군과 비교하여 3mM 용액에서 우물 중앙에서 보낸 시간. (C) 플라나리아가 3mM 그룹과 대조군 모두와 비교하여 6mM 용액에서 우물 주변에서 보낸 시간. (D) 대조군과 비교하여 3mM 용액에서 중앙 및 주변 구역에 들어가는 플라나리아의 빈도. 데이터에는 개별 값(검은색 점), 평균(녹색 선), 표준 오차 평균(SEM, 파란색 막대), 표준 편차(파란색 선) 및 사분위수(빨간색 상자)가 표시됩니다. 유의성을 계산하기 위해 분산 분석을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 플라나리아의 신경 구조 분석. (A) 그래픽은 주요 신경학적 특징을 강조하는 플라나리아 총체적 구조를 묘사하며, 소화 및 근육 구조를 강조하는 장을 통과하는 플라나리아의 횡단면과 주요 신경 구조를 강조하는 플라나리아 뇌의 횡단면을 따릅니다. (B) 면역형광을 이용한 필로카르핀 신경 구조 대조. 신경 밀도의 추정치는 필로카르핀 처리군에서 감소했다(대조군의 0.16 신경/픽셀에서 0.11 신경/픽셀로). (C) 골지체(Golgi) 염색을 이용한 플라나리아의 대표적인 부분; 1 : 뇌를 보여주는 머리 화살표; 2 : 복부 신경삭을 보여주는 화살표; 3 개의 뉴런과 같은 돌출부 (화살표). (D) 측면 분기(별표)와 (E) 신경 구조는 필로카르핀에서 감소합니다. (F) 필로카르핀에서 신경 세포 프로파일의 수가 감소합니다. 데이터에는 개별 값(검은색 점), 평균(녹색 선), 표준 오차 평균(SEM, 파란색 막대), 표준 편차(파란색 선) 및 사분위수(빨간색 상자)가 표시됩니다. 유의성을 계산하기 위해 학생의 t-Test를 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구는 다양한 농도의 플라나리아에서 필로카르핀 유도 행동을 보여주었습니다. 가장 적절한 행동은 진동하는 등쪽 확장이었는데, 이 행동은 플라나리아 9,10,11,12의 발작과 같은 행동에 관한 다른 연구에서 문서화되지 않았기 때문입니다. 필로카르핀이 플라나리아에서 발작과 같은 행동을 유도하는 메커니즘은 아직 알려져 있지 않습니다. 그러나 이 연구는 서로 다른 행동이 신경 흥분성의 정도에 따라 달라질 수 있음을 보여줍니다. 이러한 효과는 무스카린 수용체 작용작용(muscarinic receptor agonism)에 의해 유발되는 것으로 생각된다22.
프로토콜의 주요 단계는 용량 의존적 분석을 위한 필로카르핀 용액의 준비와 관련이 있습니다. 여기서의 절차를 따르면 행동 기록에 사용된 플라나리아가 일관된 조건을 갖도록 했습니다. 플라나리아를 필로카르핀 용액 또는 스프링워터를 포함하는 별도의 우물 플레이트에 배치하면 등쪽 진동, C자형 움직임 및 머리 튕기기와 같은 주요 동작을 관찰할 수 있었습니다. 웰 플레이트당 하나의 플라나리아에 초점을 맞춤으로써 1시간 기록에 대한 자동 추적 소프트웨어에 의한 잠재적 오류도 줄였습니다. 또한 운동성 분석을 위해 중앙 영역과 주변 영역에서 보낸 시간을 포함하여 이동 패턴을 정량화하기 위해 특정 설정으로 비디오 영상을 보정하고 분석하는 것이 필수적이었습니다. 플라나리아를 골지 염색에 보존하기 전에 강력한 용액으로 헹구는 안락사는 플라나리아의 인도적 종결을 허용하고 신경 조직의 무결성에 영향을 미칠 수 있는 유기체에서 발생할 수 있는 잠재적인 생리학적 변화를 방지했기 때문에 조직학적 분석에 매우 중요했습니다. 골지 염색은 용액 A, B 및 C를 사용하여 단계적으로 수행된 후 신경 구조를 검사하기 위해 포매 및 절편화 및 절편화를 수행했습니다. 이 기술은 신경 세포 형태에 대한 상세한 시각화를 제공하고 신경 구조에서 관찰 가능한 변화를 가능하게 했기 때문에 중요했습니다. 면역형광 염색은 특정 항체를 사용하여 신경 세포 마커를 식별하며, 철저한 세척 및 차단 단계를 통해 투명도를 향상시킵니다. 이미지 분석은 사용된 소프트웨어를 사용하여 뉴런 변화를 정량화하여 신뢰할 수 있는 비교를 위한 일관된 임계값을 보장했습니다. ANOVA 및 t-test를 포함한 통계 분석은 행동과 신경 구조의 유의미한 차이를 평가합니다. 이 모든 단계는 플라나리아에서 발작과 같은 활동과 신경 기반을 평가하기 위한 강력한 방법론을 제공합니다.
문제 해결이 필요한 몇 가지 요인이 있었습니다. 첫째, 발작과 같은 활동을 유도하기 위해 충분한 농도의 필로카르핀이 필요했지만 모든 활동이 중단될 정도로 심하게 손상되어서는 안 되었습니다. 이러한 이유로 이러한 결과를 얻기 위한 최적의 농도를 결정하기 위해 먼저 여러 농도를 테스트했습니다. 이러한 농도는 또한 행동이 용량 의존성을 나타내는지 여부를 결정하는 데 사용되었습니다. 둘째, Golgi assay는 조직 손실에 최적화되었습니다. 용액 C를 사용하여 슬라이드에 장착한 후 염색 과정에서 조직이 떨어집니다. 젤라틴으로 코팅된 슬라이드가 통합되었으며 슬라이드는 염색 과정에서 조심스럽게 처리되었습니다. 이 두 가지 변형은 조직 손실을 최소화했습니다. 다음으로, 단면을 얻기 위해 플라나리아를 임시 주형에 평평하게 놓고 저온 유지 장치에서 동결한 다음 원래 위치에 수직으로 척에 장착하여 횡단면을 절단할 수 있도록 했습니다. 면역형광 분석과 관련하여 항체의 최적 농도를 결정해야 했습니다. 최적의 희석 농도를 결정하기 위해 연속 희석이 권장됩니다. 다행히도 이 분석에 대해 제조업체의 권장 사항이 잘 작동했기 때문에 연속 희석이 필요하지 않았습니다. 이 프로토콜은 우유를 차단 버퍼로 사용했는데, 이는 더 저렴하고 저렴한 옵션이며 버퍼 23,24,25와 마찬가지로 작동하기 때문입니다. 마지막으로, 비디오 아티팩트에 대한 문제 해결이 필요했습니다. 2mM 필로카르핀에 노출된 플라나리아는 컨테이너 이동, 조명 문제 및 각도 변화로 인한 추적 중단으로 인해 제외되었습니다.
모든 절차와 마찬가지로 제한 사항이 있습니다. 플라나리아는 인간과 유사한 신경 경로를 보이지만, 무척추동물이며 포유류 뇌의 복잡성이 부족하다26. 따라서 플라나리아에서 관찰된 결과는 인간과 직접적인 상관관계가 없을 수 있습니다. 둘째, 이 분석법은 뉴런의 정량화를 허용하지만 뉴런과 그 수상돌기의 형태에 대한 분석은 허용하지 않으며, 이는 종종 간질 환자에서 진단됩니다15,19. 따라서 이 연구의 결과는 인간 간질에 대한 예비 분석으로만 사용됩니다.
그림 4에서 0 mM 및 6 mM 필로카르핀 플라나리아의 정량화는 플라나리아가 발작을 경험했는지 여부를 결정하는 데 중요한 의미를 갖습니다. 실험 그룹과 통제 그룹에서 얻은 값을 주의 깊게 분석하고 비교함으로써 두 그룹 간에 통계적으로 유의미한 차이가 있었습니다. 이것은 실험군에 적용된 필로카르핀이 플라나리아에서 관찰된 행동에 직접적으로 기여했을 수 있음을 시사한다. 비디오 분석 소프트웨어에 추가 개선 사항을 통합하면 플라나리아 관찰에서 수집된 데이터의 정확성과 신뢰성도 향상시킬 수 있습니다. 이러한 소프트웨어는 모션 패턴의 추적 및 정량화를 자동화하여 등쪽 진동과 같은 움직임에 대한 객관적인 측정을 제공하고 이러한 관찰을 위해 비디오 품질에만 의존하는 것을 줄일 수 있습니다.
현재 연구는 플라나리아에서 발작과 같은 행동을 보여주었습니다. 그러나 우리가 아는 한, 진동하는 등쪽 팽창 운동은 주목되지 않았다 9,10,11. C-shape와 같이 관찰된 다른 행동은 현재 연구 9,10,11,12와 일치합니다. 면역형광 분석은 플라나리아에서 수행되었으며, 결과는 이 분석과 일치합니다20,27; 그러나 우리가 아는 한, 골지 염색은 이전에 플라나리아에서 수행된 적이 없으며, 이 염색의 최적화는 신경 형태를 분석할 수 있는 기회를 제공할 수 있습니다. 이것은 차례로 간질의 병태 생리학에 대한 통찰력을 제공할 수 있습니다. 필로카르핀(pilocarpine)이 플라나리아에서 발작과 같은 행동을 유도한다는 것은 이미 입증되었습니다. 추가 수정 및 반복을 통해 이 분석은 항경련 약물에 대한 약물 스크리닝에 사용될 수 있는 잠재력을 가지고 있습니다.
공개
저자는 선언할 것이 없습니다.
감사의 말
면역형광 프로토콜 최적화에 도움이 되는 제안을 해주신 EVMS Research Incentive Fund(PI: A.E. Musto)와 Jorge Jacot 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | |||
| 4% paraformaldehyde solution | Himedia | TCL119 | |
| Aqueous mounting media | Clini Sciences | NB-47-02240-30ML | |
| Beakers (one for each concentration tested) | |||
| Carolina Springwater | carolina | 132450 | |
| Cryostat | |||
| Diluted primary and secondary antibodies | |||
| Ethanol (100%) | sigma Aldrich | ||
| EthosVision XT 16 | noldus | ||
| Fiji Version 2.9.0 | |||
| Gelatin-coated slides | sigma Aldrich | 643203 | |
| Golgi Antibody 1H6 | DSHB | AB_2619608 | |
| Golgi stain kit_ | Neuroscience Associate | PK 401/401A | |
| Hydrogen Peroxide | |||
| Methanol | |||
| Mounting media | thermo fischer scientific | ||
| OCT compound | |||
| PBS buffer | sigma Aldrich | P4417 | |
| Powdered Milk | |||
| Tin foil | |||
| Transfer pipettes | |||
| Xylene |
참고문헌
- World Health Organization. . Epilepsy. , (2024).
- Dalic, L., Cook, M. J. Managing drug-resistant epilepsy: challenges and solutions. Neuropsychiatr Dis Treat. 12, 2605-2616 (2016).
- Mayo Clinic. . Seizures - Symptoms and causes. , (2023).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. J Exp Biol. 216 (20), 3799-3810 (2013).
- Moreira-Lobo, D. C., et al. Eugenol modifies the excitability of rat sciatic nerve and superior cervical ganglion neurons. Neurosci Lett. 472 (3), 220-224 (2010).
- Johan Arief, M. F., Choo, B. K. M., Yap, J. L., Kumari, Y., Shaikh, M. F. A systematic review on non-mammalian models in epilepsy research. Front Pharmacol. 9, 655 (2018).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci U S A. 100, 7666-7671 (2003).
- Wu, J. P., Lee, H. L., Li, M. H. Cadmium neurotoxicity to a freshwater planarian. Arch Environ Contam Toxicol. 67 (4), 639-650 (2014).
- Kim, A., Rawls, S. M. Nicotine-induced C-shape movements in planarians are reduced by antinociceptive drugs: Implications for pain in planarian paroxysm etiology. Brain Res. 1778, 147770 (2022).
- Reho, G., Lelièvre, V., Cadiou, H. Planarian nociception: Lessons from a scrunching flatworm. Front Mol Neurosci. 15, 935918 (2022).
- Pagán, O. R., et al. Planarians require an intact brain to behaviorally react to cocaine, but not to react to nicotine. Neuroscience. 246, 265-270 (2013).
- Raffa, R. B., Holland, L. J., Schulingkamp, R. J. Quantitative assessment of dopamine D2 antagonist activity using invertebrate (Planaria) locomotion as a functional endpoint. J Pharmacol Toxicol Methods. 45 (3), 223-226 (2001).
- Bhatt, P., Reitz, A. B., Tallarida, C. Mephedrone ("bath salt") pharmacology: insights from invertebrates. Neuroscience. 208, 79-84 (2012).
- Neufeld, T., Carniello, T., Dotta, B. A single hypoxic event ameliorates pilocarpine-induced hyperkinetic movements in Planaria. Nat Sci. 14, 149-156 (2022).
- Rossini, L., et al. Dendritic pathology, spine loss, and synaptic reorganization in human cortex from epilepsy patients. Brain. 144 (1), 251-265 (2021).
- Owuor, K., et al. LGI1-associated epilepsy through altered ADAM23-dependent neuronal morphology. Mol Cell Neurosci. 42 (4), 448-457 (2009).
- Dubey, V., et al. Dendritic reorganization in the hippocampus, anterior temporal lobe, and frontal neocortex of lithium-pilocarpine induced Status Epilepticus (SE). J Chem Neuroanat. 133, 102329 (2023).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Musto, A. E., Walker, C. P., Petasis, N. A., Bazan, N. G. Hippocampal neuro-networks and dendritic spine perturbations in epileptogenesis are attenuated by neuroprotectin D1. PLoS One. 10 (1), e0116543 (2015).
- Omuro, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15 (2), (2015).
- Keenan, C. L., et al. Cytoarchitecture of primitive brains: Golgi studies in flatworms. J Comp Neurol. 195, 4 (1981).
- Pronin, A. N., Wang, Q., Slepak, V. Z. Teaching an old drug new trick: Agonism, antagonism, and biased signaling of pilocarpine through M3 muscarinic acetylcholine receptor. Mol Pharmacol. 92 (5), 601-612 (2017).
- Im, K., Mareninov, S., Diaz, M. F. P., Yong, W. H. An introduction to performing immunofluorescence staining. Methods Mol Biol. 1897, 299-311 (2019).
- Vogt, R. V., Phillips, D. L., Henderson, L. O., Whitfield, W., Spierto, F. W. Quantitative differences among various proteins as blocking agents for ELISA microtiter plates. J Immunol Meth. 101 (1), 43-50 (1987).
- Duhamel, R. C., Johnson, D. A. Use of nonfat dry milk to block nonspecific nuclear and membrane staining by avidin conjugates. J Histochem Cytochem. 33 (7), 711-714 (1985).
- Chen, T. S., Huang, T. H., Lai, M. C., Huang, C. W. The role of glutamate receptors in epilepsy. Biomedicines. 11 (3), 783 (2023).
- Kreshchenko, N. Immunocytochemical identification of serotoninergic neurons in Planaria Girardia tigrina. Biochem. Moscow Suppl Ser A. 11, 68-76 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유