Method Article
المستوي كنموذج حيواني للنوبات الحادة التجريبية
In This Article
Summary
تؤثر النوبات سلبا على الوظائف المختلفة ونوعية الحياة. تعرضت ديدان بلاناريا لتركيزات متفاوتة من الاختلاجات الكيميائية لتقييم الأنماط الظاهرية للنوبات وحركتها التخريبية. تقترح هذه الدراسة استخدام الديدان المستوية كنموذج للنوبات الحادة لدى البشر ولها أهمية في تطوير أدوية الصرع.
Abstract
الصرع هو من بين الاضطرابات العصبية الأكثر انتشارا التي تتميز بنوبات عفوية متكررة. تمثل النوبات مظهرا سريريا لنشاط الخلايا العصبية غير المنضبط والمتزامن بشكل مفرط. يعتمد مدى تلف الدماغ الناتج عن النوبات على مدتها وشدتها. للأسف ، لا يوجد علاج فعال للصرع. الهدف من هذا التحقيق هو تقييم ما إذا كانت دودة بلاناريا Dugesia dorotocephala يمكن أن تكون بمثابة نموذج للمساعدة في تحديد وتطوير علاجات للصرع يمكن أن تستهدف النوبات الحادة. حاليا ، يتم استخدام نماذج مختلفة ، مثل النماذج البحرية ، لتقييم الأدوية المضادة للنوبات (ASM). ومع ذلك ، فهي باهظة الثمن ، وهناك مخاوف أخلاقية. بدلا من ذلك ، توفر نماذج اللافقاريات فرصة بحثية فعالة من حيث التكلفة في عملية اكتشاف الأدوية ل ASM. تنتمي Planaria إلى عائلة الديدان المفلطحة وتعيش في المياه العذبة البحرية والبيئات الأرضية. Dugesia dorotocephala هو النوع السائد من المسطح المائي في جميع أنحاء أمريكا الشمالية. D. dorotocephala يقدم كنموذج لافقاريات قابل للتطبيق لدراسات الصرع نظرا لفعاليته من حيث التكلفة ، والخلايا العصبية الشبيهة بالفقاريات ، والسلوكيات القابلة للقياس الكمي ، على عكس اللافقاريات الأخرى أو الكبيرة. لقد تم استخدامها في العديد من دراسات علم الأدوية والسموم البيئية المتعلقة بالعمر والذاكرة والتجديد. في هذه الدراسة ، تعرضت بلاناريا لتركيزات مختلفة من بيلوكاربين ، وهو مخلج كيميائي شائع لدراسة سلوكهم عند التعرض. بعد الملاحظة ، تم القتل الرحيم للبلاناريا وحفظها إما في محلول الفورمالديهايد أو جولجي للتقييم النسيجي العصبي. لوحظت ستة أنماط ظاهرية سلوكية متميزة في السطح: التذبذبات الظهرية ، وتذبذبات الرأس ، والتمدد الظهري للذيل ، والشكل C ، ونفض الغبار على الرأس ، ونفض الغبار عن الذيل. زادت ترددات التذبذب الظهري بشكل ملحوظ بين المجموعات التجريبية مقارنة بالمجموعات الضابطة وأظهرت اعتمادا على الجرعة. بالإضافة إلى ذلك ، عطل بيلوكاربين حركة المستويات. يمكن أن تكون النوبات التي يسببها بيلوكاربين في بلاناريا بمثابة نموذج لتقييم النوبات الحادة والأدوية المضادة للنوبات ، وهو أمر ضروري في تطوير التدخلات العلاجية للمرضى الذين يعانون من الصرع.
Introduction
الصرع ، الذي يتميز بنوبة صرع أو أكثر في غضون 24 ساعة دون سبب واضح ، يؤثر على ~ 50 مليون شخص على مستوىالعالم 1. من بينهم ، تم الإبلاغ عن إصابة 10-15 مليون شخص بالصرع المقاومللأدوية 2. لذلك ، فإن التحقيق في أدوية الصرع أمر بالغ الأهمية. تستلزم الحالة نوبات قصيرة من الحركة اللاإرادية الجزئية أو المعممة ، تتراوح من التحديق الفارغ إلى تصلب الجسم والاهتزاز ، وترتبط بزيادة النشاط الكهربائي فيالدماغ 3.
تاريخيا ، اعتمدت أبحاث الصرع على القوارض والثدييات الأخرى بسبب أوجه التشابه التطورية مع البشر. ومع ذلك ، يمكن أن تستغرق هذه الطرق وقتا طويلا ومكلفة ، مما يستلزم نهجا بديلا4،5. تم استخدام المخلوقات غير الثديية مثل ذباب الفاكهة والعلقات والضفادع الصغيرة وأسماك الزرد والديدان الأسطوانية في الدراسات وأظهرت نتائج واعدة6. علاوة على ذلك ، تبين أن بلاناريا يمكن أن توفر نموذجا للدراسة الجينومية المقارنة بين جينومات اللافقاريات والبشرية جنبا إلى جنب مع القدرة على اختبار الأدوية المؤيدة للاختلاج والأدوية المضادة للنوبات (ASM) والأنماط السلوكية6. تشتهر Planaria (Phylum Platyhelminthes) ، والمعروفة باسم الديدان المفلطحة وأعضاء فئة Turbellaria ، في المقام الأول بقدراتها على التجدد. ومع ذلك ، يركز هذا التحقيق على استجابتهم للمواد المسببة للنوبات.
تشترك Planaria في الآليات العصبية الأساسية مع البشر ، مثل الاستجابة للسيروتونين والدوبامين ، مما يدل على تشابه بنسبة 95٪ مع الجينات المرتبطة بالجهاز العصبي في دماغ الثدييات ويمتلكان بنية دماغية يمكن التعرفعليها 7. بالإضافة إلى ذلك ، فإنها تظهر حركات يمكن ملاحظتها في ظروف المختبر وهي فعالة من حيث التكلفة وفعالة من حيث الوقت وأخلاقية مقارنة بالقوارض أو الثدييات الأخرى. تم توثيق هذه السلوكيات التي يمكن ملاحظتها ، مثل الحركات الشبيهة باللولب ، والحركات الشبيهة ب C ، وعلى شكل جوز ، على نطاق واسع لعقود من الزمن وترتبط بمواد مثل الكوكايين والنيكوتين والدوبامين والبيلوكاربين7،8،9،10،11،12،13،14. ومن ثم ، تظهر بلاناريا كنموذج قابل للتطبيق لأبحاث أدوية الصرع في البشر.
تهدف هذه الطريقة إلى توصيف الخلايا العصبية للبلاناريا التي تعرضت للبيلوكاربين باستخدام صبغة جولجي. تستخدم صبغة جولجي لتصور الخلايا العصبية تحت الفحص المجهري الضوئي وقد تم استخدامها للتحقيق فيما إذا كان التغيير في التشكل مرتبطا بنوباتالصرع 15،16،17. لا يوجد في الأدبيات الحالية أي دليل على تلطيخ جولجي يتم إجراؤه على الأدمغة المستوية. على الرغم من أن الدراسات السابقة قد وثقت التأثيرات الدوائية من خلال مراقبة الأنماط الظاهرية السلوكية ، إلا أن هذه المخطوطة هي الأولى التي تميز الخلايا العصبية للبلاناريا المعرضة للبيلوكاربين باستخدام تلطيخ جولجي11،18. أثبتت هذه التقنية قيمتها في تصور وفهم التغيرات المورفولوجية المرتبطة بالنوبات. لاحظت هذه الدراسة زيادة كبيرة في تواتر سلوك التذبذب الظهري المتذبذب في الديدان المستوية مع زيادة تركيز البيلوكاربين.
Protocol
ملاحظة: تم وصف التصميم التجريبي العام في الشكل 1.
1. فحص النمط الظاهري للسلوك
- تحضير تركيزات 1 ملي مولار و 2 ملي بيلوكاربين مذابة في مياه الينابيع وكذلك التحكم بمياه الينابيع فقط.
- ماصة 3 مل من كل محلول في صفيحة بئر 4 × 3 ، حيث يمثل كل صف تركيزا مختلفا من بيلوكاربين.
- ضع Dugesia dorotocephala التي تمت تربيتها في المختبر والتي يبلغ عمرها حوالي أسبوعين في كل من الآبار ال 12 باستخدام ماصة نقل مع قطع الطرف.
ملاحظة: قم بقص الطرف بحيث تكون النهاية كبيرة بما يكفي لتناسب planaria دون إتلافها. - سجل سلوك السطح لمدة 1 ساعة باستخدام أي كاميرا تسجل السلوكيات جيدا ويمكن ملاحظتها للعين البشرية ، موضوعة فوق لوحة البئر 4 × 3 في ظروف الإضاءة الداخلية العادية.
- كرر الخطوات 1.1-1.4 بتركيزات 3 ملي مولار و 4 ملي مولار و 6 ملي بيلوكاربين مذاب في مياه الينابيع.
2. تحليل الحركة
ملاحظة: تم تسجيل سلوكيات Planaria في آبار قطرها 2.5 سم. تم تقسيم تسجيلات الفيديو التي تبلغ مدتها ساعة واحدة إلى أجزاء مدتها 30 دقيقة واقتصاصها باستخدام برامج تجارية لتحليل المستويات بشكل فردي.
- ابدأ تجربة جديدة باستخدام برنامج تحليل السلوك الآلي. افتح نظام تعقب السلوك التلقائي المحسن. انقر فوق جديد ضمن تجربة جديدة. قم بتسمية التجربة.
- قم بإعداد الإعدادات التجريبية كما هو موضح أدناه.
- انقر على إعدادات التجربة في مطالبة القائمة. تأكد من أن الإعدادات افتراضية: مصدر الفيديو (من ملف الفيديو)، عدد الساحات (1)، الميزات المتعقبة (اكتشاف النقطة المركزية)، تقنية اكتشاف نقطة الجسم (المستندة إلى المحيط)، خيارات التحليل (لا شيء)، الوحدات (سم، ثانية، درجة).
- قم بإعداد إعدادات الساحة كما هو موضح أدناه.
- انقر فوق إعدادات الساحة ضمن علامة التبويب إعدادات الساحة في أعلى يمين لوحة الإعداد. عندما يطلب منك تحميل مقطع فيديو، حدد لقطات مسجلة من بلاناريا من موقع الملف المخزن. بمجرد تحديد الفيديو، انقر على Grab.
- اتبع التعليمات الموجودة على اللوحة العلوية اليمنى من الشاشة. انقر فوق 1. ارسم المقياس للمعايرة. في صورة الفيديو الخاصة بالبئر ، اسحب خط مقياس من حافة إلى حافة بئر العينة. أدخل مسافة البئر في العالم الحقيقي (2.5 سم).
- انقر فوق 2. حدد الشكل ورسم الساحة. تأكد من تحديد Arena 1 في اللوحة اليمنى. حرك مؤشر الماوس إلى أعلى منتصف الشاشة وانقر فوق أيقونة الدائرة.
- قم بإنشاء دائرة في صورة الفيديو التي تم تحميلها عن طريق السحب من محيط من الساحة إلى آخر. تأكد من أن الساحة في المنطقة البرتقالية. اضبط الشكل بحيث يناسب الساحة. تأكد من أن ملصق Arena 1 يقع ضمن حدود الساحة.
- في الجزء السفلي من اللوحة اليمنى، قم بتغيير الشكل والحجم والموضع (العرض: 2.75، الارتفاع: 2.75، X: 0، Y: 0) إلى القياسات المطلوبة.
- انقر فوق 3. حدد مناطق الشكل والرسم (اختياري). سيتم الآن تحديد مجموعة المنطقة 1 داخل اللوحة اليمنى. حرك مؤشر الماوس إلى أعلى منتصف الشاشة وحدد أيقونة الدائرة. قم بإنشاء دائرة أصغر في صورة الساحة عن طريق سحبها بداخلها.
- في اللوحة السفلية اليمنى، قم بتغيير الشكل والحجم والموضع إلى القياسات المطلوبة (العرض: 1.75، الارتفاع: 1.75، X: 0، Y: 0).
- انقر على زر إضافة تسمية منطقة في شريط القائمة نفسه مثل الدائرة. انقر داخل وسط الدائرة الأصغر. انقر بزر الماوس الأيمن فوق علامة المنطقة 1 في اللوحة اليمنى لإعادة تسمية مركز المنطقة.
- انقر فوق الزر إضافة تسمية منطقة مرة أخرى. انقر فوق محيط الساحة ، خارج منطقة المركز. انقر بزر الماوس الأيمن فوق المنطقة 2 في اللوحة اليمنى لإعادة تسمية المنطقة محيط.
- انقر فوق 4. تحقق من صحة الإعداد لضمان إعدادات الساحة الصالحة.
- قم بإعداد إعدادات التحكم في الإصدار التجريبي كما هو موضح أدناه.
- انقر فوق إعدادات التحكم في الإصدار التجريبي ضمن علامة التبويب إعدادات التحكم في الإصدار التجريبي في أعلى يمين لوحة الإعداد. ستظهر ستة مربعات مكونة. انقر فوق الإعدادات داخل المربع الرابع المسمى شرط، والذي يتضمن الوقت (1) والوقت اللانهائي (الشرط لم يتم استيفائه).
- انقر على الفقاعة بجانب بعد، ثم أدخل المدة (30 دقيقة) في مربع النص الأيمن. ستكون هناك أيضا قائمة منسدلة على يمين مربع نص الوقت للاختيار بين h و min و s.
ملاحظة: تعتمد إعدادات الكشف عن اللقطات المسجلة على جودة اللقطات. يمكن التلاعب بالطرق التالية لمراقبة أفضل النتائج ، خاصة باللقطات الفردية.
- قم بإعداد إعدادات الكشف كما هو موضح أدناه.
- انقر فوق إعدادات الكشف ضمن علامة التبويب إعدادات الاكتشاف في لوحة الإعداد العلوية اليمنى. انقر على حدد فيديو زر في اللوحة العلوية اليمنى. قم بتحميل الفيديو المطلوب إلى إعدادات الكشف الأساسية.
- انقر فوق علامة التبويب خيارات متقدمة في نفس اللوحة اليمنى. الآن ، ضمن علامة التبويب الطريقة ، تأكد من تعيينه على Gray Scaling. قم بتغيير النطاق (0 - 100).
- ضمن علامة التبويب Smoothing في اللوحة اليمنى، تأكد من أن تجانس بكسل الفيديو لا شيء، وإيقاف تشغيل تصحيح الإطارات المسقطة، وإيقاف تشغيل تقليل تشويش المسار.
- أسفل علامة التبويب Subject Contour في اللوحة اليمنى، اضبط إعداد التسلسل وقم بتغيير Erosion و Dilation و Erosion إلى 1 و 1 و 0 على التوالي.
- ضمن علامة التبويب حجم الموضوع، قم بتغيير الحد الأدنى (0) والحد الأقصى (125000). انقر على حفظ في أسفل يسار الصفحة.
- إعداد سلسلة من التجارب بالفيديو للمراقبة كما هو موضح أدناه.
- انقر فوق قائمة الإصدارات التجريبية في لوحة الإعداد العلوية اليمنى. قم بتحميل لقطات فيديو للعينات بالتسلسل المطلوب بالنقر فوق علامات القطع الناقص أسفل عمود ملف فيديو النظام. لإضافة المزيد من الإصدارات التجريبية، انقر فوق إضافة إصدارات تجريبية بالقرب من أعلى يمين لوحة قائمة الإصدارات التجريبية.
- قم بإعداد إعدادات الاكتساب.
- انقر على الاكتساب ضمن علامة التبويب الاكتساب في أعلى يمين الصفحة. ضمن إعدادات الاكتساب في اللوحة اليمنى، انقر فوق تعقب جميع الإصدارات التجريبية المخطط لها.
- لبدء الاستحواذ ، انقر فوق الزر الأحمر في الجزء السفلي الأوسط من الشاشة بجوار جاهز للبدء. سيبدأ الحصول على الفيديو الآن ويستغرق وقتا معينا ، اعتمادا على كمية وطول إصدارات الفيديو التي تم تحميلها.
- قم بإعداد إعدادات التحليل كما هو موضح أدناه.
- انقر فوق ملف تعريف التحليل ضمن علامة التبويب تحليل اللوحة اليمنى. انقر فوق المتغيرات التابعة الافتراضية المحددة ، السرعة والمسافة المقطوعة ، واحذفها.
- ضمن لوحة المتغيرات التابعة، ضمن علامة التبويب الموقع، انقر فوق In Zone. انقر فوق المربعين Center و Perimeter Zone بحيث يتم وضع علامة اختيار.
- انقر فوق علامة التبويب إحصائيات الإصدار التجريبي ضمن المربع في المنطقة. انقر لإلغاء تحديد زمن الانتقال إلى أولا. انقر على إضافة.
- ضمن علامة التبويب النص الأساسي ، انقر فوق الزر تدوير. انقر في اتجاه عقارب الساعة واترك العتبة (50.00 درجة) والحد الأدنى للمسافة المنقولة (2.00 سم) في الوضع الافتراضي. انقر على إضافة.
- انقر فوق الزر "تدبير" مرة أخرى وانقر فوق عكس اتجاه عقارب الساعة. انقر على إضافة.
- تحليل المسارات كما هو موضح أدناه.
- ضمن علامة التبويب النتائج، انقر فوق تعقب المرئيات. في اللوحة اليمنى، ضمن التصفية، قم بإلغاء تحديد الأخير. سيصور شريط التحكم في التشغيل في اللوحة الوسطى السفلية من الشاشة تصور المسار للعينات خلال أوقات محددة من المراقبة.
- تحليل النتائج وتصديرها. يمكن العثور على النتائج في بقية علامات تبويب اللوحة السفلية اليسرى. لتصدير البيانات، انقر على البيانات الأولية أو الإحصائيات ضمن تصدير في اللوحة اليمنى.
3. القتل الرحيم
- تحضير محلول 22 ملي من الأوجينول في مياه الينابيع. ضع بلاناريا في أطباق بتري مع 9 مل من محلول الأوجينول 22 ملي مولار باستخدام ماصة النقل المقطوعة ، مع الحفاظ على كل تركيز منفصل. القتل الرحيم لمدة 3 دقائق أو حتى تتوقف كل الحركة.
- ضع بلاناريا في طبق بتري طازج مملوء ب 9 مل من مياه الينابيع لشطفها 1x-2x ، وضعها إما في محلول Golgi الموضح أدناه (صبغة Golgi) أو 4٪ paraformaldehyde (صبغة التألق المناعي).
4. التحليل النسيجي
- تلطيخ جولجي
- بعد القتل الرحيم للبلاناريا ، ضعها في كوب أو طبق بتري مملوء بمزيج 1: 1 من المحاليل A و B من Golgi Stain Kit. استبدل المحاليل A و B في اليوم التالي بوضع planaria في دورق جديد مملوء بمزيج من المحاليل A و B.
- اسمح للبلاناريا بالجلوس لمدة أسبوع واحد في المحاليل A و B.
- قم بإزالة المستويات من المحاليل A و B وضعها في المحلول C في دورق آخر. استبدل المحلول C في اليوم التالي. اسمح للبلاناريا بالجلوس لمدة لا تقل عن 72 ساعة وحتى أسبوع واحد في المحلول C.
- قم بإزالة planaria من المحلول C باستخدام ماصة نقل وقم بتضمينها عن طريق وضع كمية صغيرة من مركب OCT على ظرف ، وإضافة planaria ، ثم إحاطة Planaria بمركب OCT. قم بتقطيع المستويات بشكل عرضي إلى أقسام 5 ميكرومتر باستخدام آلة ناظم البرد عند -24 درجة مئوية.
- قم بتركيب بلاناريا على شرائح مغلفة بالجيلاتين باستخدام ماصة نقل ومحلول C واتركها تجف في الظلام عند RT لمدة تصل إلى 3 أيام.
- شرائح البقع باستخدام محلول التلوين (محلول جزء واحد D ، محلول جزء واحد E ، 2 جزء من مياه الينابيع) عن طريق غمر الشرائح في أكواب مع المحاليل على النحو التالي: محلول تلطيخ لمدة 10 دقائق ، ثم في مياه الينابيع 2x لمدة 4 دقائق لكل منهما ، ثم 50٪ إيثانول لمدة 4 دقائق ، ثم 75٪ إيثانول لمدة 4 دقائق ، ثم 95٪ إيثانول لمدة 4 دقائق ، ثم في 100٪ إيثانول 4x لمدة 4 دقائق ، وأخيرا في الزيلين 3x لمدة 4 دقائق.
- الشرائح الغطاء مع وسائط التثبيت النسيجية ومراقبة الأنسجة تحت الفحص المجهري للمجال الساطع.
- تلطيخ التألق المناعي
- بعد القتل الرحيم للبلاناريا ، ضعه في 4٪ بارافورمالدهيد لمدة 24 ساعة على الأقل. يمكن أيضا تخزينه في الثلاجة بعد هذه الخطوة.
- نقل بلاناريا إلى 20٪ سكروز من 4٪ PFA واتركها لمدة 1 يوم. قم بإزالة البلاناريا من السكروز وضعها في مخزن PBS المؤقت لمدة 5 دقائق.
- اشطفها ب 3-4 غسلات من PBS Buffer وانقله إلى 20٪ سكروز للتخزين حتى يصبح جاهزا للتلطيخ.
- ضعها في محاليل كحول 70٪ و 95٪ و 100٪ لمدة دقيقة واحدة لكل منها. ضعها في الزيلين لمدة 1 دقيقة.
- ضع في 95٪ و 70٪ كحول لمدة دقيقة واحدة لكل منهما. ضعها في المخزن المؤقت PBS 3x لمدة 5 دقائق لكل منهما. ضعه في محلول 60:40 من الميثانول وبيروكسيد الهيدروجين لمدة 10-15 دقيقة.
- اشطفها في PBS 3x لمدة 5 دقائق لكل منهما. أضف حجم 4٪ بارافورمالدهايد المستخدم سابقا في 4.2.1 في هذا المخزن المؤقت PBS.
- اشطفها في PBS 3x لمدة 5 دقائق لكل منهما. كتلة لمدة 1 ساعة مع الحليب المجفف ، عن طريق تغطية بلاناريا به.
- قم بتخفيف الجسم المضاد الأولي (1H6) إلى 5 ميكروغرام / مل باستخدام PBS واحتضان الشرائح طوال الليل عند 4 درجات مئوية في محلول الجسم المضاد. في اليوم التالي ، اشطف planaria في PBS لمدة 10 دقائق.
- تمييع الجسم المضاد الثانوي (الماعز المضاد للفأر IgG) إلى 1 ميكروغرام / مل في PBS واحتضان الشرائح طوال الليل في RT في محلول الجسم المضاد. في اليوم التالي ، اشطف بلاناريا في PBS لمدة 15 دقيقة.
ملاحظة: الأجسام المضادة المختلفة لها تركيزات مثالية مختلفة. حدد هذا قبل بدء التجربة. - قم بتركيب بلاناريا كاملة على الشريحة ، وقم بتغطيتها بغطاء ، وأغلقها بوسائط تركيب مائية ، وراقب الأنسجة تحت المجهر الفلوري.
5. تحليل الصور
- افتح تطبيق برنامج تحليل الصور مفتوح المصدر. قم بتثبيت المكون الإضافي colour_deconvolution2.jar في تطبيق برنامج تحليل الصور مفتوح المصدر عن طريق سحب المكون الإضافي إلى التطبيق.
- حدد الصورة المراد تحليلها واسحبها إلى تطبيق برنامج تحليل الصور مفتوح المصدر. انتقل إلى علامة التبويب صورة. انقر فوق اللون. انقر فوق إلغاء الالتفاف اللون2 v2.1.
- في خيار المتجهات ، انقر فوق H DAB. في خيار الإخراج ، انقر فوق 8bit_Transmittance. تأكد من تحديد جداول البحث المحاكاة والمنتج المتقاطع للون 3 وإظهار المصفوفات وإخفاء وسيلة الإيضاح. انقر فوق موافق.
- حدد الصورة بالأبيض والأسود للتأكد من أن تطبيق برنامج تحليل الصور مفتوح المصدر يمكنه تحليل الصورة بشكل فعال.
- انتقل إلى علامة التبويب صورة. انقر فوق ضبط. انقر على الحد. اضبط العتبة بحيث يكون تلطيخ DAB أو المقدمة حمراء اللون مع خلفية بيضاء. تأكد من أن الحد هو نفسه لكل صورة إذا تم تحديد صور متعددة.
- انقر فوق تحليل. انقر فوق تعيين القياسات. حدد المنطقة والحد الأدنى والحد الأقصى للقيمة الرمادية والحد إلى الحد وتسمية العرض والوسيط ومتوسط القيمة الرمادية. انقر فوق موافق. انقر فوق تحليل. انقر على قياس. احصل على النتيجة.
- كرر الخطوات من 1.2 إلى 1. يتم تحديد جميع الصور كميا. انقر فوق صورة النتائج. انقر على ملف. انقر على حفظ باسم. احفظ الملف كجدول بيانات واعرض البيانات على برنامج جدول البيانات.
6. التحليل الإحصائي
- احسب متوسط الأخطاء والمعيار للمتوسط (SEM) لسلوك المسطح باستخدام تحليل التباين (ANOVA) واختبار t للطالب للدلالة الإحصائية (ص < 0.05).
النتائج
لوحظ السلوك التالي من قبل البلاناريا المعرضة لتركيزات متفاوتة من بيلوكاربين:
التذبذبات الظهرية: تكوين يشبه الفقاعة ينتقل من نهاية الجمجمة لجسم المستوي إلى النهاية الذيلية.
تذبذبات الرأس: تشكيل يشبه الفقاعة من قبل رأس المستوي الذي يشكل مظهرا يشبه الشرغوف.
شكل C: يتحرك الرأس في اتجاه عقارب الساعة والذيل يتحرك عكس اتجاه عقارب الساعة لتشكيل C.
نفض الغبار على الرأس: يهتز رأس المستوي فجأة إلى اليسار أو اليمين.
التذبذب الظهري للذيل: تكوين يشبه الفقاعة من ذيل المستوي الذي يشكل مظهرا يشبه الشرغوف.
نفض الغبار عن الذيل: يهتز ذيل المستوي فجأة إلى اليسار أو اليمين.
لاحظنا أن تواتر السلوكيات زاد مع زيادة تركيز البيلوكاربين. النتائج هي عدد السلوكيات المعينة التي لوحظت في التسجيل بأكمله. كانت التذبذبات الظهرية عند 6 ملي مولار بيلوكاربين (المتوسط = 16 ± 4.10 ، ص < 0.0001) و 4 ملي مولار (المتوسط = 11.25 ± 2.17 ، ص < 0.0001) ذات دلالة إحصائية مقارنة بالمجموعة الضابطة (المتوسط = 0 ؛ الشكل 2 أ). أظهرت هذه الحركة سلوكا يعتمد على الجرعة (R2 = 0.87 ؛ الشكل 2 ز). بالإضافة إلى ذلك ، استغرق الأمر وقتا أقل حتى يظهر Planaria هذا السلوك عند تعرضها ل 6 ملي مولار من البيلوكاربين مقارنة بالتركيزات الأخرى.
بالنسبة لتذبذبات الرأس ، لوحظت اختلافات ذات دلالة إحصائية بين 6 ملي مولار والتحكم (المتوسط = 10.25 ± 3.57 ، ص = 0.0070) ، 3 ملي مولار والتحكم (المتوسط = 1.50 ± 0.96 ، ص = 0.0187) ، و 1 ملي مولار والتحكم (المتوسط = 2.75 ± 1.80 ، ص = 0.0405). عند 4 ملي مولار بيلوكاربين ، لم تكن هناك فروق إحصائية لوحظت (المتوسط = 6.75 ± 3.4004 ؛ الشكل 2 ب).
لوحظت اختلافات ذات دلالة إحصائية في النمط الظاهري على شكل حرف C بين المراقبة و 6 ملي مولار (المتوسط = 8.50 ± 2.47 ، ص = 0.0034) ، 1 ملي مولار (المتوسط = 5.75 ± 0.48 ، ص = 0.0368) ، وبين 6 ملي مولار و 2 ملي مولار (المتوسط = 3.75 ± 1.28 ، ص = 0.0454). لم تكن هناك فروق إحصائية لوحظت بين 3 ملي مولار بيلوكاربين (المتوسط = 3.50 ± 1.8484) و 4 ملي بيلوكاربين (المتوسط = 5.00 ± 2.6771 ؛ الشكل 2 د).
لوحظ اختلاف كبير في النمط الظاهري لنفض الغبار بين 6 ملي مولار والتحكم (المتوسط = 6.50 ± 1.19 ، ص = 0.0072) و 6 ملي مولار و 4 ملي مولار (المتوسط = 1.75 ± 0.85 ، ص = 0.0416). لم تكن هناك فروق إحصائية بين 1 ملي مولار بيلوكاربين (المتوسط = 4.250 ± 1.2500) ، 2 ملي بيلوكاربين (المتوسط = 3.8750 ± 1.6630) ، و 3 ملي بيلوكاربين (المتوسط = 2.75000 ± 1.0308 ؛ الشكل 2 ه).
لوحظت اختلافات ذات دلالة إحصائية في النمط الظاهري للتذبذبات الظهرية للذيل بين 4 ملي مولار والتحكم (المتوسط = 5.50 ± 2.63 ، ص = 0.0087) ، 2 ملي مولار (المتوسط = 0.50 ± 0.19 ، ص = 0.0063) ، وبين 6 ملي مولار والتحكم (المتوسط = 5.00 ± 2.45 ، ص = 0.0157) ، 2 ملي مولار (المتوسط = 0.50 ± 0.19 ، ص = 0.0125) ، و 1 ملي مولار (المتوسط = 0.75 ± 0.48 ، ص = 0.0366). لم تكن هناك فروق إحصائية عند 3 ملي مولار بيلوكاربين (المتوسط = 1.7500 ± 0.250 ؛ الشكل 2 ج).
بالنسبة للنمط الظاهري للنفض بالحرارة ، لوحظت اختلافات ذات دلالة إحصائية بين 6 ملي مولار والتحكم (المتوسط = 15.25 ± 7.20 ، ص = 0.0037) ، 4 ملي مولار (المتوسط = 2.50 ± 0.87 ، ص = 0.0125) ، 1 ملي مولار (المتوسط = 4.50 ± 1.55 ، ص = 0.0318) ، و 2 ملي مولار بيلوكاربين (المتوسط = 4.63 ± 1.67 ، ص = 0.0158). لم تكن هناك فروق إحصائية عند 3 ملي مولار بيلوكاربين (المتوسط = 7.2500 ± 3.5444 ؛ الشكل 2F)
تدعم هذه النتائج أن بيلوكاربين يحفز أنواعا مختلفة من السلوك في المستويات. من المعروف أن التذبذبات الظهرية تمثل سلوكا موثوقا به بعد التعرض للبيلوكاربين.
باستخدام التتبع التلقائي للحركة (الشكل 3 أ) ، لاحظنا أن المستويات في محاليل 3 ملي مولار قضت وقتا أطول في وسط الآبار مقارنة بالمجموعة الضابطة (التحكم ، المتوسط = 101.938 ± 32.219 ؛ 3 ملي مولار بيلوكاربين ، المتوسط = 187.966 ± 24.908 ، 6 ملي بيلوكاربين ، المتوسط = 176.467 ± 22.980 ؛ الشكل 3 ب).
قضت Planaria في محاليل 6 ملي مولار وقتا أطول في محيط الآبار من كل من مجموعة 3 ملي والمجموعة الضابطة ، مع وجود فرق معتد به بين 6 ملي مولار والتحكم (التحكم ، المتوسط = 708.958 ± 59.506 ؛ 3 ملي بيلوكاربين ، المتوسط = 881.562 ± 80.604 ؛ المتوسط = 968.712 ± 84.267 ، ص = 0.0241 ؛ الشكل 3 ج).
دخلت Planaria المعالجة ب 3 ملي مولار و 6 ملي بيلوكاربين أيضا إلى المناطق المركزية مقابل المناطق المحيطة بشكل متكرر أكثر من المجموعة الضابطة (التحكم ، المتوسط = 104.250 ± 11.436 ؛ 3 ملي بيلوكاربين ، المتوسط = 159.625 ± 13.368 ؛ 6 ملي بيلوكاربين ، المتوسط = 132.500 ± 28.126 ؛ الشكل 3 د).
على الرغم من وجود حجم عينة صغير ، إلا أن المخطط الكمي العادي الذي تم إنشاؤه باستخدام برنامج التحليل الإحصائي يوضح أن معظم قيم البيانات تقع بالقرب من الخط الأحمر الصلب. تقع قيم البيانات أيضا ضمن حدود الثقة الحمراء المنقطة، مما يشير إلى التوزيع الطبيعي. تم اختيار برنامج التحليل الإحصائي لهذا التحليل لأنه يوفر مزيجا قويا من تصور البيانات والأدوات الإحصائية. البرنامج فعال بشكل خاص في إنشاء مخططات كمية ، وهي ضرورية لتقييم الوضع الطبيعي بصريا في مجموعات البيانات الصغيرة. واجهته البديهية والاختبارات الإحصائية المدمجة ، مثل ANOVA ، تجعله مثاليا لإجراء التحليلات بسرعة وضمان الدقة في التمثيلات الرسومية ، مما يساعد في تفسير البيانات القوي9،13،14،19.
لوحظت فروق ذات دلالة إحصائية في متوسط مدد المحيط بين المجموعة الضابطة ومجموعة 6 ملي مولار. تقدم هذه الدراسة رؤى قيمة حول التغيرات الحركية في المسطحات عند التعرض لتركيزات مختلفة من المحاليل. كشف التحليل الإحصائي عن اختلافات ذات دلالة إحصائية في متوسط مدد المحيط بين المجموعة الضابطة ومجموعة 6 ملي مولار ، مما يوفر رؤى حول التغيرات الحركية في البلاناريا عند التعرض لتركيزات مختلفة من المحاليل.
لدعم التحليل السلوكي ، تم إجراء التحليل النسيجي باستخدام طريقتين. تم استخدام صبغة جولجي لتصور الخلايا العصبية في الجهاز العصبي المستوي ، لتحديد ما إذا كان للسلوك الشبيه بالنوبات تأثير على وجود الخلايا العصبية أو مورفولوجيتها. ثانيا ، للتأكد من أن الخلايا العصبية هي التي تمت ملاحظتها بالفعل ، تم إجراء فحص فلوري مناعي باستخدام جسم مضاد يتعرف على مستضد موجود في الإسقاطات المحورية للخلايا العصبيةالحسية 20. أظهرت الدراسات النسيجية باستخدام تلطيخ جولجي والتألق المناعي باستخدام مضاد 1H6 القدرة على تحديد الأعصاب وتحديدها باستخدام كل من المقاطع المستعرضة والمستحضرات الكاملة (الشكل 4) 21. قلل علاج بيلوكاربين (6 مليمتر) عدد الهياكل العصبية مقارنة بالتحكم (التحكم (العدد = 3): المتوسط = 764.14 ± 260.46 ؛ بيلوكاربين (ن = 3): المتوسط = 162.12 ± 86.22 ؛ ص < 0.05)

الشكل 1: نظرة عامة على الإجراء التجريبي ل Dugesia dorotocephala. الإجراء العام لهذه الدراسة. يتم وضع Planaria في تركيزات مختلفة من pilocarpine ، ويتم تسجيل سلوكها وتحليلها. يتبع ذلك تحليل نسيجي باستخدام صبغة جولجي ومقايسة الفلورية المناعية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التغيرات التي يسببها بيلوكاربين في حركة بلاناريا والتذبذبات. (أ-و) التغييرات في حركات البلاناريا مع زيادة تركيزات البيلوكاربين ، مع ملاحظة القيم ذات الدلالة الإحصائية مع *. تمت ملاحظة القيم الفردية (النقاط السوداء) والمتوسط (الخط الأخضر) ومتوسط الخطأ المعياري (SEM ، الشريط الأزرق) والانحراف المعياري (الخط الأزرق) والربع (المربع الأحمر). (ز) تواتر التذبذبات الظهرية مع زيادة تركيز البيلوكاربين مع القيم الفردية (النقاط الخضراء) والخط الأنسب (أسود). R = معامل الارتباط. تم استخدام تحليل التباين لحساب الأهمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
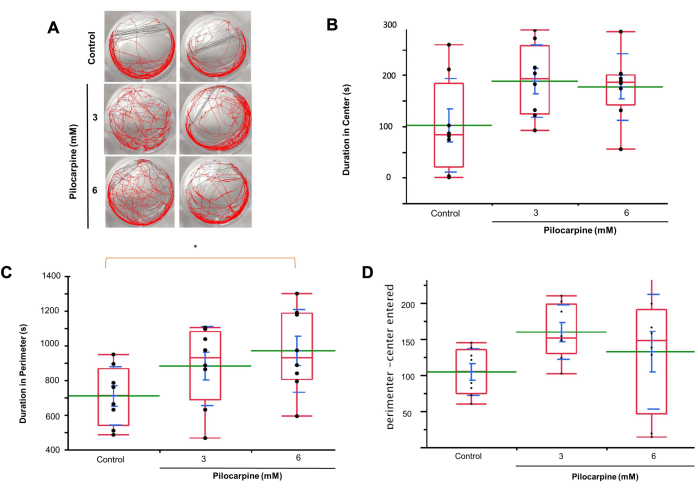
الشكل 3: سلوك Planaria في حلول التحكم والبيلوكاربين باستخدام تحليل تتبع الحركة. (أ) ملاحظات سلوك المستويات في التحكم ، محاليل 3 ملي مولار و 6 ملي مولار. (ب) المدة الزمنية التي يقضيها بلاناريا في وسط الآبار في محاليل 3 ملي مولار مقارنة بالمجموعة الضابطة. (ج) المدة الزمنية التي تقضيها بلاناريا في محيط الآبار في محاليل 6 ملي مولار مقارنة بكل من مجموعة 3 ملي ومجموعة التحكم. (د) تواتر دخول المستويات إلى مناطق المركز والمحيط في محاليل 3 ملي مولار مقارنة بمجموعة التحكم. تظهر البيانات القيم الفردية (النقاط السوداء) ، والمتوسط (الخط الأخضر) ، ومتوسط الخطأ المعياري (SEM ، الشريط الأزرق) ، والانحراف المعياري (الخط الأزرق) ، والربع (المربع الأحمر). تم استخدام تحليل التباين لحساب الأهمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحليل الهيكلي العصبي للبلاناريا. (أ) يصور الرسم الهيكل الإجمالي المستوي الذي يسلط الضوء على السمات العصبية الرئيسية ، بعد القسم العرضي من المستويين من خلال القناة الهضمية الذي يسلط الضوء على الهياكل الهضمية والعضلية ، والقسم العرضي من الدماغ المستوي الذي يسلط الضوء على الهياكل العصبية الرئيسية. (ب) التحكم مقابل البنية العصبية بيلوكاربين باستخدام التألق المناعي. انخفض تقدير كثافة الأعصاب (0.16 عصب/بكسل في المجموعة الضابطة إلى 0.11 عصب/بكسل) في المجموعة المعالجة بالبيلوكاربين. (ج) الأقسام التمثيلية للبلاناريا باستخدام تلطيخ جولجي؛ 1: سهم الرأس يظهر الدماغ. 2: السهم يظهر الحبل العصبي البطني. 3 شبيهة بالخلايا العصبية تظهر نتوءا (سهم). (د) لاحظ أن الفروع الجانبية (النجمة) و (ه) الهياكل العصبية تنخفض في بيلوكاربين. (F) يتم تقليل عدد ملامح الخلايا العصبية في بيلوكاربين. تظهر البيانات القيم الفردية (النقاط السوداء) ، والمتوسط (الخط الأخضر) ، ومتوسط الخطأ المعياري (SEM ، الشريط الأزرق) ، والانحراف المعياري (الخط الأزرق) ، والربع (المربع الأحمر). تم استخدام اختبار t للطالب لحساب الأهمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أظهرت هذه الدراسة السلوك الناجم عن بيلوكاربين في بلاناريا بتركيزات مختلفة. كان السلوك الأكثر صلة هو التمدد الظهري المتذبذب ، حيث لم يتم توثيق هذا السلوك في دراسات أخرى تتعلق بالسلوك الشبيه بالنوبات في Planaria9،10،11،12. لا تزال الآلية التي يحفز بها البيلوكاربين سلوكيات شبيهة بالنوبات في بلاناريا غير معروفة. ومع ذلك ، توضح هذه الدراسة أن السلوكيات المختلفة قد تتوافق مع درجات مختلفة من الاستثارة العصبية. ويعتقد أن هذا التأثير ناتج عن ناهض مستقبلات المسكارين22.
تضمنت الخطوات الرئيسية في البروتوكول إعداد محاليل بيلوكاربين للتحليل المعتمد على الجرعة. باتباع الإجراء هنا يضمن أن المستويات المستخدمة في التسجيل السلوكي سيكون لها شروط متسقة. سمح وضع البلاناريا في ألواح بئر منفصلة تحتوي إما على محاليل بيلوكاربين أو مياه الينابيع بملاحظة السلوكيات الرئيسية مثل التذبذبات الظهرية وحركات الشكل C ونقرات الرأس. كما أدى التركيز على واحد مستوي لكل لوحة بئر إلى تقليل الأخطاء المحتملة بواسطة برنامج التتبع الآلي للتسجيلات التي تستغرق ساعة واحدة. بالإضافة إلى ذلك ، كان من الضروري معايرة وتحليل لقطات الفيديو بإعدادات محددة لتحديد أنماط الحركة ، بما في ذلك الوقت الذي يقضيه في المركز مقابل المناطق المحيطة لتحليل الحركة. كان القتل الرحيم الذي يتم إجراؤه عن طريق شطف المستويات في محلول قوي قبل حفظها في صبغة جولجي أمرا بالغ الأهمية للتحليل النسيجي لأنه سمح بالإنهاء الإنساني للبلاناريا ومنع التغيرات الفسيولوجية المحتملة التي يمكن أن تحدث في الكائنات الحية التي يمكن أن تؤثر على سلامة الأنسجة العصبية. تم إجراء تلطيخ جولجي تدريجيا باستخدام المحاليل A و B و C ، متبوعا بالتضمين والتقسيم إلى الأجزاء والتقسيم لفحص الهياكل العصبية. كانت هذه التقنية مهمة لأنها قدمت تصورا مفصلا لمورفولوجيا الخلايا العصبية ومكنت من تغييرات يمكن ملاحظتها في الهياكل العصبية. يستخدم تلطيخ التألق المناعي أجساما مضادة محددة لتحديد العلامات العصبية ، مع خطوات الغسيل والحظر الشاملة لتعزيز الوضوح. تم إجراء تحليل الصور باستخدام برنامج لتحديد التغيرات العصبية ، مما يضمن عتبات متسقة للمقارنات الموثوقة. يقيم التحليل الإحصائي ، بما في ذلك اختبارات ANOVA و t ، الاختلافات الكبيرة في السلوكيات والهياكل العصبية. توفر كل هذه الخطوات منهجية قوية لتقييم النشاط الشبيه بالنوبات وأساسها العصبي في المستويات.
كانت هناك عدة عوامل تحتاج إلى استكشاف الأخطاء وإصلاحها. أولا ، كانت هناك حاجة إلى تركيز كاف من البيلوكاربين للحث على النشاط الشبيه بالنوبات ولكن لا يجب أن يكون ضارا للغاية بحيث يتم إيقاف جميع الأنشطة. لهذا السبب ، تم اختبار العديد من التركيزات لأول مرة لتحديد التركيز الأمثل للحصول على هذه النتائج. تم استخدام هذه التركيزات أيضا لتحديد ما إذا كان السلوك أظهر الاعتماد على الجرعة. ثانيا ، تم تحسين اختبار جولجي لفقدان الأنسجة. بعد التركيب على الشريحة باستخدام المحلول C ، سوف تسقط الأنسجة أثناء عملية التلوين. تم دمج الشرائح المطلية بالجيلاتين ، وتم التعامل مع الشرائح بعناية أثناء عملية التلوين. قلل هذان التعديلان من فقدان الأنسجة. بعد ذلك ، للحصول على مقاطع عرضية ، تم وضع المستويات بشكل مسطح في قالب مؤقت ، وتجميدها في الثلاجة ، ثم تركيبها على ظرف بشكل عمودي على موضعها الأصلي حتى يمكن قطع المقاطع المستعرضة. فيما يتعلق بمقايسة التألق المناعي ، يجب تحديد التركيز الأمثل للجسم المضاد. يوصى بالتخفيف التسلسلي لتحديد تركيز التخفيف الأمثل. لحسن الحظ ، عملت توصيات الشركة المصنعة بشكل جيد مع هذا الاختبار ، لذلك لم يكن التخفيف التسلسلي ضروريا. استخدم هذا البروتوكول الحليب كمخزن مؤقت للحظر لأن هذا خيار أرخص وبأسعار معقولة ويعمل تماما مثل المخزن المؤقت23،24،25. أخيرا ، كان استكشاف الأخطاء وإصلاحها مطلوبا لقطع الأثر. تم استبعاد Planaria المعرضة ل 2 mM pilocarpine بسبب تتبع الاضطرابات الناجمة عن حركة الحاويات ، ومشكلات الإضاءة ، وتغيرات الزاوية.
كما هو الحال مع أي إجراء ، هناك قيود. على الرغم من أن المستويات تظهر مسارات عصبية مماثلة للبشر ، إلا أنها لافقاريات وتفتقر إلى تعقيد أدمغة الثدييات26. لذلك ، قد لا ترتبط النتائج التي لوحظت في planaria ارتباطا مباشرا بالبشر. ثانيا ، يسمح هذا الاختبار بالقياس الكمي للخلايا العصبية ولكنه لا يسمح بتحليل مورفولوجيا الخلايا العصبية وتشعباتها ، والتي غالبا ما يتم تشخيصها في مرضى الصرع15،19. وبالتالي ، فإن نتائج هذا البحث تعمل فقط كتحليل أولي للصرع البشري.
إن القياس الكمي ل 0 ملي مولار و 6 ملي بيلوكاربين بلاناريا في الشكل 4 له آثار كبيرة في تحديد ما إذا كانت بلاناريا قد تعرضت لنوبات. من خلال التحليل الدقيق ومقارنة القيم التي تم الحصول عليها من المجموعات التجريبية والضابطة ، كان هناك فرق ذي دلالة إحصائية بين المجموعتين. يشير هذا إلى أن البيلوكاربين المطبق على المجموعة التجريبية ربما يكون قد ساهم بشكل مباشر في السلوك المرصود في المستويات. كما أن إدماج المزيد من التحسينات في برمجيات التحليل الفيديوي يمكن أن يعزز دقة وموثوقية البيانات التي تم جمعها من عمليات الرصد المسطحة. ويمكن لهذه البرمجيات أن تمتمتة تتبع أنماط الحركة وقياسها كميا، وتوفر قياسات موضوعية للحركات مثل التذبذب الظهري وتقلل من الاعتماد على جودة الفيديو وحدها في هذه الملاحظات.
أظهرت الدراسات الحالية سلوكا شبيها بالنوبات في planaria. ومع ذلك ، على حد علمنا ، لم يتم ملاحظة حركة التمدد الظهري المتذبذبة9،10،11. تتوافق السلوكيات الأخرى التي لوحظت ، مثل الشكل C ، مع البحث الحالي9،10،11،12. تم إجراء فحوصات التألق المناعي على planaria ، وتتوافق النتائج مع هذا الاختبار20،27. ومع ذلك ، على حد علمنا ، لم يتم إجراء وصمة عار جولجي على Planaria من قبل ، وقد يوفر تحسين هذه البقعة الفرصة لتحليل مورفولوجيا الخلايا العصبية. وهذا بدوره قد يوفر نظرة ثاقبة على الفيزيولوجيا المرضية للصرع. لقد ثبت بالفعل أن البيلوكاربين يحفز سلوكا شبيها بالنوبات في بلاناريا. مع مزيد من التعديلات والتكرار ، يمكن استخدام هذا الاختبار في فحص الأدوية للأدوية المضادة للنوبات.
Disclosures
ليس لدى المؤلفين ما يعلنون عنه.
Acknowledgements
نود أن نشكر صندوق حوافز أبحاث EVMS (PI: A.E. Musto) والدكتور خورخي جاكوت على اقتراحاته المفيدة في تحسين بروتوكول التألق المناعي.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | |||
| 4% paraformaldehyde solution | Himedia | TCL119 | |
| Aqueous mounting media | Clini Sciences | NB-47-02240-30ML | |
| Beakers (one for each concentration tested) | |||
| Carolina Springwater | carolina | 132450 | |
| Cryostat | |||
| Diluted primary and secondary antibodies | |||
| Ethanol (100%) | sigma Aldrich | ||
| EthosVision XT 16 | noldus | ||
| Fiji Version 2.9.0 | |||
| Gelatin-coated slides | sigma Aldrich | 643203 | |
| Golgi Antibody 1H6 | DSHB | AB_2619608 | |
| Golgi stain kit_ | Neuroscience Associate | PK 401/401A | |
| Hydrogen Peroxide | |||
| Methanol | |||
| Mounting media | thermo fischer scientific | ||
| OCT compound | |||
| PBS buffer | sigma Aldrich | P4417 | |
| Powdered Milk | |||
| Tin foil | |||
| Transfer pipettes | |||
| Xylene |
References
- World Health Organization. . Epilepsy. , (2024).
- Dalic, L., Cook, M. J. Managing drug-resistant epilepsy: challenges and solutions. Neuropsychiatr Dis Treat. 12, 2605-2616 (2016).
- Mayo Clinic. . Seizures - Symptoms and causes. , (2023).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. J Exp Biol. 216 (20), 3799-3810 (2013).
- Moreira-Lobo, D. C., et al. Eugenol modifies the excitability of rat sciatic nerve and superior cervical ganglion neurons. Neurosci Lett. 472 (3), 220-224 (2010).
- Johan Arief, M. F., Choo, B. K. M., Yap, J. L., Kumari, Y., Shaikh, M. F. A systematic review on non-mammalian models in epilepsy research. Front Pharmacol. 9, 655 (2018).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci U S A. 100, 7666-7671 (2003).
- Wu, J. P., Lee, H. L., Li, M. H. Cadmium neurotoxicity to a freshwater planarian. Arch Environ Contam Toxicol. 67 (4), 639-650 (2014).
- Kim, A., Rawls, S. M. Nicotine-induced C-shape movements in planarians are reduced by antinociceptive drugs: Implications for pain in planarian paroxysm etiology. Brain Res. 1778, 147770 (2022).
- Reho, G., Lelièvre, V., Cadiou, H. Planarian nociception: Lessons from a scrunching flatworm. Front Mol Neurosci. 15, 935918 (2022).
- Pagán, O. R., et al. Planarians require an intact brain to behaviorally react to cocaine, but not to react to nicotine. Neuroscience. 246, 265-270 (2013).
- Raffa, R. B., Holland, L. J., Schulingkamp, R. J. Quantitative assessment of dopamine D2 antagonist activity using invertebrate (Planaria) locomotion as a functional endpoint. J Pharmacol Toxicol Methods. 45 (3), 223-226 (2001).
- Bhatt, P., Reitz, A. B., Tallarida, C. Mephedrone ("bath salt") pharmacology: insights from invertebrates. Neuroscience. 208, 79-84 (2012).
- Neufeld, T., Carniello, T., Dotta, B. A single hypoxic event ameliorates pilocarpine-induced hyperkinetic movements in Planaria. Nat Sci. 14, 149-156 (2022).
- Rossini, L., et al. Dendritic pathology, spine loss, and synaptic reorganization in human cortex from epilepsy patients. Brain. 144 (1), 251-265 (2021).
- Owuor, K., et al. LGI1-associated epilepsy through altered ADAM23-dependent neuronal morphology. Mol Cell Neurosci. 42 (4), 448-457 (2009).
- Dubey, V., et al. Dendritic reorganization in the hippocampus, anterior temporal lobe, and frontal neocortex of lithium-pilocarpine induced Status Epilepticus (SE). J Chem Neuroanat. 133, 102329 (2023).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Musto, A. E., Walker, C. P., Petasis, N. A., Bazan, N. G. Hippocampal neuro-networks and dendritic spine perturbations in epileptogenesis are attenuated by neuroprotectin D1. PLoS One. 10 (1), e0116543 (2015).
- Omuro, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15 (2), (2015).
- Keenan, C. L., et al. Cytoarchitecture of primitive brains: Golgi studies in flatworms. J Comp Neurol. 195, 4 (1981).
- Pronin, A. N., Wang, Q., Slepak, V. Z. Teaching an old drug new trick: Agonism, antagonism, and biased signaling of pilocarpine through M3 muscarinic acetylcholine receptor. Mol Pharmacol. 92 (5), 601-612 (2017).
- Im, K., Mareninov, S., Diaz, M. F. P., Yong, W. H. An introduction to performing immunofluorescence staining. Methods Mol Biol. 1897, 299-311 (2019).
- Vogt, R. V., Phillips, D. L., Henderson, L. O., Whitfield, W., Spierto, F. W. Quantitative differences among various proteins as blocking agents for ELISA microtiter plates. J Immunol Meth. 101 (1), 43-50 (1987).
- Duhamel, R. C., Johnson, D. A. Use of nonfat dry milk to block nonspecific nuclear and membrane staining by avidin conjugates. J Histochem Cytochem. 33 (7), 711-714 (1985).
- Chen, T. S., Huang, T. H., Lai, M. C., Huang, C. W. The role of glutamate receptors in epilepsy. Biomedicines. 11 (3), 783 (2023).
- Kreshchenko, N. Immunocytochemical identification of serotoninergic neurons in Planaria Girardia tigrina. Biochem. Moscow Suppl Ser A. 11, 68-76 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved