Method Article
Planaria come modello animale per la crisi acuta sperimentale
In questo articolo
Riepilogo
Le convulsioni hanno un impatto negativo su varie funzioni e sulla qualità della vita. I vermi Planaria sono stati esposti a concentrazioni variabili di chemioconvulsivanti per valutare i loro fenotipi convulsivanti e la motilità dirompente. Questo studio propone di utilizzare i vermi planaria come modello per le convulsioni acute nell'uomo e ha un significato nello sviluppo di farmaci per l'epilessia.
Abstract
L'epilessia è tra i disturbi neurologici più diffusi, caratterizzati da crisi epilettiche spontanee ricorrenti. Le convulsioni rappresentano una manifestazione clinica di un'attività delle cellule neurali incontrollata ed eccessivamente sincronizzata. L'entità del danno cerebrale causato dalle convulsioni dipende dalla loro durata e intensità. Purtroppo, non esiste un rimedio efficace per l'epilessia. Lo scopo di questa indagine è valutare se il verme planaria Dugesia dorotocephala possa fungere da modello per aiutare nell'identificazione e nello sviluppo di trattamenti per l'epilessia in grado di mirare alle convulsioni acute. Attualmente, vari modelli, come i modelli marini, vengono utilizzati per valutare i farmaci antiepilettici (ASM). Tuttavia, sono molto costosi e ci sono preoccupazioni etiche. In alternativa, i modelli di invertebrati offrono un'opportunità di ricerca economicamente vantaggiosa nel processo di scoperta di farmaci per l'ASM. Le planarie appartengono alla famiglia dei vermi piatti e abitano ambienti marini d'acqua dolce e terrestri. Dugesia dorotocephala è la specie dominante di planarie acquatiche in tutto il Nord America. D. dorotocephala si presenta come un modello di invertebrato praticabile per gli studi sull'epilessia grazie al suo rapporto costo-efficacia, ai neuroni simili ai vertebrati e ai comportamenti quantificabili, a differenza di altri invertebrati o animali più grandi. Sono stati utilizzati in vari studi di farmacologia e tossicologia ambientale relativi all'età, alla memoria e alla rigenerazione. In questo studio, le planarie sono state esposte a diverse concentrazioni di pilocarpina, un comune chemioconvulsivante, per studiare il loro comportamento dopo l'esposizione. A seguito dell'osservazione, le planarie sono state soppresse e conservate in formaldeide o in soluzione di Golgi per la valutazione neuroistologica. Nelle planarie sono stati osservati sei fenotipi comportamentali distinti: oscillazioni dorsali, oscillazioni della testa, espansione dorsale della coda, forma a C, movimento della testa e movimento della coda. Le frequenze di oscillazione dorsale erano significativamente aumentate tra i gruppi sperimentali rispetto al controllo e mostravano dipendenza dalla dose. Inoltre, la pilocarpina ha interrotto la motilità delle planarie. Le convulsioni indotte da pilocarpina nelle planarie possono fungere da modello per valutare le convulsioni acute e i farmaci antiepilettici, che sono essenziali nello sviluppo di interventi terapeutici per i pazienti umani affetti da epilessia.
Introduzione
L'epilessia, caratterizzata da due o più crisi epilettiche entro 24 ore senza una causa apparente, colpisce ~50 milioni di persone in tutto il mondo1. Tra questi, 10-15 milioni di individui hanno l'epilessia resistente ai farmaci2. Pertanto, l'indagine sui farmaci per l'epilessia è fondamentale. La condizione comporta brevi episodi di movimento involontario parziale o generalizzato, che vanno dallo sguardo vuoto all'irrigidimento e al tremore del corpo, ed è collegata a un aumento dell'attività elettricanel cervello.
Storicamente, la ricerca sull'epilessia si è basata su roditori e altri mammiferi a causa delle loro somiglianze evolutive con gli esseri umani. Tuttavia, questi metodi possono richiedere molto tempo e denaro, richiedendo un approccio alternativo 4,5. Creature non mammifere come moscerini della frutta, sanguisughe, girini, pesci zebra e nematodi sono state utilizzate negli studi e hanno mostrato risultati promettenti6. Inoltre, è stato dimostrato che le planarie potrebbero fornire un modello di studio genomico comparativo tra genomi di invertebrati e umani insieme alla capacità di testare farmaci pro-convulsivanti, antiepilettici (ASM) e modelli comportamentali6. Le Planarie (Phylum Platyhelminthes), conosciute come platelminti e membri della classe Turbellaria, sono principalmente rinomate per le loro capacità rigenerative; Tuttavia, questa indagine si concentra sulla loro risposta alle sostanze che inducono convulsioni.
Le planarie condividono meccanismi neurologici fondamentali con gli esseri umani, come la reattività alla serotonina e alla dopamina, mostrando una somiglianza del 95% con i geni correlati al sistema nervoso nel cervello dei mammiferi e possedendo una struttura cerebrale riconoscibile7. Inoltre, mostrano movimenti osservabili in condizioni di laboratorio e sono convenienti, efficienti in termini di tempo ed etici rispetto ai roditori o ad altri mammiferi. Questi comportamenti osservabili, come i movimenti a forma di vite, a C e a forma di noce, sono stati ampiamente documentati per decenni e sono associati a sostanze come la cocaina, la nicotina, la dopamina e la pilocarpina 7,8,9,10,11,12,13,14. Quindi, le planarie emergono come un modello praticabile per la ricerca sui farmaci per l'epilessia nell'uomo.
Questo metodo mira a caratterizzare i neuroni delle planarie che sono stati esposti alla pilocarpina utilizzando una colorazione di Golgi. La colorazione di Golgi viene utilizzata per visualizzare i neuroni al microscopio ottico ed è stata utilizzata per indagare se un cambiamento nella morfologia è correlato alle convulsioni 15,16,17. La letteratura attuale non ha prove di colorazione di Golgi eseguita su cervelli planari. Sebbene studi precedenti abbiano documentato effetti farmacologici osservando fenotipi comportamentali, questo manoscritto è il primo a caratterizzare i neuroni delle planarie esposte alla pilocarpina utilizzando la colorazione di Golgi11,18. Questa tecnica si rivela preziosa per visualizzare e comprendere i cambiamenti morfologici associati alle convulsioni. Questo studio ha rilevato un aumento significativo della frequenza del comportamento di oscillazione dorsale oscillante nei vermi planari all'aumentare della concentrazione di pilocarpina.
Protocollo
NOTA: Il disegno sperimentale complessivo è descritto nella Figura 1.
1. Saggio del fenotipo comportamentale
- Preparare concentrazioni di 1 mM e 2 mM di pilocarpina disciolta in acqua di sorgente e controllare solo con acqua di sorgente.
- Pipettare 3 mL di ciascuna soluzione in una piastra da 4 x 3 pozzetti, con ogni riga che rappresenta una diversa concentrazione di pilocarpina.
- Posizionare una Dugesia dorotocephala allevata in laboratorio di circa 2 settimane in ciascuno dei 12 pozzetti utilizzando una pipetta di trasferimento con la punta tagliata.
NOTA: Tagliare la punta in modo che l'estremità sia abbastanza grande da contenere la planaria senza danneggiarla. - Registra il comportamento delle planarie per 1 ora utilizzando qualsiasi telecamera che registri bene i comportamenti e sia osservabile dall'occhio umano, posizionata sopra la piastra a 4 x 3 pozzetti in normali condizioni di illuminazione interna.
- Ripetere i passaggi 1.1-1.4 con concentrazioni di 3 mM, 4 mM e 6 mM di pilocarpina disciolta in acqua di sorgente.
2. Analisi della motilità
NOTA: I comportamenti delle planarie sono stati registrati in pozzetti di 2,5 cm di diametro. Le registrazioni video della durata di 1 ora sono state suddivise in parti di 30 minuti e ritagliate utilizzando un software commerciale per analizzare le planarie individualmente.
- Inizia un nuovo esperimento utilizzando un software di analisi del comportamento automatizzato. Apri il sistema di tracciamento automatico del comportamento migliorato. Fai clic su Nuovo in Nuovo esperimento. Assegna un nome all'esperimento.
- Configurare le impostazioni sperimentali come descritto di seguito.
- Fai clic su Impostazioni esperimento nel prompt del menu. Assicurati che le impostazioni siano predefinite: sorgente video (dal file video), Numero di arene (1), Funzioni tracciate (rilevamento del punto centrale), Tecnica di rilevamento del punto del corpo (basata sul contorno), Opzioni di analisi (nessuna), Unità (cm, s, gradi).
- Configura le impostazioni dell'arena come descritto di seguito.
- Fai clic su Impostazioni arena nella scheda Impostazioni arena nel pannello Configurazione in alto a sinistra. Quando viene richiesto di caricare un video, selezionare il metraggio registrato di planaria dalla posizione del file memorizzato. Una volta selezionato il video, fai clic su Acquisisci.
- Segui le istruzioni nel pannello in alto a destra dello schermo. Fare clic su 1. Disegna la scala per calibrare. Sull'immagine video del pozzetto, trascinare una linea di scala da un bordo all'altro del pozzetto del campione. Inserisci la distanza reale del pozzo (2,5 cm).
- Fare clic su 2. Seleziona Forma e disegna arena. Assicurati che l'Arena 1 sia selezionata nel pannello di destra. Sposta il cursore del mouse in alto al centro dello schermo e fai clic sull'icona del cerchio.
- Crea un cerchio nell'immagine video caricata trascinando da un perimetro all'altro dell'arena. Assicurati che l'arena sia nella zona arancione. Regola la forma in modo che si adatti all'arena. Assicurati che l'etichetta Arena 1 si trovi entro i limiti dell'arena.
- Nella parte inferiore del pannello di destra, modifica la forma, le dimensioni e la posizione (larghezza: 2,75, altezza: 2,75, X:0, Y: 0) alle misure desiderate.
- Fare clic su 3. Seleziona Forma e Disegna zone (opzionale). Verrà ora selezionato il Gruppo di Zone 1 all'interno del pannello di destra. Sposta il cursore del mouse in alto al centro dello schermo e seleziona l'icona del cerchio. Crea un cerchio più piccolo nell'immagine dell'arena trascinandolo all'interno.
- Nel pannello in basso a destra, modifica Forma, Dimensione e Posizione alle misure desiderate (Larghezza: 1,75, Altezza: 1,75, X: 0, Y: 0).
- Fare clic sul pulsante Aggiungi etichetta zona nella stessa barra dei menu del cerchio. Fare clic all'interno del centro del cerchio più piccolo. Fare clic con il pulsante destro del mouse sul tag Zona 1 nel pannello di destra per rinominare il centro della zona.
- Fare nuovamente clic sul pulsante Aggiungi etichetta zona . Fare clic sul perimetro dell'arena, al di fuori della zona centrale. Fare clic con il pulsante destro del mouse su Zona 2 nel pannello di destra per rinominare la zona Perimetro.
- Fare clic su 4. Convalida la configurazione per garantire la validità delle impostazioni dell'arena.
- Configurare le impostazioni di controllo della versione di prova come descritto di seguito.
- Fare clic su Impostazioni di controllo della versione di prova nella scheda Impostazioni di controllo della versione di prova nel pannello di configurazione in alto a sinistra. Appariranno sei caselle di componenti. Fai clic su Impostazioni all'interno della quarta casella denominata Condizione, che include Tempo (1) e Tempo infinito (condizione mai soddisfatta).
- Fai clic sulla bolla accanto a Dopo, quindi inserisci la durata (30 minuti) nella casella di testo a destra. Ci sarà anche un menu a discesa a destra della casella di testo del tempo per selezionare tra h, min e s.
NOTA: Le impostazioni di rilevamento per le riprese registrate dipendono dalla qualità delle riprese. I seguenti metodi possono essere manipolati per ottenere i migliori risultati, specifici per le singole riprese.
- Configurare le impostazioni di rilevamento come descritto di seguito.
- Fare clic su Impostazioni di rilevamento nella scheda Impostazioni di rilevamento nel pannello di configurazione in alto a sinistra. Fai clic sul pulsante Seleziona video nel pannello in alto a destra. Carica il video desiderato su base le impostazioni di rilevamento attivate.
- Fare clic sulla scheda Avanzate nello stesso pannello di destra. Ora, nella scheda Metodo, assicurati che sia impostato su Scala di grigi. Modificare l'intervallo (0 - 100).
- Nella scheda Arrotondamento del pannello di destra, assicurati che l'uniformità dei pixel video sia Nessuna, la correzione dei fotogrammi persi sia disattivata e la riduzione del rumore della traccia sia disattivata.
- Nella scheda Contorno soggetto del pannello di destra, regolare l'impostazione della sequenza e modificare Erosione, Dilatazione ed Erosione rispettivamente su 1, 1 e 0.
- Nella scheda Dimensione oggetto, modificare Minimo (0) e Massimo (125000). Fai clic su Salva in basso a destra.
- Impostare una sequenza di prove video per l'osservazione come descritto di seguito.
- Fai clic su Elenco versioni di prova nel pannello Configurazione in alto a sinistra. Caricare le riprese video dei campioni nella sequenza desiderata facendo clic sui puntini di sospensione sotto la colonna File video di sistema. Per aggiungere altre versioni di prova, fai clic su Aggiungi versioni di prova nella parte superiore sinistra del pannello Elenco versioni di prova.
- Configurare le impostazioni di acquisizione.
- Fai clic su Acquisizione nella scheda Acquisizione in alto a sinistra. In Impostazioni di acquisizione nel pannello a destra, fai clic su Monitora tutte le prove pianificate.
- Per iniziare l'acquisizione, fai clic sul pulsante rosso nella parte inferiore centrale dello schermo accanto a Pronto per l'avvio. L'acquisizione video inizierà ora e richiederà un certo periodo di tempo, a seconda della quantità e della durata delle prove video caricate.
- Configurare le impostazioni di analisi come descritto di seguito.
- Fare clic su Profilo analisi nella scheda Analisi del pannello di sinistra. Fare clic sulle variabili dipendenti selezionate di default, Velocità e Distanza spostata, ed eliminarle.
- All'interno del pannello delle variabili dipendenti, nella scheda Posizione, fare clic su Nella zona. Fare clic sulle caselle Centro e Zona perimetrale in modo che siano contrassegnate da un segno di spunta.
- Fare clic sulla scheda Statistiche di prova nella casella In zona. Fare clic per deselezionare Latenza al primo. Fare clic su Aggiungi.
- Nella scheda Corpo, fare clic sul pulsante Rotazione. Fare clic su In senso orario e lasciare la soglia (50,00 gradi) e la distanza minima spostate (2,00 cm) come predefinite. Fare clic su Aggiungi.
- Fare nuovamente clic sul pulsante Rotazione e fare clic su In senso antiorario. Fare clic su Aggiungi.
- Analizzare le tracce come descritto di seguito.
- Nella scheda Risultati, fare clic su Traccia visualizzazione. Nel pannello di destra, in Filtro, deseleziona Ultimo. La barra di controllo della riproduzione nel pannello centrale inferiore dello schermo mostrerà la visualizzazione della traccia dei campioni durante specifici momenti di osservazione.
- Analizza ed esporta i risultati. I risultati possono essere trovati nel resto delle schede del pannello in basso a sinistra. Per esportare i dati, fare clic su Dati grezzi o Statistiche in Esporta nel pannello di sinistra.
3. Eutanasia
- Preparare una soluzione 22 mM di eugenolo in acqua di sorgente. Posizionare la planaria in piastre di Petri con 9 mL di soluzione di eugenolo 22 mM utilizzando la pipetta di trasferimento tagliata, mantenendo separate le concentrazioni. Praticare l'eutanasia per 3 minuti o fino a quando tutti i movimenti non sono cessati.
- Mettere la planaria in una capsula di Petri fresca riempita con 9 ml di acqua di sorgente per risciacquare 1x-2x e inserirla nella soluzione di Golgi descritta di seguito (colorazione di Golgi) o nel 4% di paraformaldeide (colorazione di immunofluorescenza).
4. Analisi istologica
- Colorazione del Golgi
- Dopo l'eutanasia delle planarie, mettile in un bicchiere o in una capsula di Petri riempita con una miscela 1:1 delle soluzioni A e B del Golgi Tain Kit. Sostituire le soluzioni A e B il giorno seguente inserendo le planarie in un nuovo becher riempito con una miscela di soluzioni A e B.
- Lasciare riposare le planarie per 1 settimana nelle soluzioni A e B.
- Rimuovete le planarie dalle soluzioni A e B e mettetele nella soluzione C in un altro becher. Sostituire la soluzione C il giorno successivo. Lasciare riposare le planarie per un minimo di 72 ore e fino a 1 settimana nella soluzione C.
- Rimuovere la planaria dalla soluzione C con una pipetta di trasferimento e incorporarla posizionando una piccola quantità di composto OCT su un mandrino, aggiungendo la planaria e quindi circondando la planaria con il composto OCT. Tagliare trasversalmente le planarie in sezioni da 5 μM con la macchina per criostato a -24° C.
- Montare la planaria su vetrini rivestiti di gelatina utilizzando una pipetta di trasferimento e la soluzione C e lasciarla asciugare al buio a RT per un massimo di 3 giorni.
- Colorare i vetrini utilizzando la soluzione colorante (1 parte di soluzione D, 1 parte di soluzione E, 2 parti di acqua di sorgente) immergendo i vetrini in becher con le seguenti soluzioni: soluzione colorante per 10 minuti, poi in acqua di sorgente 2 volte per 4 minuti ciascuno, quindi etanolo al 50% per 4 minuti, quindi etanolo al 75% per 4 minuti, quindi etanolo al 95% per 4 minuti, poi in etanolo al 100% 4 volte per 4 minuti e infine in xilene 3 volte per 4 minuti.
- Vetrini coprioggetti con mezzi di montaggio istologici e osservazione dei tessuti al microscopio a campo chiaro.
- Colorazione in immunofluorescenza
- Dopo l'eutanasia delle planarie, immergerle in paraformaldeide al 4% per almeno 24 ore. Può anche essere conservato in frigorifero dopo questo passaggio.
- Trasferisci la planaria al 20% di saccarosio dal 4% di PFA e lasciala per 1 giorno. Rimuovere la planaria dal saccarosio e metterla nel tampone PBS per 5 minuti.
- Risciacquare con 3-4 lavaggi di tampone PBS e trasferire al 20% di saccarosio per la conservazione fino al momento della macchia.
- Mettere in soluzioni alcoliche al 70%, 95% e 100% per 1 minuto ciascuna. Mettere in xilene per 1 min.
- Mettere in alcool al 95% e al 70% per 1 min ciascuno. Mettere nel tampone PBS 3 volte per 5 minuti ciascuno. Mettere in una soluzione 60:40 di metanolo e perossido di idrogeno per 10-15 minuti.
- Risciacquare in PBS 3 volte per 5 minuti ciascuno. Aggiungere il volume di paraformaldeide al 4% utilizzato in precedenza in 4.2.1 in questo tampone PBS.
- Risciacquare in PBS 3 volte per 5 minuti ciascuno. Bloccare per 1 ora con latte in polvere, coprendo con esso la planaria.
- Diluire l'anticorpo primario (1H6) a 5 μg/mL con PBS e incubare i vetrini per una notte a 4 °C nella soluzione anticorpale. Il giorno seguente, sciacquare la planaria in PBS per 10 minuti.
- Diluire l'anticorpo secondario (IgG di capra anti-topo) a 1 μg/mL in PBS e incubare i vetrini per una notte a RT nella soluzione anticorpale. Il giorno seguente, sciacquare la planaria in PBS per 15 minuti.
NOTA: Anticorpi diversi hanno concentrazioni ottimali diverse; Determinalo prima di iniziare l'esperimento. - Montare le planarie intere sul vetrino, coprire con un vetrino coprioggetti, sigillare con un mezzo di montaggio acquoso e osservare il tessuto al microscopio a fluorescenza.
5. Analisi delle immagini
- Aprire l'applicazione software open source per l'analisi delle immagini. Installa il plug-in colour_deconvolution2.jar nell'applicazione software di analisi delle immagini open source trascinando il plug-in nell'applicazione.
- Seleziona l'immagine da analizzare e trascinala nell'applicazione software di analisi delle immagini open source. Vai alla scheda Immagine. Fai clic su colore. Fare clic su Deconvoluzione colore2 v2.1.
- Nell'opzione vettori, fare clic su H DAB. Nell'opzione di output fare clic su 8bit_Transmittance. Assicurati che le LUT simulate, Incrocia prodotto per Colore 3, Mostra matrici e Nascondi legenda siano tutte selezionate. Fare clic su OK.
- Seleziona l'immagine in bianco e nero per assicurarti che l'applicazione software di analisi delle immagini open source possa analizzare efficacemente l'immagine.
- Vai alla scheda Immagine. Fai clic su Regola. Fare clic su Soglia. Regolare la soglia in modo che la colorazione DAB o il primo piano siano di colore rosso con uno sfondo bianco. Assicurati che la soglia sia la stessa per ogni immagine se vengono quantificate più immagini.
- Fare clic su Analizza. Fare clic su Imposta misure. Selezionare Area, Valore di grigio minimo e massimo, Limite alla soglia, Visualizza etichetta, Mediana e Valore medio di grigio. Fare clic su OK. Fare clic su Analizza. Fai clic su Misura. Ottenere il risultato.
- Ripetere i passaggi da 1.2 a 1. Fino a quando tutte le immagini sono quantificate. Fare clic sull'immagine dei risultati. Fare clic su File. Fai clic su Salva con nome. Salva il file come foglio di calcolo e visualizza i dati sul software per fogli di calcolo.
6. Analisi statistica
- Calcola la media e gli errori standard della media (SEM) per il comportamento delle planarie utilizzando l'analisi della varianza (ANOVA) e il t-test di Student per la significatività statistica (p < 0,05).
Risultati
Il seguente comportamento è stato osservato dalle planarie esposte a concentrazioni variabili di pilocarpina:
Oscillazioni dorsali: una formazione simile a una bolla che viaggia dall'estremità cranica del corpo planario all'estremità caudale.
Oscillazioni della testa: formazione a forma di bolla da parte della testa della planaria che forma un aspetto simile a un girino.
Forma a C: la testa si muove in senso orario e la coda si muove in senso antiorario per formare una C.
Colpo di testa: la testa della planaria sobbalza bruscamente a sinistra o a destra.
Oscillazione dorsale della coda: formazione a forma di bolla dalla coda della planaria che forma un aspetto simile a un girino.
Colpo di coda: la coda della planaria sobbalza bruscamente a sinistra o a destra.
Abbiamo osservato che la frequenza dei comportamenti aumentava con l'aumentare della concentrazione di pilocarpina. I risultati sono il numero di comportamenti particolari notati nell'intera registrazione. Le oscillazioni dorsali a 6 mM di pilocarpina (media = 16 ± 4,10, p < 0,0001) e 4 mM (media = 11,25 ± 2,17, p < 0,0001) erano statisticamente significative rispetto al controllo (media = 0; Figura 2A). Questo movimento ha mostrato un comportamento dose-dipendente (R2 = 0,87; Figura 2G). Inoltre, le planarie hanno impiegato meno tempo a mostrare questo comportamento quando esposte a 6 mM di pilocarpina rispetto ad altre concentrazioni.
Per le oscillazioni della testa, sono state osservate differenze significative tra 6 mM e controllo (media = 10,25 ± 3,57, p = 0,0070), 3 mM e controllo (media = 1,50 ± 0,96, p = 0,0187) e 1 mM e controllo (media = 2,75 ± 1,80, p = 0,0405). A 4 mM di pilocarpina, non sono state osservate differenze statistiche (media = 6,75 ± 3,4004; Figura 2B).
Differenze significative nel fenotipo a forma di C sono state osservate tra il controllo e 6 mM (media = 8,50 ± 2,47, p = 0,0034), 1 mM (media = 5,75 ± 0,48, p = 0,0368) e tra 6 mM e 2 mM (media = 3,75 ± 1,28, p = 0,0454). Non sono state osservate differenze statistiche tra 3 mM di pilocarpina (media = 3,50 ± 1,8484) e 4 mM di pilocarpina (media = 5,00 ± 2,6771; Figura 2D).
Una differenza significativa nel fenotipo del colpo di testa è stata osservata tra 6 mM e controllo (media = 6,50 ± 1,19, p = 0,0072) e 6 mM e 4 mM (media = 1,75 ± 0,85, p = 0,0416). Non ci sono state differenze statistiche tra 1 mM di Pilocarpina (media = 4,250 ± 1,2500), 2 mM di Pilocarpina (media = 3,8750 ± 1,6630) e 3 mM di Pilocarpina (media = 2,75000 ± 1,0308; Figura 2E).
Differenze significative nel fenotipo delle oscillazioni dorsali della coda sono state osservate tra 4 mM e controllo (media = 5,50 ± 2,63, p = 0,0087), 2 mM (media = 0,50 ± 0,19, p = 0,0063) e tra 6 mM e controllo (media = 5,00 ± 2,45, p = 0,0157), 2 mM (media = 0,50 ± 0,19, p = 0,0125) e 1 mM (media = 0,75 ± 0,48, p = 0,0366). Non ci sono state differenze statistiche a 3 mM di pilocarpina (media = 1,7500 ± 0,250; Figura 2C).
Per il fenotipo tail-flick, sono state osservate differenze significative tra 6 mM e controllo (media = 15,25 ± 7,20, p = 0,0037), 4 mM (media = 2,50 ± 0,87, p = 0,0125), 1 mM (media = 4,50 ± 1,55, p = 0,0318) e 2 mM di pilocarpina (media = 4,63 ± 1,67, p = 0,0158). Non ci sono state differenze statistiche a 3 mM di pilocarpina (media = 7,2500 ± 3,5444; Figura 2F)
Questi risultati supportano che la pilocarpina induce diversi tipi di comportamento nelle planarie. È noto che le oscillazioni dorsali rappresentano un comportamento affidabile dopo l'esposizione alla pilocarpina.
Utilizzando il tracciamento automatico della motilità (Figura 3A), abbiamo osservato che le planarie in soluzioni 3 mM trascorrevano più tempo al centro dei pozzetti rispetto al gruppo di controllo (Controllo, media = 101,938 ± 32,219; 3 mM Pilocarpina, media = 187,966 ± 24,908, 6 mM Pilocarpina, media = 176,467 ± 22,980; Figura 3B).
Le planarie nelle soluzioni da 6 mM hanno trascorso più tempo nel perimetro dei pozzetti rispetto sia al gruppo da 3 mM che al gruppo di controllo, con una differenza significativa tra 6 mM e il controllo (Controllo, media = 708,958 ± 59,506; 3 mM Pilocarpina, media = 881,562 ± 80,604; media = 968,712 ± 84,267, p = 0,0241; Figura 3C).
Anche le planarie trattate con 3 mM e 6 mM di pilocarpina sono entrate nelle zone centrali rispetto a quelle perimetrali più frequentemente rispetto al gruppo di controllo (Controllo, media = 104,250 ± 11,436; 3 mM di pilocarpina, media = 159,625 ± 13,368; 6 mM di pilocarpina, media = 132,500 ± 28,126; Figura 3D).
Sebbene la dimensione del campione sia ridotta, il normale grafico quantile generato utilizzando il software di analisi statistica dimostra che la maggior parte dei valori dei dati cade vicino alla linea rossa continua. I valori dei dati rientrano anche nei limiti di confidenza rossi puntati, che indicano una distribuzione normale. Il software di analisi statistica è stato scelto per questa analisi perché offre una potente combinazione di strumenti di visualizzazione dei dati e statistici. Il software è particolarmente efficace per la creazione di grafici quantilici, essenziali per valutare visivamente la normalità in piccoli set di dati. La sua interfaccia intuitiva e i test statistici integrati, come ANOVA, lo rendono ideale per eseguire rapidamente analisi e garantire l'accuratezza delle rappresentazioni grafiche, il che aiuta a interpretare i dati in modo robusto 9,13,14,19.
Differenze significative sono state osservate nella durata media del perimetro tra il gruppo di controllo e il gruppo 6 mM. Questo studio fornisce preziose informazioni sui cambiamenti di motilità nelle planarie quando esposte a diverse concentrazioni di soluzione. L'analisi statistica ha rivelato differenze significative nella durata media del perimetro tra il gruppo di controllo e il gruppo 6 mM, fornendo informazioni sulle variazioni di motilità delle planarie quando esposte a diverse concentrazioni di soluzione.
Per supportare l'analisi comportamentale, l'analisi istologica è stata eseguita utilizzando due metodi. La colorazione di Golgi è stata utilizzata per visualizzare i neuroni nel sistema nervoso planario, per determinare se il comportamento simile a una crisi epilettica avesse un effetto sulla presenza o sulla morfologia dei neuroni. In secondo luogo, per confermare che si trattava effettivamente di neuroni, è stato eseguito un test di immunofluorescenza utilizzando un anticorpo che riconosce un antigene trovato sulle proiezioni assonali dei neuroni sensoriali20. Gli studi istologici che utilizzano la colorazione di Golgi e l'immunofluorescenza con anti-1H6 hanno mostrato il potenziale per identificare e quantificare i nervi utilizzando sia sezioni trasversali che preparazioni a montatura intera (Figura 4)21. Il trattamento con pilocarpina (6 mM) ha ridotto il numero di strutture neurali rispetto al controllo (Controllo (n = 3): media = 764,14 ± 260,46; pilocarpina (n = 3): media = 162,12 ± 86,22; p < 0,05)

Figura 1: Panoramica della procedura sperimentale per Dugesia dorotocephala. Procedura generale di questo studio. Le planarie vengono poste in varie concentrazioni di pilocarpina e il loro comportamento viene registrato e analizzato. Segue l'analisi istologica con la colorazione di Golgi e un test di immunofluorescenza. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cambiamenti indotti dalla pilocarpina nel movimento e nelle oscillazioni delle planarie. (A-F) Cambiamenti dei movimenti delle planarie con l'aumento delle concentrazioni di pilocarpina, rilevando valori statisticamente significativi con *. Vengono annotati i singoli valori (punti neri), la media (linea verde), la media dell'errore standard (SEM, barra blu), la deviazione standard (linea blu) e il quartile (casella rossa). (G) Frequenza delle oscillazioni dorsali con l'aumentare della concentrazione di pilocarpina con valori individuali (punti verdi) e la linea di miglior adattamento (nero). R = coefficiente di correlazione. L'analisi della varianza è stata utilizzata per calcolare la significatività. Clicca qui per visualizzare una versione più grande di questa figura.
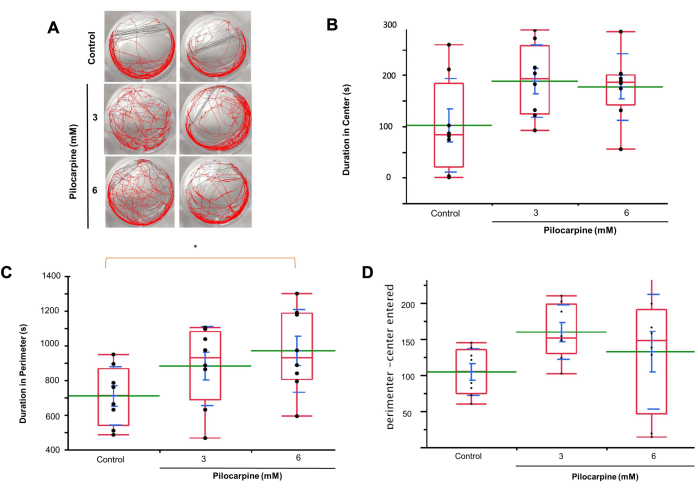
Figura 3: Comportamento delle planarie in soluzioni di controllo e pilocarpina utilizzando l'analisi del tracciamento del movimento. (A) Osservazioni del comportamento delle planarie in soluzioni di controllo, 3 mM e 6 mM. (B) Durata del tempo trascorso nelle planarie al centro dei pozzetti in soluzioni da 3 mM rispetto al gruppo di controllo. (C) Durata del tempo trascorso nelle planarie nel perimetro dei pozzetti in soluzioni da 6 mM rispetto sia al gruppo da 3 mM che al gruppo di controllo. (D) Frequenza di ingresso delle planarie nelle zone centrali e perimetrali in soluzioni di 3 mM rispetto al gruppo di controllo. I dati mostrano i singoli valori (punti neri), la media (linea verde), la media dell'errore standard (SEM, barra blu), la deviazione standard (linea blu) e il quartile (casella rossa). L'analisi della varianza è stata utilizzata per calcolare la significatività. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Analisi strutturale neurale delle planarie. (A) Il grafico raffigura la struttura grossolana della planaria evidenziando le caratteristiche neurologiche chiave, seguendo la sezione trasversale della planaria attraverso l'intestino evidenziando le strutture digestive e muscolari e la sezione trasversale del cervello planaria evidenziando le strutture neurologiche chiave. (B) Controllo rispetto alla struttura neuronale della pilocarpina mediante immunofluorescenza. La stima della densità nervosa è diminuita (da 0,16 nervi/pixel nel gruppo di controllo a 0,11 nervi/pixel) nel gruppo trattato con pilocarpina. (C) Sezioni rappresentative di planarie utilizzando la colorazione di Golgi; 1: freccia della testa che mostra il cervello; 2: freccia che mostra il cordone nervoso ventrale; 3 simili a neuroni che mostrano sporgenza (freccia). (D) Si noti che i rami laterali (asterisco) e le strutture neurali (E) sono ridotte nella pilocarpina. (F) Il numero di profili di cellule neurali è ridotto nella pilocarpina. I dati mostrano i singoli valori (punti neri), la media (linea verde), la media dell'errore standard (SEM, barra blu), la deviazione standard (linea blu) e il quartile (casella rossa). Il t-Test di Student è stato utilizzato per calcolare la significatività. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo studio ha dimostrato il comportamento indotto dalla pilocarpina nelle planarie a diverse concentrazioni. Il comportamento più pertinente era l'espansione dorsale oscillante, poiché questo comportamento non è stato documentato in altri studi riguardanti il comportamento convulsivo nelle planarie 9,10,11,12. Il meccanismo con cui la pilocarpina induce comportamenti simili a convulsioni nelle planarie è ancora sconosciuto. Tuttavia, questo studio dimostra che comportamenti diversi possono corrispondere a diversi gradi di eccitabilità neurale. Si ritiene che questo effetto sia causato dall'agonismo del recettore muscarinico22.
Le fasi chiave del protocollo hanno riguardato la preparazione di soluzioni di pilocarpina per l'analisi dose-dipendente. Seguendo la procedura qui si è assicurato che le planarie utilizzate nella registrazione comportamentale avessero condizioni coerenti. Il posizionamento della planaria in piastre a pozzetti separate contenenti soluzioni di pilocarpina o acqua di sorgente ha permesso di osservare comportamenti chiave come le oscillazioni dorsali, i movimenti a forma di C e i movimenti della testa. L'attenzione su una planaria per piastra a pozzetti ha anche ridotto i potenziali errori grazie al software di tracciamento automatizzato per le registrazioni di un'ora. Inoltre, era essenziale calibrare e analizzare le riprese video con impostazioni specifiche per quantificare i modelli di movimento, incluso il tempo trascorso nelle zone centrali rispetto a quelle perimetrali per l'analisi della motilità. L'eutanasia eseguita sciacquando le planarie in una soluzione potente prima di conservarle nella colorazione di Golgi è stata fondamentale per l'analisi istologica in quanto ha permesso la terminazione umana delle planarie e ha impedito potenziali cambiamenti fisiologici che potrebbero verificarsi negli organismi che potrebbero influenzare l'integrità dei tessuti neurali. La colorazione di Golgi è stata eseguita gradualmente utilizzando le soluzioni A, B e C, seguita dall'inclusione e dal sezionamento e dal sezionamento per esaminare le strutture neuronali. Questa tecnica è stata significativa perché ha fornito una visualizzazione dettagliata della morfologia neuronale e ha permesso cambiamenti osservabili nelle strutture neurali. La colorazione in immunofluorescenza utilizza anticorpi specifici per identificare i marcatori neuronali, con passaggi di lavaggio e blocco accurati per migliorare la chiarezza. L'analisi delle immagini eseguita ha utilizzato un software per quantificare i cambiamenti neuronali, garantendo soglie coerenti per confronti affidabili. L'analisi statistica, inclusi ANOVA e t-test, valuta differenze significative nei comportamenti e nelle strutture neurali. Tutti questi passaggi forniscono una solida metodologia per valutare l'attività convulsiva e le sue basi neurali nelle planarie.
C'erano diversi fattori che richiedevano la risoluzione dei problemi. In primo luogo, era necessaria una concentrazione sufficiente di pilocarpina per indurre l'attività convulsiva, ma non doveva essere eccessivamente dannosa in modo da cessare tutta l'attività. Per questo motivo, sono state prima testate diverse concentrazioni per determinare la concentrazione ottimale per ottenere questi risultati. Queste concentrazioni sono state utilizzate anche per determinare se il comportamento mostrava dipendenza dalla dose. In secondo luogo, il test di Golgi è stato ottimizzato per la perdita di tessuto. Dopo il montaggio sul vetrino utilizzando la soluzione C, il tessuto cadrebbe durante il processo di colorazione. Sono stati incorporati vetrini rivestiti di gelatina e i vetrini sono stati maneggiati con cura durante il processo di colorazione; Queste due modifiche hanno ridotto al minimo la perdita di tessuto. Successivamente, per ottenere le sezioni trasversali, le planarie venivano posizionate in piano in uno stampo temporaneo, congelate nel criostato e quindi montate sul mandrino perpendicolarmente alla loro posizione originale in modo che le sezioni trasversali potessero essere tagliate. Per quanto riguarda il test di immunofluorescenza, è stato necessario determinare la concentrazione ottimale dell'anticorpo. Si consiglia una diluizione seriale per determinare la concentrazione di diluizione ottimale. Fortunatamente, le raccomandazioni del produttore hanno funzionato bene per questo test, quindi non è stata necessaria una diluizione seriale. Questo protocollo utilizzava il latte come tampone di blocco in quanto si tratta di un'opzione più economica e conveniente e funziona altrettanto bene come tampone 23,24,25. Infine, è stata necessaria la risoluzione dei problemi per gli artefatti video; le planarie esposte a 2 mM di pilocarpina sono state escluse a causa di interruzioni del tracciamento dovute al movimento del contenitore, problemi di illuminazione e cambiamenti di angolazione.
Come per qualsiasi procedura, ci sono delle limitazioni. Sebbene le planarie mostrino percorsi neuronali simili a quelli degli esseri umani, sono invertebrati e mancano della complessità del cervello dei mammiferi26. Pertanto, i risultati osservati nelle planarie potrebbero non essere direttamente correlati con gli esseri umani. In secondo luogo, questo test consente la quantificazione dei neuroni ma non consente l'analisi della morfologia dei neuroni e dei loro dendriti, che è spesso diagnostica nei pazienti con epilessia 15,19. I risultati di questa ricerca, quindi, servono solo come analisi preliminare per l'epilessia umana.
La quantificazione delle planarie pilocarpine 0 mM e 6 mM nella Figura 4 ha implicazioni significative nel determinare se le planarie hanno avuto convulsioni. Analizzando e confrontando attentamente i valori ottenuti dai gruppi sperimentale e di controllo, è emersa una differenza statisticamente significativa tra i due gruppi. Ciò suggerisce che la pilocarpina applicata al gruppo sperimentale potrebbe aver contribuito direttamente al comportamento osservato nelle planarie. L'integrazione di ulteriori miglioramenti nel software di analisi video potrebbe anche migliorare l'accuratezza e l'affidabilità dei dati raccolti dalle osservazioni delle planarie. Tale software potrebbe automatizzare il tracciamento e la quantificazione dei modelli di movimento, fornendo misurazioni oggettive di movimenti come l'oscillazione dorsale e riducendo la dipendenza dalla sola qualità video per queste osservazioni.
Gli studi attuali hanno dimostrato un comportamento simile a una crisi epilettica nelle planarie; Tuttavia, per quanto ne sappiamo, il movimento di espansione dorsale oscillante non è stato notato 9,10,11. Altri comportamenti osservati, come la forma a C, sono coerenti con la ricerca attuale 9,10,11,12. Saggi di immunofluorescenza sono stati eseguiti su planarie e i risultati sono coerenti con questo test20,27; tuttavia, per quanto ne sappiamo, una colorazione di Golgi non è mai stata eseguita prima sulle planarie e l'ottimizzazione di questa colorazione può fornire l'opportunità di analizzare la morfologia neuronale. Questo può, a sua volta, fornire informazioni sulla fisiopatologia dell'epilessia. È già stato dimostrato che la pilocarpina induce un comportamento simile alle convulsioni nelle planarie. Con ulteriori modifiche e ripetizioni, questo test ha il potenziale per essere utilizzato nello screening antidroga per i farmaci antiepilettici.
Divulgazioni
Gli autori non hanno nulla da dichiarare.
Riconoscimenti
Vogliamo ringraziare l'EVMS Research Incentive Fund (PI: A.E. Musto) e il Dr. Jorge Jacot per i suoi utili suggerimenti sull'ottimizzazione del protocollo di immunofluorescenza.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | |||
| 4% paraformaldehyde solution | Himedia | TCL119 | |
| Aqueous mounting media | Clini Sciences | NB-47-02240-30ML | |
| Beakers (one for each concentration tested) | |||
| Carolina Springwater | carolina | 132450 | |
| Cryostat | |||
| Diluted primary and secondary antibodies | |||
| Ethanol (100%) | sigma Aldrich | ||
| EthosVision XT 16 | noldus | ||
| Fiji Version 2.9.0 | |||
| Gelatin-coated slides | sigma Aldrich | 643203 | |
| Golgi Antibody 1H6 | DSHB | AB_2619608 | |
| Golgi stain kit_ | Neuroscience Associate | PK 401/401A | |
| Hydrogen Peroxide | |||
| Methanol | |||
| Mounting media | thermo fischer scientific | ||
| OCT compound | |||
| PBS buffer | sigma Aldrich | P4417 | |
| Powdered Milk | |||
| Tin foil | |||
| Transfer pipettes | |||
| Xylene |
Riferimenti
- World Health Organization. . Epilepsy. , (2024).
- Dalic, L., Cook, M. J. Managing drug-resistant epilepsy: challenges and solutions. Neuropsychiatr Dis Treat. 12, 2605-2616 (2016).
- Mayo Clinic. . Seizures - Symptoms and causes. , (2023).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. J Exp Biol. 216 (20), 3799-3810 (2013).
- Moreira-Lobo, D. C., et al. Eugenol modifies the excitability of rat sciatic nerve and superior cervical ganglion neurons. Neurosci Lett. 472 (3), 220-224 (2010).
- Johan Arief, M. F., Choo, B. K. M., Yap, J. L., Kumari, Y., Shaikh, M. F. A systematic review on non-mammalian models in epilepsy research. Front Pharmacol. 9, 655 (2018).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci U S A. 100, 7666-7671 (2003).
- Wu, J. P., Lee, H. L., Li, M. H. Cadmium neurotoxicity to a freshwater planarian. Arch Environ Contam Toxicol. 67 (4), 639-650 (2014).
- Kim, A., Rawls, S. M. Nicotine-induced C-shape movements in planarians are reduced by antinociceptive drugs: Implications for pain in planarian paroxysm etiology. Brain Res. 1778, 147770 (2022).
- Reho, G., Lelièvre, V., Cadiou, H. Planarian nociception: Lessons from a scrunching flatworm. Front Mol Neurosci. 15, 935918 (2022).
- Pagán, O. R., et al. Planarians require an intact brain to behaviorally react to cocaine, but not to react to nicotine. Neuroscience. 246, 265-270 (2013).
- Raffa, R. B., Holland, L. J., Schulingkamp, R. J. Quantitative assessment of dopamine D2 antagonist activity using invertebrate (Planaria) locomotion as a functional endpoint. J Pharmacol Toxicol Methods. 45 (3), 223-226 (2001).
- Bhatt, P., Reitz, A. B., Tallarida, C. Mephedrone ("bath salt") pharmacology: insights from invertebrates. Neuroscience. 208, 79-84 (2012).
- Neufeld, T., Carniello, T., Dotta, B. A single hypoxic event ameliorates pilocarpine-induced hyperkinetic movements in Planaria. Nat Sci. 14, 149-156 (2022).
- Rossini, L., et al. Dendritic pathology, spine loss, and synaptic reorganization in human cortex from epilepsy patients. Brain. 144 (1), 251-265 (2021).
- Owuor, K., et al. LGI1-associated epilepsy through altered ADAM23-dependent neuronal morphology. Mol Cell Neurosci. 42 (4), 448-457 (2009).
- Dubey, V., et al. Dendritic reorganization in the hippocampus, anterior temporal lobe, and frontal neocortex of lithium-pilocarpine induced Status Epilepticus (SE). J Chem Neuroanat. 133, 102329 (2023).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Musto, A. E., Walker, C. P., Petasis, N. A., Bazan, N. G. Hippocampal neuro-networks and dendritic spine perturbations in epileptogenesis are attenuated by neuroprotectin D1. PLoS One. 10 (1), e0116543 (2015).
- Omuro, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15 (2), (2015).
- Keenan, C. L., et al. Cytoarchitecture of primitive brains: Golgi studies in flatworms. J Comp Neurol. 195, 4 (1981).
- Pronin, A. N., Wang, Q., Slepak, V. Z. Teaching an old drug new trick: Agonism, antagonism, and biased signaling of pilocarpine through M3 muscarinic acetylcholine receptor. Mol Pharmacol. 92 (5), 601-612 (2017).
- Im, K., Mareninov, S., Diaz, M. F. P., Yong, W. H. An introduction to performing immunofluorescence staining. Methods Mol Biol. 1897, 299-311 (2019).
- Vogt, R. V., Phillips, D. L., Henderson, L. O., Whitfield, W., Spierto, F. W. Quantitative differences among various proteins as blocking agents for ELISA microtiter plates. J Immunol Meth. 101 (1), 43-50 (1987).
- Duhamel, R. C., Johnson, D. A. Use of nonfat dry milk to block nonspecific nuclear and membrane staining by avidin conjugates. J Histochem Cytochem. 33 (7), 711-714 (1985).
- Chen, T. S., Huang, T. H., Lai, M. C., Huang, C. W. The role of glutamate receptors in epilepsy. Biomedicines. 11 (3), 783 (2023).
- Kreshchenko, N. Immunocytochemical identification of serotoninergic neurons in Planaria Girardia tigrina. Biochem. Moscow Suppl Ser A. 11, 68-76 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon