Method Article
Planaire comme modèle animal pour les crises aiguës expérimentales
Dans cet article
Résumé
Les crises ont un impact négatif sur diverses fonctions et la qualité de vie. Les vers Planaria ont été exposés à des concentrations variables de chimioconvulsivants afin d’évaluer leurs phénotypes de convulsions et leur motilité perturbatrice. Cette étude propose d’utiliser les vers planaires comme modèle pour les crises aiguës chez l’homme et revêt une importance dans le développement de médicaments contre l’épilepsie.
Résumé
L’épilepsie est l’un des troubles neurologiques les plus répandus caractérisés par des crises spontanées récurrentes. Les crises représentent une manifestation clinique d’une activité cellulaire neurale incontrôlée et excessivement synchronisée. L’étendue des lésions cérébrales causées par les crises dépend de leur durée et de leur intensité. Malheureusement, il n’existe pas de remède efficace contre l’épilepsie. Le but de cette étude est d’évaluer si le ver planaire Dugesia dorotocephala pourrait servir de modèle pour aider à identifier et à développer des traitements de l’épilepsie pouvant cibler les crises aiguës. Actuellement, divers modèles, tels que les modèles marins, sont utilisés pour évaluer les médicaments anticonvulsivants (ASM). Cependant, ils sont très coûteux et il y a des problèmes éthiques. Par ailleurs, les modèles d’invertébrés offrent une opportunité de recherche rentable dans le processus de découverte de médicaments pour l’ASM. Les planaires appartiennent à la famille des vers plats et habitent les environnements marins d’eau douce et terrestres. Dugesia dorotocephala est l’espèce dominante de planaires aquatiques en Amérique du Nord. D. dorotocephala se présente comme un modèle d’invertébré viable pour les études sur l’épilepsie en raison de son rapport coût-efficacité, de ses neurones semblables à ceux des vertébrés et de ses comportements quantifiables, contrairement à d’autres invertébrés ou animaux plus grands. Ils ont été utilisés dans diverses études de pharmacologie et de toxicologie environnementale liées à l’âge, à la mémoire et à la régénération. Dans cette étude, les planaires ont été exposés à différentes concentrations de pilocarpine, un chimioconvulsivant commun pour étudier leur comportement lors de l’exposition. Suite à l’observation, les planaires ont été euthanasiés et conservés dans du formaldéhyde ou une solution de Golgi pour une évaluation neurohistologique. Six phénotypes comportementaux distincts ont été observés dans les planaires : oscillations dorsales, oscillations de la tête, expansion dorsale de la queue, forme en C, battement de la tête et battement de la queue. Les fréquences d’oscillation dorsale étaient significativement plus élevées chez les groupes expérimentaux par rapport au groupe témoin et présentaient une dépendance à la dose. De plus, la pilocarpine a perturbé la motilité des planaires. Les crises induites par la pilocarpine dans les planaires peuvent servir de modèle pour évaluer les crises aiguës et les médicaments anticonvulsivants, ce qui est essentiel dans le développement d’interventions thérapeutiques pour les patients humains souffrant d’épilepsie.
Introduction
L’épilepsie, caractérisée par deux crises ou plus dans les 24 heures sans cause apparente, touche ~50 millions de personnes dans le monde1. Parmi eux, 10 à 15 millions de personnes seraient atteintes d’épilepsie résistante aux médicaments2. Par conséquent, la recherche de médicaments contre l’épilepsie est cruciale. La condition implique de brefs épisodes de mouvement involontaire partiel ou généralisé, allant du regard vide à la rigidité et aux tremblements du corps, et est liée à une augmentation de l’activité électrique dans le cerveau3.
Historiquement, la recherche sur l’épilepsie s’est appuyée sur des rongeurs et d’autres mammifères en raison de leurs similitudes évolutives avec les humains. Cependant, ces méthodes peuvent prendre du temps et être coûteuses, ce qui nécessite une approche alternative 4,5. Des créatures non mammifères comme les mouches des fruits, les sangsues, les têtards, les poissons-zèbres et les vers ronds ont été utilisées dans des études et ont montré des résultats prometteurs6. De plus, il a été démontré que les planaires pouvaient fournir un modèle d’étude génomique comparative entre les génomes des invertébrés et des humains, ainsi que la capacité de tester des médicaments pro-convulsivants, des médicaments anticonvulsivants (ASM) et des modèles comportementaux6. Les planaires (Phylum Platyhelminthes), connus sous le nom de vers plats et membres de la classe des Turbellaria, sont principalement réputés pour leurs capacités de régénération ; Cependant, la présente étude se concentre sur leur réponse aux substances provoquant des convulsions.
Les planaires partagent des mécanismes neurologiques fondamentaux avec les humains, tels que la réactivité à la sérotonine et à la dopamine, montrant une similitude de 95 % avec les gènes liés au système nerveux dans le cerveau des mammifères et possédant une structure cérébrale reconnaissable7. De plus, ils présentent des mouvements observables dans des conditions de laboratoire et sont rentables, rapides et éthiques par rapport aux rongeurs ou à d’autres mammifères. Ces comportements observables, tels que les mouvements en forme de vis, de C et de noix, ont été largement documentés depuis des décennies et sont associés à des substances comme la cocaïne, la nicotine, la dopamine et la pilocarpine 7,8,9,10,11,12,13,14. Par conséquent, les planaires apparaissent comme un modèle viable pour la recherche sur les médicaments contre l’épilepsie chez l’homme.
Cette méthode vise à caractériser les neurones des planaires qui ont été exposés à la pilocarpine à l’aide d’une coloration de Golgi. La coloration de Golgi est utilisée pour visualiser les neurones en microscopie optique et a été utilisée pour déterminer si un changement de morphologie est lié aux crises 15,16,17. La littérature actuelle n’a aucune preuve d’une coloration de Golgi réalisée sur des cerveaux planaires. Bien que des études antérieures aient documenté les effets pharmacologiques en observant les phénotypes comportementaux, ce manuscrit est le premier à caractériser les neurones des planaires exposés à la pilocarpine à l’aide de la coloration de Golgi11,18. Cette technique s’avère précieuse pour visualiser et comprendre les changements morphologiques associés aux crises. Cette étude a noté une augmentation significative de la fréquence du comportement d’oscillation dorsale chez les vers planaires à mesure que la concentration de pilocarpine était augmentée.
Protocole
REMARQUE : La conception globale de l’expérience est décrite à la figure 1.
1. Dosage du phénotype comportemental
- Préparez des concentrations de 1 mM et 2 mM de pilocarpine dissoute dans l’eau de source et contrôlez avec de l’eau de source uniquement.
- Pipeter 3 mL de chaque solution dans une plaque de 4 x 3 puits, chaque rangée représentant une concentration différente de pilocarpine.
- Placez une Dugesia dorotocephala élevée en laboratoire et âgée d’environ 2 semaines dans chacun des 12 puits à l’aide d’une pipette de transfert dont la pointe est coupée.
REMARQUE : Coupez la pointe de manière à ce que l’extrémité soit suffisamment grande pour s’adapter à la planaire sans l’endommager. - Enregistrez le comportement de la planaire pendant 1 h à l’aide de n’importe quelle caméra qui enregistre bien les comportements et qui est observable à l’œil humain, positionnée sur la plaque 4 x 3 puits dans des conditions normales d’éclairage intérieur.
- Répétez les étapes 1.1 à 1.4 avec des concentrations de 3 mM, 4 mM et 6 mM de pilocarpine dissoute dans de l’eau de source.
2. Analyse de la motilité
REMARQUE : Les comportements des planaires ont été enregistrés dans des puits de 2,5 cm de diamètre. Les enregistrements vidéo d’une durée de 1 h ont été divisés en parties de 30 minutes et recadrés à l’aide d’un logiciel commercial pour analyser les planaires individuellement.
- Commencez une nouvelle expérience à l’aide d’un logiciel d’analyse comportementale automatisée. Ouvrez le système amélioré de suivi automatisé du comportement. Cliquez sur Nouveau sous Nouvelle expérience. Nommez l’expérience.
- Configurez les paramètres expérimentaux comme décrit ci-dessous.
- Cliquez sur Paramètres du test dans l’invite du menu. Assurez-vous que les paramètres sont définis par défaut : source vidéo (à partir du fichier vidéo), Nombre d’arènes (1), Entités suivies (détection du point central), Technique de détection des points du corps (basée sur les contours), Options d’analyse (aucune), Unités (cm, s, deg).
- Configurez les paramètres de l’arène comme décrit ci-dessous.
- Cliquez sur Paramètres de l’arène sous l’onglet Paramètres de l’arène dans le panneau de configuration en haut à gauche. Lorsque vous êtes invité à télécharger une vidéo, sélectionnez les séquences enregistrées de planaria à partir de l’emplacement du fichier stocké. Une fois la vidéo sélectionnée, cliquez sur Saisir.
- Suivez les instructions dans le panneau supérieur droit de l’écran. Cliquez sur 1. Dessinez l’échelle pour calibrer. Sur l’image vidéo du puits, faites glisser une ligne d’échelle d’un bord à l’autre du puits de l’échantillon. Entrez la distance réelle du puits (2,5 cm).
- Cliquez sur 2. Sélectionnez Forme et dessiner l’arène. Assurez-vous que Arena 1 est sélectionné dans le panneau de droite. Déplacez le curseur de la souris en haut au milieu de l’écran et cliquez sur l’icône du cercle.
- Créez un cercle dans l’image vidéo téléchargée en le faisant glisser d’un périmètre de l’arène à un autre. Assurez-vous que l’aréna est dans la zone orange. Ajustez la forme pour qu’elle s’adapte à l’arène. Assurez-vous que l’étiquette Arena 1 se trouve à l’intérieur des limites de l’arena.
- En bas du panneau de droite, modifiez la forme, la taille et la position (Largeur : 2,75, Hauteur : 2,75, X : 0, Y : 0) aux mesures souhaitées.
- Cliquez sur 3. Sélectionnez Forme et dessiner des zones (facultatif). Le groupe de zone 1 dans le panneau de droite sera maintenant sélectionné. Déplacez le curseur de la souris en haut au milieu de l’écran et sélectionnez l’icône du cercle. Créez un cercle plus petit dans l’image de l’arène en le faisant glisser à l’intérieur.
- Dans le panneau inférieur droit, modifiez Forme, Taille et Position aux mesures souhaitées (Largeur : 1,75, Hauteur : 1,75, X : 0, Y : 0).
- Cliquez sur le bouton Ajouter une étiquette de zone dans la même barre de menu que le cercle. Cliquez au centre du cercle plus petit. Cliquez avec le bouton droit de la souris sur la balise Zone 1 dans le panneau de droite pour renommer le centre de zone.
- Cliquez à nouveau sur le bouton Ajouter une étiquette de zone . Cliquez sur le périmètre de l’arène, à l’extérieur de la zone centrale. Cliquez avec le bouton droit de la souris sur la zone 2 dans le panneau de droite pour renommer la zone Périmètre.
- Cliquez sur 4. Validez la configuration pour vous assurer que les paramètres de l’arène sont valides.
- Configurez les paramètres de contrôle de la version d’évaluation comme décrit ci-dessous.
- Cliquez sur Paramètres de contrôle d’essai sous l’onglet Paramètres de contrôle d’essai dans le panneau de configuration en haut à gauche. Six cases de composants apparaîtront. Cliquez sur Paramètres dans la quatrième case intitulée Condition, qui comprend Temps (1) et Temps infini (condition jamais remplie).
- Cliquez sur la bulle à côté de Après, puis saisissez la durée (30 min) dans la zone de texte de droite. Il y aura également un menu déroulant à droite de la zone de texte de l’heure pour sélectionner entre h, min et s.
REMARQUE : Les paramètres de détection pour les séquences enregistrées dépendent de la qualité de la séquence. Les méthodes suivantes peuvent être manipulées pour observer les meilleurs résultats, spécifiques à chaque séquence.
- Configurez les paramètres de détection comme décrit ci-dessous.
- Cliquez sur Paramètres de détection sous l’onglet Paramètres de détection dans le panneau de configuration en haut à gauche. Cliquez sur le bouton Sélectionner une vidéo dans le panneau supérieur droit. Téléchargez la vidéo souhaitée pour baser les paramètres de détection.
- Cliquez sur l’onglet Avancé dans le même panneau de droite. Maintenant, sous l’onglet Méthode, assurez-vous qu’il est défini sur Mise à l’échelle des gris. Modifiez la plage (0 - 100).
- Sous l’onglet Lissage du panneau de droite, assurez-vous que le lissage des pixels vidéo est Aucun, que la correction des images perdues est désactivée et que la réduction du bruit de la piste est désactivée.
- Sous l’onglet Contour du sujet du panneau de droite, ajustez le réglage de la séquence et définissez Érosion, Dilatation et Érosion sur 1, 1 et 0, respectivement.
- Sous l’onglet Taille de l’objet, remplacez Minimum (0) et Maximum (125000). Cliquez sur Enregistrer en bas à droite.
- Mettez en place une séquence d’essais vidéo pour l’observation comme décrit ci-dessous.
- Cliquez sur Liste d’essai dans le panneau de configuration en haut à gauche. Téléchargez des séquences vidéo d’échantillons dans l’ordre souhaité en cliquant sur les points de suspension sous la colonne Fichier vidéo du système. Pour ajouter d’autres essais, cliquez sur Ajouter des essais en haut à gauche du panneau Liste des essais.
- Configurez les paramètres d’acquisition.
- Cliquez sur Acquisition sous l’onglet Acquisition en haut à gauche. Sous Paramètres d’acquisition dans le panneau de droite, cliquez sur Suivre tous les essais planifiés.
- Pour commencer l’acquisition, cliquez sur le bouton rouge en bas au milieu de l’écran à côté de Prêt pour le démarrage. L’acquisition vidéo va maintenant commencer et prendre un certain temps, en fonction de la quantité et de la durée des essais vidéo téléchargés.
- Configurez les paramètres d’analyse comme décrit ci-dessous.
- Cliquez sur Profil d’analyse sous l’onglet Analyse du panneau de gauche. Cliquez sur les variables dépendantes sélectionnées par défaut, Vélocité et Distance déplacée, et supprimez-les.
- Dans le panneau des variables dépendantes, sous l’onglet Emplacement, cliquez sur Dans la zone. Cliquez sur les cases Centre et Zone de périmètre pour qu’elles soient cochées.
- Cliquez sur l’onglet Statistiques d’essai dans la zone Inzone. Décochez la case Latency to First. Cliquez sur Ajouter.
- Sous l’onglet Corps, cliquez sur le bouton Rotation. Cliquez dans le sens des aiguilles d’une montre et laissez le seuil (50,00 degrés) et la distance minimale déplacée (2,00 cm) par défaut. Cliquez sur Ajouter.
- Cliquez à nouveau sur le bouton Rotation , puis sur Dans le sens inverse des aiguilles d’une montre. Cliquez sur Ajouter.
- Analysez les pistes comme décrit ci-dessous.
- Sous l’onglet Résultats, cliquez sur Suivre la visualisation. Dans le panneau de droite, sous Filtre, décochez Dernier. La barre de contrôle de lecture dans le panneau central inférieur de l’écran illustrera la visualisation des traces des échantillons à des moments précis de l’observation.
- Analysez et exportez les résultats. Les résultats se trouvent dans le reste des onglets du panneau inférieur gauche. Pour exporter des données, cliquez sur Données brutes ou Statistiques sous Exporter dans le panneau de gauche.
3. Euthanasie
- Préparez une solution de 22 mM d’eugénol dans de l’eau de source. Placez les planaires dans des boîtes de Pétri avec 9 ml de solution d’eugénol à 22 mM à l’aide de la pipette de transfert coupée, en gardant chaque concentration séparée. Euthanasier pendant 3 minutes ou jusqu’à ce que tout mouvement ait cessé.
- Placez les planaria dans une boîte de Pétri fraîche remplie de 9 ml d’eau de source pour rincer 1x-2x, et placez-les dans la solution de Golgi décrite ci-dessous (coloration de Golgi) ou dans le paraformaldéhyde à 4 % (coloration par immunofluorescence).
4. Analyse histologique
- Coloration de Golgi
- Une fois les planaires euthanasiés, placez-les dans un bécher ou une boîte de Pétri remplie d’un mélange 1:1 des solutions A et B du kit de coloration de Golgi. Remplacez les solutions A et B le lendemain en plaçant les planaires dans un nouveau bécher rempli d’un mélange de solutions A et B.
- Laisser les planaires reposer pendant 1 semaine dans les solutions A et B.
- Retirez les planaires des solutions A et B et placez-les dans la solution C dans un autre bécher. Remplacez la solution C le lendemain. Laisser reposer les planaires pendant au moins 72 h et jusqu’à 1 semaine dans la solution C.
- Retirez les planaires de la solution C à l’aide d’une pipette de transfert et intégrez-les en plaçant une petite quantité de composé OCT sur un mandrin, en ajoutant les planaires, puis en entourant les planaires avec du composé OCT. Découpez transversalement des planaires en sections de 5 μM avec la machine cryostat à -24° C.
- Montez le planaire sur des lames recouvertes de gélatine à l’aide d’une pipette de transfert et de la solution C et laissez-le sécher dans l’obscurité à RT jusqu’à 3 jours.
- Stachez les lames à l’aide de la solution de coloration (1 partie de solution D, 1 partie de solution E, 2 parties d’eau de source) en immergeant les lames dans des béchers avec les solutions suivantes : Solution de coloration pendant 10 min, puis dans l’eau de source 2x pendant 4 min chacune, puis 50 % d’éthanol pendant 4 min, puis 75 % d’éthanol pendant 4 min, puis 95 % d’éthanol pendant 4 min, puis en 100 % éthanol 4x pendant 4 min, et enfin en xylène 3x pendant 4 min.
- Lames de lamelle avec des supports de montage histologiques et observez les tissus sous microscopie à fond clair.
- Coloration par immunofluorescence
- Après l’euthanasie des planaires, les placer dans du paraformaldéhyde à 4 % pendant au moins 24 h. Il peut également être conservé dans un réfrigérateur après cette étape.
- Transférez le planaria à 20 % de saccharose à partir de 4 % de PFA et laissez-le pendant 1 jour. Retirez les planaires du saccharose et placez-les dans le tampon PBS pendant 5 min.
- Rincez avec 3-4 lavages de tampon PBS et transférez à 20 % de saccharose pour le stockage jusqu’au moment de teindre.
- Placer dans des solutions d’alcool à 70 %, 95 % et 100 % pendant 1 minute chacune. Placer dans le xylène pendant 1 min.
- Placer dans de l’alcool à 95 % et à 70 % pendant 1 min chacun. Placer dans le tampon PBS 3x pendant 5 min chacun. Placer dans une solution de méthanol 60:40 et de peroxyde d’hydrogène pendant 10 à 15 min.
- Rincer au PBS 3x pendant 5 min chacun. Ajouter le volume de paraformaldéhyde à 4 % utilisé précédemment en 4.2.1 dans ce tampon PBS.
- Rincer au PBS 3x pendant 5 min chacun. Bloquer pendant 1 h avec du lait en poudre, en recouvrant les planaires avec.
- Diluer l’anticorps primaire (1H6) à 5 μg/mL avec du PBS et incuber les lames pendant la nuit à 4 °C dans la solution d’anticorps. Le lendemain, rincer les planaires dans du PBS pendant 10 min.
- Diluer l’anticorps secondaire (IgG anti-souris de chèvre) à 1 μg/mL dans du PBS et incuber les lames pendant la nuit à RT dans la solution d’anticorps. Le lendemain, rincer les planaires dans du PBS pendant 15 min.
REMARQUE : Différents anticorps ont des concentrations optimales différentes ; Déterminez cela avant de commencer l’expérience. - Montez l’ensemble des planaires sur la lame, recouvrez d’une lamelle, scellez avec un milieu de montage aqueux et observez le tissu au microscope fluorescent.
5. Analyse d’images
- Ouvrez l’application logicielle d’analyse d’images open source. Installez le plug-in colour_deconvolution2.jar sur l’application logicielle d’analyse d’images open source en faisant glisser le plug-in sur l’application.
- Sélectionnez l’image à analyser et faites-la glisser vers l’application logicielle d’analyse d’images open source. Allez dans l’onglet Image. Cliquez sur couleur. Cliquez sur Color Deconvolution2 v2.1.
- Dans l’option vecteurs, cliquez sur H DAB. Dans l’option de sortie, cliquez sur 8bit_Transmittance. Assurez-vous que les options LUT simulées, Produit vectoriel pour la couleur 3, Afficher les matrices et Masquer la légende sont toutes sélectionnées. Cliquez sur OK.
- Sélectionnez l’image en noir et blanc pour vous assurer que l’application logicielle d’analyse d’images open source peut analyser efficacement l’image.
- Allez dans l’onglet Image. Cliquez sur Ajuster. Cliquez sur Seuil. Ajustez le seuil de sorte que la coloration DAB ou le premier plan soit de couleur rouge avec un fond blanc. Assurez-vous que le seuil est le même pour chaque image si plusieurs images sont quantifiées.
- Cliquez sur Analyser. Cliquez sur Définir les mesures. Sélectionnez Zone, Valeur de gris min et max, Limite au seuil, Étiquette d’affichage, Médiane et Valeur de gris moyenne. Cliquez sur OK. Cliquez sur Analyser. Cliquez sur Mesurer. Obtenez le résultat.
- Répétez les étapes 1.2 à 1. Jusqu’à ce que toutes les images soient quantifiées. Cliquez sur l’image des résultats. Cliquez sur Fichier. Cliquez sur Enregistrer sous. Enregistrez le fichier sous forme de tableur et affichez les données sur le tableur.
6. Analyse statistique
- Calculez la moyenne et les erreurs-types de la moyenne (SEM) pour le comportement de la planaire à l’aide de l’analyse de variance (ANOVA) et du test t de Student pour la signification statistique (p < 0,05).
Résultats
Le comportement suivant a été observé chez les planaires exposés à des concentrations variables de pilocarpine :
Oscillations dorsales : une formation en forme de bulle qui se déplace de l’extrémité crânienne du corps du planaire à l’extrémité caudale.
Oscillations de la tête : formation en forme de bulle par la tête du planaire qui forme une apparence de têtard.
Forme en C : la tête se déplace dans le sens des aiguilles d’une montre et la queue se déplace dans le sens inverse des aiguilles d’une montre pour former un C.
Coup de tête : la tête du planaire se balance brusquement vers la gauche ou la droite.
Oscillation dorsale de la queue : formation en forme de bulle par la queue du planaire qui forme une apparence de têtard.
Coup de queue : la queue du planaire se déplace brusquement vers la gauche ou la droite.
Nous avons observé que la fréquence des comportements augmentait avec l’augmentation de la concentration de pilocarpine. Les résultats sont le nombre de comportements particuliers remarqués dans l’ensemble de l’enregistrement. Les oscillations dorsales à 6 mM de pilocarpine (moyenne = 16 ± 4,10, p < 0,0001) et 4 mM (moyenne = 11,25 ± 2,17, p < 0,0001) étaient statistiquement significatives par rapport au témoin (moyenne = 0 ; Figure 2A). Ce mouvement présentait un comportement dose-dépendant (R2 = 0,87 ; Figure 2G). De plus, il a fallu moins de temps aux planaires pour présenter ce comportement lorsqu’ils étaient exposés à 6 mM de pilocarpine par rapport à d’autres concentrations.
Pour les oscillations de la tête, des différences significatives ont été observées entre 6 mM et le témoin (moyenne = 10,25 ± 3,57, p = 0,0070), 3 mM et le témoin (moyenne = 1,50 ± 0,96, p = 0,0187), et 1 mM et le témoin (moyenne = 2,75 ± 1,80, p = 0,0405). À 4 mM de pilocarpine, aucune différence statistique n’a été observée (moyenne = 6,75 ± 3,4004 ; Figure 2B).
Des différences significatives dans le phénotype en forme de C ont été observées entre le témoin et 6 mM (moyenne = 8,50 ± 2,47, p = 0,0034), 1 mM (moyenne = 5,75 ± 0,48, p = 0,0368), et entre 6 mM et 2 mM (moyenne = 3,75 ± 1,28, p = 0,0454). Aucune différence statistique n’a été observée entre 3 mM de pilocarpine (moyenne = 3,50 ± 1,8484) et 4 mM de pilocarpine (moyenne = 5,00 ± 2,6771 ; Figure 2D).
Une différence significative dans le phénotype du coup de tête a été observée entre 6 mM et le témoin (moyenne = 6,50 ± 1,19, p = 0,0072) et 6 mM et 4 mM (moyenne = 1,75 ± 0,85, p = 0,0416). Il n’y avait pas de différences statistiques entre 1 mM de pilocarpine (moyenne = 4,250 ± 1,2500), 2 mM de pilocarpine (moyenne = 3,8750 ± 1,6630) et 3 mM de pilocarpine (moyenne = 2,75000 ± 1,0308 ; Figure 2E).
Des différences significatives dans le phénotype des oscillations dorsales de la queue ont été observées entre 4 mM et le témoin (moyenne = 5,50 ± 2,63, p = 0,0087), 2 mM (moyenne = 0,50 ± 0,19, p = 0,0063), et entre 6 mM et le témoin (moyenne = 5,00 ± 2,45, p = 0,0157), 2 mM (moyenne = 0,50 ± 0,19, p = 0,0125) et 1 mM (moyenne = 0,75 ± 0,48, p = 0,0366). Il n’y avait pas de différences statistiques à 3 mM de pilocarpine (moyenne = 1,7500 ± 0,250 ; Figure 2C).
Pour le phénotype du coup de queue, des différences significatives ont été observées entre 6 mM et le témoin (moyenne = 15,25 ± 7,20, p = 0,0037), 4 mM (moyenne = 2,50 ± 0,87, p = 0,0125), 1 mM (moyenne = 4,50 ± 1,55, p = 0,0318) et 2 mM de pilocarpine (moyenne = 4,63 ± 1,67, p = 0,0158). Il n’y avait pas de différences statistiques à 3 mM de pilocarpine (moyenne = 7,2500 ± 3,5444 ; Graphique 2F)
Ces résultats soutiennent que la pilocarpine induit différents types de comportement chez les planaires. Il est reconnu que les oscillations dorsales représentent un comportement fiable après une exposition à la pilocarpine.
En utilisant le suivi automatique de la motilité (Figure 3A), nous avons observé que les planaires des solutions 3 mM passaient plus de temps au centre des puits que le groupe témoin (Contrôle, moyenne = 101,938 ± 32,219 ; 3 mM Pilocarpine, moyenne = 187,966 ± 24,908, 6 mM Pilocarpine, moyenne = 176,467 ± 22,980 ; Figure 3B).
Les planaires des solutions 6 mM ont passé plus de temps dans le périmètre des puits que le groupe 3 mM et le groupe témoin, avec une différence significative entre 6 mM et le groupe témoin (Contrôle, moyenne = 708,958 ± 59,506 ; 3 mM Pilocarpine, moyenne = 881,562 ± 80,604 ; moyenne = 968,712 ± 84,267, p = 0,0241 ; Figure 3C).
Les planaires traités avec 3 mM et 6 mM de pilocarpine ont également pénétré plus fréquemment dans les zones centrales que dans les zones périphériques que le groupe témoin (témoin, moyenne = 104,250 ± 11,436 ; 3 mM de pilocarpine, moyenne = 159,625 ± 13,368 ; 6 mM de pilocarpine, moyenne = 132,500 ± 28,126 ; Figure 3D).
Bien qu’il s’agisse d’un échantillon de petite taille, le graphique quantile normal généré à l’aide d’un logiciel d’analyse statistique démontre que la plupart des valeurs de données se situent près de la ligne rouge continue. Les valeurs des données se situent également dans les limites de confiance en pointillés rouges, ce qui indique une distribution normale. Un logiciel d’analyse statistique a été sélectionné pour cette analyse car il offre une combinaison puissante de visualisation de données et d’outils statistiques. Le logiciel est particulièrement efficace pour créer des graphiques quantiles, qui sont essentiels pour évaluer visuellement la normalité dans de petits ensembles de données. Son interface intuitive et ses tests statistiques intégrés, tels que l’ANOVA, le rendent idéal pour exécuter rapidement des analyses et garantir la précision des représentations graphiques, ce qui facilite l’interprétation robuste des données 9,13,14,19.
Des différences significatives ont été observées dans les durées moyennes du périmètre entre le groupe témoin et le groupe 6 mM. Cette étude fournit des informations précieuses sur les changements de motilité dans les planaires lorsqu’ils sont exposés à différentes concentrations de solution. L’analyse statistique a révélé des différences significatives dans les durées moyennes du périmètre entre le groupe témoin et le groupe 6 mM, ce qui a permis de mieux comprendre les changements de motilité dans les planaires lorsqu’ils sont exposés à différentes concentrations de solution.
Pour appuyer l’analyse comportementale, l’analyse histologique a été réalisée à l’aide de deux méthodes. La coloration de Golgi a été utilisée pour visualiser les neurones du système nerveux planaire, afin de déterminer si le comportement semblable à une crise avait un effet sur la présence ou la morphologie des neurones. Deuxièmement, pour confirmer qu’il s’agissait bien de neurones observés, un test immunofluorescent a été réalisé à l’aide d’un anticorps qui reconnaît un antigène présent sur les projections axonales des neurones sensoriels20. Des études histologiques utilisant la coloration de Golgi et l’immunofluorescence à l’aide d’anti-1H6 ont montré le potentiel d’identifier et de quantifier les nerfs en utilisant à la fois des coupes transversales et des préparations entières (Figure 4)21. Le traitement à la pilocarpine (6 mM) a réduit le nombre de structures neurales par rapport au contrôle (contrôle (n = 3) : moyenne = 764,14 ± 260,46 ; pilocarpine (n = 3) : moyenne = 162,12 ± 86,22 ; p < 0,05)

Figure 1 : Aperçu de la procédure expérimentale pour Dugesia dorotocephala. Déroulement général de cette étude. Les planaires sont placés dans diverses concentrations de pilocarpine, et leur comportement est enregistré et analysé. Cette analyse est suivie d’une analyse histologique à l’aide de la coloration de Golgi et d’un test immunofluorescent. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements induits par les pilocarpines dans le mouvement et les oscillations des planaires. (A-F) Changements des mouvements planaires avec l’augmentation des concentrations de pilocarpine, en notant des valeurs statistiquement significatives avec *. Les valeurs individuelles (points noirs), la moyenne (ligne verte), la moyenne d’erreur type (SEM, barre bleue), l’écart type (ligne bleue) et le quartile (boîte rouge) sont notés. (G) Fréquence des oscillations dorsales avec augmentation de la concentration de pilocarpine avec des valeurs individuelles (points verts) et la ligne de meilleur ajustement (noir). R = coefficient de corrélation. L’analyse de la variance a été utilisée pour calculer la signification. Veuillez cliquer ici pour voir une version agrandie de cette figure.
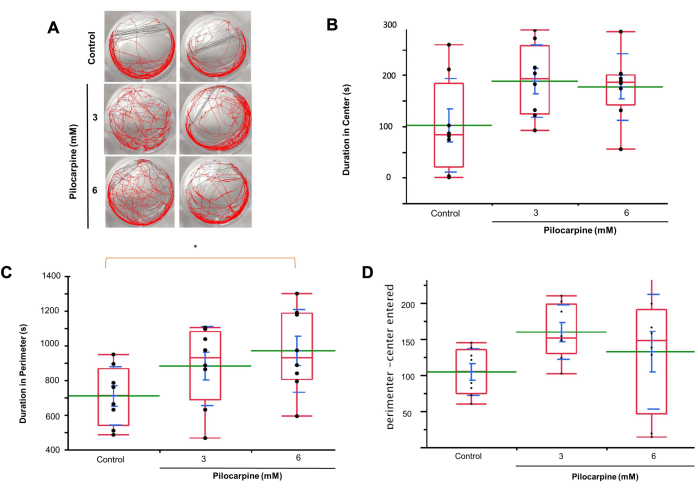
Figure 3 : Comportement des planaires dans les solutions de contrôle et de pilocarpine à l’aide de l’analyse de suivi de mouvement. (A) Observations du comportement planaire dans des solutions de contrôle, 3 mM et 6 mM. (B) Durée du temps passé par les planaires au centre des puits dans les solutions de 3 mM par rapport au groupe témoin. (C) Durée du temps passé par les planaires dans le périmètre des puits dans les solutions de 6 mM par rapport au groupe 3 mM et au groupe témoin. (D) Fréquence d’entrée des planaires dans les zones centrale et périmétrique dans les solutions 3 mM par rapport au groupe témoin. Les données affichent les valeurs individuelles (points noirs), la moyenne (ligne verte), la moyenne de l’erreur type (SEM, barre bleue), l’écart type (ligne bleue) et le quartile (boîte rouge). L’analyse de la variance a été utilisée pour calculer la signification. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Analyse structurelle neurale des planaires. (A) Le graphique représente la structure macroscopique de la planaire mettant en évidence les principales caractéristiques neurologiques, suivant la section transversale de la planaire à travers l’intestin mettant en évidence les structures digestives et musculaires, et la section transversale du cerveau planaire mettant en évidence les structures neurologiques clés. (B) Contrôle par rapport à la structure neuronale de la pilocarpine à l’aide de l’immunofluorescence. L’estimation de la densité nerveuse a diminué (0,16 nerf/pixel dans le groupe témoin à 0,11 nerf/pixel) dans le groupe traité à la pilocarpine. (C) Coupes représentatives de planaires à l’aide de la coloration de Golgi ; 1 : flèche de la tête montrant le cerveau ; 2 : flèche montrant le cordon nerveux ventral ; 3 neurones montrant une saillie (flèche). (D) Notez que les branches latérales (astérisque) et (E) les structures neurales sont réduites chez la pilocarpine. (F) Le nombre de profils de cellules neurales est réduit dans la pilocarpine. Les données affichent les valeurs individuelles (points noirs), la moyenne (ligne verte), la moyenne de l’erreur type (SEM, barre bleue), l’écart type (ligne bleue) et le quartile (boîte rouge). Le test t de Student a été utilisé pour calculer la signification. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude a démontré le comportement induit par la pilocarppine chez les planaires à différentes concentrations. Le comportement le plus pertinent était l’expansion dorsale oscillante, car ce comportement n’a pas été documenté dans d’autres études concernant le comportement convulsif dans les planaires 9,10,11,12. Le mécanisme par lequel la pilocarpine induit des comportements semblables à ceux des crises chez les planaires est encore inconnu. Cependant, cette étude démontre que différents comportements peuvent correspondre à différents degrés d’excitabilité neuronale. On pense que cet effet est causé par l’agonisme des récepteurs muscariniques22.
Les étapes clés du protocole comprenaient la préparation de solutions de pilocarpine pour l’analyse dose-dépendante. En suivant la procédure ici, on s’est assuré que les planaires utilisés dans l’enregistrement comportemental auraient des conditions cohérentes. Le fait de placer les planaires dans des plaques de puits séparées contenant des solutions de pilocarpine ou de l’eau de source a permis d’observer des comportements clés tels que les oscillations dorsales, les mouvements en forme de C et les mouvements de la tête. L’accent mis sur un planaire par plaque de puits a également réduit les erreurs potentielles du logiciel de suivi automatisé pour les enregistrements d’une heure. De plus, il était essentiel de calibrer et d’analyser les séquences vidéo avec des paramètres spécifiques pour quantifier les modèles de mouvement, y compris le temps passé dans les zones centrales par rapport aux zones périmétriques pour l’analyse de la motilité. L’euthanasie pratiquée en rinçant les planaires dans une solution puissante avant de les conserver dans une coloration de Golgi était cruciale pour l’analyse histologique car elle permettait de terminer sans cruauté les planaires et prévenait les changements physiologiques potentiels qui pouvaient se produire dans les organismes et qui pourraient affecter l’intégrité des tissus neuraux. La coloration de Golgi a été réalisée par étapes à l’aide des solutions A, B et C, suivie d’un enrobage et d’une coupe pour examiner les structures neuronales. Cette technique était importante car elle permettait une visualisation détaillée de la morphologie neuronale et permettait d’observer des changements dans les structures neuronales. La coloration par immunofluorescence utilise des anticorps spécifiques pour identifier les marqueurs neuronaux, avec des étapes de lavage et de blocage approfondies pour améliorer la clarté. L’analyse d’images effectuée a utilisé un logiciel pour quantifier les changements neuronaux, assurant des seuils cohérents pour des comparaisons fiables. L’analyse statistique, y compris l’ANOVA et les tests t, évalue les différences significatives dans les comportements et les structures neuronales. Toutes ces étapes fournissent une méthodologie robuste pour évaluer l’activité de type convulsif et sa base neuronale dans les planaires.
Plusieurs facteurs nécessitaient un dépannage. Tout d’abord, une concentration suffisante de pilocarpine était nécessaire pour induire l’activité convulsive, mais ne devait pas être excessivement dommageable de sorte que toute activité était arrêtée. Pour cette raison, plusieurs concentrations ont d’abord été testées afin de déterminer la concentration optimale pour obtenir ces résultats. Ces concentrations ont également été utilisées pour déterminer si le comportement présentait une dépendance à la dose. Deuxièmement, le test de Golgi a été optimisé pour la perte de tissu. Après le montage sur la lame à l’aide de la solution C, le tissu tomberait pendant le processus de coloration. Des lames recouvertes de gélatine ont été incorporées et les lames ont été manipulées avec soin pendant le processus de coloration ; Ces deux modifications ont minimisé la perte de tissus. Ensuite, pour obtenir des sections transversales, les planaires ont été placées à plat dans un moule temporaire, congelées dans le cryostat, puis montées sur le mandrin perpendiculairement à leur position d’origine afin que les sections transversales puissent être coupées. En ce qui concerne le test d’immunofluorescence, la concentration optimale de l’anticorps devait être déterminée. Une dilution en série est recommandée pour déterminer la concentration de dilution optimale. Heureusement, les recommandations du fabricant ont bien fonctionné pour ce test, de sorte qu’une dilution en série n’a pas été nécessaire. Ce protocole utilisait le lait comme tampon de blocage car il s’agit d’une option moins chère et plus abordable qui fonctionne aussi bien qu’un tampon 23,24,25. Enfin, un dépannage était nécessaire pour les artefacts vidéo ; les planaires exposés à 2 mM de pilocarpine ont été exclus en raison de perturbations du suivi dues au mouvement des conteneurs, de problèmes d’éclairage et de changements d’angle.
Comme pour toute procédure, il y a des limites. Bien que les planaires présentent des voies neuronales similaires à celles des humains, ils sont invertébrés et n’ont pas la complexité du cerveau des mammifères26. Par conséquent, les résultats observés chez les planaires peuvent ne pas être directement corrélés avec ceux de l’homme. Deuxièmement, ce test permet de quantifier les neurones mais ne permet pas d’analyser la morphologie des neurones et de leurs dendrites, ce qui est souvent diagnostique chez les patients atteints d’épilepsie15,19. Les résultats de cette recherche ne servent donc que d’analyse préliminaire de l’épilepsie humaine.
La quantification des planaires de pilocarpine 0 mM et 6 mM dans la figure 4 a des implications significatives pour déterminer si les planaires ont subi des convulsions. En analysant et en comparant soigneusement les valeurs obtenues dans les groupes expérimental et témoin, il y avait une différence statistiquement significative entre les deux groupes. Cela suggère que la pilocarpine appliquée au groupe expérimental peut avoir directement contribué au comportement observé dans les planaires. L’intégration d’autres améliorations dans le logiciel d’analyse vidéo pourrait également améliorer la précision et la fiabilité des données recueillies à partir des observations planes. Un tel logiciel pourrait automatiser le suivi et la quantification des modèles de mouvement, fournissant des mesures objectives de mouvements tels que l’oscillation dorsale et réduisant la dépendance à la seule qualité vidéo pour ces observations.
Des études actuelles ont démontré un comportement semblable à celui d’une crise chez les planaires ; Cependant, à notre connaissance, le mouvement oscillant d’expansion dorsale n’a pas été noté 9,10,11. D’autres comportements observés, tels que la forme en C, sont cohérents avec les recherches actuelles 9,10,11,12. Des tests d’immunofluorescence ont été effectués sur des planaires, et les résultats sont cohérents avec ce test20,27 ; cependant, à notre connaissance, une coloration de Golgi n’a jamais été réalisée sur des planaires auparavant, et l’optimisation de cette coloration peut offrir l’opportunité d’analyser la morphologie neuronale. Cela peut, à son tour, fournir des informations sur la physiopathologie de l’épilepsie. Il a déjà été démontré que la pilocarpine induit un comportement semblable à celui des convulsions dans les planaires. Avec d’autres modifications et répétitions, ce test a le potentiel d’être utilisé dans le dépistage de médicaments anticonvulsivants.
Déclarations de divulgation
Les auteurs n’ont rien à déclarer.
Remerciements
Nous tenons à remercier le Fonds d’encouragement à la recherche EVMS (PI : A.E. Musto) et le Dr Jorge Jacot pour ses suggestions utiles concernant l’optimisation du protocole d’immunofluorescence.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | |||
| 4% paraformaldehyde solution | Himedia | TCL119 | |
| Aqueous mounting media | Clini Sciences | NB-47-02240-30ML | |
| Beakers (one for each concentration tested) | |||
| Carolina Springwater | carolina | 132450 | |
| Cryostat | |||
| Diluted primary and secondary antibodies | |||
| Ethanol (100%) | sigma Aldrich | ||
| EthosVision XT 16 | noldus | ||
| Fiji Version 2.9.0 | |||
| Gelatin-coated slides | sigma Aldrich | 643203 | |
| Golgi Antibody 1H6 | DSHB | AB_2619608 | |
| Golgi stain kit_ | Neuroscience Associate | PK 401/401A | |
| Hydrogen Peroxide | |||
| Methanol | |||
| Mounting media | thermo fischer scientific | ||
| OCT compound | |||
| PBS buffer | sigma Aldrich | P4417 | |
| Powdered Milk | |||
| Tin foil | |||
| Transfer pipettes | |||
| Xylene |
Références
- World Health Organization. . Epilepsy. , (2024).
- Dalic, L., Cook, M. J. Managing drug-resistant epilepsy: challenges and solutions. Neuropsychiatr Dis Treat. 12, 2605-2616 (2016).
- Mayo Clinic. . Seizures - Symptoms and causes. , (2023).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. J Exp Biol. 216 (20), 3799-3810 (2013).
- Moreira-Lobo, D. C., et al. Eugenol modifies the excitability of rat sciatic nerve and superior cervical ganglion neurons. Neurosci Lett. 472 (3), 220-224 (2010).
- Johan Arief, M. F., Choo, B. K. M., Yap, J. L., Kumari, Y., Shaikh, M. F. A systematic review on non-mammalian models in epilepsy research. Front Pharmacol. 9, 655 (2018).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proc Natl Acad Sci U S A. 100, 7666-7671 (2003).
- Wu, J. P., Lee, H. L., Li, M. H. Cadmium neurotoxicity to a freshwater planarian. Arch Environ Contam Toxicol. 67 (4), 639-650 (2014).
- Kim, A., Rawls, S. M. Nicotine-induced C-shape movements in planarians are reduced by antinociceptive drugs: Implications for pain in planarian paroxysm etiology. Brain Res. 1778, 147770 (2022).
- Reho, G., Lelièvre, V., Cadiou, H. Planarian nociception: Lessons from a scrunching flatworm. Front Mol Neurosci. 15, 935918 (2022).
- Pagán, O. R., et al. Planarians require an intact brain to behaviorally react to cocaine, but not to react to nicotine. Neuroscience. 246, 265-270 (2013).
- Raffa, R. B., Holland, L. J., Schulingkamp, R. J. Quantitative assessment of dopamine D2 antagonist activity using invertebrate (Planaria) locomotion as a functional endpoint. J Pharmacol Toxicol Methods. 45 (3), 223-226 (2001).
- Bhatt, P., Reitz, A. B., Tallarida, C. Mephedrone ("bath salt") pharmacology: insights from invertebrates. Neuroscience. 208, 79-84 (2012).
- Neufeld, T., Carniello, T., Dotta, B. A single hypoxic event ameliorates pilocarpine-induced hyperkinetic movements in Planaria. Nat Sci. 14, 149-156 (2022).
- Rossini, L., et al. Dendritic pathology, spine loss, and synaptic reorganization in human cortex from epilepsy patients. Brain. 144 (1), 251-265 (2021).
- Owuor, K., et al. LGI1-associated epilepsy through altered ADAM23-dependent neuronal morphology. Mol Cell Neurosci. 42 (4), 448-457 (2009).
- Dubey, V., et al. Dendritic reorganization in the hippocampus, anterior temporal lobe, and frontal neocortex of lithium-pilocarpine induced Status Epilepticus (SE). J Chem Neuroanat. 133, 102329 (2023).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Musto, A. E., Walker, C. P., Petasis, N. A., Bazan, N. G. Hippocampal neuro-networks and dendritic spine perturbations in epileptogenesis are attenuated by neuroprotectin D1. PLoS One. 10 (1), e0116543 (2015).
- Omuro, K. G., et al. Novel monoclonal antibodies to study tissue regeneration in planarians. BMC Dev Biol. 15 (2), (2015).
- Keenan, C. L., et al. Cytoarchitecture of primitive brains: Golgi studies in flatworms. J Comp Neurol. 195, 4 (1981).
- Pronin, A. N., Wang, Q., Slepak, V. Z. Teaching an old drug new trick: Agonism, antagonism, and biased signaling of pilocarpine through M3 muscarinic acetylcholine receptor. Mol Pharmacol. 92 (5), 601-612 (2017).
- Im, K., Mareninov, S., Diaz, M. F. P., Yong, W. H. An introduction to performing immunofluorescence staining. Methods Mol Biol. 1897, 299-311 (2019).
- Vogt, R. V., Phillips, D. L., Henderson, L. O., Whitfield, W., Spierto, F. W. Quantitative differences among various proteins as blocking agents for ELISA microtiter plates. J Immunol Meth. 101 (1), 43-50 (1987).
- Duhamel, R. C., Johnson, D. A. Use of nonfat dry milk to block nonspecific nuclear and membrane staining by avidin conjugates. J Histochem Cytochem. 33 (7), 711-714 (1985).
- Chen, T. S., Huang, T. H., Lai, M. C., Huang, C. W. The role of glutamate receptors in epilepsy. Biomedicines. 11 (3), 783 (2023).
- Kreshchenko, N. Immunocytochemical identification of serotoninergic neurons in Planaria Girardia tigrina. Biochem. Moscow Suppl Ser A. 11, 68-76 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon