Method Article
고도로 분화된 편광 망막 색소 상피 배양에서 산소 소비율의 장기 모니터링
* 이 저자들은 동등하게 기여했습니다
요약
망막 색소 상피(RPE) 배양에서 산소 소비율(OCR)을 측정하기 위한 새로운 장치를 소개합니다. 이 장치는 플레이트가 표준 세포 배양 인큐베이터에 있는 동안 표준 배지가 있는 표준 세포 배양 플레이트에서 성장한 RPE에서 한 번에 몇 주 동안 OCR을 측정할 수 있습니다.
초록
미토콘드리아 대사는 광수용체 생존에 중요한 망막 세포의 단층인 망막 색소 상피(RPE)의 정상적인 기능에 매우 중요합니다. RPE 미토콘드리아 기능 장애는 선진국에서 돌이킬 수 없는 실명의 주요 원인인 연령 관련 황반 변성(AMD)과 망막 박리의 실명 합병증인 증식성 유리체 변성증(PVR)의 특징입니다. RPE 퇴행성 질환은 in vivo RPE를 모방하기 위해 고도로 분화되고 분극화된 RPE 배양 시스템에 의해 잘 모델링되었습니다. 그러나 미토콘드리아 기능의 대리물인 산소 소비율(OCR)을 모니터링하는 것은 이상적인 RPE 분극 및 분화를 촉진하는 조건으로 인해 OCR 측정이 쉽지 않기 때문에 이러한 배양 시스템에서는 어려웠습니다.
여기에서는 표준 세포 배양 인큐베이터에서 최적의 성장 기질 및 생리학적 배양 배지에서 RPE를 유지하면서 잘 분화된 RPE 배양에서 한 번에 몇 주 동안 OCR을 모니터링하는 새로운 시스템인 Resipher를 소개합니다. 이 시스템은 세포 위의 매체에 존재하는 산소 농도 구배를 측정하여 OCR을 계산합니다. OCR을 감지하는 다른 방법에 비해 이 시스템의 장점과 RPE 문화권에서 OCR을 측정하기 위한 시스템을 설정하는 방법에 대해 설명합니다. 시스템 사용에 대한 주요 팁과 요령, 데이터 해석에 대한 주의, 예기치 않은 결과를 해결하기 위한 지침을 다룹니다.
또한 시스템에서 감지한 세포 위의 배지 내 산소 구배를 기반으로 저산소증, 정상산소증 또는 고산소증 RPE 배양 경험을 추정할 수 있는 온라인 계산기를 제공합니다. 마지막으로, PVR 모델에서 RPE 세포의 대사 상태를 측정하고 RPE가 저산소증에 대사적으로 적응하는 방법을 이해하는 시스템의 두 가지 응용 프로그램을 검토합니다. 우리는 고도로 분극화되고 분화된 RPE 배양에 이 시스템을 사용하면 생리학적 및 질병 상태 모두에서 RPE 미토콘드리아 대사에 대한 이해를 높일 수 있을 것으로 기대합니다.
서문
망막 색소 상피(RPE)는 기능적으로 분열 후 고도로 분극된 상피 세포의 단층으로, 망막의 빛에 민감한 광수용체와 혈액 순환 사이에 장벽을 형성하며, 융모혈관이라고 하는 모세혈관층입니다. 신경교세포를 지원하는 뉴런의 역할과 마찬가지로, RPE는 광수용체 외부 분절의 식세포작용, 영양소 수송 및 광수용체의 대사 지원, 필수 성장 인자의 분비 등 광수용체를 지원하기 위한 수많은 기능을 수행하며, 이 모든 기능은 시각 기능 유지에 매우 중요합니다.
RPE의 퇴행은 몇 가지 일반적인 퇴행성 시력 장애의 기초가 됩니다. 전 세계에서 불치의 시력 상실의 가장 흔한 원인 중 하나인 연령 관련 황반 변성(AMD)의 경우 RPE가 죽고 이에 따라 상부에 있는 광수용체가 2차 변성을 겪습니다. 증식성 유리체병증(PVR)에서 RPE는 일반적으로 정지된 유사분열 후 상태를 벗어나 신진대사의 변화와 함께 중간엽 상태(소위 상피에서 중간엽으로의 전환[EMT])로 증식 및 역분화됩니다. RPE 역분화는 광수용체에 대한 RPE 지지의 손실을 유발하는 동시에 더 많은 섬유화 상태를 유발합니다. 그 결과 광수용체 변성과 RPE에 의한 흉터가 발생하며, 둘 다 시력 상실을 유발합니다 1,2.
광수용체에 대한 RPE의 지원 중 주요 부분은 대사이며, 대사 조절 장애는 AMD 및 PVR을 포함한 수많은 망막 질환에서 중요한 요소입니다. RPE는 광수용체와 광수용체의 산소 및 영양소 공급원인 융모모혈관 사이의 조절 장벽 역할을 합니다. 따라서 RPE가 대사를 위해 선택하는 것과 RPE가 융모막에서 광수용체로 통과하기로 선택하는 것은 광수용체 대사와 생존에 큰 영향을 미칩니다. 수많은 연구에 따르면 RPE는 정상적인 건강을 위해 미토콘드리아 대사에 크게 의존하며, 대신 광수용체는 해당작용에 크게 의존한다고 합니다3. 이것은 광수용체와 RPE 사이의 상보적이고 얽힌 대사 상태의 개념을 도입했습니다. 구체적으로, RPE는 선호하는 광수용체 대사 기질의 대사를 감소시키고, 대신 광수용체가 소비하지 않는 대사 산물과 결합된 광수용체 대사의 부산물을 이용합니다. PVR 및 AMD와 같은 질병에서 RPE가 해당작용이 더 커지고 미토콘드리아 대사에 덜 의존하게 된다는 증거가 강력하게 시사합니다. RPE 해당과정으로의 이러한 변화는 필요한 대사 산물의 광수용체를 굶주리게 하여 퇴행을 유발할 수 있습니다 4,5,6. RPE와 광수용체 대사가 얼마나 상호 의존적인지, 그리고 얼마나 많은 변화된 신진대사가 망막 질환의 기저에 있는지를 감안할 때, 치료 목적으로 RPE 대사를 모델링하고 조작하는 것에 대한 관심이 높습니다.
in vivo RPE 미토콘드리아 대사를 연구하는 것이 이상적이지만, RPE 미토콘드리아 대사의 많은 측면은 in vitro 배양 시스템에서만 실질적으로 조사할 수 있습니다. 지난 수십 년 동안 충실도가 높은 RPE 배양에 대한 상당한 진전이 이루어졌으며, 현재 가장 신중하게 손질된 RPE 배양이 인간 임상시험에서 세포 대체 요법에 사용되고 있다7. 이러한 고충실도 배양을 유지하기 위해서는 실험 전 몇 달 동안 특정 배지의 특정 기질에서 RPE를 성장시켜야 합니다. 이러한 조건에서 RPE 배양은 최대로 분화되고 분극화되어 in vivo RPE에 근접합니다. 불행히도, 현재 생체 내 RPE에서 미토콘드리아 대사를 특이적으로 측정할 수 있는 장비는 없습니다. 망막 모세관 네트워크의 산소 모니터링은 전자 상자성 공명(EPR) 산소 측정법8을 사용하여 생체 내에서 이루어졌지만, RPE 분석에서는 불가능합니다. in vivo 및 in vitro의 RPE 대사 간의 차이는 잘 설명되지 않았지만 RPE 배양은 RPE in vivo 3,9와 유사한 높은 미토콘드리아 활성을 보이는 것으로 나타났으며, 이는 고충실도 RPE 배양을 사용하여 RPE 미토콘드리아 대사에 대한 상당한 통찰력을 얻을 수 있음을 시사합니다.
모든 미토콘드리아 대사가 산소 소비로 이어지기 때문에 RPE 산소 소비량(OCR)을 측정하는 것은 미토콘드리아 대사에 대한 충실한 대리물입니다. RPE 배양에서 OCR을 측정하는 것은 어려웠는데, 이는 최대 RPE 분극 및 분화를 촉진하는 조건으로 인해 Seahorse 분석기와 같은 현재 사용 가능한 기술을 사용하여 장기적으로 정확한 OCR 측정을 불가능하게 하는 경우가 많기 때문입니다. 이 방법 논문에서는 Resipher(이하 "시스템"이라고 함)라고 하는 새로운 장치를 소개하며, 이를 통해 편광 및 분화를 최대한 촉진하는 조건에서 성장한 RPE에서 몇 주에 걸쳐 OCR을 지속적으로 측정할 수 있습니다. RPE 분화 및 분극화를 최대한 촉진하는 RPE 배양 조건에서 이 시스템으로 OCR을 쉽게 측정할 수 있는 것은 기존 OCR 측정 장치 중에서도 유일합니다.
이 문서에서는 RPE 문화권에서 시스템을 사용하기 위한 팁과 요령을 제공하고 두 가지 특정 응용 프로그램에 대한 데모를 제공합니다. 첫째, PVR을 모방한 RPE EMT는 변형성장 인자-베타(TGFβ)1,10,11,12에 노출됨으로써 유발됩니다. 이 시스템은 EMT 과정에서 RPE 대사가 어떻게 변화하는지 모니터링하는 데 사용됩니다. 둘째, RPE 대사에서 저산소증의 역할은 이 시스템을 사용하여 탐구됩니다. 저산소증은 AMD의 발병에 중요한 기여를 하는데, 이는13,14세가 되면 맥락막모세혈관이 얇아지기 때문입니다. 이 시스템을 저산소증 챔버와 결합하면 노화에 수반되는 미묘한 저산소증과 함께 변화된 RPE 미토콘드리아 대사를 모델링할 수 있습니다. 마지막으로, Resipher 데이터를 사용하는 온라인 계산기를 도입하여 RPE 배양이 저산소, 정상 산소 또는 고산소 상태에 있는지 확인할 수 있습니다. 이러한 정보는 체외 RPE 배양 연구에서 RPE 대사에 대한 결론을 도출하는 데 매우 중요합니다.
프로토콜
인간 1차 배양 또는 iPSC-RPE 배양을 확립하기 위한 프로토콜은 다음 참조 15,16,17,18을 참조하십시오. 이러한 프로토콜에 대한 인체 조직의 획득 및 사용은 University of Michigan Institutional Review Board (HUM00105486)에 의해 검토되고 허가되었습니다.
1. RPE 문화에 대한 시스템의 일반적인 적용
- 시스템 호환 가능한 96웰 플레이트에서 인간 유도 만능 줄기 세포(iPSC) 유래 RPE 또는 일차 인간 RPE 세포를 플레이트합니다.
- 24웰 세포 배양 플레이트에서 성장한 기존 성숙한 배양액을 가정하고 인산염 완충 식염수(PBS)로 세포를 한 번 세척한 다음 500μL의 0.25% 트립신-EDTA(Table of Materials)를 추가합니다. 세포 배양 인큐베이터에서 10-40분 동안 배양하고 세포가 둥글고 거의 분리될 준비가 될 때까지 5-10분마다 확인합니다.
- 세포 위에 배지를 부드럽게 피펫팅하여 세포 배양 플라스틱에서 분리한 다음 3배 부피의 세포 배양 배지(24웰당 1,500μL)로 옮기고 실온에서 250× g 의 원심분리기에서 5분 동안 회전시킵니다.
참고: RPE 세포 배양 배지의 제조법은 표 1에 자세히 설명되어 있으며 이전에 발표된 참고 문헌 9,15,16,17,18에서 확인할 수 있습니다. - 15% 소 태아 혈청(FBS)으로 RPE 세포 배양 배지에 세포를 재현탁시키고 혈구계로 세포를 계수합니다.
- 제조업체의 지침에 따라 고도로 전문화된 세포외 매트릭스 코팅 기판(재료 표)으로 코팅한 후 96웰 플레이트(일반적으로 225-300 × 105 cells/cm2)의 각 웰에 대해 74,000개의 세포를 파종합니다.
알림: Resipher 호환 플레이트(재료 표)에만 세포를 시드하고 감지 덮개의 프로브 어레이에 해당하는 웰에만 세포를 시드합니다(3채널 덮개의 경우 4, 9, 10열 및 32, 재료 표 참조). 시스템의 감지 덮개는 4채널, 32채널 또는 96채널 센서(그림 1A-D의 센서 위치 참조)와 함께 사용할 수 있으며 다양한 표준 세포 배양 플레이트와 호환됩니다. - 엣지 웰은 증발하기 쉬워 산소 가용성에 큰 영향을 미치므로 OCR 판독값에 모든 엣지 웰(96웰 플레이트의 행 A 및 H)에 셀을 파종하지 마십시오. 또한 96웰 플레이트의 빈 웰 각각에 200μL의 멸균수를 추가하여 증발 효과를 줄입니다.
- 세포가 가라앉을 수 있도록 플레이트를 안정된 테이블 표면에 10분 동안 두십시오. 그런 다음 인큐베이터에 다시 넣습니다. 24-72시간 후에 배지를 교체하고 FBS가 5%인 표준 RPE 배양 배지로 교체합니다. 최소 4주 동안 배양하고 일주일에 2번 미디어를 변경합니다.
참고: 세포는 착색되고 조약돌이며 매우 조밀할 때 실험할 준비가 됩니다(그림 1E).
- 시스템으로 데이터 설정 및 수집
- 빈 96웰 수신기 플레이트에 감지 덮개를 놓은 다음 세포 배양 인큐베이터에 다시 놓습니다. 감지 덮개에 장치를 정렬 및 장착하고 제공된 USB 케이블을 통해 허브에 연결합니다. 이렇게 하면 Resipher "샌드위치" 가 생성됩니다(그림 2A).
- Lucid lab 웹 사이트 애플리케이션(https://lab.lucidsci.com/)으로 이동하여 오른쪽 상단 모서리에 있는 새 실험 버튼을 클릭하여 새 실험을 만듭니다.
- 실험 제목의 이름을 지정하고 특정 연구에 대한 관련 실험 노트(예: 사용 중인 iPSC-RPE의 통로 번호)를 입력합니다.
- 우물 조건과 처리 그룹을 만듭니다. 예를 들어, OCR에서 미디어의 다양한 혈청 농도의 효과를 테스트하는 경우 그룹 이름에서 혈청을 선택한 다음 사용할 미디어 혈청 농도를 입력하고 + 버튼을 클릭하여 더 많은 혈청 백분율 값을 추가합니다. 특정 혈청 비율을 받을 웰을 할당하고 해당 웰의 색상 패턴을 선택합니다. Add group 버튼을 클릭하여 필요에 따라 더 많은 그룹(예: 테스트할 다른 실험 변수)을 추가합니다.
- 플레이트 설정을 정의하고 해당 장치 및 플레이트 스타일을 선택합니다. 플레이트 추가 버튼을 클릭하고 장치를 선택하십시오. 플레이트 유형을 선택합니다. 치료를 선택하고 해당 우물을 클릭하십시오.
- 지금 시작 버튼을 클릭하여 실험을 시작합니다. web사이트의 표시등과 허브의 LED가 녹색으로 켜져 있는지 확인하십시오.
- 각 센서가 적절하게 보정되고 5%CO200 가 있는 완전 가습 세포 배양 인큐베이터에서 ~200μM의 농도여야 하는 대기 산소를 정확하게 감지하기 위해 시스템을 15-60분 동안 실행합니다(그림 2Bi).
참고: 표준 세포 배양 인큐베이터 설정에서 다른 센서의 평균보다 20% 이상 차이가 나는 센서가 있는 경우 데이터 분석에서 해당 우물을 제외하는 것이 좋습니다(그림 2Bii).
알림: 모든 센서가 다른 센서의 평균과 표준 세포 배양 인큐베이터 설정에서 20μM로 보고된 예상 대기 O200 에서 20% 이상 차이가 나면 감지 덮개가 너무 많이 사용된 것입니다. 새 감지 덮개로 교체합니다(그림 2Biii).
알림: 실험을 시작하기 전에 공기 중에서 O2 판독값을 얻으면 나중에 문제 해결이 크게 향상됩니다. 실험이 완료된 후 특정 웰이 이상치로 나타나고 해당 웰에 보정을 벗어난 센서가 있는 경우 문제는 생물학적 복제가 아니라 센서에 있을 수 있습니다. - 감지 덮개에서 장치를 제거합니다(단, 장치에서 USB 케이블을 분리하지 마십시오). 장치의 모터가 재설정될 수 있도록 장치를 인큐베이터에 거꾸로 놓습니다. 모든 모터 소리가 멈출 때까지(약 20-30초) 장치를 재사용하지 마십시오.
알림: 장치가 감지 덮개에서 떨어져 있는 경우에도 실험 중에는 항상 USB 케이블을 통해 장치를 허브에 연결된 상태로 유지하는 것이 중요합니다. 이를 통해 장치는 세포 배양 인큐베이터 환경을 지속적으로 모니터링하고 보고할 수 있습니다. - 감지 뚜껑이 있는 플레이트를 RPE 배양이 들어 있는 96웰 플레이트와 함께 세포 배양 후드에 다시 놓습니다. 모든 웰에 대해 동일한 배지와 동일한 부피를 가진 RPE 배양으로 플레이트의 배지를 변경하여 각 웰에 대한 기준선 OCR 값을 얻습니다. 증발을 방지하기 위해 RPE가 없는 모든 우물에 멸균수를 채워야 합니다.
참고: 일반적으로 96-well당 60-100 μL의 RPE 배양 배지를 권장하며, 이는 배지 부피가 적으면 영양분이 급격히 고갈되지만 배지 부피가 높을수록 의도하지 않은 저산소증으로 이어진다는 것을 입증하는 데이터에 기반합니다9. - 센싱 뚜껑을 세포 배양이 들어있는 플레이트로 옮기고 세포 배양이 들어있는 플레이트의 표준(비리시퍼) 뚜껑을 빈 96웰 리시버 플레이트로 옮겨 표준 뚜껑의 멸균 상태를 유지하며, 이는 실험 중 여러 지점에서 필요합니다.
- 세포 배양이 있는 플레이트와 감지 뚜껑을 세포 배양 인큐베이터에 다시 놓습니다. 다시 한 번 장치를 감지 덮개에 정렬 및 장착하고 제공된 USB 케이블("샌드위치" 조립)을 통해 허브에 연결합니다. 웹 사이트 인터페이스와 허브의 표시기가 모두 녹색으로 켜져 있는지 확인하십시오.
알림: O2 농도 데이터는 즉시 표시되지만 OCR 데이터는 약 1시간 동안 충분한 O2 데이터가 수집된 후에만 표시됩니다. - 장치가 최소 12-24시간 동안 각 웰에서 OCR을 측정하여 기준 OCR을 캡처하도록 합니다.
참고: 기준 OCR은 셀에 적용되는 미디어 유형을 포함한 여러 요인에 따라 달라집니다. 그림 2C에서 FBS의 양이 다른 표준 RPE 배양 배지(0%, 5%, 15%)는 OCR 값이 약간 다릅니다. 또한, FBS가 더 많은 배양물은 미토콘드리아 대사 산물(곡선의 오른쪽)의 고갈로 인해 OCR이 떨어지기 전에 배지를 세포에 적용한 후 미토콘드리아 활동을 더 오래 유지할 수 있습니다. - 기준선 OCR을 얻으면 1.2.8-1.2.12단계를 반복하되 RPE 배양이 있는 플레이트의 배지를 실험 조건(일반적으로 약물 ± 또는 다른 배지 조건 비교)으로 변경합니다.
참고: 일상적인 미디어 변경도 동일한 방식으로 처리할 수 있습니다. 세포 배양 인큐베이터가 열릴 때마다 온도, 습도,CO2 농도 및 인큐베이터 도어가 열릴 때 일시적으로 중단되는 기타 요인에 따라 OCR 판독이 크게 중단될 수 있습니다. 감지 덮개에서 장치를 제거하는 동안 온라인으로 실험을 일시 중지할 필요가 없습니다. 세포 배양 인큐베이터 도어를 열거나 프로브 중인 플레이트에서 배지를 교체한 후 산소 구배를 다시 설정하고 정확한 OCR 측정을 시작하는 데 일반적으로 2-4시간이 걸립니다. - 데이터를 얻은 후 실험 조건이 적용된 후 OCR에서 각 웰에 대한 기준선 OCR을 빼서 처리에 의해 트리거된 델타 OCR 을 결정합니다.
- 실험이 완료된 후 감지 덮개를 멸균하고 재사용합니다(반복 사용으로 성능이 저하되지만 3-5배 재사용할 수 있음). 감지 덮개를 살균하려면 세포 배양 후드에서 70% 에탄올에 뚜껑 전체를 10분 동안 담근 다음 담그십시오. 캐비닛 프로브 면이 위로 향하게 놓고(섬세한 프로브 팁을 만지지 마십시오) 에탄올과 물을 완전히 증발시킨 후 새 96웰 수신기 플레이트에 감지 덮개를 놓습니다.
- 명시야 이미지를 촬영하여 OCR 값을 셀 수로 정규화합니다.
참고: RPE의 멜라닌 축적은 명시야 현미경을 사용하여 살아있는 배양에서 세포 수의 간단한 수를 기반으로 OCR의 정규화를 용이하게 합니다.- 1.2.8단계와 같이 장치를 제거하고 거꾸로 놓습니다. 세포 배양 후드에서 RPE 배양 플레이트의 감지 뚜껑을 표준 96웰 뚜껑으로 교체합니다.
- 표준 도립 현미경을 사용하여 각 웰의 명시야 이미지를 촬영합니다.
알림: 웰 사이의 영역 1 이미지를 일관되게 유지하십시오(웰의 상대적 위치 및 대물렌즈 배율). - 세포 배양 후드에서 RPE 배양 플레이트의 표준 96웰 뚜껑을 감지 뚜껑으로 교체하고 추가 모니터링을 위해 인큐베이터에 다시 넣습니다.
- ImageJ 또는 다른 소프트웨어를 사용하여 각 웰의 셀 수를 세십시오.
- OCR을 다른 실험 그룹의 셀 수로 정규화합니다. 시스템은 fmol∙(mm2)-1∙s-1-단면적당 소비량 단위로 OCR을 보고합니다. 따라서 셀당 OCR을 정규화하려면 OCR을 웰당 셀 수가 아닌mm2 당 셀 수로 나눕니다. 마찬가지로, 시스템에서 보고한 OCR에 웰의 단면적(표준 96웰 플레이트의 경우 약 31mm2 )을 곱하여 fmol∙s-1∙well-1 단위의 OCR을 산출합니다.
- RPE 생체 에너지 매개변수를 결정하기 위한 제어.
참고: 시스템 및 RPE 배양이 예측 가능한 방식으로 미토콘드리아 조작에 반응하는지 확인하기 위해 미토콘드리아 산화 인산화의 특정 단계를 표적으로 삼기 위해 잘 확립된 특정 소분자를 테스트할 수 있습니다. 이러한 검사는 Seahorse Analyzer10 을 사용하여 미토콘드리아 스트레스 검사에서 수행하는 단계와 유사하며 RPE 배양에 대한 생체 에너지 프로필을 제공합니다.- 5% FBS로 65μL의 표준 RPE 배양 배지에서 RPE 세포를 배양하고 24시간 동안 OCR을 측정하여 기준선을 설정합니다.
- 배양 배지를 흡입하고 5% FBS 및 미토콘드리아 언커플러(3μM 카르보닐 시안화물-p-트리플루오로메톡시페닐히드라존[FCCP] 또는 500nM Bam15, 재료 표)가 있는 표준 RPE 배양 배지 65μL를 추가합니다. 하룻밤 동안 배양합니다.
참고: 미토콘드리아 언커플러는 OCR을 크게 증가시켜야 합니다. 증가된 OCR이 표준 배양 조건에서 65μL 배지에 대해 이론적으로 최대 확산 제한 OCR인 약 275fmol∙(mm2)-1∙s-1 이하가 아닌지 확인합니다. 일반적으로 사용되는 다양한 미디어 볼륨에 대한 최대 OCR은 토론 섹션에서 확인할 수 있습니다. - 하룻밤 배양 후 미토콘드리아 언커플러로 배지를 흡입하고 5% FBS가 있는 65μL의 표준 RPE 배양 배지로 교체합니다. 약물 제거 후 RPE OCR의 회복을 확인하기 위해 플레이트를 24시간 더 관찰합니다.
- 처리 전에 얻은 OCR에서 처리 후 얻은 OCR을 빼서 OCR에 대한 언커플러의 효과를 계산합니다(그림 3).
주의: 미토콘드리아 언커플러의 추가에 따른 OCR의 증가는 세포(19)의 예비 미토콘드리아 호흡 능력을 의미한다. - Seahorse 분석기를 사용한 미토콘드리아 스트레스 테스트 중에 일반적으로 캡처되는 다른 미토콘드리아 파라미터를 측정하려면 다음 화합물에 대해 위와 동일한 단계를 수행하십시오(그림 4).
- 1μM에서 올리고마이신을 사용하여 ATP 관련 호흡을 평가합니다.
- 1μM에서 항마이신 A와 로테논을 사용하여 비미토콘드리아 호흡을 평가합니다.
참고: FCCP, 올리고마이신, 안티마이신 A 및 로테논은 RPE에 유독할 수 있습니다. 상당한 세포 사멸을 유발하는 경우 OCR 측정이 정확하지 않습니다. 따라서 OCR 측정은 일반적으로 약물을 첨가한 후 처음 몇 시간 이내에 명백한 세포 사멸이 없는 시점에만 얻어야 합니다(그림 4).
2. EMT를 받는 RPE에서 미토콘드리아 대사의 변화 측정
- 섹션 1.2에 설명된 것과 동일한 프로토콜을 따릅니다.
- 기준선 OCR 측정값을 얻은 후 EMT를 유도하려면 TGF-β2(10ng/mL)를 RPE 배양에 추가하고 3주 동안 OCR을 모니터링합니다. 2-3일마다 새로운 TGFβ2로 배지를 교체합니다(그림 5).
- 적어도 일주일에 2번, 섹션 1.3과 같이 명시야 이미지를 얻어 세포 수가 변하지 않는지 확인합니다. 개수가 변경되면 OCR 값을 각 웰의 셀 수로 정규화합니다.
참고: 세포가 인큐베이터에 있는 동안 배양 기간 동안 장기 OCR 변화를 모니터링하기 위해 EMT의 다른 유도제에 동일한 프로토콜을 사용할 수 있습니다.
3. 저산소성 RPE에서 미토콘드리아 대사의 변화 측정
참고: 저산소, 정상산소 또는 고산소 조건에서 시스템을 적용하는 것은 표준 세포 배양 인큐베이터에 배치된 저산소증 챔버(재료 표)에 "샌드위치"를 보관하는 것을 제외하고는 섹션 1.2와 동일합니다.
- 저산소증 챔버의 덮개에 구멍을 뚫어 USB type-c 케이블을 장착하고 실리콘 또는 퍼티로 밀봉합니다(그림 6A).
- 감지 덮개를 후드의 세포 배양 플레이트와 함께 조립하고 저산소증 챔버로 옮깁니다.
- 저산소증 챔버에 "샌드위치"(플레이트, 감지 뚜껑, 장치)를 설정합니다. 또한 습도를 유지하는 데 도움이 되도록 멸균수가 든 페트리 접시를 저산소증 챔버에 놓습니다. 마지막으로 휴대용 O2 센서를 저산소증 챔버(재료 표)에 넣습니다. 설정은 그림 6A에 나와 있습니다.
- 챔버를 밀봉하고 저산소 농도가O2 이고 표준 세포 배양 농도가CO2 (예: 1%O2 및 5%CO2)인 가스 실린더에 연결합니다.
- 산소 센서가 일반적으로 1%에서 1% 사이 어딘가에서 원하는O2 농도를 표시할 때까지 저산소증 챔버의 공기를 실린더의 1% O2/5% CO2 공기와 천천히 교환합니다.
알림: 휴대용 O2 센서는 평형을 이루는 데 시간이 필요하므로 실린더의 가스를 저산소증 챔버에 천천히 추가해야 합니다. - 저산소증 챔버의 입구 및 출구 밸브를 닫고 전체 챔버를 인큐베이터로 옮깁니다.
- 섹션 1.2와 같이 실험을 설정하고 시작합니다.
참고: 세포에 첨가하기 전에 저산소증 챔버에서 배지를 사전 평형화하면 세포 단층이 진정한 저산소증을 경험하는 데 걸리는 시간을 줄일 수 있습니다(그림 6B).
4. 세포가 저산소, 정상 산소 또는 과산소 상태에 있는지 확인하기 위해 RPE 단층에서O2 농도를 계산합니다.
참고: 이 시스템은 표준 플레이트가 단층 배양을 위한 해당 권장 감지 뚜껑과 함께 사용된다고 가정할 때 기본적으로 웰 바닥에서 약 1-1.5mm 사이의 O2 농도를 측정합니다(https://lucidsci.com/docs/LucidScientific_Sensing_Lid_Selection_Guide.pdf 참조). 셀 단층에서의O2 농도는 직접 측정되지 않지만, 시스템의 데이터를 사용하여 RPE 수준에서O2 농도를 추정할 수 있습니다. 특히,O2 가 사용 가능한 매체 컬럼의 상단과O2 가 소비되는 매체 컬럼의 하단 사이에 산소 구배가 존재한다는 것을 알고 있으면 Fick의 확산 법칙을 측정된 OCR 속도와 결합하여 세포 단층에서O2 수준을 외삽할 수 있습니다. 이 추정을 위한 계산기는 온라인에서 제공됩니다: https://lucidsci.com/notes?entry=oxygen_diffusion (https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture 에서 오픈 소스 대화형 노트북 형태로 이 계산기의 소스 코드는 https://github.com/lucidsci/oxygen-diffusion-calculator 에서 찾을 수 있음).
- 계산기에 액세스한 후 미디어 부피를 마이크로리터 (예: 100μL) 단위로 입력합니다.
- 공기-액체 계면(셀 위의 매체 열 상단)에서 포화 산소 농도를 입력합니다. 이 값은 5% O2 및 95% 습도의 표준 대기압에서 ~185μM입니다.
알림: 이것은 매체 전용 웰(웰 바닥에 셀이 없음)의 시스템 프로브에 의한 O2 측정에서도 결정할 수 있습니다. - Flux 입력에 시스템에서 보고한 Flux/OCR을 입력합니다.
- 이 값을 기반으로 매체 열의 각 높이에서 정상 상태 산소 농도 가 계산되어 플롯에 표시됩니다(그림 7). 플롯의 x축 은 우물 바닥 위의 높이(mm)입니다. y축 은 해당 높이(μM) 에서 계산된O2 농도 입니다.
- 우물 바닥(세포가 있는 곳)의O2 농도는 플롯 아래 선에 보고됩니다.
참고: 일반적으로 생체 내 RPE는 4-9%의O2 농도를 보이는 것으로 추정됩니다. 표준 대기 조건에서O2 의 각 10μM은 대략 1%O2에 해당한다. 따라서, 세포 수준에서의 노르목시아는 대략 40-90 μM의 O2 이다. 매체 컬럼이 높을수록,O2 는 RPE 단층(9)의 레벨에서 더 낮아질 것이다. 따라서 세포가 저산소 상태에 있는 것으로 보이면 매체 부피를 줄일 수 있습니다. 세포가 과산소 상태에 있는 것으로 보이면 배지 부피를 늘릴 수 있습니다.
결과
Resipher 실험을 위한 "샌드위치" 설정은 그림 2A에 나와 있습니다. 96웰 플레이트의 3, 4, 9, 10열에 해당하는 32개의 프로브가 있는 감지 덮개는 셀 플레이트와 장치 사이에 있습니다. 허브에 연결한 후 장치는 모터를 활성화하여 감지 덮개를 위아래로 움직여 셀 단층(일반적으로 1-1.5mm) 위의 높이 범위에서 매체 열의 O2 농도를 측정합니다. 따라서O2 구배는 단층층 위의 이러한 다양한 높이에서O2 농도를 기록하여 연속적으로 측정됩니다. 그래디언트 측정 및 Fick의 확산 법칙 적용에서 이 장치는 프로브 높이 범위 위에서 그 아래까지의 산소 플럭스를 자동으로 계산하며, 이는 셀 단층의 산소 소비율(OCR)입니다. 감지 덮개는 웰이 비어 있는지(공기 전용), 매체로 채워져 있지만 세포가 없는지(매체 전용) 또는 세포 단층 위에 매체가 있는지(매체 + 세포)에 관계없이O2 를 감지합니다. 감지 덮개의 센서가 얼마나 잘 작동하는지 확인하는 품질 검사로 먼저 덮개를 비어있는(공기 전용) 96웰 플레이트 위에 놓을 수 있습니다. 각 웰의 각 센서가 작동하는 경우 보고된O2 는 서로 일치해야 하며 표준 세포 배양 인큐베이터 조건에서 대기 중 예상되는O2 에 가까운 200μM에 가까워야 합니다. 그림 2Bi는 대기 중 8 개의 프로브에서 O2 판독 값을 보여줍니다 (기본 단위 변환은 프로브가 37 ° C 액체에 있다고 가정하기 때문에 μM 단위의 농도로 보고됨). 이 판독값은 엄격하고(±5%) 200μM에 가까우며, 이는 8개의 센서가 모두 잘 작동하고 있음을 의미합니다. 그림 2Bii에서는 그림 2Bi 와 동일한 감지 덮개가 사용되지만 다른 장치가 배치됩니다. 여기서는 이상치 곡선(빨간색)을 기준으로 결함이 있는 두 개의 장치 센서가 선택됩니다. 이는 장치에 문제가 있어 교체해야 함을 시사합니다(또는 결함이 있는 센서에 해당하는 웰을 실험에서 제외해야 함). 그림 2Biii에서는 그림 2Bi 와 동일한 장치가 사용되지만 두 개의 다른 감지 덮개가 사용됩니다. Lid1(왼쪽)은 프로브 간의 변동성이 높으며, 이는 일반적으로 덮개가 너무 많이 사용되었기 때문에 덮개의 감지 재료가 저하되었음을 시사합니다. Lid2(오른쪽)는 새로운 것으로, 약 200μM에 밀집되어 있는 판독값을 보여줍니다. 이 시스템을 사용하면 배지 내 혈청 보충이 RPE 미토콘드리아 대사에 미치는 영향을 분석할 수 있습니다. 그림 2C에서 볼 수 있듯이 혈청 보충제 수치가 증가하면 RPE OCR 수치가 미묘하게 높아졌습니다. 중요한 것은 혈청 보충제를 많이 섭취하면 미토콘드리아 대사가 더 오랜 기간 동안 유지될 수 있다는 것입니다. 혈청 보충제를 섭취하지 않아도 OCR은 약 90시간 동안 지속되며, 미토콘드리아 대사 기질이 고갈되어 OCR이 떨어집니다. 따라서 3.5일마다(일주일에 두 번) 96-well당 100μL의 배지 교체는 무혈청 배지를 사용하더라도 성숙하고 고도로 분화되고 분극화된 RPE 배양에서 영양소 고갈을 방지하기에 충분합니다.
OCR 비율은 웰(well)마다 크게 다를 수 있으며, 모든 웰(well)이 동일한 세포 수와 형태를 갖는 것처럼 보이는 배양에서도 마찬가지입니다. 따라서 OCR의 증가가 실험 조건에 기인하는지 아니면 단순히 웰 간 OCR의 기준선 차이에 기인하는지 여부를 분리하려면 정규화가 필요합니다. 정규화의 첫 번째 단계는 프로토콜 섹션 1.3에 설명된 대로 웰 간의 세포 수가 일관되도록 하는 것입니다. 웰 간에 셀 수가 다른 경우 웰의 OCR을 셀 수로 정규화해야 합니다. 일반적으로, 고도로 성숙하고 분극화된 RPE 배양의 경우, 웰 사이의 세포 수는 놀라울 정도로 일관됩니다9. 이러한 시나리오에서도 그림 3A에서 볼 수 있듯이 웰 간의 기준선 OCR은 다를 수 있습니다. 여기서 기준선 OCR은 처리 전에 웰 간에 최대 100fmol/mm2/sec까지 다릅니다. 처리 전에 OCR을 측정하면 실험적 처리에 의해 트리거된 델타 OCR 을 결정하고 이를 웰 간 기준선 OCR의 차이로부터 분리할 수 있습니다. 이 경우, 치료법은 두 개의 미토콘드리아 언커플러(FCCP 대 BAM15)를 차량 제어와 비교하는 것입니다. 기준선 OCR이 정규화에 활용되면 언커플러와 대조군에 대한 특정 처리 효과가 분명해집니다( 그림 3B 와 그림 3C 비교). 일반적으로 OCR을 변경할 수 있는 실험은 기준 OCR을 설정하기 위한 초기 OCR과 델타 OCR을 결정하기 위한 처리 단계의 두 단계 이상으로 분할해야 합니다.
RPE 배양이 미토콘드리아 조작에 예상된 방식으로 반응하는지 확인하고 RPE에 대한 생체 에너지 프로필을 확립하기 위해 애질런트의 Seahorse 분석기에서 미토콘드리아 스트레스 테스트에 사용된 기존 저분자 도구를 시스템과 함께 사용할 수 있습니다. 먼저, 예비 미토콘드리아 용량은 미토콘드리아 언커플러(19)를 사용하여 측정할 수 있다. RPE 배양에서 미토콘드리아 언커플러 BAM15는 독성을 유발하지 않으면서 FCCP에 비해 OCR이 훨씬 더 강력하고 지속적인 증가를 보여줍니다(그림 3C,D). 기초 호흡, ATP 연관 호흡, 양성자 누출 및 비미토콘드리아 호흡 용량을 포함하여 Seahorse 분석기 미토콘드리아 스트레스 테스트에서 사용할 수 있는 다른 매개변수는 시스템을 사용하여 계산할 수 있습니다. Seahorse 분석기는 주입 포트를 사용하여 특정 산화 인산화 복합체를 억제하는 독소를 순차적으로 전달하여 위의 파라미터를 추론하는 반면, Resipher에는 이러한 기능이 없습니다. 그러나 각 미토콘드리아 독소를 별도의 웰에 추가할 수 있으며, 비히클로 처리된 웰에 대한 접힘-변화를 기반으로 다른 호흡 매개변수를 계산할 수 있습니다. 그림 4A에서는 미토콘드리아 언커플러 BAM15, ATP 합성효소 억제제인 올리고마이신, 복합체 I 및 III 억제제인 안티마이신/로테논, 차량 제어(DMSO)로 처리한 웰 간의 OCR 차이를 모두 비교합니다. 이러한 독소는 장기간에 걸쳐 세포 사멸을 유발할 수 있고 세포 사멸이 OCR에 영향을 미치기 때문에 OCR 판독값은 몇 시간의 치료 후에 측정되었습니다. 그림 4B는 그림 4A의 마지막 시점으로부터 외삽된 막대 그래프 형태의 각 미토콘드리아 활성 소분자로 처리된 차량과 웰 간의 OCR 차이를 보여줍니다. 그림 4B의 OCR 값은 그림 4C에서 볼 수 있듯이 RPE 배양에 대한 생체 에너지 매개변수를 계산하는 데 사용할 수 있습니다. 그림 4C의 생체 에너지 프로파일의 각 색상 코드 값은 그림 4B의 동일한 색상 코드 값에서 비롯됩니다. 따라서 ATP 연결 호흡, 양성자 누출, 최대 미토콘드리아 호흡 능력 및 비미토콘드리아 호흡 능력과 같은 매개변수는 OCR 시스템을 사용하여 추정할 수 있습니다. 각 미토콘드리아 활성 소분자의 작용 방식에 대한 요약이 그림 4D에 나와 있습니다.
RPE 생체 에너지 프로파일을 분석하기 위한 RPE 배양 및 대조 실험에서 이 시스템에 대한 프로토콜을 시연한 후에는 RPE 생물학 및 병리학에 대한 시스템의 실험적 응용 프로그램을 탐색할 수 있습니다. 망막 박리 또는 안구 외상 후 발생하는 증식성 유리체병증(PVR)에서 RPE는 상피에서 중간엽으로의 전환(EMT)으로 알려진 극적인 변형을 겪으며, 이에 따라 매우 규칙적이고 조약돌 같은 RPE는 세포 간 접착력을 잃고 수축성 및 운동성이 있는 방추체 모양의 중간엽 세포로 분화합니다 1,2. 이것은 망막 박리를 유발할 수 있는 망막에 접선 수축력을 유발합니다. RPE에서 EMT의 전형적인 유도인자에는 형질전환성장인자-베타(TGFβ) 및 종양괴사인자-알파(TNFα)10,11,12가 포함됩니다. 3가지 포유류 TGFβ 동형 중 TGFβ2는 망막1에서 EMT를 가장 두드러지고 강력하게 유도하는 인자로, 특징적으로 육각형 RPE 세포의 뚜렷한 세포 신장과 중간엽 마커의 발현을 증가시킵니다. RPE에서 TGFβ2에 의해 유도된 EMT 반응은 이전에 Seahorse XFe9610을 사용하여 입증된 바와 같이 미토콘드리아 호흡의 억제와 그에 따른 해당작용 능력의 증가를 동반합니다. Seahorse는 실시간 생체 에너지 프로필을 제공하지만 장기적인 OCR 모니터링을 허용하지 않습니다. 따라서 이 연구에서 OCR 시스템의 첫 번째 적용(그림 5)에서 RPE에서 TGFβ2로 EMT를 유도할 때 미토콘드리아 호흡을 3주 동안 추적하여 PVR 중에 발생하는 대사 재프로그래밍의 시험관 내 모델링을 가능하게 했습니다. Seahorse 분석기를 사용한 RPE EMT의 단일 시점 분석과 달리, EMT를 받는 RPE의 대사 상태를 몇 주 동안 추적할 수 있습니다. RPE를 TGFβ2에 반복적으로 노출시키면 미토콘드리아 대사가 지속적으로 감소하는 것이 분명합니다. Seahorse XF 분석기를 사용한 이전 데이터에 따르면 TGFβ2는 24시간 및 72시간에서 최대 호흡량을 유의하게 감소시켰지만 기저 OCR수준 10에는 영향을 미치지 않았습니다. TGFβ2에서 최대 72시간까지 변하지 않은 기초 OCR은 이 연구에 사용된 OCR 시스템에 의해 확증되었습니다(그림 5). 그러나 이 연구에서 OCR 시스템의 장기 데이터에 따르면 TGFβ2에 노출된 지 5일 후에 basal OCR 수치가 감소하기 시작하며 basal OCR의 감소는 20일째에 가장 뚜렷하게 나타납니다. 이러한 결과는 이전의 Seahorse 시점에서는 포착되지 않았던 기초 OCR의 장기적인 변화를 강조합니다.
두 번째 응용 분야에서는 이 시스템을 사용하여 저산소 조건에서 RPE 미토콘드리아 대사를 모니터링할 수 있습니다. AMD는 융모모혈관 얇아짐 및 저산소증13,20과 관련이 있으므로, 아독성 저산소증에 대한 RPE의 조정을 이해하면 AMD 발병 기전에 대한 통찰력을 얻을 수 있습니다. 미토콘드리아 대사를 모니터링하는 동안 RPE 배양을 제어된 저산소증에 적용하기 위해 시스템을 저산소증 챔버에 배치한 다음 세포 배양 인큐베이터에 배치할 수 있습니다. 이 설정을 용이하게 하기 위해 저산소증 챔버의 덮개에 작은 구멍을 뚫어 시스템의 USB 케이블이 저산소증 챔버 내부에 도달할 수 있도록 합니다. 구멍은 퍼티 또는 실리콘으로 밀봉됩니다(그림 6A). 휴대용 O2 센서를 저산소증 챔버에 배치하여 대기 O2 수준을 모니터링하고 저산소증 챔버 밀봉이 손상되지 않도록 할 수 있습니다. 이 설정을 사용하여 대기 O2 농도와 매체 O2 농도 사이의 평형 속도를 결정할 수 있습니다. 도 6B에서, 대기 O2 로 평형 화 된 매체는 세포가없는 96 웰 플레이트의 개별 웰에 배치되고 단지 5 % O2 (~ 50 μM O2 )를 포함하는 저산소증 챔버로 도입됩니다. 시간이 지남에 따라 각 우물의 매체는 새로운 대기 농도와 평형을 이룹니다. 미디어 컬럼 높이가 높을수록(부피가 많을수록) 평형이 더 오래 걸립니다. 96웰 플레이트의 웰에 65μL의 매체가 있는 경우 대기 O2와의 평형에는 약 5시간이 걸립니다. 그러나 매체 부피가 100-200 μL인 경우 평형 시간이 10시간 이상 걸립니다. 이러한 결과는 저산소증 실험 중에 배지를 세포에 적용하기 전에 원하는 대기 O2 농도로 매체를 사전 평형화하는 것의 중요성을 강조합니다.
저산소증 실험의 경우 저산소증 챔버의 O2 수준이 안정적으로 유지되도록 하는 것이 중요합니다. 96웰 플레이트의 가장자리 웰 중 하나를 세포나 매체로부터 자유롭게 유지하면 감지 덮개 센서 중 하나가 대기 O2를 지속적으로 모니터링할 수 있습니다. 그림 6C에서, 공기에 노출된 단일 웰을 사용한 이러한 모니터링은 저산소증 챔버가 천천히 누출되어 30시간까지 셀이 대기 O2 농도에 가깝다는 것을 보여줍니다. 저산소증 실험을 위한 최종 대조군으로서,O2 용해도가 "신선한" 매체와 "조건된" 매체 간에 다른지 여부를 결정하는 것이 중요하다. 초기에 세포에 배치된 배지와 상당한 시간 동안 세포에 있었던 매체 간에 용해도가 다른 경우, 세포 위의 배지 열에 있는O2 구배는 세포에 대한 시간에 따른 매체 "조건"으로서 달라집니다. 이는 차례로 OCR 계산에 영향을 미칩니다. 그림 6D에서, 빈 웰("공기"), 세포가 없지만 신선한 배지가 있는 웰("새로운 배지"), 세포가 없지만 이전에 RPE 배양에서 48시간 동안 배양된 배지가 있는 웰("조건화된 배지")이 있는 96웰 플레이트를 먼저 대기 O2 에 배치하여 완전한 평형을 허용했습니다. 이어서 플레이트를 대략 3-4%O2 (30-40μM)의 저산소증 챔버에 놓고 평형화하도록 하였다. 마지막으로, 플레이트를 다시 대기O2 농도로 되돌려 놓았다. 새로운 배지와 조건화된 매체에 대한O2 농도 곡선은 동일하며, 이는 새로운 매체와 조건화된 매체 간의O2 용해도가 동일하다는 것을 보여주며, 영양분이 소비되고 부산물이 매체로 분비됨에 따라 시간이 지남에 따라 매체 조성의 변화가O2 용해도를 의미 있게 변경하지 않으므로 실수로 OCR에 영향을 미치지 않음을 확인합니다.
셀 위의 매체 컬럼의 높이가 RPE 단층(9)에서O2 가용성에 큰 영향을 미치므로, 특정 매체 부피가 RPE 단층에서 저산소증, 정상산소증 또는 고산소증을 유발하는지 여부를 결정하는 것이 중요하다. 온라인 계산기 (https://lucidsci.com/notes?entry=oxygen_diffusion (https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture 에서 오픈 소스 대화 형 노트북 형태로) - https://github.com/lucidsci/oxygen-diffusion-calculator 에서이 계산기의 소스 코드)와 결합 된 시스템의 측정 값을 사용하여 RPE 단층의 산소 농도를 추정 할 수 있습니다. 그림 7은 대화형 계산기의 스크린샷을 보여 줍니다. RPE in vivo는 일반적으로 4-9%의O2 농도를 보이며, 이는 ~40-90μM의O2 몰 농도로 변환됩니다.

그림 1: 다양한 감지 덮개의 센서 위치, 32채널 감지 덮개의 플레이트 레이아웃, RPE 형태. (A) 4 채널, (B) 32 채널 및 (C) 96 채널 덮개 옵션에 대한 다양한 감지 덮개의 센서 위치에 해당하는 웰. (D) 32채널 센서 덮개에 대한 권장 플레이트 레이아웃. 가장자리 효과로 인해 세포는 가장자리 웰에 파종되어서는 안 되며 대신 배지를 이 4개의 웰(자주색)에 배치해야 합니다. 세포는 주황색 우물에 파종됩니다. 나머지 웰은 증발 효과를 방지하기 위해 멸균수(파란색)로 채워야 합니다. (E) 육각형의 촘촘하게 채워진 색소 세포가 있는 성숙한 RPE 배양. 눈금 막대 = 20 μm. 약어: RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Resipher 시스템 "샌드위치" 설정 및 품질 관리. (A) 감지 덮개는 표준 96웰 플레이트 뚜껑을 대체하며 프로브가 해당 웰에 삽입됩니다. 검은색 장치는 자석을 통해 감지 덮개에 단단히 고정됩니다. 그림 왼쪽의 이미지는 장치와 감지 덮개가 올바른 방향으로 유지되고 있음을 보여줍니다. 그러나 오른쪽 사진의 경우 장치와 감지 덮개가 옆으로 회전하여 언더프로파일을 더 잘 표시합니다. (B) 뚜껑 및 장치 감지를 위한 품질 관리. (나,ii) 동일한 감지 덮개가 빈 96웰 수신기 플레이트(공기 전용)에 배치되고 두 개의 다른 장치가 감지 덮개 위에 순차적으로 배치됩니다. (i) 첫 번째 장치는 변동성이 낮고 대기 O2 에 대해 예상되는 O2 판독 값 ~ 200 μM를 가진 8 개의 프로브의 데이터를 보여줍니다. (ii) 두 번째 장치는 2개의 프로브가 비정상적으로 판독하는 8개의 프로브(빨간색 점)의 데이터를 보여줍니다. (iii) 하나의 장치는 빈 96웰 플레이트(공기 전용)와 함께 사용되었지만 두 개의 다른 감지 덮개와 함께 순차적으로 테스트되었습니다. 16개 프로브의 데이터를 그래프로 표시하여 Lid1(왼쪽)의 변동성이 넓고 Lid2(오른쪽)의 변동성이 낮다는 것을 보여주었습니다. (C) 혈청의 양이 다른 100μL 배지의 RPE 배양에 대한 OCR 플롯을 120시간 동안 모니터링했습니다. 무혈청 배지(마젠타)의 RPE 세포는 OCR이 낮으며 혈청 양이 많은 배지보다 OCR이 더 일찍 떨어집니다. 약어: OCR = 산소 소비율; RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
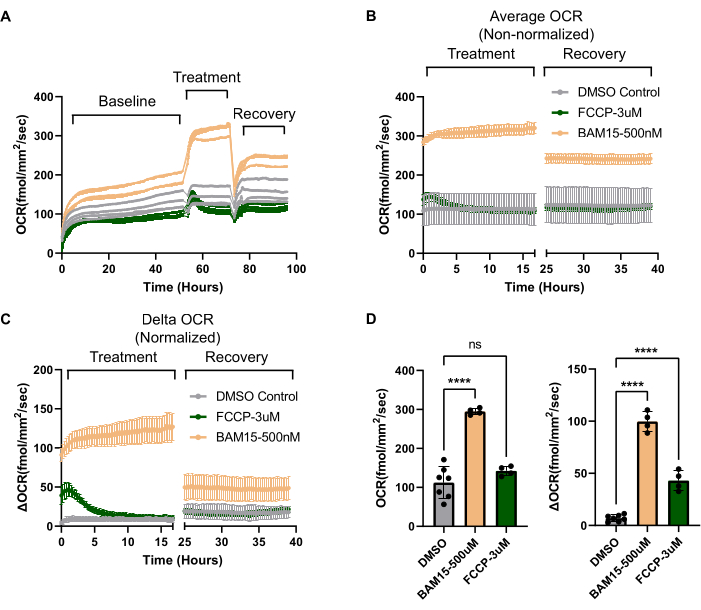
그림 3: OCR 시스템에서 독특하게 입증된 미토콘드리아 언커플러의 장기적 효과. (A) 초기 OCR(50시간 이상 설정), 치료 단계(약물 추가 후 ~20시간) 및 회복 단계(약물 세척 후 ~20시간)를 강조하는 시간 경과(시간) 경과에 따른 원시 OCR 데이터. RPE는 FCCP(3μM, N=4) 또는 BAM15(500nM, N=4)의 두 가지 다른 미토콘드리아 언커플러로 처리하고 DMSO 차량 대조군(0.6%, N=7)과 비교했습니다. 각 추적은 단일 웰을 나타냅니다. (B) (A)의 각 조건에 대한 모든 웰의 평균 OCR은 치료 및 회복 단계에 대해 표시되었습니다. 정규화가 없으면 (Y 축은 절대 OCR) FCCP로 처리 효과의 크기를 확인하기 어렵습니다. (C) 처리 전에 OCR에서 각 OCR 추적을 빼면 델타 OCR 을 계산할 수 있습니다(Y축에 표시). 이를 통해 웰 간 기준선 OCR의 가변성에도 불구하고 OCR에 대한 처리의 효과를 분리할 수 있습니다. Delta OCR을 사용하면 FCCP의 효과가 분명해집니다. 또한 BAM15에 비해 FCCP가 미토콘드리아 분리에 미치는 영향이 얼마나 짧은지 명백해집니다. 마지막으로, FCCP와 비교했을 때, 약물이 제거된 후에도 BAM15에 노출되면 지속적으로 더 높은 OCR의 새로운 "적응" 상태가 생성된다는 것이 명백해집니다. (D) (B) 및 (C)의 플롯은 막대 그래프 형식으로 표시되므로 정규화되지 않은 데이터(왼쪽 그래프, (B))와 정규화된(델타 OCR, 오른쪽 그래프, (C)) 데이터를 직접 비교할 수 있습니다. 약어: OCR = 산소 소비율; RPE = 망막 색소 상피; FCCP = 카르보닐 시안화물-p-트리플루오로메톡시페닐히드라존; DMSO = 디메틸 설폭사이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
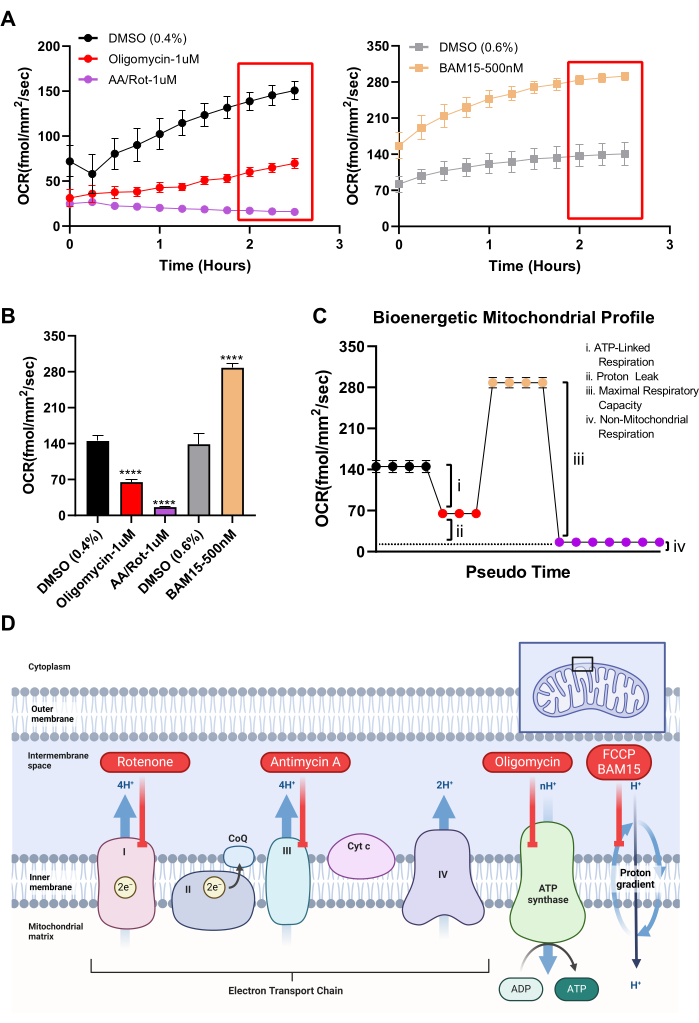
그림 4: OCR 시스템을 활용하여 미토콘드리아 생체 에너지학의 매개변수를 계산합니다. (A) Seahorse Analyzer Mitochondrial Stress Test의 일부인 동일한 소분자를 사용하여 처리 단계의 처음 2.5시간 동안의 OCR이 RPE 배양에 대해 표시됩니다. (왼쪽 그래프) ATP-합성효소 억제제인 올리고마이신(oligomycin)(N=3), 복합체 I 및 III(복합체 I 및 III) 억제제인 안티마이신 A/로테논(antimycin A/rotenone)(N=7) 또는 비히클(vehicle), DMSO 0.4%(N=4). (오른쪽 그래프) 미토콘드리아 언커플러 BAM15(N=4) 또는 비히클 DMSO 0.6%(N=4). (B) 각 치료군에 대한 마지막 3개 시점의 평균((A)의 빨간색 상자). (C) Resipher 데이터를 기반으로 시뮬레이션된 Seahorse 분석기 미토콘드리아 스트레스 테스트 생체 에너지 프로필의 묘사. 시뮬레이션된 그래프의 색상으로 구분된 데이터 포인트는 (B)의 색상으로 구분된 막대 그래프에 해당합니다. 모든 호흡기 매개변수는 Resipher 데이터를 사용하여 계산하고 소분자를 선택할 수 있습니다. (D) 그림 3 및 그림 4 에 사용된 시약의 작용 모드 다이어그램.약어: OCR = 산소 소비율; RPE = 망막 색소 상피; DMSO = 디메틸 설폭사이드; AA = 안티마이신 A; 썩음 = 로테논. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: TGFβ2에 의해 자극된 상피에서 중간엽으로의 전이를 겪고 있는 RPE의 장기 OCR 모니터링. 성숙한 1차 인간 RPE 배양액을 2-3일마다 10ng/mL TGFβ2 또는 차량 대조군으로 처리했습니다. (A) 실시간 OCR 측정은 (B) 시간 경과에 따른 델타 OCR의 정량화(19일-6일)를 통해 3주 동안 모니터링되었습니다. N = 조건당 6-7웰, 쌍을 이루지 않은 t-검정, * P < 0.05. 약어: OCR = 산소 소비율; RPE = 망막 색소 상피; TGFβ2 = 형질전환 성장 인자 베타-2. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 저산소증에 대한 RPE 미토콘드리아 반응 모니터링. (A) OCR 시스템 "샌드위치"는 저산소증 챔버에 조립되었으며 USB 케이블은 뚜껑에 뚫린 구멍을 통해 허브에 연결되고 실리콘 그리스 또는 퍼티로 밀봉되었습니다. 또한 저산소증 챔버에는 습도를 유지하기 위한 멸균수가 담긴 페트리 접시와 휴대용 O2 센서가 있습니다. 전체 시스템은 저산소증 챔버의 대기가 더 낮은O2 농도로 교체된 후 세포 배양 인큐베이터에 방치되었습니다. (B) 매체는 공기-액체 계면 위의O2 농도로 평형을 이루는 데 시간이 걸립니다. 대기 O2 와 평형 된 다양한 부피의 RPE 매체를 96-웰 플레이트의 빈 웰(셀 없음)에 첨가했습니다. 이어서 저산소증 챔버를 5%(50μM)O2로 조정하였다. 각 웰의 매체 내O2 농도를 20시간 동안 모니터링하였다. 더 높은 매체 부피를 가진 웰은 더 낮은 매체 부피보다 더 천천히 5 % O2 와 평형을 이룹니다. N = 8입니다. (C) 이 시스템은 저산소증 챔버의 공기 누출을 감지하는 데 사용할 수 있습니다. 저산소증 챔버는 1%O2로 설정하고, 감지 덮개는 빈 우물(공기 전용) 위에 놓았습니다. 저산소증 챔버의 입구 및 출구 포트를 열린 상태로 두고, 저산소증 챔버 분위기는 ~90시간에 걸쳐 대기 O2 수준으로 재평형을 이뤘다. (D) 새로운 매체 및 상층액("조건화된 매체")은 유사한 O2 용해도를 갖는다. 이렇게 하면 배양 중에 조성이 변화함에 따라 매체의 차등 O2 용해도에 대한 우려가 제거되며, 이는 시간이 지남에 따라 OCR 판독값의 일관성에 영향을 미칩니다. 동일한 부피(100 μL)의 신선한 배지("새로운 배지") 또는 세포에서 48시간 동안 배양된 배지("조건화된 배지")를 세포가 없는 플레이트의 웰에 첨가했습니다. OCR 시스템 "샌드위치"는 처음에 대기 O2 수준에 노출된 다음 저산소증 챔버(3-5% O2 또는 30-50 μM)로 전달된 다음 다시 대기 O2 수준으로 전달되었습니다. 공기 중의O 2 레벨은 비어있는(공기 전용) 우물의 프로브에 의해 모니터링되었습니다. 두 매체 유형 사이의 각 전이 동안의O2 농도의 변화는 동일하며, 이는 두 매체 유형 간의O2 용해도가 동일하다는 것을 보여준다. N = 6입니다. 약어: OCR = 산소 소비율; RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 온라인 계산기로 측정한 RPE 단층의O2 농도. 온라인 계산기 스크린샷(https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture). 계산기를 사용하여 RPE 단층에서 사용 가능한 산소의 양을 결정하는 방법에 대한 자세한 내용은 텍스트를 참조하십시오. 약어: RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
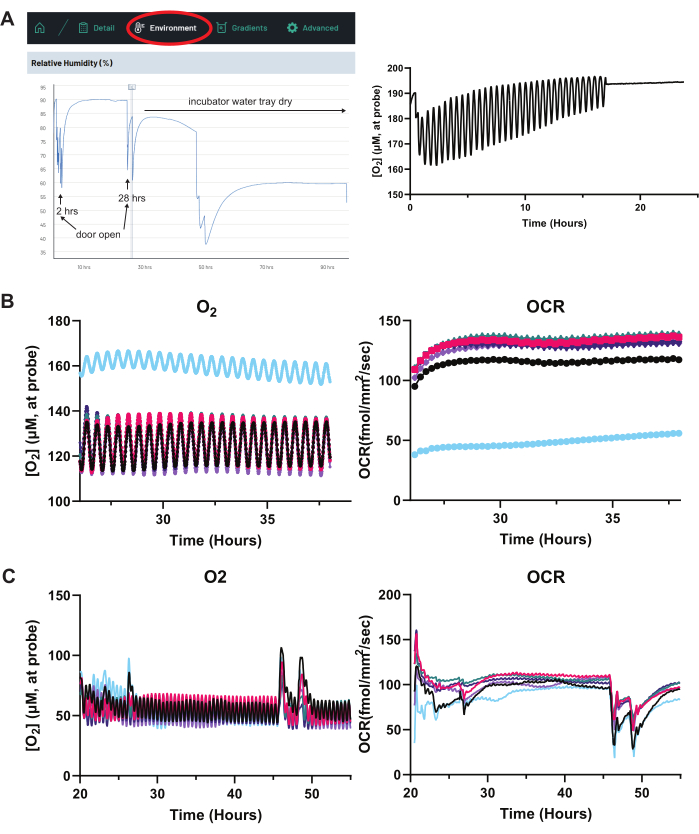
그림 8: 실험 문제 해결: 증발, 건강하지 않은 세포 및 과도한 OCR 변동. (A) 과도한 증발. 유정에 대한 OCR 추적에 불규칙성이 있는 경우 먼저 시스템의 온라인 인터페이스(왼쪽)에서 환경 탭을 클릭합니다. 여기에서 습도, 온도 및 대기압을 모니터링할 수 있습니다. 세포 배양 인큐베이터를 열면 일시적으로 습도가 중단됩니다(트레이스의 2시간 및 28시간 참조). 그러나 30시간부터 시작하여 문을 열지 않아도 시간이 지남에 따라 습도 추적이 지속적으로 낮아집니다. 이는 세포 배양 인큐베이터 물 트레이가 건조되었음을 시사합니다. 습도나 온도가 손상되면 OCR 판독값이 변경됩니다. (오른쪽) 습도가 낮으면 증발이 악화됩니다. 오른쪽 트레이스에서 빠른 증발을 겪고 있는 웰은 센서 프로브 편위의 상단과 하단 사이의O2 농도 차이가 점진적으로 작아지는 것을 보여줍니다(RPE 단층보다 1mm - 1.5mm 위). 이는 프로브 팁이 공기-매체 인터페이스에 가깝다는 것을 나타냅니다. O2 농도가 알려진 대기O2 농도(~200μM)에 가까운 값에서 "평탄선"을 판독할 때 이는 프로브 팁이 매체 컬럼에서 완전히 벗어나 공기만 샘플링한다는 것을 나타냅니다. OCR 판독값은 더 이상 유효하지 않으며 이러한 웰은 즉각적인 매체 교체가 필요합니다. (B) 건강하지 않은 세포. 각 개별 웰의 O2 및 OCR 트레이스를 플로팅하면 일반적으로 세포가 비정상하여 발생하는 이상치 웰을 식별할 수 있습니다. 여기서 파란색 추적으로 지정된 우물은 건강에 해롭습니다. N = 6웰. (C) 인큐베이터 도어 개구부 및 배지 교체. 인큐베이터 도어가 열리는 동안 대기 습도, 온도, 압력 및 CO2 의 변화와 매체 변화는 웰에 설정된 평형 O2 구배를 일시적으로 방해하여 이러한 그래프에서 초기와 후반에 비정상적인 O2 및 OCR 스파이크를 유발합니다. N = 6웰. 약어: OCR = 산소 소비율. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
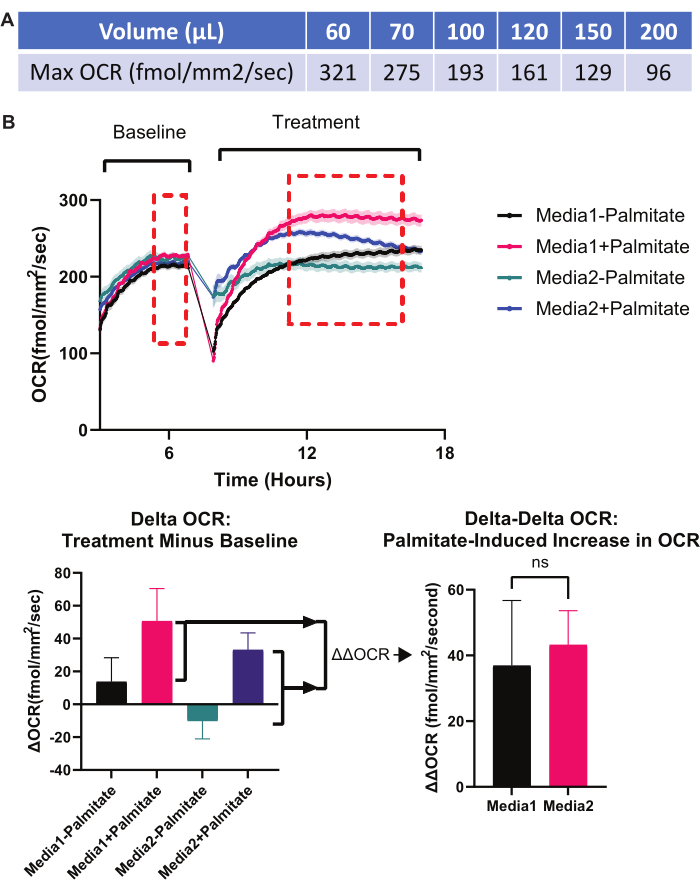
그림 9: 실험 문제 해결: 미디어 볼륨 및 정규화. (A) 미디어 볼륨은 가능한 최대 OCR을 제한합니다. 매체 부피가 높을수록 RPE 단층에서O2 가용성이 낮아지기 때문에 96웰 플레이트의 단일 웰에 있는 각 매체 부피는 최대 OCR을 갖습니다. 이 OCR 이상에서 세포 수준의 O2 는 본질적으로 0 % (무산소)입니다. 따라서 주어진 미디어 볼륨에 대한 최대 이론적 OCR에 가까운 경우 미디어 볼륨을 낮추는 데 유용하므로 실험 과정에서 OCR "천장 효과"가 나타나지 않습니다. 각 매체 부피(표준 96웰 플레이트)에서 달성할 수 있는 최대 이론적 OCR이 표시됩니다. 모든 값은 프로토콜 섹션 4에서 설명한 온라인 계산기를 사용하여 계산되었으며 그림 7에 표시되어 있습니다. (B) 적절한 정규화. 한 변수가 미토콘드리아 대사를 유도하는 다른 변수의 능력에 미치는 영향에 관심이 있는 실험의 경우 델타-델타 OCR 실험 설정이 이상적입니다. (B)의 설정에서는 팔미테이트의 β산화를 촉진하는 두 개의 서로 다른 매체의 능력이 테스트됩니다. 지방산의 β산화가 발생하면 미토콘드리아 OCR이 크게 증가해야 합니다. 일부 매체는 다른 매체보다 팔미틴산 β산화를 더 잘 촉진할 수 있습니다. OCR 그래프의 왼쪽에는 두 개의 서로 다른 배지(미디어 1 대 미디어 2)가 RPE 배양의 평행 웰에 소개되어 있습니다. 기준 OCR을 얻습니다. 다음으로, 팔미테이트는 각 매체 유형을 포함하는 웰의 절반에 추가됩니다. 이렇게 하면 미디어 1 - 팔미테이트, 미디어 1 + 팔미테이트, 미디어 2 - 팔미테이트, 미디어 2 + 팔미테이트의 네 가지 조건이 생성됩니다. 이러한 각 새로운 미디어 조건에 대한 OCR 응답이 기록됩니다. 다음으로, 실험적 처리 후 OCR 값(처리 단계에서 빨간색 점선 상자의 평균)을 처리 전의 기준 OCR 값(기준선 단계에서 빨간색 점선 상자의 평균)에서 빼서 델타 OCR 막대 그래프(왼쪽 하단)를 만듭니다. 마지막으로, 미디어 1과 미디어 2의 β산화를 촉진하는 능력은 델타-델타 OCR 막대 그래프(오른쪽 하단)에서 결정됩니다. 여기서 "미디어 1의 델타 OCR + 팔미테이트"와 "미디어 1의 델타 OCR - 팔미테이트"의 차이를 계산하여 "미디어 2의 델타 OCR + 팔미테이트"와 "미디어 2의 델타 OCR - 팔미테이트"의 차이와 비교합니다. 이러한 유형의 실험 설정 및 정규화는 β산화를 촉진하는 미디어 1과 미디어 2의 효과를 분리합니다. 이 정규화의 일반적인 구조는 OCR을 변경할 수 있는 다른 변수의 능력에 대한 한 변수의 효과를 측정하는 모든 실험에 적용할 수 있습니다. 약어: OCR = 산소 소비율; RPE = 망막 색소 상피. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: RPE 세포 배양 배지의 제조법. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
RPE의 미토콘드리아 대사는 AMD 및 PVR을 포함한 일반적인 실명 망막 질환의 발병기전에 중요한 역할을 합니다. RPE 미토콘드리아 대사 를 체외에서 모델링하면 신진대사 상태를 주변 조직의 신진대사 상태와 분리할 수 있을 뿐만 아니라 조직을 통제된 방식으로 다양한 질병 시뮬레이션 모욕에 노출시킬 수 있습니다. 이러한 RPE 미토콘드리아 대사의 in vitro 모델링은 in vivo에서 RPE를 밀접하게 근사화하는 데 필요한 적절한 분화 상태 및 극성을 달성하는 고충실도 인간 1차 및 iPSC-RPE 배양의 출현에 의해 촉진되었습니다. 이러한 배양에서 산소 소비율(OCR)을 모니터링하는 것은 미토콘드리아 대사를 모니터링하는 이상적인 방법이지만, OCR 모니터링 설정은 종종 고도로 분극화되고 완전히 분화된 RPE에 필요한 조건에서 배양을 성장시키지 못합니다. 여기에서는 Resipher를 고도로 분화되고 분극화된 RPE 배양에서 OCR의 실시간 장기 평가를 통해 RPE 미토콘드리아 대사를 모니터링하기 위한 새로운 시스템으로 설명합니다.
RPE에서 OCR을 모니터링하기 위해 다른 방법이 사용되었습니다. Seahorse XF 분석기는 미토콘드리아 기능의 급성 조작을 통해 단기간에 OCR을 모니터링하도록 설계되었습니다. 그러나 Seahorse 분석은 세포를 맞춤형 플레이트에서 성장시켜야 하며, 이는 높은 RPE 극성 및 분화를 지원하는 데 도움이 되지 않습니다21. Calton, Vollrath 및 동료들은 미세 다공성 멤브레인을 조각으로 자르고 Seahorse 플레이트에 넣어 미세 다공성 지지체에서 성장한 고도로 분화된 RPE 배양을 평가하기 위해 Seahorse를 조정했지만, 이 방법은 세포가 CO2 에 접근할 수 없기 때문에 배양의 단기 종료점 모니터링에만 여전히 효과적입니다 분석 중에, 분석은 비멸균 조건에서만 수행될 수 있으며, 미세 다공성 지지체를 절단하면 시간이 지남에 따라 미세 다공성 지지체의 가장자리 부분에 사멸 및 기능 장애가 유발됩니다22. Barofuse는 미세 다공성 지지체에서 성장한 RPE 스트립을 관류 시스템에 로드할 수 있는 펌프가 없는 관류 시스템으로, OCR을 실시간으로 모니터링할 수 있습니다23. Calton, Vollrath 및 동료들이 Seahorse에 대해 수정한 설정과 유사하게, Barofuse를 사용한 RPE 평가의 주요 한계는 미세 다공성 지지체를 절단해야 한다는 점과 분석의 단기적인 종점 특성입니다. Oxygraph는 또한 대사 조작에 대한 반응으로 OCR의 빠른 운동 변화를 위해 설계되었습니다24. 그것은 RPE 문화에는 사용되지 않았으며 Seahorse 및 Barofuse와 같이 매우 양극화되고 차별화 된 RPE 문화를 평가하는 데 동일한 제한을 겪을 것입니다.
이러한 다른 방법과 달리, 여기에 설명된 OCR 시스템을 사용하면 RPE가 표준 세포 배양 CO2 인큐베이터에서 표준 RPE 배지를 사용하여 표준 조건의 표준 세포 배양 플레이트/기질에서 배양되는 동안 OCR을 모니터링할 수 있으므로 고도로 분화되고 분극화된 RPE 배양을 쉽고 편리하게 프로빙할 수 있습니다. 시스템에 의한 실시간 OCR 변경에 대한 데이터를 생성하는 것 외에도 OCR 모니터링 기간이 끝날 때 동일한 셀을 추가 분석에 사용할 수 있습니다. 이를 통해 OCR에 대한 중재의 효과를 몇 주에 걸쳐 반복적으로 테스트하거나(예: 그림 5의 RPE EMT 유도) 중재의 장기 회복을 테스트할 수 있거나(예: 그림 3의 미토콘드리아 분리로부터의 회복) 초기 중재에 대한 반응으로 계단식 대사 변화를 모니터링할 수 있는 매우 유연한 실험을 수행할 수 있습니다(예: 그림 - 배지 영양소가 고갈된 후 OCR에 대한 혈청의 효과) 2). 이 논문의 OCR 시스템은 고도로 분극화되고 분화된 RPE 문화에서 OCR을 측정하는 데 특히 편리합니다. 이러한 배양은 기능적으로 분열 후(postmitotic)이며, 꽉 조여져 있고 색소 침착이 심합니다. 이는 각 웰이 거의 동일한 세포 번호9를 포함하고 있음을 의미하며, 따라서 대부분의 실험에서 OCR을 세포 수로 정규화할 필요가 없습니다. 세포 수에 대한 정규화가 필요한 경우에도 RPE 색소 침착이 심하고 세포 경계가 잘 구분되어 있어 명시야 이미징을 기반으로 하는 비침습적 단순 세포 수로 정규화가 가능합니다. 그림 5의 EMT 실험과 같이 미분화 RPE 및 RPE 증식과 관련된 실험의 경우, "세포당" OCR이 무엇인지 알기 위해 웰당 OCR을 세포 수로 정규화하는 것이 필요합니다.
망막 분야 밖에서, 이 시스템은 췌장 섬 세포(pancreatic islet cells)25, 골격근(skeletal muscle)26, 난소암(ovarian cancer)27, 심근세포(cardiomyocytes)28, 심지어 예쁜꼬마선충(C. elegans) 29과 같은 전체 유기체를 포함한 다양한 세포 유형에서 세포 호흡 및 대사 활동을 연구하는 데 사용되어 왔습니다. 여기에 설명된 OCR 시스템을 사용한 OCR의 실시간 장기 모니터링은 이러한 다양한 질병 모델에서 생체 에너지 변화 및 미토콘드리아 기능 장애에 대한 주요 통찰력을 보여주었습니다.
Resipher 시스템에는 제한 사항이 있습니다. OCR을 결정하는 방법은 Seahorse Analyzer, BaroFuse 또는 Oxygraph와 근본적으로 다릅니다. OCR을 계산하기 위해 O2 그래디언트를 설정해야 하며 그래디언트를 설정하는 데 몇 시간이 걸릴 수 있습니다. 따라서 다른 시스템에서는 가능한 빠른 역학 실험이 이 시스템에서는 불가능합니다. 또한 다른 시스템과 달리 Resipher에는 소분자의 빠른 전달 또는 대사 산물 수집을 위한 주입 포트가 없습니다. 대신, 세포 배양 후드에서 감지 뚜껑을 제거하고, 약물을 주입하거나 배지를 교체하고, 분석할 대사 산물을 수동으로 수집해야 합니다.
이 문서에 설명된 OCR 시스템을 사용하여 실험을 설정하고 문제를 해결하려면 다음을 수행하는 것이 좋습니다. 첫째, 증발을 최소화합니다. RPE 단층 위의 매체 열에 있는O2 그래디언트는 컬럼9의 높이에 크게 의존하며 시스템은O2 그래디언트를 기반으로 OCR을 계산합니다. 따라서 증발로 인해 실험 중에 매체 컬럼이 현저하게 낮아지면O2 그래디언트가 변경되어 OCR 판독값에 영향을 미칩니다. 인큐베이터의 물 트레이를 가득 채우는 것이 중요하지만 96웰 플레이트의 사용하지 않는 모든 웰에 물을 넣는 것도 좋습니다. 또한, 플레이트 가장자리에 있는 웰은 증발 속도가 더 높기 때문에 위에 제시된 일반적인 실험에서 이러한 웰에는 세포가 비어 있습니다. OCR 시스템의 습도 센서는 인큐베이터 습도를 모니터링하는 데 도움이 될 수 있습니다. 그림 8A에서 실험 중 습도 강하는 인큐베이터의 물 트레이가 비어 있음을 시사합니다. 우물에서 증발이 가속화됨에 따라 우물의 O2 농도 판독 값은 더 높아지고 결국 대기 O2 농도 (~ 200 μM)에서 "평탄선"이 될 것입니다 (그림 8A).
둘째, OCR 시스템의 "샌드위치"가 적절하게 조립되었는지 확인합니다. 장치 하단과 감지 덮개 상단의 금속 접촉 지점은 완전한 접촉을 방해하는 이물질이 없이 깨끗해야 합니다. 장치와 감지 덮개는 완전히 같은 높이로 부착되어야 하며 기울어지지 않고 96웰 플레이트에 균일하게 정렬되어야 합니다. 장치를 허브에 연결하는 USB 케이블은 장력이 가해져 있지 않아야 하며, 이로 인해 "샌드위치"의 토크가 발생하고 장치의 적절한 움직임이 제한될 수 있습니다.
셋째, 장치와 감지 덮개 센서가 보정되었는지 확인합니다. 그림 2B 는 각 실험을 시작할 때 적절한 센서 기능을 빠르게 확인하는 방법을 자세히 보여줍니다. 넷째, 실험적 조작 전에 특정 웰이 이상치 OCR을 나타내지 않는지 확인합니다. 센서가 작동하는지 확인한 후 세포가 있는 모든 웰에 대한 기준선 OCR 값을 결정하면 특정 웰에 비정상 세포가 포함되어 있는지 확인하는 데 도움이 될 수 있습니다. 그림 8B 는 기준선 OCR 평가를 받는 여러 웰을 보여주며, 여기서 파란색 웰은 분명히 더 낮은 OCR(따라서 높은O2 농도)을 보여줍니다. 이 웰은 이상치이며 실험적 조작에서 제외해야 합니다.
다섯째, 활성 OCR 판독 중 환경 조작을 최소화합니다. O2 그래디언트는 온도, 습도, 인큐베이터 CO2 수준 및 대기압의 변화에 매우 민감합니다. 인큐베이터 도어 개방은 이러한 요인에 큰 영향을 미치며, 배지 컬럼의 O2 그래디언트가 평형으로 돌아올 때까지 OCR 판독에 일시적인 중단을 일으킵니다(그림 8C). OCR에 영향을 미치는 매개변수는 "환경" 탭 아래의 시스템 온라인 인터페이스에서 모니터링할 수 있습니다(그림 8A).
여섯째, 실험에 가장 적합한 미디어 볼륨을 결정합니다. 매체 부피가 충분하지 않으면 과도한 증발(위의 첫 번째 문제 해결 방법 참조) 또는 매체 내 영양소의 조기 고갈로 인한 아티팩트가 생성될 수 있지만, 과도한 매체 부피는 RPE 단층에 대한 O2 가용성을 제한하여 저산소증9를 유발합니다. 도 7 은 RPE 단층에서O2 농도에 대한 매체 부피의 효과를 결정하는 데 사용할 수 있는 온라인 계산기의 스크린샷이다. 주어진 미디어 볼륨에 대해 가능한 최대 OCR은 그림 9A에 표시되어 있습니다. 주어진 부피를 사용하는 주어진 실험에 대한 OCR 속도가 그림 9A에 표시된 속도와 비슷하면 RPE 단층에서의O2 농도가 산소 결핍(0%)에 가까워지고 더 낮은 매체 부피가 필요합니다. 일반적으로 RPE 배양에서 미토콘드리아 집약적 공정과 관련된 실험은 96-웰당 75μL를 넘지 않아야 합니다.
일곱째, OCR에 대한 실험적 개입의 효과를 분리하기 위해 적절한 정규화를 수행합니다. 서로 다른 웰은 서로 다른 기준선 OCR을 가질 수 있으므로 실험적 개입 전에 각 웰에 대한 기준선 OCR 판독값을 얻는 것이 중요합니다. OCR에 대한 실험적 개입의 효과를 보여주는 "델타 OCR"을 얻기 위해 실험적 개입 후 OCR에서 기준선 OCR을 뺍니다. "델타 OCR"을 얻는 방법은 그림 3 및 그림 9B에 설명되어 있습니다. OCR을 유도하는 다른 실험적 중재의 능력에 대한 한 실험적 중재의 효과에 관심이 있는 경우, 추가적인 정규화 단계인 "델타-델타 OCR"이 필요합니다. 이러한 예는 그림 9B에 나타나 있으며, 여기서 팔미테이트(1회 실험적 중재)가 OCR을 증가(β산화 유도를 통해)를 유도하는 능력은 RPE 배양(2차 실험적 중재)을 위한 배지 유형에 따라 달라집니다.
마지막으로, 오염 위험을 최소화하십시오. 이 시스템은 세포 위의 매체에 산소 센서를 도입하여 OCR을 모니터링합니다. 이것은 감염의 위험을 증가시킵니다. 실험 중 OCR이 예기치 않게 떨어지거나 실험 시작 시 예기치 않게 낮은 OCR은 감염의 징후일 수 있습니다. 세포 배양 현미경으로 플레이트의 감염 여부를 적극적으로 모니터링해야 합니다. 96웰 플레이트 간의 교차 오염은 감지 덮개를 재사용하는 경우 발생할 수 있습니다. 이러한 교차 오염을 최소화하려면 실험이 완료된 후 오염 제거를 위해 뚜껑 전체를 70% 에탄올에 20분 동안 담가야 하며, 새 실험에서 감지 뚜껑을 재사용해야 합니다(프로토콜 섹션 1.2.15 참조).
결론적으로, Resipher라는 새로운 시스템을 사용하여 OCR 평가를 통해 고충실도 RPE 배양에서 미토콘드리아 대사를 실시간으로 장기간 모니터링하기 위한 프로토콜이 제시됩니다. 이 제품은 고도로 분극화되고 분화된 RPE 배양에 대한 수많은 응용 분야에 사용될 수 있으며, 특히 AMD 및 PVR을 포함한 망막 질환의 체외 모델에서 분리된 RPE의 생리학적 대사 특성과 변형된 RPE 대사 특성을 조사하는 데 사용할 수 있습니다.
공개
리처드 A. 브라이언(Richard A. Bryan)과 킨 로(Kin Lo)는 리시퍼 시스템을 제조하는 루시드 사이언티픽(Lucid Scientific)의 직원이다.
감사의 말
우리는 대조군으로 새로운 매체와 조건화된 매체에서 O2 용해도를 테스트하는 아이디어에 대해 Daniel Hass 박사와 Jim Hurley 박사에게 감사드립니다. 원고에 대한 편집에 도움을 주신 Magali Saint-Geniez 박사님께 감사드립니다. Resipher USB 케이블로 저산소증 챔버를 개조해 준 Kellogg Eye Center의 Instrument and Electronic Services Core의 Scott Szalay에게 감사드립니다. HFT 연구에는 연방 기금이 사용되지 않았습니다. Electronic Services Core는 National Eye Institute의 P30 EY007003 의해 지원됩니다. 이 연구는 Research to Prevent Blindness(RPB)의 무제한 부서 보조금으로 지원됩니다. J.M.L.M.은 건성 연령 관련 황반변성을 위한 제임스 그로스펠드 이니셔티브(James Grosfeld Initiative for Dry Age-Related Macular Degeneration), E. 마틸다 지글러 시각 장애인 재단(E. Matilda Ziegler Foundation for the Blind), 에버사이트 안구 은행 보조금, 국립 안과 연구소(National Eye Institute)의 K08EY033420 보조금, 디 앤 딕슨 브라운(Dee and Dickson Brown), 데이비드 앤 리사 드류스 디스커버링 호프 재단(David and Lisa Drews Discovering Hope Foundation)의 지원을 받고 있습니다. D.Y.S.는 UNSW 사이언티아 프로그램(UNSW Scientia Program)의 지원을 받습니다. L.A.K.는 Iraty Award, Monte J. Wallace, Michel Plantevin, National Eye Institute의 R01EY027739 보조금 및 국방부 육군 의료 연구 획득 활동 VR220059의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | #25-200-056 | |
| 3,3',5-triiodo-L-thyronine sodium salt | Sigma | T5516 | |
| 32-channel Resipher lid | Lucid Scientific | NS32-101A for Falcon | |
| Antimycin A from streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent to increase mitochondrial respiration |
| DMSO, cell culture grade | Sigma-aldrich | D4540-100ML | Vehicle for reconstituting mitochondrial drugs |
| Extracellular matrix coating substrates: Synthemax II-SC | Corning | #3535 | Extracellular matrix for hfRPE |
| Extracellular matrix coating substrates: Vitronectin | Gibco | A14700 | Extracellular matrix for iPSC-RPE |
| FCCP | Sigma | C2920-10MG | Uncoupling agent to increase mitochondrial respiration |
| Fetal Bovine Serum (Bio-Techne S11550H) | Bio-Techne | S11550H | |
| Hydrocortisone-Cyclodextrin | Sigma | H0396 | |
| Hypoxia chamber | Embrient Inc. | MIC-101 | |
| N1 Media Supplement | Sigma | N6530 | |
| Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| O2 sensor | Sensit technology or Forensics Detectors | P100 or FD-90A-O2 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Recombinant human TGFβ2 | Peprotech | 100-35B | Transforming growth factor beta-2 to induce epithelial-mesenchymal transition |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain |
| System-compatible plate | Corning | #353072 | |
| Taurine | Sigma | T8691 | |
| αMEM (Alpha Modification of Eagle's Media) | Corning | 15-012-CV |
참고문헌
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: emerging roles in age-related macular degeneration. Int J Mol Sci. 21 (12), 4271(2020).
- Shu, D. Y., Lovicu, F. J. Myofibroblast transdifferentiation: the dark force in ocular wound healing and fibrosis. Prog Retin Eye Res. 60, 44-65 (2017).
- Hurley, J. B. Retina metabolism and metabolism in the pigmented epithelium: a busy intersection. Annu Rev Vis Sci. 7, 665-692 (2021).
- Wu, W., et al. Deficient RPE mitochondria energetics leads to subretinal fibrosis in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (8), 2420(2023).
- Hansman, D. S., et al. Metabolic reprogramming of the retinal pigment epithelium by cytokines associated with age-related macular degeneration. Biosci Rep. 44 (4), BSR20231904BSR20231904(2024).
- Li, K. X., et al. Modulation of pyruvate kinase M2 activity as a therapy in a primary RPE cell culture model of proliferative vitreoretinopathy. Invest Ophthalmol Vis Sci. 62 (8), 2213(2021).
- Gupta, S., et al. Progress in stem cells-based replacement therapy for retinal pigment epithelium: in vitro differentiation to in vivo delivery. Stem Cells Transl Med. 12 (8), 536-552 (2023).
- Wilson, D. F., et al. Oxygen distribution and vascular injury in the mouse eye measured by phosphorescence-lifetime imaging. Appl Opt. 44 (25), 5239-5248 (2005).
- Hass, D. T., et al. Medium depth influences O2 availability and metabolism in human RPE cultures. Invest Ophthalmol Vis Sci. 64 (14), 4(2023).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFβ2-Induced EMT of retinal pigment epithelial cells. Int J Mol Sci. 22 (9), 4701(2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Front Mol Neurosci. 15, 896786(2022).
- Ng, P. Q., Saint-Geniez, M., Kim, L. A., Shu, D. Y. Divergent metabolomic signatures of TGFβ2 and TNFα in the induction of retinal epithelial-mesenchymal transition. Metabolites. 13 (2), 213(2023).
- Kar, D., et al. Choriocapillaris impairment is associated with delayed rod-mediated dark adaptation in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (12), 41(2023).
- Curcio, C. A., Kar, D., Owsley, C., Sloan, K. R., Ach, T. Age-related macular degeneration, a mathematically tractable disease. Invest Ophthalmol Vis Sci. 65 (3), 4(2024).
- Maminishkis, A., et al. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47 (8), 3612-3624 (2006).
- Maminishkis, A., Miller, S. S. Experimental models for study of retinal pigment epithelial physiology and pathophysiology. J Vis Exp: JoVE. (45), e2032(2010).
- Zhang, Q., et al. A platform for assessing outer segment fate in primary human fetal RPE cultures. Exp Eye Res. 178, 212-222 (2019).
- Sharma, R., Bose, D., Montford, J., Ortolan, D., Bharti, K. Triphasic developmentally guided protocol to generate retinal pigment epithelium from induced pluripotent stem cells. STAR Protoc. 3 (3), 101582(2022).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. FASEB J. 34 (10), 13106-13124 (2020).
- Rosenfeld, P. J., Trivizki, O., Gregori, G., Wang, R. K. An update on the hemodynamic model of age-related macular degeneration. Am J Ophthalmol. 235, 291-299 (2022).
- Fitch, T. C., et al. Real-time analysis of bioenergetics in primary human retinal pigment epithelial cells using high-resolution respirometry. J Vis Exp: JoVE. (192), (2023).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Mol Vis. 24, 425-433 (2018).
- Grumbine, M. K., et al. Maintaining and assessing various tissue and cell types of the eye using a novel pumpless fluidics system. J Vis Exp: JoVE. (197), (2023).
- Mu, C., Shearer, J. Protocol for measuring respiratory function of mitochondria in frozen colon tissue from rats. STAR Protoc. 4 (4), 102560(2023).
- Rocha, D. S., Manucci, A. C., Bruni-Cardoso, A., Kowaltowski, A. J., Vilas-Boas, E. A. A practical and robust method to evaluate metabolic fluxes in primary pancreatic islets. Mol Metab. 83, 101922(2024).
- Kanaan, M. N., et al. Cystine/glutamate antiporter xCT controls skeletal muscle glutathione redox, bioenergetics and differentiation. Redox Biol. 73, 103213(2024).
- da Veiga Moreira, J., et al. Methylene blue metabolic therapy restrains in vivo ovarian tumor growth. Cancers. 16 (2), 355(2024).
- McNally, L. A., Altamimi, T. R., Fulghum, K., Hill, B. G. Considerations for using isolated cell systems to understand cardiac metabolism and biology. J Mol Cell Cardiol. 153, 26-41 (2021).
- Misare, K. R., et al. The consequences of tetraploidy on Caenorhabditis elegans physiology and sensitivity to chemotherapeutics. Sci Rep. 13 (1), 18125(2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.