Method Article
高分化型および分極した網膜色素上皮培養における酸素消費速度の長期モニタリング
* これらの著者は同等に貢献しました
要約
私たちは、網膜色素上皮(RPE)培養における酸素消費率(OCR)を測定するための新しいデバイスを紹介します。このデバイスは、プレートが標準細胞培養インキュベーター内にある間に、標準培地で標準細胞培養プレートで成長したRPEで一度に数週間OCRを測定できます。
要約
ミトコンドリアの代謝は、光受容体の生存に重要な網膜の細胞の単層である網膜色素上皮(RPE)の正常な機能にとって重要です。RPEミトコンドリア機能障害は、先進国における不可逆的な失明の主な原因である加齢性黄斑変性症(AMD)と、網膜剥離の失明を伴う合併症である増殖性硝子体網膜症(PVR)の特徴です。RPEの変性条件は、 in vivo RPEを模倣するために高度に分化され、分極されたRPE培養システムによって十分にモデル化されています。しかし、ミトコンドリア機能の代理である酸素消費率(OCR)のモニタリングは、理想的なRPEの分極と分化を促進する条件ではOCR測定が容易ではないため、このような培養システムでは困難でした。
ここでは、標準的な細胞培養インキュベーターで最適な増殖基質と生理学的培養培地上のRPEを維持しながら、高分化型RPE培養で一度に数週間OCRをモニターする新しいシステムResipherを紹介します。このシステムは、細胞上の培地に存在する酸素濃度勾配を測定することによりOCRを計算します。OCRを検出するための他の方法と比較した場合のこのシステムの利点と、RPE培養でOCRを測定するためのシステムのセットアップ方法について説明します。システムの使用に関する重要なヒントとコツ、データの解釈に関する注意、予期しない結果のトラブルシューティングに関するガイドラインについて説明します。
また、システムによって検出された細胞上の培地中の酸素勾配に基づいて、低酸素症、正常酸素症、または高酸素症のRPE培養の経験のレベルを推定するためのオンライン計算機も提供しています。最後に、PVRモデルにおけるRPE細胞の代謝状態の測定と、RPEが低酸素症にどのように代謝的に適応するかを理解するという、システムの2つのアプリケーションについて概説します。このシステムを高度に分極し分化したRPE培養に使用することで、生理学的および疾患的状態の両方でのRPEミトコンドリア代謝の理解が深まると期待しています。
概要
網膜色素上皮(RPE)は、機能的に有糸分裂後の高度に分極された上皮細胞の単層であり、網膜の光感受性光受容体とその血液循環との間の障壁を形成します。これは、絨毛毛細血管と呼ばれる毛細血管床です。グリア支持ニューロンの役割と同様に、RPEは、視細胞の外側セグメントの食作用、光受容体の栄養素の輸送と代謝サポート、視覚機能の維持に不可欠な成長因子の分泌など、光受容体をサポートするための無数の機能を実行します。
RPEの変性は、視覚のいくつかの一般的な変性疾患の根底にあります。加齢黄斑変性症(AMD)は、世界で最も多い難治性視力喪失の原因の一つであり、RPEが死滅し、その上にある光受容体が二次変性を起こします。増殖性硝子体網膜症(PVR)では、RPEは代わりに通常は静止している有糸分裂後の状態から抜け出し、増殖して間葉系状態(いわゆる上皮間葉系への移行[EMT])に脱分化し、代謝が変化します。RPEの脱分化は、光受容体へのRPEサポートの喪失を引き起こすと同時に、より線維化した状態を引き起こします。これにより、視細胞の変性とRPE誘発性の瘢痕化の両方が起こり、どちらも視力低下を引き起こします1,2。
RPEの光受容体に対するサポートの大部分は代謝性であり、代謝調節不全はAMDやPVRを含む多くの網膜疾患の重要な要素です。RPEは、光受容体とその酸素および栄養素の供給源である絨毛毛細血管との間の調節障壁として機能します。したがって、RPEが代謝するために選択するものと、RPEが絨毛細血管から光受容体を通過するために選択するものが、光受容体の代謝と生存を強く支配します。多くの研究により、RPEは正常な健康のためにミトコンドリア代謝に大きく依存しており、光受容体は代わりに解糖系に大きく依存していることが示されています3。これにより、光受容体とRPEとの間の補完的で絡み合った代謝状態の概念が導入されました。具体的には、RPEは、好ましい視細胞代謝基質の代謝を減少させ、代わりに、光受容体が消費しない代謝産物と組み合わせた光受容体代謝の副産物を利用します。PVRやAMDなどの疾患では、RPEがより解糖性が高くなり、ミトコンドリア代謝への依存度が低くなるという証拠が強く示唆されています。このRPE解糖系へのシフトは、必要な代謝物の光受容体を飢えさせ、変性を引き起こす可能性があります4,5,6。RPEと光受容体代謝がどれほど相互依存的であるか、そして代謝の変化が網膜疾患の根底にあるかを考えると、治療目的でRPE代謝をモデル化および操作することに強い関心が寄せられています。
RPEミトコンドリア代謝をin vivoで研究することは理想的ですが、RPEミトコンドリア代謝の多くの側面は、in vitro培養システムでしか実際に調査できません。過去数十年の間に、忠実度の高いRPE培養に向けた大きな進歩が見られ、現在では最も慎重に手入れされたRPE培養物がヒト臨床試験の細胞補充療法に使用されています7。このような忠実度の高い培養を維持するためには、実験の数か月前に、RPEを特定の培地の特定の基質上で増殖させる必要があります。これらの条件により、RPE培養物は最大限に分化および分極され、in vivo RPEに近似します。残念ながら、現在、in vivo の RPE からミトコンドリア代謝を特異的に測定できる機器はありません。網膜毛細血管網の酸素モニタリングは、電子常磁性共鳴(EPR)酸素濃度計8を使用してin vivoで達成されていますが、これはRPE分析では不可能です。in vivoとin vitroのRPE代謝の違いは十分に説明されていませんが、RPE培養物はin vivoのRPEと同様に高いミトコンドリア活性を持つことが示されています3,9、これは、忠実度の高いRPE培養を使用してRPEミトコンドリア代謝に関する重要な洞察を得ることができることを示唆しています。
すべてのミトコンドリア代謝は酸素消費につながるため、RPE酸素消費率(OCR)の測定はミトコンドリア代謝の忠実な代理です。RPEの分極と分化を最大にする条件では、タツノオトシゴアナライザーなどの現在利用可能な技術では長期にわたる正確なOCR測定ができないことが多いため、RPE培養におけるOCRの測定は困難でした。この手法論文では、Resipher(以下、「システム」)と呼ばれる新しいデバイスが導入され、偏光と分化を最大限に促進する条件下で成長したRPEでOCRを数週間にわたって連続的に測定できます。RPEの分化と分極を最大限促進するRPE培養条件において、このシステムによるOCRの測定の容易さは、既存のOCR測定デバイスの中でも独特です。
このホワイト ペーパーでは、RPE カルチャでシステムを使用するためのヒントとコツを提供し、その後に 2 つの特定のアプリケーションのデモを示します。まず、PVRを模倣したRPE EMTは、トランスフォーミング成長因子ベータ(TGFβ)1,10,11,12への曝露によって引き起こされます。このシステムは、EMTプロセス中にRPE代謝がどのように進化するかを監視するために使用されます。第二に、RPE代謝における低酸素症の役割は、このシステムを使用して調査されます。低酸素症は、絨毛細血管が13,14 歳で薄くなるため、AMD の病因に重要な貢献をしています。このシステムを低酸素チャンバーと組み合わせることで、RPEミトコンドリア代謝の変化と、加齢に伴う微妙な低酸素症をモデル化することができます。最後に、Resipherデータを使用したオンライン計算機が導入され、RPE培養物が低酸素、正常酸素、または高酸素のいずれの状態にあるかを判断できます。このような情報は、in vitro RPE培養研究からRPE代謝に関する結論を導き出すために重要です。
プロトコル
ヒト初代培養またはiPSC-RPE培養を確立するためのプロトコルについては、以下の参考文献15,16,17,18を参照してください。これらのプロトコルのためのヒト組織の取得と使用は、ミシガン大学の治験審査委員会(HUM00105486)によって審査され、許可されました。
1. RPE文化へのシステムの一般的な適用
- システム適合の96ウェルプレートにヒト誘導多能性幹細胞(iPSC)由来のRPE細胞または初代ヒトRPE細胞をプレート化します。
- 既存の成熟培養物を24ウェル細胞培養プレートで培養したと仮定すると、細胞をリン酸緩衝生理食塩水(PBS)で一度洗浄した後、500 μLの0.25%トリプシン-EDTAを加えます(材料表)。細胞培養インキュベーターで10〜40分間インキュベートし、細胞が丸くなり、ほぼ剥離する準備ができるまで5〜10分ごとにチェックします。
- 培地を細胞上に静かにピペットで移し、細胞培養プラスチックから取り除いた後、3倍容量の細胞培養培地(24ウェルあたり1,500μL)に移し、遠心分離機で250 × g 、室温で5分間スピンダウンします。
注:RPE細胞培養培地のレシピは表1に詳述されており、以前に公開された参考文献9,15,16,17,18で入手できます。 - 15%ウシ胎児血清(FBS)を含むRPE細胞培養培地に細胞を再懸濁し、血球計算盤で細胞をカウントします。
- 96ウェルプレートの各ウェル(通常225-300 × 105 細胞/cm2)に対して、製造元の指示に従って高度に特殊化された細胞外マトリックスコーティング基質(材料表)でコーティングした後、74,000個の細胞を播種します。
注:シードセルは、Resipher適合プレート(材料表)および検出蓋(32チャンネル蓋の列3、4、9、および10列)上のプローブアレイに対応するウェルのみに存在します。システムのセンシングリッドには、4チャンネル、32チャンネル、または96チャンネルのセンサー(図1A-Dのセンサー位置を参照)が用意されており、さまざまな標準細胞培養プレートに対応しています。 - エッジウェルは蒸発しやすく、酸素の利用可能性に大きく影響するため、OCRの読み取り値には、すべてのエッジウェル(96ウェルプレートの行AおよびH)に細胞を播種しないようにします。さらに、96ウェルプレートの各空ウェルに200μLの滅菌水を加えて、蒸発の影響を減らします。
- プレートを安定したテーブル面に10分間置いて、セルが落ち着くようにします。その後、それをインキュベーターに戻します。24〜72時間後に培地を交換し、5%FBSを含む標準のRPE培養培地と交換します。少なくとも4週間培養し、週に2回メディアを交換します。
注:細胞は、色素が入り、丸石で、非常にコンパクトになると、実験の準備が整います(図1E)。
- システムによるデータのセットアップと集録
- 空の96ウェルレシーバープレートにセンシング蓋を置き、これを細胞培養インキュベーターに戻します。デバイスをセンシングリッドに位置合わせして取り付け、付属のUSBケーブルでハブに接続します。これにより、Resipher の "サンドイッチ " が作成されます (図 2A)。
- Lucid ラボの Web サイト アプリケーション (https://lab.lucidsci.com/) に移動し、右上隅にある [新しい実験 ] ボタンをクリックして新しい実験を作成します。
- 実験のタイトルを記入し、特定の研究に関連する実験ノート(使用しているiPSC-RPEの通過番号など)を入力します。
- 井戸条件と処理グループを作成します。例えば、OCRで培地中の異なる血清濃度の影響をテストする場合は、グループ名で「Serum」を選択し、使用する培地の血清濃度を入力し、「+」ボタンをクリックして血清パーセント値を追加します。特定の血清の割合を受け取るウェルを割り当て、それらのウェルのカラーパターンを選択します。必要に応じて、グループの追加ボタンをクリックして、グループ(テストする別の実験変数など)を追加します。
- プレート設定を定義し、対応するデバイスとプレート スタイルを選択します。[プレートの追加]ボタンをクリックして、[デバイス]を選択します。プレートタイプを選択します。治療を選択し、対応するウェルをクリックします。
- [ 今すぐ開始 ] ボタンをクリックして、実験を開始します。のインジケーターを確認してください webサイトとハブのLEDが 緑色に点灯しています。
- システムを15〜60分間稼働させて、各センサーが適切に校正され、大気中の酸素を正確に検出し、5%CO2 を含む完全加湿細胞培養インキュベーターで~200μMの濃度であることを確認してください(図2Bi)。
注:標準的な細胞培養インキュベーターのセットアップで、いずれかのセンサーが他のセンサーの平均から20%以上ずれている場合は、センサーが故障しているため、データ解析でその井戸を除外することを検討してください(図2Bii)。
注:すべてのセンサーが他のセンサーの平均から20%以上ずれており、標準的な細胞培養インキュベーターのセットアップで200μMと報告された予想される大気O2 から外れている場合は、センシングの蓋が何度も使用されています。新しいセンシングリッドと交換します(図2Biii)。
注:実験を開始する前に空気中のO2 測定値を取得すると、実験後のトラブルシューティングが大幅に改善されます。実験が行われた後に特定の井戸が外れ値として表示され、その井戸にキャリブレーションされていないセンサーがある場合、問題は生物学的複製ではなくセンサーにある可能性があります。 - デバイスをセンシングカバーから取り外します(ただし、USBケーブルをデバイスから取り外さないでください)。デバイスをインキュベーターに逆さまに置き、デバイスのモーターをリセットできるようにします。すべてのモーター音が停止するまで(約20〜30秒)、デバイスを再利用しないでください。
注:実験中は、デバイスがセンシングリッドから外れているときでも、常にデバイスをUSBケーブルでハブに接続しておくことが重要です。これにより、デバイスは細胞培養インキュベーター環境を継続的に監視し、報告することができます。 - センシング蓋付きのプレートを細胞培養フードに戻し、RPE培養物を含む96ウェルプレートをセットします。すべてのウェルについて同じ培地と同じ容量のRPE培養でプレート内の培地を交換し、各ウェルのベースラインOCR値を取得します。RPEを含まないすべてのウェルには、蒸発を防ぐために滅菌水を入れてください。
注:一般的に、培地の量が少ないと栄養素が急速に枯渇するが、培地の量が多いと不注意な低酸素症につながることを示すデータに基づいて、96ウェルあたり60〜100μLのRPE培地を推奨します9。 - 検出蓋を細胞培養物入りプレートに移し、細胞培養物入りプレート上の標準(非免疫)蓋を空の96ウェルレシーバープレートに移して、実験中のさまざまなポイントで必要となる標準蓋の無菌性を維持します。
- 細胞培養とセンシング蓋を入れたプレートを細胞培養インキュベーターに戻します。もう一度、デバイスをセンシングリッドに位置合わせして取り付け、付属のUSBケーブル(「サンドイッチ」の組み立て)を介してハブに接続します。のインジケーターを確認します webサイトインターフェイスとハブがすべて 緑色に点灯しています。
注:O2 濃度データはすぐに表示されますが、OCRデータは十分なO2 データが収集された後(約1時間)にのみ表示されます。 - デバイスで各ウェルのOCRを少なくとも12〜24時間測定して、ベースラインOCRをキャプチャさせます。
注:ベースラインOCRは、細胞に適用される培地の種類など、多くの要因によって異なります。 図 2C では、FBS の量が異なる標準 RPE 培地 (0%、5%、15%) の OCR 値はわずかに異なります。さらに、FBSを多く含む培養物は、培地を細胞に適用した後、ミトコンドリア代謝物の枯渇によりOCRが低下する前に、ミトコンドリアの活性をより長く維持することができます(曲線の右側)。 - ベースラインOCRが得られたら、ステップ1.2.8-1.2.12を繰り返しますが、RPE培養物を含むプレート上の培地を実験条件に変更します(通常は、薬物±または異なる培地条件の比較)。
メモ: 定期的なメディア交換も同じ方法で処理できます。細胞培養インキュベーターを開くと、温度、湿度、CO2 濃度、およびインキュベーターのドアが開くと一時的に中断されるその他の要因に依存するため、OCRの読み取りに大きな混乱が生じることが予想されます。デバイスをセンシングの蓋から取り外す際は、実験をオンラインで一時停止する必要はありません。細胞培養インキュベーターのドアを開けた後、またはプローブ対象のプレート上で培地を交換した後、酸素勾配を再確立し、正確なOCRの測定を開始するには、通常2〜4時間かかります。 - データを取得した後、実験条件が適用された後、OCRから各ウェルの ベースライン OCRを差し引き、治療によってトリガーされる デルタOCR を決定します。
- 実験が完了したら、センシング蓋を滅菌して再利用します(3〜5回再利用できますが、繰り返し使用すると性能が低下します)。センシングリッドを滅菌するには、リッド全体を70%エタノールに10分間細胞培養フードに浸し、その後、浸漬から取り出してキャビネットプローブ側を上にして休ませ(デリケートなプローブチップに触れないように)、エタノールと水を完全に蒸発させてから、新しい96ウェルレシーバープレートにセンシングリッドを置きます。
- 明視野画像を撮影して、OCR値をセル番号に正規化します。
注:RPEにおけるメラニン蓄積は、明視野顕微鏡を用いた生体培養中の細胞数の単純なカウントに基づくOCRの正常化を促進します。- 手順1.2.8のように、デバイスを取り外して逆さまに置きます。細胞培養フードで、RPE培養プレートの検出蓋を標準の96ウェル蓋と交換します。
- 標準的な倒立顕微鏡を使用して、各ウェルの明視野画像を撮影します。
注:エリア1の画像は、ウェル間で一貫性を保ちます(ウェル内の相対位置と客観的な倍率)。 - 細胞培養フードで、RPE培養プレートの標準的な96ウェル蓋をセンシング蓋に交換し、インキュベーターに戻してさらにモニタリングします。
- ImageJなどのソフトウェアで各ウェルの細胞数をカウントします。
- OCRをさまざまな実験グループの細胞番号に正規化します。OCRは、断面積単位面積当たりの消費量をfmol・(mm2)-1・s-1-の単位で報告します。したがって、細胞あたりのOCRを正規化するには、OCRを(ウェルあたりの細胞数ではなく)mmあたりの 細胞数2で除算します。同様に、システムによって報告されたOCRにウェルの断面積(標準的な96ウェルプレートで約31 mm2 )を掛けて、fmol・s-1・well-1の単位でOCRを算出します。
- RPE生体エネルギーパラメータを決定するための制御。
注:システムおよびRPE培養物が予測可能な方法でミトコンドリア操作に応答していることを確認するために、ミトコンドリアの酸化的リン酸化の特定のステップを標的とする確立された特定の小分子を試験することができます。これらの試験は、タツノオトシゴアナライザー10 を使用したミトコンドリアストレス試験で実施されるステップに類似しており、RPE培養の生体エネルギープロファイルを提供します。- RPE細胞を5% FBSを含む65 μLの標準RPE培養培地で培養し、OCRを24時間測定してベースラインを確立します。
- 培養培地を吸引し、5% FBSおよびミトコンドリアアンカプラー(3 μM カルボニルシアン化物-p-トリフルオロメトキシフェニルヒドラゾン[FCCP]または500 nM Bam15、 材料表)を含む65 μLの標準RPE培養培地を加えます。一晩インキュベートします。
注:ミトコンドリアアンカプラーはOCRを大幅に増加させるはずです。増加したOCRが、標準的な培養条件で65μLの培地に対して理論上の最大拡散制限OCRである約275 fmol・(mm2)-1・s-1 に近づいていないことを確認してください。一般的に使用されるさまざまなメディアボリュームの最大OCRは、ディスカッションセクションで利用できます。 - 一晩インキュベートした後、ミトコンドリアアンカプラーで培地を吸引し、5% FBSを含む65 μLの標準RPE培地と交換します。プレートをさらに24時間観察して、薬物の除去後のRPE OCRの回復を決定します。
- 治療前に得られたOCRから治療後に得られたOCRを差し引いて、OCRに対するアンカプラーの影響を計算します(図3)。
注:ミトコンドリアアンカプラーの追加によるOCRの増加は、細胞19の予備的なミトコンドリア呼吸能力を意味する。 - タツノオトシゴ分析計によるミトコンドリアストレステストで通常取得される他のミトコンドリアパラメータを測定するには、以下の化合物を使用して上記と同じ手順を実行します(図4)。
- オリゴマイシンを1 μMで使用して、ATP関連呼吸を評価します。
- アンチマイシンAとロテノンを1 μMで使用して、非ミトコンドリア呼吸を評価します。
注:FCCP、オリゴマイシン、アンチマイシンA、およびロテノンはRPEに対して毒性がある可能性があります。それらが重大な細胞死を誘発する場合、OCR測定は正確ではありません。したがって、OCR測定は、明らかな細胞死がない時点、通常は薬物が追加されてから最初の数時間以内にのみ取得する必要があります(図4)。
2. 救急救命士のRPEにおけるミトコンドリア代謝の変化測定
- セクション 1.2 で概説されているのと同じプロトコルに従います。
- ベースラインのOCR測定値を取得した後にEMTを誘導するには、TGF-β2(10 ng / mL)をRPE培養物に添加し、OCRを3週間にわたってモニターします。2〜3日ごとに新しいTGFβ2でメディアをリフレッシュしてください(図5)。
- 少なくとも週に2回、セクション1.3のように明視野画像を取得して、細胞数が変化していないことを確認します。カウントが変化した場合は、OCR値を各ウェルのセル番号に正規化します。
注:同じプロトコルをEMTの他のインデューサーに使用して、細胞がインキュベーター内にある間の培養期間を通じて長期的なOCR変化をモニターすることができます。
3. 低酸素RPEにおけるミトコンドリア代謝の変化測定
注:低酸素、正常酸素、または高酸素条件下でのシステムの適用は、標準的な細胞培養インキュベーターに置かれた低酸素チャンバー(材料表)に「サンドイッチ」を保持することを除いて、セクション1.2と同じです。
- 低酸素チャンバーの蓋に穴を開けてUSB Type-cケーブルを取り付け、シリコンまたはパテで密封します(図6A)。
- フード内の細胞培養プレートでセンシング蓋を組み立て、低酸素チャンバーに移します。
- 「サンドイッチ」(プレート、センシングリッド、デバイス)を低酸素チャンバーにセットします。また、低酸素チャンバーに滅菌水を入れたシャーレを入れて、湿度を維持します。最後に、ポータブルO2 センサーを低酸素チャンバーに入れます(材料の表)。セットアップを 図 6A に示します。
- チャンバーを密閉し、低酸素濃度O2 および標準細胞培養濃度CO2 (例:1% O2 および5% CO2)のガスボンベに接続します。
- 酸素センサーが目的のO2濃度(通常は1%から10%)を示すまで、低酸素チャンバー内の空気をシリンダー内の1%O2/5%CO2空気とゆっくりと交換します。
注:ポータブルO2 センサーは平衡化に時間がかかるため、シリンダーからのガスをゆっくりと低酸素チャンバーに追加する必要があります。 - 低酸素チャンバーの入口バルブと出口バルブを閉じ、チャンバー全体をインキュベーターに移します。
- セクション 1.2 のように実験を設定して開始します。
注:細胞に添加する前に低酸素チャンバー内で培地を事前に平衡化することで、細胞単層が真の低酸素状態を経験するのにかかる時間を短縮できます(図6B)。
4. RPE単層でのO2 濃度を計算して、細胞が低酸素、正常酸素、または高酸素状態にあるかどうかを判断します
注:このシステムは、標準プレートが単層培養に対応する推奨センシング蓋とともに使用されると仮定して、デフォルトでウェルの底から約1〜1.5 mm上のO2 濃度を測定します(https://lucidsci.com/docs/LucidScientific_Sensing_Lid_Selection_Guide.pdf を参照)。細胞単層でのO2 濃度は直接測定されませんが、システムのデータを使用してRPEレベルでのO2 濃度を推定できます。具体的には、O2 が利用可能な培地カラムの上部とO2 が消費されている培地カラムの下部との間に酸素勾配が存在することがわかっているため、Fickの拡散の法則を測定されたOCRレートと組み合わせて、細胞単層のO2 レベルを推定できます。この見積もりの計算機はオンラインで提供されています:https://lucidsci.com/notes?entry=oxygen_diffusion(そして、https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture のオープンソースのインタラクティブノートブックの形で、この計算機のソースコードは https://github.com/lucidsci/oxygen-diffusion-calculator にあります)。
- 計算機にアクセスしたら、 メディア容量をマイクロリットル( 100μLなど)で入力します。
- 気液界面(細胞の上の培地列の上部)での飽和酸素濃度を入力します。この値は、標準大気圧、O2 5%、湿度95%で~185 μMです。
注:これは、培地のみのウェル(ウェルの底にセルがない)のシステムプローブによるO2 測定からも決定できます。 - 「Flux」入力に、システムによって報告された「Flux/OCR」を入力します。
- これらの値に基づいて、 培地列の各高さにおける定常状態の酸素濃度 が計算され、プロットに示されます(図7)。プロットの x 軸 は、 ウェルの底からの高さ (mm 単位) です。 y軸 は、 その高さで計算されたO2 濃度 (μM)です。
- ウェルの底部(細胞がある場所)のO2 濃度は、プロットの下の線で報告されています。
注:一般に、 in vivo でのRPEは4〜9%のO2 濃度を見ると推定されています。標準的な大気条件で各10μMのO2 は、約1%のO2に相当します。したがって、細胞レベルでの正常酸素は、O2の約40〜90μMである。メディアカラムが高いほど、O2 はRPE単層9のレベルで低くなります。したがって、細胞が低酸素状態にあるように見える場合、培地の量を減らすことができます。細胞が高酸素状態にあるように見える場合は、培地の量を増やすことができます。
結果
Resipher実験の「サンドイッチ」セットアップを 図2Aに示します。96ウェルプレート上のカラム3、4、9、および10に対応する32個のプローブを備えたセンシングリッドが、セルプレートとデバイスの間に配置されています。ハブに接続した後、デバイスはモーターを作動させてセンシングリッドを上下に動かし、セル単層(通常は1〜1.5 mm)上の高さの範囲でメディアカラム内のO2 濃度を測定します。したがって、O2 勾配は、単層の上のこれらのさまざまな高さでのO2 濃度を記録することにより、連続的に測定されます。グラジエント測定とフィックの拡散の法則の適用により、デバイスはプローブの高さ範囲の上から下までの酸素フラックスを自動的に計算します。これはセル単分子膜の酸素消費率(OCR)です。検出蓋は、ウェルが空(空気のみ)、培地で満たされているが細胞が充填されていない(培地のみ)、または細胞単層の上に培地がある(培地+細胞)かどうかに関係なく、O2 を検出します。センシングリッドのセンサーがどの程度機能しているかの品質チェックとして、まずリッドを空の(空気のみの)96ウェルプレートの上に置くことができます。各ウェルの各センサーが機能している場合、報告されたO2 は互いに一致し、標準的な細胞培養インキュベーター条件下で大気中の予想されるO2 に近い200μMに近いはずです。 図2Bi は、大気中の8つのプローブからのO2 の読み取り値を示しています(デフォルトの単位変換ではプローブが37°Cの液体中にあると想定されているため、μM単位の濃度として報告されています)。これらの測定値はタイト(±5%)で、200μM近くであり、8つのセンサーすべてが良好に機能していることを示しています。 図2Biiでは、 図2Bi と同じセンシングリッドが使用されていますが、異なるデバイスが展開されています。ここでは、2つの故障したデバイスセンサーが外れ値曲線(赤)に基づいてピックアップされています。これは、デバイスに問題があるため、交換する必要があることを示しています(または、故障したセンサーに対応するウェルを実験から除外する必要があります)。 図2Biiiでは、 図2Bi と同じデバイスを使用していますが、2つの異なる検出リッドが使用されています。Lid1(左側)はプローブ間でばらつきが大きく、通常は蓋の使用回数が多すぎるために蓋の検出材料が劣化していることを示唆しています。Lid2(右側)は新しく、約200μMに密集した測定値を示しています。 図2Cに見られるように、血清補充レベルの増加は、RPE OCRレベルを微妙に上昇させる引き金となりました。重要なことに、血清の補給量を増やすことで、ミトコンドリアの代謝をより長期間維持することも可能になりました。血清を補給しなくても、OCRは約90時間持続し、その後、ミトコンドリアの代謝基質の枯渇によりOCRが低下します。したがって、無血清培地であっても、3.5日ごとに(週に2回)96ウェルあたり100 μLの培地交換を行うだけで、成熟した高分化型および分極したRPE培養物における栄養素の枯渇を回避するのに十分です。
OCRレートは、すべてのウェルが同じ細胞数と形態を持つように見える培養物であっても、ウェルごとに大きく異なる可能性があります。したがって、OCRの増加が実験条件に起因するのか、それとも単にウェル間のOCRのベースラインの違いによるものなのかを分離するには、正規化が必要です。標準化の最初のステップは、プロトコルセクション1.3で概説されているように、ウェル間の細胞数が一貫していることを確認することです。ウェル間で細胞数が異なる場合、ウェルのOCRを細胞番号に正規化する必要があります。一般に、高度に成熟した分極したRPE培養では、ウェル間の細胞数は非常に一貫しています9。このようなシナリオでも、 図3Aに示すように、ウェル間のベースラインOCRは異なる場合があります。ここで、治療前のベースラインOCRは、ウェル間で100 fmol/mm2/secも異なります。治療前にOCRを測定することにより、実験的治療によってトリガーされた デルタOCR を決定し、これをウェル間のベースラインOCRの違いから分離できます。この場合、処理は 2 つのミトコンドリア アンカプラー (FCCP と BAM15) と車両制御を比較しています。ベースラインOCRを標準化に利用すると、アンカプラーとコントロールに特有の治療効果が明らかになります( 図3B と 図3Cを比較)。一般に、OCRを変更する可能性のある実験は、ベースラインOCRを確立するための初期OCRと デルタOCRを決定するための治療フェーズの少なくとも2つのフェーズに分割する必要があります。
RPE培養物がミトコンドリア操作に対して期待通りに反応することを確認し、RPEの生体エネルギープロファイルを確立するために、Agilentのタツノオトシゴアナライザーのミトコンドリアストレステストで使用された従来の低分子ツールをシステムで使用できます。まず、予備のミトコンドリア容量は、ミトコンドリアアンカプラー19を利用して測定することができる。RPE培養では、ミトコンドリアアンカプラーBAM15は、毒性を誘発することなく、FCCPと比較してOCRのはるかに堅牢で持続的な増加を示します(図3C、D)。Seahorse Analyzer Mitochondrial Stress Testで利用可能なその他のパラメータ(基礎呼吸、ATP関連呼吸、陽子漏れ、非ミトコンドリア呼吸能力など)は、このシステムを使用して計算できます。Seahorse Analyzerは、上記のパラメータを推測するために、特定の酸化的リン酸化複合体を阻害する毒素を順次送達するために注入ポートに依存していますが、Resipherにはこの機能がありません。ただし、各ミトコンドリア毒素を別々のウェルに追加でき、ビヒクルで処理されたウェルの倍率変化に基づいて異なる呼吸パラメーターを計算できます。 図4Aでは、ミトコンドリアアンカプラーBAM15、ATPシンターゼ阻害剤オリゴマイシン、複合体IおよびIII阻害剤であるアンチマイシン/ロテノン、およびビヒクルコントロール(DMSO)で処理したウェル間のOCRの違いがすべて比較されています。これらの毒素は長期間にわたって細胞死を誘発し、細胞死はOCRに影響を与えるため、OCRの読み取りはわずか数時間の治療後に行われました。 図4B は、 図4Aの最後の時点から推定された、各ミトコンドリア活性小分子で処理されたビヒクルとウェルとの間のOCRの違いを棒グラフ形式で示しています。 図4B のOCR値は、 図4Cに示すように、RPE培養の生体エネルギーパラメータを計算するために使用できます。 図4C の生体エネルギープロファイルの各色分けされた値は、 図4Bの同じ色分けされた値から来ています。したがって、ATP関連呼吸、陽子漏出、最大ミトコンドリア呼吸能力、非ミトコンドリア呼吸能力などのパラメータは、OCRシステムを使用して推定できます。各ミトコンドリア活性小分子の作用機序の要約を 図4Dに示します。
RPEの生体エネルギープロファイルをアッセイするためのRPE培養および制御実験でこのシステムのプロトコルを実証したことで、RPE生物学および病理学へのシステムの実験的応用を探求することができます。網膜剥離または眼の外傷後に発生する状態である増殖性硝子体網膜症(PVR)では、RPEは上皮間葉転換(EMT)として知られる劇的な変化を遂げ、これにより、非常に規則的で丸石のようなRPEが細胞間接着を失い、収縮性で運動性の紡錘形間葉系細胞に分化します1,2.これにより、網膜に接線方向の収縮力が引き起こされ、網膜の剥離が誘発される可能性があります。RPEにおけるEMTの古典的な誘導因子には、トランスフォーミング成長因子-ベータ(TGFβ)および腫瘍壊死因子-α(TNFα)10,11,12が含まれます。3つの哺乳類TGFβアイソフォームのうち、TGFβ2は網膜1におけるEMTの最も顕著で強力な誘導物質であり、特徴的な六角形のRPE細胞の明確な細胞伸長と間葉系マーカーの発現の増加を引き起こします。RPEにおけるTGFβ2によって誘導されるEMT応答は、以前にタツノオトシゴXFe9610を用いて実証されたように、ミトコンドリア呼吸の抑制およびそれに続く解糖能力の増加を伴う。タツノオトシゴはリアルタイムの生体エネルギープロファイルを提供しますが、長期的なOCRモニタリングは可能ではありません。したがって、この研究におけるOCRシステムの最初の適用(図5)では、RPEでTGFβ2を使用してEMTが誘導されたため、ミトコンドリア呼吸が3週間にわたって追跡され、PVR中に発生する代謝リプログラミングのinvitroモデリングが可能になりました。タツノオトシゴ分析装置を使用したRPE EMTの単一時点分析とは異なり、EMTを受けているRPEの代謝状態を数週間追跡できます。RPEをTGFβ2に繰り返し曝露すると、ミトコンドリア代謝が進行的に低下し続けることは明らかです。タツノオトシゴXFアナライザーを使用した以前のデータでは、TGFβ2は24時間および72時間で最大呼吸能力を有意に減少させたが、基礎OCRレベル10には影響しなかったことが示されました。TGFβ2が最大72時間まで変化しなかった基礎OCRは、この研究で使用したOCRシステムによって裏付けられています(図5)。しかし、この研究のOCRシステムからの長期データでは、TGFβ2への曝露から5日後、基礎OCRレベルが低下し始め、基礎OCRの低下は20日後に最も顕著になることが明らかになりました。これらの知見は、以前のタツノオトシゴの時点では捉えられなかった基礎OCRの長期的な変化を浮き彫りにしています。
2番目のアプリケーションでは、このシステムを使用して、低酸素条件下でのRPEミトコンドリア代謝をモニターできます。AMDは絨毛細血管の菲薄化と低酸素症13,20に関連しているため、RPEの亜毒性低酸素症への調整を理解することで、AMDの病因に関する洞察が得られるはずです。ミトコンドリアの代謝をモニタリングしながらRPE培養を制御された低酸素状態にさらすために、システムを低酸素チャンバーに置き、次に細胞培養インキュベーターに入れることができます。このセットアップを容易にするために、低酸素チャンバーの蓋に小さな穴が開けられ、システムのUSBケーブルが低酸素チャンバー内に届くようにします。穴はパテまたはシリコンで塞がれています(図6A)。ポータブルO2センサーを低酸素チャンバーに設置して、大気中のO2レベルを監視し、低酸素チャンバーのシールが無傷のままであることを確認できます。この設定を使用して、大気中のO2濃度と媒体のO2濃度との間の平衡化速度を決定できます。図 6B では、大気中の O2 で平衡化された培地を 96 ウェルプレート上の個々のウェルに細胞なしで配置し、わずか 5% O2(~50 μM O2)を含む低酸素チャンバーに導入します。時間の経過とともに、各ウェル内の媒体は新しい大気濃度と平衡化します。培地カラムの高さが高いほど(容量が多いほど)、平衡化にかかる時間が長くなります。96ウェルプレートのウェルに65μLの培地を入れた場合、大気中のO2との平衡化には約5時間かかります。ただし、メディア容量が100〜200μLの場合、平衡時間は10時間以上かかります。これらの結果は、低酸素実験中に培地を細胞に適用する前に、培地を所望の大気O2濃度で事前に平衡化することの重要性を強調しています。
低酸素実験では、低酸素チャンバー内のO2 レベルが安定していることを確認することが重要です。96ウェルプレート上のエッジウェルの1つに細胞や培地がないようにすることで、センシングリッドセンサーの1つが大気中のO2を継続的に監視できるようになります。 図6Cでは、空気にさらされた単一の井戸でのこのようなモニタリングは、低酸素チャンバーの漏れが遅く、30時間までに細胞が大気中のO2 濃度に近づくことを示しています。低酸素実験の最終的なコントロールとして、「新鮮」培地と「コンディショニング済み」培地でO2 溶解度が異なるかどうかを判断することが重要です。最初に細胞上に置かれた培地と、細胞上に長時間置かれた培地とで溶解度が異なる場合、細胞上の培地列のO2 勾配は、細胞上の経時的に培地の「条件」として異なります。これは、OCRの計算に影響します。 図6Dでは、空のウェル(「空気」)、細胞がないが新鮮な培地が入ったウェル(「新しい培地」)、および細胞がないがRPE培養で48時間インキュベートされた培地(「コンディショニング培地」)を備えた96ウェルプレートを最初に大気O2 に配置して、完全な平衡化を可能にしました。次いで、プレートを約3〜4%O2 (30〜40μM)の低酸素チャンバーに入れ、平衡化させた。最後に、プレートは再び大気中のO2 濃度に戻されました。新しい培地と条件付けされた培地のO2 濃度曲線は同一であり、新しい培地と条件付けされた培地との間のO2 溶解度が同一であることを示しており、栄養素が消費され、副産物が培地に分泌される際の経時的な培地組成の変化はO2 溶解度を有意に変化させず、したがってOCRに不注意で影響を与えないことが確認されています。
細胞上の培地カラムの高さは、RPE単層9におけるO2の利用可能性に劇的に影響するため、特定の培地量がRPE単層における低酸素症、正常酸素症、または高酸素症を誘導しているかどうかを判断することが重要です。システムからの測定値とオンライン計算機(https://lucidsci.com/notes?entry=oxygen_diffusion(および https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture のオープンソースのインタラクティブノートブックの形式)-この計算機のソースコード https://github.com/lucidsci/oxygen-diffusion-calculator)を組み合わせて、RPE単層の酸素濃度を推定できます。図 7 は、対話型計算機のスクリーンショットを示しています。in vivoでのRPEでは、通常、O2濃度が4〜9%で、O2モル濃度が~40〜90μMになります。

図1:さまざまなセンシングリッド上のセンサの位置、32チャンネルセンシングリッドのプレートレイアウト、およびRPEの形態。(A)4チャンネル、(B)32チャンネル、および(C)96チャンネルの蓋オプションのさまざまなセンシング蓋のセンサーの位置に対応するウェル。(D)32チャンネルセンサーリッドの推奨プレートレイアウト。エッジ効果のため、細胞はエッジウェルに播種せず、代わりに培地をこれら4つのウェル(紫色)に配置する必要があります。細胞はオレンジ色のウェルに播種されます。残りの井戸は、蒸発の影響を防ぐために滅菌水(青)で満たす必要があります。(E)六角形の、密集した、色素沈着した細胞を持つ成熟RPE培養。スケールバー = 20 μm。略語:RPE=網膜色素上皮。この図の拡大版を表示するには、ここをクリックしてください。

図2:Resipherシステムの「サンドイッチ」のセットアップと品質管理 (A) センシングリッドは、標準の96ウェルプレートリッドに取って代わり、そのプローブが対応するウェルに挿入されています。黒のデバイスは、磁石を介してセンシングリッドにしっかりと固定されています。図の左側の画像は、デバイスとセンシングの蓋が正しい向きになっていることを示しています。ただし、右側の写真では、デバイスとセンシングリッドを横に回転させて、アンダープロファイルをよりよく表示しています。(B)検知蓋およびデバイスの品質管理。(イ、イ)同じ検知蓋を空の96ウェルレシーバープレート(空気のみ)に置き、2つの異なるデバイスを検知蓋の上に順番に置きます。(i) 最初のデバイスは、8つのプローブからのデータを、低変動性と、大気中のO2と予想される~200μMの読み取り値を示しています。(ii)2番目のデバイスは、2つのプローブが異常に読み取っている8つのプローブからのデータを示します(赤い点)。(iii)1つのデバイスは、空の96ウェルプレート(空気のみ)とともに使用されましたが、2つの異なるセンシング蓋を順番にテストしました。16個のプローブからのデータをプロットしたところ、Lid1(左側)のばらつきが大きく、Lid2(右側)のばらつきが小さいことが示されました。(C)異なる量の血清を含む100 μL培地中のRPE培養物のOCRプロットを120時間モニターしました。無血清培地(マゼンタ)中のRPE細胞はOCRが低く、血清量の多い培地よりもOCRが早く低下しました。略語:OCR =酸素消費率;RPE = 網膜色素上皮。この図の拡大版を表示するには、ここをクリックしてください。
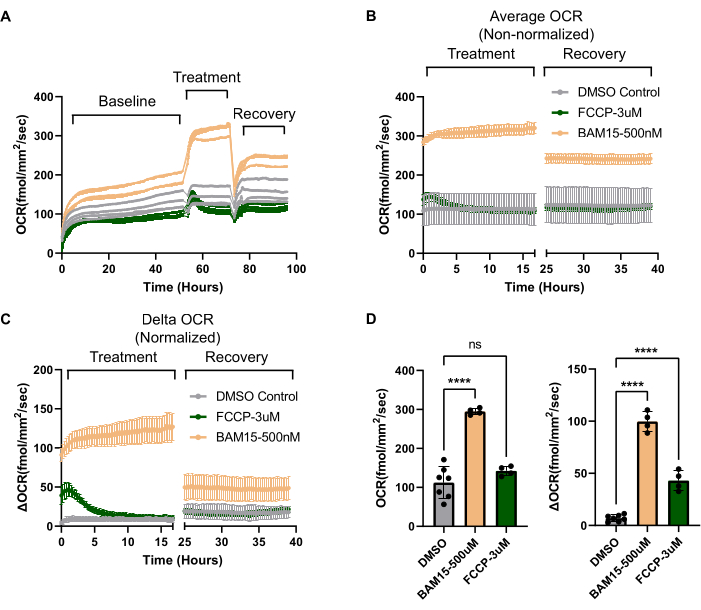
図3:OCRシステムで独自に実証されたミトコンドリアアンカプラーの長期的効果 (A)初期OCR(50時間以上で確立)、治療段階(薬物添加後~20時間後)、および回復段階(薬物ウォッシュアウト後~20時間後)を強調した経時的(時間)にわたる生のOCRデータ。RPEは、FCCP(3 μM、N = 4)またはBAM15(500 nM、N = 4)の2つの異なるミトコンドリアアンカプラーで処理し、DMSOビヒクル制御(0.6%、N = 7)と比較しました。各トレースは 1 つのウェルを表します。(B) (A) 治療段階と回復段階についてプロットされた、(A) の各条件のすべてのウェルの平均 OCR。正規化を行わない場合(Y軸は絶対OCR)、FCCPによる治療効果の大きさを確認することは困難です。(C)処理前に各OCRトレースをOCRから差し引くと、 デルタOCR を計算できます(Y軸にプロット)。これにより、ウェル間でベースラインOCRにばらつきがあるにもかかわらず、OCRに対する治療の影響を分離することができます。 Delta OCRを使用すると、FCCPの効果が明らかになります。また、FCCPがミトコンドリアのアンカップリングに及ぼす影響がBAM15と比較していかに短命であるかも明らかになります。最後に、FCCPと比較して、BAM15への曝露は、薬物が洗い流された後でも、持続的な高いOCRの新たな「適応」状態を作り出すことが明らかになります。(D) (B)と(C)のプロットは棒グラフ形式で表示され、正規化されていないデータ(左のグラフ、(B)から)と正規化されたデータ(デルタOCR、右のグラフ、(C)から)を直接比較できます。略語:OCR =酸素消費率;RPE =網膜色素上皮;FCCP =シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン;DMSO = ジメチルスルホキシド。 この図の拡大版を表示するには、ここをクリックしてください。
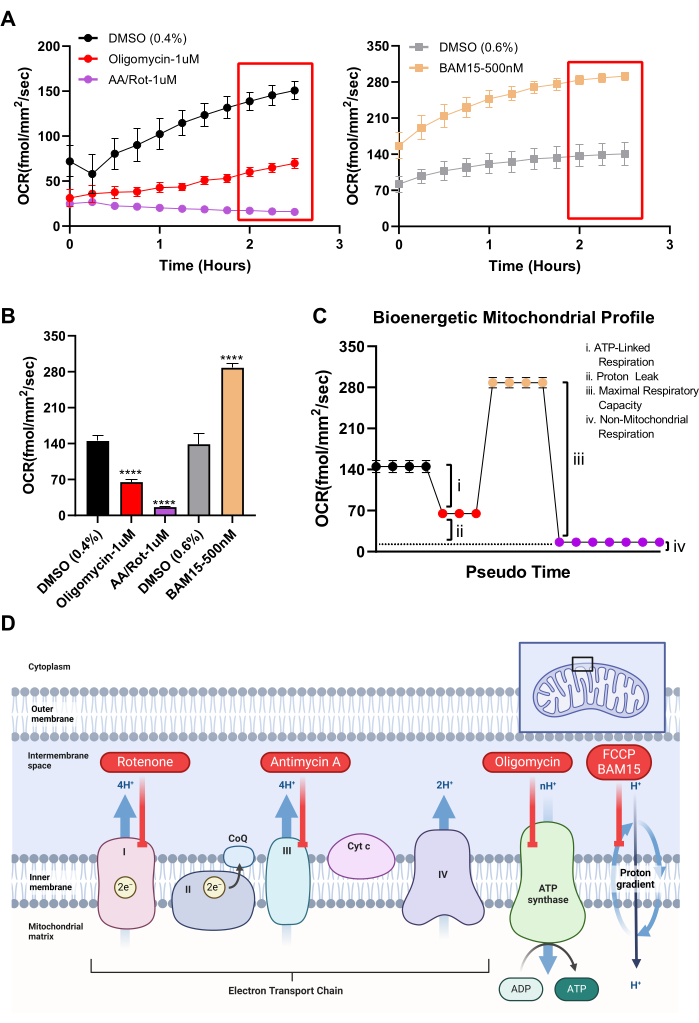
図4:OCRシステムを利用してミトコンドリア生体エネルギー学のパラメータを計算する(A)タツノオトシゴアナライザーのミトコンドリアストレステストの一部であるのと同じ小分子を利用して、処理段階の最初の2.5時間にわたるOCRがRPE培養に描かれています。(左のグラフ)ATP合成酵素阻害剤オリゴマイシン(N=3)、複合体IおよびIII阻害剤であるアンチマイシンA/ロテノン(N=7)、またはビヒクル、DMSO 0.4%(N=4)。(右のグラフ)ミトコンドリアアンカプラーBAM15(N=4)または車両DMSO0.6%(N=4)。(B)各治療群の最終3つの時点の平均((A)内の赤枠)。(C)Resipherデータに基づくシミュレートされたタツノオトシゴアナライザーミトコンドリアストレステスト生体エネルギープロファイルの描写。シミュレートされたグラフ上の色分けされたデータ点は、(B)の色分けされた棒グラフに対応しています。すべての呼吸器パラメータは、Resipherデータを使用して計算し、小分子を選択することができます。(D)図3および図4で使用した試薬の作用機序の図。略語:OCR =酸素消費率;RPE =網膜色素上皮;DMSO = ジメチルスルホキシド;AA = アンチマイシン A;ロット=ロテノン。この図の拡大版を表示するには、ここをクリックしてください。

図5:TGFβ2によって刺激された上皮間葉転換中のRPEの長期OCRモニタリング。 成熟した初代ヒトRPE培養物を10 ng/mL TGFβ2またはビヒクルコントロールで2〜3日ごとに処理しました。 (A) リアルタイムのOCR測定値を3週間監視し、 (B) デルタOCRの経時的な定量化(19日目から6日目)を行いました。条件あたりN = 6-7ウェル、対応のないt検定、* P < 0.05。略語:OCR =酸素消費率;RPE =網膜色素上皮;TGFβ2 = トランスフォーミング成長因子β-2。 この図の拡大版を表示するには、ここをクリックしてください。

図6:低酸素症に対するRPEミトコンドリア応答のモニタリング (A) OCRシステム「サンドイッチ」を低酸素チャンバーで組み立て、蓋に開けた穴を介してUSBケーブルをハブに接続し、シリコングリースまたはパテで密封しました。また、低酸素チャンバーには、湿度を維持するための滅菌水のペトリ皿とポータブルO2センサーがあります。システム全体を細胞培養インキュベーターに残した後、低酸素チャンバーの雰囲気を低濃度のO2に置き換えました。(B)媒体は、気液界面上のO2濃度まで平衡化するのに時間がかかります。大気圧のO2に平衡化された異なる容量のRPE培地を、96ウェルプレートの空のウェル(細胞なし)に添加しました。次に、低酸素チャンバーを5%(50μM)O2に調整しました。各ウェルの培地中のO2濃度を20時間モニターした。培地量の多いウェルは、低培地量よりもゆっくりと5% O2に平衡化します。N = 8 です。(C)このシステムは、低酸素チャンバー内の空気漏れを検出するために使用できます。低酸素チャンバーは1%O2で設置され、センシング蓋は空のウェル(空気のみ)の上に置かれました。低酸素チャンバーの入口と出口のポートは開いたままにされ、低酸素チャンバーの大気は~90時間にわたって大気中のO2レベルに再平衡化されました。これにより、培養中に組成が変化するため、培地にO2溶解度が差すという懸念が解消され、経時的なOCR読み取りの一貫性に影響を与えます。同容量(100 μL)のフレッシュ培地(以下「ニュー培地」)または細胞上で48時間インキュベートした培地(以下「コンディショニング培地」)を、細胞のないプレートのウェルに添加しました。OCRシステム「サンドイッチ」は、最初に大気中のO2レベルにさらされ、次に低酸素チャンバー(3〜5%O2または30〜50μM)に移され、次に再び大気中のO2レベルに移されました。空気中のO2レベルは、空の(空気のみの)井戸のプローブによって監視されました。2つの培地タイプ間の各遷移中のO2濃度の変化は同一であり、2つの培地タイプ間のO2溶解度が同一であることを示しています。N = 6です。略語:OCR =酸素消費率;RPE = 網膜色素上皮。この図の拡大版を表示するには、ここをクリックしてください。

図7:RPE単層でのO2 濃度は、オンライン計算機で測定されました。 オンライン電卓のスクリーンショット(https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture)。計算機を使用してRPE単分子膜で利用可能な酸素量を決定する方法の詳細については、テキストを参照してください。略語:RPE=網膜色素上皮。この図の拡大版を表示するには、ここをクリックしてください。
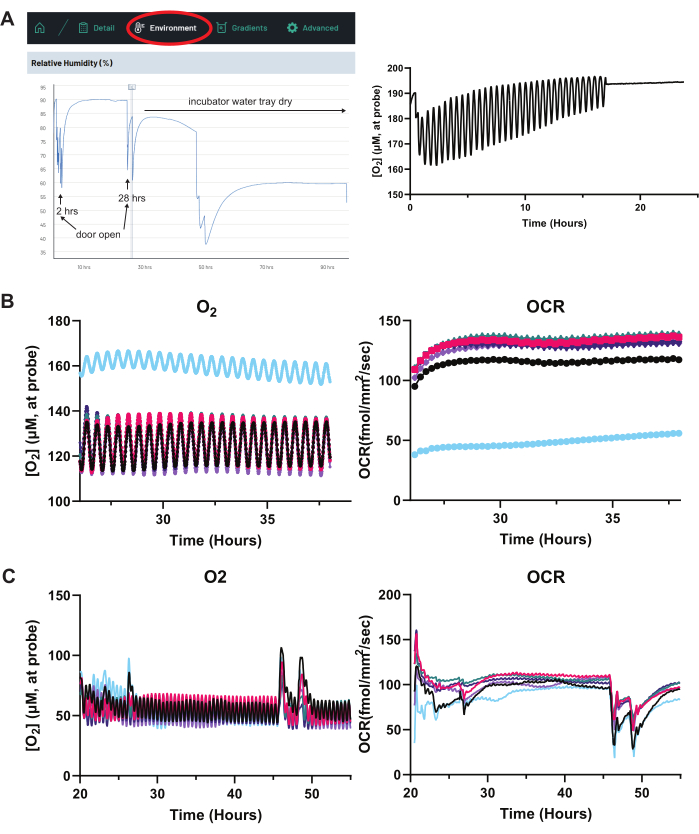
図8:トラブルシューティング実験:蒸発、不健康な細胞、過度のOCR変動。(A) 過度の蒸発。井戸のOCRトレースに不規則性がある場合は、システムのオンラインインターフェースの[ 環境 ]タブをクリックして開始します(左)。ここでは、湿度、温度、気圧を監視できます。細胞培養インキュベーターを開くと、一時的に湿度が乱れます(トレースの2時間および28時間を参照)。ただし、30時間以降、湿度トレースは、ドアが開かなくても、時間の経過とともに一貫して低下します。これは、細胞培養インキュベーターのウォータートレイが乾燥していることを示しています。湿度や温度が乱れると、OCRの読み取り値が変化します。(右)湿度が低いと蒸発が悪化します。右のトレースでは、急速な蒸発が行われているウェルは、センサープローブエクスカーションの上部と下部(RPE単層の1mmから1.5mm上)の間のO2 濃度の差が徐々に小さくなっていることを示しています。これは、プローブの先端がエアメディアインターフェースに近いことを示しています。O2 濃度が既知の大気O2 濃度(~200 μM)に近い値で「フラットライン」を示している場合、これはプローブの先端が完全にメディアカラムから外れており、空気のみをサンプリングしていることを示しています。OCRの読み取り値は無効になり、そのようなウェルはすぐにメディアを交換する必要があります。 (B) 健康でない細胞。個々のウェルのO2 およびOCRトレースをプロットすることで、通常は細胞が不健康であることによって引き起こされる外れ値のウェルを特定できます。ここでは、青いトレースで指定された井戸は健康ではありません。N = 6ウェル。 (C) インキュベーターのドアの開口部と培地の交換。インキュベーターのドアが開いている間の大気湿度、温度、圧力、CO2 の変化は、培地の変化とともに、ウェル内に確立された平衡O2 勾配を一時的に乱し、これらのグラフの早い段階と後半で異常なO2 およびOCRスパイクを引き起こします。N = 6ウェル。略語:OCR =酸素消費率。 この図の拡大版を表示するには、ここをクリックしてください。
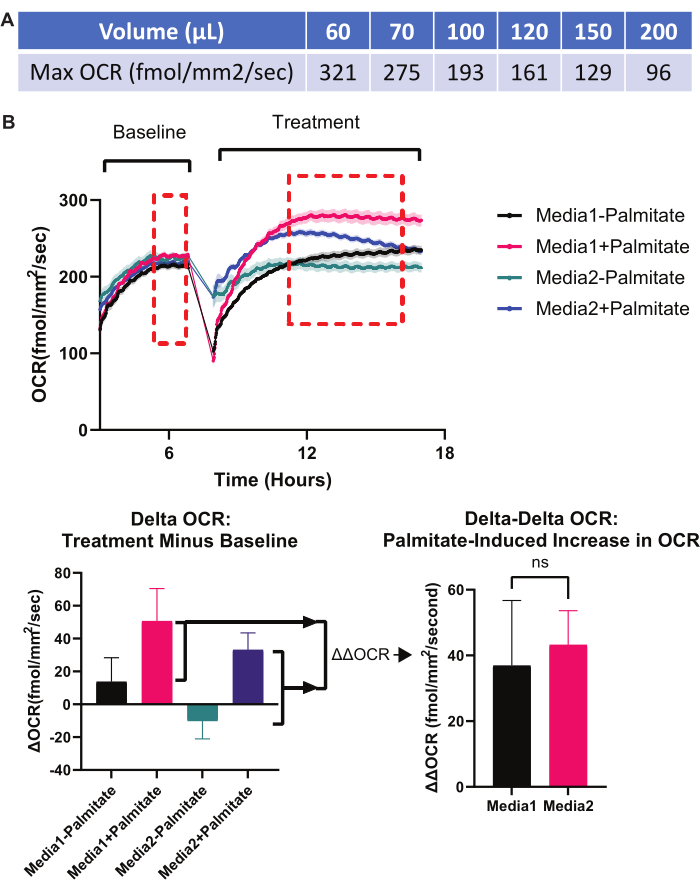
図9:トラブルシューティングの実験:メディアの音量と正規化。(A) メディアの音量は、可能な最大OCRを制限します。培地量が多いと、RPE単層でのO2 の利用可能性が低くなるため、96ウェルプレートの1つのウェル内の各培地容量は最大のOCRを持ちます。このOCRを超えると、セルレベルのO2 は基本的に0%(無酸素)です。したがって、あるメディアボリュームの最大理論上のOCRに近い場合、メディアボリュームを下げることには有用性があり、実験の過程でOCRの「天井効果」が見られなくなります。各培地ボリューム(標準的な96ウェルプレート)で達成可能な理論上の最大OCRが示されています。すべての値は、プロトコルセクション4で説明し、 図7に示したオンライン計算機を使用して計算されました。 (B) 適切な正規化。ある変数が別の変数がミトコンドリア代謝を誘導する能力に及ぼす影響に関心のある実験には、 Delta-Delta OCR 実験セットアップが理想的です。(B)のセットアップでは、パルミチン酸のβ酸化を促進する2つの異なる媒体の能力がテストされます。脂肪酸のβ酸化が起こると、ミトコンドリアOCRが大幅に増加するはずです。一部の媒体は、他の媒体よりもパルミチン酸β酸化を促進する場合があります。OCR グラフの左側では、2 つの異なるメディア (メディア 1 とメディア 2) が RPE カルチャの並列ウェルに導入されています。ベースラインOCRが取得されます。次に、パルミチン酸を各培地タイプを含むウェルの半分に添加します。これにより、メディア 1 - パルミチン酸、メディア 1 + パルミチン酸、メディア 2 - パルミチン酸、メディア 2 + パルミチン酸の 4 つの条件が作成されます。これらの新しいメディア条件のそれぞれに対するOCR応答が記録されます。次に、実験的な治療後のOCR値(治療フェーズの赤い破線の平均)を治療前のベースラインOCR値(ベースラインフェーズの赤い破線の平均)から減算し、 デルタOCR 棒グラフを作成します(左下)。最後に、Media 1 と Media 2 の β酸化を促進する能力は、 Delta-Delta OCR 棒グラフ (右下) で決定されます。ここでは、「メディア1+パルミテートのデルタOCR」と「メディア1のデルタOCR-パルミテート」の差を計算し、「メディア2+パルミテートのデルタOCR」と「メディア2-パルミテートのデルタOCR」の差と比較します。このタイプの実験セットアップと正規化により、β酸化の促進に対する培地1と培地2の影響が分離されます。この正規化の一般的な構造は、ある変数が別の変数のOCRを変更する能力に及ぼす影響を測定する任意の実験に適用できます。略語:OCR =酸素消費率;RPE = 網膜色素上皮。 この図の拡大版を表示するには、ここをクリックしてください。
表1:RPE細胞培養培地のレシピ。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
RPEのミトコンドリア代謝は、AMDやPVRなどの一般的な失明性網膜疾患の病因に重要な役割を果たします。RPEミトコンドリア代謝 をin vitro でモデル化することで、その代謝状態を周囲の組織から分離するとともに、組織を制御された方法でさまざまな疾患をシミュレートする侮辱にさらすことができます。このようなRPEミトコンドリア代謝の in vitro モデリングは、 in vivoでRPEを厳密に近似するために必要な適切な分化状態と極性を達成する高忠実度のヒト初代およびiPSC-RPE培養物の出現によって促進されました。このような培養物における酸素消費率(OCR)のモニタリングは、ミトコンドリア代謝のモニタリングに理想的な方法ですが、OCRモニタリングの設定では、高度に分極した完全分化RPEに必要な条件で培養物を成長させることができないことがよくあります。ここでは、高分化型および分極化したRPE培養におけるOCRのリアルタイムかつ長期的な評価を通じて、RPEミトコンドリア代謝をモニタリングするための新しいシステムとしてResipherについて説明します。
RPEでOCRを監視するために、他の方法が使用されています。Seahorse XFアナライザーは、ミトコンドリア機能の急性操作により、OCRを短時間で監視するように設計されています。しかし、タツノオトシゴアッセイでは、細胞をカスタムプレート上で増殖させる必要があり、これは高いRPE極性および分化21をサポートするのに役立たない。Calton、Vollrath、および同僚たちは、タツノオトシゴを微多孔質支持体上で増殖させた高分化RPE培養の評価にタツノオトシゴを適応させ、微多孔質膜を断片に切断してタツノオトシゴプレートに配置したが、この方法は、細胞がCO2 にアクセスできないため、培養の短期的なエンドポイントモニタリングにしか機能しないアッセイ中、アッセイは非滅菌条件下でのみ行うことができ、微多孔性支持体を切断すると、時間の経過とともに微小孔性支持体のエッジ部分に死亡および機能不全が誘発される22。バロフューズは、微多孔質支持体上に成長したRPEのストリップを灌流システムに装填できるポンプレス灌流システムであり、OCRをリアルタイムで監視することができます23。Calton、Vollrath、および同僚によるSeahorseの変更されたセットアップと同様に、Barofuseを使用したRPE評価の主な制限は、微多孔質のサポートを切断する必要があることと、アッセイの短期的なエンドポイントの性質です。オキシグラフは、代謝操作24に応答してOCRの高速な運動学的変化のためにも設計されています。RPE文化には使用されておらず、タツノオトシゴやバロフューズのように高度に分極化し差別化されたRPE文化を評価するための同じ制限を受けることになります。
これらの他の方法とは対照的に、ここで説明するOCRシステムでは、標準細胞培養CO2 インキュベーター内の標準RPE培地を使用して、標準条件下でRPEを標準細胞培養プレート/基質で培養しながらOCRをモニタリングすることができ、高度に分化した分極したRPE培養を簡単かつ便利にプローブできます。システムによるリアルタイムのOCR変更に関するデータを生成するだけでなく、OCRモニタリング期間の終了時に同じ細胞を追加のアッセイに利用することができます。これにより、OCRに対する介入の効果が数週間にわたって繰り返しテストされる実験(例: 図5のRPE EMT誘導)や、介入からの長期的な回復をテストできる実験(例: 図3のミトコンドリアの分離からの回復)、または初期介入に応答したカスケード代謝変化を監視できる実験(例: 図の培地栄養素が枯渇した後のOCRに対する血清の影響)2). この論文のOCRシステムは、高度に分極され分化したRPE培養物におけるOCRの測定に特に便利です。このような培養物は機能的に有糸分裂後であり、密集した充填と重い色素沈着を伴います。これは、各ウェルにほぼ同一の細胞番号9が含まれていることを意味し、したがって、ほとんどの実験でOCRを細胞番号に正規化する必要がなくなります。細胞数への正規化が必要な場合でも、RPEの色素沈着が重く、細胞境界が明確に区切られているため、明視野イメージングに基づく非侵襲的な単純な細胞数で標準化を行うことができます。 図5のEMT実験のように、未分化のRPEおよびRPE増殖を伴う実験では、「細胞ごと」のOCRが何であるかを知るために、ウェルごとのOCRを細胞数に正規化することが必要になります。
網膜野以外では、このシステムは、膵島細胞25、骨格筋26、卵巣癌27、心筋細胞28、さらには C.エレガンス29などの生物全体を含む、さまざまな細胞タイプの細胞呼吸と代謝活性を研究するために採用されています。ここで説明したOCRシステムを使用したOCRのリアルタイム長期モニタリングにより、これらの多様な疾患モデルにおける生体エネルギーシフトとミトコンドリア機能障害に関する重要な洞察が明らかになりました。
Resipher システムには制限があります。OCRを決定する方法は、Seahorse Analyzer、BaroFuse、またはOxygraphとは根本的に異なります。OCRを計算するにはO2 勾配を確立する必要があり、勾配の確立には数時間かかる場合があります。したがって、他のシステムでは可能な高速速度論実験は、このシステムでは不可能です。さらに、他のシステムとは異なり、Resipherには低分子の迅速な送達や代謝物の収集のための注入ポートがありません。代わりに、細胞培養フードでセンシング蓋を取り外し、薬物をスパイクするか培地を交換し、分析する代謝物を手動で収集する必要があります。
このホワイト ペーパーで説明する OCR システムを使用して実験を確立し、トラブルシューティングを行うには、次のことをお勧めします。まず、蒸発を最小限に抑えます。RPE単層の上のメディアカラムのO2 勾配は、カラム9の高さに大きく依存し、システムはO2 勾配に基づいてOCRを計算することを思い出してください。したがって、実験中に蒸発によって培地カラムが著しく低下すると、O2 勾配が変化し、OCRの読み取り値に影響が及びます。インキュベーターのウォータートレイをいっぱいに保つことは重要ですが、96ウェルプレートのすべての未使用のウェルに水を入れることもお勧めします。さらに、プレートの端にあるウェルは蒸発速度が高いため、上記の典型的な実験では、これらのウェルには細胞が空のままになっています。OCRシステムの湿度センサーは、インキュベーターの湿度を監視するのに役立ちます。図8Aでは、実験中の湿度の低下は、インキュベーターの水トレイが空であることを示唆しています。ウェル内での蒸発が加速すると、ウェルの O2 濃度の読み取り値は上昇し、最終的には大気中の O2 濃度 (~200 μM) で「フラットライン」になります (図 8A)。
次に、OCRシステムの「サンドイッチ」が適切に組み立てられていることを確認します。デバイスの底面とセンシングリッドの上部にある金属接点は、完全な接触を妨げる破片がなく、きれいである必要があります。デバイスとセンシングリッドは、96ウェルプレート上に傾けることなく、完全に平らに取り付け、均等に位置合わせする必要があります。デバイスをハブに接続するUSBケーブルに張力がかかってはいけないと、「サンドイッチ」のトルクが発生し、デバイスの適切な動きが制限される可能性があります。
第三に、デバイスとセンシング蓋センサーが校正されていることを確認します。 図2B は、各実験の開始時に適切なセンサー機能を迅速に確認する方法を詳しく説明しています。第 4 に、実験操作の前に、特定のウェルが外れ値の OCR を示していないことを確認します。センサーが機能していることを確認した後、細胞を含むすべてのウェルのベースラインOCR値を決定することで、特定のウェルに異常な細胞が含まれているかどうかを判断できます。 図8B は、ベースラインOCR評価を受けているいくつかのウェルを示しており、青色のウェルはOCRが低い(したがって、O2 濃度が高い)ことをはっきりと示しています。この井戸は外れ値であり、実験操作から除外する必要があります。
第 5 に、アクティブな OCR 読み取り中の環境操作を最小限に抑えます。O2 グラジエントは、温度、湿度、インキュベーターのCO2 レベル、および大気圧の変化に非常に敏感です。インキュベーターのドアの開口部はこれらの要因に大きく影響し、培地カラムのO2 グラジエントが平衡に戻るまで、OCRの読み取りに一時的な混乱を引き起こします(図8C)。OCRに影響を与えるパラメータは、システムのオンラインインターフェイスの[環境]タブで監視できます(図8A)。
第六に、実験に最適な培地の量を決定します。培地の量が不十分な場合、過剰な蒸発(上記の最初のトラブルシューティング方法を参照)や培地中の栄養素の早期枯渇によるアーチファクトが発生する可能性がありますが、培地の量が多すぎると、RPE単分子膜へのO2 の利用可能性が制限され、低酸素症9が引き起こされます。 図7 は、RPE単分子膜のO2 濃度に対する培地量の影響を決定するために利用可能なオンライン計算機のスクリーンショットです。特定のメディアボリュームで可能な最大OCRを 図9Aに示します。所与の容量を使用した特定の実験のOCRレートが 図9Aに示されているレートに近似している場合、RPE単層でのO2 濃度は無酸素症(0%)に近づき、より低い培地容量が必要になります。一般に、RPE培養におけるミトコンドリア集約的なプロセスを含む実験では、培地容量は96ウェルあたり75μL以下である必要があります。
第 7 に、OCR に対する実験的介入の影響を分離するために、適切な正規化を実行します。ウェルが異なればベースラインOCRも異なるため、実験的介入の前に各ウェルのベースラインOCR測定値を取得することが重要です。実験的介入後のOCRからベースラインOCRを差し引くと、OCRに対する実験的介入の効果を示す「デルタOCR」が得られます。「Delta OCR」を得る方法を図3および図9Bに示す。ある実験的介入が別の実験的介入のOCR誘発能力に及ぼす影響に興味がある場合は、追加の正規化ステップである「デルタデルタOCR」が必要です。このような例は図9Bに示されており、パルミチン酸(1つの実験的介入)がOCRの増加を誘導する能力(β酸化の誘導による)は、RPE培養用の培地の種類(2番目の実験的介入)に依存します。
最後に、汚染のリスクを最小限に抑えます。このシステムは、細胞の上の培地に酸素センサーを導入することにより、OCRを監視します。これにより、感染のリスクが高まります。実験中にOCRが予想外に低下したり、実験開始時にOCRが予想外に低くなったりした場合は、感染の兆候である可能性があります。プレートは、細胞培養顕微鏡で感染を積極的に監視する必要があります。96ウェルプレート間のクロスコンタミネーションは、センシングリッドを再利用すると発生する可能性があります。このような交差汚染を最小限に抑えるには、実験が行われた後、新しい実験で検出蓋を再利用する前に、除染のために蓋全体を70%エタノールに20分間浸す必要があります(プロトコルセクション1.2.15を参照)。
結論として、Resipherと呼ばれる新しいシステムを使用したOCRの評価により、高忠実度RPE培養におけるミトコンドリア代謝のリアルタイムかつ長期的なモニタリングのためのプロトコルが提示されます。これは、高度に分極され分化したRPE培養、特に単離されたRPEの生理学的代謝特性の探索、およびAMDやPVRを含む網膜疾患の in vitro モデルにおけるRPE代謝の変化を調べるための多数のアプリケーションに使用できます。
開示事項
リチャード・A・ブライアンとキン・ローは、Resipherシステムを製造しているLucid Scientificの従業員です。
謝辞
Daniel Hass博士とJim Hurley博士には、新しい媒体と条件付けされた媒体のO2 溶解度を対照としてテストするというアイデアに感謝します。原稿の編集にご協力いただいたMagali Saint-Geniez博士に感謝します。Kellogg Eye CenterのInstrument and Electronic Services CoreのScott Szalay氏に、Resipher USBケーブルを使用して低酸素チャンバーを改造してくれたことに感謝します。HFTの研究には連邦政府の資金は使用されていません。Electronic Services Coreは、National Eye InstituteのP30 EY007003によってサポートされています。この研究は、Research to Prevent Blindness(RPB)からの無制限の部門助成金によってサポートされています。J.M.L.M.は、ジェームズ・グロスフェルド・イニシアチブ・フォー・ドライ・エイジング・マグロース・マッキュラー・デパートメント、E・マチルダ・ジーグラー盲人財団、エバーサイト・アイバンク助成金、国立眼科研究所からのK08EY033420助成金、ディー・アンド・ディクソン・ブラウン、デビッド・ドリューズ・ディスカバリー・ホープ財団の支援を受けています。D.Y.S.は、UNSWサイエンティアプログラムの支援を受けています。L.A.K.は、Iraty Award、Monte J. Wallace、Michel Plantevin、National Eye InstituteからのR01EY027739助成金、および国防総省のArmy Medical Research Acquisition Activity VR220059によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | #25-200-056 | |
| 3,3',5-triiodo-L-thyronine sodium salt | Sigma | T5516 | |
| 32-channel Resipher lid | Lucid Scientific | NS32-101A for Falcon | |
| Antimycin A from streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent to increase mitochondrial respiration |
| DMSO, cell culture grade | Sigma-aldrich | D4540-100ML | Vehicle for reconstituting mitochondrial drugs |
| Extracellular matrix coating substrates: Synthemax II-SC | Corning | #3535 | Extracellular matrix for hfRPE |
| Extracellular matrix coating substrates: Vitronectin | Gibco | A14700 | Extracellular matrix for iPSC-RPE |
| FCCP | Sigma | C2920-10MG | Uncoupling agent to increase mitochondrial respiration |
| Fetal Bovine Serum (Bio-Techne S11550H) | Bio-Techne | S11550H | |
| Hydrocortisone-Cyclodextrin | Sigma | H0396 | |
| Hypoxia chamber | Embrient Inc. | MIC-101 | |
| N1 Media Supplement | Sigma | N6530 | |
| Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| O2 sensor | Sensit technology or Forensics Detectors | P100 or FD-90A-O2 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Recombinant human TGFβ2 | Peprotech | 100-35B | Transforming growth factor beta-2 to induce epithelial-mesenchymal transition |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain |
| System-compatible plate | Corning | #353072 | |
| Taurine | Sigma | T8691 | |
| αMEM (Alpha Modification of Eagle's Media) | Corning | 15-012-CV |
参考文献
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: emerging roles in age-related macular degeneration. Int J Mol Sci. 21 (12), 4271(2020).
- Shu, D. Y., Lovicu, F. J. Myofibroblast transdifferentiation: the dark force in ocular wound healing and fibrosis. Prog Retin Eye Res. 60, 44-65 (2017).
- Hurley, J. B. Retina metabolism and metabolism in the pigmented epithelium: a busy intersection. Annu Rev Vis Sci. 7, 665-692 (2021).
- Wu, W., et al. Deficient RPE mitochondria energetics leads to subretinal fibrosis in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (8), 2420(2023).
- Hansman, D. S., et al. Metabolic reprogramming of the retinal pigment epithelium by cytokines associated with age-related macular degeneration. Biosci Rep. 44 (4), BSR20231904BSR20231904(2024).
- Li, K. X., et al. Modulation of pyruvate kinase M2 activity as a therapy in a primary RPE cell culture model of proliferative vitreoretinopathy. Invest Ophthalmol Vis Sci. 62 (8), 2213(2021).
- Gupta, S., et al. Progress in stem cells-based replacement therapy for retinal pigment epithelium: in vitro differentiation to in vivo delivery. Stem Cells Transl Med. 12 (8), 536-552 (2023).
- Wilson, D. F., et al. Oxygen distribution and vascular injury in the mouse eye measured by phosphorescence-lifetime imaging. Appl Opt. 44 (25), 5239-5248 (2005).
- Hass, D. T., et al. Medium depth influences O2 availability and metabolism in human RPE cultures. Invest Ophthalmol Vis Sci. 64 (14), 4(2023).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFβ2-Induced EMT of retinal pigment epithelial cells. Int J Mol Sci. 22 (9), 4701(2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Front Mol Neurosci. 15, 896786(2022).
- Ng, P. Q., Saint-Geniez, M., Kim, L. A., Shu, D. Y. Divergent metabolomic signatures of TGFβ2 and TNFα in the induction of retinal epithelial-mesenchymal transition. Metabolites. 13 (2), 213(2023).
- Kar, D., et al. Choriocapillaris impairment is associated with delayed rod-mediated dark adaptation in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (12), 41(2023).
- Curcio, C. A., Kar, D., Owsley, C., Sloan, K. R., Ach, T. Age-related macular degeneration, a mathematically tractable disease. Invest Ophthalmol Vis Sci. 65 (3), 4(2024).
- Maminishkis, A., et al. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47 (8), 3612-3624 (2006).
- Maminishkis, A., Miller, S. S. Experimental models for study of retinal pigment epithelial physiology and pathophysiology. J Vis Exp: JoVE. (45), e2032(2010).
- Zhang, Q., et al. A platform for assessing outer segment fate in primary human fetal RPE cultures. Exp Eye Res. 178, 212-222 (2019).
- Sharma, R., Bose, D., Montford, J., Ortolan, D., Bharti, K. Triphasic developmentally guided protocol to generate retinal pigment epithelium from induced pluripotent stem cells. STAR Protoc. 3 (3), 101582(2022).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. FASEB J. 34 (10), 13106-13124 (2020).
- Rosenfeld, P. J., Trivizki, O., Gregori, G., Wang, R. K. An update on the hemodynamic model of age-related macular degeneration. Am J Ophthalmol. 235, 291-299 (2022).
- Fitch, T. C., et al. Real-time analysis of bioenergetics in primary human retinal pigment epithelial cells using high-resolution respirometry. J Vis Exp: JoVE. (192), (2023).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Mol Vis. 24, 425-433 (2018).
- Grumbine, M. K., et al. Maintaining and assessing various tissue and cell types of the eye using a novel pumpless fluidics system. J Vis Exp: JoVE. (197), (2023).
- Mu, C., Shearer, J. Protocol for measuring respiratory function of mitochondria in frozen colon tissue from rats. STAR Protoc. 4 (4), 102560(2023).
- Rocha, D. S., Manucci, A. C., Bruni-Cardoso, A., Kowaltowski, A. J., Vilas-Boas, E. A. A practical and robust method to evaluate metabolic fluxes in primary pancreatic islets. Mol Metab. 83, 101922(2024).
- Kanaan, M. N., et al. Cystine/glutamate antiporter xCT controls skeletal muscle glutathione redox, bioenergetics and differentiation. Redox Biol. 73, 103213(2024).
- da Veiga Moreira, J., et al. Methylene blue metabolic therapy restrains in vivo ovarian tumor growth. Cancers. 16 (2), 355(2024).
- McNally, L. A., Altamimi, T. R., Fulghum, K., Hill, B. G. Considerations for using isolated cell systems to understand cardiac metabolism and biology. J Mol Cell Cardiol. 153, 26-41 (2021).
- Misare, K. R., et al. The consequences of tetraploidy on Caenorhabditis elegans physiology and sensitivity to chemotherapeutics. Sci Rep. 13 (1), 18125(2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。