Method Article
ניטור ארוך טווח של שיעורי צריכת החמצן בתרביות אפיתל פיגמנט רשתית מובחנות ומקוטבות מאוד
* These authors contributed equally
In This Article
Summary
אנו מציגים מכשיר חדשני למדידת קצבי צריכת חמצן (OCR) בתרביות אפיתל פיגמנט ברשתית (RPE). המכשיר יכול למדוד OCR במשך שבועות בכל פעם על RPE גדל על לוחות תרבית תאים סטנדרטיים עם מדיה סטנדרטית בעוד הלוחות נמצאים באינקובטור תרבית תאים סטנדרטי.
Abstract
חילוף החומרים במיטוכונדריה חיוני לתפקוד תקין של אפיתל פיגמנט הרשתית (RPE), שכבה אחידה של תאים ברשתית החשובה להישרדות קולטני אור. תפקוד לקוי של RPE במיטוכונדריה הוא סימן היכר של ניוון מקולרי תלוי גיל (AMD), הגורם המוביל לעיוורון בלתי הפיך בעולם המפותח, וזגוגית שגשוגית (PVR), סיבוך מסנוור של היפרדות רשתית. התנאים הניווניים של RPE עוצבו היטב על ידי מערכות תרבות RPE שהן מאוד מובחנות ומקוטבות כדי לחקות RPE in vivo . עם זאת, ניטור קצבי צריכת חמצן (OCR), פרוקסי לתפקוד המיטוכונדריה, היה קשה במערכות תרבית כאלה מכיוון שהתנאים המקדמים קיטוב והתמיינות RPE אידיאליים אינם מאפשרים מדידות OCR קלות.
כאן, אנו מציגים מערכת חדשנית, Resipher, לניטור OCR במשך שבועות בכל פעם בתרביות RPE ממוינות היטב תוך שמירה על RPE על מצעי גדילה אופטימליים ומדיה של תרביות פיזיולוגיות באינקובטור תרביות תאים סטנדרטי. מערכת זו מחשבת OCR על ידי מדידת שיפוע ריכוז החמצן הקיים במדיה שמעל התאים. אנו דנים ביתרונות של מערכת זו על פני שיטות אחרות לזיהוי OCR וכיצד להגדיר את המערכת למדידת OCR בתרביות RPE. אנו מכסים עצות וטריקים מרכזיים לשימוש במערכת, זהירות לגבי פירוש הנתונים והנחיות לפתרון בעיות בתוצאות בלתי צפויות.
אנו מספקים גם מחשבון מקוון לאקסטרפולציה של רמת תרביות RPE היפוקסיה, נורמוקסיה, או היפראוקסיה בהתבסס על שיפוע החמצן במדיה מעל התאים שזוהו על ידי המערכת. לבסוף, אנו סוקרים שני יישומים של המערכת, מדידת המצב המטבולי של תאי RPE במודל PVR והבנה כיצד RPE מסתגל מטבולית להיפוקסיה. אנו צופים כי השימוש במערכת זו בתרביות RPE מקוטבות ומובחנות מאוד ישפר את הבנתנו את חילוף החומרים המיטוכונדריאלי של RPE הן במצבים פיזיולוגיים והן במצבי מחלה.
Introduction
אפיתל פיגמנט הרשתית (RPE) הוא חד-שכבתי של תאי אפיתל פוסט-מיטוטיים ומקוטבים מאוד היוצרים מחסום בין קולטני אור רגישים לאור ברשתית לבין מחזור הדם שלהם, מצע נימי המכונה כוריוקפילריס. בדומה לתפקידם של נוירונים תומכי גליה, RPE מבצע מספר עצום של פונקציות לתמיכה בפוטורצפטורים, כולל פאגוציטוזה של מקטעים חיצוניים של קולטני אור, הובלת חומרי מזון ותמיכה מטבולית בפוטורצפטורים והפרשת גורמי גדילה חיוניים, כולם קריטיים לשמירה על תפקוד הראייה.
ניוון של RPE עומד בבסיס מספר הפרעות ניווניות נפוצות של ראייה. בניוון מקולרי תלוי גיל (AMD), אחד הגורמים השכיחים ביותר לאובדן ראייה חשוך מרפא בעולם, RPE מת, ולכן פוטורצפטורים מעל סובלים מניוון משני. בזגוגית שגשוגית (PVR), ה-RPE יוצא במקום זאת ממצבו הפוסט-מיטוטי השקט בדרך כלל, מתרבה ומתמיין למצב מזנכימלי (מה שנקרא מעבר אפיתל למזנכימלי [EMT]) עם שינויים בחילוף החומרים שלו. דיפרנציאציה של RPE גורמת לאובדן תמיכת RPE בפוטורצפטורים תוך הפעלת מצב פיברוטי יותר. התוצאה היא גם ניוון קולטני אור וגם צלקות המושרות על ידי RPE, שניהם גורמים לאובדן ראייה 1,2.
חלק עיקרי מהתמיכה של RPE בפוטורצפטורים הוא מטבולי, וחוסר ויסות מטבולי הוא גורם קריטי במחלות רשתית רבות, כולל AMD ו- PVR. RPE משמש כמחסום רגולטורי בין פוטורצפטורים לבין מקור החמצן והחומרים המזינים שלהם, הכוריוקפילריס. לכן, מה שה-RPE בוחר לעכל לעומת מה שה-RPE בוחר לעבור דרך הכוריוקפילריס אל הפוטורצפטורים שולט מאוד בחילוף החומרים של הפוטורצפטורים ובהישרדותם. מחקרים רבים הראו כי RPE תלוי במידה רבה בחילוף החומרים במיטוכונדריה לבריאותו הרגילה, וכי פוטורצפטורים מסתמכים במידה רבה על גליקוליזה3. זה הציג את הרעיון של מצבים מטבוליים משלימים, שזורים זה בזה בין פוטורצפטורים לבין RPE. באופן ספציפי, RPE מפחית את חילוף החומרים של מצעים מטבוליים מועדפים של קולטני אור ובמקום זאת משתמש בתוצרי הלוואי של מטבוליזם קולטני אור בשילוב עם מטבוליטים שקולטני אור אינם צורכים. במחלות כגון PVR ו- AMD, ראיות מצביעות על כך שה- RPE הופך גליקוליטי יותר ופחות תלוי בחילוף החומרים במיטוכונדריה; שינוי זה לכיוון גליקוליזה RPE עלול להרעיב פוטורצפטורים של מטבוליטים הדרושים לו, ולגרום לניוון 4,5,6. בהתחשב במידת התלות ההדדית של RPE ומטבוליזם של פוטורצפטורים וכמה חילוף חומרים משתנה עומד בבסיס מחלות רשתית, יש עניין רב במידול ומניפולציה של מטבוליזם RPE למטרות טיפוליות.
בעוד שחקר מטבוליזם מיטוכונדריאלי RPE in vivo הוא אידיאלי, היבטים רבים של מטבוליזם מיטוכונדריאלי RPE יכולים להיחקר באופן מעשי רק במערכת תרבית חוץ גופית. התקדמות משמעותית לקראת תרביות RPE באיכות גבוהה נעשתה בעשורים האחרונים, עד כדי כך שתרביות RPE המטופחות ביותר משמשות כיום לטיפול בתחליפי תאים בניסויים קליניים בבני אדם7. כדי לשמור על תרבויות אמינות גבוהה כאלה, RPE צריך להיות גדל על מצעים מסוימים במדיה מסוימת במשך חודשים לפני הניסויים. בתנאים אלה, תרביות RPE מובחנות ומקוטבות באופן מקסימלי, בקירוב in vivo RPE. למרבה הצער, אין כיום ציוד זמין שיכול למדוד את חילוף החומרים במיטוכונדריה באופן ספציפי מה-RPE in vivo. בעוד ניטור חמצן של רשת נימי הרשתית הושג in vivo באמצעות תהודה פאראמגנטית אלקטרונית (EPR) oximetry8, זה לא אפשרי עבור ניתוח RPE. הבדלים בין מטבוליזם RPE in vivo ו- in vitro אינם מתוארים היטב, אך תרביות RPE הוכחו כבעלות פעילות מיטוכונדריאלית גבוהה, בדומה ל- RPE in vivo 3,9, דבר המצביע על תובנה משמעותית לגבי מטבוליזם מיטוכונדריאלי של RPE שניתן להשיג באמצעות תרביות RPE באיכות גבוהה.
מכיוון שכל חילוף החומרים במיטוכונדריה מוביל לצריכת חמצן, מדידת שיעורי צריכת חמצן RPE (OCR) היא פרוקסי נאמן למטבוליזם של המיטוכונדריה. מדידת OCR בתרביות RPE הייתה קשה, מכיוון שהתנאים המקדמים קיטוב ובידול מרביים של RPE מונעים לעתים קרובות מדידות OCR מדויקות לטווח ארוך עם טכניקות זמינות כיום, כגון מנתח סוסון ים. בנייר שיטות זה מוצג מכשיר חדשני, המכונה Resipher (להלן "המערכת"), המאפשר מדידה רציפה של OCR במשך שבועות ב-RPE הגדל בתנאים המקדמים קיטוב והתמיינות באופן מקסימלי. הקלות שבה ניתן למדוד OCR על ידי מערכת זו בתנאי תרבית RPE המקדמים באופן מרבי בידול וקיטוב RPE היא ייחודית בקרב מכשירי מדידת OCR קיימים.
מאמר זה מספק טיפים וטריקים לשימוש במערכת עם תרביות RPE, ולאחר מכן הדגמה של שני יישומים מסוימים. ראשית, RPE EMT, המחקה PVR, מופעל על ידי חשיפה לשינוי גורם גדילה-בטא (TGFβ)1,10,11,12. המערכת משמשת לניטור האופן שבו מטבוליזם RPE מתפתח במהלך תהליך EMT. שנית, התפקיד של היפוקסיה במטבוליזם RPE נחקר באמצעות מערכת זו. היפוקסיה היא תורמת חשובה לפתוגנזה של AMD, כמו choriocapillaris דליל עם גיל13,14. שילוב מערכת זו עם תאי היפוקסיה מאפשר למדל מטבוליזם מיטוכונדריאלי RPE שונה עם היפוקסיה עדינה המלווה את ההזדקנות. לבסוף, מחשבון מקוון המשתמש בנתוני Resipher מוצג כדי לאפשר לקבוע אם תרביות RPE נמצאות בתנאים היפוקסיים, נורמוקסיים או היפרוקסיים. מידע כזה הוא קריטי להסקת מסקנות כלשהן לגבי מטבוליזם RPE ממחקרי תרבית RPE במבחנה.
Protocol
לקבלת פרוטוקולים לביסוס תרבויות אנושיות ראשוניות או iPSC-RPE, ראה את ההפניות הבאות 15,16,17,18. רכישה ושימוש ברקמה אנושית עבור פרוטוקולים אלה נבדקו והותרו על ידי מועצת הביקורת המוסדית של אוניברסיטת מישיגן (HUM00105486).
1. יישום כללי של המערכת לתרבות RPE
- תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) נגזרים מ-RPE או תאי RPE אנושיים ראשוניים בצלחות תואמות מערכת של 96 בארות.
- בהנחה שכבר קיימות תרביות בוגרות הגדלות על לוחות תרביות תאים של 24 בארות, שטפו את התאים במי מלח חוצצי פוספט (PBS) פעם אחת ולאחר מכן הוסיפו 500 μL של 0.25% טריפסין-EDTA (טבלת חומרים). דוגרים 10-40 דקות באינקובטור תרבית תאים, בודקים כל 5-10 דקות עד שהתאים מעוגלים וכמעט מוכנים להתנתקות.
- יש להעביר בעדינות פיפטה על גבי התאים כדי לנתק אותם מפלסטיק תרבית התא, ולאחר מכן להעביר לנפח גדול פי 3 של מדיית תרבית תאים (1,500 מיקרוליטר ל-24 בארות), תוך סיבוב בצנטריפוגה במהירות של 250 × גרם למשך 5 דקות בטמפרטורת החדר.
הערה: המתכון למדיה של תרביות תאי RPE מפורט בטבלה 1 וזמין בהפניות 9,15,16,17,18 שפורסמו בעבר. - יש להשהות מחדש תאים במדיה של תרבית תאי RPE עם 15% נסיוב בקר עוברי (FBS) ולספור את התאים עם המוציטומטר.
- זרעו 74,000 תאים לכל באר של צלחת בת 96 בארות (בדרך כלל 225-300 × 105 תאים/ס"מ2), לאחר ציפוי במצעי ציפוי מטריצה חוץ-תאיים מיוחדים (טבלת חומרים) בהתאם להוראות היצרן.
הערה: תאי זרעים רק על לוח תואם Resipher (טבלה של חומרים) ורק בבארות המתאימות למערך הבדיקה על מכסה החישה (עמודות 3, 4, 9 ו-10 עבור מכסה 32 ערוצים; ראה טבלת חומרים). מכסה החישה של המערכת זמין עם חיישנים של 4, 32 או 96 ערוצים (ראו מיקומי חיישנים באיור 1A-D), ומגוון של לוחות תרביות תאים סטנדרטיים תואמים. - מכיוון שבארות קצה מועדות לאידוי, מה שמשפיע באופן דרמטי על זמינות החמצן, ולכן קריאות OCR, הימנעו מזריעת תאים בכל בארות הקצה (שורות A ו- H של צלחת 96 בארות). יתר על כן, הוסף 200 μL של מים סטריליים בכל אחת מהבארות הריקות של צלחת 96 בארות כדי להפחית את השפעות האידוי.
- שמור את הצלחת על משטח שולחן יציב במשך 10 דקות כדי לאפשר לתאים לשקוע; ואז להחזיר אותו לחממה. שנה את המדיה לאחר 24-72 שעות, והחלף במדיה סטנדרטית של תרבית RPE ב- 5% FBS. תרבות במשך 4 שבועות לפחות, החלפת מדיה 2 פעמים בשבוע.
הערה: תאים מוכנים לניסויים כאשר הם פיגמנטים, מרוצפים וקומפקטיים מאוד (איור 1E).
- הגדרה ורכישה של נתונים באמצעות המערכת
- הניחו את מכסה החישה על צלחת מקלט ריקה בת 96 בארות ולאחר מכן הניחו אותו בחזרה באינקובטור תרביות התא. ישר והרכיב את ההתקן על מכסה החישה וחבר אותו לרכזת באמצעות כבל ה-USB המצורף. זה יוצר "כריך" של Resipher (איור 2A).
- עבור אל יישום אתר האינטרנט של Lucid lab (https://lab.lucidsci.com/) ולחץ על הלחצן ניסוי חדש בפינה השמאלית העליונה כדי ליצור ניסוי חדש.
- תן שם לכותרת הניסוי והזן הערות ניסוי רלוונטיות עבור המחקר המסוים (למשל, מספר המעבר של iPSC-RPE שבו משתמש).
- יצירת תנאים טובים וקבוצות טיפול. לדוגמה, אם אתם בודקים את ההשפעות של ריכוזי סרום שונים במדיה על זיהוי תווים אופטי (OCR), בחרו 'סרום' בשם הקבוצה ולאחר מכן הזינו ריכוזי סרום מדיה לשימוש, והוסיפו עוד ערכים באחוזים בסרום בלחיצה על הלחצן +. הקצו אילו בארות יקבלו אחוז מסוים בסרום ובחרו תבנית צבע עבור בארות אלה. הוסף קבוצות נוספות (לדוגמה, משתנה ניסיוני אחר לבדיקה) לפי הצורך על-ידי לחיצה על לחצן הוסף קבוצה.
- הגדר את הגדרת הצלחת ובחר את סגנון ההתקן והצלחת המתאימים. לחץ על לחצן הוסף צלחת ובחר התקן; בחר סוג לוחית. בחר טיפול ולחץ על הבאר המתאימה.
- לחץ על לחצן התחל עכשיו כדי להתחיל את הניסוי. בדוק שהמחוון באתר האינטרנט והנורית ברכזת בצבע ירוק מלא.
- אפשרו למערכת לפעול במשך 15-60 דקות כדי להבטיח שכל חיישן מכויל כראוי ומזהה במדויק חמצן אטמוספרי, אשר אמור להיות בריכוז של ~200 מיקרומטר באינקובטור תרבית תאים עם לחות מלאה עם 5% CO2 (איור 2Bi).
הערה: אם אחד מהחיישנים רחוק ביותר מ-20% מהממוצע של החיישנים האחרים במערך סטנדרטי של אינקובטור לתרביות תאים, שקול לא לכלול גם את זה בניתוח נתונים, מאחר שהחיישן פגום (איור 2Bii).
הערה: אם כל החיישנים רחוקים ביותר מ-20% מהממוצע של החיישנים האחרים ומה-O2 האטמוספרי הצפוי שדווח כ-200 מיקרומטר במערך אינקובטור סטנדרטי של תרבית תאים, נעשה שימוש במכסה החישה יותר מדי פעמים; החליפו אותו במכסה חישה חדש (איור 2Biii).
הערה: קבלת קריאות O2 באוויר לפני תחילת הניסוי משפרת באופן משמעותי את פתרון הבעיות לאחר מכן. אם באר מסוימת מופיעה כחריגה לאחר ביצוע ניסוי ולבאר זו היה חיישן שלא היה בכיול, ייתכן שהבעיה היא בחיישן, ולא בשכפול הביולוגי. - הסר את ההתקן ממכסה החישה (אך אל תנתק את כבל ה-USB מההתקן). הנח את ההתקן הפוך באינקובטור כדי לאפשר למנגנון של ההתקן להתאפס. אין לעשות שימוש חוזר במכשיר עד שכל צלילי המנוע פסקו (כ-20-30 שניות).
הערה: חשוב להשאיר את ההתקן מחובר לרכזת באמצעות כבל ה-USB בכל עת במהלך ניסוי, גם כאשר ההתקן נמצא מחוץ למכסה החישה. זה מאפשר למכשיר לנטר ולדווח באופן רציף על סביבת אינקובטור תרבית התא. - הניחו את הצלחת עם מכסה החישה בחזרה במכסה התרבית של תרבית התא, יחד עם צלחת בת 96 בארות המכילה את תרביות ה-RPE. שנה את המדיה בצלחת עם תרביות RPE עם אותה מדיה ואותו נפח עבור כל הבארות כדי לקבל ערכי OCR בסיסיים עבור כל באר. הקפידו למלא את כל הבארות ללא RPE במים סטריליים כדי לסייע במניעת אידוי.
הערה: באופן כללי, אנו ממליצים על 60-100 מיקרוליטר של מדיה בתרבית RPE לכל 96-באר, בהתבסס על נתונים המוכיחים כי נפחי מדיה נמוכים יותר מובילים לדלדול תזונתי מהיר, אך נפחי מדיה גבוהים יותר מובילים להיפוקסיה 9 בשוגג. - העבירו את מכסה החישה לצלחת המכילה תרביות תאים ואת המכסה הסטנדרטי (שאינו רסיפר) על הצלחת המכילה תרביות תאים לצלחת המקלט הריקה בעלת 96 בארות כדי לשמור על סטריליות המכסה הסטנדרטי, אשר יהיה צורך בנקודות שונות במהלך הניסוי.
- הניחו את הצלחת עם תרביות התאים ואת מכסה החישה בחזרה באינקובטור תרביות התא. שוב, יישר והרכיב את ההתקן על מכסה החישה וחבר אותו לרכזת באמצעות כבל ה- USB המסופק (הרכבת "הכריך"). בדוק שהמחוונים בממשק האתר וב- Hub כולם ירוקים מלאים.
הערה: נתוני ריכוז O2 יופיעו מיד, בעוד שנתוני זיהוי תווים אופטי (OCR) יופיעו רק לאחר שנאספו מספיק נתוני O2 , בערך שעה אחת. - אפשר להתקן למדוד זיהוי תווים אופטי (OCR) בכל באר למשך 12-24 שעות לפחות כדי לצלם זיהוי תווים אופטי (OCR) בסיסי.
הערה: זיהוי תווים אופטי (OCR) בסיסי ישתנה בהתאם לגורמים רבים, כולל סוג המדיה המוחלת על תאים. באיור 2C, למדיית תרבית RPE סטנדרטית עם כמויות שונות של FBS (0%, 5%, 15%) יש ערכים שונים במקצת של זיהוי תווים אופטי (OCR). יתר על כן, תרביות עם יותר FBS יכולות לשמור על פעילות מיטוכונדריאלית למשך זמן רב יותר לאחר החלת מדיה על תאים לפני טיפות OCR עקב דלדול של מטבוליטים מיטוכונדריאליים (צד ימין של העקומה). - לאחר קבלת זיהוי תווים אופטי (OCR) בסיסי, חזור על שלבים 1.2.8-1.2.12, אך שנה את המדיה שעל הצלחת עם תרביות RPE לתנאי הניסוי של האדם (בדרך כלל, ± תרופה או השוואה של תנאי מדיה שונים).
הערה: ניתן לטפל גם בשינויי מדיה שגרתיים באותו אופן. בכל פעם שאינקובטור תרביות התאים נפתח, צפו להפרעה משמעותית בקריאות OCR, מכיוון שהן תלויות בטמפרטורה, לחות, ריכוזיCO2 וגורמים אחרים שכולם משובשים באופן זמני עם פתיחת דלת האינקובטור. במהלך כל הסרה של המכשיר ממכסה החישה, אין צורך להשהות את הניסוי באופן מקוון. לאחר פתיחת דלת האינקובטור של תרבית התאים או החלפת מדיה על הצלחת הנבדקת, בדרך כלל ייקח 2-4 שעות לבסס מחדש את שיפוע החמצן ולהתחיל למדוד OCR מדויק. - לאחר קבלת הנתונים, הפחת את ה- OCR הבסיסי עבור כל באר מה- OCR לאחר החלת תנאי הניסוי, כדי לקבוע את זיהוי התווים האופטי של דלתא המופעל על ידי הטיפול.
- לאחר השלמת הניסוי, יש לעקר ולעשות שימוש חוזר במכסה החישה (שניתן לעשות בו שימוש חוזר פי 3-5, אם כי הביצועים יורדים בשימוש חוזר). כדי לעקר את מכסה החישה, יש לטבול את כל המכסה באתנול 70% למשך 10 דקות במכסה מנוע של תרבית תאים, ואז להסיר מהטבילה ולנוח בצד הבדיקה של הארון כלפי מעלה (הימנעו מלגעת בקצות הבדיקה העדינים), ותנו לאתנול ומים להתאדות לחלוטין לפני שתניחו את מכסה החישה על צלחת מקלט חדשה בעלת 96 בארות.
- צלם תמונות שדה בהיר כדי לנרמל ערכים של זיהוי תווים אופטי (OCR) למספר התא.
הערה: הצטברות מלנין ב-RPE מאפשרת נורמליזציה של OCR בהתבסס על ספירה פשוטה של מספרי תאים בתרביות חיות באמצעות מיקרוסקופ שדה בהיר.- הסר את ההתקן והנח אותו הפוך, כמו בשלב 1.2.8. במכסה המנוע של תרבית התא, החליפו את מכסה החישה בלוח תרבית RPE במכסה סטנדרטי של 96 בארות.
- באמצעות מיקרוסקופ הפוך סטנדרטי, צלם תמונות שדה בהיר של כל באר.
הערה: שמור על שטח תמונה אחת עקבית בין בארות (מיקום יחסי בבאר והגדלה אובייקטיבית). - במכסה המנוע של תרבית התא, החלף את מכסה 96 הקידוחים הסטנדרטי בלוח תרבית RPE במכסה החישה והחזיר אותו לאינקובטור לניטור נוסף.
- ספור את מספר התא בכל באר באמצעות ImageJ או תוכנה אחרת.
- נרמול זיהוי תווים אופטי (OCR) למספר תאים בקבוצות הניסוי השונות. המערכת מדווחת על OCR ביחידות של fmol∙(mm2)-1∙s-1-הצריכה ליחידת חתך שטח. לכן, כדי לנרמל את זיהוי התווים האופטי (OCR) לתא, חלק את זיהוי התווים האופטי (OCR) לפי ספירת תאים למ"מ2 (במקום ספירת תאים לבאר). באופן שווה, הכפל את זיהוי התווים האופטי (OCR) המדווח על ידי המערכת בשטח החתך של הבאר (בסביבות 31 מ"מ2 עבור צלחת סטנדרטית של 96 בארות) כדי להניב OCR ביחידות של fmol∙s-1∙well-1.
- בקרות לקביעת פרמטרים ביואנרגטיים RPE.
הערה: כדי להבטיח שהמערכת ותרביות RPE מגיבות למניפולציות במיטוכונדריה בדרכים צפויות, ניתן לבדוק מולקולות קטנות מסוימות מבוססות היטב כדי להתמקד בשלבים מסוימים של זרחן חמצוני מיטוכונדריאלי. בדיקות אלה מקבילות לשלבים המבוצעים במבחן מאמץ מיטוכונדריאלי באמצעות מנתח סוסון ים10 ומספקות פרופיל ביו-אנרגטי לתרביות RPE.- תאי RPE בתרבית ב-65 מיקרוליטר של מדיית תרבית RPE סטנדרטית עם 5% FBS ומדידת OCR למשך 24 שעות כדי לבסס קו בסיס.
- שאפו מדיה בתרבית והוסיפו 65 μL של מדיה סטנדרטית לתרבית RPE עם 5% FBS ועם מצמדים מיטוכונדריאליים (3 מיקרומטר קרבוניל ציאניד-p-trifluoromethoxyphenylhydrazone [FCCP] או 500 ננומטר Bam15, טבלה של חומרים). לדגור למשך הלילה.
הערה: מצמדים מיטוכונדריאליים אמורים להגדיל באופן משמעותי את זיהוי התווים האופטי (OCR). ודא שה-OCR המוגדל אינו נמצא ב-OCR התיאורטי המוגבל בדיפוזיה מרבית של כ-275 fmol∙(mm2)-1∙s-1 עבור 65 μL של מדיה בתנאי תרבית סטנדרטיים. זיהוי תווים אופטי (OCR) מרבי עבור אמצעי אחסון שונים של מדיה נפוצה זמין במקטע דיון. - לאחר דגירה של לילה, יש לשאוף את המדיה עם מצמדים מיטוכונדריאליים ולהחליף ב-65 μL של תרבית RPE סטנדרטית עם 5% FBS. התבונן בצלחת במשך 24 שעות נוספות כדי לקבוע את ההתאוששות של RPE OCR לאחר הסרת התרופות.
- חשב את ההשפעות של uncouplers על OCR על-ידי הפחתת OCR שהתקבל לאחר טיפול מ-OCR שהתקבל לפני הטיפול (איור 3).
הערה: העלייה ב-OCR עם תוספת של uncouplers מיטוכונדריאליים מסמלת את יכולת הנשימה המיטוכונדריאלית הרזרבה של תא19. - כדי למדוד פרמטרים מיטוכונדריאליים אחרים שנלכדים בדרך כלל במהלך מבחן המאמץ המיטוכונדריאלי עם מנתח סוסון ים, בצעו את אותם השלבים לעיל עם התרכובות הבאות (איור 4).
- השתמש אוליגומיצין ב 1 מיקרומטר כדי להעריך נשימה מקושרת ATP.
- השתמשו באנטימיצין A ורוטנון במינון 1 מיקרומטר כדי להעריך נשימה שאינה מיטוכונדריאלית.
הערה: FCCP, אוליגומיצין, אנטימיצין A ורוטנון עלולים להיות רעילים ל-RPE. אם הם גורמים למוות תאי משמעותי, מדידות OCR לא יהיו מדויקות. לכן, מדידות OCR צריכות להתקבל רק בנקודת זמן שבה אין מוות תאי ברור, בדרך כלל בשעות הראשונות לאחר הוספת התרופות (איור 4).
2. מדידת שינויים בחילוף החומרים במיטוכונדריה ב-RPE העובר EMT
- פעל לפי אותו פרוטוקול כמתואר בסעיף 1.2.
- כדי לגרום ל-EMT לאחר קבלת מדידות OCR בסיסיות, הוסף TGF-β2 (10 ננוגרם/מ"ל) לתרביות RPE ונטר OCR במשך 3 שבועות. רענן מדיה עם TGFβ2 טרי כל 2-3 ימים (איור 5).
- לפחות פעמיים בשבוע, קבל תמונות brightfield כמו בסעיף 1.3 כדי להבטיח שספירת התאים אינה משתנה. אם הספירה משתנה, נרמל את ערכי זיהוי התווים האופטי (OCR) למספר התא בכל באר.
הערה: אותו פרוטוקול יכול לשמש עבור משרים אחרים של EMT כדי לפקח על שינויים ארוכי טווח OCR לאורך תקופת התרבית בזמן שהתאים נמצאים באינקובטור.
3. מדידת שינויים בחילוף החומרים במיטוכונדריה ב-RPE היפוקסי
הערה: היישום של המערכת בתנאים היפוקסיים, נורמוקסיים, או היפראוקסיים זהה לסעיף 1.2, למעט שמירת "הכריך" בתא היפוקסיה (טבלה של חומרים) הממוקם באינקובטור תרבית תאים סטנדרטי.
- קדח חור במכסה של תא ההיפוקסיה כדי להרכיב את כבל USB Type-C דרכו ואטם אותו עם סיליקון או מרק (איור 6A).
- להרכיב את מכסה החישה עם צלחת תרבית התא במכסה המנוע ולהעביר אותם לתוך תא היפוקסיה.
- הגדר את "כריך" (צלחת, מכסה חישה, מכשיר) בתא היפוקסיה. כמו כן מניחים בתא היפוקסיה צלחת פטרי עם מים סטריליים כדי לסייע בשמירה על לחות. לבסוף, מקם חיישן O2 נייד בתא ההיפוקסיה (טבלת חומרים). ההגדרה מוצגת באיור 6A.
- אטמו את התא וחברו אותו לבלון גז עם ריכוז היפוקסי של O2 וריכוז תרבית תאים סטנדרטי של CO2 (למשל, 1% O2 ו-5% CO2).
- החליפו לאט את האוויר בתא ההיפוקסיה עם האוויר 1% O2/5% CO2 בצילינדר עד שחיישן החמצן מראה את ריכוז O2 הרצוי, בדרך כלל איפשהו בין 1% ל -10%.
הערה: חיישן O2 הנייד דורש זמן כדי להתאזן, ולכן יש להוסיף גז מהגליל לתא ההיפוקסיה באיטיות. - סגור את שסתומי הכניסה והיציאה של תא ההיפוקסיה והעבר את החדר כולו לאינקובטור.
- הגדר והתחל את הניסוי כמו בסעיף 1.2.
הערה: שיווי משקל מראש של המדיה בתא ההיפוקסיה לפני הוספה לתאים יכול להפחית את הזמן שלוקח לחד-שכבה התאית לחוות היפוקסיה אמיתית (איור 6B).
4. חישוב ריכוז O2 בשכבה החד-שכבתית RPE כדי לקבוע אם התאים נמצאים בתנאים היפוקסיים, נורמוקסיים או היפראוקסיים
הערה: המערכת מודדת את ריכוז O2 בין כ-1 ל-1.5 מ"מ מעל תחתית הבאר כברירת מחדל בהנחה שנעשה שימוש בלוח סטנדרטי עם מכסה החישה המומלץ המתאים לתרבית חד-שכבתית (ראה https://lucidsci.com/docs/LucidScientific_Sensing_Lid_Selection_Guide.pdf). בעוד ריכוז O2 בחד-שכבה התאית אינו נמדד ישירות, ניתן להשתמש בנתונים מהמערכת כדי להעריך את ריכוז O2 ברמת RPE. באופן ספציפי, בידיעה שקיים שיפוע חמצן בין החלק העליון של עמודת המדיה, שבו O2 זמין, לבין החלק התחתון של עמודת המדיה, שבו O2 נצרך, ניתן לשלב את חוקי הדיפוזיה של פיק עם קצב OCR הנמדד כדי להסיק רמות O2 במונושכבה של התא. מחשבון להערכה זו מסופק באינטרנט: https://lucidsci.com/notes?entry=oxygen_diffusion (ובצורה של מחברת אינטראקטיבית בקוד פתוח ב- https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture, ניתן למצוא את קוד המקור של מחשבון זה בכתובת https://github.com/lucidsci/oxygen-diffusion-calculator).
- לאחר הגישה למחשבון, הזן את נפח המדיה במיקרוליטרים (לדוגמה, 100 μL).
- הזן את ריכוז החמצן הרווי בממשק אוויר-נוזל (החלק העליון של עמודת המדיה מעל התאים). ערך זה הוא ~ 185 מיקרומטר בלחץ אטמוספרי סטנדרטי עם 5% O2 ו 95% לחות.
הערה: ניתן לקבוע זאת גם ממדידות O2 על ידי בדיקות מערכת בבארות מדיה בלבד (ללא תאים בתחתית הבאר). - בקלט Flux, הזן את Flux/OCR המדווח על-ידי המערכת.
- בהתבסס על ערכים אלה, ריכוז החמצן במצב יציב בכל גובה בעמודת המדיה מחושב ומוצג בתרשים (איור 7). ציר ה-x של העלילה הוא הגובה במ"מ מעל תחתית הבאר. ציר y הוא ריכוז O2 המחושב בגובה זה (במיקרומטר).
- ריכוז O2 בתחתית הבאר (היכן שהתאים נמצאים) מדווח בקו שמתחת לחלקה.
הערה: באופן כללי, ההערכה היא כי RPE in vivo רואה ריכוז O2 של 4-9%. כל 10 מיקרומטר של O2 בתנאים אטמוספריים סטנדרטיים מתאים לכ-1% O2. לכן, normoxia ברמה של תאים הוא כ 40-90 מיקרומטר של O2. ככל שעמודת המדיה גבוהה יותר, כך O2 יהיה נמוך יותר ברמה של RPE monolayer9. לכן, אם תאים נראים בתנאים היפוקסיים, נפח המדיה יכול להיות מופחת. אם נראה שהתאים נמצאים בתנאים היפרוקסיים, ניתן להגדיל את נפח המדיה.
תוצאות
מערך ה"סנדוויץ'" של ניסוי Resipher מודגם באיור 2A. מכסי חישה עם 32 גשושיות המתאימות לעמודות 3, 4, 9 ו-10 על לוח 96 הקידוחים יושבים בין לוחית התא לבין המכשיר. לאחר החיבור לרכזת, ההתקן מפעיל מנועים כדי להזיז את מכסה החישה למעלה ולמטה, ומודד ריכוז O2 בעמודת המדיה בטווח גבהים מעל חד-שכבת התא (בדרך כלל 1-1.5 מ"מ). לכן שיפוע O2 נמדד ברציפות על ידי רישום ריכוזי O2 בגבהים שונים אלה מעל החד-שכבתי. ממדידות הדרגתיות ויישום חוקי הדיפוזיה של פיק, המכשיר מחשב באופן אוטומטי את שטף החמצן מעל טווח גובה הגשושית עד מתחתיו, שהוא קצב צריכת החמצן (OCR) של חד-שכבת התא. מכסה החישה מזהה O2 בין אם באר ריקה (אוויר בלבד), מלאה במדיה אך ללא תאים (מדיה בלבד), או שיש בה מדיה מעל חד-שכבה של תא (מדיה + תאים). כבדיקת איכות למידת פעולתם של החיישנים במכסה החישה, ניתן להניח תחילה את המכסה מעל פלטה ריקה (באוויר בלבד) בעלת 96 בארות. אם כל חיישן עבור כל באר עובד, O2 המדווח צריך להיות עקבי אחד עם השני קרוב ל 200 מיקרומטר, שהוא קרוב O2 צפוי באטמוספרה בתנאי אינקובטור תרבית תאים סטנדרטיים. איור 2Bi מראה קריאות O2 משמונה גשושיות באוויר האטמוספרי (דווח כריכוז במיקרומטר, מאחר שהמרת היחידה המוגדרת כברירת מחדל מניחה שהגשושיות נמצאות בנוזל של 37°C). קריאות אלה הדוקות (±5%) וקרובות ל-200 מיקרומטר, מה שמרמז על כך שכל שמונת החיישנים מתפקדים היטב. באיור 2Bii נעשה שימוש באותו מכסה חישה כמו באיור 2Bi , אך התקן אחר נפרס. כאן, שני חיישני מכשיר פגומים נאספים בהתבסס על עקומות חריגות (באדום). זה מצביע על כך שהמכשיר בעייתי ויש להחליף אותו (או להשאיר את הבארות המתאימות לחיישנים פגומים מחוץ לניסוי). באיור 2Biii, משתמשים באותו התקן כמו איור 2Bi , אבל משתמשים בשני מכסי חישה שונים. ל-Lid1 (צד שמאל) יש שונות גבוהה בין הגשושיות, מה שמרמז על כך שחומר החישה של המכסה פגום, בדרך כלל מכיוון שנעשה שימוש רב מדי במכסה. Lid2 (צד ימין) הוא חדש, ומדגים קריאות הדוקות ומקובצות סביב 200 מיקרומטר. באמצעות המערכת ניתן לנתח את ההשפעה של תוספי סרום בתקשורת על חילוף החומרים במיטוכונדריה RPE. כפי שניתן לראות באיור 2C, רמות מוגברות של תוספי סרום גרמו לרמות גבוהות יותר של RPE OCR. חשוב לציין, תוספי סרום גבוהים יותר גם אפשרו לחילוף החומרים במיטוכונדריה להימשך תקופה ארוכה יותר. אפילו ללא כל תוספת סרום, OCR נשמר במשך כ-90 שעות לפני שתשישות של מצעים מטבוליים מיטוכונדריאליים גורמת לירידה ב-OCR. לכן, שינויים במדיה עם 100 μL לכל 96-באר כל 3.5 ימים (פעמיים בשבוע) מספיקים, אפילו עם מדיה נטולת סרום, כדי למנוע דלדול תזונתי בתרביות RPE בוגרות, מובחנות מאוד ומקוטבות.
שיעורי זיהוי תווים אופטי (OCR) יכולים להשתנות באופן משמעותי מבאר לבאר, אפילו בתרביות שבהן נראה שלכל הבארות יש אותו מספר תאים ומורפולוגיה. לכן, כדי לבודד אם ניתן לייחס עלייה ב-OCR למצב ניסויי או פשוט להבדלים בסיסיים ב-OCR בין בארות, יש צורך בנורמליזציה. הצעד הראשון בנורמליזציה הוא להבטיח שספירת התאים בין הבארות תהיה עקבית, כמתואר בסעיף 1.3 לפרוטוקול. אם ספירת התאים משתנה בין בארות, יש לנרמל את זיהוי התווים האופטי (OCR) של הבאר למספר התא. באופן כללי, עבור תרביות RPE בוגרות ומקוטבות מאוד, ספירת התאים בין בארות עקבית להפליא9. אפילו בתרחישים כאלה, OCR בסיסי בין בארות יכול להשתנות, כפי שמודגם באיור 3A. כאן, OCR בסיסי, לפני כל טיפול, משתנה עד 100 fmol/mm2/sec בין בארות. על ידי מדידת OCR לפני הטיפול, ניתן לקבוע את ה-OCR של דלתא המופעל על ידי הטיפול הניסיוני ולבודד זאת מכל הבדל ב-OCR הבסיסי בין בארות. במקרה זה, הטיפולים משווים שני מצמדים מיטוכונדריאליים (FCCP לעומת BAM15) עם בקרת רכב. ברגע ש-OCR בסיסי מנוצל לנורמליזציה, השפעות הטיפול הספציפיות עבור ה-uncouplers לעומת הבקרה הופכות ברורות (השוו איור 3B לעומת איור 3C). באופן כללי, ניסויים שיכולים לשנות OCR צריכים להיות מפוצלים לשני שלבים לפחות: OCR ראשוני כדי לקבוע OCR בסיסי ושלב טיפול כדי לקבוע את OCR דלתא.
כדי לאשר שתרביות RPE מגיבות בדרכים צפויות למניפולציה מיטוכונדריאלית ולבסס פרופיל ביו-אנרגטי עבור RPE, ניתן להשתמש בכלים הקלאסיים של מולקולות קטנות המשמשים במבחן המאמץ המיטוכונדריאלי על מנתח סוסון הים של Agilent. ראשית, ניתן למדוד קיבולת מיטוכונדריאלית עודפת באמצעות מצמד מיטוכונדריאלי19. בתרביות RPE, BAM15 מפרק המיטוכונדריה מראה עלייה הרבה יותר חזקה ומתמשכת ב-OCR בהשוואה ל-FCCP (איור 3C,D), מבלי לגרום לרעילות. פרמטרים אחרים הזמינים במבחן המאמץ המיטוכונדריאלי של סוסון ים, כולל נשימה בסיסית, נשימה מקושרת ATP, דליפת פרוטונים ויכולת נשימה שאינה מיטוכונדריאלית, ניתנים לחישוב באמצעות המערכת. בעוד ש-Seahorse Analyzer מסתמך על יציאות הזרקה כדי לספק ברצף רעלים המעכבים מתחמי זרחן חמצוני ספציפיים כדי להסיק את הפרמטרים לעיל, ל-Resipher אין יכולת זו. עם זאת, ניתן להוסיף כל רעלן מיטוכונדריאלי לבארות נפרדות, וניתן לחשב פרמטרים נשימתיים שונים על בסיס החלפת קיפול על בארות שטופלו ברכב. באיור 4A משווים את ההבדלים ב-OCR בין בארות שטופלו ב-BAM15 המיטוכונדריאלי, אוליגומיצין מעכב ATP סינתאז, מעכבי I ו-III המורכבים אנטימיצין/רוטנון ובקרת רכב (DMSO). מכיוון שרעלים אלה יכולים לגרום למוות תאי לפרקי זמן ארוכים יותר ומוות תאים ישפיע על OCR, קריאות OCR נלקחו לאחר מספר שעות בלבד של טיפול. איור 4B מראה את ההבדלים ב-OCR בין כלי רכב לבארות שטופלו בכל מולקולה קטנה פעילה מיטוכונדרית בצורת גרף עמודות, באקסטרפולציה מנקודות הזמן האחרונות באיור 4A. לאחר מכן ניתן להשתמש בערכי זיהוי תווים אופטי (OCR) באיור 4B כדי לחשב פרמטרים ביו-אנרגטיים עבור תרבית RPE, כפי שניתן לראות באיור 4C. כל ערך מקודד צבע בפרופיל הביו-אנרגטי באיור 4C מגיע מאותו ערך מקודד צבע באיור 4B. לפיכך, ניתן להעריך פרמטרים כמו נשימה מקושרת ATP, דליפת פרוטונים, קיבולת נשימה מיטוכונדריאלית מקסימלית וקיבולת נשימה שאינה מיטוכונדריאלית באמצעות מערכת OCR. סיכום של אופן הפעולה של כל מולקולה קטנה פעילה במיטוכונדריה מוצג באיור 4D.
לאחר הדגמת הפרוטוקול של מערכת זו על תרביות RPE וניסויי בקרה לבדיקת פרופילים ביו-אנרגטיים של RPE, ניתן לחקור יישומים ניסיוניים של המערכת לביולוגיה ופתולוגיה של RPE. בזגוגית שגשוגית (PVR), מצב המתרחש לאחר היפרדות רשתית או טראומה עינית, RPE עובר טרנספורמציה דרמטית המכונה מעבר אפיתל למזנכימלי (EMT) שבו RPE רגיל מאוד דמוי אבן מאבדים את הידבקויות התא שלהם ומתמיינים לתאים מזנכימליים בצורת ציר שהם מתכווצים ונעים 1,2. זה מפעיל כוחות התכווצות משיקים על הרשתית שיכולים לגרום להיפרדות רשתית. גורמים קלאסיים של EMT ב- RPE כוללים טרנספורמציה של גורם גדילה-בטא (TGFβ) וגורם נמק גידולי-אלפא (TNFα)10,11,12. מבין שלושת איזופורמים TGFβ של יונקים, TGFβ2 הוא הגורם הבולט והחזק ביותר של EMT ברשתית1, מה שגורם להתארכות תאית מובהקת של תאי RPE משושים אופייניים ולביטוי מוגבר של סמנים מזנכימליים. תגובת EMT המושרה על ידי TGFβ2 ב- RPE מלווה בדיכוי הנשימה המיטוכונדריאלית ולאחר מכן עלייה ביכולת הגליקוליטית, כפי שהודגם בעבר באמצעות סוסון ים XFe9610. בעוד סוסון הים מספק פרופילים ביו-אנרגטיים בזמן אמת, הוא אינו מאפשר ניטור OCR לטווח ארוך. לכן, ביישום הראשון של מערכת OCR במחקר זה (איור 5), הנשימה המיטוכונדריאלית הייתה במעקב במשך שלושה שבועות כאשר EMT הושרה עם TGFβ2 ב-RPE, מה שמאפשר מידול חוץ גופי של תכנות מחדש מטבולי המתרחש במהלך PVR. שלא כמו ניתוח נקודת הזמן היחידה של RPE EMT באמצעות מנתח סוסון ים, ניתן לעקוב אחר המצב המטבולי של RPE העובר EMT במשך מספר שבועות. ניכר כי חשיפה חוזרת ונשנית של RPE ל-TGFβ2 גורמת לירידה מתמשכת במטבוליזם של המיטוכונדריה. נתונים קודמים שהשתמשו ב-Seahorse XF Analyzer הצביעו על כך ש-TGFβ2 הפחית משמעותית את יכולת הנשימה המרבית ב-24 שעות ו-72 שעות, אך לא השפיע על רמות OCR10 הבסיסיות. זיהוי תווים אופטי (OCR) בסיסי ללא שינוי עם TGFβ2 עד 72 שעות מאומת על-ידי מערכת זיהוי תווים אופטי (OCR) ששימשה במחקר זה (איור 5). עם זאת, הנתונים ארוכי הטווח ממערכת OCR במחקר זה מגלים כי לאחר 5 ימים של חשיפה ל- TGFβ2, רמות OCR בסיסיות מתחילות לרדת, כאשר ירידה ב- OCR הבסיסי הופכת לבולטת ביותר לאחר 20 יום. ממצאים אלה מדגישים שינויים ארוכי טווח ב-OCR בסיסי שלא צולמו בנקודות זמן קודמות של סוסון ים.
ביישום שני, המערכת יכולה לשמש לניטור חילוף החומרים המיטוכונדריאלי RPE בתנאים היפוקסיים. מכיוון ש-AMD מקושר לדילול כוריוקפילריס והיפוקסיה 13,20, הבנת ההתאמות של RPE להיפוקסיה תת-רעילה אמורה לספק תובנות לגבי הפתוגנזה של AMD. כדי לחשוף תרביות RPE להיפוקסיה מבוקרת תוך ניטור חילוף החומרים במיטוכונדריה, המערכת יכולה להיות ממוקמת בתא היפוקסיה אשר, בתורו, ממוקם באינקובטור תרבית תאים. כדי להקל על התקנה זו, חור קטן נקדח לתוך המכסה של תא היפוקסיה, המאפשר כבל USB של המערכת להגיע לתוך תא היפוקסיה. החור אטום באמצעות מרק או סיליקון (איור 6A). חיישן O2 נייד יכול להיות ממוקם בתא היפוקסיה כדי לפקח על רמות O2 אטמוספרי ולהבטיח את חותם תא ההיפוקסיה נשאר שלם. באמצעות מערך זה ניתן לקבוע את קצב שיווי המשקל בין ריכוז O2 באטמוספירה לבין ריכוז מדיה O2. באיור 6B, מדיה המאוזנת עם O2 אטמוספרי ממוקמת בבארות בודדות על צלחת של 96 בארות, ללא תאים, ומוחדרת לתא היפוקסיה המכיל רק 5% O2 (~50 מיקרומטר O2). עם הזמן, התקשורת בכל באר מתאזנת עם הריכוז האטמוספרי החדש. ככל שגובה עמודת המדיה גבוה יותר (נפח גדול יותר), כך אורך שיווי המשקל ארוך יותר. עם 65 μL של מדיה בבאר של צלחת 96 באר, שיווי משקל עם O2 אטמוספרי לוקח בערך 5 שעות. עם זאת, זמן שיווי משקל לוקח יותר מ -10 שעות כאשר נפח המדיה הוא 100-200 μL. תוצאות אלה מדגישות את החשיבות של שיווי משקל מראש של המדיה עם ריכוז O2 האטמוספרי הרצוי לפני החלת המדיה על תאים במהלך ניסוי היפוקסיה.
עבור ניסויי היפוקסיה, חשוב להבטיח את רמות O2 בתא ההיפוקסיה להישאר יציבות. שמירה על אחת מבארות הקצה בלוח 96 הקידוחים נקייה מתאים או מדיה תאפשר לאחד מחיישני מכסה החישה לנטר ברציפות את O2 האטמוספרי. באיור 6C, ניטור כזה עם באר אחת שנחשפה לאוויר מדגים שלתא ההיפוקסיה יש דליפה איטית, כך שעד 30 שעות, התאים קרובים לריכוזי O2 באטמוספרה. כבקרה סופית לניסויי היפוקסיה, חשוב לקבוע אם מסיסות O2 שונה בין מדיה "טרייה" למדיה "מותנית". אם המסיסות שונה בין מדיה שהונחה בתחילה על תאים לבין מדיה שהייתה על תאים במשך פרק זמן משמעותי, אז שיפוע O2 בעמודת המדיה מעל התאים יהיה שונה כ"תנאים" של מדיה עם הזמן על פני התאים. זה, בתורו, משפיע על חישוב OCR. באיור 6D, לוח של 96 בארות עם בארות ריקות ("אוויר"), בארות ללא תאים אך עם מדיה טרייה ("מדיה חדשה"), ובארות ללא תאים אך עם מדיה שקודם לכן הודגרה על תרביות RPE במשך 48 שעות ("מדיה מותנית") הוצבה לראשונה באטמוספירה O2 כדי לאפשר שיווי משקל מלא. הצלחת הונחה אז בתא היפוקסיה בערך 3-4% O2 (30-40 מיקרומטר) והותר לה להתאזן. לבסוף, הצלחת הוחזרה שוב לריכוזי O2 אטמוספריים. עקומות הריכוז של O2 עבור מדיה חדשה ומדיה מותנית זהות, מה שמוכיח כי מסיסות O2 בין מדיה חדשה ומותנית זהה, מה שמאשר כי שינויים בהרכב המדיה לאורך זמן כאשר חומרי מזון נצרכים ותוצרי לוואי מופרשים למדיה אינם משנים באופן משמעותי את מסיסות O2 ולכן אינם משפיעים בשוגג על OCR.
מכיוון שגובה עמודת המדיה מעל התאים משפיע באופן דרמטי על זמינות O2 במונושכבה9 של RPE, חשוב לקבוע אם נפח מדיה מסוים גורם להיפוקסיה, נורמוקסיה, או היפראוקסיה בשכבת ה-RPE. באמצעות מדידות מהמערכת, בשילוב עם מחשבון מקוון (https://lucidsci.com/notes?entry=oxygen_diffusion (ובצורה של מחברת אינטראקטיבית בקוד פתוח ב https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture) - קוד המקור של מחשבון זה ב https://github.com/lucidsci/oxygen-diffusion-calculator), ניתן להעריך את ריכוז החמצן ב monolayer RPE. איור 7 מדגים צילום מסך של המחשבון האינטראקטיבי. RPE in vivo בדרך כלל רואה ריכוז O2 של 4-9%, המתורגם לריכוז מולארי O2 של ~40-90 מיקרומטר.

איור 1: מיקום חיישנים על מכסי חישה שונים, פריסת לוחות עבור מכסה חישה של 32 ערוצים ומורפולוגיה של RPE. בארות התואמות את מיקום החיישנים במכסי החישה השונים עבור אפשרויות המכסה (A) של 4 ערוצים, (B) 32 ערוצים ו- (C) של 96 ערוצים. (D) פריסת לוחות מומלצת עבור מכסה החיישן בן 32 הערוצים. בשל השפעות הקצה, אין לזרוע תאים בבארות הקצה ובמקום זאת, יש להציב מדיה בארבע בארות אלה (סגול). תאים נזרעים בבארות כתומות. את הבארות הנותרות יש למלא במים סטריליים (כחולים) כדי למנוע השפעות אידוי. (E) תרבית RPE בוגרת עם תאים משושים, דחוסים היטב ופיגמנטים. סרגל קנה מידה = 20 מיקרומטר. קיצורים: RPE = אפיתל פיגמנט ברשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הגדרת מערכת Resipher "סנדוויץ'" ובקרת איכות. (A) מכסה החישה מחליף מכסה לוח סטנדרטי בעל 96 בארות והגשושיות שלו מוכנסות לבארות המתאימות. המכשיר בצבע שחור יושב בחוזקה על מכסה החישה באמצעות מגנטים. התמונות בצד שמאל של האיור מראות את המכשיר ואת מכסה החישה בכיוון הנכון שלהם. עם זאת, עבור התמונות בצד ימין, ההתקן ומכסה החישה סובבו לצדדים שלהם כדי להציג טוב יותר את פרופיל התחתון שלהם. (ב) בקרת איכות לחישת מכסים ולהתקן. (ט,ב) אותו מכסה חישה ממוקם בלוח מקלט ריק בן 96 בארות (אוויר בלבד), ושני התקנים שונים ממוקמים ברצף על גבי מכסה החישה. (i) המכשיר הראשון מדגים נתונים משמונה גשושיות עם שונות נמוכה וקריאות O2 ~200 מיקרומטר, הצפויות עבור O2 אטמוספרי. (ii) המכשיר השני מדגים נתונים משמונה גשושיות שבהן שתי גשושיות קוראות באופן חריג (נקודות אדומות). (iii) מכשיר אחד היה בשימוש עם לוחית ריקה של 96 בארות (אוויר בלבד) אך עם שני מכסי חישה שונים שנבדקו ברצף. נתונים מ-16 גשושיות שורטטו, והראו שונות רחבה עבור Lid1 (צד שמאל) ושונות נמוכה עבור Lid2 (צד ימין). (C) תרשימי OCR של תרביות RPE במדיה של 100 μL עם כמויות שונות של סרום נוטרו במשך 120 שעות. תאי RPE במדיה נטולת סרום (מגנטה) הם בעלי OCR נמוך יותר, כאשר OCR יורד מוקדם יותר מאשר מדיה עם כמויות גבוהות יותר של סרום. קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
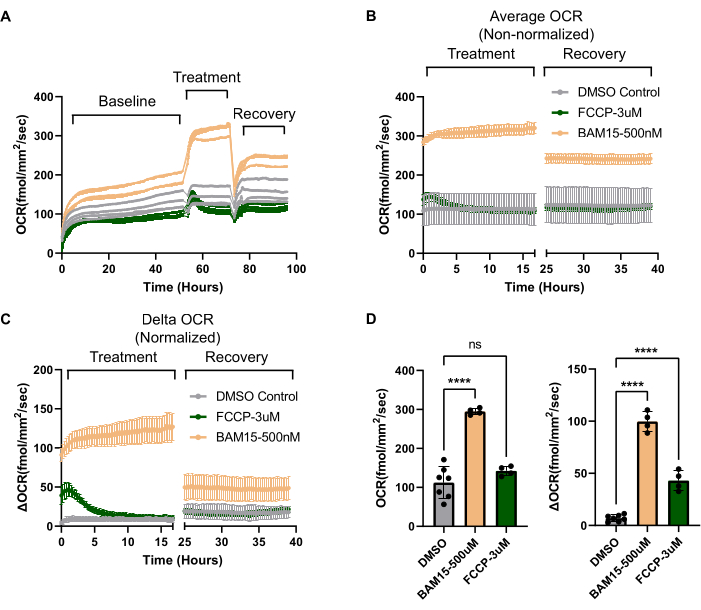
איור 3: השפעות ארוכות טווח של מפרקים מיטוכונדריאליים שהודגמו באופן ייחודי באמצעות מערכת OCR. (A) נתוני OCR גולמיים לאורך זמן (שעות) המדגישים את ה-OCR הראשוני (נקבע במשך 50 שעות), שלב הטיפול (~20 שעות לאחר הוספת תרופות) ושלב ההחלמה (~20 שעות לאחר שטיפת תרופות). RPE טופל בשני מצמדים מיטוכונדריאליים שונים, FCCP (3 μM, N = 4) או BAM15 (500 ננומטר, N = 4) והושווה לבקרת רכב DMSO (0.6%, N = 7). כל עקבות מייצגים באר אחת. (B) ממוצע OCR של כל הבארות עבור כל מצב ב-(A) המיועדות לשלבי הטיפול וההחלמה. ללא נורמליזציה (ציר Y הוא OCR מוחלט), קשה לראות את גודל אפקט הטיפול עם FCCP. (C) כאשר כל מעקב של זיהוי תווים אופטי (OCR) מופחת מזיהוי התווים האופטי (OCR) שלו לפני הטיפול, ניתן לחשב זיהוי תווים אופטי (OCR) של דלתא (משורטט על ציר Y). זה מאפשר לבודד את ההשפעות של הטיפול על OCR, למרות השונות ב- OCR הבסיסי בין בארות. באמצעות Delta OCR, ההשפעה של FCCP מתבררת. כמו כן, מתברר עד כמה קצרת מועד ההשפעה של FCCP על פירוק צימוד מיטוכונדריאלי, בהשוואה ל-BAM15. לבסוף, מתברר כי בהשוואה ל- FCCP, חשיפה ל- BAM15, גם לאחר שהתרופה נשטפת, יוצרת מצב "מותאם" חדש של OCR גבוה ומתמשך. (D) החלקות ב-(B) ו-(C) מוצגות בצורת גרף עמודות, מה שמאפשר השוואה ישירה בין נתונים לא מנורמלים (גרף שמאלי, מ-(B)) ומנורמלים (Delta OCR, גרף ימני, מ-(C)). קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית; FCCP = קרבוניל ציאניד-p-trifluoromethoxyphenylhydrazone; DMSO = דימתיל סולפוקסיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
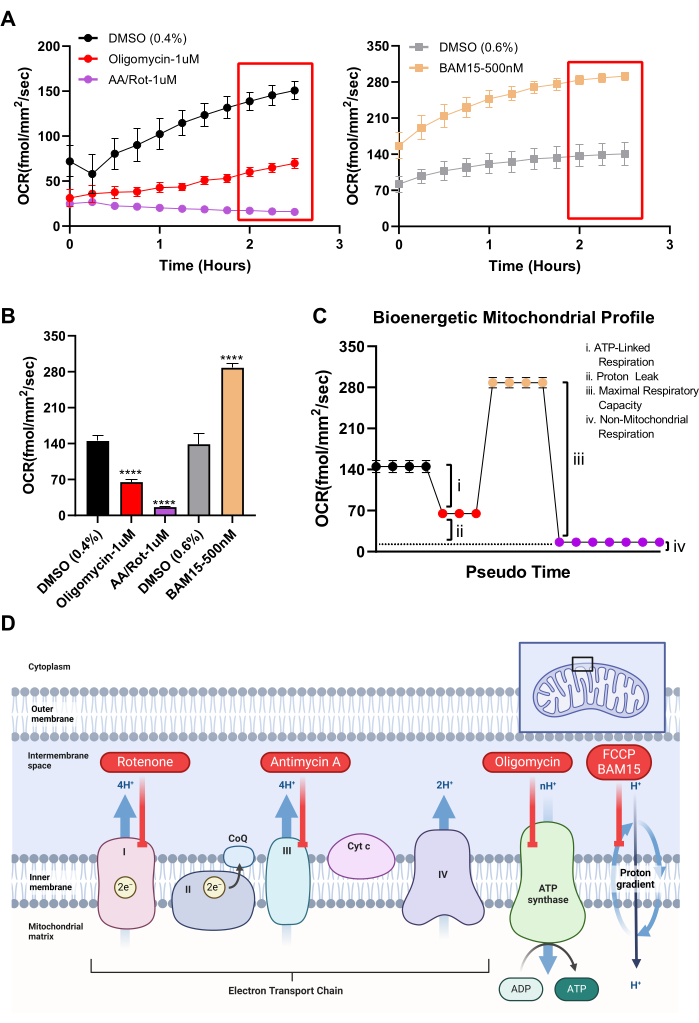
איור 4: שימוש במערכת OCR לחישוב פרמטרים של ביו-אנרגטיקה מיטוכונדריאלית. (A) שימוש באותן מולקולות קטנות שהן חלק ממבחן המאמץ המיטוכונדריאלי של מנתח סוסון ים, OCR במשך 2.5 השעות הראשונות של שלב הטיפול מתואר עבור תרביות RPE. (גרף שמאלי) אוליגומיצין מעכב ATP-סינתאז (N = 3), מעכבי I ו- III קומפלקס אנטימיצין A / רוטנון (N = 7), או רכב, DMSO 0.4% (N = 4). (גרף ימני) המצמד המיטוכונדריאלי BAM15 (N = 4) או DMSO ברכב 0.6% (N = 4). (B) ממוצע של שלוש נקודות הזמן האחרונות עבור כל קבוצת טיפול (תיבות אדומות ב-(A)). (C) תיאור של מנתח סוסון ים מנתח פרופיל ביו-אנרגטי של בדיקת מאמץ מיטוכונדריאלי בהתבסס על נתוני Resifer. נקודות הנתונים המקודדות בצבע בתרשים המדומה תואמות לתרשימי עמודות מקודדים בצבע ב- (B). ניתן לחשב את כל פרמטרי הנשימה באמצעות נתוני Resipher ולבחור מולקולות קטנות. (D) דיאגרמה של אופן הפעולה של הריאגנטים שבהם נעשה שימוש באיור 3 ובאיור 4. קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית; DMSO = dimethyl sulfoxide; AA = אנטימיצין A; ריקבון = רוטנון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ניטור ארוך טווח של זיהוי תווים אופטי (OCR) של RPE שעובר מעבר אפיתל למזנכימלי המגורה על-ידי TGFβ2. תרביות RPE אנושיות ראשוניות בוגרות טופלו ב-TGFβ2 של 10 ננוגרם/מ"ל או בבקרת רכב כל 2-3 ימים. (A) מדידות OCR בזמן אמת נוטרו במשך 3 שבועות עם (B) כימות של Delta OCR לאורך זמן (יום 19 - יום 6). N = 6-7 בארות לכל מצב, מבחן t לא מזווג, * P < 0.05. קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית; TGFβ2 = שינוי גורם גדילה בטא-2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: ניטור התגובה המיטוכונדריאלית של RPE להיפוקסיה. (A) ה"סנדוויץ'" של מערכת OCR הורכב בתא היפוקסיה וכבל ה-USB חובר לרכזת דרך חור שנקדח במכסה ואטם בסיליקון גריז או מרק. גם בתא היפוקסיה הוא צלחת פטרי של מים סטריליים כדי לשמור על לחות חיישן O2 נייד. המערכת כולה הושארה באינקובטור של תרבית תאים לאחר שהאטמוספירה של תא ההיפוקסיה הוחלפה בריכוז O2 נמוך יותר. (B) למדיה לוקח זמן להתאזן לריכוזי O2 מעל ממשק האוויר-נוזל. נפחים שונים של מדיית RPE המקבילה לאטמוספירה O2 נוספו בבארות ריקות (ללא תאים) של לוח בן 96 בארות. תא ההיפוקסיה הותאם אז ל -5% (50 מיקרומטר) O2. ריכוז O2 במדיה של כל באר נוטר במשך 20 שעות. בארות עם נפחי מדיה גבוהים יותר שיווי משקל ל-5% O2 לאט יותר מנפחי מדיה נמוכים יותר. N = 8. (C) המערכת יכולה לשמש לאיתור דליפות אוויר בתא ההיפוקסיה. תא ההיפוקסיה הוקם עם 1% O2, ומכסה החישה הונח מעל בארות ריקות (באוויר בלבד). יציאות הכניסה והיציאה של תא ההיפוקסיה נותרו פתוחות, והאטמוספירה של תא ההיפוקסיה התאזן מחדש לרמות O2 אטמוספריות מעל ~90 שעות. (D) מדיה חדשה וסופרנאטנטים ("מדיה מותנית") הם בעלי מסיסות O2 דומה. זה מבטל את החשש של מסיסות דיפרנציאלית O2 במדיה כאשר הרכבה משתנה בזמן התרבות, מה שישפיע על עקביות קריאות OCR לאורך זמן. אותו נפח (100 מיקרוליטר) של מדיה טרייה ("מדיה חדשה") או מדיה שהודגרה במשך 48 שעות מעל תאים ("מדיה מותנית") נוספו לבארות של צלחת ללא תאים. מערכת OCR "סנדוויץ'" היה נתון בתחילה לרמות O2 אטמוספריות, ואז הועבר לתא היפוקסיה (3-5% O2 או 30-50 מיקרומטר), ואז הועבר שוב לרמות O2 אטמוספריות. O2 מפלסים באוויר נוטרו על ידי גשושיות בבארות ריקות (באוויר בלבד). השינוי בריכוז O2 במהלך כל מעבר בין שני סוגי המדיה זהה, ומראה כי מסיסות O2 בין שני סוגי המדיה זהה. N = 6. קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7: ריכוזי O2 בשכבה החד-שכבתית RPE נקבעו באמצעות מחשבון מקוון. צילום מסך של המחשבון המקוון (https://observablehq.com/@lucid/oxygen-diffusion-and-flux-in-cell-culture). עיין בטקסט לקבלת פרטים על האופן שבו ניתן להשתמש במחשבון כדי לקבוע את כמות החמצן הזמינה בשכבה החד-שכבתית של RPE. קיצורים: RPE = אפיתל פיגמנט ברשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
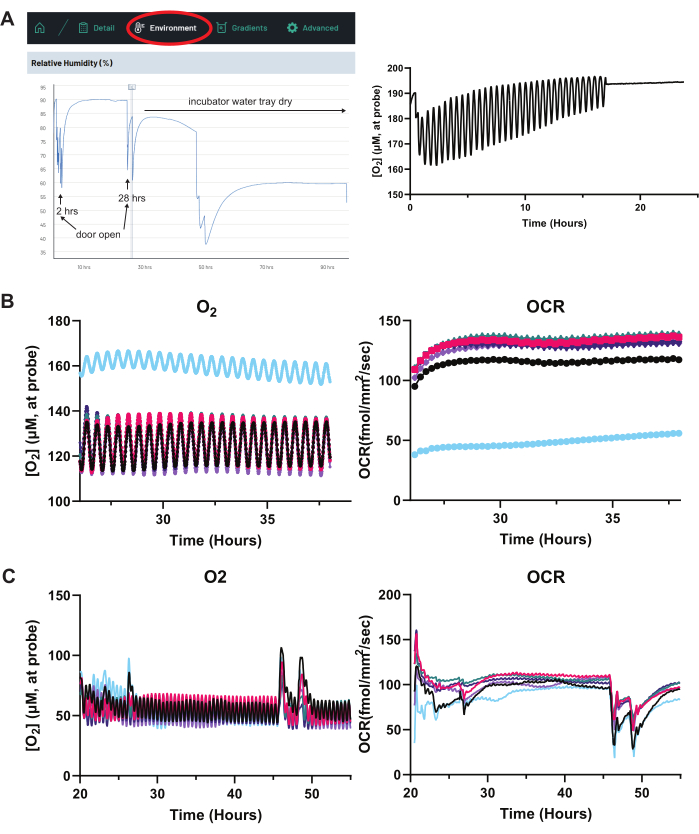
איור 8: ניסויי פתרון בעיות: אידוי, תאים לא בריאים ותנודות מוגזמות של זיהוי תווים אופטי (OCR). (א) אידוי מוגזם. כאשר קיימת חריגה במעקב אחר זיהוי תווים אופטי (OCR) עבור באר, התחל בלחיצה על הכרטיסיה סביבה בממשק המקוון של המערכת (משמאל). כאן ניתן לפקח על לחות, טמפרטורה ולחץ אטמוספרי. פתיחת אינקובטור תרבית התאים תשבש זמנית את הלחות (ראה שעתיים ו -28 שעות על המעקב). עם זאת, החל מ-30 שעות, עקבות הלחות יורדות בעקביות עם הזמן, גם ללא פתיחת הדלת. זה מצביע על כך שמגש המים של אינקובטור תרביות התאים יבש. כל הפרעה ללחות או לטמפרטורה תשנה את קריאות זיהוי התווים האופטי (OCR). (ימין) לחות נמוכה מחריפה את האידוי. בעקבה מימין, באר שעוברת אידוי מהיר מדגימה הבדלים קטנים יותר ויותר בריכוז O2 בין החלק העליון והתחתון של סיבוב הבדיקה של החיישן (1 מ"מ עד 1.5 מ"מ מעל מונו-שכבה RPE). זה מצביע על כך שקצה הגשושית קרוב לממשק האוויר-מדיה. כאשר ריכוז O2 קורא "שטוחים" בערך קרוב לריכוזי O2 באטמוספירה הידועה (~200 מיקרומטר), הדבר מצביע על כך שקצה הגשושית נמצא כולו מחוץ לעמודת המדיה ורק דוגם אוויר. קריאות OCR אינן תקפות עוד ובארות כאלה זקוקות לשינוי מיידי במדיה. (B) תאים לא בריאים. שרטוט עקבות O2 ו-OCR של כל באר בנפרד מאפשר זיהוי של באר חריגה, הנגרמת בדרך כלל על ידי התאים שאינם בריאים. כאן, הבאר המיועדת על ידי העקבות הכחולים אינה בריאה. N = 6 בארות. (ג) פתחי דלתות אינקובטור והחלפת מדיה. שינויים בלחות, טמפרטורה, לחץ ו-CO2 באטמוספירה במהלך פתיחת דלתות האינקובטור, יחד עם כל שינוי במדיה, משבשים באופן זמני את שיפוע שיווי המשקל O2 שנוצר בבאר, וגורמים לעליות חריגות של O2 ו-OCR מוקדם ומאוחר בגרפים אלה. N = 6 בארות. קיצורים: OCR = קצב צריכת חמצן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
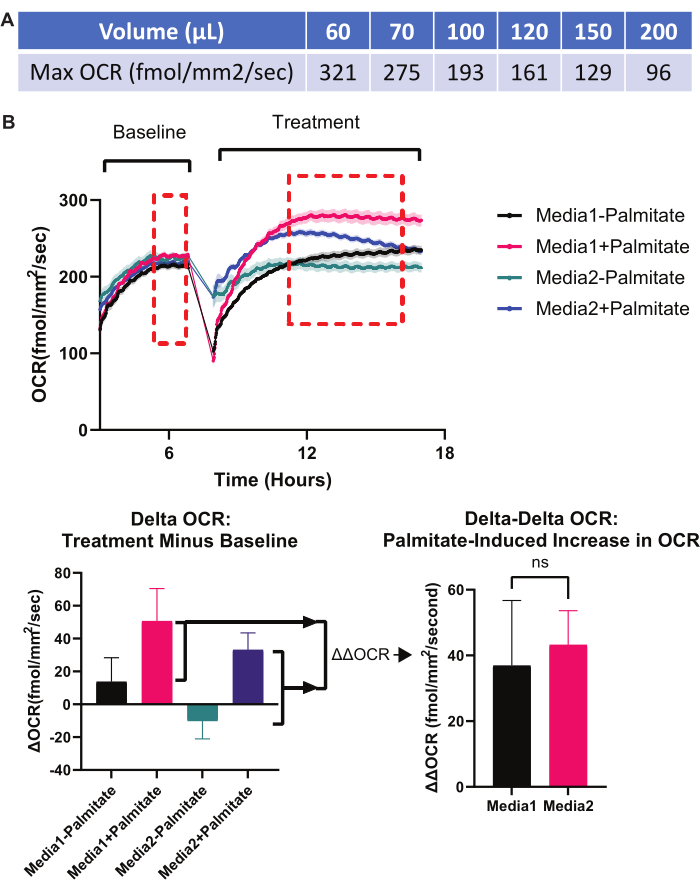
איור 9: ניסויי פתרון בעיות: נפח מדיה ונורמליזציה. (A) עוצמת המדיה מגבילה את עוצמת הזיהוי האופטי (OCR) המרבית האפשרית. מכיוון שנפחי מדיה גבוהים יותר מובילים לזמינות נמוכה יותר של O2 בשכבה החד-שכבתית של RPE, לכל נפח מדיה בבאר אחת של לוח של 96 בארות יש OCR מרבי. מעל OCR זה, O2 ברמת התאים הוא למעשה 0% (anoxic). לכן, אם קרוב ל-OCR התיאורטי המקסימלי עבור נפח מדיה נתון, יש תועלת בהנמכת נפח המדיה, כך שלא ייראה "אפקט תקרה" של OCR במהלך הניסוי. מוצג זיהוי תווים אופטי (OCR) תיאורטי מרבי שניתן להשיג בכל נפח מדיה (בלוח סטנדרטי של 96 בארות). כל הערכים חושבו באמצעות המחשבון המקוון שנדון בסעיף 4 של הפרוטוקול והוצג באיור 7. (ב) נורמליזציה מתאימה. עבור ניסויים שבהם אדם מעוניין בהשפעה של משתנה אחד על יכולתו של משתנה אחר לגרום לחילוף חומרים מיטוכונדריאלי, מערך ניסויי דלתא-דלתא OCR הוא אידיאלי. בהתקנה ב-(B) נבדקת היכולת של שתי מדיות שונות לקדם חמצון β של פלמיטט. אם מתרחש חמצון β של חומצת השומן, אמורה להיות עלייה משמעותית ב- OCR המיטוכונדריאלי. מדיה מסוימת עשויה לקדם חמצון β פלמיטט טוב יותר מאשר מדיה אחרת. בצד שמאל של גרף זיהוי התווים האופטי (OCR), שתי מדיות שונות (מדיה 1 לעומת מדיה 2) מוצגות לבארות מקבילות של תרביות RPE. מתקבל זיהוי תווים אופטי (OCR) בסיסי. הפלמיטט הבא מתווסף למחצית הבארות המכילות כל סוג מדיה. זה יוצר ארבעה תנאים: מדיה 1 - palmitate, מדיה 1 + palmitate, מדיה 2 - palmitate, מדיה 2 + palmitate. תגובת זיהוי התווים האופטי (OCR) לכל אחד מתנאי המדיה החדשים הללו נרשמת. לאחר מכן, ערכי זיהוי התווים האופטי (OCR) לאחר טיפולים ניסיוניים (ממוצע של תיבה מקווקו אדומה בשלב הטיפול) מופחתים מערכי OCR הבסיסיים לפני הטיפול (ממוצע של תיבה מקווקו אדומה תחת שלב הבסיס), ויוצרים גרפים של עמודות זיהוי תווים אופטי (OCR) של דלתא (משמאל למטה). לבסוף, היכולת של מדיה 1 לעומת מדיה 2 לקדם חמצון β נקבעת בגרף עמודות OCR של דלתא-דלתא (מימין למטה). כאן, ההבדל בין "Delta OCR של מדיה 1 + palmitate" לבין "Delta OCR של מדיה 1 - palmitate" מחושב ומושווה להבדל בין "Delta OCR של מדיה 2 + palmitate" לבין "Delta OCR של מדיה 2 - palmitate". סוג זה של הקמה ניסיונית ונורמליזציה מבודד את ההשפעות של מדיה 1 לעומת מדיה 2 על קידום חמצון β; המבנה הכללי של נורמליזציה זו ישים לכל ניסוי שבו מודדים את ההשפעה של משתנה אחד על יכולתו של משתנה אחר לשנות OCR. קיצורים: OCR = קצב צריכת חמצן; RPE = אפיתל פיגמנט ברשתית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: המתכון למדיה של תרבית תאי RPE. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
חילוף החומרים המיטוכונדריאלי של RPE ממלא תפקיד קריטי בפתוגנזה של מחלות רשתית מסנוורות נפוצות, כולל AMD ו- PVR. מידול חילוף החומרים המיטוכונדריאלי RPE במבחנה מאפשר לבודד את המצב המטבולי שלו מאלה של הרקמות הסובבות, יחד עם חשיפת הרקמה לעלבונות שונים המדמים מחלה באופן מבוקר. מודלים חוץ גופיים כאלה של מטבוליזם מיטוכונדריאלי RPE התאפשר על ידי הופעתן של תרביות ראשוניות אנושיות ו- iPSC-RPE בעלות נאמנות גבוהה המשיגות את מצב ההתמיינות והקוטביות הנכונים הדרושים כדי להתקרב מקרוב ל- RPE in vivo. בעוד ניטור קצב צריכת החמצן (OCR) בתרביות כאלה הוא שיטה אידיאלית לניטור חילוף החומרים במיטוכונדריה, ההתקנה לניטור OCR מונעת לעתים קרובות גידול תרביות בתנאים הדרושים ל-RPE מקוטב מאוד ומובחן לחלוטין. כאן, אנו מתארים את Resipher כמערכת חדשנית לניטור מטבוליזם מיטוכונדריאלי של RPE באמצעות הערכה בזמן אמת וארוכת טווח של OCR בתרביות RPE מובחנות ומקוטבות מאוד.
שיטות אחרות שימשו לניטור OCR ב- RPE. Seahorse XF Analyzer מתוכנן לנטר OCR לפרקי זמן קצרים עם מניפולציות חריפות של תפקוד המיטוכונדריה. עם זאת, מבחני סוסון ים דורשים גידול תאים על לוחות מותאמים אישית, שאינם תורמים לתמיכה בקוטביות RPE גבוהה ובהתמיינות21. קלטון, וולרת' ועמיתיו התאימו את סוסון הים להערכה של תרביות RPE מובחנות מאוד הגדלות על תמיכות מיקרו-נקבוביות על ידי חיתוך הממברנה המיקרו-נקבובית לחתיכות והצבתן בצלחת סוסון הים, אך שיטה זו עדיין עובדת רק לניטור קצר טווח ונקודת קצה של תרביות מכיוון שלתאים אין גישה ל-CO2 במהלך הבדיקה, הבדיקה יכולה להיעשות רק בתנאים לא סטריליים, וחיתוך התמיכה המיקרו-נקבובית יגרום למוות ולתפקוד לקוי לחלק הקצה של התמיכה המיקרו-נקבובית לאורך זמן22. Barofuse היא מערכת זילוח ללא משאבה שבה רצועות RPE הגדלות על תמיכות מיקרו-נקבוביות יכולות להיות נטענות למערכת הזילוח, מה שמאפשר ניטור OCR בזמן אמת23. בדומה להתקנה ששונתה עבור סוסון הים על ידי קלטון, וולרת' ועמיתיו, המגבלות העיקריות של הערכת RPE עם Barofuse הן הצורך לחתוך את התמיכות המיקרו-נקבוביות והאופי קצר הטווח ונקודת הקצה של הבדיקה. האוקסיגרף מיועד גם לשינויים קינטיים מהירים ב-OCR בתגובה למניפולציות מטבוליות24. הוא לא שימש לתרבויות RPE והוא יסבול מאותן מגבלות להערכת תרבויות RPE מקוטבות ומובחנות מאוד כמו סוסון הים והברופוס.
בניגוד לשיטות אחרות אלה, מערכת OCR המתוארת כאן מאפשרת ניטור של OCR בעוד RPE מתורבת בלוחות/מצעים סטנדרטיים של תרבית תאים בתנאים סטנדרטיים עם מדיית RPE סטנדרטית באינקובטור CO2 סטנדרטי של תרבית תאים, מה שמספק חיטוט קל ונוח של תרביות RPE ממויינות ומקוטבות מאוד. בנוסף להפקת נתונים על שינויים בזמן אמת של זיהוי תווים אופטי (OCR) על ידי המערכת, ניתן להשתמש באותם תאים לבדיקות נוספות בסוף תקופת הניטור של זיהוי תווים אופטי (OCR). זה מאפשר ניסויים גמישים מאוד שבהם ההשפעה של התערבות על OCR נבדקת שוב ושוב במשך תקופה של שבועות (למשל - השראת RPE EMT באיור 5) או שבהם ניתן לבחון את ההתאוששות ארוכת הטווח מהתערבות (למשל - התאוששות מפירוק צימוד מיטוכונדריאלי באיור 3) או שבהם ניתן לעקוב אחר שינויים מטבוליים מדורגים בתגובה להתערבות ראשונית (למשל - השפעות של סרום על OCR ברגע שחומרי המזון במדיה מתרוקנים באיור 2). מערכת OCR במאמר זה נוחה במיוחד למדידת OCR בתרביות RPE מקוטבות ומובחנות מאוד. תרביות כאלה הן פוסט-מיטוטיות מבחינה תפקודית, עם אריזה הדוקה ופיגמנטציה כבדה. משמעות הדבר היא שכל באר מכילה מספרי תאים כמעט זהים9, ובכך מייתרת את הצורך לנרמל OCR למספר תאים עבור רוב הניסויים. גם כאשר נדרש נורמליזציה למספר התא, פיגמנטציית RPE כבדה וגבולות תאים מתוחמים היטב מאפשרים לנורמליזציה להתרחש עם ספירת תאים פשוטה לא פולשנית המבוססת על הדמיה בשדה בהיר. עבור ניסויים הכוללים התפשטות RPE ו-RPE בלתי ממוינים, כמו ניסויי EMT באיור 5, נרמול ה-OCR לכל באר למספר התא הופך להיות הכרחי כדי לדעת מהו OCR "לכל תא".
מחוץ לתחום הרשתית, המערכת שימשה לחקר נשימה תאית ופעילות מטבולית בסוגי תאים שונים, כולל תאי איון הלבלב25, שרירי השלד26, סרטן השחלות27, קרדיומיוציטים28, ואפילו אורגניזמים שלמים, כגון C. elegans29. ניטור בזמן אמת וארוך טווח של OCR באמצעות מערכת OCR המתוארת כאן חשף תובנות מרכזיות לגבי שינויים ביו-אנרגטיים ותפקוד לקוי של המיטוכונדריה במודלים מגוונים אלה של מחלות.
מערכת Resipher אכן נושאת מגבלות. השיטה לקביעת OCR שונה באופן מהותי ממנתח סוסון ים, BaroFuse או אוקסיגרף. זה דורש הקמת שיפוע O2 כדי לחשב OCR, וקביעת השיפוע עשויה להימשך שעות. לפיכך, ניסויים קינטיים מהירים, אפשריים במערכות אחרות, אינם אפשריים עם מערכת זו. יתר על כן, בניגוד למערכות האחרות, לרסיפר אין יציאות הזרקה להעברה מהירה של מולקולות קטנות או איסוף מטבוליטים. במקום זאת, יש להסיר את מכסה החישה במכסה המנוע של תרבית תאים, עם זינוק בתרופות או החלפת מדיה, יחד עם איסוף ידני של מטבוליטים שיש לנתח.
כדי ליצור ניסוי ולפתור בעיות באמצעות מערכת זיהוי תווים אופטי (OCR) המתוארת במאמר זה, מומלץ לבצע את הפעולות הבאות. ראשית, צמצמו את האידוי. נזכיר כי שיפוע O2 בעמודת המדיה מעל שכבת RPE תלוי מאוד בגובה עמודה9, והמערכת מחשבת זיהוי תווים אופטי (OCR) בהתבסס על שיפוע O2 . לכן, אם יש הנמכה ניכרת של עמודת המדיה במהלך הניסוי עקב אידוי, שיפוע O2 ישתנה, וישפיע על קריאות OCR. שמירה על מגש המים לאינקובטור מלא היא קריטית, אך מוצע גם להציב מים בכל הבארות שאינן בשימוש של צלחת 96 הקידוחים. יתר על כן, הבארות בקצה הצלחת הן בעלות שיעורי אידוי גבוהים יותר, כך שבארות אלה נותרות ריקות מתאים בניסויים טיפוסיים שהוצגו לעיל. חיישן הלחות במערכת זיהוי התווים האופטי (OCR) יכול לסייע בניטור לחות האינקובטור. באיור 8A, הירידה בלחות במהלך הניסוי מצביעה על כך שמגש המים של האינקובטור ריק. ככל שהאידוי מואץ בבאר, קריאות ריכוז O2 עבור הבאר יטפסו גבוה יותר ובסופו של דבר "שטוחות" בריכוז O2 באטמוספירה (~200 מיקרומטר) (איור 8A).
שנית, ודא שה"סנדוויץ'" של מערכת זיהוי התווים האופטי (OCR) מורכב כראוי. כתמי המגע המתכתיים בתחתית ההתקן ובחלק העליון של מכסה החישה צריכים להיות נקיים, ללא לכלוך שימנע מגע מלא. ההתקן ומכסה החישה צריכים להיות מחוברים במלואם וליישר באופן שווה על לוח 96 הבארות ללא כל הטיה. כבל ה- USB המחבר את ההתקן לרכזת לא אמור להיות במתח, מה שעלול לגרום למומנט של "הכריך" ולהגבלת התנועה התקינה של ההתקן.
שלישית, ודא שחיישני ההתקן ומכסה החישה מכויילים. איור 2B מפרט כיצד לבדוק במהירות תפקוד תקין של החיישן בתחילת כל ניסוי. רביעית, ודא שבאר מסוימת אינה מדגימה OCR חריג לפני המניפולציה הניסיונית. לאחר שווידאנו שהחיישנים פועלים, קביעת ערכי זיהוי תווים אופטי (OCR) בסיסיים עבור כל הבארות עם תאים יכולה לעזור לקבוע אם בארות מסוימות מכילות תאים לא בריאים. איור 8B מראה כמה בארות שעברו הערכה בסיסית של זיהוי תווים אופטי (OCR), שבה הבאר בצבע כחול מדגימה בבירור OCR נמוך יותר (ולכן ריכוז גבוה של O2 ). באר זו היא חריגה ויש להוציא אותה ממניפולציה ניסיונית.
חמישית, צמצם מניפולציות סביבתיות במהלך קריאות OCR פעילות. שיפוע O2 רגיש מאוד לשינויים בטמפרטורה, לחות, רמות CO2 באינקובטור ולחץ אטמוספרי. פתיחת דלת האינקובטור משפיעה באופן משמעותי על גורמים אלה, וגורמת לשיבושים זמניים בקריאות OCR עד ששיפוע O2 של עמודת המדיה יחזור לשיווי משקל (איור 8C). ניתן לנטר פרמטרים המשפיעים על זיהוי תווים אופטי (OCR) בממשק המקוון של המערכת תחת הכרטיסייה "סביבה" (איור 8A).
שישית, לקבוע את נפח המדיה האופטימלי עבור הניסוי. בעוד נפח מדיה לא מספיק יכול ליצור ממצאים מאידוי מוגזם (ראה את אמצעי פתרון הבעיות הראשון לעיל) או מיצוי מוקדם מדי של חומרים מזינים במדיה, נפח מדיה מוגזם מגביל את זמינות O2 למונושכבה RPE, ומפעיל היפוקסיה9. איור 7 הוא צילום מסך של המחשבון המקוון הזמין לקביעת ההשפעה של נפח המדיה על ריכוז O2 בשכבה החד-שכבתית של RPE. זיהוי תווים אופטי (OCR) המרבי האפשרי עבור אמצעי אחסון נתון מוצג באיור 9A. אם קצב זיהוי תווים אופטי (OCR) עבור ניסוי נתון באמצעות נפח נתון מתקרב לקצב המוצג באיור 9A, אזי ריכוז O2 בשכבה החד-שכבתית RPE מתקרב לאנקסיה (0%) ויש צורך בנפח מדיה נמוך יותר. באופן כללי, ניסויים הכוללים תהליכים עתירי מיטוכונדריה בתרבית RPE צריכים להיות בעלי נפח מדיה שאינו עולה על 75 מיקרוליטר לכל 96 באר.
שביעית, לבצע נורמליזציה מתאימה כדי לבודד את ההשפעות של התערבות ניסיונית על OCR. מכיוון שלבארות שונות יכול להיות OCR בסיסי שונה, חיוני לקבל קריאות OCR בסיסיות עבור כל באר לפני התערבות ניסיונית. החסרו את ה-OCR הבסיסי מה-OCR לאחר ההתערבות הניסיונית כדי לקבל את "Delta OCR", שמדגים את ההשפעה של ההתערבות הניסויית על OCR. השיטה לקבלת "Delta OCR" מודגמת באיור 3 ובאיור 9B. אם מישהו מעוניין בהשפעות של התערבות ניסיונית אחת על היכולת של התערבות ניסיונית אחרת לגרום ל-OCR, יש צורך בצעד נורמליזציה נוסף, "OCR דלתא-דלתא". דוגמה כזו מודגמת באיור 9B, שבו היכולת של פלמיטט (התערבות ניסיונית אחת) לגרום לעלייה ב-OCR (באמצעות השראת חמצון β) תלויה בסוג המדיה של תרבית RPE (התערבות ניסיונית שנייה).
לבסוף, למזער את הסיכון של זיהום. המערכת מנטרת OCR על ידי החדרת חיישן חמצן למדיה שמעל התאים. זה מגביר את הסיכון לזיהום. ירידות בלתי צפויות ב-OCR במהלך הניסוי או OCR נמוך באופן בלתי צפוי בתחילת הניסוי יכולות להיות סימנים לזיהום. צלחות צריכות להיות מנוטרות באופן פעיל עבור זיהום תחת מיקרוסקופ תרבית תאים. זיהום צולב בין לוחות 96 בארות יכול להתרחש אם נעשה שימוש חוזר במכסה החישה. כדי למזער זיהום צולב כזה, יש לטבול את כל המכסה באתנול 70% למשך 20 דקות לצורך טיהור לאחר ביצוע ניסוי, לפני שימוש חוזר במכסה החישה בניסוי חדש (ראה סעיף פרוטוקול 1.2.15).
לסיכום, מוצג פרוטוקול לניטור בזמן אמת וארוך טווח של חילוף החומרים במיטוכונדריה בתרביות RPE באיכות גבוהה באמצעות הערכה של OCR באמצעות מערכת חדשנית בשם Resipher. ניתן להשתמש בו ליישומים רבים על תרביות RPE מקוטבות ומובחנות מאוד, בפרט, לחקור תכונות מטבוליות פיזיולוגיות של RPE מבודד, כמו גם מטבוליזם RPE שונה במודלים חוץ גופיים של מחלות רשתית, כולל AMD ו- PVR.
Disclosures
ריצ'רד א. בריאן וקין לו הם עובדים של Lucid Scientific, המייצרת את מערכת Resifer.
Acknowledgements
אנו מודים לד"ר דניאל הס וד"ר ג'ים הארלי על הרעיון לבחון את מסיסות O2 במדיה חדשה לעומת מותנית כבקרה. אנו מודים לד"ר מגאלי סן-גניז על תרומת העריכה לכתב היד. אנו מודים לסקוט סאלאי (Scott Szalay) מ-Instrument and Electronic Services Core, Kellogg Eye Center, על התאמת תא ההיפוקסיה באמצעות כבל ה-USB Resifer. לא נעשה שימוש בכספים פדרליים למחקר HFT. ליבת השירותים האלקטרוניים נתמכת על ידי EY007003 P30 מהמכון הלאומי לעיניים. עבודה זו נתמכת על ידי מענק מחלקתי בלתי מוגבל ממחקר למניעת עיוורון (RPB). J.M.L.M. נתמכת על ידי יוזמת ג'יימס גרוספלד לניוון מקולרי הקשור לגיל יבש, קרן E. Matilda Ziegler לעיוורים, מענק בנק עיניים Eversight, מענק K08EY033420 מהמכון הלאומי לעיניים, ותמיכה של די ודיקסון בראון, כמו גם קרן דיוויד וליסה דרווס לגילוי תקווה. D.Y.S. נתמך על ידי תוכנית המדע של UNSW. ל.א.ק. נתמכת על ידי פרס איראטי, מונטה ג'יי וואלאס, מישל פלנטבין, מענק R01EY027739 מהמכון הלאומי לעיניים, ופעילות רכש המחקר הרפואי של צבא ההגנה VR220059.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | #25-200-056 | |
| 3,3',5-triiodo-L-thyronine sodium salt | Sigma | T5516 | |
| 32-channel Resipher lid | Lucid Scientific | NS32-101A for Falcon | |
| Antimycin A from streptomyces sp. | Sigma | A8674-25MG | Inhibitor of Complex III of the electron transport chain |
| BAM15 | Sigma | SML1760-5MG | Uncoupling agent to increase mitochondrial respiration |
| DMSO, cell culture grade | Sigma-aldrich | D4540-100ML | Vehicle for reconstituting mitochondrial drugs |
| Extracellular matrix coating substrates: Synthemax II-SC | Corning | #3535 | Extracellular matrix for hfRPE |
| Extracellular matrix coating substrates: Vitronectin | Gibco | A14700 | Extracellular matrix for iPSC-RPE |
| FCCP | Sigma | C2920-10MG | Uncoupling agent to increase mitochondrial respiration |
| Fetal Bovine Serum (Bio-Techne S11550H) | Bio-Techne | S11550H | |
| Hydrocortisone-Cyclodextrin | Sigma | H0396 | |
| Hypoxia chamber | Embrient Inc. | MIC-101 | |
| N1 Media Supplement | Sigma | N6530 | |
| Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| O2 sensor | Sensit technology or Forensics Detectors | P100 or FD-90A-O2 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| Recombinant human TGFβ2 | Peprotech | 100-35B | Transforming growth factor beta-2 to induce epithelial-mesenchymal transition |
| Rotenone | Sigma | R8875-1G | Inhibitor of Complex I of the electron transport chain |
| System-compatible plate | Corning | #353072 | |
| Taurine | Sigma | T8691 | |
| αMEM (Alpha Modification of Eagle's Media) | Corning | 15-012-CV |
References
- Shu, D. Y., Butcher, E., Saint-Geniez, M. EMT and EndMT: emerging roles in age-related macular degeneration. Int J Mol Sci. 21 (12), 4271(2020).
- Shu, D. Y., Lovicu, F. J. Myofibroblast transdifferentiation: the dark force in ocular wound healing and fibrosis. Prog Retin Eye Res. 60, 44-65 (2017).
- Hurley, J. B. Retina metabolism and metabolism in the pigmented epithelium: a busy intersection. Annu Rev Vis Sci. 7, 665-692 (2021).
- Wu, W., et al. Deficient RPE mitochondria energetics leads to subretinal fibrosis in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (8), 2420(2023).
- Hansman, D. S., et al. Metabolic reprogramming of the retinal pigment epithelium by cytokines associated with age-related macular degeneration. Biosci Rep. 44 (4), BSR20231904BSR20231904(2024).
- Li, K. X., et al. Modulation of pyruvate kinase M2 activity as a therapy in a primary RPE cell culture model of proliferative vitreoretinopathy. Invest Ophthalmol Vis Sci. 62 (8), 2213(2021).
- Gupta, S., et al. Progress in stem cells-based replacement therapy for retinal pigment epithelium: in vitro differentiation to in vivo delivery. Stem Cells Transl Med. 12 (8), 536-552 (2023).
- Wilson, D. F., et al. Oxygen distribution and vascular injury in the mouse eye measured by phosphorescence-lifetime imaging. Appl Opt. 44 (25), 5239-5248 (2005).
- Hass, D. T., et al. Medium depth influences O2 availability and metabolism in human RPE cultures. Invest Ophthalmol Vis Sci. 64 (14), 4(2023).
- Shu, D. Y., Butcher, E. R., Saint-Geniez, M. Suppression of PGC-1α drives metabolic dysfunction in TGFβ2-Induced EMT of retinal pigment epithelial cells. Int J Mol Sci. 22 (9), 4701(2021).
- Shu, D. Y., et al. Dimethyl fumarate blocks tumor necrosis factor-alpha-driven inflammation and metabolic rewiring in the retinal pigment epithelium. Front Mol Neurosci. 15, 896786(2022).
- Ng, P. Q., Saint-Geniez, M., Kim, L. A., Shu, D. Y. Divergent metabolomic signatures of TGFβ2 and TNFα in the induction of retinal epithelial-mesenchymal transition. Metabolites. 13 (2), 213(2023).
- Kar, D., et al. Choriocapillaris impairment is associated with delayed rod-mediated dark adaptation in age-related macular degeneration. Invest Ophthalmol Vis Sci. 64 (12), 41(2023).
- Curcio, C. A., Kar, D., Owsley, C., Sloan, K. R., Ach, T. Age-related macular degeneration, a mathematically tractable disease. Invest Ophthalmol Vis Sci. 65 (3), 4(2024).
- Maminishkis, A., et al. Confluent monolayers of cultured human fetal retinal pigment epithelium exhibit morphology and physiology of native tissue. Invest Ophthalmol Vis Sci. 47 (8), 3612-3624 (2006).
- Maminishkis, A., Miller, S. S. Experimental models for study of retinal pigment epithelial physiology and pathophysiology. J Vis Exp: JoVE. (45), e2032(2010).
- Zhang, Q., et al. A platform for assessing outer segment fate in primary human fetal RPE cultures. Exp Eye Res. 178, 212-222 (2019).
- Sharma, R., Bose, D., Montford, J., Ortolan, D., Bharti, K. Triphasic developmentally guided protocol to generate retinal pigment epithelium from induced pluripotent stem cells. STAR Protoc. 3 (3), 101582(2022).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. FASEB J. 34 (10), 13106-13124 (2020).
- Rosenfeld, P. J., Trivizki, O., Gregori, G., Wang, R. K. An update on the hemodynamic model of age-related macular degeneration. Am J Ophthalmol. 235, 291-299 (2022).
- Fitch, T. C., et al. Real-time analysis of bioenergetics in primary human retinal pigment epithelial cells using high-resolution respirometry. J Vis Exp: JoVE. (192), (2023).
- Calton, M. A., Beaulieu, M. O., Benchorin, G., Vollrath, D. Method for measuring extracellular flux from intact polarized epithelial monolayers. Mol Vis. 24, 425-433 (2018).
- Grumbine, M. K., et al. Maintaining and assessing various tissue and cell types of the eye using a novel pumpless fluidics system. J Vis Exp: JoVE. (197), (2023).
- Mu, C., Shearer, J. Protocol for measuring respiratory function of mitochondria in frozen colon tissue from rats. STAR Protoc. 4 (4), 102560(2023).
- Rocha, D. S., Manucci, A. C., Bruni-Cardoso, A., Kowaltowski, A. J., Vilas-Boas, E. A. A practical and robust method to evaluate metabolic fluxes in primary pancreatic islets. Mol Metab. 83, 101922(2024).
- Kanaan, M. N., et al. Cystine/glutamate antiporter xCT controls skeletal muscle glutathione redox, bioenergetics and differentiation. Redox Biol. 73, 103213(2024).
- da Veiga Moreira, J., et al. Methylene blue metabolic therapy restrains in vivo ovarian tumor growth. Cancers. 16 (2), 355(2024).
- McNally, L. A., Altamimi, T. R., Fulghum, K., Hill, B. G. Considerations for using isolated cell systems to understand cardiac metabolism and biology. J Mol Cell Cardiol. 153, 26-41 (2021).
- Misare, K. R., et al. The consequences of tetraploidy on Caenorhabditis elegans physiology and sensitivity to chemotherapeutics. Sci Rep. 13 (1), 18125(2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.