Method Article
Picrosirius Red Staining for Semiquantitative Histopathologic Evaluation of Collagen Deposition in Murine Models of Chronic Lung Allograft rejection(만성 폐 동종이식 거부 반응의 쥐 모델에서 콜라겐 침착의 반정량적 조직병리학적 평가를 위한 Picrosirius Red Staining)
* 이 저자들은 동등하게 기여했습니다
요약
Picrosirius Red staining은 공간적으로 분해된 방식으로 쥐 폐 섬유화 리모델링에서 콜라겐 침착을 객관적으로 평가하기 위한 반정량적 방법입니다. 총 콜라겐 침착을 평가하는 것 외에도 Picrosirius Red 염색을 통해 두께가 다른 콜라겐 섬유를 구별할 수 있습니다.
초록
섬유증은 폐 이식 후 만성 거부 반응의 병태생리학적 특징이며 장기 수혜자 생존에 가장 큰 장애물입니다. 만성 거부 반응 연구를 위해 여러 쥐 폐 이식 모델을 사용할 수 있습니다. 그러나 이식편의 섬유화 변화에 대해 이질적인 결과를 보이며, 섬유증의 조직학적 정도는 대부분 질적으로 보고됩니다. 따라서 통계적 분석을 허용하는 공간적으로 해결된 접근 방식은 이러한 모델에서 섬유증을 평가하는 데 도움이 될 수 있습니다. 이 연구는 쥐 폐 동종이식편에서 콜라겐 조직의 반정량적 평가를 위해 Picrosirius Red 염색을 제시하고 이를 표준 Hematoxylin 및 Eosin, Masson's Trichrome 및 Herovici's stains와 비교합니다. 염색은 경미한 및 주요 조직적합성 복합체(MHC) 불일치를 기반으로 두 개의 서로 다른 쥐 이식 모델의 절편에 대해 수행되었습니다. 이 방법은 전체 폐 절편에서 콜라겐 조직의 반정량 분석을 위해 확립되었습니다. 따라서 섬유성 폐 질환의 쥐 실험 모델을 위한 도구 역할을 할 수 있습니다.
서문
폐 이식은 말기 폐 질환을 앓고 있는 환자를 위한 확실한 치료 옵션입니다. 그러나 만성적인 거부 반응으로 인해 장기 생존이 저해되어 수술 후 5년 이내에 접종자의 50%가 영향을 받습니다1. 소기도와 폐 실질의 섬유성 리모델링은 만성 폐 동종이식 거부 반응에서 폐 기능의 점진적인 상실의 기저에 있는 조직학적 특징이다2. 실험적으로, 만성 폐 동종이식 거부 반응은 MHC 불일치 마우스 균주 간의 쥐 정소성 폐 이식으로 모델링할 수 있습니다. 만성 거부 반응3의 표현형을 달성하기 위해 다양한 균주 조합이 제안되었습니다. 그 중, 경미한 MHC 불일치 C57BL/10 공여자와 C57BL/6 수혜자의 이식 조합이 자주 사용된다4. 또는 매일 면역억제 치료를 받는 C57BL/6 수혜자에게 BALB/c 기증자 폐를 이식할 수 있다5. 이러한 모델은 조직학적으로 다른 정도의 섬유화 변화를 초래합니다6. 이러한 변화는 종종 표준 Hematoxylin 및 Eosin, Masson의 Trichrome 염색을 사용하여 정성적으로 보고됩니다.
Hematoxylin 및 Eosin을 사용한 표준 조직학적 염색을 통해 핵을 파란색으로 염색하고 세포질과 콜라겐 섬유는 빨간색으로 나타낼 때 표본을 전체적으로 볼 수 있습니다. Masson의 트리크롬 염색을 사용하면 핵은 검은색으로 염색되고 콜라겐 섬유는 녹색에서 파란색으로 염색되며 세포질, 피브린 및 근육을 포함한 배경은 빨간색입니다. Masson의 트리크롬 염색은 과소평가된 값으로 이어질 수 있기 때문에 Picrosirius Red 염색을 사용하는 것이 유익한 것으로 간주됩니다7. Picrosirius Red는 긴 양이온 콜라겐 섬유와 결합하고 대비가 풍부한 적색 염색을 제공하는 선형 음이온 성 염료입니다. 또한, Picrosirius Red 염색은 교차 편광에서 콜라겐 섬유의 자연스러운 복굴절을 향상시킵니다8. 이런 식으로 콜라겐 섬유 두께와 패킹을 평가할 수 있습니다. 편광 필터를 사용하면 배경이 어두워지고 침전된 콜라겐의 두께를 구별할 수 있습니다. 두꺼운 콜라겐 섬유는 빨간색으로 보이지만 얇은 콜라겐 섬유는 분극 아래에서 녹색으로 나타납니다. 복굴절과 콜라겐 아형 사이의 직접적인 연관성은 문헌에 자주 설명되어 있으며, 콜라겐 I에는 적색 복굴절이 할당되고 콜라겐 III에는 녹색 복굴절이 할당되었습니다9.
이 프로토콜은 쥐 폐 동종이식편에서 섬유증을 평가하기 위해 Picrosirius Red 염색을 사용하는 방법을 설명합니다. 기존의 조직학적 염색 외에도 만성 거부 반응의 쥐 모델에서 섬유화 변화를 반정량적으로 평가할 수 있고, 단 한 번의 염색으로 두꺼운 콜라겐 섬유와 얇은 콜라겐 섬유를 구별할 수 있는 수단을 제공하며, 비용 효율적이고, 수행하기 쉽습니다. 이 방법은 폐 실질의 섬유화 리모델링을 특징으로 하는 다른 쥐 실험 모델에도 동일하게 적용할 수 있습니다.
프로토콜
모든 동물 프로토콜은 인도적 동물 연구를 위한 3R의 윤리 원칙을 준수하며 지역 수의학 윤리 위원회(Veterinäramt Kanton Zürich, 스위스, 연구 번호 45/2014)의 승인을 받았습니다. 마찬가지로, 독자는 실험실 동물에 대한 절차를 수행하기 전에 관련 기관의 허가를 받아야 합니다.
1. 샘플 수집
- 개인의 필요와 윤리적 승인에 따라 동물 실험을 수행합니다. 한 명의 미세외과 의사가 추가적인 허혈 시간 연장 없이 모든 수술을 수행합니다.
참고: 대표적인 결과를 재현하려면 Charles River Laboratories에서 27-30g 무게의 특정 병원체가 없는 성인 수컷 C57BL/6J, C57BL/10J 및 BALB/c 마우스를 구하십시오. 동종 이식편의 경우, C57BL/6J 동물을 기증자와 수혜자로 사용합니다. 경미한 불일치 모델에서는 C57BL/10J 기증자 폐를 C57BL/6J 수혜자에게 이식합니다. 주요 불일치 모델에서는 BALB/c 기증자 폐를 C57BL/6J 투여자에게 이식하고 수술 후 사이클로스포린(10mg/kg/일)과 메틸프레드니솔론(1.6mg/kg/일)을 매일 피하 주사한다5. 관류를 위해 식염수를 사용하고 8주(56일) 후에 폐를 회수합니다. - 안락사의 경우 동물에게 20G 카테터를 삽관하고 2%-3% 이소플루란이 보충된 O2 로 인공호흡을 합니다. 발 꼬집기에 대한 반응이 없는 것으로 충분한 마취 깊이를 확인하십시오.
- 수술용 가위로 복벽을 절개하고 흉골 길이를 잘라 심장을 노출시켜 정중 복강흉골 절개술을 시행합니다. 하대정맥(inferior vena cava)과 좌심방 부속기(left atrial appendage)를 해부학적 위치로 식별합니다.
- 수술용 가위로 하대정맥과 좌심방 부속기를 빠르게 연속적으로 절단하고 주사기로 폐동맥 뿌리를 통해 0.9% NaCl 3-5mL를 관류하여 폐순환에서 모든 혈액을 제거합니다.
참고: 안락사는 각각의 윤리적 승인에 따라 수행되어야 합니다. 다른 방법도 동일하게 적용할 수 있습니다. 폐 순환에서 혈액을 철저히 제거하는 것이 좋으며, 이는 순환 정지 후 관류에 의해 수행될 수도 있습니다. - 가위를 사용하여 관류된 폐를 제거합니다.
- 보존을 위해 샘플을 4% 포르말린으로 배양하십시오. 포르말린 용액을 기관지와 폐 혈관 조직에 직접 주입합니다. 샘플을 포르말린에 담그고 최소 6시간 동안 배양합니다.
참고: 포르말린으로 폐를 팽창시키는 경우, 유사한 결과를 얻기 위해 표준화된 절차를 적용해야 합니다. 이러한 절차에 대한 예시 프로토콜은 다른 곳에 발표되어 있습니다10,11. - 실험적 필요에 따라 장기를 다듬습니다. 횡단으로 폐를 반으로 잘라 한 단면에 있는 기관지 나무의 모든 부분을 포착합니다.
- 70% 에탄올, 70% 에탄올, 80% 에탄올, 96% 에탄올, 100% 에탄올(각 1시간), 100% 에탄올, 100% 에탄올, 100% 에탄올, 자일롤(각 2시간), 자일롤(1시간) 및 파라핀 3x와 같이 알코올 시퀀스의 탈수를 위해 샘플을 자동 조직 처리기로 옮깁니다.
- 파라핀을 녹이고 Polyoxymethylen 임베딩 카세트에 올바른 방향으로 샘플을 삽입합니다. 절단면이 아래를 향하도록 샘플을 삽입하도록 주의하십시오. 회전식 마이크로톰을 사용하여 5μm 절편을 연속적으로 절단합니다. 추가 처리 전에 슬라이드를 37°C에서 24시간 동안 건조시키십시오.
2. 파라핀 활주의 Deparaffinization 그리고 수화는
- 샘플을 100% 자일롤에 2회 각각 5분 동안 배양하여 파라핀을 제거합니다.
주의 : 자일롤은 가연성이며 건강에 해롭습니다. 흄 후드 아래에서만 사용하십시오. - 샘플을 100% 에탄올, 100% 에탄올, 95% 에탄올, 70% 에탄올 및 50% 에탄올로 각각 2분 동안 수화합니다. 그런 다음 증류수로 2분 동안 씻습니다.
3. Picrosirius Red로 염색하기
- 염색은 Meyer의 hemalum 용액에서 8분 동안 미끄러집니다. 흐르는 수돗물에 10분 동안 슬라이드를 세척합니다.
- Picrosirius Red 용액에서 슬라이드를 1시간 동안 배양합니다. Picrosirius Red 용액의 경우 미리 혼합된 염색 용액을 사용하거나 포화 피크르산에 희석된 Direct Red 80 또는 Sirius Red F 3B(CI 35780) 0.1%를 사용합니다.
주의: 피크르산은 가연성이며 폭발성이 높으므로 조심스럽게 다루어야 합니다.
참고: 재료 표에 나열된 바와 같이 Picrosirius Red 염색 키트에 대한 다양한 공급업체가 있습니다. 가격과 염색 방법의 차이를 인식하고 항상 공급업체의 지침을 준수하십시오. Sirius Red F 3B(CI 35780)에 대한 특정 색상 지수가 있는 염색 키트만 사용하는 것이 좋습니다. - 슬라이드를 5x-10x를 아세트산 용액(0.5%)에 담급니다. 슬라이드를 부드럽게 흔들어 용액을 물리적으로 제거합니다.
- 슬라이드를 95% 에탄올, 100% 에탄올, 100% 에탄올, 100% 자일롤로 각각 5분 동안 탈수합니다.
- 각 샘플에 장착 매체 한 방울을 추가하여 삽입하고 커버슬립으로 덮습니다. 흄 후드 아래에서 슬라이드를 말리십시오.
4. 디지털화 및 이미지 처리
- 사진이 선명하고 선명해질 때까지 적절한 이미징 소프트웨어를 사용하여 광학 현미경으로 샘플의 초점을 맞춥니다. 편광 필터를 추가하고 배경이 완전히 어둡거나 검게 될 때까지 편광 정도를 조정합니다. 배경이 가능한 한 어두우면 올바른 편광이 달성됩니다.
참고: 편광 필터 없이 기존의 투과광을 사용하여 Picrosirius Red 염색을 시각화하는 것도 가능합니다. 이를 위해 시리우스 레드와 패스트 그린을 사용하는 것이 좋은데, 이는 시리우스 레드를 단독으로 사용하는 것보다 더 민감한 것으로 나타났기 때문이다12,13. 그러나 두꺼운 콜라겐 섬유와 얇은 콜라겐 섬유를 구별하기 위해 편광 현미경이 필요합니다. - 20배 배율로 모든 샘플을 완전히 스캔하고 .tiff로 내보냅니다. 피지 소프트웨어로 전송14. 슬라이드를 미리 적절하게 청소하고 노출 시간 및 광원 강도에 대한 표준화된 설정을 사용하십시오.
- 샘플을 수동으로 둘러싸고 소프트웨어에서 Edit > Clear Outside를 사용하여 잘라냅니다. Analyze > Measure(분석 측정)를 클릭하여 전체 표면적을 측정합니다.
참고: 측정할 구획을 선택하는 것은 신뢰할 수 있고 비교 가능한 결과를 만드는 데 중요한 단계입니다. 전체 샘플을 디지털화하고 선택함으로써 양호한 단면을 표시하고 이질적인 조직을 전체적으로 고려합니다. 그러나 흉막 또는 개별 기관지와 같은 샘플 내의 특정 영역에 국한하는 것도 가능합니다. 항상 표준화된 방식으로 비교할 구획을 선택해야 합니다. 샘플이 환기에서 큰 변동성을 보이는 경우, 분석된 격실(15)에서 공역 영역을 제외하는 것이 좋습니다. - Image > Adjust >Color Threshold를 클릭하여 색상 임계값을 사용하여 샘플당 총 콜라겐 함량을 측정하고 Analyze > Analyze Particles를 클릭하여 설정을 조정합니다. 크기 = 1 - 무한대, 지우기, 요약을 설정합니다. 밝기 = 35 - 255. 색조 = 2 - 130
참고: 신뢰할 수 있는 결과를 얻으려면 색상 임계값을 적절하게 설정하는 것이 중요합니다. - 두껍고 얇은 콜라겐 섬유에 대해 색조를 빨간색
 의 두꺼운 콜라겐 섬유(Hue 2-30) 및 황록색
의 두꺼운 콜라겐 섬유(Hue 2-30) 및 황록색  의 얇은 콜라겐 섬유(Hue 31-130)로 조정하여 반복합니다. 결과는 스테인드 픽셀의 영역이됩니다.
의 얇은 콜라겐 섬유(Hue 31-130)로 조정하여 반복합니다. 결과는 스테인드 픽셀의 영역이됩니다. - Plugins > Macros > Record를 클릭하여 자동화된 처리를 위해 매크로를 구성하고 모든 샘플에 대해 반복합니다.
- 단면의 표면적에 맞게 표준화된 최종 값을 받으려면 모든 매개변수에 대한 염색된 픽셀의 면적을 각 샘플에 대해 각각 4.3 및 4.5단계에서 측정한 총 표면적으로 나눕니다.
결과
위에서 설명한 프로토콜은 쥐 폐 조직의 콜라겐 침착에 대한 객관적인 반정량적 평가를 가능하게 합니다. 섬유성 리모델링은 폐 이식 후 만성 거부 반응의 병태생리학적 특징입니다. 따라서 Picrosirius Red 염색은 좌측 쥐 정소성 폐 이식을 사용하여 만성 폐 동종이식 거부 반응 모델에 적용되었습니다. 경미한 면역억제 하에서 BALB/c 기증자에서 C57BL/6 수혜자에게 MHC 불일치가 심하게 이루어지는 폐 이식의 주요 폐 이식은 인간의 만성 폐 동종이식 기능 장애에 필적하는 섬유화 변화를 초래한다5. 대조적으로, C57BL/10 기증자에서 C57BL/6 수혜자로의 경미한 MHC 불일치 이식은 주로 림프구성 세기관지염6을 유발합니다. 그림 1 은 실험 설정을 자세히 보여줍니다.
그림 2는 두 모델의 이식된 좌측 폐와 C57BL/6J 동종이식편의 대표적인 이미지에 대한 개요를 제공합니다. Masson의 Trichrome16, Herovici의17 및 Picrosirius Red18 염색은 주요 MHC 불일치 모델(모델 1, 그림 2B, D)에서 광범위한 기관지 주위 및 혈관 주위 콜라겐 침착을 보여줍니다. 대조적으로, 경미한 불일치 모델(모델 2)은 주로 Hematoxylin 및 Eosin 염색(그림 2F)과 덜 강렬한 콜라겐 침착(그림 2G-J)에 의해 반영된 밀집된 림프구 침윤을 보여줍니다. Picrosirius Red staining에서 편광 필터를 추가하면 두 모델 모두에서 증착된 섬유의 주로 녹색 모양이 나타납니다(그림 2E, J). 동종이식편 대조군에서 콜라겐의 존재는 나이브 쥐 폐의 구조와 유사하게 직접적인 기관지 주위 및 혈관 주위 경계로 제한됩니다(그림 2K-O).
BALB/c 동물의 순진한 좌측 폐와 C57BL/6J 투여군의 우측 폐 모두 기관지 주위 및 혈관 주위 경계를 따라 얇은 콜라겐 내벽만 보입니다(그림 3).
Picrosirius Red로 염색된 전체 폐 절편의 디지털 이미지 분석은 경미한 불일치 모델(p=0.0038), 우측 미접촉 폐 조직(p=0.0006) 또는 나이브 BALB/c 좌측 폐(p=0.0003, One-way ANOVA, Tukey의 다중 비교 테스트, 그림 4A). 편광된 빛 아래에서 빨간색으로 나타나는 두꺼운 콜라겐 섬유의 경우 그룹 간의 차이를 입증할 수 없었습니다(p=0.5512, One-way ANOVA, 그림 4B). 그러나 편광에서 녹색으로 보이는 얇은 콜라겐 섬유를 분석한 결과, 경미한 불일치 모델(p=0.0005), 우측 폐 조직(p<0.0001) 또는 좌측 BALB/c 폐(p<0.0001, One-way ANOVA, Tukey의 다중 비교 검정, 그림 4C)와 비교했을 때 주요 불일치 모델에서 존재가 증가한 것으로 나타났습니다.

그림 1: 실험 설계 개요. 정소성 좌측 폐 이식은 메이저(모델 1) 및 경미한 불일치 균주 조합(모델 2)을 사용하여 수행되었습니다. MHC 주요 불일치 이식편을 이식받은 환자는 피하 주사로 10mg/kg 사이클로스포린과 1.6mg/kg 메틸프레드니솔론으로 매일 면역억제를 받았습니다. 모든 수용 동물은 수술 후 8주(56일)에 안락사되었습니다. 폐 조직은 포르말린 고정, 파라핀 포매 및 절편에 의해 처리되었습니다. 연속적인 절편은 Hematoxylin 및 Eosin(H&E), Masson's Trichrome(MTC), Herovici's 및 Picrosirius Red(PSR) 염색으로 염색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 이식된 폐에서 기관지 주위 혈관 영역의 대표적인 이미지. (A-E) 주요 MHC 불일치 모델 1은 Masson's Trichrome(MTC), Herovici's 및 Picrosirius Red staining(PSR)에 의해 입증된 바와 같이 기관지 주위 및 혈관 주위 섬유증을 초래합니다. 이는 편광 필터(PSR(pol))를 추가함으로써 반영됩니다. (F-J) 경미한 MHC 불일치 모델 2는 헤마톡실린 및 에오신 염색(H&E)에 의해 입증된 바와 같이 두드러진 기관기관지 난관 림프구 침윤을 나타냅니다. MTC 및 PSR 염색은 이 모델에서 콜라겐 침착의 제한된 범위만 보여줍니다. (K-O) 동종이식편 대조군에서 콜라겐 침착은 직접적인 기관지 주위 혈관 부위로 제한됩니다. 림프구 침투는 드뭅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
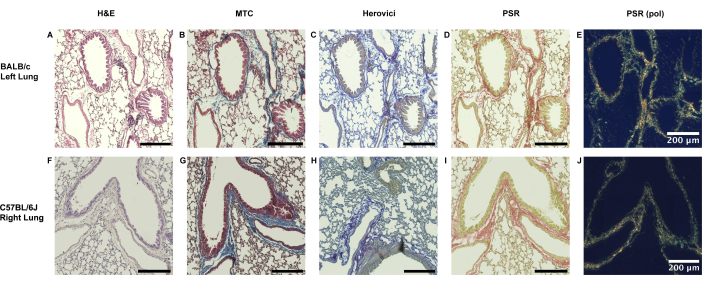
그림 3: 쥐 폐에서 기관지 주위 콜라겐 존재의 생리학적 범위. (A-E) 쥐 폐 조직의 콜라겐 존재는 큰 변형 의존성 없이 어느 정도 생리학적입니다. 주요 불일치 모델(모델 1)에 사용된 바와 같이, 좌측 미숙한 BALB/c 폐에서는 Masson's Trichrome(MTC), Herovici's and Picrosirius Red staining(PSR)에 의해 입증된 바와 같이 기관지 주위 혈관 영역에서 콜라겐의 얇은 내벽을 볼 수 있습니다. (F-J) 유사하게, 직접적인 기관지 주위 혈관 경계에 국한된 콜라겐 내벽이 수용자 C57BL/6J 기원의 반대쪽 오른쪽 폐에서 볼 수 있습니다. 약어: H&E = Hematoxylin 및 Eosin 염색; PSR(pol) = 편광 필터 추가 후 Picrosirius Red 염색. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 편광(polarized light) 하에서 Picrosirius Red 염색은 주요 MHC 불일치 쥐 이식 모델에서 얇은 콜라겐 섬유의 증착 증가를 보여줍니다. 횡단 폐 절편의 전체 영역에 대한 편광 Picrosirius Red 염색의 이미지 분석. (A) 총 콜라겐 침착 분석은 경미한 불일치 동종이식편, 반대쪽 수용자 폐 또는 나이브 BALB/c 좌측 폐 이식편에 비해 주요 불일치 모델에서 콜라겐 침착이 증가한 것으로 나타났습니다. (B) 두꺼운 콜라겐 섬유와 관련하여 그룹 간에 유의한 차이는 발견되지 않았습니다. (C) 얇은 콜라겐 섬유의 존재를 분석한 결과, 경미한 불일치 그룹, 반대쪽 수용자 폐 또는 나이브 BALB/c 좌측 폐 이식편에 비해 주요 불일치 동종이식편에서 침착이 증가한 것으로 나타났습니다. 그래프는 평균의 ±표준 오차, 일원 분산 분석, 유의성에 사용된 Tukey의 다중 비교, * p < 0.05, ** p < 0.005, *** p < 0.0005, **** p < 0.0001, ns 유의하지 않음을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
Hematoxylin 및 Eosin과 같은 표준 조직학적 방법, Masson의 Trichrome 염색은 공간적으로 분해된 방식으로 쥐 폐의 섬유화 변화를 감지하는 데 널리 사용됩니다16,19. 그러나 이러한 변화를 정량화하고 조직의 콜라겐 구성을 평가하기 위해 추가 방법이 필요한 경우가 많습니다.
Picrosirius Red 염색은 콜라겐을 확인하기 위해 1964년에 처음 설명되었습니다: 투과광 현미경 검사에서 콜라겐은 빨간색으로 나타나고 근육과 세포질은 노란색으로 나타납니다18. 편광 필터를 앞에 배치하고 복굴절을 활용함으로써 콜라겐 섬유 두께를 차별화할 수 있었습니다. 섬유소 색조와 콜라겐 섬유 두께 사이의 상관 관계는 그 이후로 반복적으로 입증되었으며 섬유화 리모델링에서 총 콜라겐 함량을 평가하고 콜라겐 아형을 추정하는 데 자주 사용됩니다 9,20,21,22,23,24,25. 그러나 보다 최근의 연구에서는 콜라겐 아형과 색조26,27의 직접적인 연관성에 의문을 제기합니다. 그러므로, 콜라겐 섬유의 두께에 대한 신중한 보고가 콜라겐 아형 구별을 직접 추론하는 것보다 선호되어야 합니다.
Picrosirius Red로 콜라겐을 염색하고 편광 현미경을 사용하면 콜라겐 분자를 포함하는 조직 구성 요소의 국소화를 얻을 수 있습니다28. Van Gieson 또는 Masson의 trichrome과 같은 다른 콜라겐 염색 방법과 비교하여, 동종이식 거부 반응에서 섬유증 중에 주로 발생하는 매우 얇은 콜라겐 섬유7를 시각화할 수 있습니다29. 또한 단 한 번의 염색으로 이러한 섬유 유형을 정량적으로 검출할 수 있습니다. 그러나 이 방법은 반정량적 평가만 허용하고 절대 진술은 허용하지 않습니다. 따라서 프로토콜을 정확하게 따라야 하며 가능할 때마다 모든 섹션을 동시에 염색해야 합니다. 현미경 및 이미지 처리 옵션에 대한 설정에도 동일하게 적용됩니다.
평가를 위한 관심 구획을 선택할 때는 개별적으로 표준화된 접근 방식을 사용하는 것이 중요합니다. 이 프로토콜은 전체 단면의 전체 샘플 선택을 설명합니다. 또한, linear polarization은 과소평가된 값으로 이어질 수 있으므로 circular polarizing filter를 사용하는 것이 좋습니다7.
여기에 제시된 프로토콜에 설명된 대로 무료로 사용할 수 있는 Fiji 소프트웨어 패키지를 사용하여 간단한 염색 분석을 수행할 수 있습니다. 그러나, 염색의 디지털 이미지 분석을 위한 보다 정교한 방법이 문헌에 기술되어 있으며, 개별 연구자의 필요에 따라 사용될 수 있다13,15. 최근에는 인공 지능 도구가 디지털 이미징 분석에 관심을 갖게 되었으며 마찬가지로 Picrosirius Red staining30을 평가하도록 훈련될 수 있습니다.
섬유성 조직 리모델링은 고형 장기 이식에서 만성 이식 실패의 조직병리학적 특징입니다. 따라서 Picrosirius Red 염색은 실험적 이식에서 유용한 판독값이 될 수 있습니다. 실제로, 이 방법은 심장 이식 수혜자의 조직 생검을 평가하기 위해 임상에서 사용되었다31. 폐 이식에서 Picrosirius Red 염색의 임상적 사용은 보고되지 않았으나, 얇은 콜라겐 III 침착의 조기 검출이 CLAD 진단을 위한 잠재적인 바이오마커로 논의되고 있습니다32. 이 질병의 전임상 쥐 모델에서는 상대적으로 적은 조직 소비로 콜라겐 침착에 대한 반정량적 평가를 가능하게 하기 때문에 유용한 도구가 될 수 있습니다.
여기에 제시된 대표적인 결과는 Picrosirius Red Staining의 디지털 이미지 분석이 경미한 불일치 균주 조합과 비교할 때 정소성 폐 이식 후 만성 거부 반응의 주요 불일치 모델에서 콜라겐 섬유의 향상된 침착을 보여줄 수 있음을 보여줍니다. 우리 그룹은 이전에 Masson의 Trichrome Staining16에 의존하여 보다 설명적인 방식으로 이 관찰을 보고했습니다. Picrosirius Red Staining은 편광 필터를 추가하여 폐 동종이식편에서 섬유화 변화에 대한 반정량적 분석 및 통계적 보고를 가능하게 합니다. 이 방법의 주요 이점은 기술적 단순성과 작은 조직 소모이며, 이는 쥐 이정소 폐 이식과 같은 기술적으로 복잡한 동물 모델에 따라 판독 방법을 선택할 때 고려해야 할 중요한 측면입니다.
연구자들은 염색이 역사적으로 콜라겐 아형 추정에 사용되어 왔지만, 최근 간행물에서는 이 방법이 콜라겐 유형 I과 III을 안정적으로 구별할 수 없다는 사실을 발견했다는 점을 알고 있어야 합니다27. 이 방법은 섬유 두께(26)를 반영하여 콜라겐 조직에 대한 정보를 제공할 수 있으며, 콜라겐 침착의 포괄적인 평가에 충분하지 않을 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
Birte Ohm은 프라이부르크 대학교 의과대학의 Berta-Ottenstein-Program for Clinician Scientists의 지원을 받고 있습니다. 슈테펜 아이젠하르트(Steffen U Eisenhardt)는 독일연구재단(DFG)의 하이젠베르크 교수로, 개인 보조금으로 이 연구를 지원했다. 또한 기술 지원에 대해 Sheena Kreuzaler에게 감사드립니다. 그림 1은 Biorender.com 의 도움으로 만들어졌습니다. 이미징은 프라이부르크 대학교 의과대학(프로젝트 번호 2023/A2-FOL, 2021/B3-FOL), DKTK 및 DFG(프로젝트 번호 450392965)의 일부 자금을 지원하는 Lighthouse Core Facility에서 수행되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid | Honeywell, Charlotte, USA | 33209 | |
| Axio Observer | Zeiss, Oberkochen, Germany | 4633000956 (serial number) | |
| Coverslip 1.5 | Roth, Karlsruhe, Germany | KCY5.1 | |
| Formaldehyde 37% | Fisher Scientific, Leicestershire, UK | F/1501/PB15 | |
| Meyer's hemalum solution | Merck, Darmstadt, Germany | 109249 | |
| Picrosirius Red Solution | Morphisto, Offenbach am Main, Germany | 13422 | alternatives that can be used: ab150681, abcam, Cambridge, UK; SRS250 ScyTek Laboratories, Logan City US |
| Polarizing filter | Zeiss, Oberkochen, Germany | 000000-1121-813 | |
| Rotary microtome, HistoCore AUTOCUT | Leica, Wetzlar, Germany | 149AUTO00C1, 14051956472 | |
| ROTI Histokitt mounting medium | Roth, Karlsruhe, Germany | 6638.1 | |
| ROTI Plast Paraffin | Roth, Karlsruhe, Germany | 6642.5 | |
| Rotilabo-embedding cassettes, POM | Roth, Karlsruhe, Germany | K113.1 | |
| Superfrost Plus Adhesion Microscope slide | epredia, Portsmouth, UK | J1800AMNZ | |
| Tissue Processor | Leica, Wetzlar, Germany | TP 1020 | |
| Software | |||
| Fiji software version 2.14.0/1.54f | Open Source | ||
| Imaging Software ZEN 3.4.91 | Zeiss, Oberkochen, Germany |
참고문헌
- Weigt, S., DerHovanessian, A., Wallace, W., Lynch, J., Belperio, J. Bronchiolitis Obliterans Syndrome: The Achilles' heel of lung transplantation. Semin Respir Crit Care Med. 34 (3), 336-351 (2013).
- Verleden, G. M., et al. Chronic lung allograft dysfunction: Definition, diagnostic criteria, and approaches to treatment-A consensus report from the Pulmonary Council of the ISHLT. J Heart Lung Transplant. 38 (5), 493-503 (2019).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), e93121(2017).
- Martinu, T., et al. Spectrum of chronic lung allograft pathology in a mouse minor-mismatched orthotopic lung transplant model. Am J Transplant. 19 (1), 247-258 (2019).
- de Vleeschauwer, S., et al. Chronic rejection pathology after orthotopic lung transplantation in mice: The development of a murine BOS model and its drawbacks. PLoS One. 7 (1), e29802(2012).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-An experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Whittaker, P., Kloner, R. A., Boughner, D. R., Pickering, J. G. Quantitative assessment of myocardial collagen with picrosirius red staining and circularly polarized light. Basic Res Cardiol. 89 (5), 397-410 (1994).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Polarization microscopic studies of connective tissue stained with picro-sirius red FBA. Beitr Pathol. 150 (2), 174-187 (1973).
- Junqueira, L. C. U., Cossermelli, W., Brentani, R. Differential staining of collagens type I, II and III by Sirius Red and polarization microscopy. Arch Histol Jpn. 41 (3), 267-274 (1978).
- Davenport, M. L., Sherrill, T. P., Blackwell, T. S., Edmonds, M. D. Perfusion and inflation of the mouse lung for tumor histology. J Vis Exp. (162), e60605(2020).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. (102), e52964(2015).
- Segnani, C., et al. Histochemical detection of collagen fibers by Sirius Red/Fast Green is more sensitive than van Gieson or Sirius Red alone in normal and inflamed rat colon. PLoS One. 10 (12), e0144630(2015).
- Courtoy, G. E., et al. Digital image analysis of Picrosirius Red staining: A robust method for multi-organ fibrosis quantification and characterization. Biomolecules. 10 (11), 1585(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Ségard, B. D., et al. Quantification of fibrosis extend and airspace availability in lung: A semi-automativ ImageJ/Fiji toolbox. PloS. 2 (2), e0298015(2024).
- Zhou, X., Moore, B. B. Lung section staining and microscopy. Bio Protoc. 7 (10), e2286(2017).
- Herovici, C. Picropolychrome: histological staining technic intended for the study of normal and pathological connective tissue. Rev Fr Etud Clin Biol. 8, 88-89 (1963).
- Sweat, F., Puchtler, H., Rosenthal, S. Sirius Red F3BA as a stain for connective tissue. Arch Pathol. 78, 69-72 (1964).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harb Protoc. 2014 (6), 655-658 (2014).
- Montes, G. S., Junqueira, L. C. The use of the Picrosirius-polarization method for the study of the biopathology of collagen. Mem Inst Oswaldo Cruz. 86, Suppl 3 1-11 (1991).
- Rittié, L. Method for Picrosirius Red-polarization detection of collagen fibers in tissue sections. Methods Mol Biol. 1627, 395-407 (2017).
- Diehm, Y. F., et al. Stem cell-enriched hybrid breast reconstruction reduces risk for capsular contracture in a hybrid breast model. Plast Reconstr Surg. 152 (3), 572-580 (2023).
- Rich, L., Whittaker, P. Collagen and Picrosirius Red staining: A polarized light assessment of fibrillar hue and spatial distribution. Braz J Morphol Sci. 22 (2), 97-104 (2005).
- Datar, U. V., et al. Clinicopathologic study of a series of giant cell fibroma using picrosirius red polarizing microscopy technique. Arch Iran Med. 17 (11), 746-749 (2014).
- Nishat, R., Kumar, H. Collagen fibers in oral submucous fibrosis - A polarizing microscopy study using two special stains. Indian J Pathol Microbiol. 62 (4), 537-543 (2019).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. J Histochem Cytochem. 62 (10), 751-758 (2014).
- López De Padilla, C. M. Picrosirius Red staining: Revisiting its application to the qualitative and quantitative assessment of collagen type I and type III in tendon. J Histochem Cytochem. 69 (10), 633-643 (2021).
- Junqueira, L. C. U., Bignolas, G., Brentani, R. R. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 11 (4), 447-455 (1979).
- Zheng, L., et al. Scar collagen deposition in the airways of allografts of lung transplant recipients. Am J Respir Crit Care Med. 155 (6), 2072-2077 (1997).
- Astbury, S., et al. Reliable computational quantification of liver fibrosis is compromised by inherent staining variation. J Pathol Clin Res. 7 (5), 471-481 (2021).
- Feingold, B., et al. Diffuse myocardial fibrosis among healthy pediatric heart transplant recipients: Correlation of histology, cardiovascular magnetic resonance, and clinical phenotype. Pediatr Transplant. 21 (5), 12986(2017).
- vander Ploeg, E. A., Melgert, B. N., Burgess, J. K., Gan, C. T. The potential of biomarkers of fibrosis in chronic lung allograft dysfunction. Transplant Rev (Orlando). 35 (3), 100626(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유