Method Article
Picrosirius-Rot-Färbung zur semiquantitativen histopathologischen Bewertung der Kollagenablagerung in Mausmodellen der chronischen Lungen-Allotransplantatabstoßung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Picrosirius-Rot-Färbung ist eine semiquantitative Methode zur objektiven Beurteilung der Kollagenablagerung beim murinen pulmonalen fibrotischen Remodeling in einer räumlich aufgelösten Weise. Neben der Bewertung der Gesamtkollagenablagerung ermöglicht die Picrosirius-Rot-Färbung die Unterscheidung von Kollagenfasern unterschiedlicher Dicke.
Zusammenfassung
Fibrose ist das pathophysiologische Kennzeichen der chronischen Abstoßung nach Lungentransplantation und die größte Hürde für ein langfristiges Überleben des Empfängers. Für die Untersuchung der chronischen Abstoßung stehen mehrere murine Lungentransplantationsmodelle zur Verfügung. Sie zeigen jedoch heterogene Ergebnisse bezüglich fibrotischer Veränderungen des Transplantats, und das histologische Ausmaß der Fibrose wird meist qualitativ berichtet. Daher kann ein ortsaufgelöster Ansatz, der eine statistische Analyse ermöglicht, bei der Bewertung der Fibrose in diesen Modellen hilfreich sein. In dieser Studie wird die Picrosirius-Rot-Färbung für eine semiquantitative Bewertung der Kollagenorganisation in murinen Lungentransplantaten vorgestellt und mit Standard-Hämatoxylin- und Eosin-, Masson-Trichrome- und Herovici-Färbungen verglichen. Die Färbung wurde an Schnitten aus zwei verschiedenen murinen Transplantationsmodellen durchgeführt, die auf kleineren und großen Histokompatibilitätskomplexen (MHC) basierten. Die Methode wurde für die semiquantitative Analyse der Kollagenorganisation in ganzen Lungenschnitten etabliert. Somit kann es als Werkzeug für murine experimentelle Modelle fibrotischer Lungenerkrankungen dienen.
Einleitung
Die Lungentransplantation ist die definitive therapeutische Option für Patienten, die an einer Lungenerkrankung im Endstadium leiden. Das Langzeitüberleben wird jedoch durch chronische Abstoßungsreaktionen beeinträchtigt, von denen 50 % der Empfänger innerhalb der ersten fünf postoperativen Jahre betroffensind 1. Der fibrotische Umbau der kleinen Atemwege und des Lungenparenchyms ist das histologische Kennzeichen, das dem fortschreitenden Verlust der Lungenfunktion bei chronischer Abstoßung von Lungentransplantaten zugrunde liegt2. Experimentell kann die chronische Abstoßung von Lungenallotransplantaten mit einer murinen orthotopen Lungentransplantation zwischen MHC-unpassenden Mausstämmen modelliert werden. Es wurden verschiedene Stammkombinationen vorgeschlagen, um den Phänotyp der chronischen Abstoßungzu erreichen 3. Unter ihnen wird häufig die Transplantatkombination aus dem minderjährigen MHC-Spender und dem C57BL/6-Empfänger verwendet4. Alternativ kann BALB/c-Spenderlunge an C57BL/6-Empfänger transplantiert werden, die täglich immunsuppressiv behandelt werden5. Diese Modelle führen zu histologisch unterschiedlichen Graden fibrotischer Veränderungen6. Diese Veränderungen werden oft qualitativ unter Verwendung der Standardfärbung von Hämatoxylin und Eosin sowie der Trichrom-Färbung nach Masson berichtet.
Die histologische Standardfärbung mit Hämatoxylin und Eosin ermöglicht einen Überblick über die Probe, da sie die Zellkerne blau färbt, während das Zytoplasma und die Kollagenfasern rot erscheinen. Bei der Trichrom-Färbung nach Masson werden die Zellkerne schwarz gefärbt, die Kollagenfasern werden grün bis blau gefärbt und der Hintergrund, einschließlich Zytoplasma, Fibrin und Muskeln, ist rot. Da die Trichrom-Beize von Masson zu unterschätzten Werten führen kann, wird die Verwendung von Picrosirius-Rot-Beize als vorteilhaft angesehen7. Picrosirius Red ist ein linearer anionischer Farbstoff, der mit langen kationischen Kollagenfasern assoziiert ist und eine kontrastreiche rote Färbung bietet. Darüber hinaus verbessert die Picrosirius-Rot-Färbung die natürliche Doppelbrechung von Kollagenfasern unter kreuzpolarisiertem Licht8. Auf diese Weise können die Dicke und Packung der Kollagenfaser bewertet werden. Mit einem Polarisationsfilter wird der Hintergrund dunkel und es wird möglich, die Dicke des abgelagerten Kollagens zu unterscheiden. Während dicke Kollagenfasern rot erscheinen, treten dünne Kollagenfasern unter Polarisation grün auf. Eine direkte Assoziation zwischen Doppelbrechung und Kollagen-Subtyp wird in der Literatur häufig beschrieben, wobei die rote Doppelbrechung Kollagen I und die grüne Doppelbrechung Kollagen IIIzugeordnet wird 9.
Dieses Protokoll beschreibt die Verwendung der Picrosirius-Rot-Färbung zur Beurteilung der Fibrose in murinen Lungentransplantaten. Zusätzlich zur konventionellen histologischen Färbung ermöglicht sie eine semiquantitative Bewertung der fibrotischen Veränderung in murinen Modellen der chronischen Abstoßung, bietet die Möglichkeit zur Unterscheidung zwischen dicken und dünnen Kollagenfasern in nur einer Färbung, ist kosteneffizient und einfach durchzuführen. Diese Methode kann auch auf andere murine experimentelle Modelle angewendet werden, die durch einen fibrotischen Umbau des Lungenparenchyms gekennzeichnet sind.
Protokoll
Alle Tierprotokolle entsprechen den ethischen Grundsätzen der 3R für humane Tierversuche und wurden von der lokalen veterinärmedizinischen Ethikkommission (Veterinäramt Kanton Zürich, Schweiz, Studiennummer 45/2014) genehmigt. Ebenso sollten die Leser die Erlaubnis der zuständigen Institutionen einholen, bevor sie Eingriffe an Labortieren durchführen.
1. Probenaufnahme
- Durchführung von Tierversuchen nach individuellem Bedarf und entsprechender ethischer Genehmigung. Ein einziger Mikrochirurg führt alle Operationen ohne zusätzliche verlängerte Ischämiezeiten durch.
HINWEIS: Für eine Reproduktion unserer repräsentativen Ergebnisse besorgen Sie sich spezifische pathogenfreie adulte männliche C57BL/6J-, C57BL/10J- und BALB/c-Mäuse mit einem Gewicht von 27-30 g von Charles River Laboratories. Verwenden Sie für Isotransplantate C57BL/6J-Tiere sowohl als Spender als auch als Empfänger. Transplantieren Sie im Modell mit geringfügigen Fehlanpassungen die Lunge eines C57BL/10J-Spenders an C57BL/6J-Empfänger. Im Major-Mismatching-Modell transplantieren Sie BALB/c-Spenderlungen an C57BL/6J-Empfänger und injizieren postoperativ täglich Cyclosporin (10 mg/kg/Tag) und Methylprednisolon (1,6 mg/kg/Tag) subkutan5. Verwenden Sie Kochsalzlösung zur Perfusion und entnehmen Sie die Lunge nach 8 Wochen (56 Tagen). - Zur Euthanasie intubieren Sie das Tier mit einem 20-G-Katheter und beatmeten Sie es mit O2 , das mit 2 % bis 3 % Isofluran ergänzt ist. Bestätigen Sie eine ausreichende Anästhesietiefe, indem Sie nicht auf ein Kneifen der Pfote reagieren.
- Führen Sie eine mediane Laparomenotomie durch, indem Sie die Bauchdecke mit einer chirurgischen Schere einschneiden und die Länge des Brustbeins durchschneiden, um das Herz freizulegen. Identifizieren Sie die untere Hohlvene und das linke Vorhofohr anhand ihrer anatomischen Lage.
- In schneller Folge die untere Hohlvene und das linke Vorhofohr mit einer chirurgischen Schere durchtrennen und das Tier mit 3-5 ml 0,9% NaCl durch die Wurzel der Lungenarterie mit einer Spritze durchbluten, um das gesamte Blut aus dem Lungenkreislauf zu entfernen.
HINWEIS: Die Euthanasie sollte gemäß der jeweiligen ethischen Genehmigung durchgeführt werden. Andere Methoden können gleichermaßen angewendet werden. Es wird empfohlen, das Blut aus dem Lungenkreislauf gründlich zu entfernen, was auch durch Perfusion nach Kreislaufstillstand erfolgen kann. - Entferne die durchblutete Lunge mit einer Schere.
- Zur Konservierung die Proben in 4 % Formalin inkubieren. Injizieren Sie die Formalinlösung direkt in den Bronchus und das Lungengefäßsystem. Tauchen Sie die Proben in Formalin und lassen Sie sie mindestens 6 h inkubieren.
HINWEIS: Für das Aufblasen der Lunge mit Formalin sollte ein standardisiertes Verfahren angewendet werden, um vergleichbare Ergebnisse zu erzielen. Beispielprotokolle für solche Verfahren sind an anderer Stelle veröffentlicht10,11. - Trimmen Sie die Orgel nach experimentellen Bedürfnissen. Schneiden Sie die Lunge quer in zwei Hälften, um alle Teile des Bronchialbaums in einem Abschnitt zu erfassen.
- Die Proben werden zur Dehydrierung in Alkoholsequenz in einen automatischen Gewebeprozessor überführt, wobei die Xylol- und Paraffinbeschichtung wie folgt geklärt wird: 70 % Ethanol, 70 % Ethanol, 80 % Ethanol, 96 % Ethanol, 100 % Ethanol (je 1 h), 100 % Ethanol, 100 % Ethanol, Xylol (je 2 h), Xylol (1 h) und Paraffin 3x für 2 h.
- Schmelzen Sie Paraffin und betten Sie die Proben in der richtigen Ausrichtung in Polyoxymethylen-Einbettkassetten ein. Achten Sie darauf, die Proben mit der Schnittfläche nach unten einzubetten. Verwenden Sie ein Rotationsmikrotom, um 5-μm-Abschnitte nacheinander zu schneiden. Lassen Sie die Objektträger 24 h bei 37 °C trocknen, bevor Sie sie weiterverarbeiten.
2. Entparaffinisierung und Hydratation von Paraffinobjektträgern
- Entfernen Sie das Paraffin, indem Sie die Proben 2x in 100% Xylol für jeweils 5 min inkubieren.
ACHTUNG: Xylol ist brennbar und gesundheitsgefährdend. Nur unter dem Abzug verwenden. - Hydratisieren Sie die Proben jeweils 2 Minuten lang in 100 % Ethanol, 100 % Ethanol, 95 % Ethanol, 70 % Ethanol und 50 % Ethanol. Dann 2 Minuten in destilliertem Wasser waschen.
3. Färben mit Picrosiriusrot
- Färben Sie sich 8 Minuten lang in Meyers Hämalumlösung. Waschen Sie die Objektträger 10 Minuten lang unter fließendem Leitungswasser.
- Inkubieren Sie die Objektträger 1 h lang in Picrosirius-Rot-Lösung. Verwenden Sie für die Picrosirius-Rot-Lösung entweder eine vorgemischte Färbelösung oder verwenden Sie 0,1 % Direct Red 80 oder Sirius Red F 3B (CI 35780), verdünnt in gesättigter Pikrinsäure.
ACHTUNG: Pikrinsäure ist brennbar und hochexplosiv und sollte sorgfältig behandelt werden.
HINWEIS: Es gibt viele verschiedene Anbieter für Picrosirius-Rot-Färbesets, wie in der Materialtabelle aufgeführt. Achten Sie auf Unterschiede im Preis und bei den Färbemethoden und halten Sie sich immer an die Anweisungen der Lieferanten. Es wird empfohlen, nur Färbesets mit dem spezifischen Farbindex für Sirius Red F 3B (CI 35780) zu verwenden. - Tauchen Sie die Objektträger 5x-10x in eine Essigsäurelösung (0,5%). Schütteln Sie die Objektträger vorsichtig, um die Lösung physisch zu entfernen.
- Dehydrieren Sie die Objektträger jeweils 5 Minuten lang in 95 % Ethanol, 100 % Ethanol, 100 % Ethanol, 100 % Xylol und 100 % Xylol.
- Betten Sie ein, indem Sie einen Tropfen Einbettmittel auf jede Probe geben und mit einem Deckglas abdecken. Lassen Sie die Dias unter einem Abzug trocknen.
4. Digitalisierung und Bildverarbeitung
- Fokussieren Sie die Proben unter einem Lichtmikroskop mit einer geeigneten Bildgebungssoftware, bis das Bild klar und scharf wird. Fügen Sie einen Polarisationsfilter hinzu und passen Sie den Polarisationsgrad an, bis der Hintergrund vollständig dunkel oder schwarz ist. Wenn der Hintergrund so dunkel wie möglich ist, wird die richtige Polarisation erreicht.
HINWEIS: Es ist auch möglich, die Picrosirius-Rot-Färbung mit herkömmlichem Durchlicht und ohne Polarisationsfilter sichtbar zu machen. Zu diesem Zweck wird empfohlen, Sirius Red mit Fast Green zu verwenden, da es sich als empfindlicher erwiesen hat als Sirius Red allein12,13. Die Polarisationsmikroskopie ist jedoch notwendig, um zwischen dicken und dünnen Kollagenfasern zu unterscheiden. - Scannen Sie alle Proben vollständig unter 20-facher Vergrößerung und exportieren Sie sie als .tiff. Übertragung auf Fidschi-Software14. Achten Sie darauf, die Dias im Vorfeld richtig zu reinigen und standardisierte Einstellungen bezüglich Belichtungszeit und Lichtquellenintensität zu verwenden.
- Umschließen Sie das Sample manuell und schneiden Sie es in der Software mit Edit > Clear Outside aus. Messen Sie die Gesamtoberfläche, indem Sie auf Analysieren > Messen klicken.
HINWEIS: Die Auswahl des zu messenden Fachs ist ein entscheidender Schritt, um zuverlässige und vergleichbare Ergebnisse zu erzielen. Durch die Digitalisierung und Selektion der gesamten Probe wird ein guter Querschnitt dargestellt und heterogene Gewebe werden als Ganzes betrachtet. Es ist aber auch möglich, sich auf bestimmte Bereiche innerhalb der Proben zu beschränken, wie z.B. das Brustfell oder einzelne Bronchien. Denken Sie daran, immer die Fächer auszuwählen, die standardisiert verglichen werden sollen. Sollten die Proben eine große Variabilität in der Belüftung aufweisen, empfiehlt es sich, den Luftraumbereich aus dem analysierten Fach15 auszuschließen. - Messen Sie den Gesamtkollagengehalt pro Probe anhand des Farbschwellenwerts, indem Sie auf Bild >> Farbschwellenwert anpassen klicken, und passen Sie die Einstellungen an, indem Sie auf Analysieren > Partikel analysieren klicken. Legen Sie die Größe = 1 fest - Unendlich, Löschen, Zusammenfassen. Helligkeit = 35 - 255. Farbton = 2 - 130
HINWEIS: Eine vernünftige Einstellung der Farbschwellenwerte ist entscheidend, um zuverlässige Ergebnisse zu erzielen. - Wiederholen Sie den Vorgang für dicke und dünne Kollagenfasern, indem Sie den Farbton als rote
 dicke Kollagenfasern (Farbton 2-30) und gelbgrüne
dicke Kollagenfasern (Farbton 2-30) und gelbgrüne  dünne Kollagenfasern (Farbton 31-130) anpassen. Das Ergebnis ist der Bereich der gefärbten Pixel.
dünne Kollagenfasern (Farbton 31-130) anpassen. Das Ergebnis ist der Bereich der gefärbten Pixel. - Konfigurieren Sie das Makro für die automatische Verarbeitung, indem Sie auf Plugins > Makros > Aufzeichnen klicken und den Vorgang mit allen Samples wiederholen.
- Um Endwerte zu erhalten, die auf die Oberfläche des Querschnitts standardisiert sind, dividieren Sie die Fläche der gefärbten Pixel für alle Parameter durch die Gesamtoberfläche, die in den Schritten 4.3 bzw. 4.5 für jede Probe gemessen wurde.
Ergebnisse
Das oben beschriebene Protokoll ermöglicht eine objektive semiquantitative Bewertung der Kollagenablagerung im Lungengewebe von Mäusen. Der fibrotische Umbau ist das pathophysiologische Kennzeichen der chronischen Abstoßung nach Lungentransplantation. Daher wurde die Picrosirius-Rot-Färbung in Modellen zur Abstoßung chronischer Lungentransplantate unter Verwendung einer linksseitigen orthotopen Lungentransplantation der Maus angewendet. Die große MHC-inmatchende Lungentransplantation von einem BALB/c-Spender auf einen C57BL/6-Empfänger unter milder Immunsuppression führt zu fibrotischen Veränderungen, die mit der chronischen Dysfunktion eines Lungentransplantats beim Menschen vergleichbarsind 5. Im Gegensatz dazu führt eine geringfügige MHC-Transplantation von einem C57BL/10-Spender zu einem C57BL/6-Empfänger in erster Linie zu einer lymphozytären Bronchiolitis6. Abbildung 1 zeigt den Versuchsaufbau im Detail.
Abbildung 2 gibt einen Überblick über repräsentative Bilder aus transplantierten linken Lungen der beiden Modelle sowie eines C57BL/6J-Isotransplantats. Die Färbung von Massons Trichrom16, Herovici17 und Picrosiriusrot18 veranschaulicht die umfangreiche peribronchiale und perivaskuläre Kollagenablagerung im wichtigsten MHC-mismatching-Modell (Modell 1, Abbildung 2B, D). Im Gegensatz dazu zeigt das Modell mit geringfügigen Fehlanpassungen (Modell 2) hauptsächlich dichte lymphozytäre Infiltrate, die sich in der Hämatoxylin- und Eosin-Färbung (Abbildung 2F) und einer weniger intensiven Kollagenablagerung (Abbildung 2G-J) widerspiegeln. Bei der Picrosirius-Rot-Färbung zeigt die Zugabe des Polarisationsfilters ein primär grünes Erscheinungsbild der abgeschiedenen Fasern bei beiden Modellen (Abbildung 2E,J). Bei Isotransplantatkontrollen ist das Vorhandensein von Kollagen auf die direkten peribronchialen und perivaskulären Grenzen beschränkt (Abbildung 2K-O), ähnlich der Struktur naiver muriner Lungen (Abbildung 3).
Sowohl die naive linksseitige Lunge von BALB/c-Tieren als auch die rechtsseitige Lunge von C57BL/6J-Empfängern zeigen nur eine dünne Kollagenauskleidung entlang der peribronchialen und perivaskulären Grenzen (Abbildung 3).
Die digitale Bildanalyse ganzer Lungenabschnitte, die mit Picrosirius-Rot gefärbt wurden, zeigte ein erhöhtes Vorhandensein von Gesamtkollagen in den Lungentransplantaten im Major-MHC-Mismatching-Modell im Vergleich zu den Transplantaten aus dem Minor-Mismatching-Modell (p=0,0038), rechtsseitigem naivem Lungengewebe (p=0,0006) oder naiver BALB/c-linker Lunge (p=0,0003, One-Way-ANOVA, Tukey-Mehrfachvergleichstest, Abbildung 4A). Für dicke Kollagenfasern, die unter polarisiertem Licht rot erscheinen, konnten Unterschiede zwischen den Gruppen nicht nachgewiesen werden (p=0,5512, Einweg-ANOVA, Abbildung 4B). Die Analyse dünner Kollagenfasern mit grünem Aussehen unter polarisiertem Licht zeigte jedoch eine erhöhte Präsenz im Major Mismatching-Modell im Vergleich zum Minor Mismatching-Modell (p=0,0005), naivem rechtsseitigem Lungengewebe (p<0,0001) oder naiver linksseitiger BALB/c-Lunge (p<0,0001, One-Way-ANOVA, Tukey's Multiple Vergleichs Test, Abbildung 4C).

Abbildung 1: Überblick über das Versuchsdesign. Die orthotope Transplantation der linken Lunge wurde mit einer Kombination aus großem (Modell 1) und kleinerem nicht übereinstimmendem Stamm (Modell 2) durchgeführt. Empfänger eines MHC-Major-Transplantats erhielten täglich eine Immunsuppression mit 10 mg/kg Cyclosporin und 1,6 mg/kg Methylprednisolon durch subkutane Injektion. Alle Empfängertiere wurden acht Wochen (Tag 56) postoperativ euthanasiert. Das Lungengewebe wurde durch Formalinfixierung, Paraffineinbettung und Schnitt aufbereitet. Aufeinanderfolgende Schnitte wurden mit Hämatoxylin- und Eosin-Färbung (H&E), Masson-Trichrome (MTC), Herovici-Färbung und Picrosirius-Rot (PSR) gefärbt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Bilder der peribronchiovaskulären Region in transplantierten Lungen. (A-E) Das wichtigste MHC-mismatched Modell 1 führt zu peribronchialer und perivaskulärer Fibrose, wie die Masson's Trichrome (MTC), Herovici's und Picrosirius Red Färbung (PSR) zeigen. Dies spiegelt sich auch durch das Hinzufügen des Polarisationsfilters (PSR (pol)) wider. (F-J) Das minore MHC-mismatched Modell 2 weist prominente peribronchiovaskuläre lymphozytäre Infiltrate auf, wie durch Hämatoxylin- und Eosin-Färbung (H&E) gezeigt wurde. MTC- und PSR-Färbungen zeigen in diesem Modell nur ein begrenztes Ausmaß an Kollagenablagerung. (K-O) Bei Isotransplantatkontrollen ist die Kollagenablagerung auf die direkten peribronchiovaskulären Regionen beschränkt. Lymphozytäre Infiltrate sind selten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
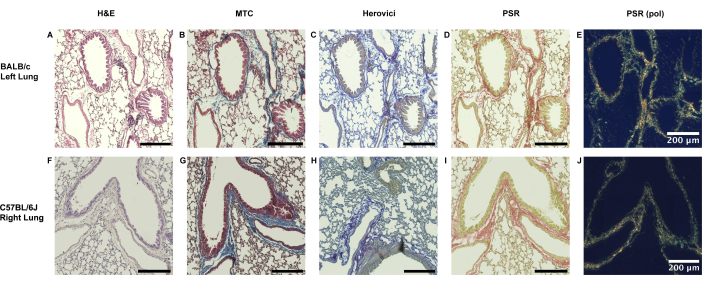
Abbildung 3: Physiologisches Ausmaß des peribronchiovaskulären Kollagenvorhandenseins in der Lunge von Mäusen. (A-E) Das Vorhandensein von Kollagen im Lungengewebe von Mäusen ist bis zu einem gewissen Grad physiologisch, ohne dass es zu einer größeren Belastungsabhängigkeit kommt. Bei linksseitigen naiven BALB/c-Lungen, wie sie für das große unpassende Modell (Modell 1) verwendet werden, ist eine dünne Kollagenauskleidung im peribronchiovaskulären Bereich zu sehen, wie die Masson-Trichrome (MTC), die Herovici-Färbung und die Picrosirius-Rot-Färbung (PSR) belegen. (F-J) In ähnlicher Weise ist eine Kollagenauskleidung, die auf die direkte peribronchiovaskuläre Grenze beschränkt ist, in der kontralateralen rechten Lunge des Empfängers C57BL/6J zu sehen. Abkürzungen: H&E = Hämatoxylin- und Eosin-Färbung; PSR (pol) = Picrosirius-Rot-Färbung nach Zugabe des Polarisationsfilters. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Die Picrosirius-Rot-Färbung unter polarisiertem Licht zeigt eine erhöhte Ablagerung dünner Kollagenfasern im wichtigsten MHC-mismatching-Maustransplantationsmodell. Bildanalyse der polarisierten Picrosirius-Rot-Färbung über den gesamten Bereich der transversalen Lungenschnitte. (A) Die Analyse der Gesamtkollagenablagerung zeigt eine erhöhte Kollagenablagerung im Major Mismatched-Modell im Vergleich zu kleineren mismatchenden Allotransplantaten, kontralateralen Empfängerlungen oder naiven BALB/c-Transplantaten der linken Lunge. (B) Es wurden keine signifikanten Unterschiede zwischen den Gruppen in Bezug auf dicke Kollagenfasern gefunden. (C) Die Analyse des Vorhandenseins dünner Kollagenfasern zeigt eine erhöhte Ablagerung bei großen nicht übereinstimmenden Allotransplantaten im Vergleich zu der kleinen nicht übereinstimmenden Gruppe, der kontralateralen Empfängerlunge oder den naiven BALB/c-Transplantaten der linken Lunge. Die Diagramme zeigen den Mittelwert ± Standardfehler des Mittelwerts, die unidirektionale ANOVA, die Mehrfachvergleiche von Tukey für die Signifikanz, * p < 0,05, ** p < 0,005, *** p < 0,0005, **** p < 0,0001, ns nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Histologische Standardmethoden wie Hämatoxylin und Eosin sowie die Masson-Trichrom-Färbung werden häufig verwendet, um fibrotische Veränderungen in der Lunge von Mäusen räumlich aufgelöst zu erkennen16,19. Oft sind jedoch zusätzliche Methoden notwendig, um diese Veränderungen zu quantifizieren und die Kollagenzusammensetzung des Gewebes zu bewerten.
Die Picrosirius-Rot-Färbung wurde erstmals 1964 zur Identifizierung von Kollagen beschrieben: Unter der Durchlichtmikroskopie erscheint Kollagen rot, während Muskeln und Zytoplasma gelb erscheinen18. Das Platzieren eines Polarisationsfilters nach vorne und die Ausnutzung der Doppelbrechung ermöglichten die Differenzierung der Kollagenfaserdicke. Die Korrelation zwischen dem fibrillären Farbton und der Dicke der Kollagenfaser wurde seitdem wiederholt nachgewiesen und wird häufig zur Beurteilung des Gesamtkollagengehalts und zur Schätzung von Kollagensubtypen beim fibrotischen Remodelingverwendet 9,20,21,22,23,24,25. Neuere Studien stellen jedoch den direkten Zusammenhang zwischen Kollagen-Subtyp und Farbtonin Frage 26,27. Daher sollte eine vorsichtige Berichterstattung über die Dicke der Kollagenfaser der direkten Ableitung einer Kollagen-Subtyp-Diskriminierung vorgezogen werden.
Das Färben von Kollagen mit Picrosirius-Rot und die Verwendung von Polarisationsmikroskopie ermöglichen die Lokalisierung von Gewebebestandteilen, die Kollagenmoleküle enthalten28. Im Vergleich zu anderen Kollagenfärbemethoden wie Van Gieson oder Massons Trichrom ermöglicht es auch die Visualisierung sehr dünner Kollagenfasern7, die hauptsächlich während der Fibrose bei der Abstoßung von Allotransplantaten entstehen29. Darüber hinaus ermöglicht es den quantitativen Nachweis dieser Fasertypen in nur einer Färbung. Diese Methode erlaubt jedoch nur eine semiquantitative Auswertung und keine absoluten Aussagen. Daher ist es erforderlich, das Protokoll genau zu befolgen und, wann immer möglich, alle Abschnitte gleichzeitig zu färben. Gleiches gilt für die Einstellungen für die Mikroskopie und die Bildverarbeitungsoptionen.
Bei der Auswahl des Fachs, das für die Bewertung von Interesse ist, ist es entscheidend, einen individuell standardisierten Ansatz zu verwenden. Dieses Protokoll beschreibt eine ganze Stichprobenauswahl ganzer Querschnitte. Des Weiteren wird die Verwendung eines zirkularen Polarisationsfilters empfohlen, da die lineare Polarisation zu unterschätzten Werten führen kann7.
Eine einfache Färbeanalyse kann mit dem frei verfügbaren Fiji-Softwarepaket erreicht werden, wie in dem hier vorgestellten Protokoll beschrieben. In der Literatur wurden jedoch ausgefeiltere Methoden zur digitalen Bildanalyse der Färbung beschrieben, die je nach den individuellen Bedürfnissen des Forschers eingesetzt werdenkönnen 13,15. In jüngster Zeit haben Werkzeuge der künstlichen Intelligenz an der digitalen Bildanalyse interessiert und könnten ebenfalls für die Bewertung der Picrosirius-Rot-Färbungtrainiert werden 30.
Der Umbau des fibrotischen Gewebes ist das histopathologische Kennzeichen des chronischen Transplantatversagens bei der Transplantation solider Organe. Daher kann die Picrosirius-Rot-Färbung eine wertvolle Aussage bei der experimentellen Transplantation sein. Tatsächlich wurde die Methode in der Klinik zur Auswertung von Gewebebiopsien bei Empfängern von Herztransplantaten eingesetzt31. Die klinische Anwendung der Picrosirius-Rot-Färbung bei Lungentransplantationen wurde nicht berichtet, obwohl die Früherkennung einer dünnen Kollagen-III-Ablagerung als potenzieller Biomarker für die CLAD-Diagnose diskutiertwird 32. In präklinischen Mausmodellen der Krankheit kann es ein wertvolles Werkzeug sein, da es eine semiquantitative Bewertung der Kollagenablagerung mit relativ geringem Gewebeverbrauch ermöglicht.
Die hier vorgestellten repräsentativen Ergebnisse zeigen, dass die digitale Bildanalyse der Picrosirius-Rotfärbung die verstärkte Ablagerung von Kollagenfasern in einem Major-Mismatch-Modell der chronischen Abstoßung nach orthotoper Lungentransplantation im Vergleich zu einer Minor-Mismatch-Stammkombination zeigen kann. Unsere Gruppe berichtete zuvor über diese Beobachtung in einer deskriptiveren Art und Weise, indem sie sich auf Massons Trichrom-Färbung16 stützte. Die Picrosirius-Rotfärbung mit einem zusätzlichen Polarisationsfilter ermöglicht eine semiquantitative Analyse und statistische Berichterstattung über fibrotische Veränderungen in Lungenallotransplantaten. Die Hauptvorteile der Methode sind ihre technische Einfachheit und ihr geringer Gewebeverbrauch, was wichtige Aspekte sind, die bei der Auswahl der Auslesemethode nach technisch komplexen Tiermodellen, wie z. B. der orthotopen Lungentransplantation von Mäusen, zu berücksichtigen sind.
Forscher sollten sich darüber im Klaren sein, dass, obwohl die Färbung in der Vergangenheit zur Schätzung des Kollagen-Subtyps verwendet wurde, neuere Veröffentlichungen ergeben haben, dass die Methode die Kollagentypen I und III nicht zuverlässig unterscheiden kann27. Das Verfahren kann durch Reflexion der Faserdicke26 Informationen über die Kollagenorganisation liefern, es ist möglicherweise nicht ausreichend für eine umfassende Bewertung der Kollagenablagerung.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Birte Ohm wird gefördert durch das Berta-Ottenstein-Programm für Clinician Scientists der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg. Steffen U Eisenhardt ist Heisenberg-Professor der Deutschen Forschungsgemeinschaft (DFG) und hat diese Arbeit mit persönlichen Stipendien unterstützt. Des Weiteren danken wir Sheena Kreuzaler für ihre technische Unterstützung. Abbildung 1 wurde mit Hilfe von Biorender.com erstellt. Die Bildgebung wurde an der Lighthouse Core Facility durchgeführt, die teilweise von der Medizinischen Fakultät der Universität Freiburg (Projektnummern 2023/A2-Fol; 2021/B3-Fol), dem DKTK und der DFG (Projektnummer 450392965) finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid | Honeywell, Charlotte, USA | 33209 | |
| Axio Observer | Zeiss, Oberkochen, Germany | 4633000956 (serial number) | |
| Coverslip 1.5 | Roth, Karlsruhe, Germany | KCY5.1 | |
| Formaldehyde 37% | Fisher Scientific, Leicestershire, UK | F/1501/PB15 | |
| Meyer's hemalum solution | Merck, Darmstadt, Germany | 109249 | |
| Picrosirius Red Solution | Morphisto, Offenbach am Main, Germany | 13422 | alternatives that can be used: ab150681, abcam, Cambridge, UK; SRS250 ScyTek Laboratories, Logan City US |
| Polarizing filter | Zeiss, Oberkochen, Germany | 000000-1121-813 | |
| Rotary microtome, HistoCore AUTOCUT | Leica, Wetzlar, Germany | 149AUTO00C1, 14051956472 | |
| ROTI Histokitt mounting medium | Roth, Karlsruhe, Germany | 6638.1 | |
| ROTI Plast Paraffin | Roth, Karlsruhe, Germany | 6642.5 | |
| Rotilabo-embedding cassettes, POM | Roth, Karlsruhe, Germany | K113.1 | |
| Superfrost Plus Adhesion Microscope slide | epredia, Portsmouth, UK | J1800AMNZ | |
| Tissue Processor | Leica, Wetzlar, Germany | TP 1020 | |
| Software | |||
| Fiji software version 2.14.0/1.54f | Open Source | ||
| Imaging Software ZEN 3.4.91 | Zeiss, Oberkochen, Germany |
Referenzen
- Weigt, S., DerHovanessian, A., Wallace, W., Lynch, J., Belperio, J. Bronchiolitis Obliterans Syndrome: The Achilles' heel of lung transplantation. Semin Respir Crit Care Med. 34 (3), 336-351 (2013).
- Verleden, G. M., et al. Chronic lung allograft dysfunction: Definition, diagnostic criteria, and approaches to treatment-A consensus report from the Pulmonary Council of the ISHLT. J Heart Lung Transplant. 38 (5), 493-503 (2019).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), e93121 (2017).
- Martinu, T., et al. Spectrum of chronic lung allograft pathology in a mouse minor-mismatched orthotopic lung transplant model. Am J Transplant. 19 (1), 247-258 (2019).
- de Vleeschauwer, S., et al. Chronic rejection pathology after orthotopic lung transplantation in mice: The development of a murine BOS model and its drawbacks. PLoS One. 7 (1), e29802 (2012).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-An experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Whittaker, P., Kloner, R. A., Boughner, D. R., Pickering, J. G. Quantitative assessment of myocardial collagen with picrosirius red staining and circularly polarized light. Basic Res Cardiol. 89 (5), 397-410 (1994).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Polarization microscopic studies of connective tissue stained with picro-sirius red FBA. Beitr Pathol. 150 (2), 174-187 (1973).
- Junqueira, L. C. U., Cossermelli, W., Brentani, R. Differential staining of collagens type I, II and III by Sirius Red and polarization microscopy. Arch Histol Jpn. 41 (3), 267-274 (1978).
- Davenport, M. L., Sherrill, T. P., Blackwell, T. S., Edmonds, M. D. Perfusion and inflation of the mouse lung for tumor histology. J Vis Exp. (162), e60605 (2020).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. (102), e52964 (2015).
- Segnani, C., et al. Histochemical detection of collagen fibers by Sirius Red/Fast Green is more sensitive than van Gieson or Sirius Red alone in normal and inflamed rat colon. PLoS One. 10 (12), e0144630 (2015).
- Courtoy, G. E., et al. Digital image analysis of Picrosirius Red staining: A robust method for multi-organ fibrosis quantification and characterization. Biomolecules. 10 (11), 1585 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Ségard, B. D., et al. Quantification of fibrosis extend and airspace availability in lung: A semi-automativ ImageJ/Fiji toolbox. PloS. 2 (2), e0298015 (2024).
- Zhou, X., Moore, B. B. Lung section staining and microscopy. Bio Protoc. 7 (10), e2286 (2017).
- Herovici, C. Picropolychrome: histological staining technic intended for the study of normal and pathological connective tissue. Rev Fr Etud Clin Biol. 8, 88-89 (1963).
- Sweat, F., Puchtler, H., Rosenthal, S. Sirius Red F3BA as a stain for connective tissue. Arch Pathol. 78, 69-72 (1964).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harb Protoc. 2014 (6), 655-658 (2014).
- Montes, G. S., Junqueira, L. C. The use of the Picrosirius-polarization method for the study of the biopathology of collagen. Mem Inst Oswaldo Cruz. 86, 1-11 (1991).
- Rittié, L. Method for Picrosirius Red-polarization detection of collagen fibers in tissue sections. Methods Mol Biol. 1627, 395-407 (2017).
- Diehm, Y. F., et al. Stem cell-enriched hybrid breast reconstruction reduces risk for capsular contracture in a hybrid breast model. Plast Reconstr Surg. 152 (3), 572-580 (2023).
- Rich, L., Whittaker, P. Collagen and Picrosirius Red staining: A polarized light assessment of fibrillar hue and spatial distribution. Braz J Morphol Sci. 22 (2), 97-104 (2005).
- Datar, U. V., et al. Clinicopathologic study of a series of giant cell fibroma using picrosirius red polarizing microscopy technique. Arch Iran Med. 17 (11), 746-749 (2014).
- Nishat, R., Kumar, H. Collagen fibers in oral submucous fibrosis - A polarizing microscopy study using two special stains. Indian J Pathol Microbiol. 62 (4), 537-543 (2019).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. J Histochem Cytochem. 62 (10), 751-758 (2014).
- López De Padilla, C. M. Picrosirius Red staining: Revisiting its application to the qualitative and quantitative assessment of collagen type I and type III in tendon. J Histochem Cytochem. 69 (10), 633-643 (2021).
- Junqueira, L. C. U., Bignolas, G., Brentani, R. R. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 11 (4), 447-455 (1979).
- Zheng, L., et al. Scar collagen deposition in the airways of allografts of lung transplant recipients. Am J Respir Crit Care Med. 155 (6), 2072-2077 (1997).
- Astbury, S., et al. Reliable computational quantification of liver fibrosis is compromised by inherent staining variation. J Pathol Clin Res. 7 (5), 471-481 (2021).
- Feingold, B., et al. Diffuse myocardial fibrosis among healthy pediatric heart transplant recipients: Correlation of histology, cardiovascular magnetic resonance, and clinical phenotype. Pediatr Transplant. 21 (5), 12986 (2017).
- vander Ploeg, E. A., Melgert, B. N., Burgess, J. K., Gan, C. T. The potential of biomarkers of fibrosis in chronic lung allograft dysfunction. Transplant Rev (Orlando). 35 (3), 100626 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten