Method Article
Colorazione rossa di Picrosirius per la valutazione istopatologica semiquantitativa della deposizione di collagene in modelli murini di rigetto cronico dell'allotrapianto polmonare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La colorazione con rosso Picrosirius è un metodo semiquantitativo per valutare oggettivamente la deposizione di collagene nel rimodellamento fibrotico polmonare murino in modo spazialmente risolto. Oltre a valutare la deposizione totale di collagene, la colorazione con Picrosirius Red consente di differenziare fibre di collagene di diversi spessori.
Abstract
La fibrosi è il segno fisiopatologico del rigetto cronico dopo il trapianto di polmone e il principale ostacolo alla sopravvivenza a lungo termine del ricevente. Sono disponibili diversi modelli di trapianto di polmone murino per lo studio del rigetto cronico. Tuttavia, mostrano risultati eterogenei per quanto riguarda le alterazioni fibrotiche dell'innesto e l'estensione istologica della fibrosi è per lo più riportata qualitativamente. Pertanto, un approccio spazialmente risolto che consenta l'analisi statistica può aiutare a valutare la fibrosi in questi modelli. Questo studio presenta la colorazione con Picrosirius Red per una valutazione semiquantitativa dell'organizzazione del collagene negli allotrapianti polmonari murini e la confronta con l'ematossilina e l'eosina standard, il tricromico di Masson e le colorazioni di Herovici. La colorazione è stata eseguita su sezioni di due diversi modelli di trapianto murino basati su discrepanze del complesso di istocompatibilità minore e maggiore (MHC). Il metodo è stato stabilito per l'analisi semiquantitativa dell'organizzazione del collagene in intere sezioni polmonari. Pertanto, può servire come strumento per modelli sperimentali murini di malattie polmonari fibrotiche.
Introduzione
Il trapianto di polmone è l'opzione terapeutica definitiva per i pazienti affetti da malattia polmonare allo stadio terminale. Tuttavia, la sopravvivenza a lungo termine è ostacolata dal rigetto cronico, che colpisce il 50% dei riceventi entro i primicinque anni postoperatori. Il rimodellamento fibrotico delle piccole vie aeree e del parenchima polmonare è il segno istologico alla base della progressiva perdita della funzione polmonare nel rigetto cronico dell'allotrapianto polmonare2. Sperimentalmente, il rigetto cronico dell'allotrapianto polmonare può essere modellato con il trapianto di polmone ortotopico murino tra ceppi di topo MHC-mismatched. Sono state proposte diverse combinazioni di ceppi per ottenere il fenotipo del rigetto cronico3. Tra questi, viene spesso utilizzata la combinazione di trapianto del donatore minore MHC non corrispondente C57BL/10 e del ricevente C57BL/64. In alternativa, i polmoni del donatore BALB/c possono essere trapiantati a riceventi C57BL/6 che ricevono un trattamento immunosoppressivo quotidiano5. Questi modelli determinano gradi istologicamente diversi di alterazioni fibrotiche6. Questi cambiamenti sono spesso riportati qualitativamente utilizzando l'ematossilina e l'eosina standard e la colorazione tricromica di Masson.
La colorazione istologica standard con ematossilina ed eosina consente una panoramica del campione in quanto colora i nuclei in blu, mentre il citoplasma e le fibre di collagene appaiono rosse. Con la colorazione Trichrome di Masson, i nuclei sono colorati di nero, le fibre di collagene sono colorate di verde o blu e lo sfondo, compreso il citoplasma, la fibrina e i muscoli, è rosso. Poiché la macchia Trichrome di Masson può portare a valori sottostimati, l'uso della macchia Picrosirius Red è considerato benefico7. Il rosso Picrosirius è un colorante anionico lineare che si associa a lunghe fibre di collagene cationico e fornisce una colorazione rossa ricca di contrasto. Inoltre, la colorazione con rosso Picrosirius migliora la naturale birifrangenza delle fibre di collagene sotto la luce polarizzata incrociata8. In questo modo, è possibile valutare lo spessore e l'impacchettamento delle fibre di collagene. Utilizzando un filtro polarizzatore, lo sfondo diventa scuro e diventa possibile distinguere lo spessore del collagene depositato. Mentre le spesse fibre di collagene appaiono rosse, le sottili fibre di collagene emergono verdi sotto polarizzazione. In letteratura è frequentemente descritta un'associazione diretta tra birifrangenza e sottotipo di collagene, con la birifrangenza rossa assegnata al collagene I e la birifrangenza verde al collagene III9.
Questo protocollo descrive l'uso della colorazione Picrosirius Red per valutare la fibrosi negli allotrapianti polmonari murini. Oltre alla colorazione istologica convenzionale, consente una valutazione semiquantitativa del cambiamento fibrotico in modelli murini di rigetto cronico, fornisce un mezzo di distinzione tra fibre di collagene spesse e sottili in una sola colorazione, è efficiente in termini di costi ed è facile da eseguire. Questo metodo può essere applicato anche ad altri modelli sperimentali murini caratterizzati da rimodellamento fibrotico del parenchima polmonare.
Protocollo
Tutti i protocolli per gli animali sono conformi ai principi etici delle 3R per la ricerca umana sugli animali e sono stati approvati dal comitato etico veterinario locale (Veterinäramt Kanton Zürich, Svizzera, studio numero 45/2014). Allo stesso modo, i lettori devono ottenere l'autorizzazione dalle istituzioni competenti prima di eseguire qualsiasi procedura sugli animali da laboratorio.
1. Acquisizione del campione
- Condurre esperimenti sugli animali in base alle esigenze individuali e alla rispettiva approvazione etica. Un singolo microchirurgo esegue tutti gli interventi chirurgici senza ulteriori tempi di ischemia prolungati.
NOTA: Per una riproduzione dei nostri risultati rappresentativi, procurarsi topi maschi adulti C57BL/6J, C57BL/10J e BALB/c specifici privi di agenti patogeni del peso di 27-30 g dai Charles River Laboratories. Per gli isotrapianti, utilizzare animali C57BL/6J sia come donatori che come riceventi. Nel modello minore non corrispondente, trapiantare i polmoni del donatore C57BL/10J a riceventi C57BL/6J. Nel modello principale non corrispondente, trapiantare i polmoni del donatore BALB/c a riceventi di C57BL/6J e iniettare dopo l'intervento ciclosporina (10 mg/kg/die) e metilprednisolone (1,6 mg/kg/die) per via sottocutaneaal giorno 5. Utilizzare una soluzione salina per la perfusione e recuperare i polmoni dopo 8 settimane (56 giorni). - Per l'eutanasia, intubare l'animale con un catetere da 20 G e ventilarlo con O2 integrato con isoflurano al 2%-3%. Confermare una profondità sufficiente dell'anestesia in base all'assenza di una risposta a un pizzico della zampa.
- Eseguire una laparosternotomia mediana incidendo la parete addominale con le forbici chirurgiche e tagliando la lunghezza dello sterno per esporre il cuore. Identificare la vena cava inferiore e l'appendice atriale sinistra in base alla loro posizione anatomica.
- In rapida successione, tagliare la vena cava inferiore e l'appendice atriale sinistra con forbici chirurgiche e perfondere l'animale con 3-5 ml di NaCl allo 0,9% attraverso la radice dell'arteria polmonare con una siringa per rimuovere tutto il sangue dalla circolazione polmonare.
NOTA: L'eutanasia deve essere eseguita secondo la rispettiva approvazione etica. Altri metodi possono essere applicati allo stesso modo. Si raccomanda di rimuovere completamente il sangue dalla circolazione polmonare, cosa che può essere eseguita anche per perfusione dopo l'arresto circolatorio. - Rimuovere i polmoni perfusi usando le forbici.
- Per la conservazione, incubare i campioni in formalina al 4%. Iniettare la soluzione di formalina direttamente nel bronco e nel sistema vascolare polmonare. Immergere i campioni in formalina e lasciarli incubare per almeno 6 ore.
NOTA: Per il gonfiaggio del polmone con formalina, è necessario applicare una procedura standardizzata per ottenere risultati comparabili. Esempi di protocolli per tali procedure sono pubblicati altrove10,11. - Trimmare l'organo in base alle esigenze sperimentali. Tagliare trasversalmente i polmoni a metà per catturare tutte le parti dell'albero bronchiale in una sezione.
- Trasferire i campioni a un processatore automatico di tessuti per la disidratazione nella sequenza alcolica, la chiarificazione in xilolo e rivestimento di paraffina come segue: 70% etanolo, 70% etanolo, 80% etanolo, 96% etanolo, 100% etanolo (1 ora ciascuno), 100% etanolo, 100% etanolo, xilolo (2 ore ciascuno), xilolo (1 ora) e paraffina 3 volte per 2 ore.
- Fondere la paraffina e incorporare i campioni con l'orientamento corretto nelle cassette di inclusione in poliossimetile. Fare attenzione a incorporare i campioni con la superficie tagliata rivolta verso il basso. Utilizzare un microtomo rotante per tagliare sezioni da 5 μm consecutivamente. Lasciare asciugare i vetrini per 24 ore a 37 °C prima di procedere con la lavorazione.
2. Deparaffinazione e idratazione dei vetrini di paraffina
- Rimuovere la paraffina incubando i campioni 2 volte in xilolo al 100% per 5 minuti ciascuno.
ATTENZIONE: Xylol è infiammabile e pericoloso per la salute. Utilizzare solo sotto la cappa aspirante. - Idratare i campioni in etanolo al 100%, etanolo al 100%, etanolo al 95%, etanolo al 70% ed etanolo al 50% per 2 minuti ciascuno. Quindi, lavare per 2 minuti in acqua distillata.
3. Colorazione con rosso Picrosirius
- La colorazione scivola per 8 minuti nella soluzione di emalum di Meyer. Lavare gli scivoli per 10 minuti sotto l'acqua corrente del rubinetto.
- Incubare i vetrini per 1 ora in soluzione di Picrosirius Red. Per la soluzione di rosso Picrosirius, utilizzare una soluzione colorante premiscelata o utilizzare lo 0,1% di rosso diretto 80 o rosso Sirius F 3B (CI 35780) diluito in acido picrico saturo.
ATTENZIONE: L'acido picrico è infiammabile e altamente esplosivo e deve essere trattato con cura.
NOTA: Sono disponibili molti fornitori diversi per i kit di colorazione Picrosirius Red, come elencato nella tabella dei materiali. Sii consapevole delle differenze di prezzo e dei metodi di colorazione e rispetta sempre le istruzioni dei fornitori. Si consiglia di utilizzare solo kit di colorazione con l'indice di colore specifico per Sirius Red F 3B (CI 35780). - Immergere i vetrini 5x-10x in una soluzione di acido acetico (0,5%). Agitare delicatamente i vetrini per rimuovere fisicamente la soluzione.
- Disidratare i vetrini in etanolo al 95%, etanolo al 100%, etanolo al 100%, xilolo al 100% e xilolo al 100% per 5 minuti ciascuno.
- Incorporare aggiungendo una goccia di terreno di montaggio su ciascun campione e coprire con un vetrino coprioggetti. Lasciare asciugare i vetrini sotto una cappa aspirante.
4. Digitalizzazione ed elaborazione delle immagini
- Focalizzare i campioni al microscopio ottico con un software di imaging appropriato fino a quando l'immagine diventa chiara e nitida. Aggiungi un filtro polarizzatore e regola il grado di polarizzazione fino a quando lo sfondo non è completamente scuro o nero. Quando lo sfondo è il più scuro possibile, si ottiene la corretta polarizzazione.
NOTA: È anche possibile visualizzare la colorazione di Picrosirius Red con luce trasmessa convenzionale e senza filtro polarizzatore. A tale scopo, si consiglia di utilizzare Sirius Red con Fast Green, poiché è stato dimostrato che è più sensibile del solo Sirius Red12,13. Tuttavia, la microscopia polarizzante è necessaria per distinguere tra fibre di collagene spesse e sottili. - Scansiona tutti i campioni completamente con un ingrandimento di 20x ed esporta come .tiff. Trasferimento al software Fiji14. Assicurati di pulire correttamente i vetrini in anticipo e di utilizzare impostazioni standardizzate per quanto riguarda il tempo di esposizione e l'intensità della sorgente luminosa.
- Circondare manualmente il campione e ritagliarlo nel software utilizzando Modifica > Cancella esterno. Misurare la superficie totale facendo clic su Analizza > Misura.
NOTA: La selezione dello scomparto da misurare è un passaggio fondamentale per creare risultati affidabili e comparabili. Digitalizzando e selezionando l'intero campione, viene visualizzata una buona sezione trasversale e i tessuti eterogenei vengono considerati nel loro insieme. Tuttavia, è anche possibile limitarsi a zone specifiche all'interno dei campioni, come la pleura o i singoli bronchi. Tieni presente di selezionare sempre gli scomparti da confrontare in modo standardizzato. Nel caso in cui i campioni mostrino una grande variabilità nella ventilazione, è consigliabile escludere l'area dello spazio aereo dal compartimentoanalizzato 15. - Misurare il contenuto totale di collagene per campione utilizzando la soglia del colore facendo clic su Immagine > Regola > soglia colore e regolare le impostazioni facendo clic su Analizza > Analizza particelle. Imposta dimensione = 1 - Infinito, Cancella, Riepiloga. Luminosità = 35 - 255. Tonalità = 2 - 130
NOTA: Un'impostazione ragionevole delle soglie di colore è fondamentale per ottenere risultati affidabili. - Ripetere per le fibre di collagene spesse e sottili regolando la tonalità come fibre di collagene spesse rosse
 (tonalità 2-30) e fibre di collagene sottili giallo-verdi
(tonalità 2-30) e fibre di collagene sottili giallo-verdi  (tonalità 31-130). Il risultato sarà l'area dei pixel macchiati.
(tonalità 31-130). Il risultato sarà l'area dei pixel macchiati. - Configura la macro per l'elaborazione automatizzata facendo clic su Plug-in > Macro > Registra e ripeti con tutti i campioni.
- Per ricevere i valori finali standardizzati in base all'area superficiale della sezione trasversale, dividere l'area dei pixel colorati per tutti i parametri per l'area superficiale totale misurata rispettivamente nei passaggi 4.3 e 4.5 per ciascun campione.
Risultati
Il protocollo sopra descritto consente una valutazione semiquantitativa oggettiva della deposizione di collagene nel tessuto polmonare murino. Il rimodellamento fibrotico è il segno fisiopatologico del rigetto cronico dopo trapianto di polmone. Pertanto, la colorazione Picrosirius Red è stata applicata in modelli di rigetto cronico dell'allotrapianto polmonare utilizzando il trapianto di polmone ortotopico murino sinistro. Il trapianto di polmone maggiore MHC-mismatched da un donatore di BALB/c a un ricevente di C57BL/6 in condizioni di lieve immunosoppressione provoca alterazioni fibrotiche paragonabili alla disfunzione cronica dell'allotrapianto polmonare umano5. Al contrario, il trapianto minore di MHC-mismatched da un donatore C57BL/10 a un ricevente C57BL/6 provoca principalmente bronchiolite linfocitica6. La Figura 1 illustra in dettaglio la configurazione sperimentale.
La Figura 2 fornisce una panoramica delle immagini rappresentative dei polmoni sinistri trapiantati dei due modelli e di un isotrapianto di C57BL/6J. La colorazione Trichrome16 di Masson, Herovici's17 e Picrosirius Red18 illustra l'estesa deposizione di collagene peribronchiale e perivascolare nel principale modello MHC-mismatched (Modello 1, Figura 2B, D). Al contrario, il modello minore non corrispondente (Modello 2) mostra principalmente infiltrati linfocitici densi come riflesso dalla colorazione con ematossilina ed eosina (Figura 2F) e una deposizione di collagene meno intensa (Figura 2G-J). Nella colorazione Picrosirius Red, l'aggiunta del filtro di polarizzazione rivela un aspetto principalmente verde delle fibre depositate in entrambi i modelli (Figura 2E, J). Nei controlli degli isotrapianti, la presenza di collagene è limitata ai bordi peribronchiale e perivascolare diretti (Figura 2K-O), in modo simile alla struttura dei polmoni murini naive (Figura 3).
Sia i polmoni sinistri naïve di animali BALB/c che i polmoni destri di riceventi di C57BL/6J mostrano solo un sottile rivestimento di collagene lungo i bordi peribronchiale e perivascolare (Figura 3).
L'analisi delle immagini digitali di intere sezioni polmonari colorate con Picrosirius Red ha rivelato una maggiore presenza di collagene totale negli innesti polmonari nel modello maggiore MHC-mismatched rispetto agli innesti del modello minore non corrispondente (p=0,0038), tessuto polmonare naïve sul lato destro (p=0,0006) o polmoni sinistri BALB/c naive (p=0,0003, ANOVA unidirezionale, test di confronto multiplo di Tukey, Figura 4A). Per le fibre spesse di collagene, che appaiono rosse alla luce polarizzata, non è stato possibile dimostrare differenze tra i gruppi (p=0,5512, ANOVA unidirezionale, Figura 4B). Tuttavia, l'analisi di sottili fibre di collagene con un aspetto verde sotto luce polarizzata ha rivelato una maggiore presenza nel modello di mancata corrispondenza maggiore rispetto al modello di mancata corrispondenza minore (p = 0,0005), nel tessuto polmonare destro naive (p<0,0001) o nei polmoni BALB/c del lato sinistro naive (p<0,0001, ANOVA unidirezionale, test di confronto multiplo di Tukey, Figura 4C).

Figura 1: Panoramica del disegno sperimentale. Il trapianto ortotopico di polmone sinistro è stato eseguito utilizzando una combinazione di ceppo maggiore (Modello 1) e minore non corrispondente (Modello 2). I riceventi di un trapianto MHC major mismatched hanno ricevuto immunosoppressione giornaliera con 10 mg/kg di ciclosporina e 1,6 mg/kg di metilprednisolone mediante iniezione sottocutanea. Tutti gli animali riceventi sono stati soppressi a otto settimane (giorno 56) dopo l'intervento. Il tessuto polmonare è stato processato mediante fissazione in formalina, inclusione di paraffina e sezionamento. Le sezioni consecutive sono state colorate con ematossilina ed eosina (H&E), tricromia di Masson (MTC), colorazione di Herovici e rosso di Picrosirius (PSR). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini rappresentative della regione peribronchiovascolare nei polmoni trapiantati. (A-E) Il principale modello 1 MHC-mismatched provoca fibrosi peribronchiale e perivascolare, come evidenziato dalla tricromia di Masson (MTC), dalla colorazione di Herovici e dal rosso di Picrosirius (PSR). Ciò si riflette anche aggiungendo il filtro di polarizzazione (PSR (pol)). (F-J) Il modello 2 minore MHC-mismatched si presenta con infiltrati linfocitici peribronchiovascolari prominenti, come dimostrato dalla colorazione con ematossilina ed eosina (H&E). La colorazione MTC e PSR mostra solo un'estensione limitata della deposizione di collagene in questo modello. (K-O) Nei controlli con isotrapianto, la deposizione di collagene è limitata alle regioni peribronchiovascolari dirette. Gli infiltrati linfocitici sono scarsi. Clicca qui per visualizzare una versione più grande di questa figura.
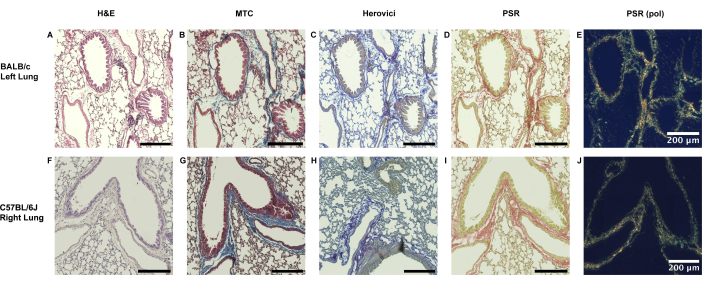
Figura 3: Estensione fisiologica della presenza di collagene peribronchiovascolare nei polmoni murini. (A-E) La presenza di collagene nel tessuto polmonare murino è fisiologica in una certa misura senza una grande dipendenza da sforzo. Nei polmoni BALB/c naïve del lato sinistro, come utilizzato per il modello principale non corrispondente (Modello 1), si può osservare un sottile rivestimento di collagene nell'area peribronchiovascolare, come evidenziato dalla tricromia di Masson (MTC), dalla colorazione del rosso di Herovici e del rosso di Picrosirio (PSR). (F-J) Allo stesso modo, un rivestimento di collagene limitato al bordo peribronchiovascolare diretto si osserva nei polmoni destri controlaterali di origine C57BL/6J ricevente. Abbreviazioni: H&E = colorazione con ematossilina ed eosina; PSR (pol) = Colorazione rosso Picrosirius dopo l'aggiunta del filtro di polarizzazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: La colorazione con rosso Picrosirius alla luce polarizzata rivela un aumento della deposizione di sottili fibre di collagene nel principale modello di trapianto murino MHC-mismatched. Analisi dell'immagine della colorazione polarizzata del rosso Picrosirius su tutta l'area delle sezioni polmonari trasversali. (A) L'analisi della deposizione totale di collagene rivela un aumento della deposizione di collagene nel modello principale non corrispondente rispetto agli allotrapianti minori non corrispondenti, ai polmoni riceventi controlaterali o agli innesti di polmone sinistro BALB/c naive. (B) Non sono state riscontrate differenze significative tra i gruppi per quanto riguarda le fibre spesse di collagene. (C) L'analisi della presenza di fibre sottili di collagene rivela un aumento della deposizione negli allotrapianti non corrispondenti maggiori rispetto al gruppo non corrispondente minore, ai polmoni riceventi controlaterali o agli innesti di polmone sinistro BALB/c naïve. I grafici mostrano l'errore medio ± standard della media, l'ANOVA unidirezionale, i confronti multipli di Tukey utilizzati per la significatività, * p < 0,05, ** p < 0,005, *** p < 0,0005, **** p < 0,0001, ns non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I metodi istologici standard come l'ematossilina e l'eosina e la colorazione tricromica di Masson sono ampiamente utilizzati per rilevare i cambiamenti fibrotici nei polmoni murini in modo spazialmente risolto16,19. Tuttavia, sono spesso necessari metodi aggiuntivi per quantificare questi cambiamenti e valutare la composizione del collagene del tessuto.
La colorazione con il rosso Picrosirius è stata descritta per la prima volta nel 1964 per identificare il collagene: al microscopio a luce trasmessa, il collagene appare rosso mentre il muscolo e il citoplasma emergono gialli18. L'inserimento di un filtro polarizzatore in anticipo e lo sfruttamento della birifrangenza hanno permesso di differenziare lo spessore delle fibre di collagene. La correlazione tra la tonalità fibrillare e lo spessore delle fibre di collagene è stata dimostrata ripetutamente da allora ed è spesso utilizzata per valutare il contenuto totale di collagene e stimare i sottotipi di collagene nel rimodellamento fibrotico 9,20,21,22,23,24,25. Tuttavia, studi più recenti mettono in discussione l'associazione diretta tra il sottotipo di collagene e la tonalità26,27. Pertanto, una segnalazione cauta dello spessore delle fibre di collagene dovrebbe essere preferita piuttosto che dedurre direttamente la discriminazione del sottotipo di collagene.
La colorazione del collagene con Picrosirius Red e l'utilizzo della microscopia polarizzante consentono la localizzazione di componenti tissutali contenenti molecole di collagene28. Rispetto ad altri metodi di colorazione del collagene come il tricromo di Van Gieson o Masson, consente anche la visualizzazione di fibre di collagene molto sottili7, che si verificano principalmente durante la fibrosi nel rigetto dell'allotrapianto29. Inoltre, consente il rilevamento quantitativo di questi tipi di fibre in una sola colorazione. Tuttavia, questo metodo consente solo una valutazione semiquantitativa e nessuna affermazione assoluta. Pertanto, è necessario seguire il protocollo in modo preciso e, quando possibile, colorare tutte le sezioni contemporaneamente. Lo stesso vale per le impostazioni per la microscopia e le opzioni di elaborazione delle immagini.
Nella scelta del comparto di interesse per la valutazione, è fondamentale utilizzare un approccio standardizzato individualmente. Questo protocollo descrive un'intera selezione di campioni di intere sezioni trasversali. Inoltre, si consiglia l'uso di un filtro polarizzatore circolare, in quanto la polarizzazione lineare può portare a valori sottostimati7.
Una semplice analisi di colorazione può essere ottenuta con il pacchetto software Fiji disponibile gratuitamente, come descritto nel protocollo presentato qui. Tuttavia, in letteratura sono stati descritti metodi più sofisticati per l'analisi digitale delle immagini della colorazione e possono essere impiegati in base alle esigenze del singolo ricercatore13,15. Recentemente, gli strumenti di intelligenza artificiale hanno acquisito interesse nell'analisi dell'imaging digitale e potrebbero anche essere addestrati per valutare la colorazione con rosso Picrosirius30.
Il rimodellamento del tessuto fibrotico è il segno istopatologico del fallimento cronico del trapianto nel trapianto di organi solidi. Pertanto, la colorazione con rosso Picrosirius può essere una lettura preziosa nel trapianto sperimentale. In effetti, il metodo è stato utilizzato in clinica per la valutazione delle biopsie tissutali nei riceventi di trapianto di cuore31. L'uso clinico della colorazione Picrosirius Red nel trapianto di polmone non è stato riportato, anche se la diagnosi precoce della deposizione sottile di collagene III è discussa come un potenziale biomarcatore per la diagnosi di CLAD32. Nei modelli murini preclinici della malattia, può essere uno strumento prezioso in quanto consente una valutazione semiquantitativa della deposizione di collagene con un consumo di tessuto relativamente basso.
I risultati rappresentativi qui presentati dimostrano che l'analisi digitale delle immagini della colorazione rossa di Picrosirius può mostrare l'aumento della deposizione di fibre di collagene in un modello di rigetto cronico grave non corrispondente dopo trapianto di polmone ortotopico rispetto a una combinazione di ceppo minore non corrispondente. Il nostro gruppo ha precedentemente riportato questa osservazione in modo più descrittivo, basandosi sulla colorazione tricromica16 di Masson. La colorazione con rosso Picrosirius, con l'aggiunta di un filtro polarizzatore, consente un'analisi semiquantitativa e la segnalazione statistica del cambiamento fibrotico negli allotrapianti polmonari. I principali vantaggi del metodo sono la sua semplicità tecnica e il piccolo consumo di tessuto, che sono aspetti importanti da considerare durante la selezione del metodo di lettura seguendo modelli animali tecnicamente complessi, come il trapianto di polmone ortotopico murino.
I ricercatori devono essere consapevoli del fatto che, anche se la colorazione è stata storicamente utilizzata per la stima dei sottotipi di collagene, recenti pubblicazioni hanno scoperto che il metodo non è in grado di distinguere in modo affidabile i tipi di collagene I e III27. Il metodo può fornire informazioni sull'organizzazione del collagene riflettendo lo spessore della fibra26, potrebbe non essere sufficiente per una valutazione completa della deposizione di collagene.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Birte Ohm è supportato dal Berta-Ottenstein-Program for Clinician Scientists, Facoltà di Medicina, Università di Friburgo. Steffen U Eisenhardt è professore presso la Fondazione tedesca per la ricerca (DFG) e ha sostenuto questo lavoro con sovvenzioni personali. Inoltre, vorremmo ringraziare Sheena Kreuzaler per la sua assistenza tecnica. La Figura 1 è stata creata con l'aiuto di Biorender.com. L'imaging è stato eseguito presso la Lighthouse Core Facility, finanziata in parte dalla Facoltà di Medicina dell'Università di Friburgo (numeri di progetto 2023/A2-Fol; 2021/B3-Fol), dal DKTK e dal DFG (numero di progetto 450392965).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid | Honeywell, Charlotte, USA | 33209 | |
| Axio Observer | Zeiss, Oberkochen, Germany | 4633000956 (serial number) | |
| Coverslip 1.5 | Roth, Karlsruhe, Germany | KCY5.1 | |
| Formaldehyde 37% | Fisher Scientific, Leicestershire, UK | F/1501/PB15 | |
| Meyer's hemalum solution | Merck, Darmstadt, Germany | 109249 | |
| Picrosirius Red Solution | Morphisto, Offenbach am Main, Germany | 13422 | alternatives that can be used: ab150681, abcam, Cambridge, UK; SRS250 ScyTek Laboratories, Logan City US |
| Polarizing filter | Zeiss, Oberkochen, Germany | 000000-1121-813 | |
| Rotary microtome, HistoCore AUTOCUT | Leica, Wetzlar, Germany | 149AUTO00C1, 14051956472 | |
| ROTI Histokitt mounting medium | Roth, Karlsruhe, Germany | 6638.1 | |
| ROTI Plast Paraffin | Roth, Karlsruhe, Germany | 6642.5 | |
| Rotilabo-embedding cassettes, POM | Roth, Karlsruhe, Germany | K113.1 | |
| Superfrost Plus Adhesion Microscope slide | epredia, Portsmouth, UK | J1800AMNZ | |
| Tissue Processor | Leica, Wetzlar, Germany | TP 1020 | |
| Software | |||
| Fiji software version 2.14.0/1.54f | Open Source | ||
| Imaging Software ZEN 3.4.91 | Zeiss, Oberkochen, Germany |
Riferimenti
- Weigt, S., DerHovanessian, A., Wallace, W., Lynch, J., Belperio, J. Bronchiolitis Obliterans Syndrome: The Achilles' heel of lung transplantation. Semin Respir Crit Care Med. 34 (3), 336-351 (2013).
- Verleden, G. M., et al. Chronic lung allograft dysfunction: Definition, diagnostic criteria, and approaches to treatment-A consensus report from the Pulmonary Council of the ISHLT. J Heart Lung Transplant. 38 (5), 493-503 (2019).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), e93121(2017).
- Martinu, T., et al. Spectrum of chronic lung allograft pathology in a mouse minor-mismatched orthotopic lung transplant model. Am J Transplant. 19 (1), 247-258 (2019).
- de Vleeschauwer, S., et al. Chronic rejection pathology after orthotopic lung transplantation in mice: The development of a murine BOS model and its drawbacks. PLoS One. 7 (1), e29802(2012).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-An experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Whittaker, P., Kloner, R. A., Boughner, D. R., Pickering, J. G. Quantitative assessment of myocardial collagen with picrosirius red staining and circularly polarized light. Basic Res Cardiol. 89 (5), 397-410 (1994).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Polarization microscopic studies of connective tissue stained with picro-sirius red FBA. Beitr Pathol. 150 (2), 174-187 (1973).
- Junqueira, L. C. U., Cossermelli, W., Brentani, R. Differential staining of collagens type I, II and III by Sirius Red and polarization microscopy. Arch Histol Jpn. 41 (3), 267-274 (1978).
- Davenport, M. L., Sherrill, T. P., Blackwell, T. S., Edmonds, M. D. Perfusion and inflation of the mouse lung for tumor histology. J Vis Exp. (162), e60605(2020).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. (102), e52964(2015).
- Segnani, C., et al. Histochemical detection of collagen fibers by Sirius Red/Fast Green is more sensitive than van Gieson or Sirius Red alone in normal and inflamed rat colon. PLoS One. 10 (12), e0144630(2015).
- Courtoy, G. E., et al. Digital image analysis of Picrosirius Red staining: A robust method for multi-organ fibrosis quantification and characterization. Biomolecules. 10 (11), 1585(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Ségard, B. D., et al. Quantification of fibrosis extend and airspace availability in lung: A semi-automativ ImageJ/Fiji toolbox. PloS. 2 (2), e0298015(2024).
- Zhou, X., Moore, B. B. Lung section staining and microscopy. Bio Protoc. 7 (10), e2286(2017).
- Herovici, C. Picropolychrome: histological staining technic intended for the study of normal and pathological connective tissue. Rev Fr Etud Clin Biol. 8, 88-89 (1963).
- Sweat, F., Puchtler, H., Rosenthal, S. Sirius Red F3BA as a stain for connective tissue. Arch Pathol. 78, 69-72 (1964).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harb Protoc. 2014 (6), 655-658 (2014).
- Montes, G. S., Junqueira, L. C. The use of the Picrosirius-polarization method for the study of the biopathology of collagen. Mem Inst Oswaldo Cruz. 86, Suppl 3 1-11 (1991).
- Rittié, L. Method for Picrosirius Red-polarization detection of collagen fibers in tissue sections. Methods Mol Biol. 1627, 395-407 (2017).
- Diehm, Y. F., et al. Stem cell-enriched hybrid breast reconstruction reduces risk for capsular contracture in a hybrid breast model. Plast Reconstr Surg. 152 (3), 572-580 (2023).
- Rich, L., Whittaker, P. Collagen and Picrosirius Red staining: A polarized light assessment of fibrillar hue and spatial distribution. Braz J Morphol Sci. 22 (2), 97-104 (2005).
- Datar, U. V., et al. Clinicopathologic study of a series of giant cell fibroma using picrosirius red polarizing microscopy technique. Arch Iran Med. 17 (11), 746-749 (2014).
- Nishat, R., Kumar, H. Collagen fibers in oral submucous fibrosis - A polarizing microscopy study using two special stains. Indian J Pathol Microbiol. 62 (4), 537-543 (2019).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. J Histochem Cytochem. 62 (10), 751-758 (2014).
- López De Padilla, C. M. Picrosirius Red staining: Revisiting its application to the qualitative and quantitative assessment of collagen type I and type III in tendon. J Histochem Cytochem. 69 (10), 633-643 (2021).
- Junqueira, L. C. U., Bignolas, G., Brentani, R. R. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 11 (4), 447-455 (1979).
- Zheng, L., et al. Scar collagen deposition in the airways of allografts of lung transplant recipients. Am J Respir Crit Care Med. 155 (6), 2072-2077 (1997).
- Astbury, S., et al. Reliable computational quantification of liver fibrosis is compromised by inherent staining variation. J Pathol Clin Res. 7 (5), 471-481 (2021).
- Feingold, B., et al. Diffuse myocardial fibrosis among healthy pediatric heart transplant recipients: Correlation of histology, cardiovascular magnetic resonance, and clinical phenotype. Pediatr Transplant. 21 (5), 12986(2017).
- vander Ploeg, E. A., Melgert, B. N., Burgess, J. K., Gan, C. T. The potential of biomarkers of fibrosis in chronic lung allograft dysfunction. Transplant Rev (Orlando). 35 (3), 100626(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon