Method Article
Coloration rouge Picrosirius pour l’évaluation histopathologique semi-quantitative du dépôt de collagène dans des modèles murins de rejet chronique d’allogreffe pulmonaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La coloration Picrosirius Red est une méthode semi-quantitative permettant d’évaluer objectivement le dépôt de collagène dans le remodelage fibrotique pulmonaire murin de manière spatialement résolue. Outre l’évaluation du dépôt total de collagène, la coloration rouge Picrosirius permet de différencier les fibres de collagène de différentes épaisseurs.
Résumé
La fibrose est la caractéristique physiopathologique du rejet chronique après une transplantation pulmonaire et le principal obstacle à la survie à long terme du receveur. Plusieurs modèles de transplantation pulmonaire murine sont disponibles pour l’étude du rejet chronique. Cependant, ils présentent des résultats hétérogènes concernant les modifications fibrotiques du greffon, et l’étendue histologique de la fibrose est principalement rapportée qualitativement. Par conséquent, une approche résolue spatialement qui permet une analyse statistique peut aider à évaluer la fibrose dans ces modèles. Cette étude présente la coloration rouge Picrosirius pour une évaluation semi-quantitative de l’organisation du collagène dans les allogreffes pulmonaires murines et la compare à l’hématoxyline et à l’éosine standard, au trichrome de Masson et aux colorants d’Herovici. La coloration a été réalisée sur des coupes de deux modèles de transplantation murine différents sur la base de mésappariements mineurs et majeurs du complexe d’histocompatibilité (CMH). La méthode a été établie pour l’analyse semi-quantitative de l’organisation du collagène dans des coupes pulmonaires entières. Ainsi, il peut servir d’outil pour des modèles expérimentaux murins de maladies pulmonaires fibrotiques.
Introduction
La transplantation pulmonaire est l’option thérapeutique définitive pour les patients souffrant d’une maladie pulmonaire en phase terminale. Cependant, la survie à long terme est entravée par le rejet chronique, affectant 50 % des receveurs au cours des cinq premières années postopératoires1. Le remodelage fibrotique des petites voies respiratoires et du parenchyme pulmonaire est la caractéristique histologique sous-jacente à la perte progressive de la fonction pulmonaire dans le rejet chronique de l’allogreffe pulmonaire2. Expérimentalement, le rejet chronique d’allogreffe pulmonaire peut être modélisé avec une transplantation pulmonaire orthotopique murine entre des souches de souris non appariées par le CMH. Différentes combinaisons de souches ont été proposées pour obtenir le phénotype du rejet chronique3. Parmi eux, la combinaison de greffe du donneur mineur C57BL/10 et du receveur C57BL/6 est fréquemment utilisée4. Alternativement, les poumons de donneurs BALB/c peuvent être transplantés chez des receveurs C57BL/6 recevant un traitement immunosuppresseur quotidien5. Ces modèles entraînent des degrés histologiquement différents de modifications fibrotiques6. Ces changements sont souvent rapportés qualitativement à l’aide de l’hématoxyline et de l’éosine standard, ainsi que de la coloration trichrome de Masson.
La coloration histologique standard à l’hématoxyline et à l’éosine permet d’avoir une vue d’ensemble de l’échantillon car elle colore les noyaux en bleu, tandis que le cytoplasme et les fibres de collagène apparaissent en rouge. Avec la coloration trichrome de Masson, les noyaux sont colorés en noir, les fibres de collagène sont colorées en vert à bleu et le fond, y compris le cytoplasme, la fibrine et les muscles, est rouge. Étant donné que la coloration trichrome de Masson peut conduire à des valeurs sous-estimées, l’utilisation de la coloration rouge Picrosirius est considérée comme bénéfique7. Picrosirius Red est un colorant anionique linéaire qui s’associe à de longues fibres de collagène cationiques et fournit une coloration rouge riche en contraste. De plus, la coloration rouge Picrosirius améliore la biréfringence naturelle des fibres de collagène sous la lumière polarisée croisée8. De cette façon, l’épaisseur et l’emballage de la fibre de collagène peuvent être évalués. À l’aide d’un filtre polarisant, l’arrière-plan s’assombrit et il devient possible de distinguer l’épaisseur du collagène déposé. Alors que les fibres de collagène épaisses apparaissent rouges, les fibres de collagène minces émergent vertes sous polarisation. Une association directe entre la biréfringence et le sous-type de collagène est fréquemment décrite dans la littérature, la biréfringence rouge étant attribuée au collagène I et la biréfringence verte au collagène III9.
Ce protocole décrit l’utilisation de la coloration Picrosirius Red pour évaluer la fibrose dans les allogreffes de poumon murin. En plus de la coloration histologique conventionnelle, il permet une évaluation semi-quantitative du changement fibrotique dans des modèles murins de rejet chronique, fournit un moyen de distinction entre les fibres de collagène épaisses et fines en une seule coloration, est rentable et est facile à réaliser. Cette méthode peut également être appliquée à d’autres modèles expérimentaux murins caractérisés par un remodelage fibrotique du parenchyme pulmonaire.
Protocole
Tous les protocoles sur les animaux sont conformes aux principes éthiques des 3R pour une recherche animale sans cruauté et ont été approuvés par le comité d’éthique vétérinaire local (Veterinäramt Kanton Zürich, Suisse, numéro d’étude 45/2014). De même, les lecteurs doivent obtenir l’autorisation des institutions compétentes avant d’effectuer toute procédure sur des animaux de laboratoire.
1. Acquisition d’échantillons
- Mener des expériences sur des animaux en fonction des besoins individuels et des approbations éthiques respectives. Un seul microchirurgien effectue toutes les interventions chirurgicales sans temps d’ischémie prolongé supplémentaire.
REMARQUE : Pour une reproduction de nos résultats représentatifs, procurez-vous des souris adultes mâles C57BL/6J, C57BL/10J et BALB/c de 27 à 30 g provenant des Laboratoires Charles River. Pour les isogreffes, utilisez des animaux C57BL/6J comme donneurs et receveurs. Dans le modèle légèrement incompatible, transplantez des poumons de donneurs C57BL/10J à des receveurs C57BL/6J. Dans le modèle principal non apparié, transplanter des poumons de donneur BALB/c à des receveurs C57BL/6J et injecter postopératoirement de la cyclosporine (10 mg/kg/jour) et de la méthylprednisolone (1,6 mg/kg/jour) par voie sous-cutanée tous les jours5. Utilisez une solution saline pour la perfusion et récupérez les poumons après 8 semaines (56 jours). - Pour l’euthanasie, intubez l’animal avec un cathéter de 20G et aérez-le avec de l’O2 complété par 2 à 3 % d’isoflurane. Confirmer une profondeur suffisante de l’anesthésie par l’absence de réponse à un pincement de la patte.
- Effectuez une laparosténotomie médiane en incisant la paroi abdominale avec des ciseaux chirurgicaux et en coupant la longueur du sternum pour exposer le cœur. Identifiez la veine cave inférieure et l’appendice auriculaire gauche par leur emplacement anatomique.
- En succession rapide, coupez la veine cave inférieure et l’appendice auriculaire gauche avec des ciseaux chirurgicaux et perfuser l’animal avec 3 à 5 ml de NaCl à 0,9 % à travers la racine de l’artère pulmonaire avec une seringue pour éliminer tout le sang de la circulation pulmonaire.
REMARQUE : L’euthanasie doit être pratiquée conformément à l’approbation éthique respective. D’autres méthodes peuvent également être appliquées. Il est recommandé d’éliminer complètement le sang de la circulation pulmonaire, ce qui peut également être effectué par perfusion après un arrêt circulatoire. - Retirez les poumons perfusés à l’aide de ciseaux.
- Pour la conservation, incubez les échantillons dans du formol à 4 %. Injectez la solution de formol directement dans les bronches et le système vasculaire pulmonaire. Immergez les échantillons dans du formol et laissez-les incuber pendant au moins 6 h.
REMARQUE : Pour le gonflage du poumon avec du formol, une procédure standardisée doit être appliquée pour obtenir des résultats comparables. Des exemples de protocoles pour de telles procédures sont publiés ailleurs10,11. - Taillez l’orgue selon les besoins expérimentaux. Coupez transversalement les poumons en deux pour capturer toutes les parties de l’arbre bronchique en une section.
- Transférez les échantillons vers un processeur automatique de tissus pour la déshydratation dans la séquence alcoolique, en les éclaircissant dans un enrobage de xylol et de paraffine comme suit : 70 % d’éthanol, 70 % d’éthanol, 80 % d’éthanol, 96 % d’éthanol, 100 % d’éthanol (1 h chacun), 100 % d’éthanol, 100 % d’éthanol, de xylol (2 h chacun), de xylol (1 h) et de paraffine 3 fois pendant 2 h.
- Faites fondre la paraffine et incorporez des échantillons dans le bon sens dans des cassettes d’enrobage de polyoxyméthylène. Prenez soin d’encastrer les échantillons avec la surface coupée vers le bas. À l’aide d’un microtome rotatif, coupez des sections de 5 μm consécutives. Laissez sécher les lames pendant 24 h à 37 °C avant de poursuivre le traitement.
2. Déparaffinisation et hydratation des lames de paraffine
- Retirez la paraffine en incubant les échantillons 2x dans du xylol à 100 % pendant 5 min chacun.
ATTENTION : Le xylol est inflammable et dangereux pour la santé. Utiliser uniquement sous la hotte. - Hydratez les échantillons dans 100 % d’éthanol, 100 % d’éthanol, 95 % d’éthanol, 70 % d’éthanol et 50 % d’éthanol pendant 2 minutes chacun. Ensuite, laver pendant 2 min dans de l’eau distillée.
3. Coloration au rouge Picrosirius
- Tache en lames pendant 8 min dans la solution d’hémalum de Meyer. Lavez les lames pendant 10 minutes sous l’eau courante du robinet.
- Incuber les lames pendant 1 h dans la solution Picrosirius Red. Pour une solution de Picrosirius Red, utilisez soit une solution de coloration prémélangée, soit utilisez 0,1 % de Direct Red 80 ou de Sirius Red F 3B (CI 35780) dilué dans de l’acide picrique saturé.
ATTENTION : L’acide picrique est inflammable et hautement explosif et doit être traité avec soin.
REMARQUE : Il existe de nombreux fournisseurs différents pour les kits de coloration Picrosirius Red disponibles, comme indiqué dans le tableau des matériaux. Soyez conscient des différences de prix et de méthodes de coloration, et respectez toujours les instructions des fournisseurs. Il est recommandé de n’utiliser que des kits de coloration avec l’indice de couleur spécifique pour Sirius Red F 3B (CI 35780). - Trempez les lames 5x-10x dans une solution d’acide acétique (0,5 %). Secouez doucement les lames pour retirer physiquement la solution.
- Déshydratez les lames dans 95 % d’éthanol, 100 % d’éthanol, 100 % d’éthanol, 100 % de xylol et 100 % de xylol pendant 5 minutes chacune.
- Intégrez en ajoutant une goutte de support de montage sur chaque échantillon et recouvrez d’une lamelle. Laissez sécher les lames sous une hotte.
4. Numérisation et traitement de l’image
- Focalisez les échantillons au microscope optique avec un logiciel d’imagerie approprié jusqu’à ce que l’image devienne claire et nette. Ajoutez un filtre polarisant et ajustez le degré de polarisation jusqu’à ce que l’arrière-plan soit complètement sombre ou noir. Lorsque l’arrière-plan est aussi sombre que possible, la polarisation correcte est obtenue.
REMARQUE : Il est également possible de visualiser la coloration Picrosirius Red avec une lumière transmise conventionnelle et sans filtre polarisant. À cette fin, il est recommandé d’utiliser Sirius Red avec Fast Green, car il s’est avéré plus sensible que Sirius Red seul 12,13. Cependant, la microscopie polarisante est nécessaire pour distinguer les fibres de collagène épaisses et fines. - Numérisez tous les échantillons complètement sous un grossissement de 20x et exportez-les comme .tiff. Transfert vers le logiciel Fidji14. Assurez-vous de bien nettoyer les lames à l’avance et d’utiliser des paramètres normalisés concernant le temps d’exposition et l’intensité de la source lumineuse.
- Entourez l’échantillon manuellement et découpez-le dans le logiciel à l’aide de Modifier > Effacer l’extérieur. Mesurez la surface totale en cliquant sur Analyser > Mesurer.
REMARQUE : La sélection du compartiment à mesurer est une étape critique dans la création de résultats fiables et comparables. En numérisant et en sélectionnant l’ensemble de l’échantillon, une bonne section transversale est affichée et les tissus hétérogènes sont considérés comme un tout. Cependant, il est également possible de se limiter à des zones spécifiques des échantillons, telles que la plèvre ou les bronches individuelles. Gardez à l’esprit de toujours sélectionner les compartiments à comparer de manière standardisée. Si les échantillons présentent une grande variabilité de la ventilation, il est conseillé d’exclure la zone de l’espace aérien du compartiment analysé15. - Mesurez la teneur totale en collagène par échantillon à l’aide du seuil de couleur en cliquant sur Image > Ajuster > seuil de couleur et ajustez les paramètres en cliquant sur Analyser > Analyser les particules. Définir la taille = 1 - Infini, Effacer, Résumer. Luminosité = 35 - 255. Teinte = 2 - 130
REMARQUE : Un réglage raisonnable des seuils de couleur est essentiel pour obtenir des résultats fiables. - Répétez l’opération pour les fibres de collagène épaisses et fines en ajustant la teinte comme les fibres de collagène épaisses rouges
 (teinte 2-30) et les fibres de collagène minces jaune-vert
(teinte 2-30) et les fibres de collagène minces jaune-vert  (teinte 31-130). Le résultat sera la zone des pixels tachés.
(teinte 31-130). Le résultat sera la zone des pixels tachés. - Configurez la macro pour le traitement automatisé en cliquant sur Plug-ins > Macros > Enregistrer et répéter l’opération avec tous les échantillons.
- Pour obtenir des valeurs finales normalisées en fonction de la surface de la section efficace, divisez la surface des pixels colorés pour tous les paramètres par la surface totale mesurée aux étapes 4.3 et 4.5 pour chaque échantillon, respectivement.
Résultats
Le protocole décrit ci-dessus permet une évaluation semi-quantitative objective du dépôt de collagène dans le tissu pulmonaire murin. Le remodelage fibrotique est la marque physiopathologique du rejet chronique après une transplantation pulmonaire. Par conséquent, la coloration Picrosirius Red a été appliquée dans des modèles de rejet d’allogreffe pulmonaire chronique à l’aide d’une transplantation pulmonaire orthotopique murine gauche. La transplantation pulmonaire majeure non compatible avec le CMH d’un donneur BALB/c à un receveur C57BL/6 sous immunosuppression légère entraîne des modifications fibrotiques comparables à un dysfonctionnement chronique de l’allogreffe pulmonaire humaine5. En revanche, la transplantation mineure de CMH non compatible d’un donneur C57BL/10 à un receveur C57BL/6 entraîne principalement une bronchiolite lymphoïde6. La figure 1 illustre en détail la configuration expérimentale.
La figure 2 donne un aperçu des images représentatives des poumons gauches transplantés des deux modèles ainsi que d’une isogreffe C57BL/6J. La coloration au trichrome16 de Masson, au17 d’Herovici et au rouge18 de Picrosirius illustre le dépôt important de collagène péribronchique et périvasculaire dans le principal modèle non apparié du CMH (modèle 1, figure 2B, D). En revanche, le modèle peu apparié (modèle 2) montre principalement des infiltrats lymphocytaires denses, comme en témoigne la coloration à l’hématoxyline et à l’éosine (figure 2F) et un dépôt de collagène moins intense (figure 2G-J). Dans la coloration rouge Picrosirius, l’ajout du filtre polarisant révèle un aspect principalement vert des fibres déposées sur les deux modèles (Figure 2E,J). Dans les contrôles isogreffes, la présence de collagène est limitée aux bords péribronchiques et périvasculaires directs (Figure 2K-O), similaire à la structure des poumons murins naïfs (Figure 3).
Les poumons gauches naïfs des animaux BALB/c et les poumons droits des receveurs C57BL/6J ne présentent qu’une fine paroi de collagène le long des bords péribronchique et périvasculaire (Figure 3).
L’analyse d’images numériques de coupes pulmonaires entières colorées au Picrosirius Red a révélé une présence accrue de collagène total dans les greffons pulmonaires dans le modèle majeur non apparié du CMH par rapport aux greffons du modèle mineur non apparié (p = 0,0038), du tissu pulmonaire naïf du côté droit (p = 0,0006) ou des poumons gauches naïfs BALB/c (p = 0,0003, ANOVA à un facteur, test de comparaisons multiples de Tukey, Figure 4A). Pour les fibres de collagène épaisses, qui apparaissent rouges sous une lumière polarisée, les différences entre les groupes n’ont pas pu être mises en évidence (p=0,5512, ANOVA à un facteur, Figure 4B). Cependant, l’analyse de fibres minces de collagène d’apparence verte sous lumière polarisée a révélé une présence accrue dans le modèle majeur non apparié par rapport au modèle mineur non apparié (p = 0,0005), au tissu pulmonaire droit naïf (p<0,0001) ou aux poumons BALB/c gauche naïfs (p<0,0001, ANOVA à un facteur, test de comparaisons multiples de Tukey, Figure 4C).

Figure 1 : Vue d’ensemble de la conception expérimentale. Une transplantation orthotopique du poumon gauche a été réalisée à l’aide d’une combinaison de souches majeures (modèle 1) et mineures non appariées (modèle 2). Les receveurs d’un greffon majeur non compatible du CMH ont reçu une immunosuppression quotidienne avec 10 mg/kg de cyclosporine et 1,6 mg/kg de méthylprednisolone par injection sous-cutanée. Tous les animaux receveurs ont été euthanasiés huit semaines (jour 56) après l’opération. Le tissu pulmonaire a été traité par fixation au formol, enrobage de paraffine et sectionnement. Des coupes consécutives ont été colorées à l’hématoxyline et à l’éosine (H&E), au trichrome de Masson (MTC), à l’herovici et au rouge Picrosirius (PSR). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images représentatives de la région péribronchiovasculaire dans les poumons transplantés. (A-E) Le modèle 1 majeur non apparié par le CMH entraîne une fibrose péribronchique et périvasculaire, comme en témoignent le trichrome de Masson (MTC), la coloration d’Herovici et le rouge de Picrosirius (PSR). Cela se reflète également dans l’ajout du filtre de polarisation (PSR (pol)). (F-J) Le modèle 2 mineur non apparié par le CMH présente des infiltrats lymphocytaires péribronchiovasculaires proéminents, comme le démontre la coloration à l’hématoxyline et à l’éosine (H&E). Les colorations MTC et PSR ne montrent qu’une étendue limitée de dépôt de collagène dans ce modèle. (K-O) Dans les contrôles isogreffes, le dépôt de collagène est limité aux régions péribronchiovasculaires directes. Les infiltrats lymphocytaires sont rares. Veuillez cliquer ici pour voir une version agrandie de cette figure.
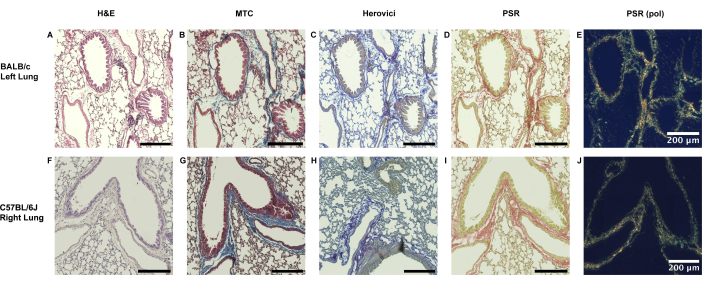
Figure 3 : Étendue physiologique de la présence de collagène péribronchiovasculaire dans les poumons murins. (A-E) La présence de collagène dans le tissu pulmonaire murin est physiologique dans une certaine mesure sans dépendance majeure à la souche. Dans les poumons BALB/c naïfs du côté gauche, tels qu’utilisés pour le modèle majeur non apparié (modèle 1), une fine muqueuse de collagène peut être observée dans la région péribronchiovasculaire, comme en témoignent le trichrome de Masson (MTC), la coloration d’Herovici et le rouge Picrosirius (PSR). (F-J) De même, une muqueuse de collagène limitée à la bordure péribronchiovasculaire directe est observée dans les poumons droits controlatéraux du receveur C57BL/6J. Abréviations : H&E = coloration à l’hématoxyline et à l’éosine ; PSR (pol) = Coloration rouge Picrosirius après ajout du filtre polarisant. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : La coloration rouge Picrosirius sous lumière polarisée révèle un dépôt accru de fines fibres de collagène dans le principal modèle de transplantation murine non apparié par le CMH. Analyse d’images de coloration polarisée Picrosirius Red sur toute la surface des sections pulmonaires transversales. (A) L’analyse du dépôt total de collagène révèle une augmentation du dépôt de collagène dans le modèle majeur non apparié par rapport aux allogreffes mineures non appariées, aux poumons récepteurs controlatéraux ou aux greffes naïves de poumon gauche BALB/c. (B) Aucune différence significative n’a été observée entre les groupes en ce qui concerne les fibres de collagène épaisses. (C) L’analyse de la présence de fibres minces de collagène révèle une augmentation du dépôt dans les allogreffes majeures non appariées par rapport au groupe peu apparié, aux poumons récepteurs controlatéraux ou aux greffes naïves de poumon gauche BALB/c. Les graphiques montrent la moyenne ± l’erreur type de la moyenne, l’ANOVA à un facteur, les comparaisons multiples de Tukey utilisées pour la signification, * p < 0,05, ** p < 0,005, *** p < 0,0005, **** p < 0,0001, ns non significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les méthodes histologiques standard telles que l’hématoxyline et l’éosine, ainsi que la coloration trichrome de Masson sont largement utilisées pour détecter les changements fibrotiques dans les poumons murins de manière résolue spatialement16,19. Cependant, des méthodes supplémentaires sont souvent nécessaires pour quantifier ces changements et évaluer la composition en collagène des tissus.
La coloration rouge Picrosirius a été décrite pour la première fois en 1964 pour identifier le collagène : sous microscopie à lumière transmise, le collagène apparaît rouge tandis que les muscles et le cytoplasme émergent jaune18. L’insertion d’un filtre polarisant en avant et l’exploitation de la biréfringence ont permis de différencier l’épaisseur des fibres de collagène. La corrélation entre la teinte fibrillaire et l’épaisseur des fibres de collagène a été démontrée à plusieurs reprises depuis et est fréquemment utilisée pour évaluer la teneur totale en collagène et estimer les sous-types de collagène dans le remodelage fibrotique 9,20,21,22,23,24,25. Cependant, des études plus récentes remettent en question l’association directe du sous-type de collagène et de la teinte26,27. Par conséquent, il est préférable de faire preuve de prudence dans l’épaisseur des fibres de collagène plutôt que d’inférer directement la discrimination des sous-types de collagène.
La coloration du collagène avec Picrosirius Red et l’utilisation de la microscopie polarisante permettent de localiser les composants tissulaires contenant des molécules de collagène28. Par rapport à d’autres méthodes de coloration du collagène comme le trichrome de Van Gieson ou le trichrome de Masson, il permet également de visualiser des fibres de collagène très fines7, qui apparaissent principalement lors de la fibrose dans le rejet d’allogreffe29. De plus, il permet la détection quantitative de ces types de fibres en une seule coloration. Cependant, cette méthode ne permet qu’une évaluation semi-quantitative et aucune affirmation absolue. Par conséquent, il est nécessaire de suivre le protocole à la lettre et, dans la mesure du possible, de colorer toutes les sections simultanément. Il en va de même pour les paramètres de microscopie et les options de traitement d’image.
Lors de la sélection du compartiment d’intérêt pour l’évaluation, il est crucial d’utiliser une approche standardisée individuelle. Ce protocole décrit une sélection complète d’échantillons de sections transversales entières. De plus, l’utilisation d’un filtre polarisant circulaire est recommandée, car la polarisation linéaire peut conduire à des valeurs sous-estimées7.
Une simple analyse de coloration peut être réalisée à l’aide du progiciel Fiji disponible gratuitement, comme décrit dans le protocole présenté ici. Cependant, des méthodes plus sophistiquées d’analyse d’images numériques de la coloration ont été décrites dans la littérature et peuvent être utilisées en fonction des besoins de chaque chercheur13,15. Récemment, les outils d’intelligence artificielle se sont intéressés à l’analyse de l’imagerie numérique et pourraient également être formés pour évaluer la coloration rouge30 de Picrosirius.
Le remodelage du tissu fibreux est la caractéristique histopathologique de l’échec chronique de la greffe dans la transplantation d’organe solide. Par conséquent, la coloration rouge Picrosirius peut être une lecture précieuse dans la transplantation expérimentale. En effet, la méthode a été utilisée en clinique pour l’évaluation des biopsies tissulaires chez les receveurs de transplantation cardiaque31. L’utilisation clinique de la coloration rouge Picrosirius dans la transplantation pulmonaire n’a pas été rapportée, même si la détection précoce du dépôt mince de collagène III est considérée comme un biomarqueur potentiel pour le diagnostic CLAD32. Dans les modèles murins précliniques de la maladie, il peut s’agir d’un outil précieux car il permet une évaluation semi-quantitative du dépôt de collagène avec une consommation de tissus relativement faible.
Les résultats représentatifs présentés ici démontrent que l’analyse d’images numériques de la coloration rouge Picrosirius peut montrer le dépôt amélioré de fibres de collagène dans un modèle majeur de rejet chronique après une transplantation pulmonaire orthotopique par rapport à une combinaison de souches mineures et non appariées. Notre groupe a précédemment rapporté cette observation de manière plus descriptive, en s’appuyant sur la coloration trichrome16 de Masson. La coloration rouge Picrosirius, avec l’ajout d’un filtre polarisant, permet une analyse semi-quantitative et un rapport statistique de la modification fibrotique dans les allogreffes pulmonaires. Les principaux avantages de la méthode sont sa simplicité technique et sa faible consommation de tissus, qui sont des aspects importants à prendre en compte lors de la sélection de la méthode de lecture suivant des modèles animaux techniquement complexes, tels que la transplantation de poumon orthotopique murin.
Les chercheurs doivent savoir que même si la coloration a toujours été utilisée pour l’estimation des sous-types de collagène, des publications récentes ont montré que la méthode ne peut pas distinguer de manière fiable les types de collagène I et III27. La méthode peut fournir des informations sur l’organisation du collagène en reflétant l’épaisseur dela fibre 26, elle peut ne pas être suffisante pour une évaluation complète du dépôt de collagène.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Birte Ohm est soutenue par le programme Berta-Ottenstein pour les cliniciens-chercheurs de la Faculté de médecine de l’Université de Fribourg. Steffen U Eisenhardt est professeur Heisenberg à la Fondation allemande pour la recherche (DFG) et a soutenu ce travail avec des subventions personnelles. De plus, nous tenons à remercier Sheena Kreuzaler pour son assistance technique. La figure 1 a été créée avec l’aide de Biorender.com. L’imagerie a été réalisée dans la plateforme Lighthouse, financée en partie par la faculté de médecine de l’Université de Fribourg (numéros de projet 2023/A2-Fol ; 2021/B3-Fol), le DKTK et la DFG (numéro de projet 450392965).
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | Honeywell, Charlotte, USA | 33209 | |
| Axio Observer | Zeiss, Oberkochen, Germany | 4633000956 (serial number) | |
| Coverslip 1.5 | Roth, Karlsruhe, Germany | KCY5.1 | |
| Formaldehyde 37% | Fisher Scientific, Leicestershire, UK | F/1501/PB15 | |
| Meyer's hemalum solution | Merck, Darmstadt, Germany | 109249 | |
| Picrosirius Red Solution | Morphisto, Offenbach am Main, Germany | 13422 | alternatives that can be used: ab150681, abcam, Cambridge, UK; SRS250 ScyTek Laboratories, Logan City US |
| Polarizing filter | Zeiss, Oberkochen, Germany | 000000-1121-813 | |
| Rotary microtome, HistoCore AUTOCUT | Leica, Wetzlar, Germany | 149AUTO00C1, 14051956472 | |
| ROTI Histokitt mounting medium | Roth, Karlsruhe, Germany | 6638.1 | |
| ROTI Plast Paraffin | Roth, Karlsruhe, Germany | 6642.5 | |
| Rotilabo-embedding cassettes, POM | Roth, Karlsruhe, Germany | K113.1 | |
| Superfrost Plus Adhesion Microscope slide | epredia, Portsmouth, UK | J1800AMNZ | |
| Tissue Processor | Leica, Wetzlar, Germany | TP 1020 | |
| Software | |||
| Fiji software version 2.14.0/1.54f | Open Source | ||
| Imaging Software ZEN 3.4.91 | Zeiss, Oberkochen, Germany |
Références
- Weigt, S., DerHovanessian, A., Wallace, W., Lynch, J., Belperio, J. Bronchiolitis Obliterans Syndrome: The Achilles' heel of lung transplantation. Semin Respir Crit Care Med. 34 (3), 336-351 (2013).
- Verleden, G. M., et al. Chronic lung allograft dysfunction: Definition, diagnostic criteria, and approaches to treatment-A consensus report from the Pulmonary Council of the ISHLT. J Heart Lung Transplant. 38 (5), 493-503 (2019).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), e93121(2017).
- Martinu, T., et al. Spectrum of chronic lung allograft pathology in a mouse minor-mismatched orthotopic lung transplant model. Am J Transplant. 19 (1), 247-258 (2019).
- de Vleeschauwer, S., et al. Chronic rejection pathology after orthotopic lung transplantation in mice: The development of a murine BOS model and its drawbacks. PLoS One. 7 (1), e29802(2012).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-An experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Whittaker, P., Kloner, R. A., Boughner, D. R., Pickering, J. G. Quantitative assessment of myocardial collagen with picrosirius red staining and circularly polarized light. Basic Res Cardiol. 89 (5), 397-410 (1994).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Polarization microscopic studies of connective tissue stained with picro-sirius red FBA. Beitr Pathol. 150 (2), 174-187 (1973).
- Junqueira, L. C. U., Cossermelli, W., Brentani, R. Differential staining of collagens type I, II and III by Sirius Red and polarization microscopy. Arch Histol Jpn. 41 (3), 267-274 (1978).
- Davenport, M. L., Sherrill, T. P., Blackwell, T. S., Edmonds, M. D. Perfusion and inflation of the mouse lung for tumor histology. J Vis Exp. (162), e60605(2020).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. (102), e52964(2015).
- Segnani, C., et al. Histochemical detection of collagen fibers by Sirius Red/Fast Green is more sensitive than van Gieson or Sirius Red alone in normal and inflamed rat colon. PLoS One. 10 (12), e0144630(2015).
- Courtoy, G. E., et al. Digital image analysis of Picrosirius Red staining: A robust method for multi-organ fibrosis quantification and characterization. Biomolecules. 10 (11), 1585(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Ségard, B. D., et al. Quantification of fibrosis extend and airspace availability in lung: A semi-automativ ImageJ/Fiji toolbox. PloS. 2 (2), e0298015(2024).
- Zhou, X., Moore, B. B. Lung section staining and microscopy. Bio Protoc. 7 (10), e2286(2017).
- Herovici, C. Picropolychrome: histological staining technic intended for the study of normal and pathological connective tissue. Rev Fr Etud Clin Biol. 8, 88-89 (1963).
- Sweat, F., Puchtler, H., Rosenthal, S. Sirius Red F3BA as a stain for connective tissue. Arch Pathol. 78, 69-72 (1964).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harb Protoc. 2014 (6), 655-658 (2014).
- Montes, G. S., Junqueira, L. C. The use of the Picrosirius-polarization method for the study of the biopathology of collagen. Mem Inst Oswaldo Cruz. 86, Suppl 3 1-11 (1991).
- Rittié, L. Method for Picrosirius Red-polarization detection of collagen fibers in tissue sections. Methods Mol Biol. 1627, 395-407 (2017).
- Diehm, Y. F., et al. Stem cell-enriched hybrid breast reconstruction reduces risk for capsular contracture in a hybrid breast model. Plast Reconstr Surg. 152 (3), 572-580 (2023).
- Rich, L., Whittaker, P. Collagen and Picrosirius Red staining: A polarized light assessment of fibrillar hue and spatial distribution. Braz J Morphol Sci. 22 (2), 97-104 (2005).
- Datar, U. V., et al. Clinicopathologic study of a series of giant cell fibroma using picrosirius red polarizing microscopy technique. Arch Iran Med. 17 (11), 746-749 (2014).
- Nishat, R., Kumar, H. Collagen fibers in oral submucous fibrosis - A polarizing microscopy study using two special stains. Indian J Pathol Microbiol. 62 (4), 537-543 (2019).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. J Histochem Cytochem. 62 (10), 751-758 (2014).
- López De Padilla, C. M. Picrosirius Red staining: Revisiting its application to the qualitative and quantitative assessment of collagen type I and type III in tendon. J Histochem Cytochem. 69 (10), 633-643 (2021).
- Junqueira, L. C. U., Bignolas, G., Brentani, R. R. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 11 (4), 447-455 (1979).
- Zheng, L., et al. Scar collagen deposition in the airways of allografts of lung transplant recipients. Am J Respir Crit Care Med. 155 (6), 2072-2077 (1997).
- Astbury, S., et al. Reliable computational quantification of liver fibrosis is compromised by inherent staining variation. J Pathol Clin Res. 7 (5), 471-481 (2021).
- Feingold, B., et al. Diffuse myocardial fibrosis among healthy pediatric heart transplant recipients: Correlation of histology, cardiovascular magnetic resonance, and clinical phenotype. Pediatr Transplant. 21 (5), 12986(2017).
- vander Ploeg, E. A., Melgert, B. N., Burgess, J. K., Gan, C. T. The potential of biomarkers of fibrosis in chronic lung allograft dysfunction. Transplant Rev (Orlando). 35 (3), 100626(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.
