Method Article
마우스의 심근경색 및 심근 허혈-재관류 손상 유도
요약
여기서는 미세 조작을 통해 좌측 전방 하행 관상동맥의 정밀 결찰에 의해 마우스에서 심근경색 또는 심근 허혈 재관류 손상을 유도할 수 있는 간단하고 재현 가능한 방법을 설명합니다.
초록
급성 심근경색은 사망률이 높은 흔한 심혈관 질환입니다. 심근 재관류 손상은 심장 재흐름의 유익한 효과를 상쇄하고 이차성 심근 손상을 유발할 수 있습니다. 심근 경색 및 심근 허혈 재관류 손상의 간단하고 재현 가능한 모델은 연구자에게 좋은 도구입니다. 여기에서는 미세조작을 통해 좌측 전방 하행 관상동맥(LAD)을 정밀하게 결찰하여 심근경색(MI) 모델 및 MIRI를 생성하는 맞춤형 방법을 설명합니다. LAD의 정확하고 재현 가능한 합자 위치 지정은 심장 손상에 대한 일관된 결과를 얻는 데 도움이 됩니다. ST 세그먼트 변경은 모델 정확도를 식별하는 데 도움이 될 수 있습니다. 심장 트로포닌 T(cTnT)의 혈청 수치는 심근 손상을 평가하는 데 사용되고, 심장 초음파는 심근 수축기 기능을 평가하는 데 사용되며, Evans-Blue/트리페닐 테트라졸륨 클로라이드 염색은 경색 크기를 측정하는 데 사용됩니다. 일반적으로 이 프로토콜은 시술 기간을 단축하고, 제어 가능한 경색 크기를 보장하며, 마우스 생존율을 향상시킵니다.
서문
급성 심근경색(AMI)은 전 세계적으로 흔한 심혈관 질환이며 사망률이 높습니다1. 기술의 발전으로 AMI 환자는 조기에 효과적인 혈관재생술을 받을 수 있습니다. 일부 환자에서 이러한 치료 후 심근 허혈 재관류 손상(MIRI)이 발생할 수 있다2. 따라서 작용 메커니즘과 MI/MIRI를 개선하는 방법을 이해하는 것이 매우 중요합니다. 마우스는 비용이 저렴하고 번식 시간이 빠르며 유전자 변형이 용이하기 때문에 모델로 널리 사용됩니다3. 학자들 은 동물 4,5,6,7,8,9에서 MIRI와 MI를 모델링하는 다양한 방법을 개발했습니다. 이 전략은 연구를 촉진하지만 채택된 다양한 기준과 방법은 연구 팀 간의 결과 해석을 복잡하게 만듭니다.
마우스에서, MI는 이소프로테레놀10, cryoinjury 11,12 또는 소작 13에 의해 유도되었다. MI는 이소프로테레놀에 의해 쉽게 유도될 수 있지만, 병태생리학적 과정은 임상적 MI의 그것과 다릅니다. 극저온손상으로 인한 MI는 일관성이 떨어지고, 좌측 전방 하행 관상동맥(LAD) 주위의 과도한 심근 손상을 유발하며, 부정맥을 쉽게 유발할 수 있습니다. 소작으로 인한 MI는 심근 경색의 자연적인 과정과 상당히 다르며 작열 부위의 염증 반응이 더 강렬합니다. 또한 수술적 접근은 기술적인 어려움이 있습니다. 또한, 중재적 기법을 통한 풍선 차단 또는 색전술 또는 혈전증 방법을 사용하여 미니피그에서 MI 모델을 개발하는 실험실(14)이 있습니다. 이 모든 방법은 관상동맥 폐색을 직접적으로 유발할 수 있지만, 관상동맥 조영술 장치가 필요하고 무엇보다도 쥐의 관상동맥이 너무 얇기 때문에 이러한 수술은 실용적이지 않습니다. MIRI의 경우 호흡기/미세 조작을 사용하거나 사용하지 않는 것과 같이 서로 다른 모델 간의 차이는 매우 미미했습니다 5,6.
여기에서, MI를 유도할 수 있는 간단하고 신뢰할 수 있는 방법과, 이전에 발표된 방법 4,5,6,7,8,9,15로부터 채택된 MIRI 모델을 설명한다. 이 방법은 결찰을 통해 LAD를 직접 봉쇄하여 병태생리학적 과정을 시뮬레이션할 수 있습니다. 또한, 결찰을 완화시킴으로써, 이 모델은 또한 재관류 손상을 시뮬레이션할 수 있다. 이 프로토콜에서는 LAD 시각화를 위해 해부 현미경이 사용됩니다. 그러면 연구자는 LAD를 쉽게 식별할 수 있습니다. 그 후, LAD의 정확한 결찰은 재현 가능하고 예측 가능한 혈액 폐색과 심실 허혈로 이어집니다. 또한 현미경으로 관찰된 LAD의 색 변화 외에도 심전도(ECG) 변화를 사용하여 허혈 및 재관류를 확인할 수 있습니다. 이 전략은 시술 기간을 단축하고 수술 합병증 위험을 낮추며 필요한 실험용 쥐를 줄입니다. 트로포닌-T 검사, 심장 초음파 및 트리페닐 테트라졸륨 클로라이드(TTC) 염색 방법도 설명합니다. 전반적으로 이 프로토콜은 MI/MIR 메커니즘 연구와 약물 발견에 유용합니다.
프로토콜
동물 연구는 Huazhong University of Science and Technology(중국 우한)의 동물 관리 및 활용 위원회의 승인을 받았습니다.
알림: 수컷 C57BL/6J 마우스(8-10주)가 모델로 사용됩니다. 생쥐는 음식과 물에 자유롭게 접근할 수 있으며 특정 병원체가 없는 조건에서 사육됩니다. 실내는 제어된 온도(22°C ± 2°C)와 습도(45%-65%)로 유지됩니다. 생쥐는 이 기관에서 정한 지침에 따라 Tongji Medical School(중국 우한)의 동물 보호 시설에서 12시간 명암 환경에 노출됩니다. 멸균 미세 수술 기구 및 수술 용품을 사용하십시오. 수술 내내 수술용 장갑과 마스크가 필요합니다. 실험 워크플로우는 그림 1A에 나와 있습니다.
1. 수술 전 준비
- 수술 과정 내내 예열된 가열 패드(37°C)가 있는 직사각형 수술대(OT)를 사용하십시오(그림 1B). 절차를 시작하기 전에 자외선과 70% 알코올로 보드를 소독하십시오.
- 필요한 마취제의 투여량을 계산하기 위해 모든 마우스의 무게를 정확하게 측정합니다. 그런 다음 복강 내 주사를 통해 케타민(80mg/kg)과 자일라진(10mg/kg)으로 마우스를 마취합니다. 발가락 꼬집기 및 눈 깜빡임 반사에 대한 금단 반사가 없어 적절한 마취 깊이를 보장합니다.
- 눈이 과열되지 않도록 머리 아래에 거즈를 사용하여 마우스를 OT에 올려놓습니다. 눈이 건조해지는 것을 방지하기 위해 안과 연고를 바르십시오.
- 전기 면도기로 왼쪽 흉부의 털을 면도합니다. 미리 면도한 흉부에 털 제거 크림을 바르고 멸균 면봉으로 ~1분 동안 골고루 마사지합니다. 여분의 느슨한 털을 거즈로 닦으십시오.
- 포비돈 요오드를 사용하고 70% 알코올을 사용하여 해당 부위를 청소하십시오. 거즈로 흉부를 덮으십시오.
- 위쪽 앞니 아래에 4-0 봉합사를 사용하고 앵커 포인트(코 위의 OT 가장자리에 가까움)에 고정하여 입을 약간 벌리고 캐뉼레이션을 용이하게 합니다.
- 꼬리를 당겨 몸체를 똑바로 유지하고 테이프를 사용하여 꼬리를 OT에 고정합니다. 네 개의 팔다리를 고정하고 다른 앵커 포인트에 조입니다. 중요한 것은 앞다리를 과도하게 스트레칭하지 않는 것입니다. 그렇지 않으면 호흡기 손상이 발생할 수 있습니다.
- 구부러진 집게와 집게를 사용하여 턱을 열고 혀를 들어 올립니다. 조명기를 사용하여 목구멍과 성문을 명확하게 시각화합니다.
- 뭉툭하고 잘린 바늘로 22G 캐뉼라를 목구멍 아래 ~1cm의 입을 통해 기관에 부드럽게 삽입합니다. 한 손으로 혀를 잡고 뭉툭한 집게로 혀를 약간 위로 움직인 다음 동시에 다른 손으로 튜브를 기관에 부드럽게 삽입합니다. 튜브를 식도에 삽입하지 않도록 주의하십시오.
- 바늘을 부드럽게 제거하십시오. 인공호흡기에 연결하기 전에 튜브를 물에 넣어 기포가 형성되는지 삽관을 확인하십시오.
- 기관내관을 120/min으로 설정된 인공호흡기에 연결하고 일회 호흡량을 250μL로 조정합니다.
알림: 인공호흡기 설정은 체중에 따라 조정됩니다(일반적으로 체중이 높을수록 더 높은 일회 호흡량이 필요함). - 양측 대칭 흉부 확장을 확인하여 삽관을 확인합니다. 그런 다음 튜브가 떨어지는 것을 방지하기 위해 테이프로 연결을 OT에 고정합니다.
- 발에 ECG 전극을 놓고 ECG 레코더에 연결합니다. 시술 전반에 걸쳐 심장 전기 생리학을 모니터링합니다.
2. 흉곽 절제술
- 흉부의 거즈를 제거합니다. 절개 부위를 70% 알코올로 다시 소독하고 세 번의 스크럽 주기를 사용합니다. 그런 다음 수술 부위의 오염을 줄이기 위해 수술 부위에 구멍이 있는 멸균 수술용 드레이프로 마우스를 덮습니다.
- 멸균 메스로 왼쪽 쇄골 중앙선을 따라 비스듬한 피부 절개(0.8-1.0cm)를 합니다.
- 아래의 갈비뼈를 노출시키기 위해 피하 조직을 둔하게 해부합니다. 혈관, 갈비뼈, 폐를 다치지 않도록 주의하십시오. 멸균 면 어플리케이터를 사용하여 출혈을 멈춥니다.
- 세 번째 늑간 공간을 확인하고 약 6-8mm를 절개합니다. 그런 다음 흉강을 열기 위해 연안 공간에서 조직을 둔기로 절개합니다. 내부 흉부 동맥을 다치지 않도록 주의하십시오.
- 집게를 사용하여 늑간 공간에 걸쳐 있습니다. 사전 멸균된 수제 견인기(그림 1C)를 흉곽에 삽입하고 뒤로 당겨 절개 부위를 너비 ~6mm로 벌립니다. 고무 밴드로 견인기를 OT에 부착합니다.
- 주변 조직을 조심스럽게 제거하여 심장이 완전히 노출되도록 합니다. 심장을 다치게 하지 않고 구부러진 집게로 심낭을 부드럽게 잡아당깁니다. 이제 심장을 선명하게 볼 수 있습니다.
3. LAD 결찰
참고: LAD는 정점 부근에서 좌심실을 통해 수직으로 이어지는 얇은 빨간색 선으로 나타납니다. LAD는 밝은 빨간색이므로 정맥으로 착각하지 않도록 주의하세요. 일반적으로 결찰 부위는 왼쪽 귓바퀴 아래 ~ 1-2mm입니다. 이 결찰 위치는 좌심실에서 허혈의 약 40%-50%를 생성합니다. 위치가 높을수록 더 넓은 경색 영역이 만들어집니다. 더 말단 부위는 더 작은 경색 영역을 만듭니다.
- 해부 현미경을 사용하여 LAD 시각화를 위해 초점이 맞춰진 적절한 조명을 비춥니다. 선택한 결찰 위치 아래의 부위를 부드럽게 눌러 LAD를 일시적으로 확대합니다(시간당 ≤5초). 이 방법으로 LAD를 다시 확인합니다.
- 테이퍼 바늘(3/8, 2.5 x 5)을 사용하여 8-0을 통과합니다. 해부 현미경으로 LAD 아래의 실크 합자. 바늘 깊이에 주의하십시오: 좌심실에 들어가기에는 너무 깊지 않고 LAD가 손상되지 않도록 너무 얕지 않아야 합니다.
- 느슨한 이중 매듭으로 합자를 묶습니다. 루프 직경은 약 2-3mm입니다.
- 2-3mm PE-10 튜브를 동맥과 평행한 루프에 넣습니다.
- 합자 루프가 동맥과 튜브 주위에 올 때까지 부드럽게 조입니다. 그런 다음 슬립 매듭으로 루프를 고정하십시오. 과도한 조임 압력으로 심근 벽이 손상되지 않도록 주의하십시오.
알림: 가짜 수술 그룹에 대해서는 결찰이 수행되지 않습니다. - LAD의 혈류 중단 확인: 결찰 후 LV의 전벽에서 더 옅은 색을 관찰합니다. 또한, 몇 번의 심장 박동 내에서 상당한 ST 상승은 폐색을 나타낸다16. 영구 결찰이 필요한 경우(예: MI) PE-10 튜브를 제거하고 LAD를 매듭으로 직접 묶습니다. 아래 4.3단계에서 설명한 대로 나머지 절차를 다시 시작합니다.
- 절개부에서 견인기를 제거합니다. 그런 다음 불독 클램프로 상처를 일시적으로 봉합합니다. 허혈 지속 시간은 실험 설계에 따릅니다. 마우스가 인공호흡기에 계속 연결되어 있는지 확인합니다.
4. 재관류
- 허혈 기간이 끝나면 불독 클램프를 제거하고 견인기를 다시 삽입하여 절개 부위를 열고 심장 (특히 결찰 부위)을 노출시킵니다.
- 슬립매듭을 풀고 PE-10 튜브를 제거합니다. 이 단계에서 20초 이내에 색상이 다시 분홍색-빨간색으로 변하는 것을 관찰하여 혈류의 회복을 확인합니다. 동시에 ECG를 주의 깊게 관찰하십시오: ST 상승의 잠재적인 용해는 또한 재관류를 시사합니다.
- 8-0을 떠나 후속 Evans-Blue 및 TTC 염색을 위한 합자 in situ . 다른 경우에는 이 단계에서 봉합사를 제거하십시오.
- 견인기를 제거하고 세 번째와 네 번째 갈비뼈를 4-0 나일론 봉합사로 봉합하여 절개 부위를 봉합합니다. 폐를 다치지 않도록 주의하십시오. 봉합사 매듭을 묶으면서 가슴을 부드럽게 눌러 흉강에 갇힐 수 있는 공기를 밀어냅니다.
- 연속 봉합사로 근육층을 닫습니다. 4-0 나일론 봉합사로 피부를 닫으십시오. 연속 봉합사와 중단된 봉합사가 허용됩니다.
5. 수술 후 관리
- 예를 들어 마취에서 회복된 징후가 있는지 쥐를 주의 깊게 관찰하십시오.ample, 꼬리나 수염의 움직임. 그 후 쥐는 일반적으로 약 150bpm의 호흡수로 정상적인 호흡 패턴을 재개합니다. 튜브를 천천히 제거하여 마우스를 발관합니다.
- 호흡 곤란이 없는지 확인하기 위해 추가로 3-5분 동안 마우스를 모니터링합니다.
- 생쥐가 숨을 쉬기 시작한 후 100μL의 부프레노르핀(0.1mg/mL, s.c.)을 투여합니다. 다음 24시간 동안 4-6시간마다 추가 용량을 제공하십시오. 이부프로펜을 식수에 0.2mg/mL 용액으로 넣어 수술 전 2일, 수술 후 ≤7일 동안 추가로 진통제로 투여합니다.
- 쥐는 마취 후 저체온증에 걸리기 쉽기 때문에 단열 담요를 사용하여 쥐를 따뜻하게 유지하고 사망 위험을 줄입니다.
6. 시술 후 유효성 검사
- 트로포닌-T 테스트
- 후안와신경총에서 혈액 샘플을 채취하고 원심분리(3,000× g, 10분, 실온)를 통해 혈청을 분리합니다.
- 트로포닌-T 검사를 위해 식염수로 혈청 20μL를 100μL로 희석합니다. 나머지 샘플은 -80 °C에 보관합니다.
- 제조업체의 지침에 따라 상용 키트를 사용하여 트로포닌 T(cTnT)를 감지합니다.
- 심장 초음파
참고: 심장 초음파는 실험 설계17,18에 따라 수술 전후의 여러 단계에서 심장 기능 및 벽 운동 이상을 평가하는 데 사용됩니다. 심실 벽 두께, 심실 용적, 심실 공동 직경, 박출률 및 단축 단축 분율과 같은 다양한 파라미터가 측정됩니다.- 복강 내 주사를 통해 케타민(80mg/kg)과 자일라진(10mg/kg)으로 마우스를 마취합니다.
- 전기 면도기로 가슴을 면도하십시오. 털 제거 크림을 바르고 골고루 마사지하십시오. 여분의 느슨한 털을 거즈로 닦으십시오.
- 마우스를 OT에 놓고 접착 테이프로 네 개의 팔다리를 고정합니다.
- 초음파 프로브(30MHz)를 흉골까지 ~ 30°의 심장 전방 영역에 놓습니다. 이 보기의 프로브는 심장의 긴 축과 정렬되어 있습니다. 초음파를 B-모드로 설정합니다. 좌심실, 좌심방, 승모판막, 상행 대동맥을 명확하게 확인할 수 있습니다. 비디오 캡처를 사용하여 후속 분석을 위한 데이터를 얻습니다.
- 변환기를 시계 방향으로 90° 회전하여 유두근 수준에서 흉골 주위 단축 보기를 얻어 좌심실과 우심실을 명확하게 감지합니다. 그런 다음 B-모드 및 M-모드를 사용하여 심장 기능 및 형태 측정을 평가합니다.
- 초음파 영상에서 해당 위치를 지정하여 좌심실 이완기 끝 직경(Dd), 수축기 말단 직경(Ds) 및 심실 중격 두께를 계산합니다.
알림: 기계는 좌심실 이완기 말기 용적(LVEDV) 및 수축기 말기 용적(LVESV)을 수동으로 계산합니다. 또한 기계는 FS = (Dd-Ds)/Dd × 100% 및 EF= (LVEDV-LVESV)/LVEDV × 100% 공식을 사용하여 분수 단축(FS) 및 취출률(EF) 값을 계산합니다. 5개의 연속된 심장 주기를 선택하고 평균값을 구합니다.
- 심근 경색 크기 측정
참고: Evans-Blue/TTC 염색은 조직 생존율을 평가할 수 있기 때문에 경색 크기를 측정하는 데 사용된다19. 흉터가 줄어들기 때문에 재관류 후 72시간 이내에 염색하는 것이 좋습니다. 이 단계는 복강 내 주사를 통해 200mg/kg 펜토바르비탈 나트륨으로 동물을 안락사시킨 후 수행됩니다.- 2.2-2.5단계의 이전 절차에 따라 심장을 다시 노출합니다. 그런 다음 원하는 재관류 기간이 끝날 때 4.3단계에서 언급한 봉합사로 검증된 초기 부위에서 LAD를 다시 결찰합니다.
- 대동맥을 캐뉼레이션한 다음 1% Evans Blue 용액 0.3mL를 심장에 관류합니다. 비허혈성 부위의 심근은 파란색으로 염색되어 있습니다. 관류 후 가위로 대동맥을 잘라 심장을 빠르게 제거합니다.
- 그런 다음 KCl 용액(30mM)으로 심장을 씻어 심장 박동을 멈춥니다. -20°C에서 주변 지방 조직을 제거한 후 ≥4시간 동안 보관하십시오.
- 날카로운 메스를 사용하여 가로 방향으로 심장을 1mm 두께의 5 조각으로 자릅니다. 슬라이스의 무게를 잰 다음 37°C에서 40분 동안 2% TTC로 배양합니다.
참고: 배양 후 경색 부위는 흰색으로 구분되는 반면 비경색 부위의 생존 가능한 조직은 빨간색으로 유지됩니다. - 밤새 4% 포름알데히드로 조각을 고정합니다.
알림: 이 작업은 경색 영역과 비경색 영역 사이의 대비를 향상시킵니다. 또한 슬라이스가 축소됩니다. - 디지털 카메라로 슬라이스를 촬영합니다. 그런 다음 그래픽 소프트웨어를 사용하여 위험 영역(AAR), 경색 영역 및 비허혈 영역을 계산합니다.
알림: Evans-Blue/TTC 이중 염색 후 파란색 영역은 "정상" 영역입니다. 나머지 영역(흰색 및 빨간색 포함)은 "허혈 위험" 영역입니다: 흰색 영역은 심근 경색 영역(IA)이고 빨간색 영역은 허혈성(경색이 아닌) 영역입니다. 심장 절편 크기의 불일치를 고려하여 결과는 무게에 맞게 조정됩니다.
할당하다:
A1-A5 경색 영역 영역 / 심장 절편 영역;
B1-B5 비경색 영역 / 심장 절편 영역;
W1-W5 : 하트 슬라이스의 무게.
그러면:
경색 심근의 총 무게 : A1 × × A1 + W2 A2 + W3 × A3 + W4 × A4 + W5 × A5;
경색되지 않은 심근의 총 무게: W1 × B1 + W2 × B2 + W3 × B3 + W4 × B4+ W5 × B5;
AAR의 총 중량 = (W1 + W2 +W3 + W4 + W5) - (W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5)
마침내:
심근 허혈의 면적은 좌심실의 AAR 비율로 계산됩니다.
심근 경색 면적은 AAR에서 IA의 백분율로 계산됩니다.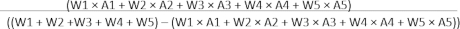
결과
실험 워크플로우는 그림 1A에 나와 있습니다. 연구자는 연구 시작 시 실험 설계에 따라 시간 노드를 예약할 수 있습니다. LAD 결찰 기간은 연구 목적에 따라 다릅니다. MI의 경우 연구는 재관류 단계를 무시할 수 있습니다. 심장 초음파는 비침습적이기 때문에 연구의 여러 단계에서 사용할 수 있는 반면, Evans-Blue/TTC 염색은 마우스를 희생한 경우에만 수행할 수 있습니다. 섬유증 및 심실 리모델링에 중점을 둔 연구의 경우 관찰 시간이 훨씬 더 깁니다.
실험 과정의 일부에 대한 일반적인 이미지는 기관 내 삽관, 피부 절개, 개흉술, LAD 식별, LAD 결찰에서 재관류에 이르기까지 그림 2A에 나와 있습니다. 심근 허혈 및 재관류를 확인하기 위해 결찰 후 상당한 ST 상승 및 슬립매듭이 풀렸을 때 ST 상승이 용해된 대표적인 ECG 이미지가 그림 2B에 나와 있습니다.
모든 쥐에서 혈액 샘플을 채취한 후 트로포닌-T 검사를 통해 경색을 확인할 수 있습니다. 그림 3A 는 가짜 그룹과 비교할 때 MIRI 및 MI 그룹에서 cTnT가 크게 증가했음을 보여줍니다. 그림 3B 는 가짜 그룹과 MIRI 그룹 사이의 심장의 5개 연속 횡절편에 대한 Evans-Blue 및 TTC의 이중 염색을 보여줍니다. 파란색 영역은 정상 영역, 흰색 영역은 심근 경색 영역, 빨간색 영역은 허혈성 영역이지만 경색이 없는 영역을 나타냅니다. 그림 3C 는 가짜 그룹과 MI 그룹 사이의 심장 초음파의 장축 이미지를 나타냅니다. 소프트웨어 응용 프로그램을 사용하여 MI 그룹과 비교하여 그림 3C 의 가짜 그룹에 대한 더 높은 박출률 값과 같은 다양한 기능 파라미터를 계산할 수 있습니다.

그림 1: 수술 설정. (A) 실험 타임라인의 개요. (B) 예열된 가열 패드와 ECG 전극 연결이 있는 수술대. (C) 수제 견인기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
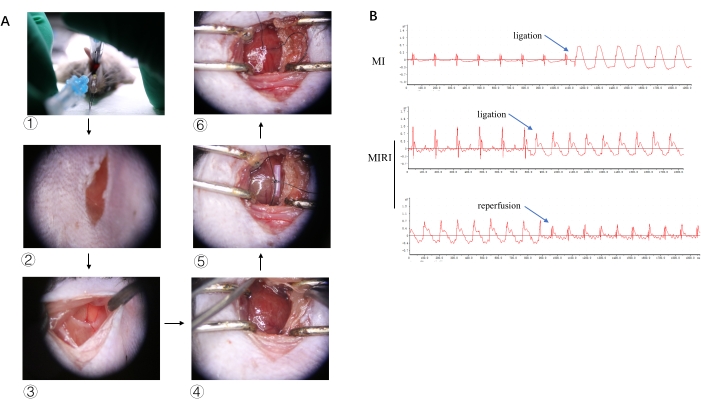
그림 2: 실험 과정 및 ECG 변화. (A) 기관내 삽관, 피부 절개, 개흉술, LAD 식별, LAD 결찰 및 재관류의 이미지는 각각 1, 2, 3, 4, 5 및 6에 나와 있습니다. (B) 결찰 및 재관류 후 MI 및 MIRI의 일반적인 ECG 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
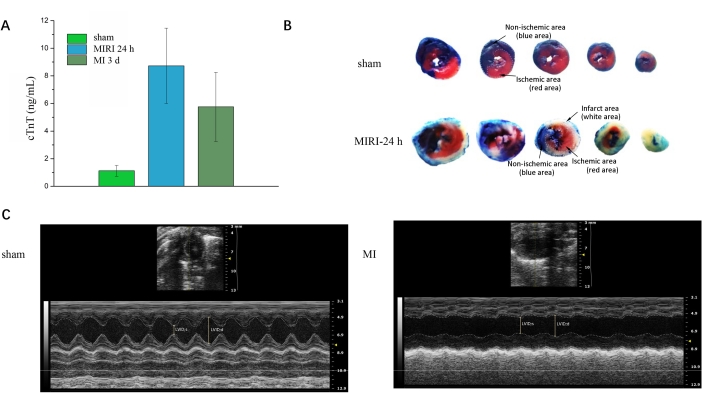
그림 3: 절차 후 유효성 검사. (A) 가짜, MIRI 24 h 및 MI 3 d 그룹 중 심장 트로포닌의 발현. (B) Evans - 가짜 및 MIRI 24시간 그룹에 대한 파란색/TTC 이중 염색. (C) 가짜 및 MI 그룹에 대한 심장 초음파. 위위; d, 이완기 말기 좌심실 내부 치수; 위위; S, 수축기 좌심실 내부 치수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
최근 몇 년 동안 임상 및 과학 연구에서 MI 및 MIRI에 대한 모델 생성이 빠르게 발전했습니다20,21. 그러나 행동 메커니즘 및 MI/MIRI를 개선하는 방법과 같이 해결해야 할 몇 가지 질문이 여전히 남아 있습니다. 여기서, MI 및 MIRI의 뮤린 모델을 확립하기 위한 수정된 프로토콜이 설명된다. 몇 가지 핵심 사항을 신중하게 고려해야 합니다.
첫 번째 요점은 기관내 삽관입니다. 일부 시술(6,9)은 자궁경부 피부를 절개하고, 조직을 분리한 다음, 흉골 근육을 노출시켜 기관을 관찰하는 것이다. 이러한 방식으로 연구원은 기관으로의 튜브 삽입을 시각화할 수 있습니다. 이것은 호흡 곤란의 위험을 줄이기 위한 좋은 단계입니다. 현재 방법에서 연구원은 조명기 아래에서 호흡으로 성문이 닫히고 열리는 것을 명확하게 시각화한 다음 튜브를 기관에 쉽게 삽입할 수 있습니다. 따라서 자궁경부 절개는 염증 신호 연구에서 중요한 피부 외상과 잠재적 감염을 줄이기 위해 이루어지지 않습니다. 시각 후두경은 임상 기관 삽관에 널리 사용되며, 생쥐에서도 사용할 수 있습니다. Mares et al.22는 동물의 코와 입에 놓인 비침습적 마스크를 통해 산소를 투여하여 5% 이소플루란 유도 후 2% 이소플루란 흡입에 의해 수행된 기관내 삽관 없이 연속 마스크 흡입 마취를 보고했습니다. 조직 손상을 방지하고 마취의 안전성과 효율성을 향상시킬 수 있습니다. 그러나 특수 흡입 마취 기계가 필요합니다. 또한 휘발성 마취제는 작업자에게 신체적 상해를 입힐 수 있습니다.
두 번째이자 가장 중요한 핵심 포인트는 LAD의 식별 및 결찰입니다. LAD 식별 및 결찰에서 실수할 때마다 일관성 없는 결과가 발생합니다: 너무 큰 경색 크기는 사망을 초래하거나 너무 작은 경색 크기는 실패를 초래합니다. LAD를 식별하고 결찰을 확인하기 위해 다양한 방법을 적용할 수 있습니다. 여기에서 해부 현미경을 사용하여 LAD를 찾습니다. LAD는 일반적으로 정점 부근에서 좌심실을 통해 수직으로 이어지는 얇은 빨간색 선으로 나타납니다. 선택한 결찰 위치 아래의 부위를 부드럽게 눌러 LAD를 일시적으로(시간당 ≤5초) 확대하면 LAD를 다시 확인할 수 있습니다. 결찰 후 LAD 폐색은 좌심실 전벽의 옅은 색과 몇 번의 심장 박동 내에 상당한 ST 상승으로 확인됩니다. 그런 다음 결찰이 풀리고 20초 이내에 다시 분홍색-빨간색으로 색상이 변경되고 ECG 시 ST 상승이 용해될 수 있으므로 재관류가 검증됩니다. 마지막으로 트로포닌-T 검사, TTC 염색 및 심장 초음파를 사용하여 심근 손상을 평가합니다. 이러한 여러 보험과 상호 검증을 통해 실험 결과의 신뢰성이 높습니다. 또한 미세 조작은 더 높은 정확도와 더 적은 합병증(예: 출혈)을 유도합니다. 또 다른 중요한 문제는 쥐의 혈관이 정상이라는 가정이지만 실제로 일부 관상 동맥은 크게 다르며 측부 순환조차도23,24를 나타낼 수 있습니다. 따라서 경색 크기는 결찰이 동일한 수준으로 간주되더라도 일정하지 않은 경우가 있습니다. 현미경의 장점이 여기에 전시되어 있습니다. 결찰은 경험이나 해부학적 특징만으로 수행할 수 없습니다: 결찰 전에 LAD와 그 방향을 명확하게 확인해야 하며, 그렇지 않으면 결과를 신뢰할 수 없습니다. 일부 실험6,8에서, 마우스는 심장 노출 후 좌심실 및 관상 동맥의 전벽을 관찰하는 편의를 위해 오른쪽 측면 욕창 위치에 있습니다.
이 모델에는 두 가지 주요 제한 사항이 있습니다. 첫째, LAD 결찰술은 우측 관상동맥의 폐색을 시뮬레이션할 수 없습니다. 실제로, 동물 간의 해부학적 차이로 인해(25), LAD는 일반적으로 생쥐와 쥐에서 심장의 정점까지 확장되며, 좌측 곡절 가지는 발달하지 않았으므로, 생쥐와 쥐의 모델은 LAD 결찰에 의해 확립된다. 토끼 및 돼지와 같은 대형 및 중형 동물의 경우 LAD가 상대적으로 짧은 반면 좌측 곡절 동맥은 심장의 넓은 영역을 덮기 때문에 모델을 설정하기 위해 좌측 곡절 동맥의 결찰을 선택합니다. Sicard et al.26 은 생쥐의 우측 관상동맥을 결찰하여 우심실 기능 장애 및 양심실 상호작용을 조사하는 새로운 방법을 보고했으며, 이는 이러한 한계를 해결할 수 있습니다. 두 번째 한계는 관상동맥 해부학적 구조의 가변성과 외과의사의 경험으로 인한 경색의 크기가 일정하지 않다는 것이다27 . 위에서 논의한 바와 같이 현미경은 결찰 전에 LAD와 그 방향을 확인하여 일관성을 높이는 데 매우 중요하며, 숙련된 연구자의 경우 혈관 해부학을 완전히 평가한 후 결찰 위치를 조정할 수 있습니다.
언급할 가치가 있는 몇 가지 다른 문제가 있습니다. 예를 들어, 개흉술과 바늘 피어싱은 필연적으로 근육과 심근에 약간의 손상을 일으켜 염증에 영향을 미칠 수 있습니다. 또한, 진통제는 MI28에 영향을 미치는 것으로 보고되었다. 따라서 염증이나 MI에 미치는 영향을 분석할 때 이러한 요인을 고려해야 합니다. 문제 해결을 위해 쥐를 죽일 수 있는 몇 가지 요인이 있습니다. 예를 들어, 심근 경색, 마취 사고 및 출혈과 관련된 합병증이 있습니다. 더욱이, 일관성 없는 결과는 주로 부적절한 결찰 위치에서 비롯됩니다: 너무 높은 결찰 위치는 생쥐 심지어 너무 큰 경색 크기를 유도할 것입니다. 한편, LAD의 잘못된 식별은 모델 실패를 초래할 수 있습니다. 이 방법에서는 몇 가지 세부 사항을 개선해야 합니다. 예를 들어, 시술 중 온도를 모니터링하기 위해 직장 프로브를 삽입할 수 있다면 더 좋을 것입니다. 마지막으로, 실험자는 동물 연구와 임상 현실의 차이점, 특히 30분 허혈 시간이 임상에 매우 짧다는 점을 명심해야 합니다. 연구자는 허혈 시간을 포함하여 실험 설계에 따라 단계를 정렬하는 것이 좋습니다. 이러한 방식으로만 이 프로토콜은 MI/MIRI 및 약물 발견의 메커니즘 및 치료 연구에 유용할 수 있습니다.
요컨대, MIRI 및 MI에 대한 간단하고 생식적인 쥐 모델이 제공됩니다. 이 모델은 MI/MIRI 메커니즘 연구 및 치료 연구에 사용할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (82070317, Jibin Lin, 81700390 8210021880 Bingjie Lv, Boyuan Wang 82000428)과 중국 국가 핵심 R & D 프로그램 (2017YFA0208000에서 Shaolin He)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9 % sodium chloride solution | Kelun Industry Group,China | - | |
| 4% paraformaldehyde fixing solution | Servicebio,China | G1101 | - |
| 4-0 silk suture | Shanghai Pudong Jinhuan Medical Products,China | C412 | - |
| 8-0 suture | Shanghai Pudong Jinhuan Medical Products,China | H801 | - |
| Buprenorphine | IsoReag,China | IR-11190 | - |
| Camera | Canon,Japan | EOS 80D | - |
| Depilatory cream | Veet,French | - | |
| Elecsys Troponin T hs STAT | Roche,Germany | - | |
| Electrochemical luminescence immunoanalyzer | Roche,Germany | Elecsys 2010 | - |
| Evans blue | Sigma,America | E2129 | - |
| Eye scissors | Shanghai Medical Instruments,China | JC2303 | - |
| Haemostatic forceps | Shanghai Medical Instruments,China | J31020 | - |
| High frequency in vivo imaging systems | Visualsonics,Canada | Vevo2100 | - |
| Ibuprofen | PerFeMiKer,China | CLS-12921 | - |
| Intravenous catheter | Introcan,Germany | 4254090B | - |
| Ketamine | Sigma-Aldrich,America | K2753 | - |
| Medical alcohol | Huichang ,China | - | |
| Microneedle holders | Shanghai Medical Instruments,China | WA2040 | - |
| Microscopic shears | Shanghai Medical Instruments,China | WA1040 | - |
| Microsurgical forceps | Shanghai Medical Instruments,China | WA3020 | - |
| Mouse electrocardiograph | Techman,China | BL-420F | - |
| Needle holders | Shanghai Medical Instruments,China | JC3202 | - |
| operating floor | Chico,China | ZK-HJPT | - |
| PE-10 tube | Huamei,China | - | |
| Pentobarbital | Merck,America | 1030001 | - |
| Rodent Ventilator | Shanghai Alcott Biotech,China | ALC-V8S-P | - |
| Stereo microscope | Aomei Industry,China | SZM0745-STL3-T3 | - |
| Surgical thermostatic heating pad | Globalebio, China | GE0-20W | - |
| Triphenyltetrazolium chloride | Servicebio,China | G1017 | - |
| Xylazine | Huamaike Biochemicals and Life Science Research Prouducts,China | 323004 | - |
참고문헌
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Ibanez, B., Heusch, G., Ovize, M., Van de Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. Journal of the American College of Cardiology. 65 (14), 1454-1471 (2015).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Kim, S. C., et al. A murine closed-chest model of myocardial ischemia and reperfusion. Journal of Visualized Experiments: JoVE. (65), e3896 (2012).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments: JoVE. (86), e51329 (2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments: JoVE. (94), e52206 (2014).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: An improved and simplified model for myocardial infarction. Journal of Visualized Experiments: JoVE. (122), e55353 (2017).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine myocardial infarction model using permanent ligation of left anterior descending coronary artery. Journal of Visualized Experiments: JoVE. (150), e59591 (2019).
- Li, X., et al. Cardioprotective effects of Puerarin-V on isoproterenol-induced myocardial infarction mice is associated with regulation of PPAR-Y/NF-Kappa B pathway. Molecules. 23 (12), 3322 (2018).
- Vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: A comparison with coronary artery ligation. American Journal of Physiology: Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Wang, D., et al. A cryoinjury model to study myocardial infarction in the mouse. Journal of Visualized Experiments: JoVE. (151), e59958 (2019).
- Brooks, W. W., Garibaldi, B. A., Conrad, C. H. Myocardial injury in the mouse induced by transthoracic cauterization. Laboratory Animal Science. 48 (4), 374-378 (1998).
- Tao, B., et al. Preclinical modeling and multimodality imaging of chronic myocardial infarction in minipigs induced by novel interventional embolization technique. EJNMMI Research. 6 (1), 59 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- Scofield, S. L., Singh, K. Confirmation of myocardial ischemia and reperfusion injury in mice using surface pad electrocardiography. Journal of Visualized Experiments: JoVE. (117), e54814 (2016).
- Gnyawali, S. C., et al. High-frequency high-resolution echocardiography: First evidence on non-invasive repeated measure of myocardial strain, contractility, and mitral regurgitation in the ischemia-reperfused murine heart. Journal of Visualized Experiments: JoVE. (41), e1781 (2010).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. Journal of Visualized Experiments: JoVE. (42), e2100 (2010).
- Shibata, R., et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nature Medicine. 11 (10), 1096-1103 (2005).
- Anderson, J. L., Morrow, D. A. Acute myocardial infarction. New England Journal of Medicine. 376 (21), 2053-2064 (2017).
- Frank, A., et al. Myocardial ischemia reperfusion injury: From basic science to clinical bedside. Seminars in Cardiothoracic and Vascular Anesthesia. 16 (3), 123-132 (2012).
- Mares, R. G., et al. Studying the innate immune response to myocardial infarction in a highly efficient experimental animal model. Romanian Journal of Cardiology. 31 (3), 573-585 (2021).
- Fernandez, B., et al. The coronary arteries of the C57bl/6 mouse strains: Implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Zhang, R., Hess, D. T., Reynolds, J. D., Stamler, J. S. Hemoglobin S-nitrosylation plays an essential role in cardioprotection. Journal of Clinical Investigation. 126 (12), 4654-4658 (2016).
- Sorop, O., et al. Experimental animal models of coronary microvascular dysfunction. Cardiovascular Research. 116 (4), 756-770 (2020).
- Sicard, P., et al. Right coronary artery ligation in mice: A novel method to investigate right ventricular dysfunction and biventricular interaction. American Journal of Physiology: Heart and Circulatory Physiology. 316 (3), 684-692 (2019).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology: Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Kato, R., Foex, P. Myocardial protection by anesthetic agents against ischemia-reperfusion injury: An update for anesthesiologists. Canadian Journal of Anaesthesia. 49 (8), 777-791 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유