Method Article
השראת אוטם שריר הלב ופגיעה באיסכמיה של שריר הלב בעכברים
In This Article
Summary
כאן אנו מתארים שיטה פשוטה וניתנת לשחזור שיכולה לגרום לאוטם שריר הלב או לפגיעה באיסכמיה של שריר הלב בעכברים על ידי קשירה מדויקת של העורק הכלילי היורד הקדמי השמאלי באמצעות מיקרומניפולציה.
Abstract
אוטם שריר הלב חריף הוא מחלה קרדיווסקולרית נפוצה עם תמותה גבוהה. פגיעה בזילוח שריר הלב יכולה לנטרל את ההשפעות המועילות של זרימת הלב מחדש ולגרום לפגיעה משנית בשריר הלב. מודל פשוט וניתן לשחזור של אוטם שריר הלב ופגיעה באיסכמיה של שריר הלב הוא כלי טוב לחוקרים. כאן מתוארת שיטה הניתנת להתאמה אישית ליצירת מודל אוטם שריר הלב (MI) ו- MIRI על ידי קשירה מדויקת של העורק הכלילי היורד הקדמי השמאלי (LAD) באמצעות מיקרומניפולציה. מיקום ליגטורה מדויק וניתן לשחזור של LAD מסייע להשיג תוצאות עקביות עבור פגיעה בלב. שינויים במקטע ST יכולים לסייע בזיהוי דיוק הדגם. רמת הסרום של טרופונין T (cTnT) בסרום משמשת להערכת הפגיעה בשריר הלב, אולטרסאונד לב משמש להערכת תפקוד שריר הלב, וצביע כלוריד אוונס-בלו / טריפניל טטרזוליום משמש למדידת גודל אוטם. באופן כללי, פרוטוקול זה מקצר את משך ההליך, מבטיח גודל אוטם נשלט ומשפר את הישרדות העכבר.
Introduction
אוטם חריף של שריר הלב (AMI) היא מחלה קרדיווסקולרית נפוצה ברחבי העולם ונושאת תמותה גבוהה1. ההתקדמות בטכנולוגיות הופכת רה-וסקולריזציה מוקדמת ויעילה לזמינה עבור חולי AMI. לאחר טיפולים אלה בחלק מהחולים, פגיעה איסכמיה שריר הלב (MIRI) יכולה להתרחש2. לכן, יש חשיבות רבה להבנת מנגנוני הפעולה וכיצד לשפר את MI/MIRI. עכברים נמצאים בשימוש נרחב כמודלים בגלל עלותם הנמוכה, זמן הרבייה המהיר שלהם והקלות לביצוע שינויים גנטיים3. חוקרים פיתחו שיטות שונות למדל MIRI ו-MI בבעלי חיים 4,5,6,7,8,9. אסטרטגיה זו מקדמת מחקר, אך הקריטריונים והשיטות השונות הננקטים מסבכים את פרשנות התוצאות בקרב צוותי המחקר.
בעכברים, MI נגרם על ידי isoproterenol 10, cryoinjury 11,12, או צריבה 13. MI יכול להיגרם בקלות על ידי isoproterenol, אבל התהליך הפתופיזיולוגי שונה מזה של MI קליני. MI המושרה Cryoinjury יש עקביות ירודה, מעורר נזק שריר הלב מוגזם סביב העורק הכלילי היורד הקדמי השמאלי (LAD), והוא יכול בקלות לגרום הפרעות קצב. MI המושרה על ידי צריבה שונה למדי מהתהליך הטבעי של אוטם שריר הלב, והתגובה הדלקתית באזור השריפה אינטנסיבית יותר; בנוסף, לגישה הניתוחית יש קשיים טכניים. יתר על כן, ישנן מעבדות14 המפתחות מודל MI במיני-חזירים באמצעות חסימת בלונים או אמבוליזציה או שיטת פקקת באמצעות טכניקה התערבותית. כל השיטות הללו יכולות לגרום לחסימת עורקים כליליים ישירות, אך הצורך במכשירי אנגיוגרפיה כלילית, ומעל לכל, העורקים הכליליים הדקים מדי של העכבר הופך פעולות אלה ללא מעשיות. עבור MIRI, ההבדלים בין דגמים שונים היו צנועים למדי, כגון שימוש במכונות הנשמה / מיקרומניפולציה או לא 5,6.
כאן מתוארת שיטה פשוטה ואמינה שיכולה לגרום ל-MI ולמודל MIRI, המותאם משיטות 4,5,6,7,8,9,15 שפורסמו בעבר. שיטה זו יכולה לדמות תהליכים פתופיזיולוגיים על ידי חסימה ישירה של LAD באמצעות קשירה. יתר על כן, על ידי הקלה על הקשירה, מודל זה יכול גם לדמות פגיעה רפרפוזיה. בפרוטוקול זה, מיקרוסקופ מנתח משמש להדמיית LAD. לאחר מכן, החוקר יכול לזהות את LAD בקלות. לאחר מכן, קשירה מדויקת של LAD מובילה לחסימת דם ניתנת לשחזור וצפויה ולאיסכמיה חדרית. יתר על כן, שינויים אלקטרוקרדיוגרפיה (ECG) ניתן להשתמש כדי לאשר איסכמיה ו reperfusion בנוסף לשינויי צבע של LAD שנצפו תחת מיקרוסקופ. אסטרטגיה זו מובילה למשך הליך קצר יותר, סיכון נמוך יותר לסיבוכים כירורגיים ופחות עכברי ניסוי הדרושים. כמו כן מתוארות השיטות לבדיקת טרופונין-T, אולטרסאונד לב וצביעה של טריפניל טטרזוליום כלוריד (TTC). בסך הכל, פרוטוקול זה שימושי למחקרים של מנגנון MI/MIR, כמו גם לגילוי תרופות.
Protocol
מחקרים בבעלי חיים אושרו על ידי הוועדה לטיפול וניצול בעלי חיים של אוניברסיטת Huazhong למדע וטכנולוגיה (ווהאן, סין).
הערה: עכברי C57BL/6J זכרים (8-10 שבועות) משמשים כמודלים. לעכברים יש גישה חופשית למזון ומים והם מגודלים בתנאים ספציפיים ללא פתוגנים. החדר נשמר תחת טמפרטורה מבוקרת (22 ° C ± 2 ° C) ולחות (45%-65%). עכברים נחשפים לסביבה בהירה / כהה של 12 שעות במתקן לטיפול בבעלי חיים של בית הספר לרפואה טונג'י (ווהאן, סין) על פי ההנחיות שנקבעו על ידי מוסד זה. השתמש במכשירים מיקרוכירורגיים סטריליים ובציוד כירורגי. כפפות כירורגיות ומסכות נדרשות לאורך כל ההליך. תהליך העבודה הניסיוני מוצג באיור 1A.
1. הכנה טרום ניתוחית
- השתמשו בשולחן ניתוחים מלבני (OT) עם כרית חימום שחוממה מראש (37°C) לאורך כל ההליך הכירורגי (איור 1B). יש לחטא את הלוח באור אולטרה סגול ו-70% אלכוהול לפני תחילת ההליך.
- לשקול את כל העכברים במדויק כדי לחשב את המינון של תרופות הרדמה הדרושות. לאחר מכן, הרדימו את העכברים עם קטמין (80 מ"ג/ק"ג) וקסילזין (10 מ"ג/ק"ג) באמצעות הזרקה תוך צפקית. ודא עומק הרדמה מתאים על ידי היעדר רפלקס נסיגה לצביטה בבוהן ורפלקסים מצמוץ.
- הניחו את העכבר שכיבה על OT עם גזה מתחת לראש כדי למנוע התחממות יתר של העיניים. החל משחה אופתלמית על העיניים כדי למנוע מהם להתייבש.
- מגלחים את הפרווה על החזה השמאלי עם סכין גילוח חשמלי. יש להשתמש בקרם להסרת פרווה על בית החזה המגולח מראש ולעסות באופן שווה עם צמר גפן סטרילי למשך ~1 דקות. נגבו את עודפי הפרווה הרופפת עם גזה.
- השתמש povidone-יוד, ואחריו 70% אלכוהול כדי לנקות את האזור. מכסים את בית החזה בגזה.
- השתמש בתפר 4-0 מתחת לשיניים החותכות העליונות וחבר אותו לנקודת העיגון (קרוב לקצה ה- OT מעל האף) כדי לשמור על הפה פתוח מעט ולהקל על הקנולציה.
- משוך את הזנב כדי לשמור על גוף ישר, וחבר את הזנב ל- OT באמצעות סרט הדבקה. הדקו את ארבעת הגפיים והדקו אותן על נקודות העוגן האחרות. חשוב לציין, לא למתוח יתר על המידה את הגפיים הקדמיות; אחרת, עלולה להתרחש פגיעה נשימתית.
- השתמש במלקחיים ומלקחיים מעוקלים כדי לפתוח את הלסת ולהרים את הלשון. השתמש מאיר כדי לדמיין בבירור את הגרון ואת glottis.
- הכנס צינורית 22-G בעדינות עם מחט קהה וקטועה לתוך קנה הנשימה דרך הפה ~ 1-cm במורד הגרון. השתמש ביד אחת כדי להחזיק את הלשון, להזיז אותה מעט כלפי מעלה עם מלקחיים קהה, ובמקביל להשתמש ביד השנייה כדי להחדיר בעדינות את הצינור לתוך קנה הנשימה. היזהר לא להכניס את הצינור לתוך הוושט.
- הסר את המחט בעדינות. בדוק את האינטובציה על ידי הכנסת הצינור למים להיווצרות בועות לפני החיבור למכונת ההנשמה.
- חבר את הצינור האנדוטרכאלי למכונת הנשמה המוגדרת ל-120/min ונפח הגאות מותאם ל-250 μL.
הערה: הגדרת מכונת ההנשמה מותאמת לפי משקל הגוף (באופן כללי, משקל גוף גבוה יותר דורש נפח גאות גבוה יותר). - יש לוודא אינטובציה על ידי בדיקת הרחבת חזה סימטרית דו צדדית. לאחר מכן, החיבור מקובע ל- OT עם סרט כדי למנוע את נפילת הצינור.
- הניחו אלקטרודות אק"ג על הכפות וחברו אותן לרשמקול האק"ג. עקוב אחר אלקטרופיזיולוגיה של הלב לאורך כל ההליך.
2. Thoracotomy
- הסר את הגזה על בית החזה. יש לחטא שוב עם 70% אלכוהול לאזורי החתך באמצעות שלושה מחזורי קרצוף. לאחר מכן, לכסות את העכבר עם וילון כירורגי סטרילי עם חור מעל שדה הניתוח כדי להפחית את הזיהום של אתר הניתוח.
- בצע חתך עור אלכסוני (0.8-1.0 ס"מ) לאורך קו אמצע הרחם השמאלי עם אזמל סטרילי.
- בצע דיסקציה קהה של רקמות תת עוריות כדי לחשוף את הצלעות שמתחת. היזהר לא לפגוע בכלי דם, צלעות וריאות. עצור את הדימום באמצעות אפליקטורים כותנה סטרילית.
- לזהות ולבצע חתך של כ 6-8 מ"מ בחלל intercostal השלישי. לאחר מכן, לבצע דיסקציה קהה של רקמות בחלל בין החוף כדי לפתוח את חלל החזה. היזהר לא לפגוע בעורק החזה הפנימי.
- השתמש במלקחיים כדי להקיף את החלל הבין-קוסטלי. הכניסו מסירים תוצרת בית מעוקרים מראש (איור 1C) לכלוב הצלעות ומשכו לאחור כדי לפזר את החתך לרוחב ~6 מ"מ. חבר את המשחזרים ל- OT באמצעות גומיות.
- הסר את הרקמות שמסביב בזהירות כדי לחשוף את הלב במלואו. משוך את קרום הלב בעדינות עם מלקחיים מעוקלים מבלי לפגוע בלב. עכשיו נוף ברור של הלב זמין.
3. קשירת LAD
הערה: ה-LAD מופיע כקו אדום דק העובר בניצב מקרוב לקודקוד ומטה דרך החדר השמאלי. ה- LAD הוא בצבע אדום בהיר, אז היזהר לא לטעות בו לווריד. בדרך כלל, אתר הקשירה הוא ~ 1-2 מ"מ מתחת לאוריקל השמאלי. תנוחת קשירה זו תייצר כ-40%-50% מהאיסכמיה בחדר השמאלי. מיקום גבוה יותר ייצור אזור אוטם נרחב יותר. אתר דיסטלי יותר ייצור אזור אוטם קטן יותר.
- השתמש במיקרוסקופ מנתח וכוון אור ממוקד ומתאים להדמיית LAD. לחץ בעדינות על האתר מתחת לתנוחת הקשירה שנבחרה כדי להגדיל את ה- LAD באופן זמני (≤5 שניות בכל פעם). בדוק מחדש את LAD בדרך זו.
- השתמש במחט מחודדת (3/8, 2.5 x 5) כדי להעביר 8-0 ליגטורת משי מתחת ל-LAD תחת מיקרוסקופ מנתח. היזהר עם עומק המחט: לא עמוק מדי כדי להיכנס לחדר השמאלי ולא רדוד מדי כדי למנוע פגיעה LAD.
- לקשור את הרצועה עם קשר כפול רופף. קוטר הלולאה הוא כ 2-3 מ"מ.
- מניחים צינור PE-10 בקוטר 2-3 מ"מ בלולאה מקבילה לעורק.
- הדקו את לולאת הרצועה בעדינות עד שהיא סביב העורק והצינורית. לאחר מכן, אבטח את הלולאה באמצעות slipknot. היזהר לא לפגוע בקיר שריר הלב עם לחץ הידוק מוגזם.
הערה: קשירה אינה מתבצעת עבור קבוצת ניתוח דמה. - לאשר הפסקת זרימת הדם ב- LAD: שימו לב לצבע חיוור יותר בקיר הקדמי של ה- LV לאחר הקשירה. בנוסף, העלאת ST משמעותית תוך מספר פעימות לב מצביעה גם על חסימה16. אם נדרשת קשירה קבועה (למשל, MI), הסר את צינור PE-10 וקשר את ה- LAD ישירות עם קשר. חדש את ההליך הנותר כמתואר בשלב 4.3 להלן.
- הסר את המסירים מהחתך. לאחר מכן, סגור את הפצע באופן זמני עם מהדק בולדוג. משך האיסכמיה הוא על פי תכנון הניסוי. ודא שהעכבר ממשיך להיות מחובר למכונת ההנשמה.
4. רפרפוזיה
- כאשר תקופת האיסכמיה מסתיימת, להסיר את מהדק בולדוג ולהכניס את retractors שוב כדי לפתוח את החתך ולחשוף את הלב (במיוחד את אתר הקשירה).
- התירו את החלקה והסירו את צינור PE-10. אשר את שיקום זרימת הדם בשלב זה על ידי התבוננות בשינוי הצבע בחזרה לוורוד-אדום תוך 20 שניות. במקביל, התבוננו היטב באק"ג: פירוק פוטנציאלי של ST-elevation מצביע גם הוא על רפרפוזיה.
- עזבו את ה-8-0 ligature in situ עבור צביעת אוונס-כחול ו- TTC הבאים. במקרים אחרים, הסר את התפר בשלב זה.
- מוציאים את החוזרים וסוגרים את החתך על ידי תפירת הצלעות השלישית והרביעית בתפר ניילון 4-0. היזהר לא לפגוע בריאה. דחפו החוצה את האוויר שעלול להילכד בחלל החזה על ידי לחיצה עדינה על החזה תוך כדי קשירת קשרי התפרים.
- סגור את שכבות השריר עם תפרים רציפים. סגור את העור בתפר ניילון 4-0; תפרים רציפים ותפרים קטועים מקובלים.
5. טיפול לאחר הניתוח
- התבונן בעכבר בזהירות עבור סימני התאוששות מהרדמה, למשל, תנועה של הזנב או שפם. לאחר מכן, העכבר בדרך כלל חוזר דפוס נשימה רגיל עם קצב נשימה של סביב 150 bpm. להוציא את העכבר על ידי הסרת הצינור לאט.
- עקוב אחר העכבר למשך 3-5 דקות נוספות כדי לוודא שאין מצוקה נשימתית.
- מתן 100 μL של buprenorphine (0.1 מ"ג / מ"ל, s.c.) לאחר העכבר מתחיל לנשום. במשך 24 השעות הבאות, לספק מנה נוספת כל 4-6 שעות. לספק איבופרופן כהקלה נוספת בכאב במי השתייה כתמיסה של 0.2 מ"ג / מ"ל במשך יומיים לפני ו -≤7 ימים לאחר הניתוח.
- שמור על חום העכברים והפחת את הסיכון לתמותה באמצעות שמיכות בידוד תרמי מכיוון שעכברים נוטים להיפותרמיה לאחר ההרדמה.
6. אימות לאחר ההליך
- בדיקת טרופונין-T
- אספו דגימות דם מהמקלעים הרטרואורביטליים ובודדו את הסרומים באמצעות צנטריפוגה (3,000 × גרם, 10 דקות, טמפרטורת החדר).
- לדלל 20 μL של סרום ל 100 μL עם תמיסת מלח עבור בדיקת troponin-T. אחסןאת שאר הדגימות ב -80 ° C.
- זהה את Troponin T (cTnT באמצעות ערכה מסחרית בהתאם להוראות היצרן.
- אולטרסאונד לב
הערה: אולטרסאונד לב משמש להערכת תפקוד הלב והפרעות בתנועת הקיר בשלבים שונים לפני ואחרי הניתוח על פי תכנון הניסוי17,18. נמדדים פרמטרים שונים כגון עובי דופן החדר, נפח החדר, קוטר חלל החדר, מקטע פליטה ומקטע קיצור ציר קצר.- מרדימים את העכברים עם קטמין (80 מ"ג/ק"ג) וקסילזין (10 מ"ג/ק"ג) באמצעות הזרקה תוך צפקית.
- לגלח את החזה עם סכין גילוח חשמלי. יש להשתמש בקרם להסרת פרווה ולעסות באופן שווה. נגבו את עודפי הפרווה הרופפת עם גזה.
- הניחו את העכבר על ה-OT ואבטחו את ארבעת הגפיים בעזרת סרט הדבקה.
- מקם את בדיקת האולטרסאונד (30 MHz) על האזור הקדמי של הלב ב ~ 30° לחזה. הגשושית בהשקפה זו מיושרת עם הציר הארוך של הלב. הגדר את האולטרסאונד במצב B; ניתן לזהות בבירור את החדר השמאלי, אטריום שמאלי, המסתם המיטרלי ואבי העורקים העולה. השתמש בלכידת וידאו כדי להשיג נתונים לניתוח הבא.
- על ידי סיבוב המתמר ב-90 מעלות בכיוון השעון, קבל מבט על הציר הקצר של עצם החזה ברמת השרירים הפפילריים כדי לזהות בבירור את החדר השמאלי והימני. לאחר מכן השתמש ב- B-Mode וב- M-Mode כדי להעריך את תפקוד הלב ואת המורפומטריה.
- חשב את הקוטר הדיאסטולי של החדר השמאלי (Dd), הקוטר הסיסטולי הסופי (Ds) ועובי המחיצה הבין-חדרית על-ידי ציון המיקום המתאים בתמונות האולטרסאונד.
הערה: ההתקן יחשב ידנית נפח דיאסטולי קצה חדר שמאלי (LVEDV) ונפח סיסטולי קצה (LVESV). כמו כן, המכונה תחשב את הערכים עבור קיצור שברים (FS) ושבר פליטה (EF) באמצעות נוסחאות FS = (Dd-Ds)/Dd × 100% ו- EF= (LVEDV-LVESV)/LVEDV ×- 100%. בחר חמישה מחזורי לב רצופים וקבל את הערכים הממוצעים שלהם.
- מדידת גודל אוטם שריר הלב
הערה: צביעת Evans-Blue/TTC משמשת למדידת גודל האוטם מכיוון שהיא יכולה להעריך את כדאיות הרקמה19. מומלץ להכתים תוך 72 שעות מרגע הרפרפוזיה מכיוון שהצלקת תתכווץ. שלב זה מבוצע לאחר המתת חסד החיה עם 200 מ"ג / ק"ג נתרן pentobarbital באמצעות הזרקה intraperitoneal.- חשוף את הלב שוב לאחר ההליכים הקודמים משלבים 2.2-2.5. לאחר מכן, יש לקשר מחדש את ה-LAD באתר הראשוני שאומת על ידי התפר שהוזכר בשלב 4.3 בתום משך הרפרפוזיה הרצוי.
- לערבב את אבי העורקים ולאחר מכן לנקב את הלב עם 0.3 מ"ל של 1% אוונס כחול פתרון. שריר הלב של האזור הלא איסכמי מוכתם בכחול. לאחר זילוח, להסיר את הלב במהירות על ידי חיתוך אבי העורקים עם מספריים.
- לאחר מכן, שטפו את הלב בתמיסת KCl (30 mM) כדי לעצור את הלב מלפעום. יש לאחסן בטמפרטורה של -20°C למשך ≥4 שעות לאחר הסרת רקמת השומן שמסביב.
- חותכים את הלב בכיוון הרוחבי לחמש פרוסות עובי 1 מ"מ באמצעות אזמל חד. שוקלים את הפרוסות ואז דוגרים עליהן עם 2% TTC למשך 40 דקות ב-37°C.
הערה: לאחר הדגירה, אזורי האוטם מסומנים כלבנים, בעוד שרקמות קיימא באזורים שאינם אוטם נשארות אדומות. - קבעו את הפרוסות עם 4% פורמלדהיד למשך הלילה.
הערה: פעולה זו תשפר את הניגודיות בין אזור האוטם לאזור שאינו אוטם. זה גם יכווץ את הפרוסות. - צלמו את הפרוסות במצלמה דיגיטלית. לאחר מכן, חשב את האזור בסיכון (AAR), אזור אוטם ואזור לא איסכמי באמצעות תוכנת גרפיקה.
הערה: לאחר צביעה כפולה של Evans-Blue/TTC, האזור הכחול הוא האזור ה"רגיל". האזורים הנותרים (כולל לבן ואדום) הם אזורי "סיכון איסכמיה": האזור הלבן הוא אזור אוטם שריר הלב (IA), והאזור האדום הוא האזור האיסכמי (אך לא אוטם). אם ניקח בחשבון את חוסר העקביות של גדלים של פרוסות לב, התוצאות מותאמות למשקל.
להקצות:
A1-A5 עבור אזור אוטם / אזור פרוסת הלב;
B1-B5 עבור אזור שאינו אזור אוטם / אזור פרוסת הלב;
W1-W5 למשקל פרוסת הלב.
ולאחר מכן:
משקל כולל של שריר הלב האוטם: W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5;
משקל כולל של שריר הלב שאינו אוטם: W1 × B1 + W2 × B2 + W3 × B3 + W4 × B4+ W5 × B5;
משקל כולל של AAR = (W1 + W2 + W3 + W4 + W5) - (W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5)
סוף סוף:
אזור איסכמיה שריר הלב מחושב כאחוז AAR בחדר השמאלי:
אזור אוטם שריר הלב מחושב כאחוז IA ב- AAR: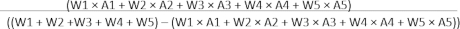
תוצאות
תהליך העבודה הניסיוני מוצג באיור 1A. החוקר יכול לתזמן את צמתי הזמן בהתאם לתכנון הניסוי עם תחילת המחקר. משך קשירת LAD הוא בהתאם למטרת המחקר. עבור MI, המחקר יכול להתעלם משלב הרפרפוזיה. אולטרסאונד לב זמין בשלבים שונים של המחקר מכיוון שהוא אינו פולשני, בעוד צביעת אוונס-בלו / TTC יכולה להתבצע רק כאשר העכבר מוקרב. עבור מחקר המתמקד בפיברוזיס ושיפוץ חדרים, זמן התצפית ארוך בהרבה.
התמונות האופייניות לחלק מתהליך הניסוי מוצגות באיור 2A, החל מאינטובציה אנדוטרכאלית, חתך בעור, תורקוטומיה, זיהוי LAD, קשירת LAD ועד רפרפוזיה. כדי לאמת איסכמיה ורפרפוזיה של שריר הלב, תמונות האק"ג המייצגות עם העלאת ST משמעותית לאחר קשירה ופירוק של ST-elevation כאשר החלקה אינה קשורה מוצגות באיור 2B.
לאחר קבלת דגימות דם מכל העכברים, ניתן לבצע את בדיקת טרופונין-T כדי לאמת אוטם. איור 3A מראה עלייה משמעותית של cTnT בקבוצות MIRI ו-MI בהשוואה לקבוצות דמה. איור 3B מדגים את הצביעה הכפולה של אוונס-בלו ו-TTC במשך חמישה חתכים רוחביים רצופים של הלב בין קבוצת הדמה לקבוצת MIRI. האזור הכחול מרמז על האזור הנורמלי, האזור הלבן מרמז על אזור אוטם שריר הלב, והאזור האדום מרמז על האזור האיסכמי אך לא אוטם. איור 3C מייצג את התמונות ארוכות הציר של אולטרסאונד לב בין קבוצת הדמה לקבוצת MI. ניתן להשתמש ביישומי תוכנה כדי לחשב פרמטרים פונקציונליים שונים, כגון ערך גבוה יותר של מקטע פליטה עבור קבוצת הדמה באיור 3C בהשוואה לזה שבקבוצת MI.

איור 1: מערך כירורגי. (A) סקירה כללית של ציר הזמן של הניסוי. (B) שולחן ניתוחים עם כרית חימום שחוממה מראש וחיבור לאלקטרודות אק"ג. (ג) מחזירים תוצרת בית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
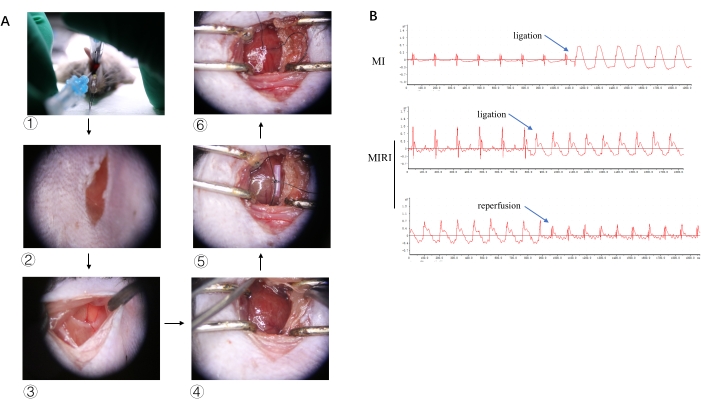
איור 2: שינויים בתהליך הניסוי ובאק"ג. (A) תמונות של אינטובציה אנדוטרכאלית, חתך בעור, בית החזה, זיהוי LAD, קשירת LAD ורפרפוזיה מוצגות ב-1, 2, 3, 4, 5 ו-6, בהתאמה. (B) תמונות אק"ג אופייניות של MI ו-MIRI לאחר קשירה ורפרפוזיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
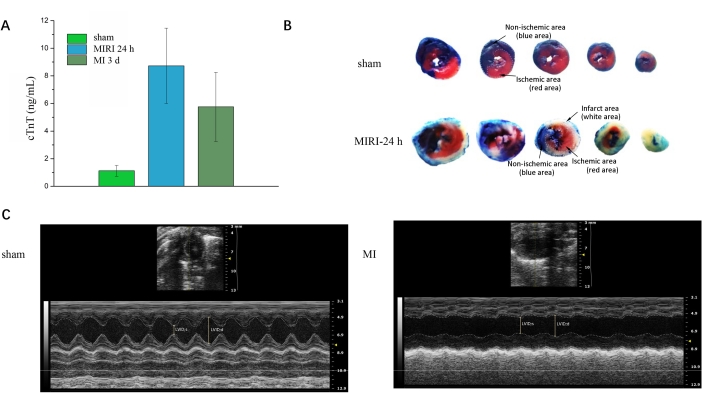
איור 3: תיקוף לאחר ההליך. (A) ביטוי של טרופונין לבבי בקרב קבוצות דמה, MIRI 24 h, ו-MI 3 d. (B) אוונס -כחול / TTC צביעה כפולה עבור קבוצות sham ו- MIRI 24 שעות. (C) אולטרסאונד לב לקבוצות דמה ו-MI. LVID; D, ממד פנימי של החדר השמאלי הדיאסטולי הסופי; LVID; S, ממד פנימי של החדר השמאלי הסיסטולי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בשנים האחרונות, יצירת מודלים עבור MI ו- MIRI במחקר קליני ומדעי התפתחה במהירות20,21. עם זאת, יש עדיין כמה שאלות, כגון מנגנוני הפעולה וכיצד לשפר MI / MIRI, כי יש לפתור. כאן מתואר פרוטוקול שונה להקמת מודל מורין של MI ו- MIRI. יש לשקול בזהירות מספר נקודות מפתח.
נקודת המפתח הראשונה היא אינטובציה אנדוטרכאלית. חלק מההליכים6,9 כוללים חתך של עור צוואר הרחם, הפרדת רקמות, ואחריו חשיפה של שריר sternohyoideus כדי לראות את קנה הנשימה. בדרך זו, החוקר יכול לדמיין החדרת צינור לתוך קנה הנשימה. זהו צעד טוב להפחתת הסיכון למצוקה נשימתית. בשיטה הנוכחית, החוקר יכול לדמיין בבירור את הסגירה והפתיחה של הגלוטיס עם נשימה תחת מאיר ולאחר מכן להכניס את הצינור לתוך קנה הנשימה בקלות. לפיכך, חתך צוואר הרחם אינו נעשה כדי להפחית טראומה בעור וזיהומים פוטנציאליים, אשר חשוב במחקר על איתות דלקתי. לרינגוסקופים חזותיים נמצאים בשימוש נרחב באינטובציה קלינית בקנה הנשימה: אולי ניתן להשתמש בהם גם בעכברים. Mares et al.22 דיווחו על הרדמה רציפה בשאיפת מסכה ללא אינטובציה אנדוטרכאלית, שבוצעה על ידי שאיפת איזופלורן 2% לאחר אינדוקציה איזופלורנית של 5% עם חמצן שניתן דרך מסכה לא פולשנית שהונחה על האף והפה של החיה. זה יכול למנוע נזק לרקמות ולשפר את הבטיחות והיעילות של הרדמה. עם זאת, יש צורך במכונת הרדמה מיוחדת בשאיפה. יתר על כן, חומרי הרדמה נדיפים עלולים לגרום נזק פיזי למפעיל.
נקודת המפתח השנייה והחשובה ביותר היא זיהוי וקשירה של LAD. כל טעות בזיהוי וקשירת LAD תוביל לתוצאות לא עקביות: או גודל אוטם גדול מדי הגורם למוות או גודל אוטם קטן מדי המביא לכישלון. ניתן ליישם שיטות שונות כדי לזהות את LAD ולאמת את קשירתו. כאן, מיקרוסקופ דיסקציה משמש כדי לאתר את LAD. ה- LAD מופיע בדרך כלל כקו אדום דק העובר בניצב מקרוב לקודקוד ומטה דרך החדר השמאלי. על ידי לחיצה עדינה על האתר מתחת למיקום הקשירה שנבחר כדי להגדיל את ה- LAD באופן זמני (≤5 שניות בכל פעם), ניתן לבדוק שוב את ה- LAD. לאחר הקשירה, חסימת LAD מאומתת על ידי צבע חיוור יותר בדופן הקדמית של החדר השמאלי והגבהת ST משמעותית תוך מספר פעימות לב. לאחר מכן, הקשירה אינה קשורה, והרפרפוזיה מאומתת על ידי שינוי צבע בחזרה לוורוד-אדום תוך 20 שניות ופירוק פוטנציאלי של גובה ST באק"ג. לבסוף, בדיקת טרופונין-T, צביעת TTC ואולטרסאונד לב משמשים להערכת הפגיעה בשריר הלב. ביטוחים מרובים אלה ואימותים הדדיים הופכים את תוצאות הניסוי לאמינות ביותר. יתר על כן, מיקרומניפולציה מעוררת דיוק גבוה יותר ופחות סיבוכים (למשל, דימום). נושא חשוב נוסף הוא ההנחה כי כלי הדם של עכברים הם נורמליים, אבל למעשה, כמה עורקים כליליים להשתנות מאוד, ואפילו זרימת בטחונות יכול להציג23,24. לפיכך, גדלי האוטם לעיתים אינם עקביים למרות שהקשירות נחשבות באותה רמה. היתרונות של המיקרוסקופ מוצגים כאן. קשירה לא יכולה להיעשות רק על סמך ניסיון או ציוני דרך אנטומיים: יש לאמת את ה- LAD ואת כיוונו בבירור לפני הקשירה אחרת, התוצאות לא יהיו אמינות. בחלק מהניסויים6,8, עכברים נמצאים במצב דקוביטוס צדדי ימני לנוחות התבוננות בדופן הקדמית של החדר השמאלי והעורקים הכליליים לאחר חשיפה ללב.
למודל זה שתי מגבלות עיקריות. ראשית, קשירת LAD אינה יכולה לדמות חסימה של העורק הכלילי הימני. למעשה, בשל הבדלים אנטומיים בין בעלי חיים25, LAD בדרך כלל משתרע על קודקוד הלב בעכברים וחולדות, ואת ענפי circumflex השמאלי אינם מפותחים, ולכן המודלים בעכברים וחולדות נקבעים על ידי קשירת LAD. עבור בעלי חיים גדולים ובינוניים כגון ארנבות וחזירים, עורק ה- LAD קצר יחסית, ואילו עורק ה- circumflex השמאלי מכסה שטח גדול של הלב, ולכן קשירה של עורק ה- circumflex השמאלי נבחרת כדי לבסס את המודל. Sicard et al.26 דיווחו על שיטה חדשנית לחקר תפקוד לקוי של החדר הימני ואינטראקציה דו-חדרית על ידי קשירת העורק הכלילי הימני בעכברים, אשר יכולה לתקן מגבלה זו. המגבלה השנייה היא גודל אוטם לא עקבי עקב שונות באנטומיה של העורקים הכליליים27 וניסיונו של המנתח. כפי שפורט לעיל, המיקרוסקופ חשוב מאוד להגברת העקביות על ידי אימות ה- LAD וכיוונו לפני הקשירה, ולחוקר מנוסה, ניתן להשיג התאמת תנוחת הקשירה לאחר הערכה מלאה של אנטומיה וסקולרית.
כמה נושאים אחרים ראויים לאזכור. לדוגמה, כריתת בית החזה ופירסינג במחטים יגרמו בהכרח לנזק קל לשרירים ולשריר הלב, מה שעשוי להשפיע על הדלקת. בנוסף, דווח על משככי כאבים שיש להם השפעות על MI28. לפיכך, גורמים אלה חייבים להילקח בחשבון בעת ניתוח דלקת או השפעותיה על MI. לפתרון בעיות, ישנם מספר גורמים שיובילו למוות עכברים. לדוגמה, סיבוכים הקשורים לדלקת שריר הלב, תאונה הרדמה ודימום. יתר על כן, התוצאות הלא עקביות נובעות בעיקר מתנוחות קשירה לא מתאימות: תנוחת קשירה גבוהה מדי תגרום לגודל אוטם גדול מדי אפילו למוות עכברים; בינתיים, הזיהוי הכוזב של LAD יגרום לכשל במודל. כמה פרטים צריכים להיות משופרים בשיטה זו. לדוגמה, עדיף אם בדיקה רקטלית ניתן להכניס כדי לפקח על הטמפרטורה במהלך ההליך. אחרון חביב, על הנסיין לזכור את ההבדלים בין מחקרים בבעלי חיים לבין המציאות הקלינית, במיוחד שזמן איסכמיה של 30 דקות הוא אכן קצר למדי עבור מחקרים קליניים. אנו מעודדים את החוקר לארגן את השלבים בהתאם לתכנון הניסוי שלו, כולל זמן האיסכמיה. רק בדרך זו פרוטוקול זה יכול להיות שימושי למחקרים על המנגנון והטיפול ב- MI/MIRI וגילוי תרופות.
בקיצור, מודל מורין פשוט ורבייה עבור MIRI ו- MI מסופק. מודל זה יכול לשמש לחקר מנגנוני MI/MIRI ולמחקר טיפולי.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (82070317, 81700390 לג'יבין לין, 8210021880 לבינג'יה LV ו-82000428 לבויואן וואנג) ותוכנית המו"פ הלאומית של סין (2017YFA0208000 לשאולין הא).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9 % sodium chloride solution | Kelun Industry Group,China | - | |
| 4% paraformaldehyde fixing solution | Servicebio,China | G1101 | - |
| 4-0 silk suture | Shanghai Pudong Jinhuan Medical Products,China | C412 | - |
| 8-0 suture | Shanghai Pudong Jinhuan Medical Products,China | H801 | - |
| Buprenorphine | IsoReag,China | IR-11190 | - |
| Camera | Canon,Japan | EOS 80D | - |
| Depilatory cream | Veet,French | - | |
| Elecsys Troponin T hs STAT | Roche,Germany | - | |
| Electrochemical luminescence immunoanalyzer | Roche,Germany | Elecsys 2010 | - |
| Evans blue | Sigma,America | E2129 | - |
| Eye scissors | Shanghai Medical Instruments,China | JC2303 | - |
| Haemostatic forceps | Shanghai Medical Instruments,China | J31020 | - |
| High frequency in vivo imaging systems | Visualsonics,Canada | Vevo2100 | - |
| Ibuprofen | PerFeMiKer,China | CLS-12921 | - |
| Intravenous catheter | Introcan,Germany | 4254090B | - |
| Ketamine | Sigma-Aldrich,America | K2753 | - |
| Medical alcohol | Huichang ,China | - | |
| Microneedle holders | Shanghai Medical Instruments,China | WA2040 | - |
| Microscopic shears | Shanghai Medical Instruments,China | WA1040 | - |
| Microsurgical forceps | Shanghai Medical Instruments,China | WA3020 | - |
| Mouse electrocardiograph | Techman,China | BL-420F | - |
| Needle holders | Shanghai Medical Instruments,China | JC3202 | - |
| operating floor | Chico,China | ZK-HJPT | - |
| PE-10 tube | Huamei,China | - | |
| Pentobarbital | Merck,America | 1030001 | - |
| Rodent Ventilator | Shanghai Alcott Biotech,China | ALC-V8S-P | - |
| Stereo microscope | Aomei Industry,China | SZM0745-STL3-T3 | - |
| Surgical thermostatic heating pad | Globalebio, China | GE0-20W | - |
| Triphenyltetrazolium chloride | Servicebio,China | G1017 | - |
| Xylazine | Huamaike Biochemicals and Life Science Research Prouducts,China | 323004 | - |
References
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Ibanez, B., Heusch, G., Ovize, M., Van de Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. Journal of the American College of Cardiology. 65 (14), 1454-1471 (2015).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Kim, S. C., et al. A murine closed-chest model of myocardial ischemia and reperfusion. Journal of Visualized Experiments: JoVE. (65), e3896(2012).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments: JoVE. (86), e51329(2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments: JoVE. (94), e52206(2014).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: An improved and simplified model for myocardial infarction. Journal of Visualized Experiments: JoVE. (122), e55353(2017).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine myocardial infarction model using permanent ligation of left anterior descending coronary artery. Journal of Visualized Experiments: JoVE. (150), e59591(2019).
- Li, X., et al. Cardioprotective effects of Puerarin-V on isoproterenol-induced myocardial infarction mice is associated with regulation of PPAR-Y/NF-Kappa B pathway. Molecules. 23 (12), 3322(2018).
- Vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: A comparison with coronary artery ligation. American Journal of Physiology: Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Wang, D., et al. A cryoinjury model to study myocardial infarction in the mouse. Journal of Visualized Experiments: JoVE. (151), e59958(2019).
- Brooks, W. W., Garibaldi, B. A., Conrad, C. H. Myocardial injury in the mouse induced by transthoracic cauterization. Laboratory Animal Science. 48 (4), 374-378 (1998).
- Tao, B., et al. Preclinical modeling and multimodality imaging of chronic myocardial infarction in minipigs induced by novel interventional embolization technique. EJNMMI Research. 6 (1), 59(2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- Scofield, S. L., Singh, K. Confirmation of myocardial ischemia and reperfusion injury in mice using surface pad electrocardiography. Journal of Visualized Experiments: JoVE. (117), e54814(2016).
- Gnyawali, S. C., et al. High-frequency high-resolution echocardiography: First evidence on non-invasive repeated measure of myocardial strain, contractility, and mitral regurgitation in the ischemia-reperfused murine heart. Journal of Visualized Experiments: JoVE. (41), e1781(2010).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. Journal of Visualized Experiments: JoVE. (42), e2100(2010).
- Shibata, R., et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nature Medicine. 11 (10), 1096-1103 (2005).
- Anderson, J. L., Morrow, D. A. Acute myocardial infarction. New England Journal of Medicine. 376 (21), 2053-2064 (2017).
- Frank, A., et al. Myocardial ischemia reperfusion injury: From basic science to clinical bedside. Seminars in Cardiothoracic and Vascular Anesthesia. 16 (3), 123-132 (2012).
- Mares, R. G., et al. Studying the innate immune response to myocardial infarction in a highly efficient experimental animal model. Romanian Journal of Cardiology. 31 (3), 573-585 (2021).
- Fernandez, B., et al. The coronary arteries of the C57bl/6 mouse strains: Implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Zhang, R., Hess, D. T., Reynolds, J. D., Stamler, J. S. Hemoglobin S-nitrosylation plays an essential role in cardioprotection. Journal of Clinical Investigation. 126 (12), 4654-4658 (2016).
- Sorop, O., et al. Experimental animal models of coronary microvascular dysfunction. Cardiovascular Research. 116 (4), 756-770 (2020).
- Sicard, P., et al. Right coronary artery ligation in mice: A novel method to investigate right ventricular dysfunction and biventricular interaction. American Journal of Physiology: Heart and Circulatory Physiology. 316 (3), 684-692 (2019).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology: Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Kato, R., Foex, P. Myocardial protection by anesthetic agents against ischemia-reperfusion injury: An update for anesthesiologists. Canadian Journal of Anaesthesia. 49 (8), 777-791 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved