Method Article
Induction d’un infarctus du myocarde et d’une lésion d’ischémie-reperfusion myocardique chez la souris
Dans cet article
Résumé
Nous décrivons ici une méthode simple et reproductible qui peut induire un infarctus du myocarde ou une lésion d’ischémie-reperfusion myocardique chez la souris par ligature de précision de l’artère coronaire descendante antérieure gauche par micromanipulation.
Résumé
L’infarctus aigu du myocarde est une maladie cardiovasculaire fréquente avec une mortalité élevée. La lésion de reperfusion myocardique peut contrecarrer les effets bénéfiques de la refusion cardiaque et induire une lésion myocardique secondaire. Un modèle simple et reproductible d’infarctus du myocarde et d’ischémie-reperfusion myocardique est un bon outil pour les chercheurs. Ici, une méthode personnalisable pour créer un modèle d’infarctus du myocarde (IM) et MIRI par ligature de précision de l’artère coronaire descendante antérieure gauche (LAD) par micromanipulation est décrite. Le positionnement précis et reproductible de la ligature du LAD permet d’obtenir des résultats cohérents pour les lésions cardiaques. Les modifications apportées au segment ST peuvent aider à identifier la précision du modèle. Le taux sérique de troponine T cardiaque (cTnT) est utilisé pour évaluer la lésion myocardique, l’échographie cardiaque est utilisée pour évaluer la fonction systolique myocardique et la coloration au chlorure d’Evans-Blue/triphényltétrazolium est utilisée pour mesurer la taille de l’infarctus. En général, ce protocole réduit la durée de la procédure, assure une taille d’infarctus contrôlable et améliore la survie des souris.
Introduction
L’infarctus aigu du myocarde (IAM) est une maladie cardiovasculaire courante dans le monde et entraîne une mortalité élevée1. Les progrès technologiques rendent la revascularisation précoce et efficace disponible pour les patients atteints d’IAM. Après ces traitements, chez certains patients, une lésion d’ischémie-reperfusion myocardique (IRMI) peut survenir2. Ainsi, il est d’une grande importance de comprendre les mécanismes d’action et comment améliorer l’IM/MIRI. Les souris sont largement utilisées comme modèles en raison de leur faible coût, de leur temps de reproduction rapide et de leur facilité à effectuer des modifications génétiques3. Les chercheurs ont développé différentes méthodes pour modéliser MIRI et MI chez l’animal 4,5,6,7,8,9. Cette stratégie favorise la recherche, mais les différents critères et méthodes utilisés compliquent l’interprétation des résultats entre les équipes de recherche.
Chez la souris, l’infarctus du myocarde a été induit par l’isoprotérénol10, la cryolésion 11,12 ou la cautérisation 13. L’infarctus du myocarde peut être facilement induit par l’isoprotérénol, mais le processus physiopathologique est différent de celui de l’infarctus du myocarde clinique. L’infarctus du myocarde induit par la cryolésion a une faible consistance, provoque des lésions myocardiques excessives autour de l’artère coronaire descendante antérieure gauche (LAD) et peut facilement induire une arythmie. L’infarctus du myocarde induit par la cautérisation est très différent du processus naturel de l’infarctus du myocarde, et la réaction inflammatoire dans la zone brûlante est plus intense ; De plus, l’approche chirurgicale présente des difficultés techniques. De plus, certains laboratoires14 développent un modèle d’IM chez les miniporcs en utilisant la méthode de blocage par ballonnet ou d’embolisation ou de thrombose par technique interventionnelle. Toutes ces méthodes peuvent provoquer directement une occlusion de l’artère coronaire, mais le fait de nécessiter des appareils de coronarographie et, surtout, les artères coronaires trop fines de la souris ne rend pas ces opérations pratiques. Pour MIRI, les différences entre les différents modèles étaient assez modestes, comme l’utilisation de respirateurs / micromanipulation ou non 5,6.
Ici, une méthode simple et fiable qui peut induire l’IM et le modèle MIRI, adapté des méthodesprécédemment publiées 4,5,6,7,8,9,15, est décrit. Cette méthode permet de simuler des processus physiopathologiques par blocage direct du LAD par ligature. De plus, en soulageant la ligature, ce modèle peut également simuler une lésion de reperfusion. Dans ce protocole, un microscope à dissection est utilisé pour la visualisation LAD. Ensuite, le chercheur peut facilement identifier le DAL. Par la suite, une ligature précise du LAD conduit à une occlusion sanguine et à une ischémie ventriculaire reproductibles et prévisibles. De plus, les modifications de l’électrocardiographie (ECG) peuvent être utilisées pour confirmer l’ischémie et la reperfusion en plus des changements de couleur du LAD observés au microscope. Cette stratégie permet de raccourcir la durée de la procédure, de réduire le risque de complications chirurgicales et de réduire le nombre de souris expérimentales nécessaires. Les méthodes de dosage de la troponine-T, d’échographie cardiaque et de coloration au chlorure de triphényltétrazolium (TTC) sont également décrites. Dans l’ensemble, ce protocole est utile pour les études du mécanisme MI/MIR, ainsi que pour la découverte de médicaments.
Protocole
Des études sur les animaux ont été approuvées par le Comité de protection et d’utilisation des animaux de l’Université des sciences et technologies de Huazhong (Wuhan, Chine).
REMARQUE : Les souris mâles C57BL/6J (8-10 semaines) sont utilisées comme modèles. Les souris ont libre accès à la nourriture et à l’eau et sont élevées dans des conditions spécifiques exemptes d’agents pathogènes. La pièce est maintenue sous température (22 °C ± 2 °C) et humidité (45%-65%). Les souris sont exposées à un environnement clair/sombre de 12 heures à l’installation de soins aux animaux de la faculté de médecine de Tongji (Wuhan, Chine) selon les directives établies par cette institution. Utiliser des instruments microchirurgicaux stériles et du matériel chirurgical. Des gants chirurgicaux et des masques sont obligatoires tout au long de l’intervention. Le flux de travail expérimental est illustré à la figure 1A.
1. Préparation préopératoire
- Utiliser une table d’opération rectangulaire avec un coussin chauffant préchauffé (37 °C) tout au long de l’intervention chirurgicale (Figure 1B). Désinfectez la planche avec de la lumière ultraviolette et de l’alcool à 70 % avant le début de la procédure.
- Pesez toutes les souris avec précision pour calculer la dose de médicaments anesthésiques nécessaire. Ensuite, anesthésiez les souris avec de la kétamine (80 mg/kg) et de la xylazine (10 mg/kg) par injection intrapéritonéale. Assurez-vous d’une profondeur d’anesthésie appropriée par l’absence d’un réflexe de retrait pour pincer les orteils et les réflexes de clignement des yeux.
- Placez la souris en décubitus dorsal sur l’ergothérapie avec de la gaze sous la tête pour éviter la surchauffe des yeux. Appliquez une pommade ophtalmique sur les yeux pour éviter qu’ils ne se dessèchent.
- Rasez la fourrure sur la poitrine précordiale gauche avec un rasoir électrique. Utilisez une crème démaquillante sur le thorax pré-rasé et massez uniformément avec un coton-tige stérile pendant ~1 min. Essuyez l’excédent de fourrure lâche avec de la gaze.
- Utilisez de la povidone iodée, suivie d’alcool à 70 % pour nettoyer la zone. Couvrir le thorax avec de la gaze.
- Utilisez une suture 4-0 sous les incisives supérieures et fixez-la au point d’ancrage (près du bord de l’OT au-dessus du nez) pour garder la bouche légèrement ouverte et faciliter la canulation.
- Tirez sur la queue pour garder le corps droit et fixez la queue à l’OT à l’aide de ruban adhésif. Fixez les quatre branches et serrez-les sur les autres points d’ancrage. Il est important de ne pas trop étirer les membres antérieurs ; sinon, une atteinte respiratoire peut survenir.
- Utilisez des pinces et des pinces incurvées pour ouvrir la mâchoire et soulever la langue. Utilisez un illuminateur pour visualiser clairement la gorge et la glotte.
- Insérez doucement une canule de 22 G avec une aiguille émoussée et tronquée dans la trachée par la bouche à ~1 cm dans la gorge. Utilisez une main pour tenir la langue, déplacez-la légèrement vers le haut avec une pince émoussée et, simultanément, utilisez l’autre main pour insérer doucement le tube dans la trachée. Veillez à ne pas insérer le tube dans l’œsophage.
- Retirez délicatement l’aiguille. Vérifiez l’intubation en plaçant le tube dans l’eau pour détecter la formation de bulles avant de le connecter au ventilateur.
- Connectez la sonde endotrachéale à un ventilateur réglé à 120/min et au volume courant ajusté à 250 μL.
REMARQUE : Le réglage du ventilateur est ajusté en fonction du poids corporel (en général, un poids corporel plus élevé nécessite un volume courant plus élevé). - Vérifier l’intubation en vérifiant l’expansion thoracique symétrique bilatérale. Ensuite, la connexion est fixée à l’OT avec du ruban adhésif pour éviter que le tube ne tombe.
- Placez les électrodes ECG sur les pattes et connectez-les à l’enregistreur ECG. Surveillez l’électrophysiologie cardiaque tout au long de l’intervention.
2. Thoracotomie
- Retirez la gaze sur le thorax. Désinfectez à nouveau avec de l’alcool à 70 % pour les zones d’incision en utilisant trois cycles de gommage. Ensuite, couvrez la souris avec un champ chirurgical stérile avec un trou sur le champ chirurgical pour réduire la contamination du site chirurgical.
- Faites une incision cutanée oblique (0,8 à 1,0 cm) le long de la ligne médio-claviculaire gauche avec un scalpel stérile.
- Entreprendre une dissection contondante des tissus sous-cutanés pour exposer les côtes en dessous. Veillez à ne pas blesser les vaisseaux, les côtes et les poumons. Arrêtez le saignement en utilisant des applicateurs en coton stérile.
- Identifiez et faites une incision d’environ 6 à 8 mm dans le troisième espace intercostal. Ensuite, effectuez une dissection contondante des tissus dans l’espace intercôtier pour ouvrir la cavité thoracique. Veillez à ne pas blesser l’artère thoracique interne.
- Utilisez des pinces pour enjamber l’espace intercostal. Insérez des écarteurs faits maison pré-stérilisés (Figure 1C) dans la cage thoracique et tirez vers l’arrière pour écarter l’incision à ~6 mm de largeur. Fixez les enrouleurs à l’OT avec des élastiques.
- Retirez soigneusement les tissus environnants pour exposer complètement le cœur. Retirez doucement le péricarde avec une pince incurvée sans blesser le cœur. Maintenant, une vue claire du cœur est disponible.
3. Ligature LAD
REMARQUE : Le LAD apparaît sous la forme d’une fine ligne rouge perpendiculaire à partir de près de l’apex et vers le bas à travers le ventricule gauche. Le LAD est de couleur rouge vif, alors veillez à ne pas le confondre avec une veine. Habituellement, le site de ligature se trouve à ~1-2 mm en dessous du pavillon de l’oreille gauche. Cette position de ligature produira environ 40 à 50 % de l’ischémie dans le ventricule gauche. Une position plus élevée créera une zone d’infarctus plus étendue. Un site plus distal créera une zone d’infarctus plus petite.
- Utilisez un microscope à dissection et dirigez une lumière focalisée et appropriée pour la visualisation LAD. Appuyez doucement sur le site situé sous la position de ligature choisie pour agrandir temporairement le LAD (≤5 s à la fois). Revérifiez le LAD de cette façon.
- Utilisez une aiguille conique (3/8, 2,5 x 5) pour passer un 8-0 ligature de soie sous le LAD sous un microscope de dissection. Attention à la profondeur de l’aiguille : pas trop profonde pour pénétrer dans le ventricule gauche et pas trop peu profonde pour éviter d’endommager le LAD.
- Nouez la ligature avec un double nœud lâche. Le diamètre de la boucle est d’environ 2-3 mm.
- Placez une tubulure PE-10 de 2 à 3 mm dans une boucle parallèle à l’artère.
- Serrez doucement la boucle de ligature jusqu’à ce qu’elle soit autour de l’artère et de la tubulure. Ensuite, fixez la boucle avec un nœud coulant. Veillez à ne pas endommager la paroi myocardique avec une pression de serrage excessive.
NOTE : La ligature n’est pas effectuée pour le groupe opération fictive. - Confirmer l’arrêt du flux sanguin dans le DAL : observer une couleur plus pâle dans la paroi antérieure du VG après la ligature. De plus, une élévation significative de la ST en quelques battements de cœur indique également une occlusion16. Si une ligature permanente est nécessaire (p. ex., MI), retirez la tubulure PE-10 et attachez le DAL directement avec un nœud. Reprenez la procédure restante comme indiqué à l’étape 4.3 ci-dessous.
- Retirez les écarteurs de l’incision. Ensuite, fermez temporairement la plaie avec une pince bouledogue. La durée de l’ischémie dépend du plan expérimental. Assurez-vous que la souris continue d’être connectée au ventilateur.
4. Reperfusion
- Lorsque la période d’ischémie se termine, retirez la pince bouledogue et insérez à nouveau les écarteurs pour ouvrir l’incision et exposer le cœur (en particulier le site de ligature).
- Dénouez le nœud collecteur et retirez le tube PE-10. Confirmez le rétablissement de la circulation sanguine à cette étape en observant le changement de couleur vers le rose-rouge dans les 20 s. En même temps, observez attentivement l’ECG : une dissolution potentielle de l’élévation ST suggère également une reperfusion.
- Quittez le 8-0 ligature in situ pour la coloration subséquente d’Evans-Blue et de TTC. Dans les autres cas, retirez la suture à cette étape.
- Retirez les écarteurs et fermez l’incision en suturant les troisième et quatrième côtes avec une suture en nylon 4-0. Veillez à ne pas blesser le poumon. Poussez l’air qui pourrait être emprisonné dans la cavité thoracique en appuyant doucement sur la poitrine tout en faisant les nœuds de suture.
- Fermez les couches musculaires avec des sutures continues. Fermez la peau avec une suture en nylon 4-0 ; Les sutures continues et les sutures interrompues sont acceptables.
5. Soins postopératoires
- Observez attentivement la souris pour détecter les signes de récupération de l’anesthésie, par exemple, le mouvement de la queue ou des moustaches. Après cela, la souris reprend généralement un schéma respiratoire normal avec une fréquence respiratoire d’environ 150 bpm. Extubez la souris en retirant lentement le tube.
- Surveillez la souris pendant 3 à 5 minutes supplémentaires pour vous assurer qu’il n’y a pas de détresse respiratoire.
- Administrer 100 μL de buprénorphine (0,1 mg/mL, s.c.) après que la souris a commencé à respirer. Pendant les 24 heures suivantes, fournir une dose supplémentaire toutes les 4 à 6 heures. Fournir de l’ibuprofène comme soulagement supplémentaire de la douleur dans l’eau potable sous forme de solution à 0,2 mg/mL pendant 2 jours avant et ≤7 jours après la chirurgie.
- Gardez les souris au chaud et réduisez le risque de mortalité en utilisant des couvertures d’isolation thermique car les souris sont sujettes à l’hypothermie après l’anesthésie.
6. Validation après la procédure
- Test de troponine-T
- Prélever des échantillons de sang dans les plexus rétroorbitaires et isoler les sérums par centrifugation (3 000 × g, 10 min, température ambiante).
- Diluer 20 μL de sérum à 100 μL avec une solution saline pour le test de troponine-T. Conservez le reste des échantillons à -80 °C.
- Détectez la troponine T (cTnT à l’aide d’un kit commercial en suivant les instructions du fabricant.
- Échographie cardiaque
REMARQUE : L’échographie cardiaque est utilisée pour évaluer la fonction cardiaque et les anomalies du mouvement de la paroi à différents stades avant et après la chirurgie selon le plan expérimental17,18. Différents paramètres tels que l’épaisseur de la paroi ventriculaire, le volume ventriculaire, le diamètre de la cavité ventriculaire, la fraction d’éjection et la fraction de raccourcissement à axe court sont mesurés.- Anesthésier les souris avec de la kétamine (80 mg/kg) et de la xylazine (10 mg/kg) par injection intrapéritonéale.
- Rasez-vous la poitrine avec un rasoir électrique. Utilisez une crème défroissante et massez uniformément. Essuyez l’excédent de fourrure lâche avec de la gaze.
- Placez la souris sur l’OT et fixez les quatre membres avec du ruban adhésif.
- Placez la sonde à ultrasons (30 MHz) sur la région antérieure du cœur à ~ 30° par rapport au sternum. Dans cette vue, la sonde est alignée avec le grand axe du cœur. Réglez l’échographie en mode B ; Le ventricule gauche, l’oreillette gauche, la valve mitrale et l’aorte ascendante peuvent être clairement identifiés. Utilisez la capture vidéo pour obtenir des données en vue d’une analyse ultérieure.
- En faisant pivoter le transducteur de 90° dans le sens des aiguilles d’une montre, obtenez une vue parasternale à court axe au niveau des muscles papillaires pour détecter clairement les ventricules gauche et droit. Utilisez ensuite le mode B et le mode M pour évaluer la fonction cardiaque et la morphométrie.
- Calculez le diamètre de la fin de la diastolique (Dd) du ventricule gauche, le diamètre de la fin de la systolique (Ds) et l’épaisseur de la cloison interventriculaire en spécifiant l’emplacement correspondant dans les images échographiques.
REMARQUE : L’appareil calculerait manuellement le volume diastolique en fin de ventricule gauche (LVEDV) et le volume systolique en fin de partie (LVESV). De plus, la machine calculerait les valeurs du raccourcissement fractionnaire (FS) et de la fraction d’éjection (EF) à l’aide des formules FS = (Dd-Ds)/Dd × 100 % et EF= (LVEDV-LVESV)/LVEDV × 100 %. Choisissez cinq cycles cardiaques consécutifs et obtenez leurs valeurs moyennes.
- Mesure de la taille de l’infarctus du myocarde
REMARQUE : La coloration Evans-Blue/TTC est utilisée pour mesurer la taille de l’infarctus car elle permet d’évaluer la viabilité des tissus19. Il est recommandé de colorer dans les 72 h suivant la reperfusion car la cicatrice va rétrécir. Cette étape est réalisée après euthanasie de l’animal avec 200 mg/kg de pentobarbital sodique par injection intrapéritonéale.- Exposez à nouveau le cœur en suivant les procédures précédentes des étapes 2.2 à 2.5. Ensuite, religaturer le DAL au site initial validé par la suture mentionnée à l’étape 4.3 à la fin de la durée de reperfusion souhaitée.
- Canulez l’aorte, puis perfusez le cœur avec 0,3 mL de solution de bleu d’Evans à 1 %. Le myocarde de la région non ischémique est coloré en bleu. Après perfusion, retirez rapidement le cœur en coupant l’aorte avec des ciseaux.
- Ensuite, lavez le cœur dans une solution de KCl (30 mM) pour arrêter les battements du cœur. Conserver à -20 °C pendant ≥4 h après avoir retiré le tissu adipeux environnant.
- Coupez le cœur dans le sens transversal en cinq tranches d’épaisseur 1 mm à l’aide d’un scalpel tranchant. Pesez les tranches puis incubez-les à 2% TTC pendant 40 min à 37 °C.
REMARQUE : Après l’incubation, les zones de l’infarctus sont délimitées en blanc, tandis que les tissus viables dans les zones sans infarctus restent rouges. - Fixez les tranches avec 4% de formaldéhyde pendant la nuit.
REMARQUE : Cette action améliorera le contraste entre la zone de l’infarctus et la zone de non-infarctus. Cela réduira également les tranches. - Photographiez les tranches avec un appareil photo numérique. Ensuite, calculez la zone à risque (AAR), la zone d’infarctus et la zone non ischémique à l’aide d’un logiciel graphique.
REMARQUE : Après la double coloration Evans-Blue / TTC, la zone bleue est la zone « normale ». Les zones restantes (y compris les zones blanches et rouges) sont les zones de « risque d’ischémie » : la zone blanche est la zone d’infarctus du myocarde (IA) et la zone rouge est la zone ischémique (mais pas d’infarctus). En tenant compte de l’incohérence de la taille des tranches de cœur, les résultats sont ajustés en fonction du poids.
Assigner:
A1-A5 pour la zone de l’infarctus / la zone de la tranche de cœur ;
B1-B5 pour la zone de non-infarctus / la zone de la tranche de cœur ;
W1-W5 pour le poids de la tranche de cœur.
Alors:
Poids total du myocarde infarctus : W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5 ;
Poids total du myocarde non infarctus : W1 × B1 + W2 × B2 + W3 × B3 + W4 × B4+ W5 × B5 ;
Poids total de l’AAR = (W1 + W2 +W3 + W4 + W5) - (W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5)
Finalement:
La zone d’ischémie myocardique est calculée comme le pourcentage d’AAR dans le ventricule gauche :
La superficie de l’infarctus du myocarde est calculée comme le pourcentage d’IA dans l’ARA :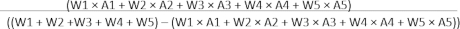
Résultats
Le flux de travail expérimental est illustré à la figure 1A. Le chercheur peut programmer les nœuds temporels en fonction de la conception expérimentale au début de l’étude. La durée de la ligature LAD dépend de l’objectif de la recherche. Dans le cas de l’IM, la recherche peut ignorer l’étape de reperfusion. L’échographie cardiaque est disponible à différents stades de l’étude car elle est non invasive, tandis que la coloration Evans-Blue/TTC ne peut être effectuée que lorsque la souris est sacrifiée. Pour les recherches qui se concentrent sur la fibrose et le remodelage ventriculaire, le temps d’observation est beaucoup plus long.
Les images typiques d’une partie du processus expérimental sont présentées à la figure 2A, de l’intubation endotrachéale, de l’incision cutanée, de la thoracotomie, de l’identification LAD, de la ligature LAD à la reperfusion. Pour vérifier l’ischémie myocardique et la reperfusion, les images ECG représentatives avec une élévation significative du ST après la ligature et la dissolution de l’élévation du ST lorsque le nœud coulant est dénoué sont présentées à la figure 2B.
Après avoir obtenu des échantillons de sang de toutes les souris, le test de troponine-T peut être entrepris pour valider l’infarctus. La figure 3A montre une augmentation significative de cTnT dans les groupes MIRI et MI par rapport aux groupes fictifs. La figure 3B montre la double coloration du bleu d’Evans et du TTC pour cinq coupes transversales consécutives du cœur entre le groupe simulé et le groupe MIRI. La zone bleue suggère la zone normale, la zone blanche suggère la zone de l’infarctus du myocarde et la zone rouge suggère la zone ischémique mais pas l’infarctus. La figure 3C représente les images grand axe de l’échographie cardiaque entre le groupe simulé et le groupe MI. Des applications logicielles peuvent être utilisées pour calculer différents paramètres fonctionnels, tels qu’une valeur plus élevée de la fraction d’éjection pour le groupe fictif de la figure 3C par rapport à celle du groupe MI.

Figure 1 : Configuration chirurgicale. (A) Vue d’ensemble de la chronologie expérimentale. (B) Table d’opération avec coussin chauffant préchauffé et raccord pour électrodes ECG. (C) Écarteurs faits maison. Veuillez cliquer ici pour voir une version agrandie de cette figure.
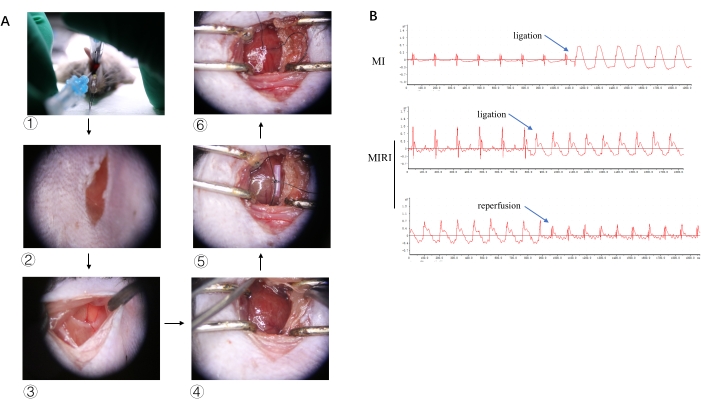
Figure 2 : Processus expérimental et modifications de l’ECG. (A)Des images de l’intubation endotrachéale, de l’incision cutanée, de la thoracotomie, de l’identification du DAL, de la ligature du LAD et de la reperfusion sont présentées en 1, 2, 3, 4, 5 et 6, respectivement. (B) Images ECG typiques de l’IM et de l’IRMI après ligature et reperfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
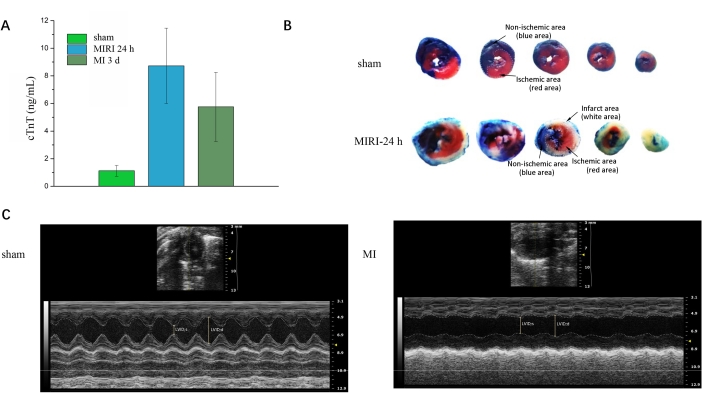
Figure 3 : Validation après l’intervention. (A) Expression de la troponine cardiaque chez les groupes simulés, MIRI 24 h et MI 3 d. (B) Evans -Bleu/TTC double coloration pour les groupes simulés et MIRI 24 h. (C) Échographie cardiaque pour les groupes fictifs et MI. LVID ; d, dimension interne du ventricule gauche en fin de diastolie ; LVID ; s, dimension interne du ventricule gauche systolique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Au cours des dernières années, la création de modèles pour l’IM et l’IRMI dans la recherche clinique et scientifique s’est développée rapidement20,21. Cependant, il reste encore quelques questions, telles que les mécanismes d’action et la façon d’améliorer l’IM/MIRI, qui doivent être résolues. Ici, un protocole modifié pour l’établissement d’un modèle murin de l’IM et de l’IRMI est décrit. Plusieurs points clés doivent être examinés avec soin.
Le premier point clé est l’intubation endotrachéale. Certaines procéduresimpliquent une incision de la peau cervicale, une séparation des tissus, suivie d’une exposition du muscle sterno-hoïdée pour voir la trachée. De cette façon, le chercheur peut visualiser l’insertion du tube dans la trachée. C’est une bonne étape pour réduire le risque de détresse respiratoire. Dans la méthode actuelle, le chercheur peut visualiser clairement la fermeture et l’ouverture de la glotte en respirant sous un illuminateur, puis insérer facilement le tube dans la trachée. Par conséquent, une incision cervicale n’est pas faite pour réduire les traumatismes cutanés et les infections potentielles, ce qui est important dans la recherche sur la signalisation inflammatoire. Les laryngoscopes visuels sont largement utilisés dans l’intubation trachéale clinique : peut-être peuvent-ils également être utilisés chez la souris. Mares et al.22 ont rapporté l’anesthésie par inhalation continue par masque sans intubation endotrachéale, qui a été réalisée par inhalation d’isoflurane à 2 % après induction d’isoflurane à 5 % avec de l’oxygène administré à travers un masque non invasif placé sur le nez et la bouche de l’animal. Il peut éviter les dommages aux tissus et améliorer la sécurité et l’efficacité de l’anesthésie. Cependant, un appareil spécial d’anesthésie par inhalation est nécessaire. De plus, les anesthésiques volatils peuvent causer des dommages physiques à l’opérateur.
Le deuxième point clé, et le plus important, est l’identification et la ligature du LAD. Chaque erreur dans l’identification et la ligature du DAL conduira à des résultats incohérents : soit une taille d’infarctus trop importante entraînant la mort, soit une taille d’infarctus trop petite entraînant un échec. Différentes méthodes peuvent être appliquées pour identifier le DAL et vérifier sa ligature. Ici, un microscope à dissection est utilisé pour localiser le LAD. Le LAD apparaît généralement sous la forme d’une fine ligne rouge perpendiculaire à partir de près de l’apex et vers le bas à travers le ventricule gauche. En appuyant doucement sur le site situé sous la position de ligature choisie pour agrandir temporairement le LAD (≤5 s par fois), le LAD peut être vérifié à nouveau. Après la ligature, l’occlusion LAD est vérifiée par une couleur plus pâle dans la paroi antérieure du ventricule gauche et une élévation significative du ST en quelques battements de cœur. Ensuite, la ligature est dénouée et la reperfusion est validée par un changement de couleur vers le rose-rouge dans les 20 s et une dissolution potentielle de l’élévation ST à l’ECG. Enfin, le test de troponine-T, la coloration TTC et l’échographie cardiaque sont utilisés pour évaluer la lésion myocardique. Ces multiples assurances et vérifications mutuelles rendent les résultats expérimentaux très fiables. De plus, la micromanipulation permet d’obtenir une plus grande précision et moins de complications (par exemple, des saignements). Une autre question importante est l’hypothèse que les vaisseaux sanguins des souris sont normaux, mais en fait, certaines artères coronaires varient considérablement, et même la circulation collatérale peut présenter23,24. Par conséquent, la taille des infarctus n’est parfois pas cohérente même si les ligatures sont considérées comme étant au même niveau. Les avantages du microscope sont exposés ici. La ligature ne peut pas se faire uniquement sur la base de l’expérience ou de repères anatomiques : le DAL et sa direction doivent être vérifiés clairement avant la ligature, sinon les résultats ne seront pas fiables. Dans certaines expériences6,8, les souris sont en position de décubitus latéral droit pour la commodité d’observer la paroi antérieure du ventricule gauche et les artères coronaires après une exposition cardiaque.
Ce modèle présente deux limites principales. Tout d’abord, la ligature LAD ne peut pas simuler l’occlusion de l’artère coronaire droite. En fait, en raison des différences anatomiques entre les animaux25, le LAD s’étend généralement jusqu’à l’apex du cœur chez les souris et les rats, et les branches circonflexes gauches ne sont pas développées, de sorte que les modèles chez les souris et les rats sont établis par ligature LAD. Pour les animaux de grande et moyenne taille tels que les lapins et les porcs, le LAD est relativement court, tandis que l’artère circonflexe gauche couvre une grande surface du cœur, de sorte que la ligature de l’artère circonflexe gauche est sélectionnée pour établir le modèle. Sicard et al.26 ont rapporté une nouvelle méthode pour étudier le dysfonctionnement ventriculaire droit et l’interaction biventriculaire par ligaturation de l’artère coronaire droite chez la souris, ce qui pourrait remédier à cette limitation. La deuxième limite est une taille d’infarctus incohérente due à la variabilité de l’anatomie de l’artère coronaire27 et à l’expérience du chirurgien. Comme nous l’avons vu plus haut, le microscope est très important pour augmenter la cohérence en vérifiant le LAD et sa direction avant la ligature, et pour un chercheur expérimenté, il est possible d’ajuster la position de ligature après une évaluation complète de l’anatomie vasculaire.
D’autres questions méritent d’être mentionnées. Par exemple, la thoracotomie et le perçage à l’aiguille causeront inévitablement de légers dommages aux muscles et au myocarde, ce qui peut avoir des effets sur l’inflammation. De plus, des agents analgésiques auraient des effets sur le MI28. Par conséquent, ces facteurs doivent être pris en considération lors de l’analyse de l’inflammation ou de ses effets sur l’IM. Pour le dépannage, il existe plusieurs facteurs qui entraîneraient la mort des souris. Par exemple, les complications liées à l’infarctus du myocarde, à l’accident anesthésique et aux saignements. De plus, les résultats incohérents proviennent principalement de positions de ligature inappropriées : une position de ligature trop haute induirait une taille d’infarctus trop importante, voire la mort des souris ; Pendant ce temps, la fausse identification de LAD entraînerait une défaillance du modèle. Certains détails doivent être améliorés dans cette méthode. Par exemple, il serait préférable qu’une sonde rectale puisse être insérée pour surveiller la température pendant la procédure. Enfin, l’expérimentateur doit garder à l’esprit les différences entre les études animales et les réalités cliniques, en particulier que le temps d’ischémie de 30 minutes est en effet assez court pour les études cliniques. Nous encourageons le chercheur à organiser les étapes en fonction de son plan d’expérience, y compris le temps d’ischémie. Ce n’est qu’ainsi que ce protocole peut être utile pour l’étude du mécanisme et du traitement de l’IM/MIRI et la découverte de médicaments.
En bref, un modèle murin simple et reproducteur pour MIRI et MI est fourni. Ce modèle peut être utilisé pour l’étude des mécanismes MI/MIRI et la recherche thérapeutique.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (82070317, 81700390 à Jibin Lin, 8210021880 à Bingjie Lv et 82000428 à Boyuan Wang) et le National Key R&D Program of China (2017YFA0208000 à Shaolin He).
matériels
| Name | Company | Catalog Number | Comments |
| 0.9 % sodium chloride solution | Kelun Industry Group,China | - | |
| 4% paraformaldehyde fixing solution | Servicebio,China | G1101 | - |
| 4-0 silk suture | Shanghai Pudong Jinhuan Medical Products,China | C412 | - |
| 8-0 suture | Shanghai Pudong Jinhuan Medical Products,China | H801 | - |
| Buprenorphine | IsoReag,China | IR-11190 | - |
| Camera | Canon,Japan | EOS 80D | - |
| Depilatory cream | Veet,French | - | |
| Elecsys Troponin T hs STAT | Roche,Germany | - | |
| Electrochemical luminescence immunoanalyzer | Roche,Germany | Elecsys 2010 | - |
| Evans blue | Sigma,America | E2129 | - |
| Eye scissors | Shanghai Medical Instruments,China | JC2303 | - |
| Haemostatic forceps | Shanghai Medical Instruments,China | J31020 | - |
| High frequency in vivo imaging systems | Visualsonics,Canada | Vevo2100 | - |
| Ibuprofen | PerFeMiKer,China | CLS-12921 | - |
| Intravenous catheter | Introcan,Germany | 4254090B | - |
| Ketamine | Sigma-Aldrich,America | K2753 | - |
| Medical alcohol | Huichang ,China | - | |
| Microneedle holders | Shanghai Medical Instruments,China | WA2040 | - |
| Microscopic shears | Shanghai Medical Instruments,China | WA1040 | - |
| Microsurgical forceps | Shanghai Medical Instruments,China | WA3020 | - |
| Mouse electrocardiograph | Techman,China | BL-420F | - |
| Needle holders | Shanghai Medical Instruments,China | JC3202 | - |
| operating floor | Chico,China | ZK-HJPT | - |
| PE-10 tube | Huamei,China | - | |
| Pentobarbital | Merck,America | 1030001 | - |
| Rodent Ventilator | Shanghai Alcott Biotech,China | ALC-V8S-P | - |
| Stereo microscope | Aomei Industry,China | SZM0745-STL3-T3 | - |
| Surgical thermostatic heating pad | Globalebio, China | GE0-20W | - |
| Triphenyltetrazolium chloride | Servicebio,China | G1017 | - |
| Xylazine | Huamaike Biochemicals and Life Science Research Prouducts,China | 323004 | - |
Références
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Ibanez, B., Heusch, G., Ovize, M., Van de Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. Journal of the American College of Cardiology. 65 (14), 1454-1471 (2015).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Kim, S. C., et al. A murine closed-chest model of myocardial ischemia and reperfusion. Journal of Visualized Experiments: JoVE. (65), e3896 (2012).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments: JoVE. (86), e51329 (2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments: JoVE. (94), e52206 (2014).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: An improved and simplified model for myocardial infarction. Journal of Visualized Experiments: JoVE. (122), e55353 (2017).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine myocardial infarction model using permanent ligation of left anterior descending coronary artery. Journal of Visualized Experiments: JoVE. (150), e59591 (2019).
- Li, X., et al. Cardioprotective effects of Puerarin-V on isoproterenol-induced myocardial infarction mice is associated with regulation of PPAR-Y/NF-Kappa B pathway. Molecules. 23 (12), 3322 (2018).
- Vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: A comparison with coronary artery ligation. American Journal of Physiology: Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Wang, D., et al. A cryoinjury model to study myocardial infarction in the mouse. Journal of Visualized Experiments: JoVE. (151), e59958 (2019).
- Brooks, W. W., Garibaldi, B. A., Conrad, C. H. Myocardial injury in the mouse induced by transthoracic cauterization. Laboratory Animal Science. 48 (4), 374-378 (1998).
- Tao, B., et al. Preclinical modeling and multimodality imaging of chronic myocardial infarction in minipigs induced by novel interventional embolization technique. EJNMMI Research. 6 (1), 59 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- Scofield, S. L., Singh, K. Confirmation of myocardial ischemia and reperfusion injury in mice using surface pad electrocardiography. Journal of Visualized Experiments: JoVE. (117), e54814 (2016).
- Gnyawali, S. C., et al. High-frequency high-resolution echocardiography: First evidence on non-invasive repeated measure of myocardial strain, contractility, and mitral regurgitation in the ischemia-reperfused murine heart. Journal of Visualized Experiments: JoVE. (41), e1781 (2010).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. Journal of Visualized Experiments: JoVE. (42), e2100 (2010).
- Shibata, R., et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nature Medicine. 11 (10), 1096-1103 (2005).
- Anderson, J. L., Morrow, D. A. Acute myocardial infarction. New England Journal of Medicine. 376 (21), 2053-2064 (2017).
- Frank, A., et al. Myocardial ischemia reperfusion injury: From basic science to clinical bedside. Seminars in Cardiothoracic and Vascular Anesthesia. 16 (3), 123-132 (2012).
- Mares, R. G., et al. Studying the innate immune response to myocardial infarction in a highly efficient experimental animal model. Romanian Journal of Cardiology. 31 (3), 573-585 (2021).
- Fernandez, B., et al. The coronary arteries of the C57bl/6 mouse strains: Implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Zhang, R., Hess, D. T., Reynolds, J. D., Stamler, J. S. Hemoglobin S-nitrosylation plays an essential role in cardioprotection. Journal of Clinical Investigation. 126 (12), 4654-4658 (2016).
- Sorop, O., et al. Experimental animal models of coronary microvascular dysfunction. Cardiovascular Research. 116 (4), 756-770 (2020).
- Sicard, P., et al. Right coronary artery ligation in mice: A novel method to investigate right ventricular dysfunction and biventricular interaction. American Journal of Physiology: Heart and Circulatory Physiology. 316 (3), 684-692 (2019).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology: Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Kato, R., Foex, P. Myocardial protection by anesthetic agents against ischemia-reperfusion injury: An update for anesthesiologists. Canadian Journal of Anaesthesia. 49 (8), 777-791 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.