Method Article
Induktion von Myokardinfarkt und myokardialer Ischämie-Reperfusionsschädigung bei Mäusen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine einfache und reproduzierbare Methode, die bei Mäusen durch Präzisionsligation der linken vorderen absteigenden Koronararterie durch Mikromanipulation einen Myokardinfarkt oder eine myokardiale Ischämie-Reperfusionsverletzung induzieren kann.
Zusammenfassung
Der akute Myokardinfarkt ist eine häufige Herz-Kreislauf-Erkrankung mit hoher Mortalität. Eine myokardiale Reperfusionsverletzung kann den positiven Auswirkungen des Herzreflows entgegenwirken und eine sekundäre Myokardschädigung induzieren. Ein einfaches und reproduzierbares Modell des Myokardinfarkts und der myokardialen Ischämie-Reperfusionsverletzung ist ein gutes Werkzeug für Forscher. Hier wird eine anpassbare Methode zur Erstellung eines Myokardinfarktmodells (MI) und MIRI durch Präzisionsligation der linken vorderen absteigenden Koronararterie (LAD) durch Mikromanipulation beschrieben. Die genaue und reproduzierbare Ligaturpositionierung des LAD trägt dazu bei, konsistente Ergebnisse bei Herzverletzungen zu erzielen. ST-Segment-Änderungen können helfen, die Modellgenauigkeit zu identifizieren. Der Serumspiegel von kardialem Troponin T (cTnT) wird verwendet, um die Myokardverletzung zu beurteilen, Herzultraschall wird verwendet, um die myokardiale systolische Funktion zu beurteilen, und Evans-Blue/Triphenyltetrazoliumchlorid-Färbung wird verwendet, um die Infarktgröße zu messen. Im Allgemeinen verkürzt dieses Protokoll die Dauer des Eingriffs, gewährleistet eine kontrollierbare Infarktgröße und verbessert das Überleben der Maus.
Einleitung
Der akute Myokardinfarkt (AMI) ist eine weltweit häufige Herz-Kreislauf-Erkrankung und mit hoher Sterblichkeit verbunden1. Fortschritte in der Technologie machen eine frühzeitige und wirksame Revaskularisierung für AMI-Patienten möglich. Nach diesen Behandlungen kann es bei einigen Patienten zu einer myokardialen Ischämie-Reperfusionsverletzung (MIRI) kommen2. Daher ist es von großer Bedeutung, die Wirkmechanismen zu verstehen und MI/MIRI zu verbessern. Mäuse werden aufgrund ihrer geringen Kosten, ihrer kurzen Brutzeit und ihrer einfachen genetischen Veränderungen häufig als Modelle verwendet3. Wissenschaftler haben verschiedene Methoden entwickelt, um MIRI und MI bei Tierenzu modellieren 4,5,6,7,8,9. Diese Strategie fördert die Forschung, aber die unterschiedlichen Kriterien und Methoden erschweren die Interpretation der Ergebnisse zwischen den Forschungsteams.
Bei Mäusen wurde der Myokardinfarkt durch Isoproterenol10, Kryoverletzung 11,12 oder Kauterisation13 induziert. Ein Myokardinfarkt kann leicht durch Isoproterenol induziert werden, aber der pathophysiologische Prozess unterscheidet sich von dem des klinischen Myokardinfarkts. Kryoverletzungs-induzierter Myokardinfarkt hat eine schlechte Konsistenz, löst übermäßige Myokardschäden um die linke anteriore absteigende Koronararterie (LAD) aus und kann leicht Arrhythmien hervorrufen. Der durch Kauterisation induzierte Myokardinfarkt unterscheidet sich deutlich vom natürlichen Prozess des Myokardinfarkts, und die Entzündungsreaktion im brennenden Bereich ist intensiver; Darüber hinaus weist der chirurgische Ansatz technische Schwierigkeiten auf. Darüber hinaus gibt es einige Laboratorien14, die ein MI-Modell bei Minischweinen entwickeln, bei denen Ballonblockierung oder Embolisation oder Thrombose durch interventionelle Technik verwendet wird. Alle diese Methoden können direkt zu einem Verschluss der Herzkranzgefäße führen, aber die Notwendigkeit von Koronarangiographiegeräten und vor allem der zu dünnen Herzkranzgefäße der Maus macht diese Operationen nicht praktikabel. Bei MIRI waren die Unterschiede zwischen den verschiedenen Modellen recht gering, wie z. B. die Verwendung von Atemschutzmasken/Mikromanipulation oder nicht 5,6.
Hier wird eine einfache und zuverlässige Methode beschrieben, die MI induzieren kann, und das MIRI-Modell, das von den zuvor veröffentlichten Methoden 4,5,6,7,8,9,15 adaptiert wurde. Mit dieser Methode können pathophysiologische Prozesse durch direkte Blockade des LAD durch Ligatur simuliert werden. Darüber hinaus kann dieses Modell durch die Entlastung der Ligatur auch eine Reperfusionsschädigung simulieren. In diesem Protokoll wird ein Präpariermikroskop für die LAD-Visualisierung verwendet. Dann kann der Forscher die LAD leicht identifizieren. In der Folge führt eine genaue Ligatur des LAD zu einem reproduzierbaren und vorhersagbaren Blutverschluss und einer ventrikulären Ischämie. Darüber hinaus können elektrokardiographische (EKG) Veränderungen verwendet werden, um Ischämie und Reperfusion zusätzlich zu den unter dem Mikroskop beobachteten Farbänderungen des LAD zu bestätigen. Diese Strategie führt zu einer kürzeren Verfahrensdauer, einem geringeren Risiko für chirurgische Komplikationen und weniger benötigten Versuchsmäusen. Die Methoden für den Troponin-T-Test, den Herzultraschall und die Triphenyltetrazoliumchlorid (TTC)-Färbung werden ebenfalls beschrieben. Insgesamt ist dieses Protokoll sowohl für Studien des MI/MIR-Mechanismus als auch für die Arzneimittelforschung nützlich.
Protokoll
Tierstudien wurden vom Animal Care and Utilization Committee der Huazhong University of Science and Technology (Wuhan, China) genehmigt.
HINWEIS: Männliche C57BL/6J-Mäuse (8-10 Wochen) werden als Modelle verwendet. Mäuse haben freien Zugang zu Futter und Wasser und werden unter spezifischen, pathogenfreien Bedingungen gezüchtet. Der Raum wird unter kontrollierter Temperatur (22 °C ± 2 °C) und Luftfeuchtigkeit (45%-65%) gehalten. Mäuse werden in der Tierpflegeeinrichtung der Tongji Medical School (Wuhan, China) gemäß den von dieser Einrichtung festgelegten Richtlinien einer 12-stündigen Hell-Dunkel-Umgebung ausgesetzt. Verwenden Sie sterile mikrochirurgische Instrumente und chirurgisches Zubehör. Chirurgische Handschuhe und Masken sind während des gesamten Eingriffs erforderlich. Der experimentelle Arbeitsablauf ist in Abbildung 1A dargestellt.
1. Präoperative Vorbereitung
- Verwenden Sie während des gesamten chirurgischen Eingriffs einen rechteckigen Operationstisch (OT) mit einem vorgewärmten Heizkissen (37 °C) (Abbildung 1B). Desinfizieren Sie die Tafel mit ultraviolettem Licht und 70%igem Alkohol, bevor Sie mit dem Verfahren beginnen.
- Wiegen Sie alle Mäuse genau, um die Dosis der benötigten Anästhetika zu berechnen. Anschließend werden die Mäuse mit Ketamin (80 mg/kg) und Xylazin (10 mg/kg) per intraperitonealer Injektion anästhesiert. Sorgen Sie für eine angemessene Narkosetiefe, indem Sie keinen Rückzugsreflex auf Zehenkneif- und Blinzelreflexe ausüben.
- Legen Sie die Maus in Rückenlage mit Gaze unter den Kopf, um eine Überhitzung der Augen zu vermeiden. Tragen Sie Augensalbe auf die Augen auf, um sie vor dem Austrocknen zu schützen.
- Rasieren Sie das Fell auf der linken präkordialen Brust mit einem elektrischen Rasierer. Verwenden Sie eine Fellentfernungscreme auf dem vorrasierten Brustkorb und massieren Sie sie mit einem sterilen Wattestäbchen ~1 Minute lang gleichmäßig ein. Wischen Sie das überschüssige lose Fell mit Gaze ab.
- Verwenden Sie Povidon-Jod, gefolgt von 70%igem Alkohol, um den Bereich zu reinigen. Bedecke den Brustkorb mit Gaze.
- Verwenden Sie eine 4-0-Naht unter den oberen Schneidezähnen und befestigen Sie sie am Verankerungspunkt (nahe dem Rand des OT über der Nase), um den Mund leicht offen zu halten und die Kanülierung zu erleichtern.
- Ziehe am Schwanz, um den Körper gerade zu halten, und befestige den Schwanz mit Klebeband am OT. Befestigen Sie die vier Gliedmaßen und ziehen Sie sie an den anderen Verankerungspunkten fest. Wichtig ist, dass Sie die vorderen Gliedmaßen nicht überdehnen. Andernfalls kann es zu einer Beeinträchtigung der Atemwege kommen.
- Verwende gebogene Pinzetten und Pinzetten, um den Kiefer zu öffnen und die Zunge anzuheben. Verwenden Sie einen Illuminator, um den Hals und die Stimmritze deutlich zu visualisieren.
- Führen Sie eine 22-G-Kanüle vorsichtig mit einer stumpfen und abgeschnittenen Nadel durch den Mund ~1 cm den Rachen hinunter in die Luftröhre ein. Halten Sie die Zunge mit einer Hand fest, bewegen Sie sie mit einer stumpfen Pinzette leicht nach oben und führen Sie gleichzeitig mit der anderen Hand den Schlauch vorsichtig in die Luftröhre ein. Achten Sie darauf, den Schlauch nicht in die Speiseröhre einzuführen.
- Entfernen Sie die Nadel vorsichtig. Überprüfen Sie die Intubation, indem Sie den Schlauch ins Wasser halten, um Blasen zu erkennen, bevor Sie ihn an das Beatmungsgerät anschließen.
- Schließen Sie den Endotrachealtubus an ein Beatmungsgerät an, das auf 120/min eingestellt ist und dessen Tidalvolumen auf 250 μl eingestellt ist.
HINWEIS: Die Einstellung des Beatmungsgeräts wird an das Körpergewicht angepasst (im Allgemeinen erfordert ein höheres Körpergewicht ein höheres Atemzugvolumen). - Überprüfen Sie die Intubation, indem Sie die bilaterale symmetrische Thoraxerweiterung überprüfen. Dann wird die Verbindung mit Klebeband am OT befestigt, um ein Herunterfallen des Schlauches zu vermeiden.
- Platzieren Sie EKG-Elektroden an den Pfoten und schließen Sie sie an den EKG-Rekorder an. Überwachen Sie die Elektrophysiologie des Herzens während des gesamten Eingriffs.
2. Thorakotomie
- Entferne die Gaze am Brustkorb. Desinfizieren Sie die Schnittbereiche erneut mit 70%igem Alkohol in drei Peeling-Zyklen. Decken Sie die Maus dann mit einem sterilen OP-Tuch mit einem Loch über dem Operationsfeld ab, um die Kontamination des Operationsfeldes zu reduzieren.
- Machen Sie mit einem sterilen Skalpell einen schrägen Hautschnitt (0,8-1,0 cm) entlang der linken mittleren Schlüsselbeinlinie.
- Führen Sie eine stumpfe Dissektion des Unterhautgewebes durch, um die darunter liegenden Rippen freizulegen. Achten Sie darauf, Gefäße, Rippen und Lungen nicht zu verletzen. Stoppen Sie die Blutung, indem Sie sterile Baumwollapplikatoren verwenden.
- Identifizieren und machen Sie einen Schnitt von ca. 6-8 mm im dritten Zwischenrippenraum. Führen Sie dann eine stumpfe Dissektion des Gewebes im Zwischenküstenraum durch, um die Brusthöhle zu öffnen. Achten Sie darauf, die Arteria thoracica interna nicht zu verletzen.
- Verwende eine Pinzette, um den Interkostalraum zu überspannen. Führen Sie vorsterilisierte, selbstgemachte Retraktoren (Abbildung 1C) in den Brustkorb ein und ziehen Sie sie zurück, um den Einschnitt auf ~6 mm Breite zu spreizen. Befestigen Sie die Retraktoren mit Gummibändern am OP.
- Entfernen Sie das umliegende Gewebe vorsichtig, um das Herz vollständig freizulegen. Ziehen Sie den Herzbeutel vorsichtig mit einer gebogenen Pinzette ab, ohne das Herz zu verletzen. Nun ist eine freie Sicht auf das Herz gegeben.
3. LAD-Ligatur
HINWEIS: Der LAD erscheint als dünne rote Linie, die senkrecht von der Nähe des Apex nach unten durch die linke Herzkammer verläuft. Der LAD hat eine leuchtend rote Farbe, also achten Sie darauf, ihn nicht mit einer Vene zu verwechseln. In der Regel befindet sich die Ligaturstelle ~1-2 mm unterhalb der linken Ohrmuschel. Diese Ligaturposition erzeugt etwa 40%-50% der Ischämie im linken Ventrikel. Eine höhere Position führt zu einer ausgedehnteren Infarktzone. Eine weiter entfernte Lokalisation führt zu einer kleineren Infarktzone.
- Verwenden Sie ein Präpariermikroskop und richten Sie ein fokussiertes und geeignetes Licht für die LAD-Visualisierung. Drücken Sie vorsichtig auf die Stelle unterhalb der gewählten Ligaturposition, um die LAD vorübergehend zu vergrößern (≤5 s pro Mal). Überprüfen Sie die LAD auf diese Weise erneut.
- Verwende eine spitz zulaufende Nadel (3/8, 2,5 x 5), um eine 8-0 zu passieren Seidenligatur unter dem LAD unter dem Präpariermikroskop. Seien Sie vorsichtig mit der Nadeltiefe: nicht zu tief, um in die linke Herzkammer einzudringen, und nicht zu flach, um eine Beschädigung der LAD zu vermeiden.
- Binde die Ligatur mit einem lockeren Doppelknoten. Der Schlaufendurchmesser beträgt ca. 2-3 mm.
- Legen Sie einen 2-3 mm PE-10 Schlauch in eine Schlaufe parallel zur Arterie.
- Ziehen Sie die Ligaturschlaufe vorsichtig fest, bis sie sich um die Arterie und den Schlauch befindet. Befestigen Sie dann die Schlaufe mit einem Schlupfknoten. Achten Sie darauf, die Herzmuskelwand nicht durch übermäßigen Anzugsdruck zu beschädigen.
HINWEIS: Für die Scheinoperationsgruppe wird keine Ligatur durchgeführt. - Bestätigen Sie die Beendigung des Blutflusses im LAD: beobachten Sie nach der Ligatur eine blassere Farbe in der Vorderwand des LV. Darüber hinaus deutet eine signifikante ST-Erhöhung innerhalb weniger Herzschläge auch auf eine Okklusionhin 16. Wenn eine permanente Ligatur erforderlich ist (z. B. MI), entfernen Sie den PE-10-Schlauch und binden Sie den LAD direkt mit einem Knoten. Setzen Sie den verbleibenden Vorgang fort, wie in Schritt 4.3 unten beschrieben.
- Entfernen Sie die Retraktoren aus dem Einschnitt. Verschließen Sie dann die Wunde vorübergehend mit einer Bulldoggenklemme. Die Dauer der Ischämie richtet sich nach dem Versuchsplan. Stellen Sie sicher, dass die Maus weiterhin mit dem Beatmungsgerät verbunden ist.
4. Reperfusion
- Wenn die Periode der Ischämie endet, entfernen Sie die Bulldoggenklemme und führen Sie die Retraktoren erneut ein, um den Einschnitt zu öffnen und das Herz (insbesondere die Ligaturstelle) freizulegen.
- Lösen Sie den Strumpfknoten und entfernen Sie den PE-10-Schlauch. Bestätigen Sie die Wiederherstellung des Blutflusses in diesem Schritt, indem Sie innerhalb von 20 Sekunden beobachten, wie sich die Farbe wieder zu Rosa-Rot ändert. Gleichzeitig sollte das EKG genau beobachtet werden: Eine mögliche Auflösung der ST-Hebung deutet ebenfalls auf eine Reperfusion hin.
- Belassen Sie das 8-0 Ligatur in situ für die anschließende Evans-Blue- und TTC-Färbung. In anderen Fällen entfernen Sie die Naht in diesem Schritt.
- Entfernen Sie die Retraktoren und schließen Sie den Einschnitt, indem Sie die dritte und vierte Rippe mit einer 4-0-Nylonnaht vernähen. Achten Sie darauf, die Lunge nicht zu verletzen. Drücken Sie die Luft heraus, die in der Brusthöhle eingeschlossen sein könnte, indem Sie sanft auf die Brust drücken, während Sie die Nahtknoten binden.
- Verschließen Sie die Muskelschichten mit durchgehenden Nähten. Schließen Sie die Haut mit einer 4-0-Nylonnaht; Durchgehende Nähte und unterbrochene Nähte sind akzeptabel.
5. Nachsorge
- Beobachten Sie die Maus sorgfältig auf Anzeichen einer Erholung von der Narkose, z. B. Bewegungen des Schwanzes oder der Schnurrhaare. Danach nimmt die Maus in der Regel ein normales Atemmuster mit einer Atemfrequenz von etwa 150 Schlägen pro Minute wieder auf. Extubieren Sie die Maus, indem Sie den Schlauch langsam entfernen.
- Überwachen Sie die Maus für weitere 3-5 Minuten, um sicherzustellen, dass keine Atemnot auftritt.
- Verabreichen Sie 100 μl Buprenorphin (0,1 mg/ml, s.c.), nachdem die Maus zu atmen begonnen hat. Verabreichen Sie in den nächsten 24 Stunden alle 4-6 Stunden eine zusätzliche Dosis. Verabreichen Sie Ibuprofen als zusätzliche Schmerzlinderung im Trinkwasser als 0,2 mg/ml-Lösung für 2 Tage vor und ≤7 Tage nach der Operation.
- Halten Sie die Mäuse warm und verringern Sie das Sterberisiko, indem Sie Wärmedämmdecken verwenden, da Mäuse nach der Narkose zu Unterkühlung neigen.
6. Validierung nach dem Eingriff
- Troponin-T-Test
- Es werden Blutproben aus den retroorbitalen Plexus entnommen und die Seren durch Zentrifugation isoliert (3.000 × g, 10 min, Raumtemperatur).
- Verdünnen Sie 20 μl Serum auf 100 μl mit Kochsalzlösung für den Troponin-T-Test. Die restlichen Proben werden bei -80 °C gelagert.
- Erkennen Sie das Troponin T (cTnT mit einem handelsüblichen Kit gemäß den Anweisungen des Herstellers.
- Ultraschall des Herzens
HINWEIS: Der Herzultraschall wird verwendet, um Herzfunktions- und Wandbewegungsanomalien in verschiedenen Stadien vor und nach der Operation gemäß dem Versuchsdesign17,18 zu beurteilen. Gemessen werden verschiedene Parameter wie Ventrikelwanddicke, Ventrikelvolumen, Ventrikelhöhlendurchmesser, Ejektionsfraktion und Kurzachsenverkürzungsfraktion.- Betäuben Sie die Mäuse mit Ketamin (80 mg/kg) und Xylazin (10 mg/kg) per intraperitonealer Injektion.
- Rasiere die Brust mit einem elektrischen Rasierer. Fellentfernungscreme verwenden und gleichmäßig einmassieren. Wischen Sie das überschüssige lose Fell mit Gaze ab.
- Setzen Sie die Maus auf den OP und sichern Sie die vier Gliedmaßen mit Klebeband.
- Platzieren Sie die Ultraschallsonde (30 MHz) im vorderen Bereich des Herzens in ~ 30° zum Brustbein. Die Sonde in dieser Ansicht ist auf die Längsachse des Herzens ausgerichtet. Stellen Sie den Ultraschall in den B-Modus; Die linke Herzkammer, der linke Vorhof, die Mitralklappe und die aufsteigende Aorta können eindeutig identifiziert werden. Verwenden Sie die Videoaufzeichnung, um Daten für die anschließende Analyse zu erhalten.
- Durch Drehen des Schallkopfes um 90° im Uhrzeigersinn erhalten Sie eine parasternale Kurzachsenansicht auf Höhe der Papillarmuskeln, um die linke und rechte Herzkammer eindeutig zu erkennen. Verwenden Sie dann den B-Modus und den M-Modus , um die Herzfunktion und Morphometrie zu beurteilen.
- Berechnen Sie den linksventrikulären enddiastolischen Durchmesser (Dd), den endsystolischen Durchmesser (Ds) und die interventrikuläre Septumdicke, indem Sie die entsprechende Stelle in den Ultraschallbildern angeben.
HINWEIS: Das Gerät berechnet manuell das linksventrikuläre enddiastolische Volumen (LVEDV) und das endsystolische Volumen (LVESV). Außerdem berechnet die Maschine die Werte für die fraktionierte Verkürzung (FS) und die Auswurffraktion (EF) mit den Formeln FS = (Dd-Ds)/Dd × 100 % und EF= (LVEDV-LVESV)/LVEDV × 100 %. Wählen Sie fünf aufeinanderfolgende Herzzyklen aus und ermitteln Sie deren Mittelwerte.
- Messung der Myokardinfarktgröße
HINWEIS: Die Evans-Blue/TTC-Färbung wird zur Messung der Infarktgröße verwendet, da sie die Lebensfähigkeit des Gewebes beurteilen kann19. Es wird empfohlen, innerhalb von 72 Stunden nach der Reperfusion zu färben, da die Narbe schrumpft. Dieser Schritt wird nach der Euthanasie des Tieres mit 200 mg/kg Pentobarbital-Natrium durch intraperitoneale Injektion durchgeführt.- Legen Sie das Herz erneut frei, indem Sie die vorherigen Verfahren aus den Schritten 2.2 bis 2.5 befolgen. Anschließend wird die LAD am Ende der gewünschten Reperfusionsdauer an der Ausgangsstelle religiert, die durch die in Schritt 4.3 erwähnte Naht validiert wurde.
- Kanülieren Sie die Aorta und perfundierten Sie dann das Herz mit 0,3 ml 1%iger Evansblau-Lösung. Das Myokard der nicht-ischämischen Region ist blau gefärbt. Nach der Perfusion wird das Herz schnell entfernt, indem die Aorta mit einer Schere durchtrennt wird.
- Waschen Sie dann das Herz in KCl-Lösung (30 mM), um den Herzschlag zu stoppen. Bei -20 °C für ≥4 h lagern, nachdem das umgebende Fettgewebe entfernt wurde.
- Schneiden Sie das Herz in Querrichtung mit einem scharfen Skalpell in fünf Scheiben mit einer Dicke von 1 mm. Die Scheiben werden gewogen und anschließend mit 2% TTC für 40 min bei 37 °C inkubiert.
HINWEIS: Nach der Inkubation werden die Infarktbereiche als weiß abgegrenzt, während lebensfähiges Gewebe in Nicht-Infarktbereichen rot bleibt. - Die Scheiben über Nacht mit 4% Formaldehyd fixieren.
HINWEIS: Diese Aktion verstärkt den Kontrast zwischen dem Infarktbereich und dem Nicht-Infarktbereich. Außerdem werden die Scheiben verkleinert. - Fotografieren Sie die Scheiben mit einer Digitalkamera. Berechnen Sie dann den Risikobereich (AAR), den Infarktbereich und die nicht-ischämische Zone mithilfe einer Grafiksoftware.
HINWEIS: Nach der Evans-Blue/TTC-Doppelfärbung ist der blaue Bereich der "normale" Bereich. Die übrigen Bereiche (einschließlich Weiß und Rot) sind die Bereiche mit "Ischämierisiko": Der weiße Bereich ist der Myokardinfarktbereich (IA) und der rote Bereich ist der ischämische (aber nicht infarktierte) Bereich. Unter Berücksichtigung der Inkonsistenz der Größe der Herzschnitte werden die Ergebnisse um das Gewicht bereinigt.
Zuweisen:
A1-A5 für Bereich der Infarktzone / Bereich des Herzschnitts;
B1-B5 für Bereich der Nicht-Infarktzone/ Bereich des Herzschnitts;
W1-W5 für Gewicht der Herzscheibe.
Dann:
Gesamtgewicht des infarktierten Myokards: W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5;
Gesamtgewicht des nicht infarktierten Myokards: W1 × B1 + W2 × B2 + W3 × B3 + W4 × B4+ W5 × B5;
Gesamtgewicht AAR = (W1 + W2 + W3 + W4 + W5) - (W1 × A1 + W2 × A2 + W3 × A3 + W4 × A4 + W5 × A5)
Endlich:
Der Bereich der myokardialen Ischämie wird als Prozentsatz der AAR im linken Ventrikel berechnet:
Der Bereich des Myokardinfarkts wird als Prozentsatz der IA im AAR berechnet: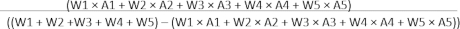
Ergebnisse
Der experimentelle Arbeitsablauf ist in Abbildung 1A dargestellt. Der Forscher kann die Zeitknoten entsprechend dem Versuchsdesign bei Studienbeginn planen. Die Dauer der LAD-Ligatur richtet sich nach dem Forschungszweck. Bei Myokardinfarkt kann die Forschung den Reperfusionsschritt ignorieren. Herzultraschall ist in verschiedenen Stadien der Studie verfügbar, da er nicht-invasiv ist, während die Evans-Blue/TTC-Färbung nur durchgeführt werden kann, wenn die Maus getötet wird. Für Forschungen, die sich auf Fibrose und ventrikuläres Remodeling konzentrieren, ist die Beobachtungszeit viel länger.
Die typischen Bilder für einen Teil des Versuchsprozesses sind in Abbildung 2A dargestellt, von der endotrachealen Intubation, der Hautinzision, der Thorakotomie, der LAD-Identifizierung, der LAD-Ligatur bis hin zur Reperfusion. Um die myokardiale Ischämie und Reperfusion zu verifizieren, sind in Abbildung 2B die repräsentativen EKG-Bilder mit signifikanter ST-Hebung nach Ligatur und Auflösung der ST-Hebung bei gelöstem Slipknot dargestellt.
Nach der Entnahme von Blutproben von allen Mäusen kann der Troponin-T-Test durchgeführt werden, um den Infarkt zu validieren. Abbildung 3A zeigt einen signifikanten Anstieg von cTnT in MIRI- und MI-Gruppen im Vergleich zu den Scheingruppen. Abbildung 3B zeigt die Doppelfärbung von Evans-Blau und TTC für fünf aufeinanderfolgende Querschnitte des Herzens zwischen der Scheingruppe und der MIRI-Gruppe. Der blaue Bereich deutet auf den normalen Bereich hin, der weiße Bereich auf den Myokardinfarktbereich und der rote Bereich auf den ischämischen, aber nicht infarktierten Bereich. Abbildung 3C zeigt die Längsachsenbilder des Herzultraschalls zwischen der Scheingruppe und der MI-Gruppe. Softwareanwendungen können verwendet werden, um verschiedene Funktionsparameter zu berechnen, wie z. B. einen höheren Wert der Ejektionsfraktion für die Scheingruppe in Abbildung 3C im Vergleich zu dem in der MI-Gruppe.

Abbildung 1: Chirurgischer Aufbau. (A) Überblick über den experimentellen Zeitplan. (B) OP-Tisch mit vorgewärmtem Heizkissen und Anschluss für EKG-Elektroden. (C) Selbstgebaute Retraktoren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
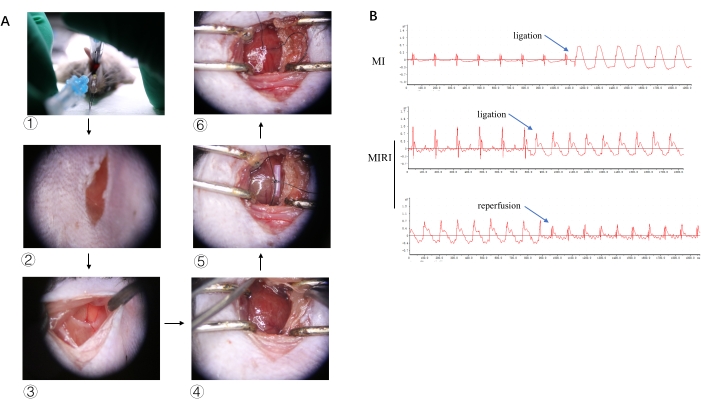
Abbildung 2: Experimenteller Ablauf und EKG-Veränderungen. (A)Bilder der endotrachealen Intubation, der Hautinzision, der Thorakotomie, der LAD-Identifizierung, der LAD-Ligatur und der Reperfusion sind in 1, 2, 3, 4, 5 bzw. 6 dargestellt. (B) Typische EKG-Bilder von MI und MIRI nach Ligatur und Reperfusion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
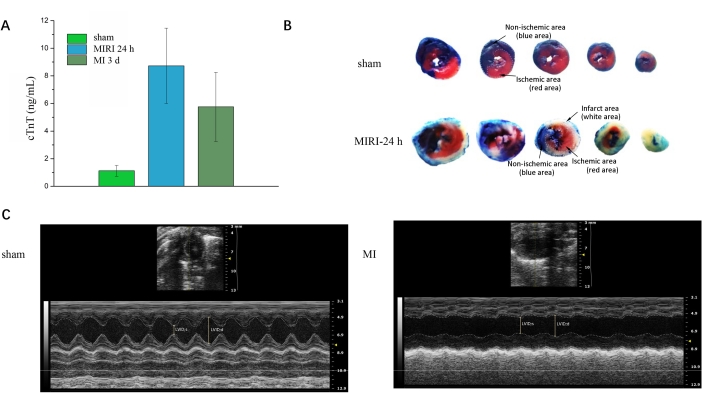
Abbildung 3: Validierung nach dem Eingriff. (A) Expression von kardialem Troponin in Schein-, MIRI-24-h- und MI-3d-Gruppen. (B) Evans-Blau/TTC-Doppelfärbung für Schein- und MIRI-24-Stunden-Gruppen. (C) Herzultraschall für Schein- und Myokardinfarkte. LVID; d, enddiastolische linksventrikuläre innere Dimension; LVID; s, systolische linksventrikuläre innere Dimension. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In den letzten Jahren hat sich die Erstellung von Modellen für MI und MIRI in der klinischen und wissenschaftlichen Forschung rasant entwickelt20,21. Es gibt jedoch noch einige Fragen, wie z. B. die Mechanismen der Maßnahmen und wie MI/MIRI verbessert werden können, die geklärt werden müssen. Hier wird ein modifiziertes Protokoll zur Etablierung eines murinen Modells von MI und MIRI beschrieben. Einige wichtige Punkte müssen sorgfältig abgewogen werden.
Der erste wichtige Punkt ist die endotracheale Intubation. Einige Verfahren6,9 beinhalten einen Schnitt der zervikalen Haut, eine Gewebetrennung, gefolgt von einer Freilegung des Musculus sternohyoideus, um die Luftröhre zu betrachten. Auf diese Weise kann der Forscher das Einführen eines Schlauchs in die Luftröhre visualisieren. Dies ist ein guter Schritt, um das Risiko von Atemnot zu verringern. Bei der aktuellen Methode kann der Forscher das Schließen und Öffnen der Stimmritze mit der Atmung unter einer Illumination deutlich visualisieren und dann den Schlauch einfach in die Luftröhre einführen. Daher wird ein Gebärmutterhalsschnitt nicht vorgenommen, um Hauttraumata und potenzielle Infektionen zu reduzieren, was für die Erforschung von Entzündungssignalen wichtig ist. Visuelle Laryngoskope werden häufig in der klinischen Trachealintubation eingesetzt: Vielleicht können sie auch bei Mäusen eingesetzt werden. Mares et al.22 berichteten über die kontinuierliche Maskeninhalationsanästhesie ohne endotracheale Intubation, die durch eine 2%ige Isofluran-Inhalation nach einer 5%igen Isofluran-Induktion mit Sauerstoff durchgeführt wurde, der durch eine nicht-invasive Maske über Nase und Mund des Tieres gelegt wurde. Es kann Gewebeschäden vermeiden und die Sicherheit und Effizienz der Anästhesie verbessern. Es wird jedoch ein spezielles Inhalationsanästhesiegerät benötigt. Darüber hinaus können flüchtige Anästhetika den Bediener körperlich schädigen.
Der zweite und wichtigste Schlüsselpunkt ist die Identifizierung und Ligatur der LAD. Jeder Fehler bei der LAD-Identifizierung und -Ligatur führt zu inkonsistenten Ergebnissen: entweder eine zu große Infarktgröße mit Todesfolge oder eine zu kleine Infarktgröße mit Versagen. Es können verschiedene Methoden angewendet werden, um die LAD zu identifizieren und ihre Ligatur zu verifizieren. Hier wird ein Präpariermikroskop verwendet, um die LAD zu lokalisieren. Die LAD erscheint in der Regel als dünne rote Linie, die senkrecht von der Nähe des Apex nach unten durch die linke Herzkammer verläuft. Durch leichtes Drücken der Stelle unterhalb der gewählten Ligaturposition, um die LAD vorübergehend (≤5 s pro Mal) zu vergrößern, kann die LAD erneut überprüft werden. Nach der Ligatur zeigt sich der LAD-Verschluss durch eine blassere Färbung der Vorderwand des linken Ventrikels und eine signifikante ST-Hebung innerhalb weniger Herzschläge. Dann wird die Ligatur gelöst und die Reperfusion wird durch einen Farbwechsel zurück zu Rosa-Rot innerhalb von 20 s und eine mögliche Auflösung der ST-Hebung im EKG validiert. Schließlich werden der Troponin-T-Test, die TTC-Färbung und der Herzultraschall eingesetzt, um die Myokardverletzung zu beurteilen. Diese Mehrfachversicherungen und gegenseitigen Überprüfungen machen die experimentellen Ergebnisse sehr zuverlässig. Darüber hinaus führt die Mikromanipulation zu einer höheren Genauigkeit und weniger Komplikationen (z. B. Blutungen). Ein weiterer wichtiger Punkt ist die Annahme, dass die Blutgefäße von Mäusen normal sind, aber tatsächlich variieren einige Koronararterien stark, und sogar die Kollateralzirkulation kann23,24 aufweisen. Daher sind die Infarktgrößen manchmal nicht konsistent, obwohl die Ligaturen auf dem gleichen Niveau liegen. Hier zeigen sich die Vorteile des Mikroskops. Die Ligatur kann nicht nur auf der Grundlage von Erfahrungen oder anatomischen Orientierungspunkten durchgeführt werden: Die LAD und ihre Richtung müssen vor der Ligatur eindeutig überprüft werden, da sonst die Ergebnisse unzuverlässig sind. In einigen Experimenten6,8 befinden sich die Mäuse in der rechten lateralen Dekubitusposition, um die Vorderwand des linken Ventrikels und der Koronararterien nach der Herzexposition beobachten zu können.
Dieses Modell weist zwei Haupteinschränkungen auf. Erstens kann die LAD-Ligatur keinen Verschluss der rechten Koronararterie simulieren. Aufgrund anatomischer Unterschiede zwischen den Tieren25 erstreckt sich die LAD bei Mäusen und Ratten in der Regel bis zur Herzspitze, und die linken Zirkumflexäste sind nicht entwickelt, so dass die Modelle bei Mäusen und Ratten durch LAD-Ligatur festgelegt werden. Bei großen und mittelgroßen Tieren wie Kaninchen und Schweinen ist die LAD relativ kurz, während die linke Zirkumflexarterie einen großen Bereich des Herzens abdeckt, so dass die Ligatur der linken Zirkumflexarterie gewählt wird, um das Modell zu erstellen. Sicard et al.26 berichteten über eine neuartige Methode zur Untersuchung der rechtsventrikulären Dysfunktion und der biventrikulären Interaktion durch Ligatur der rechten Koronararterie bei Mäusen, die diese Einschränkung beheben könnte. Die zweite Einschränkung ist eine inkonsistente Infarktgröße aufgrund der Variabilität in der Koronararterienanatomie27 und der Erfahrung des Chirurgen. Wie oben erwähnt, ist das Mikroskop sehr wichtig, um die Konsistenz zu erhöhen, indem es die LAD und ihre Richtung vor der Ligatur überprüft, und für einen erfahrenen Forscher kann die Anpassung der Ligationsposition nach einer vollständigen Beurteilung der Gefäßanatomie erreicht werden.
Einige andere Punkte verdienen es, erwähnt zu werden. Zum Beispiel führen Thorakotomien und Nadelstiche unweigerlich zu leichten Schäden an den Muskeln und dem Herzmuskel, was sich auf die Entzündung auswirken kann. Darüber hinaus wurde berichtet, dass Analgetika Auswirkungen auf MI28 haben. Daher müssen diese Faktoren bei der Analyse von Entzündungen oder deren Auswirkungen auf den Myokardinfarkt berücksichtigt werden. Bei der Fehlerbehebung gibt es mehrere Faktoren, die zum Tod von Mäusen führen würden. Zum Beispiel Komplikationen im Zusammenhang mit Myokardinfarkt, Anästhesieunfall und Blutungen. Darüber hinaus sind die inkonsistenten Ergebnisse hauptsächlich auf ungeeignete Ligationspositionen zurückzuführen: Eine zu hohe Ligaturposition würde zu einer zu großen Infarktgröße führen, sogar zum Tod von Mäusen; In der Zwischenzeit würde die falsche Identifizierung von LAD zum Versagen des Modells führen. Einige Details müssen bei dieser Methode verbessert werden. Besser wäre es beispielsweise, wenn eine Rektalsonde eingeführt werden könnte, um die Temperatur während des Eingriffs zu überwachen. Zu guter Letzt sollte der Versuchsleiter die Unterschiede zwischen Tierversuchen und klinischen Realitäten im Auge behalten, insbesondere dass die 30-minütige Ischämiezeit in der Tat recht kurz für klinisch ist. Wir ermutigen den Forscher, die Schritte entsprechend seinem Versuchsdesign anzuordnen, einschließlich der Ischämiezeit. Nur so kann dieses Protokoll für Studien zum Mechanismus und zur Behandlung von MI/MIRI und zur Wirkstoffforschung nützlich sein.
Kurz gesagt, es wird ein einfaches und reproduktives Mausmodell für MIRI und MI bereitgestellt. Dieses Modell kann für die Untersuchung von MI/MIRI-Mechanismen und die therapeutische Forschung verwendet werden.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (82070317, 81700390 an Jibin Lin, 8210021880 an Bingjie Lv und 82000428 an Boyuan Wang) und dem National Key R&D Program of China ( 2017YFA0208000 an Shaolin He) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9 % sodium chloride solution | Kelun Industry Group,China | - | |
| 4% paraformaldehyde fixing solution | Servicebio,China | G1101 | - |
| 4-0 silk suture | Shanghai Pudong Jinhuan Medical Products,China | C412 | - |
| 8-0 suture | Shanghai Pudong Jinhuan Medical Products,China | H801 | - |
| Buprenorphine | IsoReag,China | IR-11190 | - |
| Camera | Canon,Japan | EOS 80D | - |
| Depilatory cream | Veet,French | - | |
| Elecsys Troponin T hs STAT | Roche,Germany | - | |
| Electrochemical luminescence immunoanalyzer | Roche,Germany | Elecsys 2010 | - |
| Evans blue | Sigma,America | E2129 | - |
| Eye scissors | Shanghai Medical Instruments,China | JC2303 | - |
| Haemostatic forceps | Shanghai Medical Instruments,China | J31020 | - |
| High frequency in vivo imaging systems | Visualsonics,Canada | Vevo2100 | - |
| Ibuprofen | PerFeMiKer,China | CLS-12921 | - |
| Intravenous catheter | Introcan,Germany | 4254090B | - |
| Ketamine | Sigma-Aldrich,America | K2753 | - |
| Medical alcohol | Huichang ,China | - | |
| Microneedle holders | Shanghai Medical Instruments,China | WA2040 | - |
| Microscopic shears | Shanghai Medical Instruments,China | WA1040 | - |
| Microsurgical forceps | Shanghai Medical Instruments,China | WA3020 | - |
| Mouse electrocardiograph | Techman,China | BL-420F | - |
| Needle holders | Shanghai Medical Instruments,China | JC3202 | - |
| operating floor | Chico,China | ZK-HJPT | - |
| PE-10 tube | Huamei,China | - | |
| Pentobarbital | Merck,America | 1030001 | - |
| Rodent Ventilator | Shanghai Alcott Biotech,China | ALC-V8S-P | - |
| Stereo microscope | Aomei Industry,China | SZM0745-STL3-T3 | - |
| Surgical thermostatic heating pad | Globalebio, China | GE0-20W | - |
| Triphenyltetrazolium chloride | Servicebio,China | G1017 | - |
| Xylazine | Huamaike Biochemicals and Life Science Research Prouducts,China | 323004 | - |
Referenzen
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Ibanez, B., Heusch, G., Ovize, M., Van de Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. Journal of the American College of Cardiology. 65 (14), 1454-1471 (2015).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Kim, S. C., et al. A murine closed-chest model of myocardial ischemia and reperfusion. Journal of Visualized Experiments: JoVE. (65), e3896 (2012).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments: JoVE. (86), e51329 (2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments: JoVE. (94), e52206 (2014).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: An improved and simplified model for myocardial infarction. Journal of Visualized Experiments: JoVE. (122), e55353 (2017).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine myocardial infarction model using permanent ligation of left anterior descending coronary artery. Journal of Visualized Experiments: JoVE. (150), e59591 (2019).
- Li, X., et al. Cardioprotective effects of Puerarin-V on isoproterenol-induced myocardial infarction mice is associated with regulation of PPAR-Y/NF-Kappa B pathway. Molecules. 23 (12), 3322 (2018).
- Vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: A comparison with coronary artery ligation. American Journal of Physiology: Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Wang, D., et al. A cryoinjury model to study myocardial infarction in the mouse. Journal of Visualized Experiments: JoVE. (151), e59958 (2019).
- Brooks, W. W., Garibaldi, B. A., Conrad, C. H. Myocardial injury in the mouse induced by transthoracic cauterization. Laboratory Animal Science. 48 (4), 374-378 (1998).
- Tao, B., et al. Preclinical modeling and multimodality imaging of chronic myocardial infarction in minipigs induced by novel interventional embolization technique. EJNMMI Research. 6 (1), 59 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- Scofield, S. L., Singh, K. Confirmation of myocardial ischemia and reperfusion injury in mice using surface pad electrocardiography. Journal of Visualized Experiments: JoVE. (117), e54814 (2016).
- Gnyawali, S. C., et al. High-frequency high-resolution echocardiography: First evidence on non-invasive repeated measure of myocardial strain, contractility, and mitral regurgitation in the ischemia-reperfused murine heart. Journal of Visualized Experiments: JoVE. (41), e1781 (2010).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. Murine echocardiography and ultrasound imaging. Journal of Visualized Experiments: JoVE. (42), e2100 (2010).
- Shibata, R., et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nature Medicine. 11 (10), 1096-1103 (2005).
- Anderson, J. L., Morrow, D. A. Acute myocardial infarction. New England Journal of Medicine. 376 (21), 2053-2064 (2017).
- Frank, A., et al. Myocardial ischemia reperfusion injury: From basic science to clinical bedside. Seminars in Cardiothoracic and Vascular Anesthesia. 16 (3), 123-132 (2012).
- Mares, R. G., et al. Studying the innate immune response to myocardial infarction in a highly efficient experimental animal model. Romanian Journal of Cardiology. 31 (3), 573-585 (2021).
- Fernandez, B., et al. The coronary arteries of the C57bl/6 mouse strains: Implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Zhang, R., Hess, D. T., Reynolds, J. D., Stamler, J. S. Hemoglobin S-nitrosylation plays an essential role in cardioprotection. Journal of Clinical Investigation. 126 (12), 4654-4658 (2016).
- Sorop, O., et al. Experimental animal models of coronary microvascular dysfunction. Cardiovascular Research. 116 (4), 756-770 (2020).
- Sicard, P., et al. Right coronary artery ligation in mice: A novel method to investigate right ventricular dysfunction and biventricular interaction. American Journal of Physiology: Heart and Circulatory Physiology. 316 (3), 684-692 (2019).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology: Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Kato, R., Foex, P. Myocardial protection by anesthetic agents against ischemia-reperfusion injury: An update for anesthesiologists. Canadian Journal of Anaesthesia. 49 (8), 777-791 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.