Method Article
체외에서 생분해성 임플란트 재료를 연구하기 위한 직접 및 간접 배양 방법
요약
우리는 생분해성 임플란트 재료의 시험관내 세포 적합성을 평가하기 위해 직접 배양, 직접 노출 배양 및 노출 배양의 세 가지 방법을 소개합니다. 이러한 시험관 내 방법은 상이한 생체내 세포-임플란트 상호작용을 모방하고 다양한 생분해성 물질을 연구하는데 적용될 수 있다.
초록
지난 수십 년 동안 생분해 성 물질은 정형 외과, 치과 및 두개골 안면 임플란트와 같은 생물 의학 응용 분야를 위해 광범위하게 탐구되었습니다. 생분해성 물질을 생체의학 응용을 위해 스크리닝하기 위해서는 시험관내 세포 반응, 세포 적합성 및 세포독성 측면에서 이들 물질을 평가할 필요가 있다. 국제 표준화기구 (ISO) 표준은 생체 재료 평가에 널리 활용되었습니다. 그러나 대부분의 ISO 표준은 원래 비분해성 물질의 세포 독성을 평가하기 위해 확립되었으므로 생분해 성 물질 스크리닝에 제한된 가치를 제공합니다.
이 기사에서는 세 가지 다른 배양 방법, 즉 직접 배양 방법, 직접 노출 배양 방법 및 생분해성 폴리머, 세라믹, 금속 및 그 복합체를 포함한 생분해 성 임플란트 재료의 시험관 내 세포 적합성을 평가하기위한 노출 배양 방법을 소개하고 논의합니다. 연구에 따르면 배양 방법은 동적 분해가 계면과 지역 환경에서 시공간 차이를 유도하기 때문에 생분해성 물질에 대한 세포 반응에 영향을 미친다는 사실이 밝혀졌습니다. 구체적으로, 직접 배양 방법은 임플란트에 직접 시딩된 세포의 반응을 드러낸다; 직접 노출 배양 방법은 임플란트와 접촉하는 확립 된 숙주 세포의 반응을 해명합니다. 노출 배양 방법은 임플란트와 직접 접촉하지는 않지만 임플란트 분해로 인한 국소 환경의 변화에 의해 영향을받는 확립 된 숙주 세포를 평가합니다.
이 기사에서는 생분해성 임플란트 물질의 시험관내 세포 적합성 및 골수 유래 중간엽 줄기 세포 (BMSCs)와의 상호 작용을 연구하기 위한 이러한 세 가지 배양 방법의 예를 제공합니다. 또한 수확, 계대, 배양, 종자, 고정, 염색, 세포 특성화 및 배양 후 배지 및 재료 분석 방법을 설명합니다. 이 기사에서 설명된 시험관내 방법은 생체내 환경의 상이한 시나리오를 모방하여, 다양한 생체의학적 응용을 위한 상이한 생체재료의 시험관내 세포적합성 시험의 적용가능성 및 관련성을 넓힌다.
서문
수십 년 동안 생분해 성 물질은 정형 외과1,2, dental3,4 및 craniomaxillofacial5 응용 분야와 같은 생물 의학 응용 분야에서 광범위하게 연구되고 사용되었습니다. 영구 임플란트 및 재료와 달리 생분해 성 금속, 세라믹, 폴리머 및 그 복합체는 생리 환경에서 다양한 화학 반응을 통해 시간이 지남에 따라 체내에서 점차 분해됩니다. 예를 들어, 마그네슘 (Mg) 합금1,6,7 및 아연 (Zn) 합금8,9와 같은 생분해 성 금속은 뼈 고정 장치의 유망한 재료입니다. 그들의 생분해성은 뼈 치유 후 임플란트를 제거하기 위해 이차 수술의 필요성을 제거 할 수 있습니다. 인산칼슘 시멘트(CPCs)와 같은 생분해성 세라믹은 경피적 척추성형술에서 골다공증 척추 압박 골절의 치료에 대한 흥미로운 잠재력을 보여주었다10. CPC는 골절 된 척추 신체에 기계적 지원을 제공하고 골절이 치유 된 후 점차적으로 저하됩니다.
일부 다당류 및 폴리에스테르와 같은 생분해성 폴리머도 생물 의학 응용 분야에서 널리 탐구되었습니다. 예를 들어, 생분해성 다당류로서의 키토산 하이드로젤은 감염을 예방하고 피부 조직을 재생시키는 능력을 나타내었다11. 폴리-L-락트산(PLLA), 폴리(글리콜산)(PGA) 및 폴리(락틱-코-글리콜산)(PLGA)은 조직 공학 응용을 위한 2D 또는 3D 다공성 스캐폴드를 제조하기 위한 폴리에스테르로 널리 연구되어 있다12,13,14. 또한, 복합 재료는 금속, 세라믹 및 폴리머의 두 개 이상의 단계를 통합하여 광범위한 생물 의학 응용 분야에 고급 기능을 제공합니다15,16,17. 예를 들어, PLGA 및 인산칼슘 복합체는 두개골 뼈 결함 복구와 같은 용도를 위해 생분해성 스캐폴드를 제조하는데 사용될 수 있다18. 이러한 생분해성 스캐폴드와 임플란트는 세포와 조직의 성장을 지원하고 촉진한 다음 시간이 지남에 따라 신체에서 점진적으로 분해될 수 있습니다.
보충 표 1에 나타낸 바와 같이, 상이한 생분해성 물질은 다양한 분해 메카니즘, 생성물 및 비율을 가질 수 있다. 예를 들어, 마그네슘 합금, 예컨대 Mg-2 wt% Zn-0.5 wt% Ca(ZC21)1, Mg-4 wt% Zn-1 wt% Sr (ZSr41)19, 및 Mg-9 wt% Al-1 wt% 아연 (AZ91)20, 물과 반응하여 분해되고, 이들의 분해 생성물은 주로 Mg2+ 이온, OH-이온, H2 가스, 및 광물 증착을 포함한다. 생분해성 금속의 분해 속도는 다양한 조성, 기하학적 및 분해 환경에 따라 다릅니다. 예를 들어, Cipriano et al.19는 ZSr41 와이어 (Ø1.1 × 15mm)가 85 %의 질량을 잃는 반면 동일한 기하학적 구조를 가진 순수한 Mg 와이어는 47 일 동안 쥐 경골에 이식 된 후 40 % 질량을 잃었다고보고했습니다. 하이드록시아파타이트(HA) 및 β-트리칼슘 포스페이트(β-TCP)와 같은 생분해성 세라믹 물질은 용액 구동 세포외 액체 용해를 통해 분해되거나 작은 입자로 분해된 후 세포외 액체 용해 및 세포 매개 재흡수 과정을 통해 분해될 수 있습니다. 이들 인산칼슘계 세라믹의 분해 생성물은 Ca2+ 이온, (PO4)3-이온, OH-이온, 및 미네랄 침착21을 포함할 수 있다. 인산 칼슘 세라믹의 분해 속도는 결정 구조에 의해 크게 영향을받습니다. 예를 들어, Van Blitterswijk et al.22는 40 vol.% 미세 기공을 가진 HA가 질량을 잃지 않는 반면, 40 vol.% 미세 기공을 가진 β-TCP는 토끼의 경골에 3 개월 동안 이식 된 후 30 ± 4 % 질량을 잃었다고보고했다. PLGA14,23과 같은 중합체는 물의 존재 하에 에스테르 결합의 가수분해로 인해 분해될 수 있고, 분해 생성물은 주로 락트산 및 글리콜산을 포함한다. PLGA 50/50의 경우 한 달이 걸리고 PLGA 95/5가 완전한 성능 저하를 달성하는 데 몇 달이 걸릴 수 있습니다24.
세포 반응 및 세포 적합성 테스트는 생물 의학 응용 분야에서 이러한 생분해성 임플란트 재료를 평가하고 스크리닝하는 데 중요합니다. 그러나 ISO 10993-5:2009 "의료기기의 생물학적 평가-시험관내 세포독성에 대한 Part 5 시험"과 같은 국제 표준화기구 (ISO)의 현재 표준은 처음에는 시험관 내 Ti 합금 및 Cr-Co 합금과 같은 비분해성 생체 물질의 세포 독성을 평가하기 위해 설계되었습니다. 특히, ISO 10993-5:2009는 추출물의 시험관내 세포독성 시험, 직접 접촉 및 간접 접촉 시험만을 다룹니다. 추출물 시험에서, 추출물은 표준 시간 및 온도 조건 중 하나 하에서 혈청 및 생리 식염수로 배양 배지와 같은 추출 유체에 샘플을 침지함으로써 제조된다. 수집된 추출물 또는 희석액은 세포 독성을 연구하기 위해 세포 배양물에 첨가된다. 직접 접촉 시험을 위해, 샘플과 세포 사이의 직접 접촉은 시험 샘플을 확립된(adherd) 세포층 상에 배치함으로써 달성된다. 간접 접촉 시험에서, 혈청 및 용융된 한천을 함유하는 배양 배지는 확립된 세포를 덮기 위해 피펫팅된다. 이어서, 샘플을 필터 유무에 관계없이 응고된 한천 층 상에 놓는다.
ISO 표준은 시험관 내에서 생분해성 물질을 평가하기 위해 적용될 때 몇 가지 한계를 보여주었습니다. 비분해성 물질과는 달리, 생분해성 물질의 분해 거동은 동적이며, 상이한 시간 또는 다양한 환경 조건(예를 들어, 온도, 습도, 배지 조성 및 세포 유형)에서 변할 수 있다. 추출물 시험은 물질의 분해 생성물의 세포독성만을 평가하고, 샘플 분해의 동적 과정을 반영하지 않는다. ISO 표준의 직접 및 간접 접촉 테스트는 확립 된 세포와 샘플 간의 상호 작용 만 특성화합니다. 더욱이, 간접 접촉 시험에서, 물질 및 세포는 생체내 환경을 반영하지 않고 생분해성 물질의 동적 분해를 포착하지 않는 상이한 미세환경에 있다.
이 기사의 목적은 현재 ISO 표준에 설명 된 방법의 위에서 언급 한 한계를 해결하기 위해 다양한 생분해 성 임플란트 재료에 대한 세포 적합성 테스트 방법을 소개하고 논의하는 것입니다. 이 기사에서 제시된 방법은 임플란트 재료의 동적 분해 거동과 생체 내에서 세포 - 물질 상호 작용의 다양한 상황을 고려합니다. 특히, 이 기사에서는 세 가지 세포 적합성 테스트 방법, 즉 생분해성 폴리머, 세라믹, 금속 및 의료용 임플란트 적용을 위한 복합 소재를 포함한 다양한 생분해성 물질에 대한 직접 배양, 직접 노출 배양 및 노출 배양을 제공합니다.
직접 배양 방법에서, 배양 배지에 현탁된 세포는 샘플에 직접 시딩되고, 따라서 새로 시딩된 세포와 임플란트 사이의 상호작용을 평가한다. 직접 노출 배양에서, 샘플은 체내에서 확립된 숙주 세포와의 임플란트의 상호작용을 모방하기 위해 확립된 세포층 상에 직접 배치된다. 노출 배양에서, 샘플은 각각의 웰 인서트에 배치된 다음, 확립된 세포와 함께 배양 웰에 도입되며, 이는 임플란트와 직접 접촉하지 않을 때 임플란트 분해에 의해 유도되는 국소 환경의 변화에 대한 확립된 세포의 반응을 특성화한다. 직접 배양 및 직접 노출 배양 방법은 동일한 배양 웰에서 임플란트 물질과 직접 또는 간접적으로 접촉하는 세포를 평가한다. 노출 배양물은 동일한 배양 웰에서 규정된 거리 내에서 임플란트 물질과 간접적으로 접촉하는 세포를 특성화한다.
이 기사는 다양한 생분해성 물질에 대한 세포 적합성 테스트 및 모델 세포, 즉 골수 유래 중간엽 줄기 세포 (BMSCs)와의 상호 작용에 대한 자세한 설명을 제공합니다. 프로토콜에는 세포의 수확, 배양, 파종, 고정, 염색 및 이미징과 함께 다양한 생분해성 임플란트 재료 및 광범위한 세포 유형에 적용되는 배양 후 재료 및 배지의 분석이 포함됩니다. 이들 방법은 시험관내에서 세포 반응 및 세포 적합성 측면에서 상이한 생의학적 응용을 위한 생분해성 물질을 스크리닝하는데 유용하다.
프로토콜
이 프로토콜은 세포 및 조직 수확을 위해 리버 사이드 캘리포니아 대학 (UCR)의 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았습니다. 12 주 된 암컷 Sprague-Dawley (SD) 쥐가 비디오에 예로 나와 있습니다. 젊은 암컷과 수컷 쥐가 선호됩니다.
1. 세포 배양 준비
참고: 이 문서에 설명된 세 가지 배양 방법은 일반적으로 부착되는 다른 세포 유형에 적용할 수 있습니다. 여기서, 래트 이유식으로부터 수확된 BMSCs는 세포 배양 준비를 위한 예로서 도입될 것이다. 특정 의료 용도에 대한 관련성에 따라, 동물 또는 인간 기증자로부터 수확한 일차 세포 및 세포/조직 은행으로부터의 세포주를 포함하여 상이한 세포 유형이 이용될 수 있다.
- 쥐 이유식에서 BMSC를 수확
참고: 그림 1 의 개략도는 쥐 이유식에서 BMSC를 수확하는 단계를 보여줍니다.- CO2 흡입으로 Sprague Dawley (SD) 쥐를 안락사시킵니다.
- 피부와 근육 및 결합 조직을 제거하여 안락사 된 쥐에서 대퇴골을 해부하십시오. 대퇴골 뼈를 세포 배양 배지를 함유하는 15 mL 원뿔형 튜브(폴리프로필렌)에 넣는다. 세포 추출을 수행 할 때까지 얼음 위에 원뿔형 튜브를 놓습니다.
참고 : 경골은 BMSC를 수확하는 데에도 사용할 수 있습니다. 세포 배양 배지는 10% 태아 소 혈청(FBS)과 1% 페니실린/스트렙토마이신(P/S)이 보충된 둘베코의 변형 이글 배지(DMEM)입니다. - 뼈를 생물학적 안전 캐비닛의 페트리 접시로 옮깁니다. 수술용 블레이드를 사용하여 뼈의 말단을 절단하고 251/2 G 바늘이 있는 주사기를 사용하여 골수를 세포 배양 배지로 세척하여 골수를 50 mL 원뿔형 튜브(폴리프로필렌)로 플러시합니다.
참고: 18G 바늘이 있는 주사기를 골수가 있는 배지에 삽입하십시오. 천천히 그리고 부드럽게 미디어를 들고 분배하여 눈에 보이는 세포 / 조직 응집체가 없을 때까지 골수의 큰 덩어리를 분해하십시오. - 세포 현탁액을 70 μm 필터를 사용하여 여과하고, 126 × g (1,000 rpm)에서 5분 동안 원심분리하여 세포 펠릿을 얻었다.
- 상청액 배지를 흡인하고 10mL의 신선한 배지로 보충하십시오. 부드럽게 위아래로 피펫하여 10 mL 혈청학적 피펫을 사용하여 세포를 재현탁시켰다.
- 현탁액을 T-75 플라스크의 내부 바닥에 직접 피펫하고 매체를 추가하여 부피를 최대 25mL까지 가져옵니다. 세포를 표준 멸균 세포 배양 환경(즉, 37°C, 5% CO2 및 95% 공기로 가습된 분위기)의 인큐베이터에서 배양한다.
- 3-7 일 후, 오래된 배지를 흡인하고 신선한 배지로 보충하여 비 부착성 세포를 헹구십시오. 세포 계대, 동결 또는 실험에 사용할 준비가 될 때까지 세포를 새로운 배지로 계속 배양하고 먹이십시오.
- 세포 유지 보수
- 세포 배양 배지를 정기적으로 변경하여 세포 노폐물을 제거하고 세포가 90 % -100 % 합류 할 때까지 매일 약 격일로 영양소를 보충하십시오. 90% 컨플루언시에서, 계대, 동결, 또는 실험에서 세포를 사용한다.
- 패시징 셀
참고: 계대배양이라고도 하는 통과는 세포가 한 배양물에서 다른 배양으로 옮겨질 때마다 적용되는 용어입니다. 갓 수확된 세포는 통과 단계 0(P0)에 있다. 트립신-에틸렌디아민테트라아세트산 용액(trypsin-EDTA) 및 이 문서에 기재된 배지의 양은 T-75 플라스크에 대한 것이다.- 광학 현미경으로 세포를 확인하여 세포가 90% 합류하는지 확인합니다.
- 세포 플라스크로부터 배지를 흡인한다.
- 혈청학적 피펫을 사용하여 10 mL의 인산완충식염수(PBS)를 플라스크에 분배한다. 플라스크를 부드럽게 흔들어 PBS로 세포를 헹구고; 모든 PBS를 흡인한다.
참고: 이 단계는 통과 중에 죽은 세포나 세포 폐기물이 전달되지 않도록 하기 위한 추가 헹굼 역할을 합니다. - 트립신-EDTA 3 mL를 세포 플라스크에 직접 세포 표면에 분배한다. 플라스크를 부드럽게 흔들어 세포가 트립신-EDTA로 덮인 전체 표면을 보장한다.
- 트립신-EDTA로 세포 플라스크를 5분 동안 인큐베이터에 넣어 세포가 분리되도록 한다.
- 배양기에서 5분 후, 광학 현미경으로 세포를 검사하여 세포가 분리되어 있는지 확인하였다. 일부 세포가 분리되지 않은 경우 세포 플라스크의 측면을 부드럽게 탭하고 플라스크를 다시 확인하십시오.
- 세포 플라스크에 신선한 배지 9 mL를 첨가하여 트립신-EDTA를 희석시킨다. 이것은 트립신-EDTA가 세포를 용해시키는 대신 결합하기 위한 보다 접근하기 쉬운 단백질을 제공한다.
- 세포를 배지 및 트립신-EDTA에서 피펫팅하고 15 mL 원뿔형 튜브에 분배한다. 세포를 126 × g (1,000 rpm)에서 5분 동안 원심분리한다.
- 세포 펠릿을 교란시키지 않고, 트립신-EDTA로 배지를 흡인한다.
- 5-10 mL의 신선한 배지를 원심분리 튜브에 첨가하고, 10 mL 혈청학적 피펫을 사용하여 배지에서 세포를 부드럽게 재현탁시켰다.
- 세포를 원심분리 튜브 밖으로 배지에 현탁시키고 부피를 2-3개의 신선한 배양 플라스크로 분할한다. 각 플라스크에 대해 총 배지 부피를 25 mL로 가져 오기에 충분한 배지를 첨가하십시오.
참고: 계대 배양 동안의 분할 비율은 세포 유형 및 특정 성장 특성에 따라 달라질 수 있습니다. - 세포를 광학 현미경으로 확인하고 인큐베이터에 다시 넣으십시오.
- 세포 동결
- 광학 현미경으로 세포를 확인하여 세포가 90% 합류하는지 확인합니다.
- 1.2.2.2~1.2.2.9단계를 반복합니다.
- 900 μL의 신선한 배지를 100-1000 μL 마이크로피펫으로 원심분리 튜브에 첨가한다. 동일한 마이크로피펫을 사용하여 세포를 배지에 천천히 그리고 부드럽게 재현탁시킨다.
- 900 μL 세포 현탁액을 냉동 내로 옮긴다. 100 μL의 디메틸설폭사이드(DMSO)를 첨가한다.
- 가능한 한 빨리 cryovial을 온도 감소를 조절하도록 설계된 원통형 폼 용기에 넣으십시오 ( 재료 표 참조). 발포 용기를 -80°C 냉동고에 넣는다.
- 해동 세포
- 얼어 붙은 세포를 수조에서 해동하십시오. 5 mL의 신선한 배지로 채워진 멸균된 15 mL 원뿔형 튜브를 취하고, 세포를 원뿔형 튜브에 넣고, 126 × g (1,000 rpm)에서 5 분 동안 원심분리한다.
- DMSO를 함유하는 배지를 흡인한다.
- 5-10 mL의 신선한 배지를 15 mL 원뿔형 세포 튜브에 첨가한다. 천천히 그리고 부드럽게 피펫을 위아래로 피펫하여 세포를 재현탁시킵니다.
- 세포를 15 mL 원뿔형 튜브 밖으로 배지에 현탁시키고 새로운 T-75 플라스크에 분배한다. 세포를 분배 할 때 스위핑 모션을 사용하여 세포를 세포 플라스크 바닥에 가능한 한 고르게 분배하십시오.
- 신선한 배지를 충분히 첨가하여 각 T-75 플라스크에 대해 총 배지 부피를 25 mL로 가져옵니다.
- 세포를 광학 현미경으로 확인하고 세포 플라스크를 다시 인큐베이터에 넣습니다.
2. 시료 준비 및 살균
- 시료 준비
- 이 문서에 설명된 세포 배양 실험을 위해 6, 12, 24, 48 또는 96-웰 플레이트와 같은 조직 배양 처리된 플레이트를 사용하십시오. 조직 배양 플레이트의 종류와 샘플 치수와 같은 다양한 실험 설계에 따라 각 웰의 배지 부피를 선택하십시오.
- 세포 배양 전에 모든 생분해성 샘플을 멸균 또는 소독한다.
참고: 소독은 다음을 위해 허용됩니다. in vitro 샘플이 고열, 산화제 및 / 또는 라디칼을 포함하는 일부 멸균 조건 하에서 화학적 및 / 또는 표면 변화에 취약 할 때 연구. 다른 샘플 유형에 대한 살균 또는 소독 방법은 중합체, 금속 및 세라믹과 같은 재료의 다양한 특성에 따라 다릅니다. 살균 또는 소독 과정에는 열, 가스, 방사선, 화학 물질, 고압 또는 이들의 조합이 포함될 수 있습니다.- 생분해성 금속
- 일반적으로 자외선(UV) 방사선을 사용하여 시험관 내 연구를 위해 생분해성 금속을 소독합니다.
참고: 예를 들어, Zhang et al.은 순수 마그네슘(Mg) 및 ZC21 Mg 합금 샘플이 세포 연구에 활용되기 전에 4시간 동안 UV 방사 하에서 소독되었다고 보고하였다1. 생체내 연구를 위해, 샘플은 일반적으로 멸균될 필요가 있다. 마그네슘 또는 마그네슘 합금과 같은 많은 생분해성 금속의 경우, 이러한 샘플이 물에서 산화되거나 부식될 수 있기 때문에 증기를 이용한 오토클레이빙은 피해야 합니다6. 석영 요리는 대부분의 안경과 플라스틱보다 더 나은 UV 투명도를 제공하기 때문에 UV 소독에 권장됩니다. - Mg 합금 샘플을 100-200 °C의 온도 범위에서 오븐 또는 오토클레이브에서 건조한 열로 멸균하십시오.
참고 : 일부 금속 합금은 공기 중 고온에서 표면에서 여전히 산화 될 수 있으므로 경우에 따라 고강도 방사선이 대안으로 사용될 수 있습니다. 그러나 알파 또는 감마 방사선과 같은 고강도 방사선은 얇은 금속 호일을 살균 할 때 피해야합니다. 그것은 재료 내에서 원자 변위를 일으켜 재료의 미세 구조를 변화시킬 수 있습니다. - 열 및 방사선에 민감한 생분해성 금속의 대체 방법으로 에틸렌 옥사이드(EtO) 가스 살균을 사용하십시오26.
- 일반적으로 자외선(UV) 방사선을 사용하여 시험관 내 연구를 위해 생분해성 금속을 소독합니다.
- 생분해성 세라믹
- 일반적으로 시험관 내 연구 전에 UV 방사선 또는 70 % 에탄올 용액을 사용하여 생분해 성 세라믹을 소독하십시오.
참고: 예를 들어, Liu et al.은 인산칼슘 샘플이 시험관내 세포 적합성 시험에서 사용되기 전에 1시간 동안 70% 에탄올에 침지하고 각 측면에서 12시간 동안 자외선에 노출됨으로써 소독되었다고 보고하였다27. - 고온과 수증기가 퇴비와 미세 구조를 손상시키지 않으면 오토클레이브를 사용하여 생분해 성 세라믹을 살균하십시오.
참고: 일부 도자기는 오토클레이빙의 영향을 받을 수 있습니다. 예를 들어, 이트리아-안정화된 지르코니아 세라믹을 121°C에서 15분 동안 오토클레이브했을 때 상 변화 및 표면 조면화가 발견되었다. 또한 CPC는 샘플이 물과 반응하기 때문에 증기로 오토클레이빙을 통해 살균 할 수 없습니다. - 상기 언급된 이트리아-안정화된 지르코니아 세라믹 및 CPC 샘플28에 대해 코발트-60 방사선과 같은 대안적인 멸균 방법을 사용한다.
- 일반적으로 시험관 내 연구 전에 UV 방사선 또는 70 % 에탄올 용액을 사용하여 생분해 성 세라믹을 소독하십시오.
- 생분해성 폴리머
- 일반적으로 생분해성 고분자를 시험관 내 세포 연구에 사용하기 전에 UV 방사선 또는 70% 에탄올을 사용하여 소독한다.
참고: 일부 폴리머는 UV 방사선 하에서 화학적 변화를 겪을 수 있습니다. 멸균을 위해, 코발트-60 방사선과 같은 감마선 처리가 사용될 수 있다. 예를 들어, 전분 분말은 시험관내 세포 연구에서 활용되기 전에 코발트-60 방사선 하에서 멸균되었다29. - 고온과 습기를 견딜 수있는 오토클레이브 폴리머 소재.
참고: 예를 들어, 폴리프로필렌과 같은 폴리머는 오토클레이빙 온도(즉, 121-134°C)를 견딜 수 있기 때문에 오토클레이브될 수 있습니다. 폴리카프로락톤(PCL)과 같은 일부 중합체는 비교적 낮은 융점(즉, 약 60°C)30 때문에 오토클레이브될 수 없다. - EtO 가스를 사용하여 열 또는 방사선 살균에 민감한 고분자 물질을 멸균하십시오.
- 일반적으로 생분해성 고분자를 시험관 내 세포 연구에 사용하기 전에 UV 방사선 또는 70% 에탄올을 사용하여 소독한다.
- 생분해성 금속
3. 세포 배양 방법
- 직접 배양 방법
참고: 도 2A 의 개략도는 직접 배양 방법의 단계를 보여준다. 본 글에서, BMSCs는 배양 방법을 예시하기 위한 예로서 12-웰 조직-배양-처리된 플레이트의 웰 내부에 놓인 Mg-유래 플레이트 상에서 배양되었다.- 단계 1.2.2.1-1.2.2.10에 설명된 단계에 따라 세포 현탁액을 얻었다.
- 90% 컨플루언트 플라스크를 사용하여 혈구측정기를 사용하여 세포 현탁액 중의 세포 농도를 결정한다. 시험 관 내에서 세포 연구에 필요한 처방된 세포 농도로 신선한 배지를 사용하여 세포 현탁액을 희석한다.
참고: 세포의 시딩 밀도는 실험 설계에 의해 결정됩니다. 예를 들어, 2,000-40,000 cells/cm2 의 세포 밀도는 생분해성 물질을 사용한 다양한 세포 연구에 사용되었습니다. - 샘플(Mg 플레이트)을 12-웰 처리된 조직-배양 플레이트의 중앙에 놓는다. 순차적으로, 배양 플레이트를 PBS 2 mL 및 DMEM 2 mL로 헹구어 멸균 조건하에서 삼투압을 교정한다. 희석된 세포 현탁액 3 mL를 각 웰에 관심 있는 샘플 상에 첨가한다.
- 세포를 24 h 동안 표준 세포 배양 조건 하에서 인큐베이터에서 배양하였다.
참고: 배양 시간은 실험 설계에 따라 24시간보다 길거나 짧을 수 있습니다.
- 직접 노출 문화
참고: 그림 2B 의 개략도는 직접 노출 배양의 단계를 보여줍니다.- 단계 3.1.1 및 3.1.2에 기재된 바와 같이, 상이한 세포 유형 및 의도된 적용에 대한 실험 설계에 기초하여 필요한 농도의 세포로 세포 현탁액을 준비한다.
- 배양 플레이트를 PBS 2 mL 및 DMEM 2 mL로 순차적으로 헹구어 멸균 조건하에서 삼투압을 교정한다. 희석된 세포 현탁액 3 mL를 각 웰에 첨가한다. 세포를 가습된 인큐베이터에서 24시간 동안 또는 세포가 50-80% 합류에 도달할 때까지 표준 세포 배양 조건 하에서 배양한다.
참고: 세포 합류 수준은 세포 유형 및 실험 설계에 따라 다를 수 있습니다. - 24시간 후, PBS로 웰 플레이트 내의 세포를 헹구고 피펫을 이용하여 부유하는 죽은 세포를 제거하였다.
- 소독 또는 멸균된 샘플을 부착된 세포 위에 직접 놓는다. 신선한 배지 3 mL를 각 웰에 넣으십시오.
- 세포를 또 다른 24 시간 동안 표준 세포 배양 조건 하에서 배양한다.
참고: 배양 시간은 실험 설계에 따라 24시간보다 길거나 짧을 수 있습니다.
- 노출 문화
참고: 도 2C 의 개략도는 노출 배양 방법의 단계를 보여준다.- 세포 제제를 위한 초기 단계는 노출 배양물과 동일하다. 단계 3.1.1 및 3.1.2에 기재된 바와 같이, 원하는 세포와 함께 세포 현탁액을 준비한다. 단계 3.2.1 및 3.2.2와 유사하게, 세포를 원하는 밀도로 웰 플레이트에 시드하고 이를 24시간 동안 표준 세포 배양 조건 하에 인큐베이터에서 배양한다.
- 24시간 후, 부착성 세포를 PBS로 헹구어 부유하는 죽은 세포를 제거하고, 3 mL의 신선한 배지를 각 웰에 첨가하였다.
- 그 후, 샘플을 막 공극 크기가 0.4 μm인 웰 인서트에 놓고 샘플이 있는 웰 인서트를 세포와 함께 각 웰에 배치한다.
- 세포를 또 다른 24 시간 동안 표준 세포 배양 조건 하에서 배양한다.
참고: 배양 시간은 실험 설계에 따라 24시간보다 길거나 짧을 수 있습니다.
4. 세포의 배양 후 특성화
참고: 직접 배양 및 직접 노출 배양의 경우, 웰 플레이트와 샘플 모두에서 부착되는 세포를 고정, 염색, 이미지 및 분석하십시오. 노출 배양을 위해, 웰 플레이트에 부착된 세포를 분석한다.
- 세포 고정
- 추가 분석을 위해 각 웰로부터 후배양 배지를 상응하는 15 mL 원뿔형 튜브로 수집한다. 추가 분석을 위해 배양 후 모든 샘플을 수집한다.
- PBS를 사용하여 샘플 및 웰 플레이트 둘 다에 부착된 세포를 3회 헹구십시오.
- 1 mL의 4% 파라포름알데히드 (PFA, 10% 중성 완충 포르말린)를 각 웰 플레이트에 첨가한다. 뚜껑을 다시 웰 플레이트에 올려 놓고 PFA가 20 분 동안 반응하도록하십시오.
- 20 분 후, PFA를 흡인하고 폐기물 병에 분배하십시오. PBS를 이용하여 웰 플레이트를 3회 헹구어 PFA를 제거하고, 폐기물을 폐병으로 옮긴다.
- 세포 염색
- 제조업체의 지시에 따라 염색제의 작업 재고를 준비하십시오.
참고: 예를 들어, Alexa Fluor 488 Phalloidin은 F-actin을 염색하는 데 사용되며, 4', 6-디아미디노-2-페닐인돌(DAPI)은 세포 핵을 염색하는 데 사용됩니다. 염색 시간은 샘플이 염색 용액에서 빠르게 분해되는 경우 감소될 수 있다. - 희석된 알렉사 플루오르 488 Phalloidin 염색제 200-400 μL를 각 웰에 첨가하여 웰 플레이트 및 샘플 상의 세포를 덮는다. 빛 노출을 방지하기 위해 알루미늄 호일에 웰 플레이트를 감싸고 Alexa Fluor 488 Phalloidin이 실온에서 20 분 동안 반응하도록하십시오.
- Alexa Fluor 488 Phalloidin 염색제를 수집하여 해당 폐기물 병에 분배하십시오. PBS를 사용하여 웰 플레이트를 3회 헹구어 과량의 알렉사 플루오르 488 팔로이드인을 제거하고, 사용된 PBS를 상응하는 폐병에 분배한다.
- 희석된 DAPI 200-400 μL를 각 웰에 첨가하여 웰 및 샘플 상의 세포를 덮는다. 웰 플레이트를 알루미늄 호일로 감싸고 DAPI가 실온에서 5 분 동안 반응하도록하십시오.
- DAPI를 수집하여 해당 폐기물 병에 분배하십시오. PBS를 사용하여 웰 플레이트를 3회 헹구어 DAPI를 제거하고, 사용된 PBS를 상응하는 폐병에 분배한다.
- 제조업체의 지시에 따라 염색제의 작업 재고를 준비하십시오.
- 세포 이미징
- 염색 후, 형광현미경을 이용하여 세포를 이미지화하였다. 가능할 때마다 형광 이미지 외에도 세포의 위상차 이미지를 찍으십시오. 샘플을 지속적으로 분해함으로써 야기되는 가능한 변화를 피하거나 감소시키기 위해 염색 직후에 가능한 한 빨리 또는 염색 직후에 세포를 이미지화한다. 세포를 고정 후 2-8°C의 완충용액에 웰 플레이트에 저장하고, 염색 후 가능한 빨리 세포를 이미지화하여 형광 신호의 손실을 방지한다.
- 직접 배양 및 직접 노출 배양을 위해, 두 가지 유형의 세포를 이미지 및 평가한다: (1) 샘플 상의 세포(샘플과 직접 접촉함) 및 (2) 도 3A에 도시된 바와 같이, 샘플을 둘러싸는 웰 플레이트 상에 부착된 세포(샘플과의 간접 접촉).
- 노출 배양의 경우, 도 3B에 도시된 바와 같이, 세포의 형광 이미지를 촬영할 때 이미지 가이드를 사용하여 세포 반응이 샘플의 동적 분해 구배에 반응하여 상이한지를 결정한다. 내부 링 내 영역(중심에서 3.5mm 떨어져 있음)과 외부 링(중심에서 7mm 떨어져 있음)에 위치한 세포를 별도로 이미지 및 분석합니다.
참고: 이미지 가이드는 셀과 샘플 사이의 거리를 정의하는 데 사용됩니다. - 배양 플레이트 내의 각 샘플 및 웰에 대해, 세포가 미리 정의된 거리에서 샘플과 직접 접촉하거나 간접 접촉하는 각 관심 영역으로부터 적어도 다섯 개의 이미지를 랜덤하게 취한다.
- 이미지 분석
- 단계 4.3으로부터 수득된 모든 세포 이미지에 대해, 이미지 분석을 위해 ImageJ와 같은 소프트웨어를 사용하여 세포 확산 면적 및 종횡비를 측정함으로써 세포 형태를 정량화한다.
- 각 이미지 영역의 셀 수를 계산합니다. 직접 및 간접 접촉 조건 하에서의 세포 부착 밀도를 단위 면적당 셀 수로 계산한다.
5. 배지 및 샘플의 배양 후 분석
- 배양 후 배지의 pH를 측정한다.
참고: 일부 샘플은 분해되는 동안 배지의 pH 값을 변경합니다. 예를 들어, 마그네슘 합금과 같은 생분해성 금속은 일반적으로 분해로 인해 매질의 pH 값을 증가시킵니다31. 대조적으로, PLGA와 같은 생분해성 중합체는 종종 그들이 분해될 때 배지의 pH 값을 감소시킨다32. 배양 후 배지의 pH 값을 측정하는 것은 시험관내에서 이들 샘플의 분해를 나타낼 수 있다.- 세포 고정 전에, 단계 4.1.1에서와 같이 배양 후 배지를 수집한다.
- 미리 보정된 pH 측정기를 사용하여 수집 직후 각 웰에서 배양 후 배지의 pH 값을 측정한다.
참고: 매체의 pH는 CO2 수준 및 온도와 같은 환경 조건 때문에 시간이 지남에 따라 표류할 수 있으며, 이를 고려해야 합니다.
- 생분해성 샘플의 분해 거동에 대한 배지 조성물을 분석한다. 배지의 색 변화를 일으키는 일부 샘플의 경우, 분광광도계 또는 마이크로플레이트 리더를 사용하여 배양 후 배지의 광학 밀도(O.D.) 값을 측정하여 분해 거동을 결정한다. 또는 자외선 가시 분광법 (UV-VIS) 및 푸리에 변환 적외선 분광법 감쇠 총 반사율 (FTIR-ATR)을 사용하여 배양 후 배지에서 분해 생성물을 분석하십시오.
참고: 배양 후 배지에서 분해 생성물을 측정하는 것은 샘플의 분해 거동을 이해하는 데 유용합니다. 가장 일반적인 접근법 중 하나는 유도 결합 플라즈마-광학 방출 분광계(ICP-OES)를 사용하여 배양 후 배지에서 관심있는 이온을 측정하는 것이다. ICP-OES는 금속 및 세라믹의 배양 후 배지의 조성을 측정하는 데 사용할 수 있지만 중합체에는 적합하지 않을 수 있습니다. 중합체는 일반적으로 탄소, 수소 및 산소로 구성되며 ICP-OES에서는 이러한 원소의 정확한 정량화가 어렵습니다.- pH 측정을 위한 단계 5.1.2에 이어서, 이온 농도의 최적 측정을 위해 바람직한 희석 계수를 사용하여 배지를 수집하고 희석한다.
- ICP-OES를 이용하여 후배양 배지에서 관심있는 이온의 농도를 측정한다.
- 샘플의 배양 후 분석
참고: 시험관내 세포 연구 후, 생분해성 샘플은 치수, 질량, 표면 형태학, 미세구조 및 조성이 바뀔 수 있습니다. 샘플의 배양 후 분석은 샘플의 분해 메커니즘을 이해하는 데 도움이됩니다.- 세포 배양 후, 샘플의 사진을 찍어 샘플 치수, 색상, 형태학 및 기타 가시적 특성의 가능한 변화를 보여줍니다.
- 배양 후 샘플을 건조 또는 탈수시키고 샘플 질량, 치수 및 부피를 측정하여 질량, 치수 및 부피의 변화를 정량화한다.
- 주사 전자 현미경 (SEM)을 사용하여 샘플의 미세 구조와 형태를 특성화하십시오. 에너지 분산 X선 분광법(EDX) 및 X선 회절(XRD)을 사용하여 샘플에서 분해 생성물의 조성과 위상을 특성화합니다. FTIR-ATR을 사용하여 샘플 표면의 화학적 결합을 감지합니다.
결과
도 4는 상이한 배양 방법을 이용한 직접 및 간접 접촉 조건하에서의 BMSCs의 대표적인 형광 이미지를 나타낸다. 도 4A, B는 ZC21 마그네슘 합금1과 동일한 24시간 직접 배양 후 직접 및 간접 접촉 조건 하에서의 BMSC를 보여준다. ZC21 합금은 97.5 wt % 마그네슘, 2 wt % 아연 및 0.5 wt % 칼슘으로 구성됩니다. ZC21 합금 샘플과 직접 접촉하지 않은 셀은 샘플과 직접 접촉하는 셀보다 더 잘 퍼집니다. 도 4C,D에 나타난 바와 같이, 직접 및 간접 접촉 조건 하에서의 세포는 모두 Fe3+ 이온에 의해 가교된 히알루론산(HyA) 하이드로젤에 24시간 직접 노출된 후 정상적인 형태를 나타낸다. 그러나, 간접 접촉 조건 하에서의 세포의 수는 직접 접촉 조건하에서의 세포보다 낮다33. 또 다른 연구는 24 시간 노출 배양 후 BMSCs에 대한 ZSr41 합금 (ф = 1.1 mm)의 분해의 효과를보고했다19. ZSr41 합금은 95 wt % 마그네슘, 4 wt % 아연 및 1 wt % 스트론튬으로 구성됩니다. 도 4E는 생분해성 핀19로 24시간 노출 배양한 후 웰 중심으로부터 3.5 mm 떨어진 위치에서 배양 웰에 부착된 BMSCs의 대표적인 형광 이미지를 도시한다.
도 5는 정량화된 세포 부착 밀도에 대한 예시적인 데이터를 나타낸다. 도 5A에 나타낸 바와 같이, 24시간 직접 노출(24h_DE) 배양에서, ZC21과 직접 접촉하는 BMSCs는 다른 어떤 그룹보다 유의하게 더 큰 세포 부착 밀도를 갖는다. 24시간 직접 배양(24h_D)에서, ZC21과 직접 접촉하는 BMSCs는 Mg 그룹보다 유의하게 높은 세포 부착 밀도를 나타내고, 유리 기준군보다 유의하게 낮지만, Ti 합금(T64) 대조군과 비교하여 통계적 차이는 없다. 도 5B에 나타난 바와 같이, 직접 노출 배양의 간접 접촉 조건에서, BMSC 부착 밀도는 Mg 군보다 ZC21 군에 대해 유의하게 더 높다. 그러나, T64 및 세포 전용 대조군과 비교하여 유의한 차이를 보이지 않는다. 직접 배양의 간접 접촉 조건에서, BMSC 부착 밀도는 Mg 군에 대한 것보다 ZC21 군에 대해 유의하게 더 높지만 T64 및 세포 전용 대조군1과 비교하여 유의한 차이를 보이지 않는다.
도 6A는 직접 노출 배양 및 직접 배양 후의 배양 후 배지의 pH 값을 나타낸다. 직접 노출 배양의 경우, 배지의 pH 값은 모든 샘플에 대해 8.3 내지 8.4 범위이다. 직접 배양에서, 배지의 pH 값은 그룹에 걸쳐 7.9 내지 8의 범위이다. 도 9B는 배양 후 배지 내의 Mg2+ 이온 농도를 나타낸다. 직접 노출 배양 및 직접 배양 둘 다에서, ZC21 및 Mg 그룹 내의 Mg2+ 이온 농도는 다른 대조군1에서보다 유의하게 높다. 도 7은 3-일 노출 배양 후의 ZSr41 및 순수 Mg에 대한 XRD 패턴을 나타낸다. 도 7A에서, Mg, Ca(OH)2, ZnO, MgO∙H2O, Ca(HPO4)(H2O)2, 및 Ca5(PO4)3(OH)(즉, 하이드록시아파타이트 또는 HA), Mg17Sr2의 결정상은 ZSr41의 표면에서 발견된다. 도 7B에서, Mg, Ca(OH)2, Mg3(PO4)2, Mg7(PO4)2(OH)8, Ca2P2O7∙5H2O의 결정상은 순수한 Mg19의 표면 상에 있다. 도 8A는 BMSCs를 사용한 직접 배양 24시간 후에 MgO 코팅된 Mg 및 Mg 기질 및 Glass의 대조군을 위한 표면 원소 조성물의 SEM 이미지 및 EDX 맵의 오버레이를 도시한다. 도 8B는 세포 배양 동안 형성된 상이한 침착을 나타내는 샘플 표면의 정량적 표면 원소 조성을 나타낸다34.

그림 1: 쥐 이유식에서 BMSC를 수확하는 단계를 보여주는 개략도. 이 수치는 35에서 수정되었습니다. 약어: BMSCs = 골수 유래 중간엽 줄기세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 세 가지 세포 배양 방법을 보여주는 모식도. (A) 직접 배양, (B) 직접 노출 배양, 및 (C) 노출 배양. 이 수치는 36에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 직접 배양 및 직접 노출 배양을 보여주는 모식도. (A) 직접 배양 및 직접 노출 배양에서 직접 접촉 및 간접 접촉 조건 하에서의 세포. (b) 노출 배양물에서 샘플의 중심으로부터 멀리 떨어진 다른 거리에서 웰 플레이트에 부착된 세포의 사진을 촬영하기 위한 이미징 가이드의 활용. 도 3B는 도 37로부터 변형된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: BMSCs의 대표적인 형광 이미지 . (A, B) ZC21 합금으로 24시간 직접 배양한 후 직접 및 간접 접촉 조건. (C, D) HyA 하이드로젤을 이용한 직접 노출 배양. (e) ZSr41 합금으로 24시간 노출 배양한 후 배양 플레이트 상에서. 스케일 바 = 100 μm. A 및 B 는 1로부터 재생된다; C 및 D 는 33으로부터 재생되고; E 는 19에서 재현됩니다. 약어: BMSCs = 골수 유래 중간엽 줄기세포; HyA = 히알루론산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5: BMSCs의 세포 부착 밀도에 대한 정량적 결과. (A) 직접 접촉 및 (B) 24시간 직접 노출 배양 후의 간접 접촉 조건 (24 h_DE) 및 직접 배양 (24 h_D). 이 그림은 1에서 재현됩니다. 약어: BMSCs = 골수 유래 중간엽 줄기세포; DE = 직접 노출 배양; D = 직접 문화권. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
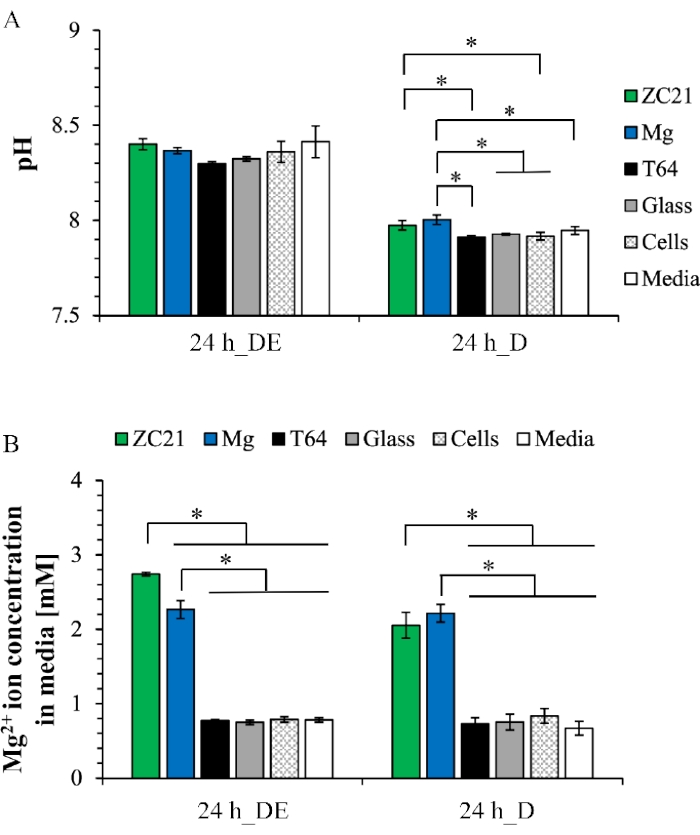
도 6: 24시간 직접 노출 배양 및 직접 배양 후 배지의 배양 후 분석에 대한 대표적인 결과 . (A) pH 값 및 (B) Mg2+ 이온 농도. 이 그림은 1에서 재현됩니다. 약어: DE = 직접 노출 문화; D = 직접 문화권. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 7: BMSCs로 3일간 배양한 후 생분해성 금속 샘플의 상 분석에 대한 대표적인 배양 후 결과 . (A) ZSr41에 대한 X선 회절 스펙트럼. (B) 순수 Mg에 대한 XRD 스펙트럼. 이 그림은 19에서 재현됩니다. 약어: BMSCs = 골수 유래 중간엽 줄기세포; XRD = X선 회절. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 8: BMSCs로 직접 배양한 후 24시간 후 시료의 표면 분석에 대한 대표적인 배양 후 결과(표면 미세구조, 형태학 및 조성 포함). (A) MgO 코팅 Mg., 코팅되지 않은 Mg 대조군 및 유리 참고를 위한 표면 원소 조성물의 SEM 이미지 및 EDX 맵의 오버레이. (B) EDX 분석으로부터 정량화된 표면 원소 조성(at. %). 스케일 바 = 200 μm. 34에서 재현. 약어: BMSCs = 골수 유래 중간엽 줄기세포; SEM = 주사 전자 현미경; EDX = 에너지 분산 X선 분광법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 분해 메카니즘, 생성물, 및 상이한 유형의 물질에 대한 비율, 및 배양 후 샘플 및 배지 분석을 위해 수집된 결과. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
상이한 세포 배양 방법이 생체내 적용의 다양한 양태에 대해 관심있는 생체재료의 시험관내 세포적합성을 평가하는데 사용될 수 있다. 이 기사에서는 세 가지 시험관 내 배양 방법, 즉 직접 배양, 직접 노출 배양 및 노출 배양을 보여 주어 생분해 성 임플란트 재료가 인체 내부에서 사용되는 다양한 생체 내 시나리오를 모방합니다. 직접 배양 방법은 주로 임플란트 재료에 직접 부착되고 주위하는 새로 시딩된 세포의 거동을 평가하기 위해 사용된다. 직접 노출 배양 방법은 임플란트 재료가 확립 된 세포 및 조직과 직접 접촉하는 생체 내 시나리오를 모방합니다. 노출 배양 방법은 임플란트 재료로부터의 분해 생성물 및 국소 미세 환경의 변화가 임플란트 재료와 직접 접촉하지 않는 확립된 세포 및 조직에 어떻게 영향을 미칠 수 있는지를 보여주기 위해 사용될 수 있다.
직접 배양에서, 직접 및 간접 접촉 조건 둘 다하에서 새로 시딩된 세포가 평가된다. 직접 노출 배양에서, 확립된 세포는 직접 및 간접 접촉 조건 둘 다하에서 평가될 수 있다. 노출 배양에서, 간접 접촉 조건 하에서 확립된 세포만이 평가될 수 있다. 직접 배양물에서 직접 접촉 조건 하에서 새로 시딩된 세포는 이온 농도 및 pH 값의 변화와 같은 물질 특성 및 물질-유도된 배지의 변화에 의해 영향을 받는다.
상기 언급된 물질 특성은 표면 형태학, 친수성, 표면 자유 에너지, 강성, 및 조성물을 포함할 수 있다. 직접 배양 방법 및 직접 노출 배양 방법에서 확립된 모든 세포가 간접 접촉 조건 하에서 새로 시딩된 세포는 주로 배지의 물질-유도된 변화에 의해 영향을 받는다. 이 기사에서 설명하는 세 가지 다른 방법은 배지 추출 방법과 같은 기존의 방법보다 생체 내 환경의 실제 시나리오에 더 가깝습니다. 배지 추출 방법은 물질의 분해 생성물의 세포독성만을 평가하고, 샘플 분해의 동적 과정을 반영하지 않는다. 이 기사에 기술된 배양 방법에서, 세포가 임플란트 재료와 함께 배양될 때, 생분해성 물질 및 배지 환경의 동적 변화는 계 내 세포에 영향을 미칠 수 있다.
시험관내 연구가 생체내 연구를 완전히 대체할 수 있는 것은 아니지만, 시험관내 연구는 상보적이며 저렴한 비용과 효율적인 방식으로 귀중한 데이터를 제공할 수 있다. 생체 내 연구는 일반적으로 모델의 모든 다중 변수를 포함하는 반면, 시험관 내 세포 배양은 세포 - 물질 상호 작용에 대한 단일 인자의 효과를 연구 할 수 있습니다. 이 기사에서 소개 된 방법은 관련 생체 내 연구의 다양한 시나리오를 모방 할 수 있습니다. 우리는 생체 내 연구를위한 보충제를 제공하기 위해 서로 다른 변수 간의 연관성을 만들 수 있습니다. 생체내 모델은 일반적으로 동물 유형에서 동일한 조직만을 포함한다. 그러나, 시험관내 연구는 하나의 배양물에서 상이한 세포 유형을 포함할 수 있으며, 이는 세포-물질 상호작용에 대한 상이한 변수들의 조합된 효과를 연구할 수 있다. 더욱이, 생체내 모델에서 세포-물질 상호작용에 대한 동적 환경 변화의 영향을 연구하는 것은 상대적으로 어렵다. 이 기사에 기술된 방법은 배지 내의 이온 농도와 같은 동적 변화가 세포 거동에 미치는 영향을 조사할 수 있다38.
이 기사에 제시된 방법은 중합체, 금속, 세라믹, 복합 재료 및 나노 입자를 포함한 모든 유형의 물질의 시험관 내 세포 적합성을 이해하고 의도 된 용도에 따라 다른 세포, 박테리아 또는 곰팡이와의 상호 작용을 결정하는 데 적용 할 수 있습니다. 예를 들어, Xu et al.은 직접 노출 배양 방법33을 통해 HyA계 하이드로젤과 BMSCs의 시험관내 세포적합성을 평가하였다. 세포 부착 밀도 및 세포 형태를 직접 및 간접 접촉 조건 하에서 분석하였다. HyA계 하이드로겔 복합체의 세포독성은 세포 배양 실험 동안 가교된 HyA 하이드로젤로부터 방출되는 Fe3+ 및 H+ 이온의 농도와 관련될 수 있다. Tian et al. 직접 노출 배양을 사용하여 24 시간 및 48 시간 동안 4 시간 동안 네 가지 Mg 합금으로 인간 비뇨 생식기 세포 (HUCs)를 배양하고 직접 노출 배양을 사용하여 MgO 및 Mg(OH)2의 불용성 분해 생성물을 사용하여 잠재적 요관 스텐트 적용을위한 아연 (Zn) 및 스트론튬 (Sr)을 함유 한 Mg 합금의 세포 적합성 및 분해 거동을 조사했습니다39 . 본 연구에서, 4 wt% Zn 및 0.5 wt% Sr을 함유하는 ZSr41_B은 24h 및 48h 노출 배양물 둘 다에서 다른 모든 Mg-4Zn-xSr 합금들 사이에서 HUCs와 더 우수한 세포적합성을 갖는 것으로 밝혀졌다. 결과는 또한 직접 노출 배양 24 시간 후 산화 마그네슘 (MgO)과 수산화 마그네슘 (Mg(OH)2)의 농도가 1.0 mg / mL를 초과했을 때 웰 플레이트에서 눈에 띄는 부착 세포가 발견되지 않았 음을 보여주었습니다. 따라서 Tian et al.은 Mg 합금의 분해 속도를 줄이는 것이 향후 임상 번역을 향한 가능한 부작용을 조절하는 데 필요하다고 결론지었습니다. Wetteland et al. 생분해성 PLGA 폴리머40에 하이드록시아파타이트(nHA) 및 nMgO 나노입자를 분산시켜 폴리머계 나노복합체를 만들었다. 이 나노복합체는 직접 배양 방법을 사용하여 BMSCs를 상이한 샘플과 함께 배양함으로써 연구되었다. 결과는 폴리머에서 나노 입자의 분산 개선이 nHA / PLGA에서의 BMSC 접착력을 향상시킬 수 있지만 nMgO / PLGA에서의 세포 생존력을 감소시킬 수 있음을 보여주었습니다. 시험관 내 세포 연구의 결과를 바탕으로, Wetteland et al.은 다양한 생물 의학 응용을위한 최적의 세라믹 / 폴리머 나노 복합체를 엔지니어링하는 데 대한 귀중한 통찰력을보고했습니다.
세포 형태학 및 세포 번호는 ImageJ와 같은 정량적 이미지 분석을 위한 소프트웨어를 사용하여 형광 이미지에서 관찰되고 정량화될 수 있다. 우리는 다른 샘플 그룹에 대한 세포 부착 밀도, 세포 종횡비 및 세포 확산 영역을 정량화함으로써 세포 부착 및 형태학에 대한 다양한 물질의 영향을 조사 할 수 있습니다. 세포만이 배지에서 배양되는 빈 대조군으로부터의 세포의 형태학은 샘플 물질로부터의 어떠한 영향도 없이 기준의 표준으로서 작용할 수 있었다. 우리는 샘플 물질이 샘플 그룹의 세포 부착 밀도 및 세포 형태를 블랭크 대조군의 세포 부착과 비교함으로써 시험관 내에서 세포 부착 및 형태학에 영향을 미치는지 여부를 결정할 수 있습니다. 세포 확산 영역은 샘플 표면에 대한 세포 부착의 선호도를 나타내며, 세포가 샘플 물질과 어떻게 상호 작용하는지 보여줍니다. 이 기사에서는 순수한 마그네슘과 같은 생분해성 샘플이 수용액에서 빠르게 분해되기 때문에 DAPI 염색에 대한 반응 시간을 공급 업체가 권장하는 최적 시간보다 짧게 줄였습니다. 생분해성 물질에 부착된 세포의 형태학은 염색 과정이 너무 오래 걸리고 물 노출 시간이 샘플에 대해 너무 길면 바뀔 수 있습니다. 더욱이, 생분해성 물질에 부착되는 세포의 경우, 샘플 분해로 인한 세포 부착 및 형태학의 가능한 변화를 줄이기 위해 세포 이미지를 신속하게 촬영해야 한다.
세포의 수집 결과 외에도 배양 후 배지 및 샘플 분석은 임플란트 재료의 분해 메커니즘, 제품 및 속도를 분석하는 데 유용한 데이터를 제공하기 때문에 중요합니다. 예를 들어, PLGA와 같은 생분해성 중합체는 세포 배양 동안32 동안 단량체성 또는 올리고머성 히드록실카르복실산과 같은 산성 분해 부산물을 생성할 수 있으며, 이는 세포 성장 및 증식에 영향을 미칠 수 있다. 대조적으로, 마그네슘 및 그 합금과 같은 생분해성 금속은 분해 중에 수산화 이온과 수소 가스를 생성하며31, 이는 국소 pH를 상당히 증가시킬 수 있으며, 심한 알칼리도는 국소 세포 기능에 악영향을 미칠 수 있다. 다양한 생분해성 세라믹은 또한 배지(41)의 pH를 증가시킬 수 있다. 일반적으로, 세포는 적절하게 기능하기 위해 배지에서 특정 pH 범위를 필요로 하며, 체액의 pH 값이 증가하거나 감소하는 것은 생명에 해롭다는 것이 알려져 있다42. 배양 후 배지의 pH를 측정하는 것은 생분해성 샘플 물질이 세포 배양에서 야기할 수 있는 잠재적 피해를 이해하는 데 유용합니다. 따라서, 이러한 생분해성 물질이 세포에 어떻게 영향을 미치는지에 대한 잠재적인 메카니즘을 이해하기 위해서는 배양 후 배지의 pH 값을 측정할 필요가 있다.
생분해성 물질에 대한 배양 후 배지에서 중요한 이온 농도를 측정하는 것이 중요하다. 예를 들어, Cortez Alcaraz 등은 BMSCs34로 직접 배양하여 산화 마그네슘 나노 입자가 코팅 된 마그네슘 샘플을 연구 할 때 배양 후 배지의 Mg2 + 및 Ca2+ 이온 농도를 측정했습니다. 마그네슘 이온의 농도는 세포 배양 동안 시험관 내에서 다른 샘플의 분해 특성을 나타내며, 칼슘 이온의 농도는 세포 증식 동안 칼슘 침착에 대한 정보를 제공 할 수 있습니다. Xu et al. BMSCs와 함께 직접 노출 배양을 사용하여 HyA 하이드로젤을 연구했을 때 배양 후 배지의 Fe3+ 이온 농도를 측정했습니다. 그들은 Fe3+ 이온을 사용하여 HyA33의 가교 밀도를 조정했습니다. Fe3+ 이온은 배양 배지의 pH 값을 감소시킬 수 있고, 고농도의 Fe3+ 이온은 세포에 독성을 가질 수 있다. 따라서, 생분해성 물질 및 이들의 관련 분해 생성물의 세포 적합성을 향상시키기 위해 관심있는 이온의 농도를 측정하는 것이 중요하다.
우리는 다른 물질에 대한 세포 - 물질 상호 작용을 분석하기 위해 다른 데이터를 수집 할 수 있습니다. 예를 들어, 보충 표 1에 나타낸 바와 같이, Mg 합금은 물과 반응하여 분해되고, 분해 생성물은 Mg2+ 및 OH-이온, H2 가스, 및 Mg(OH)2와 같은 일부 다른 불용성 분해 생성물을 포함할 수 있다. XRD, SEM, 및 EDX는 물질 상에 형성된 광물 침착을 결정하는데 사용될 수 있다. 우리는 배지에서 Mg2+ 이온 농도와 pH 값이 세포 거동에 미치는 영향을 연구할 수 있습니다. 또한, 우리는 금속 분해 중 가스 진화를 연구하기 위해 이러한 결과를 사용할 수 있습니다. 시험관 내 연구에 따르면 H2 가스의 임계 허용 오차 수준은 <0.01 mL/cm2/day이며, 이는 임시 임플란트 적용을 위해 마그네슘 합금을 스크리닝하는 데 널리 사용되었습니다. 본질적으로, 가스 진화의 양은 마그네슘 합금의 분해 속도에 달려 있습니다. 또 다른 예에서, PLGA는 물의 존재 하에 그의 에스테르 결합의 가수분해로 인해 분해된다. 젖산과 글리콜산의 분해 생성물뿐만 아니라 배지의 pH 값도 세포 - 물질 상호 작용을 분석하기 위해 연구 될 수 있습니다. 이 기사에 설명 된 방법에는 세포 배양 배지에서 방출 된 이온 및 pH 값의 측정 및 물질의 질량 변화가 포함되며, 이는 물질의 분해 속도를 추정하는 데 사용될 수 있습니다.
상이한 물질은 일반적으로 시험관내 및 생체내에서 다르게 행동하며, 세포 적합성 연구를 위한 방법은 적용 환경 및 물질 유형에 기초하여 선택되어야 한다. 정형 외과 적용의 경우, 관련 뼈 세포와 임플란트가 서로 직접 접촉 할 때 상호 작용을 평가하는 것이 바람직합니다. 직접 배양 방법은 새로 시딩된 세포와 임플란트 사이의 상호작용을 조사하기 위해 이용될 수 있었다. 심혈관 응용에서, 확립된 세포가 이식된 스텐트 물질과 직접 또는 간접적으로 접촉할 때, 직접 노출 배양 및 노출 배양 방법이 심혈관 응용을 위한 생분해성 금속의 세포 적합성을 평가하기 위해 사용될 수 있다. 우리는이 기사에서 설명 된 시험관 내 방법이 생분해 성 임플란트 물질의 세포 적합성에 대한 초기 증거를 제공하는 것이 가능하다고 믿습니다. 배양 방법은 다양한 분해 메커니즘, 제품 및 비율을 가진 다양한 물질에 대해 수정되어야합니다. 예를 들어, 상이한 재료에 대한 배양 시간은 상이한 재료 유형의 다양한 분해 속도에 기초하여 변형될 수 있다. 상이한 결과는 물질의 상이한 분해 메카니즘 및 생성물에 기초하여 수집될 수 있다.
요약하면, 세포, 배지 및 샘플 물질을 시험관 내 세포 배양 전후에 정성 및 정량적으로 분석하여 생분해성 임플란트 재료 및 분해 생성물이 세포 적합성에 미치는 영향을 이해하는 것이 중요합니다. 이 기사에서 제시 한 세 가지 배양 방법은 의료용 임플란트 및 조직 공학 응용 분야를위한 생분해 성 폴리머, 세라믹 및 금속을 포함한 광범위한 생분해 성 물질을 연구하는 데 사용할 수 있습니다. 이러한 시험관내 세포 연구는 생분해성 물질을 스크리닝하고, 제품 개발 초기 단계에서 이식형 장치 및 스캐폴드의 설계를 최적화하며, 세포에 대한 잠재적 독성을 감소시키는 데 유용합니다.
공개
저자는 이해 상충이 없습니다.
감사의 말
저자들은 미국 국립 과학 재단 (NSF CBET 상 1512764 및 NSF PIRE 1545852), 국립 보건원 (NIH NIDCR 1R03DE028631), 캘리포니아 대학 (UC) 리젠트 교수 개발 펠로우십, 연구 종자 보조금위원회 (Huinan Liu) 및 UC-Riverside 논문 연구 보조금 (Jiajia Lin)의 재정 지원에 감사드립니다. 저자들은 SEM/EDS를 사용하기 위해 UC-Riverside의 CFAMM(Advanced Microscopy and Microanalysis) 중앙 시설(CFAMM)과 XRD 기기 사용을 위한 페리 청 박사를 높이 평가합니다. 저자는 또한 부분 편집을 위해 Thanh Vy Nguyen과 Queenie Xu를 높이 평가합니다. 저자는 또한 비디오에 대한 내레이션을 녹음 한 Cindy Lee에게 감사하고 싶습니다. 이 기사에서 표현 된 의견, 결과 및 결론 또는 권장 사항은 저자의 의견이며 국립 과학 재단 또는 국립 보건원 (National Institutes of Health)의 견해를 반드시 반영하지는 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | VWR | 490019-704 | |
| 12-well tissue-culture-treated plates | Thermo Fisher Scientific | 353043 | |
| 15 mL conical tube (Polypropylene) | VWR | 89039-666 | |
| 18 G needle | BD | 305196 | |
| 25½ G needle | BD | 305122 | |
| 4′,6-diamidino-2- phenylindole dilactate (DAPI) | Invitrogen | D3571 | |
| 50 mL conical tube (Polypropylene) | VWR | 89039-658 | |
| 70 μm nylon strainer | Fisher Scientific | 50-105-0135 | |
| Alexa Flour 488-phalloidin | Life technologies | A12379 | |
| Biological safety cabinet | LABCONCO | Class II, Type A2 | |
| Centrifuge | Eppendorf | Rotor F-35-6-30, Centrifuge5430 | |
| Clear Fused Quartz Round Dish | AdValue Technology | FQ-4085 | |
| CO2 incubator | SANYO | MCO-19AIC | |
| CoolCell Freezer Container | Corning | 432000 | foam container designed to regulate temperature decrease |
| Cryovial | Thermo Fisher Scientific | 5000-1020 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Sigma-Aldrich | D5648 | |
| EDX analysis software | Oxford Instruments | AztecSynergy | |
| Energy dispersive X-ray spectroscopy (EDX) | FEI | 50mm2 X-Max50 SDD | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Inc. | SH30910 | |
| Fluorescence microscope | Nikon | Eclipse Ti | |
| Formaldehyde | VWR | 100496-496 | |
| Hemacytometer | Hausser Scientific | 3520 | |
| ImageJ software | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation (LOCI, University of Wisconsin) | ||
| Inductively coupled plasma optical emission spectrometry (ICP-OES) | PerkinElmer | Optima 8000 | |
| Optical microscope | VWR | VistaVision | |
| Penicillin/streptomycin (P/S) | Thermo Fisher Scientific, Inc., | 15070063 | |
| pH meter | VWR | model SB70P | |
| Phosphate Buffered Saline (PBS) | VWR | 97062-730 | |
| Scanning electronic microscope (SEM) | FEI | Nova NanoSEM 450 | |
| surgical blade | VWR | 76353-728 | |
| Tissue Culture Flasks | VWR | T-75, MSPP-90076 | |
| Transwell inserts | Corning | 3460 | |
| Trypsin-ethylenediaminetetraacetic acid solution (Trypsin-EDTA) | Sigma-Aldrich | T4049 | |
| X-ray diffraction instrument (XRD) | PANalytical | Empyrean Series 2 |
참고문헌
- Zhang, C., et al. Antimicrobial bioresorbable Mg-Zn-Ca alloy for bone repair in a comparison study with Mg-Zn-Sr Alloy and pure Mg. ACS Biomaterials Science & Engineering. 6 (1), 517-538 (2019).
- Xu, C., et al. A green biocompatible fabrication of highly porous functional ceramics with high strength and controllable pore structures. Journal of Materials Science & Technology. 32 (8), 729-732 (2016).
- Asgari, M., et al. Biodegradable metallic wires in dental and orthopedic applications: a review. Metals. 8 (4), 212(2018).
- Shi, Y., Liu, J., Yu, L., Zhong, L. Z., Jiang, H. B. β-TCP scaffold coated with PCL as biodegradable materials for dental applications. Ceramics International. 44 (13), 15086-15091 (2018).
- Wu, C. -C., et al. A self-reinforcing biodegradable implant made of poly (ɛ-caprolactone)/calcium phosphate ceramic composite for craniomaxillofacial fracture fixation. Journal of Cranio-Maxillofacial Surgery. 44 (9), 1333-1341 (2016).
- Jiang, W., et al. In vitro evaluation of MgSr and MgCaSr alloys via direct culture with bone marrow derived mesenchymal stem cells. Acta Biomaterialia. 72, 407-423 (2018).
- Zhang, C., et al. Magnesium-based biodegradable microelectrodes for neural recording. Materials Science and Engineering: C. 110, 110614(2020).
- Jia, B., et al. In vitro and in vivo studies of Zn-Mn biodegradable metals designed for orthopedic applications. Acta Biomaterialia. 108, 358-372 (2020).
- Yang, H., et al. Alloying design of biodegradable zinc as promising bone implants for load-bearing applications. Nature Communications. 11 (1), 1-16 (2020).
- Liu, H., et al. Injectable, biomechanically robust, biodegradable and osseointegrative bone cement for percutaneous kyphoplasty and vertebroplasty. International Orthopaedics. 42 (1), 125-132 (2018).
- Anjum, S., Arora, A., Alam, M., Gupta, B. Development of antimicrobial and scar preventive chitosan hydrogel wound dressings. International Journal of Pharmaceutics. 508 (1-2), 92-101 (2016).
- Barroca, N., et al. Electrically polarized PLLA nanofibers as neural tissue engineering scaffolds with improved neuritogenesis. Colloids and Surfaces B: Biointerfaces. 167, 93-103 (2018).
- Liu, Y., et al. Polydopamine-modified poly (l-lactic acid) nanofiber scaffolds immobilized with an osteogenic growth peptide for bone tissue regeneration. RSC Advances. 9 (21), 11722-11736 (2019).
- Liu, H., Webster, T. J. Enhanced biological and mechanical properties of well-dispersed nanophase ceramics in polymer composites: from 2D to 3D printed structures. Materials Science and Engineering: C. 31 (2), 77-89 (2011).
- Xu, C., et al. Bioinspired mechano-sensitive macroporous ceramic sponge for logical drug and cell delivery. Advanced Science. 4 (6), 1600410(2017).
- Xu, C., Bai, Y., Yang, H., Yang, L. Mechanically modulated, ultra-high precision logic delivery of molecules by bio-inspired macroporous ceramic sponge. MRS Advances. 2 (19-20), 1125-1130 (2017).
- Zhang, N., Xu, C., Azer, A., Liu, H. Dispersibility and characterization of polyvinyl alcohol-coated magnetic nanoparticles in poly (glycerol sebacate) for biomedical applications. Journal of Nanoparticle Research. 21 (12), 1-11 (2019).
- Kim, S. S., et al. A poly (lactide-co-glycolide)/hydroxyapatite composite scaffold with enhanced osteoconductivity. Journal of Biomedical Materials Research Part A. 80 (1), 206-215 (2007).
- Cipriano, A. F., et al. Degradation of bioresorbable Mg-4Zn-1Sr intramedullary pins and associated biological responses in vitro and in vivo. ACS Applied Materials & Interfaces. 9 (51), 44332-44355 (2017).
- Surmeneva, M. A., et al. Bone marrow derived mesenchymal stem cell response to the RF magnetron sputter deposited hydroxyapatite coating on AZ91 magnesium alloy. Materials Chemistry and Physics. 221, 89-98 (2019).
- Sheikh, Z., et al. Mechanisms of in vivo degradation and resorption of calcium phosphate based biomaterials. Materials. 8 (11), 7913-7925 (2015).
- Klein, C., Driessen, A., De Groot, K., Van den Hooff, A. Biodegradation behavior of various calcium phosphate materials in bone tissue. Journal of Biomedical Materials Research. 17 (5), 769-784 (1983).
- Lanao, R. P. F., Leeuwenburgh, S. C., Wolke, J. G., Jansen, J. A. Bone response to fast-degrading, injectable calcium phosphate cements containing PLGA microparticles. Biomaterials. 32 (34), 8839-8847 (2011).
- Vey, E., et al. Degradation kinetics of poly (lactic-co-glycolic) acid block copolymer cast films in phosphate buffer solution as revealed by infrared and Raman spectroscopies. Polymer Degradation and Stability. 96 (10), 1882-1889 (2011).
- Standard, I. Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity. Geneve, Switzerland: International Organization for Standardization. , (2009).
- Liu, X., Zhou, W., Wu, Y., Cheng, Y., Zheng, Y. Effect of sterilization process on surface characteristics and biocompatibility of pure Mg and MgCa alloys. Materials Science and Engineering: C. 33 (7), 4144-4154 (2013).
- Liu, H., Yazici, H., Ergun, C., Webster, T. J., Bermek, H. An in vitro evaluation of the Ca/P ratio for the cytocompatibility of nano-to-micron particulate calcium phosphates for bone regeneration. Acta Biomaterialia. 4 (5), 1472-1479 (2008).
- Liu, H., et al. Enhancing effects of radiopaque agent BaSO4 on mechanical and biocompatibility properties of injectable calcium phosphate composite cement. Materials Science and Engineering: C. 116, 110904(2020).
- Xu, C., et al. A versatile three-dimensional foam fabrication strategy for soft and hard tissue engineering. Biomedical Materials. 13 (2), 025018(2018).
- Speranza, V., Sorrentino, A., De Santis, F., Pantani, R. Characterization of the polycaprolactone melt crystallization: complementary optical microscopy, DSC, and AFM studies. The Scientific World Journal. , 720157(2014).
- Cipriano, A. F., et al. Anodization of magnesium for biomedical applications-Processing, characterization, degradation and cytocompatibility. Acta Biomaterialia. 62, 397-417 (2017).
- Li, H., Chang, J. pH-compensation effect of bioactive inorganic fillers on the degradation of PLGA. Composites science and technology. 65 (14), 2226-2232 (2005).
- Xu, C., Hung, C., Cao, Y., Liu, H. H. Tunable crosslinking, reversible phase transition, and 3D printing of hyaluronic acid hydrogels via dynamic coordination of innate carboxyl groups and metallic ions. ACS Applied Bio Materials. 4 (3), 2408-2428 (2021).
- Cortez Alcaraz, M. C., et al. Electrophoretic deposition of magnesium oxide nanoparticles on magnesium: processing parameters, microstructures, degradation, and cytocompatibility. ACS Applied Bio Materials. 2 (12), 5634-5652 (2019).
- Rutherford, D., et al. Synthesis, characterization, and cytocompatibility of yttria stabilized zirconia nanopowders for creating a window to the brain. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 108 (3), 925-938 (2020).
- Tian, Q., Deo, M., Rivera-Castaneda, L., Liu, H. Cytocompatibility of magnesium alloys with human urothelial cells: a comparison of three culture methodologies. ACS Biomaterials Science & Engineering. 2 (9), 1559-1571 (2016).
- Nguyen, T., Cipriano, A., Guan, R. G., Zhao, Z. Y., Liu, H. In vitro interactions of blood, platelet, and fibroblast with biodegradable magnesium-zinc-strontium alloys. Journal of Biomedical Materials Research Part A. 103 (9), 2974-2986 (2015).
- Jiang, W., Lin, J., Chen, A. H., Pan, J., Liu, H. A portable device for studying the effects of fluid flow on degradation properties of biomaterials inside cell incubators. Regenerative Biomaterials. 6 (1), 39-48 (2019).
- Tian, Q., et al. Responses of human urothelial cells to magnesium-zinc-strontium alloys and associated insoluble degradation products for urological stent applications. Materials Science and Engineering: C. 96, 248-262 (2019).
- Wetteland, C. L., Liu, H. Optical and biological properties of polymer-based nanocomposites with improved dispersion of ceramic nanoparticles. Journal of Biomedical Materials Research Part A. 106 (10), 2692-2707 (2018).
- Wetteland, C. L., Nguyen, N. -Y. T., Liu, H. Concentration-dependent behaviors of bone marrow derived mesenchymal stem cells and infectious bacteria toward magnesium oxide nanoparticles. Acta Biomaterialia. 35, 341-356 (2016).
- Aoi, W., Marunaka, Y. The importance of regulation of body fluid pH in the development and progression of metabolic diseases. Advances in Medicine and Biology. 77, 177-189 (2014).
- Wang, H. Hydroxyapatite degradation and biocompatibility. , The Ohio State University. (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유