Method Article
Direkte und indirekte Kulturmethoden zur Untersuchung biologisch abbaubarer Implantatmaterialien in vitro
In diesem Artikel
Zusammenfassung
Wir stellen drei Methoden der direkten Kultur, der direkten Expositionskultur und der Expositionskultur zur Bewertung der In-vitro-Zytokompatibilität von biologisch abbaubaren Implantatmaterialien vor. Diese In-vitro-Methoden ahmen verschiedene In-vivo-Zell-Implantat-Interaktionen nach und können zur Untersuchung verschiedener biologisch abbaubarer Materialien angewendet werden.
Zusammenfassung
In den letzten Jahrzehnten wurden biologisch abbaubare Materialien für biomedizinische Anwendungen wie orthopädische, zahnärztliche und kraniomaxillofaziale Implantate umfassend erforscht. Um biologisch abbaubare Materialien für biomedizinische Anwendungen zu screenen, ist es notwendig, diese Materialien in Bezug auf In-vitro-Zellreaktionen , Zytokompatibilität und Zytotoxizität zu bewerten. Die Standards der Internationalen Organisation für Normung (ISO) wurden bei der Bewertung von Biomaterialien häufig verwendet. Die meisten ISO-Normen wurden jedoch ursprünglich festgelegt, um die Zytotoxizität von nicht abbaubaren Materialien zu bewerten, wodurch ein begrenzter Wert für das Screening biologisch abbaubarer Materialien erbracht wurde.
Dieser Artikel stellt drei verschiedene Kulturmethoden vor und diskutiert sie, nämlich die direkte Kulturmethode, die direkte Expositionskulturmethode und die Expositionskulturmethode zur Bewertung der In-vitro-Zytokompatibilität von biologisch abbaubaren Implantatmaterialien, einschließlich biologisch abbaubarer Polymere, Keramiken, Metalle und ihrer Verbundwerkstoffe, mit verschiedenen Zelltypen. Die Forschung hat gezeigt, dass Kulturmethoden die Zellreaktionen auf biologisch abbaubare Materialien beeinflussen, da ihr dynamischer Abbau räumlich-zeitliche Unterschiede an der Grenzfläche und in der lokalen Umgebung induziert. Insbesondere zeigt die direkte Kulturmethode die Reaktionen von Zellen, die direkt auf den Implantaten ausgesät sind; die Methode der direkten Expositionskultur klärt die Reaktionen etablierter Wirtszellen auf, die mit den Implantaten in Kontakt kommen; Und die Expositionskulturmethode wertet die etablierten Wirtszellen aus, die nicht in direktem Kontakt mit den Implantaten stehen, sondern durch die Veränderungen in der lokalen Umgebung aufgrund des Implantatabbaus beeinflusst werden.
Dieser Artikel enthält Beispiele für diese drei Kulturmethoden zur Untersuchung der In-vitro-Zytokompatibilität von biologisch abbaubaren Implantatmaterialien und deren Wechselwirkungen mit aus dem Knochenmark stammenden mesenchymalen Stammzellen (BMSCs). Es beschreibt auch, wie man die Zellen erntet, durchlässt, kultiviert, samt, fixiert, färbt, charakterisiert und postkulturelle Medien und Materialien analysiert. Die in diesem Artikel beschriebenen In-vitro-Methoden ahmen verschiedene Szenarien der In-vivo-Umgebung nach und erweitern die Anwendbarkeit und Relevanz von In-vitro-Zytokompatibilitätstests verschiedener Biomaterialien für verschiedene biomedizinische Anwendungen.
Einleitung
Seit Jahrzehnten werden biologisch abbaubare Materialien umfassend untersucht und in biomedizinischen Anwendungen wie orthopädischen1,2, dentalen3,4 und kraniomaxillofacialen5 Anwendungen eingesetzt. Im Gegensatz zu permanenten Implantaten und Materialien werden biologisch abbaubare Metalle, Keramiken, Polymere und ihre Verbundwerkstoffe im Laufe der Zeit durch verschiedene chemische Reaktionen in der physiologischen Umgebung allmählich im Körper abgebaut. Zum Beispiel sind biologisch abbaubare Metalle wie Magnesium (Mg) -Legierungen1,6,7 und Zink (Zn) -Legierungen8,9 vielversprechende Materialien für Knochenfixierungsgeräte. Ihre biologische Abbaubarkeit könnte die Notwendigkeit von Sekundäroperationen beseitigen, um die Implantate nach der Knochenheilung zu entfernen. Biologisch abbaubare Keramiken wie Calciumphosphatzemente (CPCs) haben ein aufregendes Potenzial für die Behandlung von osteoporotischen Wirbelkompressionsfrakturen in der perkutanen Kyphoplastie gezeigt10. Die CPCs unterstützen den gebrochenen Wirbelkörper mechanisch und bauen sich nach der Verheilung der Fraktur allmählich ab.
Biologisch abbaubare Polymere, wie einige Polysaccharide und Polyester, wurden auch für biomedizinische Anwendungen umfassend erforscht. Zum Beispiel hat Chitosan-Hydrogel als biologisch abbaubares Polysaccharid seine Fähigkeiten zur Vorbeugung von Infektionen und zur Regeneration von Hautgewebe unter Beweis gestellt11. Poly-L-Milchsäure (PLLA), Poly(glykolsäure) (PGA) und Poly(milch-Co-Glykolsäure) (PLGA) sind weithin untersuchte Polyester zur Herstellung von porösen 2D- oder 3D-Gerüsten für Tissue-Engineering-Anwendungen12,13,14. Darüber hinaus integrieren Verbundwerkstoffe zwei oder mehr Phasen von Metallen, Keramiken und Polymeren, um erweiterte Funktionen für eine Vielzahl von biomedizinischen Anwendungen bereitzustellen15,16,17. Beispielsweise können PLGA- und Calciumphosphat-Verbundwerkstoffe zur Herstellung biologisch abbaubarer Gerüste für Anwendungen wie die Reparatur von Schädelknochendefekten verwendet werden18. Diese biologisch abbaubaren Gerüste und Implantate könnten das Wachstum von Zellen und Geweben unterstützen und fördern und dann im Laufe der Zeit allmählich im Körper abgebaut werden.
Wie in der Ergänzenden Tabelle 1 gezeigt, können verschiedene biologisch abbaubare Materialien unterschiedliche Abbaumechanismen, Produkte und Raten aufweisen. Zum Beispiel werden Magnesiumlegierungen, wie Mg-2 Gew.-% Zn-0,5 Gew.-% Ca (ZC21)1, Mg-4 Gew.-% Zn-1 Gew.-% Sr (ZSr41)19 und Mg-9 Gew.-% Al-1 Gew.-% Zink (AZ91)20, durch Reaktion mit Wasser abgebaut, und ihre Abbauprodukte umfassen hauptsächlich Mg2+-Ionen, OH-Ionen, H2-Gas und Mineralablagerungen. Die Abbaurate für biologisch abbaubare Metalle variiert je nach ihrer unterschiedlichen Zusammensetzung, Geometrie und Abbauumgebung. Zum Beispiel berichteten Cipriano et al.19, dass ZSr41-Drähte (Ø1,1 × 15 mm) 85% Masse verloren, während reine Mg-Drähte mit der gleichen Geometrie 40% Masse verloren, nachdem sie 47 Tage lang in die Tibien der Ratte implantiert worden waren. Biologisch abbaubare keramische Materialien wie Hydroxylapatit (HA) und β-Tricalciumphosphat (β-TCP) können durch lösungsgetriebene extrazelluläre Flüssigkeitsauflösung abgebaut oder in kleine Partikel zerfallen und dann sowohl durch extrazelluläre Flüssigkeitsauflösung als auch durch zellvermittelte Resorptionsprozesse abgebaut werden. Die Abbauprodukte dieser Keramiken auf Calciumphosphatbasis können Ca2+-Ionen, (PO4)3-Ionen, OH-Ionen und Mineralablagerungen21 umfassen. Die Abbaurate für Calciumphosphatkeramiken wird maßgeblich durch ihre Kristallstrukturen beeinflusst. Zum Beispiel berichteten Van Blitterswijk et al.22, dass HA mit 40 Vol.% Mikroporen keine Masse verlor, während β-TCP mit 40 Vol.% Mikroporen 30 ± 4% Masse verlor, nachdem es 3 Monate lang in die Tibien von Kaninchen implantiert worden war. Polymere wie PLGA14,23 können aufgrund der Hydrolyse der Esterbindungen in Gegenwart von Wasser abgebaut werden, und die Abbauprodukte umfassen hauptsächlich Milch- und Glykolsäuren. Es kann einen Monat für PLGA 50/50 und mehrere Monate dauern, bis PLGA 95/5 eine vollständige Verschlechterung erreicht hat24.
Zellantwort- und Zytokompatibilitätstests sind entscheidend, um diese biologisch abbaubaren Implantatmaterialien für biomedizinische Anwendungen zu bewerten und zu screenen. Aktuelle Normen der Internationalen Organisation für Normung (ISO), wie ISO 10993-5:2009 "Biological evaluation of medical devices-Part 5 Tests for in vitro cytotoxicity", wurden jedoch ursprünglich entwickelt, um die Zytotoxizität von nicht abbaubaren Biomaterialien wie Ti-Legierungen und Cr-Co-Legierungen in vitro25 zu bewerten. Insbesondere deckt ISO 10993-5:2009 nur die In-vitro-Zytotoxizitätstests des Extrakts, den direkten Kontakt und den indirekten Kontakt ab. Im Extrakttest wird der Extrakt durch Eintauchen von Proben in Extraktionsflüssigkeiten wie Kulturmedien mit Serum und physiologischen Kochsalzlösungen unter einer der üblichen Zeit- und Temperaturbedingungen hergestellt. Der gesammelte Extrakt oder die Verdünnung wird dann in die Zellkultur gegeben, um die Zytotoxizität zu untersuchen. Für den Direktkontakttest wird ein direkter Kontakt zwischen Probe und Zellen erreicht, indem die Testprobe auf die etablierte (haftete) Zellschicht gelegt wird. Beim indirekten Kontakttest werden die Kulturmedien, die Serum und geschmolzenes Agar enthalten, pipettiert, um die etablierten Zellen zu bedecken. Die Probe wird dann mit oder ohne Filter auf die erstarrte Agarschicht gelegt.
Die ISO-Normen haben einige Einschränkungen aufgezeigt, wenn sie zur Bewertung biologisch abbaubarer Materialien in vitro angewendet werden. Im Gegensatz zu nicht abbaubaren Materialien ist das Abbauverhalten von biologisch abbaubaren Materialien dynamisch und kann sich zu einem anderen Zeitpunkt oder unter verschiedenen Umgebungsbedingungen (z. B. Temperatur, Luftfeuchtigkeit, Medienzusammensetzung und Zelltyp) ändern. Der Extrakttest bewertet nur die Zytotoxizität der Abbauprodukte des Materials und spiegelt nicht den dynamischen Prozess des Probenabbaus wider. Sowohl direkte als auch indirekte Kontakttests der ISO-Norm charakterisieren nur die Wechselwirkungen zwischen den etablierten Zellen und Proben. Darüber hinaus befinden sich die Materialien und Zellen beim indirekten Kontakttest in verschiedenen Mikroumgebungen, die die In-vivo-Umgebung nicht widerspiegeln und den dynamischen Abbau biologisch abbaubarer Materialien nicht erfassen.
Ziel dieses Artikels ist es, die Zytokompatibilitätstestmethoden für verschiedene biologisch abbaubare Implantatmaterialien vorzustellen und zu diskutieren, um die oben genannten Einschränkungen der in den aktuellen ISO-Normen beschriebenen Methoden zu beheben. Die in diesem Artikel vorgestellten Methoden berücksichtigen das dynamische Abbauverhalten von Implantatmaterialien und die unterschiedlichen Umstände von Zell-Material-Interaktionen in vivo. Insbesondere enthält dieser Artikel drei Zytokompatibilitätstestmethoden, nämlich Direktkultur, Direktexpositionskultur und Expositionskultur für verschiedene biologisch abbaubare Materialien, einschließlich biologisch abbaubarer Polymere, Keramik, Metalle und deren Verbundwerkstoffe für medizinische Implantatanwendungen.
Bei der direkten Kulturmethode werden in den Kulturmedien suspendierte Zellen direkt auf den Proben ausgesät und so die Wechselwirkungen zwischen neu ausgesäten Zellen und den Implantaten bewertet. In der direkten Expositionskultur werden die Proben direkt auf die etablierte Zellschicht gelegt, um die Wechselwirkungen von Implantaten mit etablierten Wirtszellen im Körper nachzuahmen. In der Expositionskultur werden die Proben in ihre jeweiligen Vertiefungseinsätze gegeben und dann mit etablierten Zellen in die Kulturvertiefungen eingeführt, was die Reaktionen etablierter Zellen auf die Veränderungen in der lokalen Umgebung charakterisiert, die durch den Implantatabbau induziert werden, wenn sie keinen direkten Kontakt mit Implantaten haben. Die Methoden der direkten Kultur und der direkten Expositionskultur bewerten die Zellen in Kontakt mit den Implantatmaterialien in derselben Kultur gut. Die Expositionskultur charakterisiert die Zellen indirekt in Kontakt mit den Implantatmaterialien innerhalb eines vorgeschriebenen Abstands in derselben Kultur gut.
Dieser Artikel enthält eine detaillierte Beschreibung der Zytokompatibilitätstests für verschiedene biologisch abbaubare Materialien und deren Wechselwirkungen mit Modellzellen, dh aus dem Knochenmark stammenden mesenchymalen Stammzellen (BMSCs). Die Protokolle umfassen die Ernte, Kultivierung, Aussaat, Fixierung, Färbung und Bildgebung der Zellen sowie Analysen von Postkulturmaterialien und -medien, die für eine Vielzahl von biologisch abbaubaren Implantatmaterialien und eine breite Palette von Zelltypen gelten. Diese Methoden sind nützlich für das Screening biologisch abbaubarer Materialien für verschiedene biomedizinische Anwendungen in Bezug auf Zellantworten und Zytokompatibilität in vitro.
Protokoll
Dieses Protokoll wurde vom Institutional Animal Care and Use Committee (IACUC) an der University of California at Riverside (UCR) für die Zell- und Gewebegewinnung genehmigt. Eine 12 Wochen alte weibliche Sprague-Dawley (SD) Ratte wird als Beispiel im Video gezeigt. Jüngere weibliche und männliche Ratten werden bevorzugt.
1. Zellkulturvorbereitung
HINWEIS: Die drei in diesem Artikel beschriebenen Kulturmethoden sind im Allgemeinen für verschiedene Zelltypen anwendbar, die adhärenzhaft sind. Hier werden BMSCs aus Rattenentwöhnungen als Beispiel für die Zellkulturpräparation vorgestellt. Abhängig von ihrer Relevanz für spezifische medizinische Anwendungen können verschiedene Zelltypen verwendet werden, einschließlich Primärzellen, die von Tieren oder menschlichen Spendern geerntet wurden, und Zelllinien aus einer Zell- / Gewebebank.
- Ernte von BMSCs aus Rattenentwöhnungen
HINWEIS: Das schematische Diagramm in Abbildung 1 zeigt die Schritte zur Ernte von BMSCs aus Rattenentwöhnungen.- Euthanasie die Sprague Dawley (SD) Ratte durch CO2-Inhalation .
- Entfernen Sie die Haut und die Muskeln und das Bindegewebe, um den Femur aus der eingeschläferten Ratte zu sezieren. Legen Sie die Oberschenkelknochen in ein 15 ml konisches Röhrchen (Polypropylen), das Zellkulturmedium enthält. Legen Sie die konischen Röhren bis zum Zeitpunkt der Zellextraktion auf Eis.
HINWEIS: Tibia kann auch zur Ernte von BMSCs verwendet werden. Das Zellkulturmedium ist Dulbeccos Modified Eagle Medium (DMEM), ergänzt mit 10% fetalem Rinderserum (FBS) und 1% Penicillin/Streptomycin (P/S). - Geben Sie die Knochen in eine Petrischale in der biologischen Sicherheitswerkbank. Schneiden Sie die Enden des Knochens mit einer chirurgischen Klinge ab und spülen Sie das Knochenmark in einen 50 ml konischen Schlauch (Polypropylen), indem Sie die Knochenmarkhöhle mit einer Spritze mit einer 251/2 G-Nadel mit Zellkulturmedien waschen.
HINWEIS: Führen Sie eine Spritze mit einer 18 G Nadel in das Medium mit Knochenmark ein. Nehmen Sie langsam und sanft die Medien auf und verteilen Sie sie, um den großen Teil des Knochenmarks auseinander zu brechen, bis keine sichtbaren Zell- / Gewebeagglomerate vorhanden sind. - Filtern Sie die Zellsuspension mit einem 70-μm-Filter, gefolgt von einer Zentrifugation bei 126 × g (1.000 U / min) für 5 Minuten, um die Zellpellets zu erhalten.
- Saugen Sie die überstehenden Medien ab und füllen Sie sie mit 10 ml frischen Medien auf. Pipettieren Sie vorsichtig auf und ab, um die Zellen mit einer serologischen 10-ml-Pipette wieder zu suspendieren.
- Pippen Sie die Aufhängung direkt auf den Innenboden eines T-75-Kolbens und fügen Sie Medien hinzu, um die Lautstärke auf 25 ml zu erhöhen. Kultivieren Sie die Zellen in einem Inkubator in einer sterilen Standard-Zellkulturumgebung (d. h. 37 °C, befeuchtete Atmosphäre mit 5% CO2 und 95% Luft).
- Nach 3-7 Tagen spülen Sie die nicht adhärenten Zellen ab, indem Sie das alte Medium absaugen und mit frischem Medium auffüllen. Setzen Sie die Kultivierung und Fütterung der Zellen mit frischem Medium fort, bis sie für die Zellpassage, das Einfrieren oder die Verwendung in einem Experiment bereit sind.
- Zellpflege
- Wechseln Sie das Zellkulturmedium regelmäßig, um zelluläre Abfallprodukte zu entfernen, und füllen Sie die Nährstoffe etwa jeden zweiten Tag auf, bis die Zellen zu 90% -100% konfluent sind. Bei 90% Konfluenz, Durchgang, Einfrieren oder Verwenden Sie die Zellen in einem Experiment.
- Übertragende Zellen
HINWEIS: Passaging, auch Subkulturation genannt, ist ein Begriff, der immer dann gilt, wenn Zellen von einer Kultur in eine andere übertragen werden. Frisch geerntete Zellen befinden sich im Durchgangsstadium 0 (P0). Die in diesem Artikel beschriebenen Mengen an Trypsin-ethylendiamintetraessigsäurelösung (Trypsin-EDTA) und Medien sind für einen T-75-Kolben bestimmt.- Überprüfen Sie die Zellen unter einem optischen Mikroskop, um zu bestätigen, dass die Zellen zu 90% konfluent sind.
- Saugen Sie das Medium aus dem Zellenkolben ab.
- Geben Sie 10 ml phosphatgepufferte Kochsalzlösung (PBS) mit einer serologischen Pipette in den Kolben. Schaukeln Sie den Kolben vorsichtig, um die Zellen mit PBS zu spülen. aspirieren Sie alle PBS.
HINWEIS: Dieser Schritt dient als zusätzliche Spülung, um sicherzustellen, dass während des Passierens keine abgestorbenen Zellen oder Zellabfälle übertragen werden. - Geben Sie 3 ml Trypsin-EDTA direkt auf die Oberfläche der Zellen in den Zellkolben. Schaukeln Sie den Kolben vorsichtig, um sicherzustellen, dass die gesamte Oberfläche mit den Zellen von der Trypsin-EDTA bedeckt ist.
- Legen Sie den Zellkolben mit Trypsin-EDTA für 5 Minuten in den Inkubator, damit sich die Zellen lösen können.
- Überprüfen Sie nach 5 Minuten im Inkubator die Zellen unter einem optischen Mikroskop, um zu bestätigen, dass sich die Zellen gelöst haben. Wenn sich einige Zellen nicht gelöst haben, tippen Sie vorsichtig auf die Seite des Zellenkolbens und überprüfen Sie den Kolben erneut.
- Geben Sie 9 ml frisches Medium in den Zellkolben, um die Trypsin-EDTA zu verdünnen. Dies liefert zugänglichere Proteine, an die sich das Trypsin-EDTA binden kann, anstatt die Zellen zu lysieren.
- Pipette die Zellen in Medien und Trypsin-EDTA und dosieren sie in einen 15 ml konischen Schlauch. Zentrifugieren Sie die Zellen bei 126 × g (1.000 U/min) für 5 min.
- Ohne das Zellpellet zu stören, aspirieren Sie das Medium mit Trypsin-EDTA.
- Geben Sie 5-10 ml frisches Medium in das Zentrifugenröhrchen und resuspendieren Sie die Zellen im Medium vorsichtig mit einer serologischen 10 ml Pipette.
- Die in Medium suspendierten Zellen werden aus dem Zentrifugenröhrchen pipettiert und das Volumen in 2-3 Frischkulturkolben aufgeteilt. Fügen Sie genügend Medium hinzu, um das gesamte mittlere Volumen auf 25 ml für jeden Kolben zu bringen.
HINWEIS: Das Split-Verhältnis während der Subkultur kann je nach Zelltyp und spezifischen Wachstumsmerkmalen variieren. - Überprüfen Sie die Zellen unter einem optischen Mikroskop und legen Sie sie wieder in den Inkubator.
- Zellen einfrieren
- Überprüfen Sie die Zellen unter einem optischen Mikroskop, um zu bestätigen, dass die Zellen zu 90% konfluent sind.
- Wiederholen Sie die Schritte 1.2.2.2 bis 1.2.2.9.
- 900 μL frisches Medium in das Zentrifugenröhrchen mit einer 100-1000 μL Mikropipette geben. Langsam und sanft resuspendieren Sie Zellen in Medium mit der gleichen Mikropipette.
- Übertragen Sie die 900 μL Zellsuspension in ein Kryovial. 100 μL Dimethylsulfoxid (DMSO) hinzufügen.
- Legen Sie das Kryovial so schnell wie möglich in einen zylindrischen Schaumbehälter, der den Temperaturabfall regulieren soll (siehe Materialtabelle). Legen Sie den Schaumstoffbehälter in den -80 °C Gefrierschrank.
- Auftauende Zellen
- Tauen Sie die gefrorenen Zellen im Wasserbad auf. Nehmen Sie ein steriles konisches 15-ml-Röhrchen, das mit 5 ml frischem Medium gefüllt ist, legen Sie die Zellen in das konische Röhrchen und zentrifugieren Sie bei 126 × g (1.000 U / min) für 5 min.
- Saugen Sie das Medium ab, das DMSO enthält.
- Fügen Sie 5-10 ml frisches Medium zu dem 15 ml konischen Zellröhrchen hinzu. Langsam und sanft auf und ab pipettieren, um die Zellen wieder zu suspendieren.
- Die in Medium suspendierten Zellen werden aus dem 15 ml konischen Röhrchen pipettiert und in einen neuen T-75-Kolben dosiert. Verwenden Sie beim Dosieren von Zellen eine ausladende Bewegung, um die Zellen so gleichmäßig wie möglich auf der Unterseite des Zellkolbens zu verteilen.
- Fügen Sie genug frisches Medium hinzu, um das gesamte mittlere Volumen auf 25 ml für jeden T-75-Kolben zu bringen.
- Überprüfen Sie die Zellen unter einem optischen Mikroskop und legen Sie den Zellkolben wieder in den Inkubator.
2. Probenvorbereitung und Sterilisation
- Probenvorbereitung
- Verwenden Sie mit Gewebekulturen behandelte Platten wie 6, 12, 24, 48 oder 96-Well-Platten für Zellkulturexperimente, die in diesem Artikel beschrieben werden. Wählen Sie die Art der Gewebekulturplatten und das Volumen des Mediums in jedem Well, basierend auf verschiedenen experimentellen Designs wie der Probendimension.
- Sterilisieren oder desinfizieren Sie alle biologisch abbaubaren Proben vor der Zellkultur.
HINWEIS: Desinfektion ist akzeptabel für in vitro Untersuchungen, bei denen die Proben unter bestimmten Sterilisationsbedingungen mit hoher Hitze, Oxidationsmittel und/oder Radikalen zu chemischen und/oder Oberflächenveränderungen neigen. Sterilisations- oder Desinfektionsmethoden für verschiedene Probentypen variieren je nach den unterschiedlichen Eigenschaften der Materialien wie Polymere, Metalle und Keramik. Der Prozess zur Sterilisation oder Desinfektion kann Wärme, Gas, Strahlung, Chemikalien, Hochdruck oder eine Kombination davon beinhalten.- Biologisch abbaubare Metalle
- Verwenden Sie im Allgemeinen ultraviolette (UV) Strahlung, um biologisch abbaubare Metalle für In-vitro-Studien zu desinfizieren.
HINWEIS: Zum Beispiel berichteten Zhang et al., dass reines Magnesium (Mg) und ZC21 Mg-Legierungsproben 4 h lang unter UV-Strahlung desinfiziert wurden, bevor sie in den Zellstudien verwendet wurden1. Für In-vivo-Studien müssen die Proben in der Regel sterilisiert werden. Bei vielen biologisch abbaubaren Metallen wie Magnesium oder Magnesiumlegierungen sollte das Autoklavieren mit Dampf vermieden werden, da diese Proben in Wasser oxidiert oder korrodiert werden könnten6. Eine Quarzschale wird für die UV-Desinfektion empfohlen, da sie eine bessere UV-Transparenz bietet als die meisten Gläser und Kunststoffe. - Sterilisieren Sie Mg-Legierungsproben unter trockener Hitze in einem Ofen oder Autoklaven im Temperaturbereich von 100-200 °C.
HINWEIS: Da einige metallische Legierungen bei hohen Temperaturen in der Luft immer noch an der Oberfläche oxidieren können, kann in einigen Fällen hochintensive Strahlung als Alternative verwendet werden. Hochintensive Strahlung wie Alpha- oder Gammastrahlung sollte jedoch bei der Sterilisation dünner Metallfolien vermieden werden. Es kann eine Atomverschiebung innerhalb der Materialien verursachen und die Mikrostruktur von Materialien verändern. - Verwenden Sie die Gassterilisation von Ethylenoxid (EtO) als alternative Methode für biologisch abbaubare Metalle, die empfindlich auf Hitze und Strahlung reagieren26.
- Verwenden Sie im Allgemeinen ultraviolette (UV) Strahlung, um biologisch abbaubare Metalle für In-vitro-Studien zu desinfizieren.
- Biologisch abbaubare Keramik
- Im Allgemeinen desinfizieren Sie biologisch abbaubare Keramik vor In-vitro-Studien mit UV-Strahlung oder 70% iger Ethanollösung.
ANMERKUNG: Zum Beispiel berichteten Liu et al., dass die Calciumphosphatproben durch Eintauchen in 70% Ethanol für 1 h und Exposition gegenüber UV-Licht für 12 h auf jeder Seite desinfiziert wurden, bevor sie in In-vitro-Zytokompatibilitätstests verwendet wurden27. - Verwenden Sie Autoklaven, um biologisch abbaubare Keramik zu sterilisieren, wenn Hochtemperatur- und Wasserdampf ihre Zusammensetzungen und Mikrostrukturen nicht beschädigen.
HINWEIS: Einige Keramiken können durch Autoklavieren beeinträchtigt werden. Zum Beispiel wurden Phasenwechsel und Oberflächenaufrauen gefunden, wenn yttriastabilisierte Zirkonoxidkeramiken bei 121 °C für 15 min autoklaviert wurden. Darüber hinaus können CPCs nicht durch Autoklavieren mit Dampf sterilisiert werden, da die Proben mit Wasser reagieren. - Verwenden Sie alternative Sterilisationsmethoden wie Cobalt-60-Strahlung für die oben genannten Yttria-stabilisierten Zirkonoxidkeramiken und CPC-Proben28.
- Im Allgemeinen desinfizieren Sie biologisch abbaubare Keramik vor In-vitro-Studien mit UV-Strahlung oder 70% iger Ethanollösung.
- Biologisch abbaubare Polymere
- Im Allgemeinen desinfizieren Sie biologisch abbaubare Polymere mit UV-Strahlung oder 70% Ethanol, bevor Sie sie in Zellstudien in vitro verwenden.
HINWEIS: Einige Polymere können unter UV-Strahlung chemischen Veränderungen unterliegen. Zur Sterilisation kann eine Gammastrahlenbehandlung wie Cobalt-60-Strahlung verwendet werden. Beispielsweise wurden Stärkepulver unter Cobalt-60-Strahlung sterilisiert, bevor sie in In-vitro-Zellstudien verwendet wurden29. - Autoklavische Polymermaterialien, die hohen Temperaturen und Feuchtigkeit standhalten können.
HINWEIS: Zum Beispiel können Polymere wie Polypropylen autoklaviert werden, da sie Autoklaviertemperaturen (dh 121-134 ° C) tolerieren können. Einige Polymere wie Polycaprolacton (PCL) können aufgrund ihrer relativ niedrigen Schmelzpunkte (d. h. etwa 60 °C) nicht autoklaviert werden30. - Verwenden Sie EtO-Gas, um polymere Materialien zu sterilisieren, die empfindlich auf Hitze oder Strahlensterilisation reagieren.
- Im Allgemeinen desinfizieren Sie biologisch abbaubare Polymere mit UV-Strahlung oder 70% Ethanol, bevor Sie sie in Zellstudien in vitro verwenden.
- Biologisch abbaubare Metalle
3. Zellkulturmethoden
- Direkte Kulturmethoden
HINWEIS: Das schematische Diagramm in Abbildung 2A zeigt die Schritte der direkten Kulturmethode. In diesem Artikel wurden BMSCs auf einer von Mg abgeleiteten Platte kultiviert, die in den Vertiefungen einer 12-Well-Gewebekultur-behandelten Platte als Beispiel platziert wurde, um die Kulturmethode zu veranschaulichen.- Führen Sie die in den Schritten 1.2.2.1-1.2.2.10 beschriebenen Schritte aus, um die Zellsuspension zu erhalten.
- Verwenden Sie einen 90% konfluierenden Kolben, um die Zellkonzentration in der Zellsuspension mit einem Hämozytometer zu bestimmen. Verdünnen Sie die Zellsuspension mit frischem Medium auf eine vorgeschriebene Zellkonzentration, die für die Zellstudie in vitro benötigt wird.
HINWEIS: Die Seeding-Dichte von Zellen wird durch das experimentelle Design bestimmt. Zum Beispiel wurden Zelldichten von 2.000-40.000 Zellen/cm2 in verschiedenen Zellstudien mit biologisch abbaubaren Materialien verwendet. - Platzieren Sie die Proben (Mg-Platte) in der Mitte der 12 gut behandelten Gewebekulturplatten. Spülen Sie die Kulturplatten nacheinander mit 2 ml PBS und 2 ml DMEM ab, um den osmotischen Druck unter sterilen Bedingungen zu kalibrieren. Fügen Sie 3 ml der verdünnten Zellsuspension in jede Vertiefung auf die interessierenden Proben hinzu.
- Kultur der Zellen in einem Inkubator unter Standard-Zellkulturbedingungen für 24 h.
HINWEIS: Die Kulturzeit kann je nach Versuchsplan länger oder kürzer als 24 h sein.
- Direkte Expositionskulturen
HINWEIS: Das schematische Diagramm in Abbildung 2B zeigt die Schritte der direkten Belichtungskultur.- Wie in den Schritten 3.1.1 und 3.1.2 beschrieben, wird die Zellsuspension mit den erforderlichen Zellkonzentrationen auf der Grundlage des Versuchsdesigns für verschiedene Zelltypen und beabsichtigte Anwendungen hergestellt.
- Spülen Sie die Kulturplatten nacheinander mit 2 ml PBS und 2 ml DMEM ab, um den osmotischen Druck unter sterilen Bedingungen zu kalibrieren. Fügen Sie 3 ml der verdünnten Zellsuspension in jede Vertiefung hinzu. Kultivieren Sie die Zellen im befeuchteten Inkubator unter Standard-Zellkulturbedingungen für 24 h oder bis die Zellen einen 50-80% igen Zusammenfluss erreichen.
HINWEIS: Der Zellzusammenflusspegel kann für verschiedene Zelltypen und experimentelles Design variieren. - Nach 24 h spülen Sie die Zellen in der Bohrlochplatte mit PBS mit einer Pipette ab, um schwimmende tote Zellen zu entfernen.
- Legen Sie die desinfizierten oder sterilisierten Proben direkt auf die anhaftenden Zellen. Fügen Sie 3 ml frisches Medium in jede Vertiefung hinzu.
- Kultivieren Sie die Zellen unter Standard-Zellkulturbedingungen für weitere 24 h.
HINWEIS: Die Kulturzeit kann je nach Versuchsplan länger oder kürzer als 24 h sein.
- Expositionskulturen
HINWEIS: Das schematische Diagramm in Abbildung 2C zeigt die Schritte der Belichtungskulturmethode.- Die ersten Schritte für die Zellpräparation sind die gleichen wie bei der Expositionskultur. Wie in den Schritten 3.1.1 und 3.1.2 beschrieben, bereiten Sie die Zellsuspension mit den gewünschten Zellen vor. Ähnlich wie bei den Schritten 3.2.1 und 3.2.2 werden die Zellen in der Bohrlochplatte in der gewünschten Dichte ausgesät und in einem Inkubator unter Standard-Zellkulturbedingungen für 24 h kultiviert.
- Nach 24 h spülen Sie die adhärenten Zellen mit PBS ab, um schwimmende tote Zellen zu entfernen, gefolgt von der Zugabe von 3 ml frischem Medium in jedes Well.
- Anschließend legen Sie die Proben in die Vertiefungseinsätze mit einer Membranporengröße von 0,4 μm und legen die Vertiefungseinsätze mit den Proben in jede Vertiefung mit den Zellen.
- Kultivieren Sie die Zellen unter Standard-Zellkulturbedingungen für weitere 24 h.
HINWEIS: Die Kulturzeit kann je nach Versuchsplan länger oder kürzer als 24 h sein.
4. Postkulturelle Charakterisierung von Zellen
HINWEIS: Für direkte Kultur und direkte Belichtungskultur fixieren, färben, bebildern und analysieren Sie die Zellen, die sowohl auf Bohrlochplatten als auch auf Proben haften. Für die Expositionskultur analysieren Sie die Zellen, die an den Well-Plates haften.
- Zellfixierung
- Sammeln Sie das Postkulturmedium aus jedem Bohrloch in ein entsprechendes 15 ml konisches Röhrchen zur weiteren Analyse. Sammeln Sie alle Proben nach der Kultur zur weiteren Analyse.
- Spülen Sie die Zellen, die sowohl an Proben als auch an den Brunnenplatten haften, 3 Mal mit PBS aus.
- Fügen Sie 1 ml 4% Paraformaldehyd (PFA, 10% neutrales gepuffertes Formalin) in jede Vertiefungsplatte hinzu. Setzen Sie den Deckel wieder auf die Bohrlochplatte und lassen Sie die PFA 20 min lang reagieren.
- Nach 20 Minuten die PFA absaugen und in eine Abfallflasche geben. Spülen Sie die Bohrlochplatte 3 Mal mit PBS ab, um die PFA zu entfernen, und geben Sie den Abfall in die Abfallflasche.
- Zellfärbung
- Bereiten Sie die Arbeitsbestände der Färbemittel nach den Anweisungen des Herstellers vor.
HINWEIS: Zum Beispiel wird Alexa Fluor 488 Phalloidin verwendet, um F-Aktin zu färben, und 4 ', 6-Diamidino-2-phenylindol (DAPI) wird verwendet, um Zellkerne zu färben. Die Färbezeit kann sich verkürzen, wenn die Proben in den Färbelösungen schnell abgebaut werden. - Fügen Sie 200-400 μL verdünntes Alexa Fluor 488 Phalloidin-Färbemittel zu jeder Vertiefung hinzu, um die Zellen auf der Bohrlochplatte und die Probe abzudecken. Wickeln Sie die Vertiefungsplatte in Aluminiumfolie, um Lichteinwirkung zu vermeiden, und lassen Sie die Alexa Fluor 488 Phalloidin 20 Minuten bei Raumtemperatur reagieren.
- Sammeln Sie das Alexa Fluor 488 Phalloidin Färbemittel und geben Sie es in die entsprechende Abfallflasche. Spülen Sie die Bohrlochplatte 3 Mal mit PBS ab, um das überschüssige Alexa Fluor 488 Phalloidin zu entfernen, und geben Sie das verbrauchte PBS in die entsprechende Abfallflasche ab.
- Fügen Sie 200-400 μL verdünntes DAPI zu jeder Vertiefung hinzu, um die Zellen in der Vertiefung und auf der Probe abzudecken. Wickeln Sie die Bohrlochplatte in Aluminiumfolie und lassen Sie den DAPI 5 min bei Raumtemperatur reagieren.
- Sammeln Sie den DAPI und geben Sie ihn in die entsprechende Abfallflasche ab. Spülen Sie die Bohrlochplatte 3 Mal mit PBS ab, um den DAPI zu entfernen, und geben Sie das verwendete PBS in die entsprechende Abfallflasche ab.
- Bereiten Sie die Arbeitsbestände der Färbemittel nach den Anweisungen des Herstellers vor.
- Zellbildgebung
- Nach der Färbung stellen Sie die Zellen mit einem Fluoreszenzmikroskop ab. Nehmen Sie, wann immer möglich, zusätzlich zu Fluoreszenzbildern Phasenkontrastbilder von Zellen auf. Stellen Sie die Zellen auf den biologisch abbaubaren Proben so schnell wie möglich oder unmittelbar nach der Färbung ab, um mögliche Veränderungen, die durch den kontinuierlichen Abbau von Proben verursacht werden, zu vermeiden oder zu reduzieren. Lagern Sie die Zellen in den Vertiefungsplatten in einer Pufferlösung bei 2-8 °C nach der Fixierung und bilden Sie die Zellen so schnell wie möglich nach der Färbung ab, um den Verlust von Fluoreszenzsignalen zu vermeiden.
- Für die direkte Kultur und die direkte Belichtungskultur können Sie zwei Arten von Zellen abbilden und bewerten: (1) die Zellen auf den Proben (in direktem Kontakt mit den Proben) und (2) die Zellen, die an der Wellplatte haften, die die Proben umgibt (indirekter Kontakt mit den Proben), wie in Abbildung 3A gezeigt.
- Verwenden Sie für die Belichtungskultur, wie in Abbildung 3B gezeigt, eine Bildführung, wenn Sie die Fluoreszenzbilder von Zellen aufnehmen, um festzustellen, ob die Zellantwort als Reaktion auf den dynamischen Abbaugradienten der Proben unterschiedlich wäre. Bilden Sie die Zellen im Bereich innerhalb des inneren Rings (3,5 mm von der Mitte entfernt) und des äußeren Rings (7 mm von der Mitte entfernt) getrennt ab und analysieren Sie sie.
HINWEIS: Die Bildführung wird verwendet, um den Abstand zwischen den Zellen und Proben zu definieren. - Nehmen Sie für jede Probe und den Brunnen in den Kulturplatten nach dem Zufallsprinzip mindestens fünf Bilder aus jedem Bereich von Interesse auf, in dem die Zellen entweder in direktem Kontakt oder indirektem Kontakt mit den Proben in einer vordefinierten Entfernung stehen.
- Bildanalyse
- Für alle Zellbilder, die aus Schritt 4.3 erhalten wurden, quantifizieren Sie die Zellmorphologie, indem Sie die Zellausbreitungsfläche und das Seitenverhältnis mit einer Software wie ImageJ für die Bildanalyse messen.
- Zählen Sie die Anzahl der Zellen in jedem Bildbereich. Berechnen Sie die Zelladhäsionsdichte unter direkten und indirekten Kontaktbedingungen als Anzahl der Zellen pro Flächeneinheit.
5. Postkulturelle Analysen von Medien und Proben
- Messen Sie den pH-Wert des Postkulturmediums.
HINWEIS: Einige Proben verändern den pH-Wert des Mediums während ihres Abbaus. Beispielsweise erhöhen biologisch abbaubare Metalle wie Magnesiumlegierungen aufgrund ihres Abbaus in der Regel den pH-Wert des Mediums31. Im Gegensatz dazu senken biologisch abbaubare Polymere wie PLGA oft den pH-Wert des Mediums, wenn sie abgebaut werden32. Die Messung des pH-Wertes von Postkulturmedium kann auf den Abbau dieser Proben in vitro hinweisen.- Vor der Zellfixierung das Postkulturmedium wie in Schritt 4.1.1 einsammeln.
- Messen Sie die pH-Werte des Postkulturmediums in jedem Vertiefungsraum unmittelbar nach der Entnahme mit einem vorkalibrierten pH-Messgerät.
HINWEIS: Der pH-Wert der Medien kann im Laufe der Zeit aufgrund von Umgebungsbedingungen wie CO2-Gehalt und Temperatur driften, die berücksichtigt werden sollten.
- Analysieren Sie die Mediumzusammensetzungen auf das Abbauverhalten biologisch abbaubarer Proben. Für einige Proben, die eine Farbänderung des Mediums verursachen, messen Sie den optischen Dichtewert (O.D.) des Postkulturmediums mit einem Spektralphotometer oder einem Mikroplattenleser, um das Abbauverhalten zu bestimmen. Alternativ können Sie die UV-sichtbare Spektroskopie (UV-VIS) und die Fourier-Transformations-Infrarotspektroskopie-abgeschwächte Totalreflexion (FTIR-ATR) verwenden, um die Abbauprodukte im Postkulturmedium zu analysieren.
HINWEIS: Die Messung der Abbauprodukte im Postkulturmedium ist wertvoll, um das Abbauverhalten der Proben zu verstehen. Einer der gebräuchlichsten Ansätze ist die Messung der interessierenden Ionen im Postkulturmedium mit einem induktiv gekoppelten plasma-optischen Emissionsspektrometer (ICP-OES). Das ICP-OES kann verwendet werden, um die Zusammensetzungen von Postkulturmedien aus Metallen und Keramiken zu messen, ist jedoch möglicherweise nicht für Polymere geeignet. Polymere bestehen normalerweise aus Kohlenstoff, Wasserstoff und Sauerstoff, und eine genaue Quantifizierung dieser Elemente ist für ICP-OES schwierig.- Nach Schritt 5.1.2 für die pH-Messung wird das Medium mit einem wünschenswerten Verdünnungsfaktor gesammelt und verdünnt, um die Ionenkonzentrationen optimal zu messen.
- Messen Sie die Konzentrationen der interessierenden Ionen im Postkulturmedium mit einem ICP-OES.
- Postkulturanalyse von Proben
HINWEIS: Nach einer In-vitro-Zellstudie können sich die biologisch abbaubaren Proben in Dimension, Masse, Oberflächenmorphologie, Mikrostruktur und Zusammensetzung ändern. Die Postkulturanalyse von Proben hilft, den Abbaumechanismus von Proben zu verstehen.- Machen Sie nach der Zellkultur die Fotos der Proben, um mögliche Veränderungen der Probendimension, Farbe, Morphologie und anderer sichtbarer Merkmale zu zeigen.
- Trocknen oder dehydrieren Sie die Postkulturproben und messen Sie die Probenmasse, -dimension und -volumen, um Änderungen der Masse, der Dimension und des Volumens zu quantifizieren.
- Verwenden Sie ein Rasterelektronenmikroskop (REM), um die Mikrostruktur und Morphologie der Proben zu charakterisieren. Verwenden Sie energiedispersive Röntgenspektroskopie (EDX) und Röntgenbeugung (XRD), um die Zusammensetzung und Phase der Abbauprodukte auf den Proben zu charakterisieren. Verwenden Sie FTIR-ATR, um die chemische Bindung auf den Probenoberflächen nachzuweisen.
Ergebnisse
Abbildung 4 zeigt die repräsentativen Fluoreszenzbilder von BMSCs unter direkten und indirekten Kontaktbedingungen unter Verwendung verschiedener Kulturmethoden. Abbildung 4A,B zeigt die BMSCs unter direkten und indirekten Kontaktbedingungen nach der gleichen 24 h direkten Kultur mit ZC21-Magnesiumlegierungen1. Die ZC21-Legierungen bestehen aus 97,5 Gew.-% Magnesium, 2 Gew.-% Zink und 0,5 Gew.-% Calcium. Die Zellen, die keinen direkten Kontakt mit den Proben der ZC21-Legierung haben, verteilen sich besser als diejenigen, die direkten Kontakt mit den Proben haben. Wie in Abbildung 4C,D gezeigt, zeigen die Zellen unter direkten und indirekten Kontaktbedingungen alle eine normale Morphologie nach einer 24-stündigen direkten Exposition mit Hyaluronsäure (HyA)-Hydrogelen, die mit Fe3+-Ionen vernetzt sind. Die Anzahl der Zellen unter der indirekten Kontaktbedingung ist jedoch geringer als die unter der Direktkontaktbedingung33. Eine weitere Studie berichtete über die Auswirkungen des Abbaus von ZSr41-Legierungen (ф = 1,1 mm) auf BMSCs nach einer 24-stündigen Expositionskultur19. Die ZSr41-Legierungen bestehen aus 95 Gew.-% Magnesium, 4 Gew.-% Zink und 1 Gew.-% Strontium. Abbildung 4E zeigt die repräsentativen Fluoreszenzbilder von BMSCs, die an der Kulturvertiefung haften, an einer Stelle, die 3,5 mm vom Bohrlochzentrum entfernt ist, nach einer 24-Stunden-Belichtungskultur mit den biologisch abbaubaren Stiften19.
Abbildung 5 zeigt die Beispieldaten für die quantifizierte Zelladhäsionsdichte. Wie in Abbildung 5A gezeigt, weisen in der 24-stündigen direkten Expositionskultur (24h_DE) BMSCs in direktem Kontakt mit dem ZC21 eine signifikant höhere Zelladhäsionsdichte auf als jede andere Gruppe. In der 24-h-Direktkultur (24h_D) zeigen BMSCs in direktem Kontakt mit dem ZC21 eine signifikant höhere Zelladhäsionsdichte als die Mg-Gruppe, signifikant niedriger als die Glasreferenzgruppe, aber keinen statistischen Unterschied zur Ti-Legierung (T64) -Kontrolle. Wie in Abbildung 5B gezeigt, ist die BMSC-Adhäsionsdichte im indirekten Kontaktzustand der direkten Expositionskultur für die ZC21-Gruppe signifikant höher als für die Mg-Gruppe. Es zeigt jedoch keinen signifikanten Unterschied im Vergleich zu den Kontrollgruppen T64 und reine Zellen. Im indirekten Kontaktzustand der direkten Kultur ist die BMSC-Adhäsionsdichte für die ZC21-Gruppe signifikant höher als für die Mg-Gruppe, zeigt jedoch keinen signifikanten Unterschied im Vergleich zu den Kontrollgruppen T64 und reinen Zellen1.
Abbildung 6A zeigt den pH-Wert des Postkulturmediums nach der direkten Expositionskultur und der direkten Kultur. Für die direkte Expositionskultur liegen die pH-Werte von mittel zwischen 8,3 und 8,4 für alle Proben. In der direkten Kultur reichen die pH-Werte von mittel von 7,9 bis 8 über die Gruppen hinweg. Abbildung 9B zeigt die Mg2+-Ionenkonzentration im Postkulturmedium. Sowohl in der direkten Expositionskultur als auch in der direkten Kultur sind die Mg2+-Ionenkonzentrationen in der ZC21- und der Mg-Gruppe signifikant höher als in jeder anderen Kontrollgruppe1. Abbildung 7 zeigt die XRD-Muster für ZSr41 und reines Mg nach einer 3-tägigen Expositionskultur. In Abbildung 7A befinden sich die kristallinen Phasen von Mg, Ca(OH)2, ZnO, MgO∙H2O, Ca(HPO4)(H2O)2 und Ca5(PO4)3(OH) (d. h. Hydroxylapatit oder HA), Mg17Sr2 auf der Oberfläche von ZSr41. In Abbildung 7B befinden sich die kristallinen Phasen von Mg, Ca(OH)2, Mg3(PO4)2, Mg7(PO4)2(OH)8, Ca2P2O7∙5H2O auf der Oberfläche von reinem Mg19. Abbildung 8A zeigt die Überlagerung von REM-Bildern und EDX-Karten der Oberflächenelementzusammensetzung für MgO-beschichtetes Mg und die Kontrolle von Mg-Substraten und Glas nach 24 h direkter Kultur mit BMSCs. Abbildung 8B zeigt die quantitative Oberflächenelementzusammensetzung der Probenoberflächen und zeigt verschiedene Ablagerungen, die während der Zellkultur gebildet wurden34.

Abbildung 1: Schematische Darstellung, die die Schritte zur Ernte von BMSCs aus Rattenentwöhnungen zeigt. Diese Zahl wurde von 35 geändert. Abkürzung: BMSCs = bone marrow-derived mesenchymal stem cells. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Schematische Darstellung der drei Zellkulturmethoden . (A) direkte Kultur, (B) direkte Expositionskultur und (C) Expositionskultur. Diese Zahl wurde von 36 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Schematische Diagramme, die die direkte Kultur und die direkte Expositionskultur zeigen. (A) Zellen unter direktem Kontakt und indirektem Kontakt in direkter Kultur und direkter Expositionskultur. (B) Verwendung eines bildgebenden Leitfadens zur Aufnahme von Bildern der Zellen, die in verschiedenen Abständen vom Zentrum der Proben in der Belichtungskultur an der Vertiefungsplatte haften. Abbildung 3B wurde von 37 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Repräsentative Fluoreszenzbilder von BMSCs. (A, B) Direkte und indirekte Kontaktbedingungen nach einer 24 h direkten Kultur mit ZC21-Legierungen. (C, D) Direkte Expositionskultur mit HyA-Hydrogelen. (E) Auf der Kulturplatte nach einer 24 h Belichtungskultur mit ZSr41-Legierungen. Maßstabsstäbe = 100 μm. A und B werden von 1 reproduziert; C und D werden aus 33 reproduziert; und E wird von 19 reproduziert. Abkürzungen: BMSCs = Knochenmark-abgeleitete mesenchymale Stammzellen; HyA = Hyaluronsäure. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Quantitative Ergebnisse für die Zelladhäsionsdichte von BMSCs. (A) Direkter Kontakt und (B) indirekte Kontaktbedingungen nach der 24-Stunden-Direktexpositionskultur (24 h_DE) und der direkten Kultur (24 h_D). Diese Abbildung ist von 1 wiedergegeben. Abkürzungen: BMSCs = Knochenmark-abgeleitete mesenchymale Stammzellen; DE = Direct Exposure Culture; D = direkte Kultur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
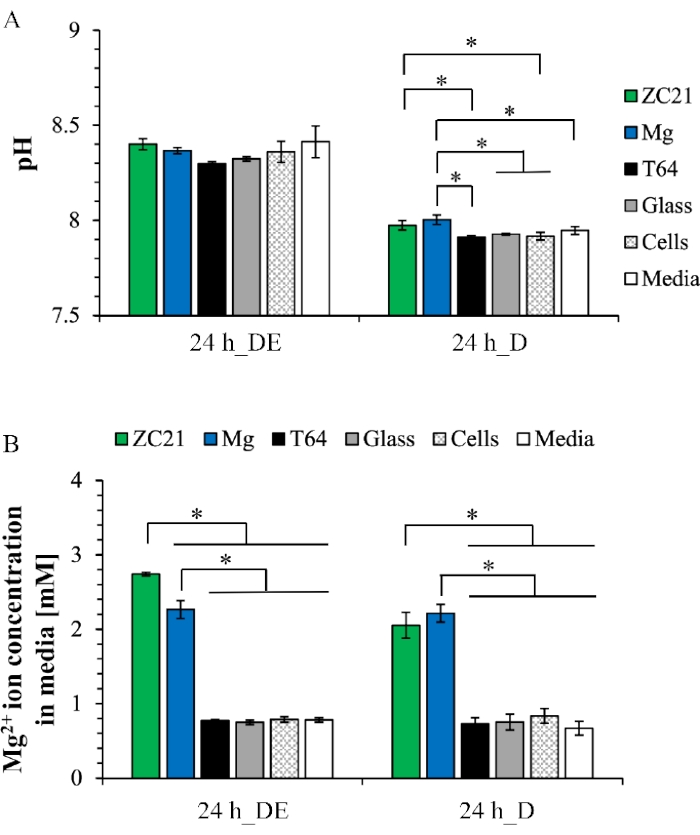
Abbildung 6: Repräsentative Ergebnisse für postkulturelle Analysen des Mediums nach der 24 h direkten Expositionskultur und der direkten Kultur . (A) pH-Werte und (B) Mg2+ Ionenkonzentrationen. Diese Abbildung ist von 1 wiedergegeben. Abkürzungen: DE = direct exposure culture; D = direkte Kultur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Repräsentative Postkulturergebnisse für Phasenanalysen biologisch abbaubarer metallischer Proben nach 3 Tagen Kultur mit BMSCs . (A) Röntgenbeugungsspektrum für ZSr41. (B) XRD-Spektrum für reines Mg. Diese Zahl ist von 19 reproduziert. Abkürzungen: BMSCs = Knochenmark-abgeleitete mesenchymale Stammzellen; XRD = Röntgenbeugung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 8: Repräsentative Postkulturergebnisse für Oberflächenanalysen von Proben nach 24 h direkter Kultur mit BMSCs, einschließlich Oberflächenmikrostruktur, Morphologie und Zusammensetzung . (A) Überlagerung von REM-Bildern und EDX-Karten der Oberflächenelementzusammensetzung für MgO-beschichtetes Mg., unbeschichtete Mg-Kontrolle und Glasreferenz. (B) Zusammensetzung der Oberflächenelemente (zu %) quantifiziert aus EDX-Analysen. Maßstabsstäbe = 200 μm. Nachdruck von 34. Abkürzungen: BMSCs = Knochenmark-abgeleitete mesenchymale Stammzellen; SEM = Rasterelektronenmikroskopie; EDX = energiedispersive Röntgenspektroskopie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Tabelle 1: Abbaumechanismen, Produkte und Raten für verschiedene Arten von Materialien und die für die postkulturelle Stichproben- und Medienanalyse gesammelten Ergebnisse. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Verschiedene Zellkulturmethoden können verwendet werden, um die In-vitro-Zytokompatibilität von Biomaterialien zu bewerten, die für verschiedene Aspekte von Anwendungen in vivo von Interesse sind. Dieser Artikel demonstriert drei In-vitro-Kulturmethoden, d.h. direkte Kultur, direkte Expositionskultur und Expositionskultur, um verschiedene In-vivo-Szenarien nachzuahmen, in denen biologisch abbaubare Implantatmaterialien im menschlichen Körper verwendet werden. Die direkte Kulturmethode wird hauptsächlich verwendet, um das Verhalten neu ausgesäter Zellen zu bewerten, die direkt an und um die Implantatmaterialien herum haften. Die direkte Expositionskulturmethode ahmt das In-vivo-Szenario nach, bei dem die Implantatmaterialien in direkten Kontakt mit den etablierten Zellen und Geweben kommen. Mit der Expositionskulturmethode kann gezeigt werden, wie sich die Abbauprodukte aus den Implantatmaterialien und die Veränderungen in der lokalen Mikroumgebung auf die etablierten Zellen und Gewebe auswirken können, die nicht direkt mit den Implantatmaterialien in Kontakt kommen.
In der direkten Kultur werden die neu ausgesäten Zellen sowohl unter direkten als auch unter indirekten Kontaktbedingungen bewertet. In der direkten Expositionskultur können etablierte Zellen sowohl unter direkten als auch unter indirekten Kontaktbedingungen bewertet werden. In der Expositionskultur können nur etablierte Zellen unter indirekten Kontaktbedingungen ausgewertet werden. Die neu ausgesäten Zellen werden unter direkten Kontaktbedingungen in der direkten Kultur durch Materialeigenschaften und materialinduzierte Veränderungen im Medium wie die Änderungen der Ionenkonzentration und des pH-Wertes beeinflusst.
Die oben genannten Materialeigenschaften können Oberflächenmorphologie, Hydrophilie, freie Oberflächenenergie, Steifigkeit und Zusammensetzung umfassen. Die neu ausgesäten Zellen unter indirekten Kontaktbedingungen in der direkten Kulturmethode und alle etablierten Zellen in der direkten Expositionskultur und den Expositionskulturmethoden sind hauptsächlich von materialinduzierten Veränderungen im Medium betroffen. Die drei verschiedenen Methoden, die in diesem Artikel beschrieben werden, sind dem praktischen Szenario der In-vivo-Umgebung näher als herkömmliche Methoden wie die Medium-Extract-Methode. Die Medium-Extrakt-Methode bewertet nur die Zytotoxizität der Abbauprodukte des Materials und spiegelt nicht den dynamischen Prozess des Probenabbaus wider. Bei den in diesem Artikel beschriebenen Kulturmethoden, wenn die Zellen mit den Implantatmaterialien kultiviert werden, kann die dynamische Veränderung der biologisch abbaubaren Materialien und der mittleren Umgebung die Zellen in situ beeinflussen.
Obwohl keine In-vitro-Studien In-vivo-Studien vollständig ersetzen können, sind In-vitro-Studien komplementär und können wertvolle Daten auf kostengünstige und effiziente Weise liefern. In-vivo-Studien umfassen in der Regel alle multiplen Variablen in einem Modell, während in vitro-Zellkulturen die Auswirkungen eines einzelnen Faktors auf Zell-Material-Interaktionen untersucht werden können. Die in diesem Artikel vorgestellten Methoden können verschiedene Szenarien der relevanten In-vivo-Studien nachahmen. Wir können die Verbindungen zwischen verschiedenen Variablen herstellen, um Ergänzungen für In-vivo-Studien bereitzustellen. Ein In-vivo-Modell enthält normalerweise nur das gleiche Gewebe bei einem Tiertyp. In-vitro-Studien können jedoch verschiedene Zelltypen in einer Kultur einschließen, wodurch die kombinierten Effekte verschiedener Variablen auf Zell-Material-Interaktionen untersucht werden können. Darüber hinaus ist es relativ schwierig, die Auswirkungen dynamischer Umweltveränderungen auf Zell-Material-Interaktionen in In-vivo-Modellen zu untersuchen. Die in diesem Artikel beschriebenen Methoden können die Auswirkungen dynamischer Veränderungen wie Ionenkonzentrationen im Medium auf das Zellverhalten untersuchen38.
Die in diesem Artikel vorgestellten Methoden sind anwendbar, um die In-vitro-Zytokompatibilität aller Arten von Materialien, einschließlich Polymeren, Metallen, Keramiken, Verbundwerkstoffen und Nanopartikeln, zu verstehen und ihre Wechselwirkungen mit verschiedenen Zellen, Bakterien oder Pilzen basierend auf den beabsichtigten Anwendungen zu bestimmen. Beispielsweise bewerteten Xu et al. die in vitro Zytokompatibilität von HyA-basierten Hydrogelen mit BMSCs über die direkte Expositionskulturmethode33. Zelladhäsionsdichten und Zellmorphologien wurden unter direkten und indirekten Kontaktbedingungen analysiert. Die Zytotoxizität von HyA-basierten Hydrogelkompositen könnte mit den Konzentrationen von Fe3+- und H+ -Ionen zusammenhängen, die während des Zellkulturexperiments aus den vernetzten HyA-Hydrogelen freigesetzt wurden. Tian et al. kultivierten menschliche Urothelzellen (HUCs) mit vier verschiedenen Mg-Legierungen für 24 h und 48 h unter Verwendung der Expositionskulturmethode und ihrer unlöslichen Abbauprodukte von MgO und Mg(OH)2 für 24 h unter Verwendung einer direkten Expositionskultur zur Untersuchung der Zytokompatibilität und des Abbauverhaltens von Mg-Legierungen, die Zink (Zn) und Strontium (Sr) für eine potenzielle Harnleiterstentanwendung enthalten39 . In dieser Studie wurde festgestellt, dass ZSr41_B mit 4 Gew.-% Zn und 0,5 Gew.-% Sr eine bessere Zytokompatibilität mit HUCs unter allen anderen Mg-4Zn-xSr-Legierungen sowohl in 24-h- als auch in 48-h-Expositionskulturen aufweisen. Die Ergebnisse zeigten auch, dass keine sichtbaren adhärenten Zellen auf der Vertiefungsplatte gefunden wurden, wenn die Konzentrationen von Magnesiumoxid (MgO) und Magnesiumhydroxid (Mg(OH)2) nach 24 h direkter Expositionskultur 1,0 mg/ml überstiegen. Daher kamen Tian et al. zu dem Schluss, dass eine Verringerung der Abbauraten von Mg-Legierungen notwendig ist, um die möglichen Nebenwirkungen für die zukünftige klinische Translation zu kontrollieren. Wetteland et al. schufen einen polymerbasierten Nanokomposit, indem sie Hydroxylapatit (nHA) und nMgO-Nanopartikel in einem biologisch abbaubaren PLGA-Polymer dispergierten40. Dieses Nanokomposit wurde untersucht, indem BMSCs mit verschiedenen Proben unter Verwendung der direkten Kulturmethode kultiviert wurden. Die Ergebnisse zeigten, dass eine verbesserte Dispersion von Nanopartikeln im Polymer die BMSC-Adhäsion auf nHA/PLGA verbessern, aber die Zelllebensfähigkeit auf nMgO/PLGA verringern könnte. Basierend auf den Ergebnissen von In-vitro-Zellstudien berichteten Wetteland et al. über wertvolle Erkenntnisse für die Entwicklung optimaler Keramik/Polymer-Nanokomposite für verschiedene biomedizinische Anwendungen.
Zellmorphologien und Zellzahlen können in Fluoreszenzbildern mit Hilfe von Software zur quantitativen Bildanalyse wie ImageJ beobachtet und quantifiziert werden. Wir können die Auswirkungen verschiedener Materialien auf die Zelladhäsion und -morphologie untersuchen, indem wir die Zelladhäsionsdichten, Zellaspektverhältnisse und Zellausbreitungsbereiche für verschiedene Probengruppen quantifizieren. Die Morphologie der Zellen aus der Blanko-Kontrollgruppe, bei der nur die Zellen in Medium kultiviert werden, könnte als Referenzmaßstab dienen, ohne dass Probenmaterialien beeinflusst werden. Wir können feststellen, ob die Probenmaterialien die Zelladhäsion und -morphologie in vitro beeinflussen würden, indem wir die Zelladhäsionsdichten und Zellmorphologien der Probengruppen mit denen der Blindkontrolle vergleichen. Der Zellausbreitungsbereich zeigt die Präferenz der Zelladhäsion an der Probenoberfläche und zeigt, wie die Zellen mit den Probenmaterialien interagieren. In diesem Artikel haben wir die Reaktionszeit für die DAPI-Färbung auf weniger als die vom Hersteller empfohlene optimale Zeit reduziert, da biologisch abbaubare Proben, wie reines Magnesium, in wässrigen Lösungen schnell abgebaut werden. Die Morphologie der Zellen, die an den biologisch abbaubaren Materialien haften, kann sich ändern, wenn der Färbeprozess zu lange dauert und die Wassereinwirkungszeit für die Proben zu lang ist. Darüber hinaus sollten für die Zellen, die an biologisch abbaubaren Materialien haften, sofort Zellbilder aufgenommen werden, um mögliche Veränderungen der Zelladhäsion und -morphologie aufgrund des Probenabbaus zu reduzieren.
Neben der Erfassung von Zellergebnissen sind Postkultur-Medium- und Probenanalysen wichtig, da sie wertvolle Daten für die Analyse des Abbaumechanismus, der Produkte und der Raten der Implantatmaterialien liefern. Zum Beispiel können biologisch abbaubare Polymere wie PLGA während der Zellkultur saure Abbaunebenprodukte wie monomere oder oligomere Hydroxyl-Carbonsäuren erzeugen32, die das Zellwachstum und die Zellproliferation beeinflussen können. Im Gegensatz dazu produzieren biologisch abbaubare Metalle wie Magnesium und seine Legierungen während ihres Abbaus Hydroxidionen und Wasserstoffgas31, was den lokalen pH-Wert signifikant erhöhen kann, und eine starke Alkalität kann nachteilige Auswirkungen auf lokale Zellfunktionen haben. Verschiedene biologisch abbaubare Keramiken können auch den pH-Wert des Mediums erhöhen41. Im Allgemeinen benötigen Zellen einen bestimmten pH-Bereich in Kulturmedium, um richtig zu funktionieren, und es ist bekannt, dass erhöhte oder erniedrigte pH-Werte in Körperflüssigkeiten lebensschädlich sind42. Die Messung des pH-Werts von Postkulturmedium ist wertvoll, um mögliche Schäden zu verstehen, die biologisch abbaubare Probenmaterialien in der Zellkultur verursachen können. Daher ist es notwendig, den pH-Wert des Postkulturmediums zu messen, um die möglichen Mechanismen zu verstehen, wie sich diese biologisch abbaubaren Materialien auf Zellen auswirken.
Es ist wichtig, die entscheidenden Ionenkonzentrationen im Postkulturmedium für biologisch abbaubare Materialien zu messen. Zum Beispiel maßen Cortez Alcaraz et al. die Mg2+- und Ca2+-Ionenkonzentrationen des Postkulturmediums, als sie mit Magnesiumoxid-Nanopartikeln beschichtete Magnesiumproben unter Verwendung von Direktkultur mit BMSCs34 untersuchten. Die Konzentrationen von Magnesiumionen weisen auf die Abbaueigenschaften verschiedener Proben in vitro während der Zellkultur hin, und die Konzentrationen von Calciumionen können Informationen über die Kalziumablagerung während der Zellproliferation liefern. Xu et al. maßen Fe3+-Ionenkonzentrationen des Postkulturmediums, als sie HyA-Hydrogele unter Verwendung einer direkten Expositionskultur mit BMSCs untersuchten. Sie verwendeten Fe3+-Ionen, um die Vernetzungsdichten von HyA33 anzupassen. Fe3 + -Ionen können den pH-Wert des Kulturmediums verringern, und hohe Konzentrationen von Fe3 + -Ionen können für die Zellen toxisch sein. Daher ist es wichtig, die Konzentrationen der interessierenden Ionen zu messen, um die Zytokompatibilität von biologisch abbaubaren Materialien und den damit verbundenen Abbauprodukten zu verbessern.
Wir können verschiedene Daten sammeln, um die Zell-Material-Wechselwirkungen für verschiedene Materialien zu analysieren. Zum Beispiel, wie in Ergänzender Tabelle 1 gezeigt, werden Mg-Legierungen durch Reaktion mit Wasser abgebaut, und die Abbauprodukte können Mg2 + - und OH-Ionen, H2-Gas und einige andere unlösliche Abbauprodukte wie Mg (OH) 2 umfassen. XRD, REM und EDX, die verwendet werden könnten, um die auf dem Material gebildete Mineralablagerung zu bestimmen. Wir können die Auswirkungen der Konzentration von Mg2 + -Ionen und pH-Werten in Medium auf das Zellverhalten untersuchen. Darüber hinaus können wir diese Ergebnisse verwenden, um die Gasentwicklung während des Metallabbaus zu untersuchen. In-vitro-Studien haben berichtet, dass die kritische Toleranzschwelle von H2-Gas <0,01 ml / cm2 / Tag beträgt, und dies wurde häufig verwendet, um Magnesiumlegierungen für temporäre Implantatanwendungen zu screenen. Im Wesentlichen hängt die Menge der Gasentwicklung von der Abbaurate der Magnesiumlegierungen ab. In einem anderen Beispiel baut sich PLGA aufgrund der Hydrolyse seiner Esterbindungen in Gegenwart von Wasser ab. Die Abbauprodukte von Milchsäure und Glykolsäure sowie die pH-Werte im Medium konnten untersucht werden, um Zell-Material-Wechselwirkungen zu analysieren. Die in diesem Artikel beschriebenen Verfahren umfassen die Messung der freigesetzten Ionen und der pH-Werte in den Zellkulturmedien und die Massenänderung der Materialien, mit denen die Abbaurate der Materialien abgeschätzt werden kann.
Verschiedene Materialien verhalten sich in der Regel in vitro und in vivo unterschiedlich, und die Methoden für Zytokompatibilitätsstudien sollten basierend auf der Anwendungsumgebung und dem Materialtyp ausgewählt werden. Für orthopädische Anwendungen ist es wünschenswert, die Wechselwirkungen zwischen den relevanten Knochenzellen und Implantaten zu bewerten, wenn sie in direktem Kontakt miteinander stehen. Die direkte Kulturmethode könnte verwendet werden, um die Wechselwirkungen zwischen den neu ausgesäten Zellen und dem Implantat zu untersuchen. Da in kardiovaskulären Anwendungen die etablierten Zellen direkt oder indirekt mit den implantierten Stentmaterialien in Kontakt kommen, können direkte Expositionskultur- und Expositionskulturmethoden verwendet werden, um die Zytokompatibilität von biologisch abbaubaren Metallen für kardiovaskuläre Anwendungen zu bewerten. Wir glauben, dass die in diesem Artikel beschriebenen In-vitro-Methoden durchführbar sind, um erste Hinweise auf die Zytokompatibilität von biologisch abbaubaren Implantatmaterialien zu liefern. Die Kulturmethoden müssen für verschiedene Materialien mit unterschiedlichen Abbaumechanismen, Produkten und Raten modifiziert werden. Beispielsweise kann die Kultivierungszeit für verschiedene Materialien basierend auf unterschiedlichen Abbauraten verschiedener Materialtypen modifiziert werden. Basierend auf verschiedenen Abbaumechanismen und Produkten der Materialien können unterschiedliche Ergebnisse gesammelt werden.
Zusammenfassend ist es wichtig, die Zellen, das Medium und die Probenmaterialien vor und nach der In-vitro-Zellkultur qualitativ und quantitativ zu analysieren, um die Auswirkungen von biologisch abbaubaren Implantatmaterialien und ihren Abbauprodukten auf die Zytokompatibilität zu verstehen. Die drei in diesem Artikel vorgestellten Kulturmethoden können zur Untersuchung einer breiten Palette von biologisch abbaubaren Materialien verwendet werden, einschließlich biologisch abbaubarer Polymere, Keramiken und Metalle für medizinische Implantat- und Tissue-Engineering-Anwendungen. Diese In-vitro-Zellstudien sind wertvoll für das Screening biologisch abbaubarer Materialien, die Optimierung des Designs implantierbarer Geräte und Gerüste in der frühen Phase der Produktentwicklung und die Verringerung der potenziellen Toxizität für Zellen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Die Autoren schätzen die finanzielle Unterstützung der U.S. National Science Foundation (NSF CBET Award 1512764 und NSF PIRE 1545852), der National Institutes of Health (NIH NIDCR 1R03DE028631), der University of California (UC) Regents Faculty Development Fellowship und des Committee on Research Seed Grant (Huinan Liu) und des UC-Riverside Dissertation Research Grant (Jiajia Lin). Die Autoren schätzen die Central Facility for Advanced Microscopy and Microanalysis (CFAMM) an der UC-Riverside für den Einsatz von SEM/EDS und Dr. Perry Cheung für den Einsatz von XRD-Instrumenten. Die Autoren schätzen auch Thanh Vy Nguyen und Queenie Xu für die teilweise Bearbeitung. Die Autoren möchten sich auch bei Cindy Lee für die Aufnahme der Erzählung für das Video bedanken. Alle Meinungen, Erkenntnisse, Schlussfolgerungen oder Empfehlungen, die in diesem Artikel zum Ausdruck gebracht werden, sind die der Autoren und spiegeln nicht unbedingt die Ansichten der National Science Foundation oder der National Institutes of Health wider.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | VWR | 490019-704 | |
| 12-well tissue-culture-treated plates | Thermo Fisher Scientific | 353043 | |
| 15 mL conical tube (Polypropylene) | VWR | 89039-666 | |
| 18 G needle | BD | 305196 | |
| 25½ G needle | BD | 305122 | |
| 4′,6-diamidino-2- phenylindole dilactate (DAPI) | Invitrogen | D3571 | |
| 50 mL conical tube (Polypropylene) | VWR | 89039-658 | |
| 70 μm nylon strainer | Fisher Scientific | 50-105-0135 | |
| Alexa Flour 488-phalloidin | Life technologies | A12379 | |
| Biological safety cabinet | LABCONCO | Class II, Type A2 | |
| Centrifuge | Eppendorf | Rotor F-35-6-30, Centrifuge5430 | |
| Clear Fused Quartz Round Dish | AdValue Technology | FQ-4085 | |
| CO2 incubator | SANYO | MCO-19AIC | |
| CoolCell Freezer Container | Corning | 432000 | foam container designed to regulate temperature decrease |
| Cryovial | Thermo Fisher Scientific | 5000-1020 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Sigma-Aldrich | D5648 | |
| EDX analysis software | Oxford Instruments | AztecSynergy | |
| Energy dispersive X-ray spectroscopy (EDX) | FEI | 50mm2 X-Max50 SDD | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Inc. | SH30910 | |
| Fluorescence microscope | Nikon | Eclipse Ti | |
| Formaldehyde | VWR | 100496-496 | |
| Hemacytometer | Hausser Scientific | 3520 | |
| ImageJ software | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation (LOCI, University of Wisconsin) | ||
| Inductively coupled plasma optical emission spectrometry (ICP-OES) | PerkinElmer | Optima 8000 | |
| Optical microscope | VWR | VistaVision | |
| Penicillin/streptomycin (P/S) | Thermo Fisher Scientific, Inc., | 15070063 | |
| pH meter | VWR | model SB70P | |
| Phosphate Buffered Saline (PBS) | VWR | 97062-730 | |
| Scanning electronic microscope (SEM) | FEI | Nova NanoSEM 450 | |
| surgical blade | VWR | 76353-728 | |
| Tissue Culture Flasks | VWR | T-75, MSPP-90076 | |
| Transwell inserts | Corning | 3460 | |
| Trypsin-ethylenediaminetetraacetic acid solution (Trypsin-EDTA) | Sigma-Aldrich | T4049 | |
| X-ray diffraction instrument (XRD) | PANalytical | Empyrean Series 2 |
Referenzen
- Zhang, C., et al. Antimicrobial bioresorbable Mg-Zn-Ca alloy for bone repair in a comparison study with Mg-Zn-Sr Alloy and pure Mg. ACS Biomaterials Science & Engineering. 6 (1), 517-538 (2019).
- Xu, C., et al. A green biocompatible fabrication of highly porous functional ceramics with high strength and controllable pore structures. Journal of Materials Science & Technology. 32 (8), 729-732 (2016).
- Asgari, M., et al. Biodegradable metallic wires in dental and orthopedic applications: a review. Metals. 8 (4), 212(2018).
- Shi, Y., Liu, J., Yu, L., Zhong, L. Z., Jiang, H. B. β-TCP scaffold coated with PCL as biodegradable materials for dental applications. Ceramics International. 44 (13), 15086-15091 (2018).
- Wu, C. -C., et al. A self-reinforcing biodegradable implant made of poly (ɛ-caprolactone)/calcium phosphate ceramic composite for craniomaxillofacial fracture fixation. Journal of Cranio-Maxillofacial Surgery. 44 (9), 1333-1341 (2016).
- Jiang, W., et al. In vitro evaluation of MgSr and MgCaSr alloys via direct culture with bone marrow derived mesenchymal stem cells. Acta Biomaterialia. 72, 407-423 (2018).
- Zhang, C., et al. Magnesium-based biodegradable microelectrodes for neural recording. Materials Science and Engineering: C. 110, 110614(2020).
- Jia, B., et al. In vitro and in vivo studies of Zn-Mn biodegradable metals designed for orthopedic applications. Acta Biomaterialia. 108, 358-372 (2020).
- Yang, H., et al. Alloying design of biodegradable zinc as promising bone implants for load-bearing applications. Nature Communications. 11 (1), 1-16 (2020).
- Liu, H., et al. Injectable, biomechanically robust, biodegradable and osseointegrative bone cement for percutaneous kyphoplasty and vertebroplasty. International Orthopaedics. 42 (1), 125-132 (2018).
- Anjum, S., Arora, A., Alam, M., Gupta, B. Development of antimicrobial and scar preventive chitosan hydrogel wound dressings. International Journal of Pharmaceutics. 508 (1-2), 92-101 (2016).
- Barroca, N., et al. Electrically polarized PLLA nanofibers as neural tissue engineering scaffolds with improved neuritogenesis. Colloids and Surfaces B: Biointerfaces. 167, 93-103 (2018).
- Liu, Y., et al. Polydopamine-modified poly (l-lactic acid) nanofiber scaffolds immobilized with an osteogenic growth peptide for bone tissue regeneration. RSC Advances. 9 (21), 11722-11736 (2019).
- Liu, H., Webster, T. J. Enhanced biological and mechanical properties of well-dispersed nanophase ceramics in polymer composites: from 2D to 3D printed structures. Materials Science and Engineering: C. 31 (2), 77-89 (2011).
- Xu, C., et al. Bioinspired mechano-sensitive macroporous ceramic sponge for logical drug and cell delivery. Advanced Science. 4 (6), 1600410(2017).
- Xu, C., Bai, Y., Yang, H., Yang, L. Mechanically modulated, ultra-high precision logic delivery of molecules by bio-inspired macroporous ceramic sponge. MRS Advances. 2 (19-20), 1125-1130 (2017).
- Zhang, N., Xu, C., Azer, A., Liu, H. Dispersibility and characterization of polyvinyl alcohol-coated magnetic nanoparticles in poly (glycerol sebacate) for biomedical applications. Journal of Nanoparticle Research. 21 (12), 1-11 (2019).
- Kim, S. S., et al. A poly (lactide-co-glycolide)/hydroxyapatite composite scaffold with enhanced osteoconductivity. Journal of Biomedical Materials Research Part A. 80 (1), 206-215 (2007).
- Cipriano, A. F., et al. Degradation of bioresorbable Mg-4Zn-1Sr intramedullary pins and associated biological responses in vitro and in vivo. ACS Applied Materials & Interfaces. 9 (51), 44332-44355 (2017).
- Surmeneva, M. A., et al. Bone marrow derived mesenchymal stem cell response to the RF magnetron sputter deposited hydroxyapatite coating on AZ91 magnesium alloy. Materials Chemistry and Physics. 221, 89-98 (2019).
- Sheikh, Z., et al. Mechanisms of in vivo degradation and resorption of calcium phosphate based biomaterials. Materials. 8 (11), 7913-7925 (2015).
- Klein, C., Driessen, A., De Groot, K., Van den Hooff, A. Biodegradation behavior of various calcium phosphate materials in bone tissue. Journal of Biomedical Materials Research. 17 (5), 769-784 (1983).
- Lanao, R. P. F., Leeuwenburgh, S. C., Wolke, J. G., Jansen, J. A. Bone response to fast-degrading, injectable calcium phosphate cements containing PLGA microparticles. Biomaterials. 32 (34), 8839-8847 (2011).
- Vey, E., et al. Degradation kinetics of poly (lactic-co-glycolic) acid block copolymer cast films in phosphate buffer solution as revealed by infrared and Raman spectroscopies. Polymer Degradation and Stability. 96 (10), 1882-1889 (2011).
- Standard, I. Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity. Geneve, Switzerland: International Organization for Standardization. , (2009).
- Liu, X., Zhou, W., Wu, Y., Cheng, Y., Zheng, Y. Effect of sterilization process on surface characteristics and biocompatibility of pure Mg and MgCa alloys. Materials Science and Engineering: C. 33 (7), 4144-4154 (2013).
- Liu, H., Yazici, H., Ergun, C., Webster, T. J., Bermek, H. An in vitro evaluation of the Ca/P ratio for the cytocompatibility of nano-to-micron particulate calcium phosphates for bone regeneration. Acta Biomaterialia. 4 (5), 1472-1479 (2008).
- Liu, H., et al. Enhancing effects of radiopaque agent BaSO4 on mechanical and biocompatibility properties of injectable calcium phosphate composite cement. Materials Science and Engineering: C. 116, 110904(2020).
- Xu, C., et al. A versatile three-dimensional foam fabrication strategy for soft and hard tissue engineering. Biomedical Materials. 13 (2), 025018(2018).
- Speranza, V., Sorrentino, A., De Santis, F., Pantani, R. Characterization of the polycaprolactone melt crystallization: complementary optical microscopy, DSC, and AFM studies. The Scientific World Journal. , 720157(2014).
- Cipriano, A. F., et al. Anodization of magnesium for biomedical applications-Processing, characterization, degradation and cytocompatibility. Acta Biomaterialia. 62, 397-417 (2017).
- Li, H., Chang, J. pH-compensation effect of bioactive inorganic fillers on the degradation of PLGA. Composites science and technology. 65 (14), 2226-2232 (2005).
- Xu, C., Hung, C., Cao, Y., Liu, H. H. Tunable crosslinking, reversible phase transition, and 3D printing of hyaluronic acid hydrogels via dynamic coordination of innate carboxyl groups and metallic ions. ACS Applied Bio Materials. 4 (3), 2408-2428 (2021).
- Cortez Alcaraz, M. C., et al. Electrophoretic deposition of magnesium oxide nanoparticles on magnesium: processing parameters, microstructures, degradation, and cytocompatibility. ACS Applied Bio Materials. 2 (12), 5634-5652 (2019).
- Rutherford, D., et al. Synthesis, characterization, and cytocompatibility of yttria stabilized zirconia nanopowders for creating a window to the brain. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 108 (3), 925-938 (2020).
- Tian, Q., Deo, M., Rivera-Castaneda, L., Liu, H. Cytocompatibility of magnesium alloys with human urothelial cells: a comparison of three culture methodologies. ACS Biomaterials Science & Engineering. 2 (9), 1559-1571 (2016).
- Nguyen, T., Cipriano, A., Guan, R. G., Zhao, Z. Y., Liu, H. In vitro interactions of blood, platelet, and fibroblast with biodegradable magnesium-zinc-strontium alloys. Journal of Biomedical Materials Research Part A. 103 (9), 2974-2986 (2015).
- Jiang, W., Lin, J., Chen, A. H., Pan, J., Liu, H. A portable device for studying the effects of fluid flow on degradation properties of biomaterials inside cell incubators. Regenerative Biomaterials. 6 (1), 39-48 (2019).
- Tian, Q., et al. Responses of human urothelial cells to magnesium-zinc-strontium alloys and associated insoluble degradation products for urological stent applications. Materials Science and Engineering: C. 96, 248-262 (2019).
- Wetteland, C. L., Liu, H. Optical and biological properties of polymer-based nanocomposites with improved dispersion of ceramic nanoparticles. Journal of Biomedical Materials Research Part A. 106 (10), 2692-2707 (2018).
- Wetteland, C. L., Nguyen, N. -Y. T., Liu, H. Concentration-dependent behaviors of bone marrow derived mesenchymal stem cells and infectious bacteria toward magnesium oxide nanoparticles. Acta Biomaterialia. 35, 341-356 (2016).
- Aoi, W., Marunaka, Y. The importance of regulation of body fluid pH in the development and progression of metabolic diseases. Advances in Medicine and Biology. 77, 177-189 (2014).
- Wang, H. Hydroxyapatite degradation and biocompatibility. , The Ohio State University. (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten