Method Article
طرق الاستزراع المباشرة وغير المباشرة لدراسة مواد الزرع القابلة للتحلل الحيوي في المختبر
In This Article
Summary
نحن نقدم ثلاث طرق للثقافة المباشرة ، ثقافة التعرض المباشر ، وثقافة التعرض لتقييم التوافق الخلوي في المختبر لمواد الزرع القابلة للتحلل الحيوي. تحاكي هذه الطرق في المختبر التفاعلات المختلفة بين زرع الخلايا في الجسم الحي ويمكن تطبيقها لدراسة مختلف المواد القابلة للتحلل الحيوي.
Abstract
على مدى العقود العديدة الماضية ، تم استكشاف المواد القابلة للتحلل الحيوي على نطاق واسع للتطبيقات الطبية الحيوية مثل زراعة العظام والأسنان والقحف والوجه والفكين. لفحص المواد القابلة للتحلل الحيوي للتطبيقات الطبية الحيوية ، من الضروري تقييم هذه المواد من حيث استجابات الخلايا في المختبر ، والتوافق الخلوي ، والسمية الخلوية. وقد استخدمت معايير المنظمة الدولية للتوحيد القياسي (ISO) على نطاق واسع في تقييم المواد الحيوية. ومع ذلك ، تم وضع معظم معايير ISO في الأصل لتقييم السمية الخلوية للمواد غير القابلة للتحلل ، وبالتالي توفير قيمة محدودة لفحص المواد القابلة للتحلل البيولوجي.
تقدم هذه المقالة وتناقش ثلاث طرق مختلفة للاستزراع ، وهي طريقة الاستزراع المباشر ، وطريقة ثقافة التعرض المباشر ، وطريقة ثقافة التعرض لتقييم التوافق الخلوي في المختبر لمواد الزرع القابلة للتحلل الحيوي ، بما في ذلك البوليمرات القابلة للتحلل الحيوي والسيراميك والمعادن ومركباتها ، مع أنواع الخلايا المختلفة. وقد أظهرت الأبحاث أن أساليب الاستزراع تؤثر على استجابات الخلايا للمواد القابلة للتحلل البيولوجي لأن تدهورها الديناميكي يحفز الاختلافات الزمانية المكانية في الواجهة وفي البيئة المحلية. على وجه التحديد ، تكشف طريقة الاستزراع المباشر عن استجابات الخلايا المزروعة مباشرة على الغرسات. توضح طريقة ثقافة التعرض المباشر استجابات الخلايا المضيفة الراسخة التي تتلامس مع الغرسات ؛ وتقوم طريقة ثقافة التعرض بتقييم الخلايا المضيفة المنشأة التي ليست على اتصال مباشر مع الغرسات ولكنها تتأثر بالتغيرات في البيئة المحلية بسبب تدهور الزرع.
تقدم هذه المقالة أمثلة على طرق الاستزراع الثلاثة هذه لدراسة التوافق الخلوي في المختبر لمواد الزرع القابلة للتحلل الحيوي وتفاعلاتها مع الخلايا الجذعية الوسيطة المشتقة من نخاع العظام (BMSCs). كما يصف كيفية الحصاد والمرور والثقافة والبذور والإصلاح والبقع وتوصيف الخلايا وتحليل وسائط ومواد ما بعد الزراعة. تحاكي الطرق المخبرية الموضحة في هذه المقالة سيناريوهات مختلفة للبيئة في الجسم الحي ، مما يوسع نطاق تطبيق وأهمية اختبار التوافق الخلوي في المختبر للمواد الحيوية المختلفة لمختلف التطبيقات الطبية الحيوية.
Introduction
على مدى عقود، تمت دراسة المواد القابلة للتحلل الحيوي على نطاق واسع واستخدامها في التطبيقات الطبية الحيوية مثل تطبيقات العظام 1،2 والأسنان 3،4 والقحف والفص 5. على عكس الغرسات والمواد الدائمة ، تتحلل المعادن القابلة للتحلل الحيوي والسيراميك والبوليمرات ومركباتها تدريجيا في الجسم بمرور الوقت عبر تفاعلات كيميائية مختلفة في البيئة الفسيولوجية. على سبيل المثال ، المعادن القابلة للتحلل الحيوي مثل سبائك المغنيسيوم (Mg) 1,6,7 وسبائك الزنك (Zn) 8,9 هي مواد واعدة لأجهزة تثبيت العظام. يمكن أن تلغي قابليتها للتحلل البيولوجي الحاجة إلى العمليات الجراحية الثانوية لإزالة الغرسات بعد التئام العظام. أظهر السيراميك القابل للتحلل الحيوي مثل أسمنت فوسفات الكالسيوم (CPCs) إمكانات مثيرة لعلاج كسور ضغط العمود الفقري لهشاشة العظام في رأب الحدباء عن طريق الجلد10. توفر CPCs الدعم الميكانيكي للجسم الفقري المكسور وتتحلل تدريجيا بعد التئام الكسر.
كما تم استكشاف البوليمرات القابلة للتحلل الحيوي ، مثل بعض السكريات والبوليستر ، على نطاق واسع للتطبيقات الطبية الحيوية. على سبيل المثال، أظهر هيدروجيل الشيتوزان كعديد متعدد السكاريد القابل للتحلل الحيوي قدراته على منع العدوى وتجديد أنسجة الجلد11. حمض البولي ل لاكتيك (PLLA) ، بولي (حمض الجليكوليك) (PGA) ، وبولي (حمض اللاكتيك كو جليكوليك) (PLGA) هي بوليستر مدروس على نطاق واسع لتصنيع سقالات مسامية ثنائية الأبعاد أو 3D لتطبيقات هندسة الأنسجة 12،13،14. علاوة على ذلك ، تدمج المواد المركبة مرحلتين أو أكثر من المعادن والسيراميك والبوليمرات لتوفير وظائف متقدمة لمجموعة واسعة من التطبيقات الطبية الحيوية15،16،17. على سبيل المثال، يمكن استخدام مركبات PLGA وفوسفات الكالسيوم لتصنيع سقالات قابلة للتحلل الحيوي لتطبيقات مثل إصلاح عيوب عظام الجمجمة18. هذه السقالات والغرسات القابلة للتحلل الحيوي يمكن أن تدعم وتعزز نمو الخلايا والأنسجة ثم تتحلل تدريجيا في الجسم بمرور الوقت.
وكما هو مبين في الجدول التكميلي 1، قد يكون للمواد المختلفة القابلة للتحلل البيولوجي آليات ومنتجات ومعدلات تحلل متنوعة. على سبيل المثال ، سبائك المغنيسيوم ، مثل Mg-2 wt ٪ Zn-0.5 wt ٪ Ca (ZC21)1 ، Mg-4 wt٪ Zn-1 wt٪ Sr (ZSr41)19 ، و Mg-9 wt٪ Al-1 wt٪ Zinc (AZ91)20 ، تتحلل عن طريق التفاعل مع الماء ، وتشمل منتجات تحللها بشكل رئيسي أيونات Mg2 + ، وأيونات OH- ، وغاز H2 ، وترسبات معدنية. يختلف معدل تحلل المعادن القابلة للتحلل البيولوجي اعتمادا على تركيباتها المختلفة وهندستها وبيئات تدهورها. على سبيل المثال ، أفاد Cipriano et al.19 أن أسلاك ZSr41 (Ø1.1 × 15 مم) فقدت كتلة 85٪ بينما فقدت أسلاك Mg النقية ذات الهندسة نفسها كتلة 40٪ بعد زرعها في ظنبوب الفئران لمدة 47 يوما. يمكن للمواد الخزفية القابلة للتحلل الحيوي مثل الهيدروكسيباتيت (HA) وفوسفات β-tricalcium (β-TCP) أن تتحلل عن طريق إذابة السائل خارج الخلية التي تحركها المحلول أو تتحلل إلى جزيئات صغيرة ثم تتحلل عبر كل من ذوبان السائل خارج الخلية وعمليات الارتشاف بوساطة الخلايا. قد تشمل منتجات تحلل هذه السيراميك القائم على فوسفات الكالسيوم أيونات Ca2+ ، (PO4) 3- أيونات ، أيونات OH، وترسبات معدنية21. يتأثر معدل تدهور سيراميك فوسفات الكالسيوم بشكل كبير بهياكلها الكريستالية. على سبيل المثال ، أفاد Van Blitterswijk et al.22 أن HA مع 40 vol.٪ micropores لم تفقد أي كتلة بينما فقدت β-TCP مع 40 vol.٪ micropores 30 ± 4٪ كتلة بعد زرعها في ظنبوب الأرانب لمدة 3 أشهر. قد تتحلل البوليمرات مثل PLGA14,23 بسبب التحلل المائي لروابط الإستر في وجود الماء ، وتشمل منتجات التحلل بشكل أساسي أحماض اللاكتيك والجليكوليك. قد يستغرق PLGA 50/50 شهرا واحدا وعدة أشهر ل PLGA 95/5 لتحقيق التدهور الكامل24.
تعد استجابة الخلايا واختبار التوافق الخلوي أمرا بالغ الأهمية لتقييم وفحص مواد الزرع القابلة للتحلل الحيوي هذه للتطبيقات الطبية الحيوية. ومع ذلك ، فإن المعايير الحالية الصادرة عن المنظمة الدولية للتوحيد القياسي (ISO) ، مثل ISO 10993-5: 2009 "التقييم البيولوجي للأجهزة الطبية - اختبارات الجزء 5 للسمية الخلوية في المختبر" ، تم تصميمها في البداية لتقييم السمية الخلوية للمواد الحيوية غير القابلة للتحلل مثل سبائك Ti وسبائك Cr-Co في المختبر 25. على وجه التحديد ، يغطي ISO 10993-5: 2009 فقط اختبارات السمية الخلوية في المختبر للمستخلص ، والاتصال المباشر ، واختبارات الاتصال غير المباشر. في اختبار الاستخراج ، يتم تحضير المستخلص عن طريق غمر العينات في سوائل الاستخراج مثل وسائط الثقافة مع المصل والمحاليل المالحة الفسيولوجية تحت أحد ظروف الوقت ودرجة الحرارة القياسية. ثم يضاف المستخلص أو التخفيف الذي تم جمعه إلى مزرعة الخلايا لدراسة السمية الخلوية. بالنسبة لاختبار الاتصال المباشر ، يتم تحقيق الاتصال المباشر بين العينة والخلايا عن طريق وضع عينة الاختبار على طبقة الخلايا الثابتة (الملتزمة). في اختبار الاتصال غير المباشر ، يتم ماصة وسائط الثقافة التي تحتوي على المصل والأجار المذاب لتغطية الخلايا الموجودة. ثم توضع العينة على طبقة الأجار الصلبة مع أو بدون مرشح.
أظهرت معايير ISO بعض القيود عند تطبيقها لتقييم المواد القابلة للتحلل الحيوي في المختبر. على عكس المواد غير القابلة للتحلل ، فإن سلوكيات التحلل للمواد القابلة للتحلل البيولوجي ديناميكية وقد تتغير في وقت مختلف أو في ظروف بيئية متنوعة (على سبيل المثال ، درجة الحرارة والرطوبة وتكوين الوسائط ونوع الخلية). يقوم اختبار المستخلص فقط بتقييم السمية الخلوية لمنتجات تحلل المادة ولا يعكس العملية الديناميكية لتحلل العينة. كل من اختبارات الاتصال المباشرة وغير المباشرة لمعيار ISO تميز فقط التفاعلات بين الخلايا والعينات الراسخة. علاوة على ذلك ، في اختبار الاتصال غير المباشر ، تكون المواد والخلايا في بيئات دقيقة مختلفة لا تعكس البيئة في الجسم الحي ولا تلتقط التدهور الديناميكي للمواد القابلة للتحلل الحيوي.
الهدف من هذه المقالة هو تقديم ومناقشة طرق اختبار التوافق الخلوي لمختلف مواد الزرع القابلة للتحلل الحيوي لمعالجة القيود المذكورة أعلاه للطرق الموضحة في معايير ISO الحالية. تأخذ الطرق المعروضة في هذه المقالة في الاعتبار سلوك التدهور الديناميكي للمواد المزروعة والظروف المختلفة للتفاعلات بين الخلايا والمواد في الجسم الحي. على وجه التحديد ، توفر هذه المقالة ثلاث طرق لاختبار التوافق الخلوي ، وهي الثقافة المباشرة ، وثقافة التعرض المباشر ، وثقافة التعرض لمختلف المواد القابلة للتحلل البيولوجي ، بما في ذلك البوليمرات القابلة للتحلل الحيوي والسيراميك والمعادن ومركباتها لتطبيقات الزرع الطبية.
في طريقة الاستزراع المباشر ، يتم زرع الخلايا المعلقة في وسائط الاستزراع مباشرة على العينات ، وبالتالي تقييم التفاعلات بين الخلايا المزروعة حديثا والغرسات. في ثقافة التعرض المباشر ، يتم وضع العينات مباشرة على طبقة الخلايا المنشأة لمحاكاة تفاعلات الغرسات مع الخلايا المضيفة الموجودة في الجسم. في ثقافة التعرض ، يتم وضع العينات في إدخالات الآبار الخاصة بها ثم يتم إدخالها إلى آبار الاستزراع ذات الخلايا الثابتة ، والتي تميز استجابات الخلايا المنشأة للتغيرات في البيئة المحلية الناجمة عن تدهور الزرع عندما لا يكون لها اتصال مباشر مع الغرسات. تقوم طرق الثقافة المباشرة وثقافة التعرض المباشر بتقييم الخلايا بشكل مباشر أو غير مباشر على اتصال بمواد الزرع في نفس الثقافة بشكل جيد. تميز ثقافة التعرض الخلايا الملامسة بشكل غير مباشر لمواد الزرع ضمن مسافة محددة في نفس الثقافة جيدا.
تقدم هذه المقالة وصفا مفصلا لاختبار التوافق الخلوي للمواد المختلفة القابلة للتحلل الحيوي وتفاعلاتها مع الخلايا النموذجية ، أي الخلايا الجذعية الوسيطة المشتقة من نخاع العظام (BMSCs). وتشمل البروتوكولات حصاد الخلايا وزراعتها وبذرها وتثبيتها وتلطيخها وتصويرها، إلى جانب تحليلات مواد ووسائط ما بعد الزراعة، والتي تنطبق على مجموعة متنوعة من مواد الزرع القابلة للتحلل الحيوي ومجموعة واسعة من أنواع الخلايا. هذه الطرق مفيدة لفحص المواد القابلة للتحلل الحيوي لمختلف التطبيقات الطبية الحيوية من حيث استجابات الخلايا والتوافق الخلوي في المختبر.
Protocol
تمت الموافقة على هذا البروتوكول من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) في جامعة كاليفورنيا في ريفرسايد (UCR) لحصاد الخلايا والأنسجة. تظهر أنثى الفئران Sprague-Dawley (SD) البالغة من العمر 12 أسبوعا كمثال في الفيديو. ويفضل الفئران الإناث والذكور الأصغر سنا.
1. إعداد زراعة الخلايا
ملاحظة: طرق الاستزراع الثلاثة الموضحة في هذه المقالة قابلة للتطبيق بشكل عام على أنواع الخلايا المختلفة المرتبطة. هنا ، سيتم تقديم BMSCs التي يتم حصادها من فطام الفئران كمثال لإعداد زراعة الخلايا. اعتمادا على أهميتها لتطبيقات طبية محددة ، يمكن استخدام أنواع مختلفة من الخلايا ، بما في ذلك الخلايا الأولية التي يتم حصادها من الحيوانات أو المتبرعين البشريين وخطوط الخلايا من بنك الخلايا / الأنسجة.
- حصاد BMSCs من فطام الفئران
ملاحظة: يوضح الرسم التخطيطي في الشكل 1 خطوات حصاد BMSCs من فطام الفئران.- القتل الرحيم لفئران Sprague Dawley (SD) عن طريق استنشاق CO2 .
- إزالة الجلد والعضلات والأنسجة الضامة لتشريح عظم الفخذ من الفئران القتل الرحيم. ضع عظام الفخذ في أنبوب مخروطي 15 مل (البولي بروبيلين) يحتوي على وسط زراعة الخلايا. ضع الأنابيب المخروطية على الجليد حتى وقت إجراء استخراج الخلايا.
ملاحظة: يمكن أيضا استخدام الساق لحصاد BMSCs. وسط زراعة الخلايا هو وسط النسر المعدل من دولبيكو (DMEM) المكمل بمصل بقري جنيني بنسبة 10٪ (FBS) و 1٪ بنسلين / ستربتومايسين (P / S). - انقل العظام إلى طبق بتري في خزانة السلامة البيولوجية. قم بقطع أطراف العظم باستخدام شفرة جراحية واغسل نخاع العظم في أنبوب مخروطي سعة 50 مل (بولي بروبيلين) عن طريق غسل تجويف نخاع العظم بوسائط زراعة الخلايا باستخدام حقنة بإبرة 251/2 جم.
ملاحظة: أدخل حقنة بإبرة 18 جم في الوسط باستخدام نخاع العظام. ببطء ولطف ، تناول الوسائط ووزعها لتفكيك الجزء الكبير من النخاع حتى لا توجد تكتلات مرئية للخلايا / الأنسجة. - قم بتصفية تعليق الخلية باستخدام مرشح 70 ميكرومتر ، متبوعا بالطرد المركزي عند 126 × جم (1000 دورة في الدقيقة) لمدة 5 دقائق للحصول على حبيبات الخلية.
- استنشق وسائل الإعلام الفائقة وتجديدها ب 10 مل من الوسائط الجديدة. ماصة بلطف لأعلى ولأسفل لإعادة تعليق الخلايا باستخدام ماصة مصلية 10 مل.
- قم بتماصة التعليق مباشرة على الجزء السفلي الداخلي من قارورة T-75 وإضافة وسائط لرفع مستوى الصوت إلى 25 مل. استزرع الخلايا في حاضنة في بيئة زراعة خلايا معقمة قياسية (أي 37 درجة مئوية ، جو رطب مع 5٪ CO2 و 95٪ هواء).
- بعد 3-7 أيام ، اشطف الخلايا غير الملتصقة عن طريق شفط الوسط القديم وتجديده بوسط طازج. استمر في زراعة الخلايا وتغذيتها بوسط طازج حتى تصبح جاهزة لمرور الخلايا أو تجميدها أو استخدامها في تجربة.
- صيانة الخلايا
- قم بتغيير وسط زراعة الخلايا بانتظام لإزالة النفايات الخلوية وتجديد العناصر الغذائية كل يومين تقريبا حتى تلتقي الخلايا بنسبة 90٪ -100٪. عند التقاء 90٪ ، أو المرور ، أو التجميد ، أو استخدام الخلايا في تجربة.
- الخلايا العابرة
ملاحظة: التمرير، ويشار إليه أيضا باسم الزراعة الفرعية، هو مصطلح ينطبق كلما تم نقل الخلايا من ثقافة إلى أخرى. الخلايا التي يتم حصادها حديثا في مرحلة المرور 0 (P0). كميات محلول حمض التربسين-إيثيلين ديامينتتراسيتيك (التربسين-EDTA) والوسائط الموضحة في هذه المقالة هي لقارورة T-75.- تحقق من الخلايا تحت المجهر الضوئي للتأكد من أن الخلايا متقاربة بنسبة 90٪.
- شفط الوسط من قارورة الخلية.
- قم بتوزيع 10 مل من المياه المالحة العازلة بالفوسفات (PBS) في القارورة باستخدام ماصة مصلية. هز بلطف القارورة لشطف الخلايا مع PBS. شفط كل PBS.
ملاحظة: تعمل هذه الخطوة كشطف إضافي لضمان عدم نقل أي خلايا ميتة أو نفايات خلوية أثناء المرور. - قم بتوزيع 3 مل من التربسين-EDTA في قارورة الخلية مباشرة على سطح الخلايا. قم بهز القارورة بلطف لضمان تغطية السطح بأكمله مع الخلايا بواسطة التربسين-EDTA.
- ضع قارورة الخلية مع التربسين-EDTA في الحاضنة لمدة 5 دقائق للسماح للخلايا بالفصل.
- بعد 5 دقائق في الحاضنة ، تحقق من الخلايا تحت المجهر الضوئي للتأكد من أن الخلايا منفصلة. إذا لم تنفصل بعض الخلايا، فاضغط على جانب قارورة الخلية بلطف، وتحقق من القارورة مرة أخرى.
- أضف 9 مل من الوسط الطازج إلى قارورة الخلية لتخفيف التربسين-EDTA. وهذا يوفر بروتينات أكثر سهولة للتريبسين-EDTA للارتباط بها بدلا من تحليل الخلايا.
- قم بإخراج الخلايا الموجودة في الوسائط والتريبسين-EDTA وتوزيعها في أنبوب مخروطي 15 مل. قم بطرد الخلايا مركزيا عند 126 × جم (1000 دورة في الدقيقة) لمدة 5 دقائق.
- دون إزعاج بيليه الخلية ، قم بشفط الوسط باستخدام التربسين-EDTA.
- أضف 5-10 مل من الوسائط الطازجة إلى أنبوب جهاز الطرد المركزي وأعد تعليق الخلايا بلطف في الوسط باستخدام ماصة مصلية سعة 10 مل.
- تماصة الخلايا المعلقة في الوسط خارج أنبوب الطرد المركزي وتقسيم الحجم إلى 2-3 قوارير ثقافة جديدة. أضف ما يكفي من الوسط ليصل الحجم المتوسط الإجمالي إلى 25 مل لكل قارورة.
ملاحظة: قد تختلف نسبة الانقسام أثناء الزراعة الفرعية اعتمادا على أنواع الخلايا وخصائص النمو المحددة. - تحقق من الخلايا تحت المجهر الضوئي وضعها مرة أخرى في الحاضنة.
- تجميد الخلايا
- تحقق من الخلايا تحت المجهر الضوئي للتأكد من أن الخلايا متقاربة بنسبة 90٪.
- كرر الخطوات من 1.2.2.2 إلى 1.2.2.9.
- أضف 900 ميكرولتر من الوسط الطازج إلى أنبوب جهاز الطرد المركزي باستخدام ماصة دقيقة 100-1000 ميكرولتر. قم بإعادة تعليق الخلايا ببطء ولطف في الوسط باستخدام نفس الماصة الدقيقة.
- انقل تعليق الخلية 900 ميكرولتر إلى تبريد. أضف 100 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO).
- في أقرب وقت ممكن ، ضع المبرد في حاوية رغوة أسطوانية مصممة لتنظيم انخفاض درجة الحرارة (انظر جدول المواد). ضع حاوية الرغوة في الفريزر -80 درجة مئوية.
- خلايا الذوبان
- إذابة الخلايا المجمدة في الحمام المائي. خذ أنبوبا مخروطيا معقما سعة 15 مل مملوءا ب 5 مل من الوسط الطازج ، وضع الخلايا في الأنبوب المخروطي ، وأجهزة الطرد المركزي عند 126 × جم (1000 دورة في الدقيقة) لمدة 5 دقائق.
- شفط الوسيط الذي يحتوي على DMSO.
- أضف 5-10 مل من الوسط الطازج إلى الأنبوب المخروطي للخلايا سعة 15 مل. ماصة ببطء وبلطف لأعلى ولأسفل لإعادة تعليق الخلايا.
- ماصة الخلايا المعلقة في الوسط من الأنبوب المخروطي 15 مل وتوزيعها في قارورة T-75 جديدة. عند توزيع الخلايا ، استخدم حركة كاسحة لتوزيع الخلايا بالتساوي قدر الإمكان في الجزء السفلي من قارورة الخلية.
- أضف ما يكفي من الوسط الطازج ليصل الحجم الإجمالي المتوسط إلى 25 مل لكل قارورة T-75.
- تحقق من الخلايا تحت المجهر الضوئي ووضع قارورة الخلية مرة أخرى في الحاضنة.
2. إعداد العينات وتعقيمها
- إعداد العينات
- استخدم اللوحات المعالجة بزراعة الأنسجة مثل لوحات 6 أو 12 أو 24 أو 48 أو 96 بئرا لتجارب زراعة الخلايا الموضحة في هذه المقالة. حدد نوع ألواح زراعة الأنسجة وحجم الوسط في كل بئر بناء على تصميمات تجريبية مختلفة مثل بعد العينة.
- تعقيم أو تطهير جميع العينات القابلة للتحلل الحيوي قبل زراعة الخلايا.
ملاحظة: التطهير مقبول ل in vitro دراسات عندما تكون العينات عرضة للتغيرات الكيميائية و / أو السطحية في ظل بعض ظروف التعقيم التي تنطوي على حرارة عالية و / أو مؤكسد و / أو جذور. تختلف طرق التعقيم أو التطهير لأنواع العينات المختلفة اعتمادا على الخصائص المختلفة للمواد ، مثل البوليمرات والمعادن والسيراميك. يمكن أن تتضمن عملية التعقيم أو التطهير الحرارة أو الغاز أو الإشعاع أو المواد الكيميائية أو الضغط العالي أو مزيج من هذه.- المعادن القابلة للتحلل الحيوي
- بشكل عام ، استخدم الأشعة فوق البنفسجية (UV) لتطهير المعادن القابلة للتحلل الحيوي للدراسات المختبرية .
ملاحظة: على سبيل المثال، أفاد تشانغ وآخرون أن عينات سبائك المغنيسيوم النقي (Mg) وZC21 Mg تم تطهيرها تحت الأشعة فوق البنفسجية لمدة 4 ساعات قبل استخدامها في دراسات الخلايا1. بالنسبة للدراسات في الجسم الحي ، تكون العينات مطلوبة بشكل عام لتعقيمها. بالنسبة للعديد من المعادن القابلة للتحلل الحيوي مثل المغنيسيوم أو سبائك المغنيسيوم ، يجب تجنب التعقيم باستخدام البخار لأن هذه العينات يمكن أن تتأكسد أو تتآكل في الماء6. يوصى باستخدام طبق كوارتز للتطهير بالأشعة فوق البنفسجية لأنه يوفر شفافية أفضل للأشعة فوق البنفسجية من معظم النظارات والبلاستيك. - تعقيم عينات سبائك Mg تحت الحرارة الجافة في فرن أو الأوتوكلاف في نطاق درجة حرارة 100-200 درجة مئوية.
ملاحظة: نظرا لأن بعض السبائك المعدنية لا تزال قابلة للأكسدة على السطح عند درجات حرارة عالية في الهواء ، يمكن استخدام الإشعاع عالي الكثافة كبديل في بعض الحالات. ومع ذلك ، يجب تجنب الإشعاع عالي الكثافة مثل إشعاع ألفا أو غاما عند تعقيم الرقائق المعدنية الرقيقة. قد يسبب إزاحة الذرة داخل المواد ، مما يغير البنية المجهرية للمواد. - استخدم تعقيم غاز أكسيد الإيثيلين (EtO) كطريقة بديلة للمعادن القابلة للتحلل الحيوي الحساسة للحرارة والإشعاع26.
- بشكل عام ، استخدم الأشعة فوق البنفسجية (UV) لتطهير المعادن القابلة للتحلل الحيوي للدراسات المختبرية .
- السيراميك القابل للتحلل الحيوي
- بشكل عام ، قم بتطهير السيراميك القابل للتحلل الحيوي باستخدام الأشعة فوق البنفسجية أو محلول الإيثانول بنسبة 70٪ من قبل في الدراسات المختبرية .
ملاحظة: على سبيل المثال، أفاد ليو وآخرون أن عينات فوسفات الكالسيوم تم تطهيرها عن طريق الغمر في 70٪ من الإيثانول لمدة 1 ساعة والتعرض للأشعة فوق البنفسجية لمدة 12 ساعة على كل جانب قبل استخدامها في اختبارات التوافق الخلوي في المختبر27. - استخدم الأوتوكلاف لتعقيم السيراميك القابل للتحلل الحيوي إذا لم تؤد درجة الحرارة العالية وبخار الماء إلى إتلاف السماد العضوي والهياكل الدقيقة.
ملاحظة: قد تتأثر بعض السيراميك بالتعقيم. على سبيل المثال ، تم العثور على تغيير الطور وخشونة السطح عندما تم تعقيم سيراميك الزركونيا المستقر في الإيتريا عند 121 درجة مئوية لمدة 15 دقيقة. بالإضافة إلى ذلك ، لا يمكن تعقيم CPCs عن طريق التعقيم بالبخار لأن العينات ستتفاعل مع الماء. - استخدم طرق تعقيم بديلة مثل إشعاع الكوبالت-60 لسيراميك الزركونيا المستقر إيتريا المذكور أعلاه وعينات CPC28.
- بشكل عام ، قم بتطهير السيراميك القابل للتحلل الحيوي باستخدام الأشعة فوق البنفسجية أو محلول الإيثانول بنسبة 70٪ من قبل في الدراسات المختبرية .
- البوليمرات القابلة للتحلل الحيوي
- بشكل عام ، قم بتطهير البوليمرات القابلة للتحلل الحيوي باستخدام الأشعة فوق البنفسجية أو الإيثانول بنسبة 70٪ قبل استخدامها في دراسات الخلايا في المختبر.
ملاحظة: قد تخضع بعض البوليمرات لتغيرات كيميائية تحت الأشعة فوق البنفسجية. للتعقيم ، يمكن استخدام العلاج بأشعة غاما مثل إشعاع الكوبالت-60. فعلى سبيل المثال، تم تعقيم مساحيق النشا تحت إشعاع الكوبالت-60 قبل استخدامها في دراسات الخلايا المخبرية29. - مواد بوليمر الأوتوكلاف التي يمكنها تحمل درجات الحرارة العالية والرطوبة.
ملاحظة: على سبيل المثال ، يمكن تعقيم البوليمرات مثل البولي بروبيلين لأنها يمكن أن تتحمل درجات حرارة التعقيم (أي 121-134 درجة مئوية). لا يمكن تعقيم بعض البوليمرات مثل البولي كابرولاكتون (PCL) بسبب نقاط انصهارها المنخفضة نسبيا (أي حوالي 60 درجة مئوية)30. - استخدم غاز EtO لتعقيم المواد البوليمرية الحساسة للتعقيم الحراري أو الإشعاعي.
- بشكل عام ، قم بتطهير البوليمرات القابلة للتحلل الحيوي باستخدام الأشعة فوق البنفسجية أو الإيثانول بنسبة 70٪ قبل استخدامها في دراسات الخلايا في المختبر.
- المعادن القابلة للتحلل الحيوي
3. طرق زراعة الخلايا
- أساليب الثقافة المباشرة
ملاحظة: يوضح الرسم التخطيطي في الشكل 2A خطوات طريقة الثقافة المباشرة. في هذه المقالة ، تم استزراع BMSCs على صفيحة مشتقة من Mg وضعت داخل آبار صفيحة معالجة بالأنسجة من 12 بئرا كمثال لتوضيح طريقة الاستزراع.- اتبع الخطوات الموضحة في الخطوات 1.2.2.1-1.2.2.10 للحصول على تعليق الخلية.
- استخدم قارورة متقاربة بنسبة 90٪ لتحديد تركيز الخلية في تعليق الخلية باستخدام مقياس الدم. قم بتخفيف تعليق الخلية باستخدام وسط طازج إلى تركيز الخلية الموصوف اللازم لدراسة الخلية في المختبر.
ملاحظة: يتم تحديد كثافة البذر للخلايا من خلال التصميم التجريبي. على سبيل المثال ، تم استخدام كثافات الخلايا من 2000-40000 خلية / سم 2 في دراسات خلوية مختلفة مع مواد قابلة للتحلل الحيوي. - ضع العينات (لوحة Mg) في وسط ألواح زراعة الأنسجة المعالجة جيدا والمكونة من 12 صفيحة. بالتتابع ، شطف لوحات الثقافة مع 2 مل من PBS و 2 مل من DMEM لمعايرة الضغط الاسموزي في ظل ظروف معقمة. أضف 3 مل من تعليق الخلايا المخفف في كل بئر إلى العينات ذات الاهتمام.
- زرع الخلايا في حاضنة تحت ظروف زراعة الخلايا القياسية لمدة 24 ساعة.
ملاحظة: قد يكون وقت الاستزراع أطول أو أقصر من 24 ساعة اعتمادا على التصميم التجريبي.
- ثقافات التعرض المباشر
ملاحظة: يوضح الرسم التخطيطي في الشكل 2B خطوات ثقافة التعرض المباشر.- كما هو موضح في الخطوتين 3-1-1 و 3-1-2، قم بإعداد تعليق الخلية بالتركيزات المطلوبة من الخلايا استنادا إلى التصميم التجريبي لأنواع الخلايا المختلفة والتطبيقات المقصودة.
- شطف لوحات الثقافة مع 2 مل من PBS و 2 مل من DMEM بالتتابع لمعايرة الضغط الاسموزي تحت ظروف معقمة. أضف 3 مل من تعليق الخلايا المخفف في كل بئر. استزرع الخلايا في الحاضنة الرطبة تحت ظروف زراعة الخلايا القياسية لمدة 24 ساعة أو حتى تصل الخلايا إلى التقاء 50-80٪.
ملاحظة: قد يختلف مستوى التقاء الخلايا باختلاف أنواع الخلايا والتصميم التجريبي. - بعد 24 ساعة ، اشطف الخلايا في صفيحة البئر باستخدام PBS باستخدام ماصة لإزالة الخلايا الميتة العائمة.
- ضع العينات المطهرة أو المعقمة مباشرة على الخلايا الملتصقة. أضف 3 مل من الوسط الطازج إلى كل بئر.
- استزرع الخلايا تحت ظروف زراعة الخلايا القياسية لمدة 24 ساعة أخرى.
ملاحظة: قد يكون وقت الاستزراع أطول أو أقصر من 24 ساعة اعتمادا على التصميم التجريبي.
- ثقافات التعرض
ملاحظة: يوضح الرسم التخطيطي في الشكل 2C خطوات طريقة ثقافة التعرض.- الخطوات الأولية لإعداد الخلية هي نفسها مثل ثقافة التعرض. كما هو موضح في الخطوتين 3.1.1 و 3.1.2 ، قم بإعداد تعليق الخلية بالخلايا المطلوبة. على غرار الخطوتين 3-2-1 و 3-2-2 ، قم بزرع الخلايا في صفيحة البئر بالكثافة المطلوبة واستزرعها في حاضنة تحت ظروف زراعة الخلايا القياسية لمدة 24 ساعة.
- بعد 24 ساعة ، اشطف الخلايا الملتصقة باستخدام PBS لإزالة الخلايا الميتة العائمة ، تليها إضافة 3 مل من الوسط الطازج إلى كل بئر.
- بعد ذلك ، ضع العينات في إدخالات البئر بحجم مسام غشاء يبلغ 0.4 ميكرومتر ووضع إدراج البئر مع العينات في كل بئر مع الخلايا.
- استزرع الخلايا تحت ظروف زراعة الخلايا القياسية لمدة 24 ساعة أخرى.
ملاحظة: قد يكون وقت الاستزراع أطول أو أقصر من 24 ساعة اعتمادا على التصميم التجريبي.
4. توصيف الخلايا بعد الزراعة
ملاحظة: بالنسبة للزراعة المباشرة وثقافة التعرض المباشر ، قم بإصلاح الخلايا الملتصقة على كل من لوحات الآبار والعينات وصبغها وتصويرها وتحليلها. بالنسبة لثقافة التعرض ، قم بتحليل الخلايا الملتصقة بألواح الآبار.
- تثبيت الخلية
- اجمع وسط ما بعد الزراعة من كل بئر في أنبوب مخروطي مقابل 15 مل لمزيد من التحليل. جمع جميع العينات بعد الثقافة لمزيد من التحليل.
- شطف الخلايا الملتصقة على كل من العينات ولوحات البئر 3 مرات باستخدام PBS.
- أضف 1 مل من 4٪ بارافورمالدهيد (PFA ، 10٪ فورمالين محايد مؤقت) في كل صفيحة بئر. ضع الغطاء مرة أخرى على لوحة البئر واسمح ل PFA بالتفاعل لمدة 20 دقيقة.
- بعد 20 دقيقة ، قم بشفط PFA وتوزيعه في زجاجة نفايات. شطف لوحة البئر 3 مرات باستخدام PBS لإزالة PFA ، ونقل النفايات إلى زجاجة النفايات.
- تلطيخ الخلايا
- قم بإعداد المخزونات العاملة لعوامل التلطيخ باتباع تعليمات الشركات المصنعة.
ملاحظة: على سبيل المثال ، يستخدم Alexa Fluor 488 Phalloidin لتلطيخ F-actin ، ويستخدم 4 ′ ، 6-diamidino-2-phenylindole (DAPI) لتلطيخ نوى الخلايا. يمكن تقليل وقت التلطيخ إذا تحللت العينات بسرعة في محاليل التلطيخ. - أضف 200-400 ميكرولتر من عامل تلطيخ Alexa Fluor 488 Phalloidin المخفف إلى كل بئر لتغطية الخلايا الموجودة على صفيحة البئر والعينة. لف لوحة البئر بورق الألومنيوم لمنع التعرض للضوء، واسمح ل Alexa Fluor 488 Phalloidin بالتفاعل لمدة 20 دقيقة في درجة حرارة الغرفة.
- جمع اليكسا فلور 488 Phalloidin تلطيخ وكيل وتوزيعه في زجاجة النفايات المقابلة. شطف لوحة البئر 3 مرات باستخدام PBS لإزالة الزائدة Alexa Fluor 488 Phalloidin ، وتوزيع PBS المستخدمة في زجاجة النفايات المقابلة.
- أضف 200-400 ميكرولتر من DAPI المخفف إلى كل بئر لتغطية الخلايا في البئر وعلى العينة. لف لوحة البئر بورق الألومنيوم واسمح ل DAPI بالتفاعل لمدة 5 دقائق في درجة حرارة الغرفة.
- جمع DAPI وتوزيعه في زجاجة النفايات المقابلة. شطف لوحة البئر 3 مرات باستخدام PBS لإزالة DAPI ، وتوزيع PBS المستخدمة في زجاجة النفايات المقابلة.
- قم بإعداد المخزونات العاملة لعوامل التلطيخ باتباع تعليمات الشركات المصنعة.
- تصوير الخلايا
- بعد تلطيخ ، صور الخلايا باستخدام المجهر الفلوري. كلما كان ذلك ممكنا ، التقط صورا لتباين الطور للخلايا بالإضافة إلى صور التألق. قم بتصوير الخلايا الموجودة على العينات القابلة للتحلل الحيوي في أقرب وقت ممكن أو مباشرة بعد التلطيخ لتجنب أو تقليل التغييرات المحتملة الناجمة عن التدهور المستمر للعينات. تخزين الخلايا في لوحات البئر في محلول عازل عند 2-8 درجة مئوية بعد التثبيت ، وتصوير الخلايا في أقرب وقت ممكن بعد تلطيخ لتجنب فقدان إشارات التألق.
- بالنسبة للزراعة المباشرة وثقافة التعرض المباشر ، قم بتصوير وتقييم نوعين من الخلايا: (1) الخلايا الموجودة على العينات (في اتصال مباشر مع العينات) و (2) الخلايا الملتصقة بصفيحة البئر المحيطة بالعينات (الاتصال غير المباشر مع العينات) ، كما هو موضح في الشكل 3A.
- بالنسبة لثقافة التعرض، كما هو موضح في الشكل 3B، استخدم دليل الصور عند التقاط صور التألق للخلايا لتحديد ما إذا كانت استجابة الخلية ستكون مختلفة استجابة لتدرج التحلل الديناميكي للعينات. تصوير وتحليل الخلايا الموجودة في المنطقة داخل الحلقة الداخلية (3.5 مم بعيدا عن المركز) والحلقة الخارجية (7 مم بعيدا عن المركز) بشكل منفصل.
ملاحظة: يتم استخدام دليل الصورة لتحديد المسافة بين الخلايا والعينات. - لكل عينة وبئر في لوحات الاستزراع ، التقط عشوائيا خمس صور على الأقل من كل منطقة اهتمام حيث تكون الخلايا إما على اتصال مباشر أو اتصال غير مباشر مع العينات على مسافة محددة مسبقا.
- تحليل الصور
- بالنسبة لجميع صور الخلايا التي تم الحصول عليها من الخطوة 4.3 ، قم بقياس مورفولوجيا الخلية عن طريق قياس مساحة انتشار الخلية ونسبة العرض إلى الارتفاع باستخدام برنامج مثل ImageJ لتحليل الصور.
- احسب عدد الخلايا في كل منطقة صورة. احسب كثافة التصاق الخلية تحت ظروف التلامس المباشر وغير المباشر كعدد الخلايا لكل وحدة مساحة.
5. تحليلات ما بعد الثقافة لوسائل الإعلام والعينات
- قياس درجة الحموضة في وسط ما بعد الثقافة.
ملاحظة: تغير بعض العينات قيمة الأس الهيدروجيني للوسط أثناء تحللها. على سبيل المثال، المعادن القابلة للتحلل الحيوي مثل سبائك المغنيسيوم عادة ما تزيد من قيمة الرقم الهيدروجيني للوسط بسبب تدهورها31. في المقابل، غالبا ما تقلل البوليمرات القابلة للتحلل الحيوي مثل PLGA من قيمة الرقم الهيدروجيني للوسط عندما تتحلل32. يمكن أن يشير قياس قيمة الأس الهيدروجيني لوسط ما بعد الزراعة إلى تدهور هذه العينات في المختبر.- قبل تثبيت الخلية، اجمع وسيط ما بعد الزراعة كما في الخطوة 4.1.1.
- قم بقياس قيم الأس الهيدروجيني لوسط ما بعد الزراعة في كل بئر مباشرة بعد التجميع ، باستخدام مقياس الأس الهيدروجيني المعاير مسبقا.
ملاحظة: قد ينحرف الرقم الهيدروجيني للوسائط بمرور الوقت بسبب الظروف البيئية مثل مستوى CO2 ودرجة الحرارة ، والتي يجب مراعاتها.
- تحليل التراكيب المتوسطة لسلوك التحلل للعينات القابلة للتحلل الحيوي. بالنسبة لبعض العينات التي تسبب تغيرا في لون الوسط، قم بقياس قيمة الكثافة البصرية (O.D.) لوسط ما بعد الزراعة باستخدام مقياس الطيف الضوئي أو قارئ الصفائح الدقيقة لتحديد سلوك التدهور. بدلا من ذلك ، استخدم التحليل الطيفي المرئي فوق البنفسجي (UV-VIS) و Fourier تحويل الانعكاس الكلي الموهن بالأشعة تحت الحمراء (FTIR-ATR) لتحليل منتجات التحلل في وسط ما بعد الاستزراع.
ملاحظة: يعد قياس نواتج التحلل في وسط ما بعد الاستزراع أمرا قيما لفهم سلوك التحلل في العينات. أحد أكثر النهج شيوعا هو قياس الأيونات ذات الأهمية في وسط ما بعد الاستزراع باستخدام مطياف انبعاث البلازما البصري المقترن بالحث (ICP-OES). يمكن استخدام ICP-OES لقياس تركيبات وسط ما بعد الزراعة من المعادن والسيراميك ولكن قد لا يكون مناسبا للبوليمرات. تتكون البوليمرات عادة من الكربون والهيدروجين والأكسجين ، ويصعب تحديد كمية دقيقة لهذه العناصر بالنسبة لبرنامج المقارنات الدولية - OES.- بعد الخطوة 5.1.2 لقياس الأس الهيدروجيني ، قم بجمع الوسط وتخفيفه باستخدام عامل تخفيف مرغوب فيه لإجراء قياسات مثالية لتركيزات الأيونات.
- قياس تركيزات الأيونات ذات الأهمية في وسط ما بعد الاستزراع باستخدام برنامج المقارنات الدولية (ICP-OES).
- تحليل العينات بعد الزراعة
ملاحظة: بعد دراسة الخلايا في المختبر ، قد تتغير العينات القابلة للتحلل الحيوي في الأبعاد والكتلة ومورفولوجيا السطح والبنية المجهرية والتكوين. يساعد تحليل العينات بعد الزراعة على فهم آلية تدهور العينات.- بعد زراعة الخلايا ، التقط صورا فوتوغرافية للعينات لإظهار التغييرات المحتملة في أبعاد العينة واللون والمورفولوجيا والخصائص المرئية الأخرى.
- تجفيف أو تجفيف عينات ما بعد الزراعة وقياس كتلة العينة وبعدها وحجمها لتحديد أي تغييرات في الكتلة والبعد والحجم.
- استخدم المجهر الإلكتروني الماسح (SEM) لتوصيف البنية المجهرية ومورفولوجيا العينات. استخدم التحليل الطيفي للأشعة السينية المشتتة للطاقة (EDX) وحيود الأشعة السينية (XRD) لتوصيف تكوين وطور نواتج التحلل على العينات. استخدم FTIR-ATR للكشف عن الترابط الكيميائي على أسطح العينة.
النتائج
ويبين الشكل 4 صور التألق التمثيلية ل BMSCs في ظل ظروف اتصال مباشرة وغير مباشرة باستخدام طرق استزراع مختلفة. يوضح الشكل 4A ، B BMSCs تحت ظروف الاتصال المباشر وغير المباشر بعد نفس الثقافة المباشرة لمدة 24 ساعة مع سبائك المغنيسيوم ZC21 1. تتكون سبائك ZC21 من 97.5٪ وزن٪ من المغنيسيوم و 2 واط من الزنك و 0.5٪ من الكالسيوم. تنتشر الخلايا التي ليس لها اتصال مباشر مع عينات سبائك ZC21 بشكل أفضل من تلك التي لها اتصال مباشر مع العينات. كما هو موضح في الشكل 4C ، D ، تظهر الخلايا تحت ظروف الاتصال المباشر وغير المباشر مورفولوجيا طبيعية بعد التعرض المباشر لمدة 24 ساعة مع هيدروجيل حمض الهيالورونيك (HyA) المتقاطع بواسطة أيونات Fe3 +. ومع ذلك ، فإن عدد الخلايا تحت حالة الاتصال غير المباشر أقل من ذلك في ظل حالة الاتصال المباشر33. وأبلغت دراسة أخرى عن آثار تدهور سبائك ZSr41 (ф = 1.1 مم) على BMSCs بعد ثقافة التعرض لمدة 24 ساعة19. تتكون سبائك ZSr41 من 95٪ من المغنيسيوم و 4 طن من الزنك و 1 طن من السترونتيوم. ويبين الشكل 4E صور التألق التمثيلية لمركبات BMSCs الملتصقة بالمستنبتة جيدا في موقع يبعد 3.5 مم عن مركز البئر، بعد استزراع تعرض لمدة 24 ساعة باستخدام دبابيس قابلة للتحلل الحيوي19.
يوضح الشكل 5 بيانات المثال لكثافة التصاق الخلايا الكمية. كما هو موضح في الشكل 5A ، في ثقافة التعرض المباشر (24h_DE) على مدار 24 ساعة ، تتمتع BMSCs التي تتلامس مباشرة مع ZC21 بكثافة التصاق خلوي أكبر بكثير من أي مجموعة أخرى. في الثقافة المباشرة على مدار 24 ساعة (24h_D) ، تظهر BMSCs على اتصال مباشر مع ZC21 كثافة التصاق خلوي أعلى بكثير من مجموعة Mg ، وهي أقل بكثير من المجموعة المرجعية الزجاجية ، ولكن لا يوجد فرق إحصائي مقارنة بعنصر تحكم سبيكة Ti (T64). كما هو موضح في الشكل 5B ، في حالة الاتصال غير المباشر لثقافة التعرض المباشر ، تكون كثافة التصاق BMSC أعلى بكثير لمجموعة ZC21 من مجموعة Mg. ومع ذلك ، فإنه لا يظهر فرقا كبيرا مقارنة بمجموعات التحكم T64 والخلايا فقط. في حالة التلامس غير المباشر للثقافة المباشرة ، تكون كثافة التصاق BMSC أعلى بكثير لمجموعة ZC21 منها لمجموعة Mg ولكنها لا تظهر فرقا كبيرا مقارنة بمجموعات التحكم T64 والخلايا فقط1.
يوضح الشكل 6A قيمة الأس الهيدروجيني لوسط ما بعد الثقافة بعد ثقافة التعرض المباشر والثقافة المباشرة. بالنسبة لثقافة التعرض المباشر ، تتراوح قيم الأس الهيدروجيني المتوسطة من 8.3 إلى 8.4 لجميع العينات. في الثقافة المباشرة ، تتراوح قيم الأس الهيدروجيني المتوسطة من 7.9 إلى 8 عبر المجموعات. يوضح الشكل 9B تركيز أيون Mg2+ في وسط ما بعد الزرع. في كل من ثقافة التعرض المباشر والثقافة المباشرة ، تكون تركيزات أيون Mg2 + في مجموعات ZC21 و Mg أعلى بكثير من أي مجموعات تحكم أخرى1. يوضح الشكل 7 أنماط XRD ل ZSr41 و Mg النقي بعد ثقافة التعرض لمدة 3 أيام. في الشكل 7A ، توجد المراحل البلورية ل Mg و Ca(OH)2 و ZnO و MgO∙H2O و Ca(HPO4) (H2O)2 و Ca5(PO4)3(OH) (أي الهيدروكسيباتيت أو HA) و Mg17Sr2 على سطح ZSr41. في الشكل 7B ، توجد المراحل البلورية ل Mg و Ca(OH)2 و Mg3(PO4)2 و Mg7(PO4)2(OH)8 و Ca2P2O7∙5H2O على سطح Mg19 النقي. ويبين الشكل 8A تراكب صور SEM وخرائط EDX للتكوين الأولي السطحي ل Mg المغلفة ب MgO والتحكم في ركائز Mg والزجاج بعد 24 ساعة من الزراعة المباشرة مع BMSCs. يوضح الشكل 8B التركيب الكمي للعناصر السطحية لأسطح العينات ، مما يشير إلى الترسبات المختلفة التي تشكلت أثناء زراعة الخلايا34.

الشكل 1: رسم تخطيطي يوضح خطوات حصاد BMSCs من فطام الفئران. تم تعديل هذا الرقم من 35. اختصار: BMSCs = الخلايا الجذعية الوسيطة المشتقة من نخاع العظام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: رسم تخطيطي يوضح طرق زراعة الخلايا الثلاثة . (أ) الثقافة المباشرة، (ب) ثقافة التعرض المباشر، و (ج) ثقافة التعرض. تم تعديل هذا الرقم من 36. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مخططات تخطيطية توضح الثقافة المباشرة وثقافة التعرض المباشر. (أ) الخلايا تحت الاتصال المباشر وظروف الاتصال غير المباشر في الثقافة المباشرة وثقافة التعرض المباشر. (ب) استخدام دليل التصوير لالتقاط صور للخلايا الملتصقة بصفيحة البئر على مسافات مختلفة بعيدا عن مركز العينات في ثقافة التعرض. ويعدل الشكل 3 باء من الرقم 37. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صور التألق التمثيلية ل BMSCs . (A ، B) ظروف الاتصال المباشر وغير المباشر بعد زراعة مباشرة لمدة 24 ساعة مع سبائك ZC21. (ج، دال) ثقافة التعرض المباشر مع الهيدروجيل HyA. (ه) على لوحة الاستزراع بعد استزراع التعرض لمدة 24 ساعة باستخدام سبائك ZSr41. أشرطة المقياس = 100 ميكرومتر. A و B مستنسختان من 1 ؛ C و D مستنسختان من 33 ؛ و E مستنسخة من 19. الاختصارات: BMSCs = الخلايا الجذعية الوسيطة المشتقة من نخاع العظام. HyA = حمض الهيالورونيك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: النتائج الكمية لكثافة التصاق الخلايا في BMSCs. (أ) الاتصال المباشر و (ب) ظروف الاتصال غير المباشر بعد ثقافة التعرض المباشر لمدة 24 ساعة (24 h_DE) والثقافة المباشرة (24 h_D). هذا الرقم مستنسخ من 1. الاختصارات: BMSCs = الخلايا الجذعية الوسيطة المشتقة من نخاع العظام. DE = ثقافة التعرض المباشر ؛ D = الثقافة المباشرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
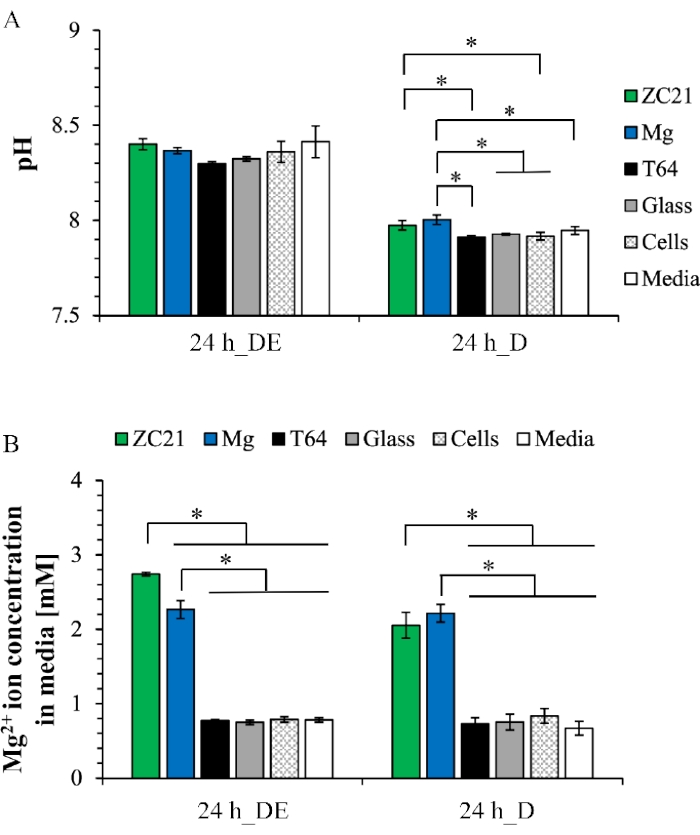
الشكل 6: النتائج التمثيلية لتحليلات ما بعد الزراعة المتوسطة بعد ثقافة التعرض المباشر لمدة 24 ساعة والثقافة المباشرة . (أ) قيم الأس الهيدروجيني و (ب) تركيزات أيون Mg2+ . هذا الرقم مستنسخ من 1. الاختصارات: DE = ثقافة التعرض المباشر; D = الثقافة المباشرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: نتائج ما بعد الزراعة التمثيلية للتحليلات المرحلية للعينات المعدنية القابلة للتحلل البيولوجي بعد 3 أيام من الاستزراع باستخدام BMSCs . (أ) طيف حيود الأشعة السينية ل ZSr41. (B) طيف XRD للملغ النقي. هذا الرقم مستنسخ من 19. الاختصارات: BMSCs = الخلايا الجذعية الوسيطة المشتقة من نخاع العظام. XRD = حيود الأشعة السينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: نتائج ما بعد الزراعة التمثيلية للتحليلات السطحية للعينات بعد 24 ساعة من الاستزراع المباشر باستخدام BMSCs ، بما في ذلك البنية المجهرية السطحية والمورفولوجيا والتكوين . (أ) تراكب صور SEM وخرائط EDX لتكوين العناصر السطحية ل MgO-Mg المغلفة ، والتحكم في Mg غير المطلي ، ومرجع الزجاج. (ب) تكوين العناصر السطحية (في٪) كميا من تحليلات EDX. أشرطة المقياس = 200 ميكرومتر. مستنسخة من 34. الاختصارات: BMSCs = الخلايا الجذعية الوسيطة المشتقة من نخاع العظام. SEM = المجهر الإلكتروني الماسح; EDX = التحليل الطيفي للأشعة السينية المشتتة للطاقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: آليات التحلل والمنتجات والمعدلات لأنواع مختلفة من المواد، والنتائج التي تم جمعها لعينة ما بعد الزراعة والتحليل المتوسط. يرجى النقر هنا لتنزيل هذا الجدول.
Discussion
يمكن استخدام طرق زراعة الخلايا المختلفة لتقييم التوافق الخلوي في المختبر للمواد الحيوية ذات الأهمية لمختلف جوانب التطبيقات في الجسم الحي. توضح هذه المقالة ثلاث طرق للزراعة في المختبر ، أي الثقافة المباشرة ، وثقافة التعرض المباشر ، وثقافة التعرض ، لتقليد سيناريوهات مختلفة في الجسم الحي حيث يتم استخدام مواد زرع قابلة للتحلل الحيوي داخل جسم الإنسان. تستخدم طريقة الاستزراع المباشر بشكل أساسي لتقييم سلوك الخلايا المزروعة حديثا الملتصقة مباشرة بمواد الزرع والمحيطة بها. تحاكي طريقة زراعة التعرض المباشر سيناريو الجسم الحي حيث تتلامس مواد الزرع بشكل مباشر مع الخلايا والأنسجة الراسخة. يمكن استخدام طريقة زراعة التعرض لإظهار كيف يمكن أن تؤثر منتجات التحلل من مواد الزرع والتغيرات في البيئة الدقيقة المحلية على الخلايا والأنسجة الموجودة التي لا تتلامس مباشرة مع مواد الزرع.
في الثقافة المباشرة ، يتم تقييم الخلايا المزروعة حديثا تحت ظروف الاتصال المباشر وغير المباشر. في ثقافة التعرض المباشر ، يمكن تقييم الخلايا الموجودة في ظل ظروف الاتصال المباشرة وغير المباشرة. في ثقافة التعرض ، يمكن تقييم الخلايا الموجودة فقط في ظل ظروف الاتصال غير المباشر. تتأثر الخلايا المزروعة حديثا تحت ظروف الاتصال المباشر في الثقافة المباشرة بخصائص المواد والتغيرات التي تسببها المواد في الوسط مثل التغيرات في تركيز الأيونات وقيمة الرقم الهيدروجيني.
قد تشمل خصائص المواد المذكورة أعلاه مورفولوجيا السطح ، والمحبة للماء ، والطاقة الحرة السطحية ، والصلابة ، والتكوين. تتأثر الخلايا المزروعة حديثا في ظل ظروف الاتصال غير المباشر في طريقة الاستزراع المباشر وجميع الخلايا الموجودة في ثقافة التعرض المباشر وطرق ثقافة التعرض بشكل رئيسي بالتغيرات التي تسببها المواد في الوسط. الطرق الثلاث المختلفة الموضحة في هذه المقالة أقرب إلى السيناريو العملي للبيئة في الجسم الحي من الطرق التقليدية مثل طريقة الاستخراج المتوسطة. تقوم طريقة الاستخراج المتوسطة فقط بتقييم السمية الخلوية لمنتجات تحلل المادة ولا تعكس العملية الديناميكية لتحلل العينة. في طرق الزراعة الموضحة في هذه المقالة ، حيث يتم زراعة الخلايا بمواد الزرع ، يمكن أن يؤثر التغيير الديناميكي للمواد القابلة للتحلل الحيوي والبيئة المتوسطة على الخلايا الموجودة في الموقع.
على الرغم من أنه لا توجد دراسات في المختبر يمكن أن تحل محل الدراسات في الجسم الحي تماما ، إلا أن الدراسات في المختبر مكملة ويمكن أن توفر بيانات قيمة بطريقة منخفضة التكلفة وفعالة. في الجسم الحي ، عادة ما تشمل الدراسات جميع المتغيرات المتعددة في النموذج ، في حين أن زراعة الخلايا في المختبر يمكن أن تدرس آثار عامل واحد على التفاعلات بين الخلية والمواد. يمكن للطرق المقدمة في هذه المقالة محاكاة سيناريوهات مختلفة للدراسات ذات الصلة في الجسم الحي . يمكننا إنشاء روابط بين المتغيرات المختلفة لتوفير مكملات للدراسات في الجسم الحي . عادة ما يتضمن نموذج في الجسم الحي نفس الأنسجة فقط في نوع الحيوان. ومع ذلك ، يمكن أن تشمل الدراسات في المختبر أنواعا مختلفة من الخلايا في ثقافة واحدة ، والتي يمكن أن تدرس الآثار المشتركة للمتغيرات المختلفة على التفاعلات بين الخلايا والمواد. علاوة على ذلك ، من الصعب نسبيا دراسة آثار التغيرات البيئية الديناميكية على التفاعلات بين الخلايا والمواد في نماذج الجسم الحي . يمكن للطرق الموضحة في هذه المقالة التحقيق في آثار التغيرات الديناميكية مثل تركيزات الأيونات في الوسط على سلوك الخلية38.
الطرق المعروضة في هذه المقالة قابلة للتطبيق لفهم التوافق الخلوي في المختبر لجميع أنواع المواد ، بما في ذلك البوليمرات والمعادن والسيراميك والمواد المركبة والجسيمات النانوية ، وتحديد تفاعلاتها مع الخلايا المختلفة أو البكتيريا أو الفطريات بناء على التطبيقات المقصودة. على سبيل المثال، قام شو وآخرون بتقييم التوافق الخلوي في المختبر للهيدروجيل المائي القائم على HyA مع BMSCs عبر طريقة ثقافة التعرض المباشر33. تم تحليل كثافات التصاق الخلايا ومورفولوجيا الخلايا في ظل ظروف الاتصال المباشر وغير المباشر. قد تكون السمية الخلوية لمركبات الهيدروجيل القائمة على HyA مرتبطة بتركيزات أيونات Fe3 + و H+ المنبعثة من هيدروجيل HyA المتشابك أثناء تجربة زراعة الخلايا. قام تيان وآخرون بزراعة الخلايا البولية البشرية (HUCs) مع أربع سبائك Mg مختلفة لمدة 24 ساعة و 48 ساعة باستخدام طريقة ثقافة التعرض ومنتجات التحلل غير القابلة للذوبان الخاصة بها من MgO و Mg (OH)2 لمدة 24 ساعة باستخدام ثقافة التعرض المباشر للتحقيق في التوافق الخلوي وسلوكيات التحلل لسبائك Mg التي تحتوي على الزنك (Zn) والسترونتيوم (Sr) لتطبيق دعامة الحالب المحتملة39 . في هذه الدراسة ، وجد أن ZSr41_B التي تحتوي على 4 wt٪ Zn و 0.5 wt٪ Sr لديها توافق خلوي أفضل مع HUCs بين جميع سبائك Mg-4Zn-xSr الأخرى في كل من ثقافات التعرض 24 ساعة و 48 ساعة. أظهرت النتائج أيضا أنه لم يتم العثور على خلايا ملتصقة مرئية على صفيحة البئر عندما تجاوزت تركيزات أكسيد المغنيسيوم (MgO) وهيدروكسيد المغنيسيوم (Mg(OH)2) 1.0 مجم / مل بعد 24 ساعة من ثقافة التعرض المباشر. لذلك ، خلص تيان وآخرون إلى أن تقليل معدلات تحلل سبائك Mg ضروري للسيطرة على الآثار الجانبية المحتملة نحو الترجمة السريرية المستقبلية. أنشأ ويتلاند وآخرون مركبا نانويا قائما على البوليمر عن طريق تشتيت جسيمات الهيدروكسيباتيت (nHA) و nMgO النانوية في بوليمر PLGA قابل للتحلل الحيوي 40. تمت دراسة هذا المركب النانوي عن طريق زراعة BMSCs بعينات مختلفة باستخدام طريقة الزراعة المباشرة. أظهرت النتائج أن تحسين تشتت الجسيمات النانوية في البوليمر يمكن أن يحسن التصاق BMSC على nHA / PLGA ولكنه يقلل من صلاحية الخلية على nMgO / PLGA. استنادا إلى نتائج دراسات الخلايا المخبرية ، أبلغ ويتلاند وآخرون عن رؤية قيمة لهندسة المركبات النانوية المثلى من السيراميك / البوليمر لمختلف التطبيقات الطبية الحيوية.
يمكن ملاحظة مورفولوجيا الخلايا وأرقام الخلايا وتحديدها كميا في صور التألق باستخدام برنامج للتحليل الكمي للصور مثل ImageJ. يمكننا التحقيق في آثار المواد المختلفة على التصاق الخلايا ومورفولوجيتها عن طريق تحديد كثافات التصاق الخلايا ، ونسب العرض إلى الارتفاع للخلية ، ومناطق انتشار الخلايا لمجموعات العينات المختلفة. يمكن أن يكون مورفولوجيا الخلايا من المجموعة الضابطة الفارغة ، حيث يتم زراعة الخلايا فقط في الوسط ، بمثابة معيار مرجعي دون أي تأثير من مواد العينة. يمكننا تحديد ما إذا كانت مواد العينة ستؤثر على التصاق الخلايا والتشكل في المختبر من خلال مقارنة كثافات التصاق الخلايا ومورفولوجيا الخلايا لمجموعات العينة مع تلك الموجودة في عنصر التحكم الفارغ. تكشف منطقة انتشار الخلايا عن تفضيل التصاق الخلية بسطح العينة ، مما يوضح كيفية تفاعل الخلايا مع مواد العينة. في هذه المقالة، قمنا بتقليل وقت التفاعل لتلطيخ DAPI ليكون أقل من الوقت الأمثل الموصى به من قبل البائع لأن العينات القابلة للتحلل، مثل المغنيسيوم النقي، تتحلل بسرعة في المحاليل المائية. قد يتغير مورفولوجيا الخلايا الملتصقة بالمواد القابلة للتحلل البيولوجي إذا استغرقت عملية التلطيخ وقتا طويلا جدا وكان وقت التعرض للماء طويلا جدا بالنسبة للعينات. علاوة على ذلك ، بالنسبة للخلايا الملتصقة بالمواد القابلة للتحلل البيولوجي ، يجب التقاط صور الخلايا على الفور لتقليل أي تغييرات محتملة في التصاق الخلايا ومورفولوجيتها بسبب تدهور العينة.
إلى جانب جمع نتائج الخلايا ، تعد تحليلات الوسائط والعينات بعد الزراعة مهمة لأنها ستوفر بيانات قيمة لتحليل آلية التحلل والمنتجات ومعدلات مواد الزرع. على سبيل المثال، قد تولد البوليمرات القابلة للتحلل الحيوي مثل PLGA منتجات ثانوية للتحلل الحمضي مثل الأحماض الهيدروكسيلية الكربوكسيلية أحادية أو قليلة التحلل أثناء زراعة الخلايا32، والتي قد تؤثر على نمو الخلايا وانتشارها. وعلى النقيض من ذلك، تنتج المعادن القابلة للتحلل الحيوي، مثل المغنيسيوم وسبائكه، أيونات الهيدروكسيد وغاز الهيدروجين أثناء تحللها31، مما يمكن أن يزيد بشكل كبير من درجة الحموضة المحلية، وقد يكون للقلوية الشديدة آثار ضارة على وظائف الخلايا المحلية. قد يزيد السيراميك القابل للتحلل الحيوي أيضا من درجة الحموضة في الوسط41. بشكل عام، تتطلب الخلايا نطاقا محددا من الأس الهيدروجيني في وسط الثقافة لتعمل بشكل صحيح، ومن المعروف أن زيادة أو انخفاض قيم الأس الهيدروجيني في سوائل الجسم ضارة بالحياة42. يعد قياس درجة الحموضة في وسط ما بعد الزراعة أمرا قيما لفهم أي ضرر محتمل قد تسببه مواد العينات القابلة للتحلل الحيوي في زراعة الخلايا. لذلك ، من الضروري قياس قيمة الرقم الهيدروجيني لوسط ما بعد الزراعة لفهم الآليات المحتملة لكيفية تأثير هذه المواد القابلة للتحلل الحيوي على الخلايا.
من المهم قياس تركيزات الأيونات الحاسمة في وسط ما بعد الاستزراع للمواد القابلة للتحلل الحيوي. على سبيل المثال ، قام كورتيز ألكاراز وآخرون بقياس تركيزات أيون Mg2 + و Ca2 + لوسط ما بعد الزراعة عندما درسوا عينات المغنيسيوم المغلفة بالجسيمات النانوية من أكسيد المغنيسيوم باستخدام الثقافة المباشرة مع BMSCs34. تشير تركيزات أيونات المغنيسيوم إلى خصائص التحلل للعينات المختلفة في المختبر أثناء زراعة الخلايا ، ويمكن أن توفر تركيزات أيونات الكالسيوم معلومات حول ترسب الكالسيوم أثناء انتشار الخلايا. قام شو وآخرون بقياس تركيزات أيون Fe3+ لوسط ما بعد الزراعة عندما درسوا الهيدروجيلات HyA باستخدام ثقافة التعرض المباشر مع BMSCs. استخدموا أيونات Fe3+ لضبط كثافات الربط المتقاطع ل HyA33. قد تقلل أيونات Fe3+ من قيمة الأس الهيدروجيني لوسط المزرعة ، وقد تكون التركيزات العالية من أيونات Fe3 + سامة للخلايا. لذلك ، من المهم قياس تركيزات الأيونات ذات الأهمية لتحسين التوافق الخلوي للمواد القابلة للتحلل البيولوجي ومنتجات التحلل المرتبطة بها.
قد نجمع بيانات مختلفة لتحليل التفاعلات بين الخلايا والمواد المختلفة للمواد المختلفة. على سبيل المثال ، كما هو موضح في الجدول التكميلي 1 ، تتحلل سبائك Mg عن طريق التفاعل مع الماء ، وقد تشمل منتجات التحلل أيونات Mg2 + و OH- ، وغاز H2 ، وبعض منتجات التحلل غير القابلة للذوبان الأخرى مثل Mg(OH)2. XRD و SEM و EDX ، والتي يمكن استخدامها لتحديد ترسب المعادن المتشكل على المادة. قد ندرس آثار تركيز أيونات Mg2+ وقيم الأس الهيدروجيني في الوسط على سلوكيات الخلية. علاوة على ذلك ، قد نستخدم هذه النتائج لدراسة تطور الغاز أثناء تدهور المعادن. وقد أفادت الدراسات المخبرية أن مستوى التسامح الحرج لغاز H2 هو <0.01 مل / سم 2 / يوم ، وقد استخدم هذا على نطاق واسع لفحص سبائك المغنيسيوم لتطبيقات الزرع المؤقتة. في الأساس ، تعتمد كمية تطور الغاز على معدل تدهور سبائك المغنيسيوم. في مثال آخر ، يتحلل PLGA بسبب التحلل المائي لروابط استر في وجود الماء. يمكن دراسة منتجات تحلل حمض اللاكتيك وحمض الجليكوليك ، وكذلك قيم الرقم الهيدروجيني في الوسط ، لتحليل التفاعلات بين الخلايا والمواد. تتضمن الطرق الموضحة في هذه المقالة قياس الأيونات المنبعثة وقيم الأس الهيدروجيني في وسائط زراعة الخلايا والتغير الكتلي للمواد ، والتي يمكن استخدامها لتقدير معدل تحلل المواد.
عادة ما تتصرف المواد المختلفة بشكل مختلف في المختبر وفي الجسم الحي ، ويجب اختيار طرق دراسات التوافق الخلوي بناء على بيئة التطبيق ونوع المادة. بالنسبة لتطبيقات تقويم العظام ، من المستحسن تقييم التفاعلات بين خلايا العظام ذات الصلة والغرسات عندما تكون على اتصال مباشر مع بعضها البعض. يمكن استخدام طريقة الاستزراع المباشر للتحقيق في التفاعلات بين الخلايا المزروعة حديثا والزرع. في تطبيقات القلب والأوعية الدموية ، نظرا لأن الخلايا الموجودة سوف تتلامس بشكل مباشر أو غير مباشر مع مواد الدعامات المزروعة ، يمكن استخدام ثقافة التعرض المباشر وطرق ثقافة التعرض لتقييم التوافق الخلوي للمعادن القابلة للتحلل الحيوي لتطبيقات القلب والأوعية الدموية. نعتقد أن الطرق المخبرية الموضحة في هذه المقالة ممكنة لتقديم أدلة أولية على التوافق الخلوي لمواد الزرع القابلة للتحلل. تحتاج أساليب الاستزراع إلى تعديل لمواد مختلفة ذات آليات ومنتجات ومعدلات تحلل متنوعة. على سبيل المثال ، يمكن تعديل وقت زراعة المواد المختلفة بناء على معدلات التدهور المتنوعة لأنواع المواد المختلفة. يمكن جمع نتائج مختلفة بناء على آليات التحلل المختلفة ومنتجات المواد.
باختصار ، من المهم تحليل الخلايا والمواد المتوسطة والعينات نوعيا وكميا ، قبل وبعد زراعة الخلايا في المختبر ، لفهم آثار مواد الزرع القابلة للتحلل الحيوي ومنتجات التحلل على التوافق الخلوي. يمكن استخدام طرق الاستزراع الثلاث المعروضة في هذه المقالة لدراسة مجموعة واسعة من المواد القابلة للتحلل الحيوي ، بما في ذلك البوليمرات القابلة للتحلل الحيوي والسيراميك والمعادن لتطبيقات الزرع الطبي وهندسة الأنسجة. هذه الدراسات في الخلايا المختبرية قيمة لفحص المواد القابلة للتحلل الحيوي ، وتحسين تصميم الأجهزة والسقالات القابلة للزرع في المرحلة المبكرة من تطوير المنتج ، والحد من السمية المحتملة للخلايا.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
يقدر المؤلفون الدعم المالي المقدم من مؤسسة العلوم الوطنية الأمريكية (NSF CBET Award 1512764 و NSF PIRE 1545852) ، والمعاهد الوطنية للصحة (NIH NIDCR 1R03DE028631) ، وزمالة جامعة كاليفورنيا (UC) لتنمية أعضاء هيئة التدريس ، ولجنة منحة بذور الأبحاث (Huinan Liu) ، ومنحة أبحاث أطروحة UC-Riverside (Jiajia Lin). يقدر المؤلفون المرفق المركزي للفحص المجهري المتقدم والتحليل الدقيق (CFAMM) في UC-Riverside لاستخدام SEM / EDS والدكتور بيري تشيونغ لاستخدام أدوات XRD. يقدر المؤلفون أيضا ثانه في نغوين وكويني شو للتحرير الجزئي. يود المؤلفون أيضا أن يشكروا سيندي لي على تسجيل السرد للفيديو. أي آراء أو نتائج أو استنتاجات أو توصيات يتم التعبير عنها في هذه المقالة هي آراء المؤلفين ولا تعكس بالضرورة وجهات نظر المؤسسة الوطنية للعلوم أو المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | VWR | 490019-704 | |
| 12-well tissue-culture-treated plates | Thermo Fisher Scientific | 353043 | |
| 15 mL conical tube (Polypropylene) | VWR | 89039-666 | |
| 18 G needle | BD | 305196 | |
| 25½ G needle | BD | 305122 | |
| 4′,6-diamidino-2- phenylindole dilactate (DAPI) | Invitrogen | D3571 | |
| 50 mL conical tube (Polypropylene) | VWR | 89039-658 | |
| 70 μm nylon strainer | Fisher Scientific | 50-105-0135 | |
| Alexa Flour 488-phalloidin | Life technologies | A12379 | |
| Biological safety cabinet | LABCONCO | Class II, Type A2 | |
| Centrifuge | Eppendorf | Rotor F-35-6-30, Centrifuge5430 | |
| Clear Fused Quartz Round Dish | AdValue Technology | FQ-4085 | |
| CO2 incubator | SANYO | MCO-19AIC | |
| CoolCell Freezer Container | Corning | 432000 | foam container designed to regulate temperature decrease |
| Cryovial | Thermo Fisher Scientific | 5000-1020 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Sigma-Aldrich | D5648 | |
| EDX analysis software | Oxford Instruments | AztecSynergy | |
| Energy dispersive X-ray spectroscopy (EDX) | FEI | 50mm2 X-Max50 SDD | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Inc. | SH30910 | |
| Fluorescence microscope | Nikon | Eclipse Ti | |
| Formaldehyde | VWR | 100496-496 | |
| Hemacytometer | Hausser Scientific | 3520 | |
| ImageJ software | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation (LOCI, University of Wisconsin) | ||
| Inductively coupled plasma optical emission spectrometry (ICP-OES) | PerkinElmer | Optima 8000 | |
| Optical microscope | VWR | VistaVision | |
| Penicillin/streptomycin (P/S) | Thermo Fisher Scientific, Inc., | 15070063 | |
| pH meter | VWR | model SB70P | |
| Phosphate Buffered Saline (PBS) | VWR | 97062-730 | |
| Scanning electronic microscope (SEM) | FEI | Nova NanoSEM 450 | |
| surgical blade | VWR | 76353-728 | |
| Tissue Culture Flasks | VWR | T-75, MSPP-90076 | |
| Transwell inserts | Corning | 3460 | |
| Trypsin-ethylenediaminetetraacetic acid solution (Trypsin-EDTA) | Sigma-Aldrich | T4049 | |
| X-ray diffraction instrument (XRD) | PANalytical | Empyrean Series 2 |
References
- Zhang, C., et al. Antimicrobial bioresorbable Mg-Zn-Ca alloy for bone repair in a comparison study with Mg-Zn-Sr Alloy and pure Mg. ACS Biomaterials Science & Engineering. 6 (1), 517-538 (2019).
- Xu, C., et al. A green biocompatible fabrication of highly porous functional ceramics with high strength and controllable pore structures. Journal of Materials Science & Technology. 32 (8), 729-732 (2016).
- Asgari, M., et al. Biodegradable metallic wires in dental and orthopedic applications: a review. Metals. 8 (4), 212(2018).
- Shi, Y., Liu, J., Yu, L., Zhong, L. Z., Jiang, H. B. β-TCP scaffold coated with PCL as biodegradable materials for dental applications. Ceramics International. 44 (13), 15086-15091 (2018).
- Wu, C. -C., et al. A self-reinforcing biodegradable implant made of poly (ɛ-caprolactone)/calcium phosphate ceramic composite for craniomaxillofacial fracture fixation. Journal of Cranio-Maxillofacial Surgery. 44 (9), 1333-1341 (2016).
- Jiang, W., et al. In vitro evaluation of MgSr and MgCaSr alloys via direct culture with bone marrow derived mesenchymal stem cells. Acta Biomaterialia. 72, 407-423 (2018).
- Zhang, C., et al. Magnesium-based biodegradable microelectrodes for neural recording. Materials Science and Engineering: C. 110, 110614(2020).
- Jia, B., et al. In vitro and in vivo studies of Zn-Mn biodegradable metals designed for orthopedic applications. Acta Biomaterialia. 108, 358-372 (2020).
- Yang, H., et al. Alloying design of biodegradable zinc as promising bone implants for load-bearing applications. Nature Communications. 11 (1), 1-16 (2020).
- Liu, H., et al. Injectable, biomechanically robust, biodegradable and osseointegrative bone cement for percutaneous kyphoplasty and vertebroplasty. International Orthopaedics. 42 (1), 125-132 (2018).
- Anjum, S., Arora, A., Alam, M., Gupta, B. Development of antimicrobial and scar preventive chitosan hydrogel wound dressings. International Journal of Pharmaceutics. 508 (1-2), 92-101 (2016).
- Barroca, N., et al. Electrically polarized PLLA nanofibers as neural tissue engineering scaffolds with improved neuritogenesis. Colloids and Surfaces B: Biointerfaces. 167, 93-103 (2018).
- Liu, Y., et al. Polydopamine-modified poly (l-lactic acid) nanofiber scaffolds immobilized with an osteogenic growth peptide for bone tissue regeneration. RSC Advances. 9 (21), 11722-11736 (2019).
- Liu, H., Webster, T. J. Enhanced biological and mechanical properties of well-dispersed nanophase ceramics in polymer composites: from 2D to 3D printed structures. Materials Science and Engineering: C. 31 (2), 77-89 (2011).
- Xu, C., et al. Bioinspired mechano-sensitive macroporous ceramic sponge for logical drug and cell delivery. Advanced Science. 4 (6), 1600410(2017).
- Xu, C., Bai, Y., Yang, H., Yang, L. Mechanically modulated, ultra-high precision logic delivery of molecules by bio-inspired macroporous ceramic sponge. MRS Advances. 2 (19-20), 1125-1130 (2017).
- Zhang, N., Xu, C., Azer, A., Liu, H. Dispersibility and characterization of polyvinyl alcohol-coated magnetic nanoparticles in poly (glycerol sebacate) for biomedical applications. Journal of Nanoparticle Research. 21 (12), 1-11 (2019).
- Kim, S. S., et al. A poly (lactide-co-glycolide)/hydroxyapatite composite scaffold with enhanced osteoconductivity. Journal of Biomedical Materials Research Part A. 80 (1), 206-215 (2007).
- Cipriano, A. F., et al. Degradation of bioresorbable Mg-4Zn-1Sr intramedullary pins and associated biological responses in vitro and in vivo. ACS Applied Materials & Interfaces. 9 (51), 44332-44355 (2017).
- Surmeneva, M. A., et al. Bone marrow derived mesenchymal stem cell response to the RF magnetron sputter deposited hydroxyapatite coating on AZ91 magnesium alloy. Materials Chemistry and Physics. 221, 89-98 (2019).
- Sheikh, Z., et al. Mechanisms of in vivo degradation and resorption of calcium phosphate based biomaterials. Materials. 8 (11), 7913-7925 (2015).
- Klein, C., Driessen, A., De Groot, K., Van den Hooff, A. Biodegradation behavior of various calcium phosphate materials in bone tissue. Journal of Biomedical Materials Research. 17 (5), 769-784 (1983).
- Lanao, R. P. F., Leeuwenburgh, S. C., Wolke, J. G., Jansen, J. A. Bone response to fast-degrading, injectable calcium phosphate cements containing PLGA microparticles. Biomaterials. 32 (34), 8839-8847 (2011).
- Vey, E., et al. Degradation kinetics of poly (lactic-co-glycolic) acid block copolymer cast films in phosphate buffer solution as revealed by infrared and Raman spectroscopies. Polymer Degradation and Stability. 96 (10), 1882-1889 (2011).
- Standard, I. Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity. Geneve, Switzerland: International Organization for Standardization. , (2009).
- Liu, X., Zhou, W., Wu, Y., Cheng, Y., Zheng, Y. Effect of sterilization process on surface characteristics and biocompatibility of pure Mg and MgCa alloys. Materials Science and Engineering: C. 33 (7), 4144-4154 (2013).
- Liu, H., Yazici, H., Ergun, C., Webster, T. J., Bermek, H. An in vitro evaluation of the Ca/P ratio for the cytocompatibility of nano-to-micron particulate calcium phosphates for bone regeneration. Acta Biomaterialia. 4 (5), 1472-1479 (2008).
- Liu, H., et al. Enhancing effects of radiopaque agent BaSO4 on mechanical and biocompatibility properties of injectable calcium phosphate composite cement. Materials Science and Engineering: C. 116, 110904(2020).
- Xu, C., et al. A versatile three-dimensional foam fabrication strategy for soft and hard tissue engineering. Biomedical Materials. 13 (2), 025018(2018).
- Speranza, V., Sorrentino, A., De Santis, F., Pantani, R. Characterization of the polycaprolactone melt crystallization: complementary optical microscopy, DSC, and AFM studies. The Scientific World Journal. , 720157(2014).
- Cipriano, A. F., et al. Anodization of magnesium for biomedical applications-Processing, characterization, degradation and cytocompatibility. Acta Biomaterialia. 62, 397-417 (2017).
- Li, H., Chang, J. pH-compensation effect of bioactive inorganic fillers on the degradation of PLGA. Composites science and technology. 65 (14), 2226-2232 (2005).
- Xu, C., Hung, C., Cao, Y., Liu, H. H. Tunable crosslinking, reversible phase transition, and 3D printing of hyaluronic acid hydrogels via dynamic coordination of innate carboxyl groups and metallic ions. ACS Applied Bio Materials. 4 (3), 2408-2428 (2021).
- Cortez Alcaraz, M. C., et al. Electrophoretic deposition of magnesium oxide nanoparticles on magnesium: processing parameters, microstructures, degradation, and cytocompatibility. ACS Applied Bio Materials. 2 (12), 5634-5652 (2019).
- Rutherford, D., et al. Synthesis, characterization, and cytocompatibility of yttria stabilized zirconia nanopowders for creating a window to the brain. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 108 (3), 925-938 (2020).
- Tian, Q., Deo, M., Rivera-Castaneda, L., Liu, H. Cytocompatibility of magnesium alloys with human urothelial cells: a comparison of three culture methodologies. ACS Biomaterials Science & Engineering. 2 (9), 1559-1571 (2016).
- Nguyen, T., Cipriano, A., Guan, R. G., Zhao, Z. Y., Liu, H. In vitro interactions of blood, platelet, and fibroblast with biodegradable magnesium-zinc-strontium alloys. Journal of Biomedical Materials Research Part A. 103 (9), 2974-2986 (2015).
- Jiang, W., Lin, J., Chen, A. H., Pan, J., Liu, H. A portable device for studying the effects of fluid flow on degradation properties of biomaterials inside cell incubators. Regenerative Biomaterials. 6 (1), 39-48 (2019).
- Tian, Q., et al. Responses of human urothelial cells to magnesium-zinc-strontium alloys and associated insoluble degradation products for urological stent applications. Materials Science and Engineering: C. 96, 248-262 (2019).
- Wetteland, C. L., Liu, H. Optical and biological properties of polymer-based nanocomposites with improved dispersion of ceramic nanoparticles. Journal of Biomedical Materials Research Part A. 106 (10), 2692-2707 (2018).
- Wetteland, C. L., Nguyen, N. -Y. T., Liu, H. Concentration-dependent behaviors of bone marrow derived mesenchymal stem cells and infectious bacteria toward magnesium oxide nanoparticles. Acta Biomaterialia. 35, 341-356 (2016).
- Aoi, W., Marunaka, Y. The importance of regulation of body fluid pH in the development and progression of metabolic diseases. Advances in Medicine and Biology. 77, 177-189 (2014).
- Wang, H. Hydroxyapatite degradation and biocompatibility. , The Ohio State University. (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved