Method Article
Metodi di coltura diretta e indiretta per lo studio di materiali implantari biodegradabili in vitro
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Introduciamo tre metodi di coltura diretta, coltura a esposizione diretta e coltura di esposizione per valutare la citocompatibilità in vitro di materiali implantari biodegradabili. Questi metodi in vitro imitano diverse interazioni cellula-impianto in vivo e possono essere applicati per studiare vari materiali biodegradabili.
Abstract
Negli ultimi decenni, i materiali biodegradabili sono stati ampiamente esplorati per applicazioni biomediche come impianti ortopedici, dentali e craniomaxillofacciali. Per lo screening di materiali biodegradabili per applicazioni biomediche, è necessario valutare questi materiali in termini di risposte cellulari in vitro , citocompatibilità e citotossicità. Gli standard dell'Organizzazione internazionale per la standardizzazione (ISO) sono stati ampiamente utilizzati nella valutazione dei biomateriali. Tuttavia, la maggior parte degli standard ISO sono stati originariamente stabiliti per valutare la citotossicità dei materiali non degradabili, fornendo così un valore limitato per lo screening dei materiali biodegradabili.
Questo articolo introduce e discute tre diversi metodi di coltura, vale a dire, metodo di coltura diretta, metodo di coltura di esposizione diretta e metodo di coltura di esposizione per valutare la citocompatibilità in vitro di materiali implantari biodegradabili, inclusi polimeri biodegradabili, ceramiche, metalli e loro compositi, con diversi tipi di cellule. La ricerca ha dimostrato che i metodi di coltura influenzano le risposte cellulari ai materiali biodegradabili perché la loro degradazione dinamica induce differenze spazio-temporali all'interfaccia e nell'ambiente locale. Nello specifico, il metodo di coltura diretta rivela le risposte delle cellule seminate direttamente sugli impianti; il metodo di coltura ad esposizione diretta chiarisce le risposte delle cellule ospiti stabilite che entrano in contatto con gli impianti; e il metodo di coltura di esposizione valuta le cellule ospiti stabilite che non sono in contatto diretto con gli impianti ma sono influenzate dai cambiamenti nell'ambiente locale dovuti alla degradazione dell'impianto.
Questo articolo fornisce esempi di questi tre metodi di coltura per studiare la citocompatibilità in vitro dei materiali implantari biodegradabili e le loro interazioni con le cellule staminali mesenchimali derivate dal midollo osseo (BMSC). Descrive anche come raccogliere, passare, coltivare, seminare, fissare, macchiare, caratterizzare le cellule e analizzare i media e i materiali post-coltura. I metodi in vitro descritti in questo articolo imitano diversi scenari dell'ambiente in vivo , ampliando l'applicabilità e la rilevanza dei test di citocompatibilità in vitro di diversi biomateriali per varie applicazioni biomediche.
Introduzione
Per decenni, i materiali biodegradabili sono stati ampiamente studiati e utilizzati in applicazioni biomediche come l'ortopedia1,2, dental3,4 e craniomaxillofacial5 applicazioni. A differenza degli impianti e dei materiali permanenti, i metalli biodegradabili, le ceramiche, i polimeri e i loro compositi si degradano gradualmente nel corpo nel tempo attraverso diverse reazioni chimiche nell'ambiente fisiologico. Ad esempio, i metalli biodegradabili come le leghe di magnesio (Mg)1,6,7 e le leghe di zinco (Zn)8,9 sono materiali promettenti per i dispositivi di fissazione ossea. La loro biodegradabilità potrebbe eliminare la necessità di interventi chirurgici secondari per rimuovere gli impianti dopo la guarigione ossea. Le ceramiche biodegradabili come i cementi fosfato di calcio (CPC) hanno mostrato un potenziale entusiasmante per il trattamento delle fratture da compressione vertebrale osteoporotica nella cifoplastica percutanea10. I CPC forniscono supporto meccanico per il corpo vertebrale fratturato e gradualmente si degradano dopo che la frattura è guarita.
Anche i polimeri biodegradabili, come alcuni polisaccaridi e poliesteri, sono stati ampiamente esplorati per applicazioni biomediche. Ad esempio, l'idrogel di chitosano come polisaccaride biodegradabile ha mostrato le sue capacità di prevenire le infezioni e rigenerare il tessuto cutaneo11. L'acido poli-L-lattico (PLLA), il poli(acido glicolico) (PGA) e l'acido poli-lattico-co-glicolico (PLGA) sono poliesteri ampiamente studiati per la fabbricazione di scaffold porosi 2D o 3D per applicazioni di ingegneria tissutale12,13,14. Inoltre, i materiali compositi integrano due o più fasi di metalli, ceramiche e polimeri per fornire funzioni avanzate per una vasta gamma di applicazioni biomediche15,16,17. Ad esempio, i compositi PLGA e fosfato di calcio possono essere utilizzati per fabbricare scaffold biodegradabili per applicazioni come la riparazione di difetti ossei del cranio18. Questi scaffold e impianti biodegradabili potrebbero supportare e promuovere la crescita di cellule e tessuti e quindi degradarsi gradualmente nel corpo nel tempo.
Come mostrato nella Tabella supplementare 1, diversi materiali biodegradabili possono avere vari meccanismi di degradazione, prodotti e tassi. Ad esempio, le leghe di magnesio, come Mg-2 wt % Zn-0,5 wt % Ca (ZC21)1, Mg-4 wt% Zn-1 wt% Sr (ZSr41)19 e Mg-9 wt% Al-1 wt% Zinc (AZ91)20, si degradano reagendo con l'acqua e i loro prodotti di degradazione includono principalmente ioni Mg2+, ioni OH-, gas H2 e deposizioni minerali. Il tasso di degradazione per i metalli biodegradabili varia a seconda delle loro diverse composizioni, geometrie e ambienti di degrado. Ad esempio, Cipriano et al.19 hanno riferito che i fili ZSr41 (Ø1,1 × 15 mm) hanno perso l'85% di massa mentre i fili Mg puri con la stessa geometria hanno perso il 40% di massa dopo essere stati impiantati nelle tibie di ratto per 47 giorni. I materiali ceramici biodegradabili come l'idrossiapatite (HA) e il fosfato β-tricalcico (β-TCP) possono degradarsi attraverso la dissoluzione del liquido extracellulare guidato dalla soluzione o scomporsi in piccole particelle e quindi degradarsi attraverso la dissoluzione liquida extracellulare e i processi di riassorbimento cellulo-mediati. I prodotti di degradazione di queste ceramiche a base di fosfato di calcio possono includere ioni Ca2+, ioni (PO4)3-, ioni OH- e deposizioni minerali21. Il tasso di degradazione per le ceramiche di fosfato di calcio è significativamente influenzato dalle loro strutture cristalline. Ad esempio, Van Blitterswijk et al.22 hanno riferito che l'HA con micropori al 40 vol.% non ha perso massa mentre β-TCP con micropori al 40% ha perso il 30± 4% di massa dopo essere stato impiantato nelle tibie dei conigli per 3 mesi. Polimeri come PLGA14,23 possono degradarsi a causa dell'idrolisi dei legami estere in presenza di acqua, e i prodotti di degradazione includono principalmente acidi lattico e glicolico. Potrebbe essere necessario un mese per PLGA 50/50 e diversi mesi per PLGA 95/5 per ottenere la completa degradazione24.
I test di risposta cellulare e citocompatibilità sono fondamentali per valutare e vagliare questi materiali implantari biodegradabili per applicazioni biomediche. Tuttavia, gli attuali standard dell'Organizzazione internazionale per la standardizzazione (ISO), come ISO 10993-5:2009 "Valutazione biologica dei dispositivi medici-Parte 5 Test per la citotossicità in vitro", sono stati inizialmente progettati per valutare la citotossicità di biomateriali non degradabili come le leghe Ti e le leghe Cr-Co in vitro25. In particolare, ISO 10993-5:2009 copre solo i test di citotossicità in vitro dell'estratto, il contatto diretto e i test di contatto indiretto. Nel test di estrazione, l'estratto viene preparato immergendo i campioni in fluidi di estrazione come terreni di coltura con siero e soluzioni saline fisiologiche in una delle condizioni standard di tempo e temperatura. L'estratto o la diluizione raccolti viene quindi aggiunto nella coltura cellulare per studiare la citotossicità. Per il test di contatto diretto, il contatto diretto tra campione e cellule si ottiene posizionando il campione di prova sullo strato cellulare stabilito (aderito). Nel test di contatto indiretto, il terreno di coltura contenente siero e agar fuso viene pipettato per coprire le cellule stabilite. Il campione viene quindi posto sullo strato di agar solidificato con o senza filtro.
Gli standard ISO hanno mostrato alcune limitazioni quando applicati per valutare materiali biodegradabili in vitro. A differenza dei materiali non degradabili, i comportamenti di degradazione dei materiali biodegradabili sono dinamici e possono cambiare in un momento diverso o in varie condizioni ambientali (ad esempio, temperatura, umidità, composizione dei media e tipo di cella). Il test dell'estratto valuta solo la citotossicità dei prodotti di degradazione del materiale e non riflette il processo dinamico di degradazione del campione. Sia i test di contatto diretto che indiretto dello standard ISO caratterizzano solo le interazioni tra le cellule e i campioni stabiliti. Inoltre, nel test di contatto indiretto, i materiali e le cellule si trovano in microambienti diversi che non riflettono l'ambiente in vivo e non catturano la degradazione dinamica dei materiali biodegradabili.
L'obiettivo di questo articolo è quello di introdurre e discutere i metodi di test di citocompatibilità per vari materiali implantari biodegradabili per affrontare le limitazioni sopra menzionate dei metodi descritti negli attuali standard ISO. I metodi presentati in questo articolo considerano il comportamento di degradazione dinamica dei materiali implantari e le diverse circostanze delle interazioni cellula-materiale in vivo. In particolare, questo articolo fornisce tre metodi di test di citocompatibilità, vale a dire coltura diretta, coltura a esposizione diretta e coltura di esposizione per vari materiali biodegradabili, tra cui polimeri biodegradabili, ceramiche, metalli e loro compositi per applicazioni implantari mediche.
Nel metodo di coltura diretta, le cellule sospese nei terreni di coltura vengono seminate direttamente sui campioni, valutando così le interazioni tra le cellule appena seminate e gli impianti. Nella coltura a esposizione diretta, i campioni vengono posizionati direttamente sullo strato cellulare stabilito per imitare le interazioni degli impianti con le cellule ospiti stabilite nel corpo. Nella coltura di esposizione, i campioni vengono collocati nei rispettivi inserti del pozzo e quindi introdotti nei pozzetti di coltura con cellule stabilite, che caratterizzano le risposte delle cellule stabilite ai cambiamenti nell'ambiente locale indotti dalla degradazione dell'impianto quando non hanno alcun contatto diretto con gli impianti. I metodi di coltura diretta e di coltura ad esposizione diretta valutano le cellule direttamente o indirettamente a contatto con i materiali implantari nello stesso pozzo di coltura. La coltura di esposizione caratterizza le cellule indirettamente a contatto con i materiali implantari entro una distanza prescritta nello stesso pozzo di coltura.
Questo articolo presenta una descrizione dettagliata dei test di citocompatibilità per diversi materiali biodegradabili e delle loro interazioni con cellule modello, cioè cellule staminali mesenchimali derivate dal midollo osseo (BMSC). I protocolli includono la raccolta, la coltivazione, la semina, il fissaggio, la colorazione e l'imaging delle cellule, insieme alle analisi dei materiali e dei mezzi di post-coltura, che si applicano a una varietà di materiali implantari biodegradabili e a una vasta gamma di tipi di cellule. Questi metodi sono utili per lo screening di materiali biodegradabili per diverse applicazioni biomediche in termini di risposte cellulari e citocompatibilità in vitro.
Protocollo
Questo protocollo è stato approvato dall'Institutional Animal Care and Use Committee (IACUC) presso l'Università della California a Riverside (UCR) per la raccolta di cellule e tessuti. Una femmina di ratto Sprague-Dawley (SD) di 12 settimane è mostrata come esempio nel video. Sono preferiti ratti femmine e maschi più giovani.
1. Preparazione della coltura cellulare
NOTA: i tre metodi di coltura descritti in questo articolo sono generalmente applicabili a diversi tipi di cellule aderenti. Qui, i BMSC raccolti dagli svezzamenti dei ratti saranno introdotti come esempio per la preparazione della coltura cellulare. A seconda della loro rilevanza per applicazioni mediche specifiche, possono essere utilizzati diversi tipi di cellule, comprese le cellule primarie raccolte da animali o donatori umani e le linee cellulari da una banca cellulare / tissutale.
- Raccolta di BMSC da svezzamenti di ratto
NOTA: il diagramma schematico nella Figura 1 mostra i passaggi per raccogliere BMSC dallo svezzamento dei ratti.- Eutanasia del ratto Sprague Dawley (SD) per inalazione di CO2 .
- Rimuovere la pelle e i muscoli e i tessuti connettivi per sezionare il femore dal ratto eutanasizzato. Posizionare le ossa femorali in un tubo conico da 15 ml (polipropilene) contenente terreno di coltura cellulare. Posizionare i tubi conici sul ghiaccio fino al momento dell'esecuzione dell'estrazione cellulare.
NOTA: La tibia può anche essere utilizzata per raccogliere BMSC. Il terreno di coltura cellulare è il Modified Eagle Medium (DMEM) di Dulbecco integrato con il 10% di siero bovino fetale (FBS) e l'1% di penicillina/streptomicina (P/S). - Trasferire le ossa in una capsula di Petri nell'armadio di sicurezza biologica. Tagliare le estremità dell'osso usando una lama chirurgica e lavare il midollo osseo in un tubo conico da 50 ml (polipropilene) lavando la cavità del midollo osseo con terreni di coltura cellulare usando una siringa con un ago da 25 1/2 G.
NOTA: Inserire una siringa con un ago da 18 G nel supporto con midollo osseo. Lentamente e delicatamente, prendere ed erogare il mezzo per rompere il grande pezzo di midollo fino a quando non sono presenti agglomerati cellulari / tissutali visibili. - Filtrare la sospensione cellulare utilizzando un filtro da 70 μm, seguito da centrifugazione a 126 × g (1.000 giri /min) per 5 minuti per ottenere il pellet di cella.
- Aspirare il mezzo surnatante e ricostituire con 10 ml di materiale fresco. Pipettare delicatamente su e giù per risospescere le celle usando una pipetta sierologica da 10 ml.
- Pipettare la sospensione direttamente sul fondo interno di un pallone T-75 e aggiungere un supporto per portare il volume a 25 ml. Coltivare le cellule in un incubatore in un ambiente di coltura cellulare sterile standard (cioè 37 °C, atmosfera umidificata con il 5% di CO2 e il 95% di aria).
- Dopo 3-7 giorni, sciacquare via le cellule non aderenti aspirando il vecchio mezzo e reintegrando con mezzo fresco. Continuare a coltivare e nutrire le cellule con mezzo fresco fino a quando non sono pronte per il passaggio cellulare, il congelamento o l'uso in un esperimento.
- Manutenzione celle
- Cambiare regolarmente il terreno di coltura cellulare per rimuovere i prodotti di scarto cellulare e reintegrare i nutrienti approssimativamente a giorni alterni fino a quando le cellule sono confluenti al 90% -100%. Al 90% di confluenza, passaggio, congelamento o utilizzo delle cellule in un esperimento.
- Cellule che passano
NOTA: Passaging, noto anche come subculturazione, è un termine che si applica ogni volta che le cellule vengono trasferite da una coltura all'altra. Le cellule appena raccolte sono allo stadio di passaggio 0 (P0). Le quantità di soluzione di acido tripsina-etilendiamminatetraacetico (tripsina-EDTA) e i mezzi descritti in questo articolo sono per un pallone T-75.- Controllare le cellule al microscopio ottico per confermare che le cellule sono confluenti al 90%.
- Aspirare il mezzo dal pallone cellulare.
- Erogare 10 mL di soluzione salina tamponata con fosfato (PBS) nel matraccio utilizzando una pipetta sierologica. Scuotere delicatamente il pallone per risciacquare le cellule con PBS; aspirare tutti i PBS.
NOTA: questo passaggio funge da risciacquo aggiuntivo per garantire che durante il passaggio non vengano trasferite cellule morte o rifiuti cellulari. - Erogare 3 mL di tripsina-EDTA nel matraccio cellulare direttamente sulla superficie delle cellule. Scuotere delicatamente il pallone per assicurarsi che l'intera superficie con le cellule sia coperta dalla tripsina-EDTA.
- Posizionare il pallone cellulare con tripsina-EDTA nell'incubatrice per 5 minuti per consentire alle cellule di staccarsi.
- Dopo 5 minuti nell'incubatore, controllare le cellule al microscopio ottico per confermare che le cellule sono staccate. Se alcune celle non si sono staccate, picchiettare delicatamente il lato del pallone cellulare e controllare nuovamente il pallone.
- Aggiungere 9 mL di mezzo fresco al matraccio cellulare per diluire la tripsina-EDTA. Ciò fornisce proteine più accessibili per la tripsina-EDTA a cui legarsi invece di lisare le cellule.
- Pipettare le cellule in media e tripsina-EDTA ed erogarle in un tubo conico da 15 ml. Centrifugare le celle a 126 × g (1.000 giri/min) per 5 min.
- Senza disturbare il pellet cellulare, aspirare il mezzo con tripsina-EDTA.
- Aggiungere 5-10 ml di materiale fresco al tubo della centrifuga e risospese delicatamente le cellule nel mezzo usando una pipetta sierologica da 10 ml.
- Pipettare le cellule sospese in mezzo fuori dal tubo della centrifuga e dividere il volume in 2-3 palloni di coltura fresca. Aggiungere un supporto sufficiente per portare il volume medio totale a 25 ml per ogni matraccio.
NOTA: il rapporto di divisione durante la sottocoltura può variare a seconda dei tipi di cellule e delle caratteristiche di crescita specifiche. - Controllare le cellule al microscopio ottico e rimetterle nell'incubatrice.
- Celle di congelamento
- Controllare le cellule al microscopio ottico per confermare che le cellule sono confluenti al 90%.
- Ripetere i passaggi da 1.2.2.2 a 1.2.2.9.
- Aggiungere 900 μL di mezzo fresco al tubo della centrifuga con una micropipetta da 100-1000 μL. Lentamente e delicatamente risospese le cellule in mezzo usando la stessa micropipetta.
- Trasferire la sospensione cellulare da 900 μL in una crioviale. Aggiungere 100 μL di dimetilsolfossido (DMSO).
- Il prima possibile, posizionare il crioviale in un contenitore cilindrico di schiuma progettato per regolare la diminuzione della temperatura (vedere la Tabella dei materiali). Posizionare il contenitore di schiuma nel congelatore a -80 °C.
- Cellule di scongelamento
- Scongelare le cellule congelate a bagnomaria. Prendere un tubo conico sterile da 15 ml riempito con 5 mL di mezzo fresco, posizionare le celle nel tubo conico e centrifugare a 126 × g (1.000 giri / min) per 5 minuti.
- Aspirare il mezzo contenente DMSO.
- Aggiungere 5-10 mL di mezzo fresco al tubo conico da 15 ml di cellule. Lentamente e delicatamente pipettare su e giù per risospescere le cellule.
- Pipettare le celle sospese in mezzo dal tubo conico da 15 ml ed erogarle in un nuovo pallone T-75. Quando si erogano le celle, utilizzare un movimento di spazzamento per distribuire le cellule nel modo più uniforme possibile sul fondo del pallone cellulare.
- Aggiungere abbastanza terreno fresco per portare il volume medio totale a 25 ml per ogni pallone T-75.
- Controllare le cellule al microscopio ottico e riposizionare il pallone cellulare nell'incubatrice.
2. Preparazione e sterilizzazione dei campioni
- Preparazione del campione
- Utilizzare piastre trattate con colture tissutali come piastre da 6, 12, 24, 48 o 96 pozzetti per gli esperimenti di coltura cellulare descritti in questo articolo. Selezionare il tipo di piastre di coltura tissutale e il volume del mezzo in ciascun pozzetto in base a diversi progetti sperimentali come la dimensione del campione.
- Sterilizzare o disinfettare tutti i campioni biodegradabili prima della coltura cellulare.
NOTA: la disinfezione è accettabile per in vitro studi quando i campioni sono soggetti a cambiamenti chimici e/o superficiali in alcune condizioni di sterilizzazione che comportano calore elevato, ossidante e/o radicali. I metodi di sterilizzazione o disinfezione per diversi tipi di campioni variano a seconda delle diverse proprietà dei materiali, come polimeri, metalli e ceramiche. Il processo di sterilizzazione o disinfezione potrebbe comportare calore, gas, radiazioni, sostanze chimiche, alta pressione o una combinazione di questi.- Metalli biodegradabili
- In generale, utilizzare radiazioni ultraviolette (UV) per disinfettare i metalli biodegradabili per studi in vitro .
NOTA: Ad esempio, Zhang et al. hanno riferito che i campioni di lega di magnesio puro (Mg) e ZC21 Mg sono stati disinfettati sotto radiazioni UV per 4 ore prima di essere utilizzati negli studi sulle cellule1. Per gli studi in vivo , i campioni devono generalmente essere sterilizzati. Per molti metalli biodegradabili come il magnesio o le leghe di magnesio, l'autoclave con vapore dovrebbe essere evitata perché questi campioni potrebbero essere ossidati o corrosi in acqua6. Un piatto di quarzo è consigliato per la disinfezione UV perché fornisce una migliore trasparenza UV rispetto alla maggior parte dei bicchieri e delle materie plastiche. - Sterilizzare i campioni di lega Mg a calore secco in forno o in autoclave all'intervallo di temperatura di 100-200 °C.
NOTA: Poiché alcune leghe metalliche potrebbero ancora ossidarsi sulla superficie ad alte temperature nell'aria, in alcuni casi possono essere utilizzate radiazioni ad alta intensità come alternativa. Tuttavia, le radiazioni ad alta intensità come le radiazioni alfa o gamma dovrebbero essere evitate quando si sterilizzano sottili pellicole metalliche. Può causare lo spostamento dell'atomo all'interno dei materiali, cambiando la microstruttura dei materiali. - Utilizzare la sterilizzazione a gas con ossido di etilene (EtO) come metodo alternativo per i metalli biodegradabili sensibili al calore e alle radiazioni26.
- In generale, utilizzare radiazioni ultraviolette (UV) per disinfettare i metalli biodegradabili per studi in vitro .
- Ceramica biodegradabile
- Generalmente, disinfettare le ceramiche biodegradabili utilizzando radiazioni UV o soluzione di etanolo al 70% prima degli studi in vitro .
NOTA: Ad esempio, Liu et al. hanno riferito che i campioni di fosfato di calcio sono stati disinfettati tramite immersione in etanolo al 70% per 1 ora ed esposizione alla luce UV per 12 ore su ciascun lato prima di essere utilizzati in test di citocompatibilità in vitro27. - Utilizzare autoclavi per sterilizzare ceramiche biodegradabili se le alte temperature e il vapore acqueo non danneggiano le loro compostoni e microstrutture.
NOTA: Alcune ceramiche potrebbero essere interessate dall'autoclave. Ad esempio, il cambiamento di fase e l'irruvidimento superficiale sono stati riscontrati quando le ceramiche in zirconia stabilizzate con ittrio sono state autoclavate a 121 ° C per 15 minuti. Inoltre, i CPC non possono essere sterilizzati tramite autoclave con vapore perché i campioni reagiranno con l'acqua. - Utilizzare metodi di sterilizzazione alternativi come la radiazione di cobalto-60 per le suddette ceramiche di zirconia stabilizzate con ittrio e campioni CPC28.
- Generalmente, disinfettare le ceramiche biodegradabili utilizzando radiazioni UV o soluzione di etanolo al 70% prima degli studi in vitro .
- Polimeri biodegradabili
- In generale, disinfettare i polimeri biodegradabili utilizzando radiazioni UV o etanolo al 70% prima di utilizzarli in studi cellulari in vitro.
NOTA: Alcuni polimeri possono subire cambiamenti chimici sotto radiazioni UV. Per la sterilizzazione, può essere utilizzato il trattamento a raggi gamma come la radiazione Cobalto-60. Ad esempio, le polveri di amido sono state sterilizzate sotto radiazioni di cobalto-60 prima di essere utilizzate in studi cellulari in vitro29. - Materiali polimerici per autoclave in grado di resistere ad alte temperature e umidità.
NOTA: Ad esempio, i polimeri come il polipropilene possono essere autoclavati in quanto possono tollerare temperature di autoclave (cioè 121-134 °C). Alcuni polimeri come il policaprolattone (PCL) non possono essere autoclavati a causa dei loro punti di fusione relativamente bassi (cioè circa 60 °C)30. - Utilizzare il gas EtO per sterilizzare materiali polimerici sensibili alla sterilizzazione a caldo o radiazioni.
- In generale, disinfettare i polimeri biodegradabili utilizzando radiazioni UV o etanolo al 70% prima di utilizzarli in studi cellulari in vitro.
- Metalli biodegradabili
3. Metodi di coltura cellulare
- Metodi di coltura diretta
NOTA: il diagramma schematico nella Figura 2A mostra i passaggi del metodo di coltura diretta. In questo articolo, le BMSC sono state coltivate su una piastra derivata da Mg posta all'interno dei pozzetti di una piastra trattata con coltura tissutale a 12 pozzetti come esempio per illustrare il metodo di coltura.- Seguire i passaggi descritti nei passaggi 1.2.2.1-1.2.2.10 per ottenere la sospensione cellulare.
- Utilizzare un pallone confluente al 90% per determinare la concentrazione cellulare nella sospensione cellulare utilizzando un emocitometro. Diluire la sospensione cellulare utilizzando mezzo fresco a una concentrazione cellulare prescritta necessaria per lo studio cellulare in vitro.
NOTA: la densità di semina delle cellule è determinata dal progetto sperimentale. Ad esempio, densità cellulari di 2.000-40.000 cellule / cm2 sono state utilizzate in diversi studi cellulari con materiali biodegradabili. - Posizionare i campioni (piastra Mg) al centro delle piastre di coltura tissutale trattate con 12 pozzetti. Sequenzialmente, sciacquare le piastre di coltura con 2 mL di PBS e 2 mL di DMEM per calibrare la pressione osmotica in condizioni sterili. Aggiungere 3 ml di sospensione cellulare diluita in ciascun pozzetto sui campioni di interesse.
- Coltivare le cellule in un incubatore in condizioni di coltura cellulare standard per 24 ore.
NOTA: il tempo di coltura può essere più lungo o più breve di 24 ore a seconda del progetto sperimentale.
- Colture ad esposizione diretta
NOTA: il diagramma schematico nella Figura 2B mostra le fasi della coltura ad esposizione diretta.- Come descritto nei passaggi 3.1.1 e 3.1.2, preparare la sospensione cellulare con le concentrazioni di cellule richieste in base al disegno sperimentale per diversi tipi di cellule e applicazioni previste.
- Risciacquare le piastre di coltura con 2 mL di PBS e 2 mL di DMEM in sequenza per calibrare la pressione osmotica in condizioni sterili. Aggiungere 3 ml di sospensione cellulare diluita in ciascun pozzetto. Coltivare le cellule nell'incubatore umidificato in condizioni di coltura cellulare standard per 24 ore o fino a quando le cellule raggiungono il 50-80% di confluenza.
NOTA: il livello di confluenza cellulare può variare in base ai diversi tipi di cellule e al design sperimentale. - Dopo 24 ore, sciacquare le cellule nella piastra del pozzo con PBS usando una pipetta per rimuovere le cellule morte galleggianti.
- Posizionare i campioni disinfettati o sterilizzati direttamente sulle cellule aderenti. Aggiungere 3 ml di mezzo fresco in ogni pozzetto.
- Coltivare le cellule in condizioni di coltura cellulare standard per altre 24 ore.
NOTA: il tempo di coltura può essere più lungo o più breve di 24 ore a seconda del progetto sperimentale.
- Colture di esposizione
NOTA: il diagramma schematico nella Figura 2C mostra i passaggi del metodo di coltura dell'esposizione.- I passaggi iniziali per la preparazione cellulare sono gli stessi della coltura di esposizione. Come descritto nei passaggi 3.1.1 e 3.1.2, preparare la sospensione cellulare con le cellule desiderate. Analogamente ai passaggi 3.2.1 e 3.2.2, seminare le cellule nella piastra del pozzo alla densità desiderata e coltivarle in un incubatore in condizioni di coltura cellulare standard per 24 ore.
- Dopo 24 ore, sciacquare le cellule aderenti con PBS per rimuovere le cellule morte galleggianti, seguito dall'aggiunta di 3 ml di mezzo fresco in ciascun pozzetto.
- Successivamente, posizionare i campioni negli inserti del pozzetto con una dimensione dei pori della membrana di 0,4 μm e posizionare gli inserti del pozzo con i campioni in ciascun pozzetto con le cellule.
- Coltivare le cellule in condizioni di coltura cellulare standard per altre 24 ore.
NOTA: il tempo di coltura può essere più lungo o più breve di 24 ore a seconda del progetto sperimentale.
4. Caratterizzazione post-colturale delle cellule
NOTA: per la coltura diretta e la coltura ad esposizione diretta, fissare, macchiare, visualizzare e analizzare le cellule aderenti sia su piastre di pozzo che su campioni. Per la coltura di esposizione, analizzare le cellule aderenti alle piastre del pozzo.
- Fissazione cellulare
- Raccogliere il mezzo di postcoltura da ciascun pozzo in un corrispondente tubo conico da 15 ml per ulteriori analisi. Raccogliere tutti i campioni dopo la coltura per ulteriori analisi.
- Risciacquare le cellule aderenti su entrambi i campioni e le piastre del pozzo 3 volte usando PBS.
- Aggiungere 1 mL di paraformaldeide al 4% (PFA, 10% formalina tamponata neutra) in ogni piastra del pozzo. Rimettere il coperchio sulla piastra del pozzo e lasciare che il PFA reagisca per 20 minuti.
- Dopo 20 minuti, aspirare il PFA ed erogarlo in una bottiglia di scarto. Risciacquare la piastra del pozzo 3 volte usando PBS per rimuovere il PFA e trasferire i rifiuti nella bottiglia di scarico.
- Colorazione cellulare
- Preparare le scorte di lavoro degli agenti coloranti seguendo le istruzioni dei produttori.
NOTA: Ad esempio, Alexa Fluor 488 Phalloidin viene utilizzato per colorare F-actina e 4′, 6-diamidino-2-fenilide (DAPI) viene utilizzato per macchiare i nuclei cellulari. Il tempo di colorazione può essere ridotto se i campioni si degradano rapidamente nelle soluzioni coloranti. - Aggiungere 200-400 μL di agente colorante alexa Fluor 488 Phalloidin diluito a ciascun pozzetto per coprire le cellule sulla piastra del pozzo e sul campione. Avvolgere la piastra del pozzo in un foglio di alluminio per evitare l'esposizione alla luce e consentire ad Alexa Fluor 488 Phalloidin di reagire per 20 minuti a temperatura ambiente.
- Raccogliere l'agente colorante Alexa Fluor 488 Phalloidin e dispensarlo nella bottiglia di scarico corrispondente. Risciacquare la piastra del pozzo 3 volte utilizzando PBS per rimuovere l'eccesso di Alexa Fluor 488 Phalloidin ed erogare il PBS utilizzato nella bottiglia di scarico corrispondente.
- Aggiungere 200-400 μL di DAPI diluito a ciascun pozzetto per coprire le cellule nel pozzetto e sul campione. Avvolgere la piastra del pozzetto in un foglio di alluminio e lasciare che il DAPI reagisca per 5 minuti a temperatura ambiente.
- Raccogliere il DAPI ed erogarlo nella bottiglia di scarico corrispondente. Risciacquare la piastra del pozzo 3 volte usando PBS per rimuovere il DAPI ed erogare il PBS usato nella bottiglia di scarico corrispondente.
- Preparare le scorte di lavoro degli agenti coloranti seguendo le istruzioni dei produttori.
- Imaging cellulare
- Dopo la colorazione, visualizzare le cellule utilizzando un microscopio a fluorescenza. Quando possibile, scatta immagini a contrasto di fase delle cellule oltre alle immagini a fluorescenza. Immagine delle cellule sui campioni biodegradabili il prima possibile o immediatamente dopo la colorazione per evitare o ridurre possibili cambiamenti causati dalla continua degradazione dei campioni. Conservare le cellule nelle piastre del pozzo in una soluzione tampone a 2-8 °C dopo la fissazione e visualizzare le cellule il prima possibile dopo la colorazione per evitare la perdita di segnali di fluorescenza.
- Per la coltura diretta e la coltura ad esposizione diretta, fotografare e valutare due tipi di cellule: (1) le cellule sui campioni (a diretto contatto con i campioni) e (2) le cellule aderenti sulla piastra del pozzo che circonda i campioni (contatto indiretto con i campioni), come mostrato nella Figura 3A.
- Per la coltura dell'esposizione, come mostrato nella Figura 3B, utilizzare una guida all'immagine quando si acquisiscono le immagini a fluorescenza delle cellule per determinare se la risposta cellulare sarebbe diversa in risposta al gradiente di degradazione dinamica dei campioni. Visualizzare e analizzare separatamente le celle situate nell'area all'interno dell'anello interno (a 3,5 mm dal centro) e dell'anello esterno (7 mm dal centro).
NOTA: la guida immagine viene utilizzata per definire la distanza tra le celle e i campioni. - Per ogni campione e pozzo nelle piastre di coltura, prelevare in modo casuale almeno cinque immagini da ciascuna area di interesse in cui le cellule sono in contatto diretto o indiretto con i campioni a una distanza predefinita.
- Analisi delle immagini
- Per tutte le immagini cellulari ottenute dal passaggio 4.3, quantificare la morfologia cellulare misurando l'area di diffusione cellulare e le proporzioni utilizzando software come ImageJ per l'analisi delle immagini.
- Contare il numero di celle in ogni area dell'immagine. Calcolare la densità di adesione cellulare in condizioni di contatto diretto e indiretto come il numero di celle per unità di area.
5. Analisi post-culturali di media e campioni
- Misurare il pH del mezzo di postcoltura.
NOTA: alcuni campioni modificano il valore di pH del mezzo durante la loro degradazione. Ad esempio, i metalli biodegradabili come le leghe di magnesio di solito aumentano il valore del pH del mezzo a causa della loro degradazione31. Al contrario, i polimeri biodegradabili come il PLGA spesso diminuiscono il valore del pH del mezzo quando si degradano32. La misurazione del valore del pH del mezzo di postcoltura può indicare la degradazione di questi campioni in vitro.- Prima della fissazione cellulare, raccogliere il mezzo di postcoltura come nel passaggio 4.1.1.
- Misurare i valori di pH del mezzo di postcoltura in ciascun pozzetto immediatamente dopo la raccolta, utilizzando un pHmetro precalibrato.
NOTA: Il pH del fluido può andare alla deriva nel tempo a causa di condizioni ambientali come il livello di CO2 e la temperatura, che dovrebbero essere prese in considerazione.
- Analizzare le composizioni del mezzo per il comportamento di degradazione dei campioni biodegradabili. Per alcuni campioni che causano un cambiamento di colore del mezzo, misurare il valore di densità ottica (O.D.) del mezzo di postcoltura utilizzando uno spettrofotometro o un lettore di micropiastre per determinare il comportamento di degradazione. In alternativa, utilizzare la spettroscopia ultravioletta-visibile (UV-VIS) e la spettroscopia infrarossa a trasformata di Fourier attenuata dalla riflettanza totale (FTIR-ATR) per analizzare i prodotti di degradazione nel mezzo di post-coltura.
NOTA: misurare i prodotti di degradazione nel mezzo post-coltura è utile per comprendere il comportamento di degradazione dei campioni. Uno degli approcci più comuni è quello di misurare gli ioni di interesse nel mezzo di post-coltura utilizzando uno spettrometro ad emissione ottica al plasma accoppiato induttivamente (ICP-OES). L'ICP-OES può essere utilizzato per misurare le composizioni del mezzo di postcoltura di metalli e ceramiche, ma potrebbe non essere adatto per i polimeri. I polimeri di solito sono costituiti da carbonio, idrogeno e ossigeno e una quantificazione accurata di questi elementi è difficile per ICP-OES.- Seguendo la fase 5.1.2 per la misurazione del pH, raccogliere e diluire il mezzo utilizzando un fattore di diluizione desiderabile per misurazioni ottimali delle concentrazioni ioniche.
- Misurare le concentrazioni degli ioni di interesse nel mezzo di postcoltura utilizzando un ICP-OES.
- Analisi post-coltura di campioni
NOTA: Dopo lo studio cellulare in vitro , i campioni biodegradabili possono cambiare in dimensioni, massa, morfologia superficiale, microstruttura e composizione. L'analisi post-coltura dei campioni aiuta a comprendere il meccanismo di degradazione dei campioni.- Dopo la coltura cellulare, scatta le fotografie dei campioni per mostrare possibili cambiamenti nelle dimensioni del campione, nel colore, nella morfologia e in altre caratteristiche visibili.
- Asciugare o disidratare i campioni di post-coltura e misurare la massa, la dimensione e il volume del campione per quantificare eventuali cambiamenti di massa, dimensione e volume.
- Utilizzare un microscopio elettronico a scansione (SEM) per caratterizzare la microstruttura e la morfologia dei campioni. Utilizzare la spettroscopia a raggi X a dispersione di energia (EDX) e la diffrazione a raggi X (XRD) per caratterizzare la composizione e la fase dei prodotti di degradazione sui campioni. Utilizzare FTIR-ATR per rilevare il legame chimico sulle superfici del campione.
Risultati
La Figura 4 mostra le immagini rappresentative di fluorescenza delle BMSC in condizioni di contatto diretto e indiretto utilizzando diversi metodi di coltura. La figura 4A,B mostra i BMSC in condizioni di contatto diretto e indiretto dopo la stessa coltura diretta di 24 ore con leghe di magnesio ZC211. Le leghe ZC21 sono costituite dal 97,5% in peso di magnesio, dal 2% in peso di zinco e dallo 0,5% di calcio in peso. Le cellule che non hanno alcun contatto diretto con i campioni di lega ZC21 si diffondono meglio di quelle che hanno un contatto diretto con i campioni. Come mostrato nella Figura 4C,D, le cellule in condizioni di contatto diretto e indiretto presentano tutte una morfologia normale dopo un'esposizione diretta di 24 ore con idrogel di acido ialuronico (HyA) reticolati da ioni Fe3+. Tuttavia, il numero di cellule nella condizione di contatto indiretto è inferiore a quello nella condizione di contatto diretto33. Un altro studio ha riportato gli effetti della degradazione delle leghe ZSr41 (ф = 1,1 mm) sulle BMSC dopo una coltura di esposizione di 24 ore19. Le leghe ZSr41 sono costituite dal 95% in peso di magnesio, dal 4% in peso di zinco e dall'1% in peso di stronzio. La Figura 4E mostra le immagini rappresentative di fluorescenza di BMSC aderenti al pozzo di coltura in una posizione a 3,5 mm di distanza dal centro del pozzo, dopo una coltura di esposizione di 24 ore con i pin biodegradabili19.
La Figura 5 mostra i dati di esempio per la densità di adesione cellulare quantificata. Come mostrato nella Figura 5A, nella coltura di esposizione diretta (24h_DE) di 24 ore, le BMSC a diretto contatto con lo ZC21 hanno una densità di adesione cellulare significativamente maggiore rispetto a qualsiasi altro gruppo. Nella coltura diretta di 24 ore (24h_D), le BMSC a diretto contatto con lo ZC21 mostrano una densità di adesione cellulare significativamente più elevata rispetto al gruppo Mg, significativamente inferiore al gruppo di riferimento Glass, ma nessuna differenza statistica rispetto al controllo della lega Ti (T64). Come mostrato nella Figura 5B, nella condizione di contatto indiretto della coltura ad esposizione diretta, la densità di adesione BMSC è significativamente più alta per il gruppo ZC21 rispetto al gruppo Mg. Tuttavia, non mostra differenze significative rispetto ai gruppi di controllo T64 e solo cellule. Nella condizione di contatto indiretto della coltura diretta, la densità di adesione BMSC è significativamente più alta per il gruppo ZC21 rispetto al gruppo Mg, ma non mostra differenze significative rispetto ai gruppi di controllo T64 e solo cellule1.
La Figura 6A mostra il valore del pH del mezzo di postcoltura dopo la coltura di esposizione diretta e la coltura diretta. Per la coltura a esposizione diretta, i valori di pH del medio intervallo da 8,3 a 8,4 per tutti i campioni. Nella coltura diretta, i valori di pH di media gamma da 7,9 a 8 tra i gruppi. La Figura 9B mostra la concentrazione di ioni Mg2+ nel mezzo di postcoltura. Sia nella coltura ad esposizione diretta che in quella a coltura diretta, le concentrazioni di ioni Mg2+ nei gruppi ZC21 e Mg sono significativamente più elevate rispetto a qualsiasi altro gruppo di controllo1. La Figura 7 mostra i modelli XRD per ZSr41 e Mg puro dopo una coltura di esposizione di 3 giorni. Nella Figura 7A, le fasi cristalline di Mg, Ca(OH)2, ZnO, MgO∙H2O, Ca(HPO4)(H2O)2 e Ca5(PO4)3(OH) (cioè idrossiapatite o HA), Mg17Sr2 si trovano sulla superficie di ZSr41. Nella Figura 7B, le fasi cristalline di Mg, Ca(OH)2, Mg3(PO4)2, Mg7(PO4)2(OH)8, Ca2P2O7∙5H2O si trovano sulla superficie di Mg19 puro. La Figura 8A mostra la sovrapposizione di immagini SEM e mappe EDX della composizione elementare superficiale per Mg rivestito di MgO e il controllo dei substrati di Mg e del vetro dopo 24 ore di coltura diretta con BMSC. La Figura 8B mostra la composizione elementare quantitativa superficiale delle superfici del campione, indicando diverse deposizioni formate durante la coltura cellulare34.

Figura 1: Diagramma schematico che mostra i passaggi per raccogliere BMSC dallo svezzamento dei ratti. Questa cifra è stata modificata da 35. Abbreviazione: BMSC = cellule staminali mesenchimali derivate dal midollo osseo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Diagramma schematico che mostra i tre metodi di coltura cellulare. (A) Coltura diretta, (B) coltura ad esposizione diretta e (C) coltura di esposizione. Questa cifra è stata modificata da 36. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Diagrammi schematici che mostrano la coltura diretta e la coltura ad esposizione diretta. (A) Cellule a contatto diretto e condizioni di contatto indiretto in coltura diretta e coltura ad esposizione diretta. (B) Utilizzo di una guida di imaging per scattare foto delle cellule aderenti alla piastra del pozzo a diverse distanze dal centro dei campioni in coltura di esposizione. La Figura 3B è modificata da 37. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagini rappresentative di fluorescenza di BMSC. (A, B) Condizioni di contatto diretto e indiretto dopo una coltura diretta di 24 ore con leghe ZC21. (C, D) Coltura ad esposizione diretta con idrogel HyA. (E) Sulla piastra di coltura dopo una coltura di esposizione di 24 ore con leghe ZSr41. Le barre della scala = 100 μm. A e B sono riprodotte da 1; C e D sono riprodotti da 33; ed E è riprodotto da 19. Abbreviazioni: BMSC = cellule staminali mesenchimali derivate dal midollo osseo; HyA = acido ialuronico. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Risultati quantitativi per la densità di adesione cellulare delle BMSC. (A) Contatto diretto e (B) condizioni di contatto indiretto dopo la coltura ad esposizione diretta di 24 ore (24 h_DE) e la coltura diretta (24 h_D). Questa figura è riprodotta da 1. Abbreviazioni: BMSC = cellule staminali mesenchimali derivate dal midollo osseo; DE = coltura ad esposizione diretta; D = cultura diretta. Fare clic qui per visualizzare una versione più grande di questa figura.
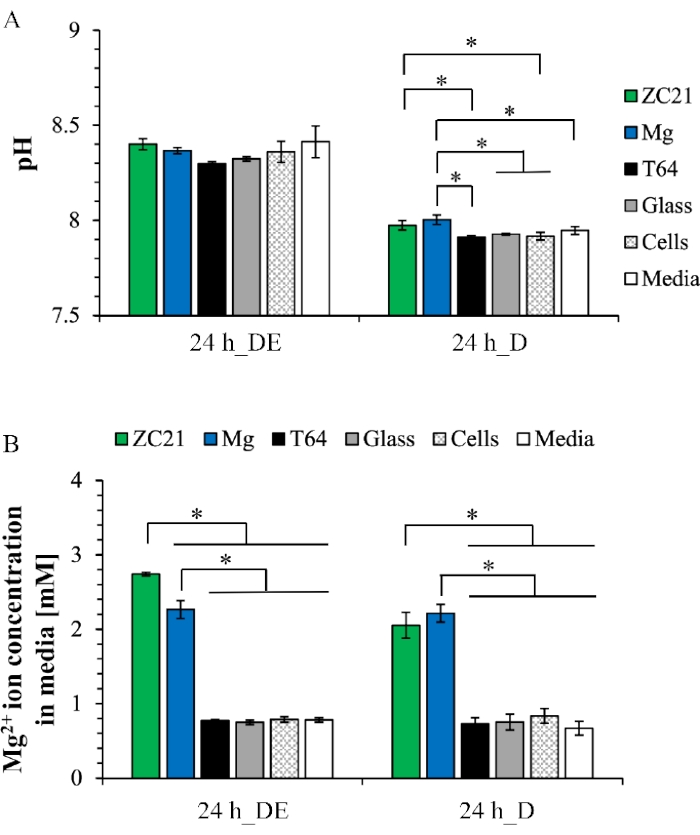
Figura 6: Risultati rappresentativi per le analisi post-coltura del mezzo dopo la coltura di esposizione diretta di 24 ore e la coltura diretta. (A) valori di pH e (B) concentrazioni di ioni Mg2+ . Questa figura è riprodotta da 1. Abbreviazioni: DE = coltura ad esposizione diretta; D = cultura diretta. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Risultati rappresentativi post-coltura per analisi di fase di campioni metallici biodegradabili dopo 3 giorni di coltura con BMSC. (A) Spettro di diffrazione a raggi X per ZSr41. (B) Spettro XRD per Mg puro. Questa figura è riprodotta da 19. Abbreviazioni: BMSC = cellule staminali mesenchimali derivate dal midollo osseo; XRD = diffrazione a raggi X. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Risultati rappresentativi della postcoltura per le analisi superficiali di campioni dopo 24 ore di coltura diretta con BMSC, compresa la microstruttura superficiale, la morfologia e la composizione. (A) Sovrapposizione di immagini SEM e mappe EDX della composizione elementare superficiale per MgO rivestito di Mg., controllo Mg non rivestito e riferimento al vetro. (B) Composizione elementare superficiale (at. %) quantificata dalle analisi EDX. Barre di scala = 200 μm. Riprodotto da 34. Abbreviazioni: BMSC = cellule staminali mesenchimali derivate dal midollo osseo; SEM = microscopia elettronica a scansione; EDX = spettroscopia a raggi X a dispersione di energia. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella supplementare 1: Meccanismi di degradazione, prodotti e tassi per diversi tipi di materiali e i risultati raccolti per l'analisi del campione e del mezzo di post-coltura. Fare clic qui per scaricare questa tabella.
Discussione
Diversi metodi di coltura cellulare possono essere utilizzati per valutare la citocompatibilità in vitro di biomateriali di interesse per vari aspetti delle applicazioni in vivo. Questo articolo dimostra tre metodi di coltura in vitro , vale a dire, coltura diretta, coltura ad esposizione diretta e coltura di esposizione, per imitare diversi scenari in vivo in cui vengono utilizzati materiali implantari biodegradabili all'interno del corpo umano. Il metodo di coltura diretta viene utilizzato principalmente per valutare il comportamento delle cellule appena seminate direttamente aderenti e circostanti i materiali dell'impianto. Il metodo di coltura ad esposizione diretta imita lo scenario in vivo in cui i materiali dell'impianto entrano in contatto diretto con le cellule e i tessuti stabiliti. Il metodo di coltura dell'esposizione può essere utilizzato per mostrare come i prodotti di degradazione dei materiali implantari e i cambiamenti nel microambiente locale possono influenzare le cellule e i tessuti stabiliti che non sono direttamente in contatto con i materiali dell'impianto.
Nella coltura diretta, vengono valutate le cellule appena seminate in condizioni di contatto diretto e indiretto. Nella coltura ad esposizione diretta, le cellule stabilite possono essere valutate in condizioni di contatto sia diretto che indiretto. Nella coltura di esposizione, possono essere valutate solo le cellule stabilite in condizioni di contatto indiretto. Le cellule appena seminate in condizioni di contatto diretto nella coltura diretta sono influenzate dalle proprietà del materiale e dai cambiamenti indotti dal materiale nel mezzo, come i cambiamenti nella concentrazione di ioni e nel valore del pH.
Le proprietà del materiale sopra menzionate possono includere la morfologia della superficie, l'idrofilia, l'energia libera dalla superficie, la rigidità e la composizione. Le cellule appena seminate in condizioni di contatto indiretto nel metodo di coltura diretta e tutte le cellule stabilite nei metodi di coltura di esposizione diretta e di coltura di esposizione sono principalmente influenzate dai cambiamenti indotti dal materiale nel mezzo. I tre diversi metodi descritti in questo articolo sono più vicini allo scenario pratico dell'ambiente in vivo rispetto ai metodi convenzionali come il metodo dell'estratto medio. Il metodo dell'estratto medio valuta solo la citotossicità dei prodotti di degradazione del materiale e non riflette il processo dinamico di degradazione del campione. Nei metodi di coltura descritti in questo articolo, poiché le cellule vengono coltivate con i materiali implantari, il cambiamento dinamico dei materiali biodegradabili e dell'ambiente del mezzo può influenzare le cellule in situ.
Sebbene nessuno studio in vitro possa sostituire completamente gli studi in vivo , gli studi in vitro sono complementari e possono fornire dati preziosi in modo economico ed efficiente. Gli studi in vivo di solito includono tutte le variabili multiple in un modello, mentre la coltura cellulare in vitro può studiare gli effetti di un singolo fattore sulle interazioni cellula-materiale. I metodi introdotti in questo articolo possono imitare diversi scenari dei pertinenti studi in vivo . Possiamo creare i collegamenti tra diverse variabili per fornire integratori per studi in vivo . Un modello in vivo di solito include solo lo stesso tessuto in un tipo animale. Tuttavia, gli studi in vitro possono includere diversi tipi di cellule in una coltura, che può studiare gli effetti combinati di diverse variabili sulle interazioni cellula-materiale. Inoltre, è relativamente difficile studiare gli effetti dei cambiamenti ambientali dinamici sulle interazioni cellula-materiale in modelli in vivo . I metodi descritti in questo articolo possono studiare gli effetti dei cambiamenti dinamici come le concentrazioni di ioni nel mezzo sul comportamento cellulare38.
I metodi presentati in questo articolo sono applicabili per comprendere la citocompatibilità in vitro di tutti i tipi di materiali, inclusi polimeri, metalli, ceramiche, compositi e nanoparticelle, e determinare le loro interazioni con diverse cellule, batteri o funghi in base alle applicazioni previste. Ad esempio, Xu et al. hanno valutato la citocompatibilità in vitro di idrogel a base di HyA con BMSC tramite il metodo di coltura ad esposizione diretta33. Le densità di adesione cellulare e le morfologie cellulari sono state analizzate in condizioni di contatto diretto e indiretto. La citotossicità dei compositi idrogel a base di HyA potrebbe essere correlata alle concentrazioni di ioni Fe3+ e H+ rilasciati dagli idrogel HyA reticolati durante l'esperimento di coltura cellulare. Tian et al. hanno coltivato cellule uroteliali umane (HUC) con quattro diverse leghe di Mg per 24 ore e 48 ore utilizzando il metodo di coltura di esposizione e i loro prodotti di degradazione insolubili di MgO e Mg (OH) 2 per 24 ore utilizzando colture di esposizione diretta per studiare la citocompatibilità e i comportamenti di degradazione delle leghe Mg contenenti zinco (Zn) e stronzio (Sr) per una potenziale applicazione di stent ureterale39 . In questo studio, ZSr41_B contenenti il 4% in peso di Zn e lo 0,5% in peso di Sr hanno una migliore citocompatibilità con gli HUC tra tutte le altre leghe mg-4Zn-xSr in entrambe le colture di esposizione a 24 ore e 48 ore. I risultati hanno anche mostrato che non sono state trovate cellule aderenti visibili sulla piastra del pozzo quando le concentrazioni di ossido di magnesio (MgO) e idrossido di magnesio (Mg (OH) 2) hanno superato 1,0 mg / mL dopo 24 ore di coltura di esposizione diretta. Pertanto, Tian et al. hanno concluso che la riduzione dei tassi di degradazione delle leghe Mg è necessaria per controllare i possibili effetti collaterali verso la futura traduzione clinica. Wetteland et al. hanno creato un nanocomposito a base di polimeri disperdendo idrossiapatite (nHA) e nanoparticelle nMgO in un polimero PLGA biodegradabile40. Questo nanocomposito è stato studiato coltivando BMSC con campioni diversi utilizzando il metodo della coltura diretta. I risultati hanno dimostrato che una migliore dispersione delle nanoparticelle nel polimero potrebbe migliorare l'adesione BMSC su nHA / PLGA ma ridurre la vitalità cellulare su nMgO / PLGA. Sulla base dei risultati di studi cellulari in vitro, Wetteland et al. hanno riportato preziose informazioni per l'ingegneria di nanocompositi ceramici / polimerici ottimali per diverse applicazioni biomediche.
Le morfologie cellulari e i numeri cellulari possono essere osservati e quantificati in immagini a fluorescenza utilizzando software per l'analisi quantitativa delle immagini come ImageJ. Possiamo studiare gli effetti di diversi materiali sull'adesione e la morfologia cellulare quantificando le densità di adesione cellulare, le proporzioni cellulari e le aree di diffusione cellulare per diversi gruppi di campioni. La morfologia delle cellule del gruppo di controllo in bianco, in cui solo le cellule sono coltivate in mezzo, potrebbe servire come standard di riferimento senza alcuna influenza da parte dei materiali campione. Possiamo determinare se i materiali campione influenzerebbero l'adesione e la morfologia cellulare in vitro confrontando le densità di adesione cellulare e le morfologie cellulari dei gruppi campione con quelle del controllo in bianco. L'area di diffusione cellulare rivela la preferenza dell'adesione cellulare alla superficie del campione, mostrando come le cellule interagiscono con i materiali campione. In questo articolo, abbiamo ridotto il tempo di reazione per la colorazione DAPI in modo inferiore al tempo ottimale raccomandato dal fornitore perché i campioni biodegradabili, come il magnesio puro, si degradano rapidamente in soluzioni acquose. La morfologia delle cellule aderenti ai materiali biodegradabili può cambiare se il processo di colorazione richiede troppo tempo e il tempo di esposizione all'acqua è troppo lungo per i campioni. Inoltre, per le cellule aderenti a materiali biodegradabili, le immagini cellulari devono essere prese tempestivamente per ridurre eventuali cambiamenti nell'adesione e nella morfologia cellulare a causa della degradazione del campione.
Oltre a raccogliere i risultati delle cellule, le analisi dei terreni di post-coltura e dei campioni sono importanti perché forniranno dati preziosi per analizzare il meccanismo di degradazione, i prodotti e le velocità dei materiali implantari. Ad esempio, i polimeri biodegradabili come il PLGA possono generare sottoprodotti di degradazione acida come gli acidi idrossile-carbossilico monomerici o oligomerici durante la coltura cellulare32, che possono influenzare la crescita e la proliferazione cellulare. Al contrario, i metalli biodegradabili, come il magnesio e le sue leghe, producono ioni idrossido e idrogeno gassoso durante la loro degradazione31, che possono aumentare significativamente il pH locale e una grave alcalinità può avere effetti negativi sulle funzioni cellulari locali. Varie ceramiche biodegradabili possono anche aumentare il pH del mezzo41. In generale, le cellule richiedono un intervallo di pH specifico nel terreno di coltura per funzionare correttamente ed è noto che valori di pH aumentati o diminuiti nei fluidi corporei sono dannosi per la vita42. Misurare il pH del mezzo di post-coltura è prezioso per comprendere qualsiasi potenziale danno che i materiali campione biodegradabili possono causare nella coltura cellulare. Pertanto, è necessario misurare il valore del pH del mezzo di post-coltura per comprendere i potenziali meccanismi di come questi materiali biodegradabili influenzano le cellule.
È importante misurare le concentrazioni ioniche cruciali nel mezzo di post-coltura per i materiali biodegradabili. Ad esempio, Cortez Alcaraz et al. hanno misurato le concentrazioni di ioni Mg2 + e Ca2 + del mezzo di post-coltura quando hanno studiato campioni di magnesio rivestiti di nanoparticelle di ossido di magnesio utilizzando la coltura diretta con BMSC34. Le concentrazioni di ioni magnesio indicano le proprietà di degradazione di diversi campioni in vitro durante la coltura cellulare e le concentrazioni di ioni calcio possono fornire informazioni sulla deposizione di calcio durante la proliferazione cellulare. Xu et al. hanno misurato le concentrazioni di ioni Fe3+ del mezzo di post-coltura quando hanno studiato gli idrogel HyA utilizzando colture ad esposizione diretta con BMSC. Hanno utilizzato ioni Fe3+ per regolare le densità di reticolazione di HyA33. Gli ioni Fe3+ possono ridurre il valore del pH del terreno di coltura e alte concentrazioni di ioni Fe3+ potrebbero essere tossiche per le cellule. Pertanto, è importante misurare le concentrazioni degli ioni di interesse per migliorare la citocompatibilità dei materiali biodegradabili e dei loro prodotti di degradazione associati.
Potremmo raccogliere dati diversi per analizzare le interazioni cellula-materiale per materiali diversi. Ad esempio, come mostrato nella Tabella supplementare 1, le leghe Mg si degradano reagendo con l'acqua e i prodotti di degradazione possono includere ioni Mg2+ e OH- , gas H2 e alcuni altri prodotti di degradazione insolubili come Mg(OH)2. XRD, SEM ed EDX, che potrebbero essere utilizzati per determinare la deposizione minerale formata sul materiale. Possiamo studiare gli effetti della concentrazione di ioni Mg2+ e i valori di pH nel mezzo sui comportamenti cellulari. Inoltre, possiamo utilizzare questi risultati per studiare l'evoluzione del gas durante la degradazione dei metalli. Studi in vitro hanno riportato che il livello critico di tolleranza del gas H2 è <0,01 ml / cm2 / die, e questo è stato ampiamente utilizzato per lo screening delle leghe di magnesio per applicazioni implantari temporanee. Essenzialmente, la quantità di evoluzione del gas dipende dal tasso di degradazione delle leghe di magnesio. In un altro esempio, PLGA si degrada a causa dell'idrolisi dei suoi legami estere in presenza di acqua. I prodotti di degradazione dell'acido lattico e dell'acido glicolico, così come i valori di pH nel mezzo, potrebbero essere studiati per analizzare le interazioni cellula-materiale. I metodi descritti in questo articolo includono la misurazione degli ioni rilasciati e dei valori di pH nel terreno di coltura cellulare e il cambiamento di massa dei materiali, che può essere utilizzato per stimare il tasso di degradazione dei materiali.
Materiali diversi di solito si comportano in modo diverso in vitro e in vivo e i metodi per gli studi di citocompatibilità devono essere selezionati in base all'ambiente di applicazione e al tipo di materiale. Per le applicazioni ortopediche, è auspicabile valutare le interazioni tra le cellule ossee e gli impianti rilevanti quando sono in contatto diretto tra loro. Il metodo di coltura diretta potrebbe essere utilizzato per studiare le interazioni tra le cellule appena seminate e l'impianto. Nelle applicazioni cardiovascolari, poiché le cellule stabilite entreranno direttamente o indirettamente in contatto con i materiali dello stent impiantato, possono essere utilizzati metodi di coltura di esposizione diretta e di coltura di esposizione per valutare la citocompatibilità dei metalli biodegradabili per applicazioni cardiovascolari. Riteniamo che i metodi in vitro descritti in questo articolo siano in grado di fornire prove iniziali della citocompatibilità dei materiali implantari biodegradabili. I metodi di coltura devono essere modificati per materiali diversi con vari meccanismi, prodotti e tassi di degradazione. Ad esempio, il tempo di coltura per diversi materiali può essere modificato in base ai vari tassi di degradazione dei diversi tipi di materiali. Risultati diversi possono essere raccolti in base a diversi meccanismi di degradazione e prodotti dei materiali.
In sintesi, è importante analizzare qualitativamente e quantitativamente le cellule, i mezzi e i materiali campione, prima e dopo la coltura cellulare in vitro , per comprendere gli effetti dei materiali implantari biodegradabili e dei loro prodotti di degradazione sulla citocompatibilità. I tre metodi di coltura presentati in questo articolo possono essere utilizzati per studiare una vasta gamma di materiali biodegradabili, tra cui polimeri biodegradabili, ceramiche e metalli per impianti medici e applicazioni di ingegneria tissutale. Questi studi cellulari in vitro sono preziosi per lo screening di materiali biodegradabili, ottimizzando la progettazione di dispositivi impiantabili e scaffold nella fase iniziale dello sviluppo del prodotto e riducendo la potenziale tossicità per le cellule.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Gli autori apprezzano il sostegno finanziario della National Science Foundation degli Stati Uniti (premio NSF CBET 1512764 e NSF PIRE 1545852), del National Institutes of Health (NIH NIDCR 1R03DE028631), della University of California (UC) Regents Faculty Development Fellowship e del Committee on Research Seed Grant (Huinan Liu) e UC-Riverside Dissertation Research Grant (Jiajia Lin). Gli autori apprezzano la Central Facility for Advanced Microscopy and Microanalysis (CFAMM) presso l'UC-Riverside per l'uso di SEM / EDS e il Dr. Perry Cheung per l'uso di strumenti XRD. Gli autori apprezzano anche Thanh Vy Nguyen e Queenie Xu per il montaggio parziale. Gli autori desiderano anche ringraziare Cindy Lee per aver registrato la narrazione per il video. Eventuali opinioni, risultati e conclusioni o raccomandazioni espresse in questo articolo sono quelle degli autori e non riflettono necessariamente le opinioni della National Science Foundation o del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | VWR | 490019-704 | |
| 12-well tissue-culture-treated plates | Thermo Fisher Scientific | 353043 | |
| 15 mL conical tube (Polypropylene) | VWR | 89039-666 | |
| 18 G needle | BD | 305196 | |
| 25½ G needle | BD | 305122 | |
| 4′,6-diamidino-2- phenylindole dilactate (DAPI) | Invitrogen | D3571 | |
| 50 mL conical tube (Polypropylene) | VWR | 89039-658 | |
| 70 μm nylon strainer | Fisher Scientific | 50-105-0135 | |
| Alexa Flour 488-phalloidin | Life technologies | A12379 | |
| Biological safety cabinet | LABCONCO | Class II, Type A2 | |
| Centrifuge | Eppendorf | Rotor F-35-6-30, Centrifuge5430 | |
| Clear Fused Quartz Round Dish | AdValue Technology | FQ-4085 | |
| CO2 incubator | SANYO | MCO-19AIC | |
| CoolCell Freezer Container | Corning | 432000 | foam container designed to regulate temperature decrease |
| Cryovial | Thermo Fisher Scientific | 5000-1020 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 472301 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Sigma-Aldrich | D5648 | |
| EDX analysis software | Oxford Instruments | AztecSynergy | |
| Energy dispersive X-ray spectroscopy (EDX) | FEI | 50mm2 X-Max50 SDD | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Inc. | SH30910 | |
| Fluorescence microscope | Nikon | Eclipse Ti | |
| Formaldehyde | VWR | 100496-496 | |
| Hemacytometer | Hausser Scientific | 3520 | |
| ImageJ software | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation (LOCI, University of Wisconsin) | ||
| Inductively coupled plasma optical emission spectrometry (ICP-OES) | PerkinElmer | Optima 8000 | |
| Optical microscope | VWR | VistaVision | |
| Penicillin/streptomycin (P/S) | Thermo Fisher Scientific, Inc., | 15070063 | |
| pH meter | VWR | model SB70P | |
| Phosphate Buffered Saline (PBS) | VWR | 97062-730 | |
| Scanning electronic microscope (SEM) | FEI | Nova NanoSEM 450 | |
| surgical blade | VWR | 76353-728 | |
| Tissue Culture Flasks | VWR | T-75, MSPP-90076 | |
| Transwell inserts | Corning | 3460 | |
| Trypsin-ethylenediaminetetraacetic acid solution (Trypsin-EDTA) | Sigma-Aldrich | T4049 | |
| X-ray diffraction instrument (XRD) | PANalytical | Empyrean Series 2 |
Riferimenti
- Zhang, C., et al. Antimicrobial bioresorbable Mg-Zn-Ca alloy for bone repair in a comparison study with Mg-Zn-Sr Alloy and pure Mg. ACS Biomaterials Science & Engineering. 6 (1), 517-538 (2019).
- Xu, C., et al. A green biocompatible fabrication of highly porous functional ceramics with high strength and controllable pore structures. Journal of Materials Science & Technology. 32 (8), 729-732 (2016).
- Asgari, M., et al. Biodegradable metallic wires in dental and orthopedic applications: a review. Metals. 8 (4), 212(2018).
- Shi, Y., Liu, J., Yu, L., Zhong, L. Z., Jiang, H. B. β-TCP scaffold coated with PCL as biodegradable materials for dental applications. Ceramics International. 44 (13), 15086-15091 (2018).
- Wu, C. -C., et al. A self-reinforcing biodegradable implant made of poly (ɛ-caprolactone)/calcium phosphate ceramic composite for craniomaxillofacial fracture fixation. Journal of Cranio-Maxillofacial Surgery. 44 (9), 1333-1341 (2016).
- Jiang, W., et al. In vitro evaluation of MgSr and MgCaSr alloys via direct culture with bone marrow derived mesenchymal stem cells. Acta Biomaterialia. 72, 407-423 (2018).
- Zhang, C., et al. Magnesium-based biodegradable microelectrodes for neural recording. Materials Science and Engineering: C. 110, 110614(2020).
- Jia, B., et al. In vitro and in vivo studies of Zn-Mn biodegradable metals designed for orthopedic applications. Acta Biomaterialia. 108, 358-372 (2020).
- Yang, H., et al. Alloying design of biodegradable zinc as promising bone implants for load-bearing applications. Nature Communications. 11 (1), 1-16 (2020).
- Liu, H., et al. Injectable, biomechanically robust, biodegradable and osseointegrative bone cement for percutaneous kyphoplasty and vertebroplasty. International Orthopaedics. 42 (1), 125-132 (2018).
- Anjum, S., Arora, A., Alam, M., Gupta, B. Development of antimicrobial and scar preventive chitosan hydrogel wound dressings. International Journal of Pharmaceutics. 508 (1-2), 92-101 (2016).
- Barroca, N., et al. Electrically polarized PLLA nanofibers as neural tissue engineering scaffolds with improved neuritogenesis. Colloids and Surfaces B: Biointerfaces. 167, 93-103 (2018).
- Liu, Y., et al. Polydopamine-modified poly (l-lactic acid) nanofiber scaffolds immobilized with an osteogenic growth peptide for bone tissue regeneration. RSC Advances. 9 (21), 11722-11736 (2019).
- Liu, H., Webster, T. J. Enhanced biological and mechanical properties of well-dispersed nanophase ceramics in polymer composites: from 2D to 3D printed structures. Materials Science and Engineering: C. 31 (2), 77-89 (2011).
- Xu, C., et al. Bioinspired mechano-sensitive macroporous ceramic sponge for logical drug and cell delivery. Advanced Science. 4 (6), 1600410(2017).
- Xu, C., Bai, Y., Yang, H., Yang, L. Mechanically modulated, ultra-high precision logic delivery of molecules by bio-inspired macroporous ceramic sponge. MRS Advances. 2 (19-20), 1125-1130 (2017).
- Zhang, N., Xu, C., Azer, A., Liu, H. Dispersibility and characterization of polyvinyl alcohol-coated magnetic nanoparticles in poly (glycerol sebacate) for biomedical applications. Journal of Nanoparticle Research. 21 (12), 1-11 (2019).
- Kim, S. S., et al. A poly (lactide-co-glycolide)/hydroxyapatite composite scaffold with enhanced osteoconductivity. Journal of Biomedical Materials Research Part A. 80 (1), 206-215 (2007).
- Cipriano, A. F., et al. Degradation of bioresorbable Mg-4Zn-1Sr intramedullary pins and associated biological responses in vitro and in vivo. ACS Applied Materials & Interfaces. 9 (51), 44332-44355 (2017).
- Surmeneva, M. A., et al. Bone marrow derived mesenchymal stem cell response to the RF magnetron sputter deposited hydroxyapatite coating on AZ91 magnesium alloy. Materials Chemistry and Physics. 221, 89-98 (2019).
- Sheikh, Z., et al. Mechanisms of in vivo degradation and resorption of calcium phosphate based biomaterials. Materials. 8 (11), 7913-7925 (2015).
- Klein, C., Driessen, A., De Groot, K., Van den Hooff, A. Biodegradation behavior of various calcium phosphate materials in bone tissue. Journal of Biomedical Materials Research. 17 (5), 769-784 (1983).
- Lanao, R. P. F., Leeuwenburgh, S. C., Wolke, J. G., Jansen, J. A. Bone response to fast-degrading, injectable calcium phosphate cements containing PLGA microparticles. Biomaterials. 32 (34), 8839-8847 (2011).
- Vey, E., et al. Degradation kinetics of poly (lactic-co-glycolic) acid block copolymer cast films in phosphate buffer solution as revealed by infrared and Raman spectroscopies. Polymer Degradation and Stability. 96 (10), 1882-1889 (2011).
- Standard, I. Biological evaluation of medical devices-Part 5: Tests for in vitro cytotoxicity. Geneve, Switzerland: International Organization for Standardization. , (2009).
- Liu, X., Zhou, W., Wu, Y., Cheng, Y., Zheng, Y. Effect of sterilization process on surface characteristics and biocompatibility of pure Mg and MgCa alloys. Materials Science and Engineering: C. 33 (7), 4144-4154 (2013).
- Liu, H., Yazici, H., Ergun, C., Webster, T. J., Bermek, H. An in vitro evaluation of the Ca/P ratio for the cytocompatibility of nano-to-micron particulate calcium phosphates for bone regeneration. Acta Biomaterialia. 4 (5), 1472-1479 (2008).
- Liu, H., et al. Enhancing effects of radiopaque agent BaSO4 on mechanical and biocompatibility properties of injectable calcium phosphate composite cement. Materials Science and Engineering: C. 116, 110904(2020).
- Xu, C., et al. A versatile three-dimensional foam fabrication strategy for soft and hard tissue engineering. Biomedical Materials. 13 (2), 025018(2018).
- Speranza, V., Sorrentino, A., De Santis, F., Pantani, R. Characterization of the polycaprolactone melt crystallization: complementary optical microscopy, DSC, and AFM studies. The Scientific World Journal. , 720157(2014).
- Cipriano, A. F., et al. Anodization of magnesium for biomedical applications-Processing, characterization, degradation and cytocompatibility. Acta Biomaterialia. 62, 397-417 (2017).
- Li, H., Chang, J. pH-compensation effect of bioactive inorganic fillers on the degradation of PLGA. Composites science and technology. 65 (14), 2226-2232 (2005).
- Xu, C., Hung, C., Cao, Y., Liu, H. H. Tunable crosslinking, reversible phase transition, and 3D printing of hyaluronic acid hydrogels via dynamic coordination of innate carboxyl groups and metallic ions. ACS Applied Bio Materials. 4 (3), 2408-2428 (2021).
- Cortez Alcaraz, M. C., et al. Electrophoretic deposition of magnesium oxide nanoparticles on magnesium: processing parameters, microstructures, degradation, and cytocompatibility. ACS Applied Bio Materials. 2 (12), 5634-5652 (2019).
- Rutherford, D., et al. Synthesis, characterization, and cytocompatibility of yttria stabilized zirconia nanopowders for creating a window to the brain. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 108 (3), 925-938 (2020).
- Tian, Q., Deo, M., Rivera-Castaneda, L., Liu, H. Cytocompatibility of magnesium alloys with human urothelial cells: a comparison of three culture methodologies. ACS Biomaterials Science & Engineering. 2 (9), 1559-1571 (2016).
- Nguyen, T., Cipriano, A., Guan, R. G., Zhao, Z. Y., Liu, H. In vitro interactions of blood, platelet, and fibroblast with biodegradable magnesium-zinc-strontium alloys. Journal of Biomedical Materials Research Part A. 103 (9), 2974-2986 (2015).
- Jiang, W., Lin, J., Chen, A. H., Pan, J., Liu, H. A portable device for studying the effects of fluid flow on degradation properties of biomaterials inside cell incubators. Regenerative Biomaterials. 6 (1), 39-48 (2019).
- Tian, Q., et al. Responses of human urothelial cells to magnesium-zinc-strontium alloys and associated insoluble degradation products for urological stent applications. Materials Science and Engineering: C. 96, 248-262 (2019).
- Wetteland, C. L., Liu, H. Optical and biological properties of polymer-based nanocomposites with improved dispersion of ceramic nanoparticles. Journal of Biomedical Materials Research Part A. 106 (10), 2692-2707 (2018).
- Wetteland, C. L., Nguyen, N. -Y. T., Liu, H. Concentration-dependent behaviors of bone marrow derived mesenchymal stem cells and infectious bacteria toward magnesium oxide nanoparticles. Acta Biomaterialia. 35, 341-356 (2016).
- Aoi, W., Marunaka, Y. The importance of regulation of body fluid pH in the development and progression of metabolic diseases. Advances in Medicine and Biology. 77, 177-189 (2014).
- Wang, H. Hydroxyapatite degradation and biocompatibility. , The Ohio State University. (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon