Method Article
Dural Stimulation and Periorbital von Frey Testing in Mice As a Preclinical Model of Headache
요약
편두통의 가장 주목할만한 증상은 심한 두부 통증이며, 이것이 수막에 신경을 쓰는 감각 뉴런에 의해 매개된다는 가설이 있습니다. 여기에서는 안면 과민증을 출력으로 사용하면서 최소 침습적 방식으로 경막에 물질을 국부적으로 적용하는 방법을 제시합니다.
초록
경막 매트, 거미류 및 피아 매트로 구성된 두개골 수막은 주로 신경계의 구조적 기능을 제공하는 것으로 생각됩니다. 예를 들어, 그들은 두개골로부터 뇌를 보호하고 피질의 혈관 및 신경 공급을 앵커 / 조직합니다. 그러나 수막은 편두통과 같은 신경계 장애에도 연루되어 편두통 중에 경험되는 통증은 국소 멸균 염증 및 국소 nociceptive 구심증의 후속 활성화에 기인합니다. 수막의 층 중 경막은 편두통의 병리 생리학에 특히 관심이 있습니다. 그것은 고도로 혈관화되고, 국소 nociceptive 뉴런을 보유하고, 면역 세포와 같은 다양한 상주 세포의 본거지입니다. 국소 수막 미세 환경의 미묘한 변화는 경막 혈관 주위 결절기의 활성화 및 감작으로 이어질 수 있으며, 따라서 편두통 통증을 유발할 수 있습니다. 연구는 경막 구심 부심이 생체 내 전기 생리학, 이미징 기술 또는 행동 모델을 사용하여 활성화 / 감작되는 방법을 다루려고 노력했지만, 이들은 일반적으로 매우 침습적 인 수술을 필요로합니다. 이 프로토콜은 마우스에서 경막에 화합물을 비교적 비침습적으로 적용하는 방법과 경막 자극 후 주변 폰 프레이 테스트를 사용하여 두통과 같은 촉각 감도를 측정하는 적절한 방법을 제시합니다. 이 방법은 경막과 두개골의 무결성을 유지하고 융합되지 않은 시상과 람도이드 봉합사의 교차점에서 0.65mm 변형 된 캐뉼라를 통해 물질을 주입하여 침습적 기술로 인한 혼란스러운 영향을 줄입니다. 이 전임상 모델을 통해 연구자들은 두개골과 수막에 대한 손상없는 상태를 유지하면서 nociceptor 활성화, 면역 세포 활성화, 혈관 변화 및 통증 행동과 같은 편두통의 병리학 적 진행에 대한 광범위한 경막 자극과 그 역할을 조사 할 수 있습니다.
서문
편두통 통증은 전 세계적으로 주요 공중 보건 문제로 남아 있습니다. 세계 보건기구 (WHO)는 지구상에서 여섯 번째로 널리 퍼진 질병으로 분류하여 지구 인구의 15 % 미만을 괴롭 히고 사회 2,3에 상당한 사회 경제적 부담을 초래합니다. 치료 옵션과 그 효능은 차선책이었으며 증상 완화만을 제공하고 편두통 발생을 저조하게 하는 병리생리학적 사건을 유의하게 변형시키지 않는다4,5. 치료 성공의 부족은 편두통이 병리학이 제대로 이해되지 않는 다인자 장애이기 때문에 제한된 수의 치료 목표로 이어질 가능성이 큽니다. 편두통은 특히 편두통 진단이 오라, 두통, 광공포증 및 동종 요법과 같은 편두통 특징에 대한 경험을 설명하는 환자와의 구두 의사 소통을 기반으로 이루어 진다는 점을 감안할 때 동물 모델에서 완전히 포착하기가 어렵습니다. 그럼에도 불구하고, 편두통 치료의 최근 발전은 현재 전임상 모델에 의해 잘 검증 된 많은 신경 학적 상태에 대한 치료법을 능가하고 있음을 주목하는 것이 중요합니다. 예를 들어, 칼시토닌 유전자 관련 펩티드 또는 그의 수용체를 표적으로 하는 모노클로날 항체 및 소분자는 편두통 환자의 삶의 질을 개선하는데 매우 성공적이었으며 잠재적으로 편두통의 임상 관리를 변화시킬 수 있다. 이 장애를 이해하는 데 진전이 있었지만, 아직 해명되지 않은 것이 많이 있습니다.
전임상 동물 모델과 인간 연구에 기초하여, 편두통은 삼차 및 상부 자궁 경부 등근 신경절 6,7,8,9,10을 통해 신호하는 수막 내의 nociceptive 섬유의 비정상적인 활성화에 의해 시작된다는 것이 널리 받아 들여지고 있습니다. 이 이론에도 불구하고, 많은 연구는 편두통의 근본적인 기여 메커니즘을 이해하기 위해 약물의 전신 투여를 여전히 사용합니다. 약물의 전신 투여가 우리의 이해를 실질적으로 강화했지만, 이러한 발견은 관심있는 표적 조직 내의 국소 행동이 편두통에 중요한 역할을하는지 여부를 직접 평가하지는 않습니다. 반대로, 몇몇 연구는 듀라를 자극하는 접근법을 취했다; 그러나 이러한 실험은 침습적 두개골 절제술과 연장 된 회복 시간11,12를 통한 캐뉼라 이식이 필요합니다. 이러한 한계 때문에, 우리는 두개골 절제술의 부족이 수술 후 회복을 제거하고 깨어있는 동물12,13,14에서 즉각적인 검사를 가능하게하는 경막을 국부적으로 자극하는 최소 침습적 접근법을 개발했습니다. 이러한 주사는 가벼운 이소플루란 마취 하에서 수행되고 마우스의 시상과 람도이드 봉합사의 접합부에서 투여된다.
설치류15에서 nociceptive 행동 반응을 평가하기 위해 몇 가지 접근법이 개발되었습니다. 피부 이질통은 편두통 환자16,17의 약 80 %에서보고되었으며 설치류에 사용하기위한 잠재적 인 번역 종점을 나타냅니다. 전임상 모델에서, 설치류 발의 발바닥 영역에 폰 프레이 필라멘트를 적용하는 것은 전임상 편두통 모델에서 통증 행동을 평가하는 데 사용되었습니다. 이 접근법의 주요 한계는 두개 부위를 검사하지 않는다는 것입니다. 얼굴 grimace 점수는 통증 자극18,19의 유도 후 얼굴 표정을 분석하여 설치류의 통증 행동을 포착하는 데 사용되었습니다. 그러나 그 한계는 급성 자극에 대한 반응 만 포착하고 만성 구강 안면 통증 상태가 아닌 것을 포함합니다. 안면 손질과 양육 감소는 편두통20,21의 전임상 모델에서 행동 반응의 결과물로 간주됩니다. 전자의 한계에는 통증 반응을 정상적인 일상적인 손질 및 가려움증과 같은 다른 감각과 구별하는 데 어려움이 포함됩니다. 후자의 경우, 사육 행동은 일반적으로 설치류를 새로운 환경에 도입 한 후 빠르게 감소합니다. 이러한 행동 종점 각각은 통증 상태에 기여하는 다양한 메커니즘의 이해에 가치가 있지만, 편두통과 같은 통증 장애의 전임상 모델에 두개 과민 반응을 특이적으로 포착하는 종점을 포함해야합니다. 경막 자극 후 주변 궤도 피부의 촉각 과민증을 평가하는 것은 감각 증상이 본질적으로 주로 두증인 편두통에 기여하는 메커니즘에 대한 더 나은 통찰력을 제공 할 수있는 방법입니다. 여기에서는 편두통의 전임상 모델로서 마우스 경막에 물질을 투여하는 방법을 설명합니다. 듀럴 적용에 따라, 우리는 또한 딕슨 업다운 방법에 적용된 보정된 폰 프레이 필라멘트를 사용하여 주변 궤도 촉각 과민증을 테스트하기 위한 상세한 방법을 제시합니다.
프로토콜
모든 절차는 달라스 텍사스 대학의 기관 동물 관리 및 사용위원회의 사전 승인을 받아 수행되었습니다. ICR(CD-1)(30-35 g) 및 C57/BL6(25-30 g) 마우스를 6-8주간 숙성시켜 본 연구에 사용하였다.
1. 듀랄 인퓨저
- 조정 가능한 비금속 용융 실리카 플라스틱 캡으로 상업적으로 이용 가능한 내부 캐뉼라 및 주입기를 일방적 주사용으로 수정하고 내경(I.D.)이 0.18mm이고 외경(O.D.)이 0.35mm인 28G 가이드 캐뉼라 아래에 삽입/연장하여 마우스 주입기/인젝터를 만듭니다(그림 1A).
- 캘리퍼 또는 기타 측정 장치를 사용하여 주입기의 용융 실리카 플라스틱 캡을 0.6mm 길이로 조정하십시오. 주입기의 팁에서 실리카 플라스틱 캡의 가장자리까지 측정되었습니다.
- 플라스틱 캡을 조정할 때 주입기를 구부리거나 둔하게 하지 않도록 주의하십시오.
- 이전에 경막 주사에 사용되지 않은 다른 마우스 균주의 경우, 길이를 0.6mm로 설정하고 잉크 또는 염료로 파일럿 주사를 실시하고 염료가 뇌나 두개골이 아닌 경막에만 있는 것이 관찰될 때까지 주입기 길이를 조정하여 최적의 주입기 길이를 결정합니다.
- 조정된 인퓨저의 긴 단부(또는 0.6 mm로 측정되지 않은 단부)를 플라스틱 튜브(펌프 튜빙, 2-스톱, I.D. 0.19 mm, 길이 406 mm)에 부착한다.
- 튜브를 최소 길이 8in으로 절단하여 5 μL의 부피를 유지하기에 충분한 라인이 있는지 확인하십시오.
- 튜브가 금속 부분과 인퓨저에있는 플라스틱 스토퍼의 상단을 덮고 있는지 확인하십시오. 이렇게하면 기포가 라인에 축적되는 것을 방지하는 데 도움이됩니다.
- 튜브의 반대쪽 끝을 10 μL 유리 미세주사기 (가스 기밀, 시멘트 바늘; 10 mm 돌출부가있는 21 G)에 부착하고 주사기의 금속 부분 위에 단단히 밀봉되어 있는지 확인하십시오 (그림 1A).
- 라인이 연결되면 기포가 형성되는 것을 방지하기 위해 선택한 5μL의 인산염 완충 식염수(PBS), 합성 간질액(SIF) 또는 기타 비히클로 주사기를 백필합니다.
- 라인에서 기포가 관찰되면 거품이 사라질 때까지 차량으로 라인을 넘치게하십시오.
참고 : 주사기를 라인에 부착하기 전에 차량으로 주사기를 채운 다음 연결되면 라인을 통해 유체를 밀어 넣는 것이 도움이 될 수 있습니다.
- 라인에서 기포가 관찰되면 거품이 사라질 때까지 차량으로 라인을 넘치게하십시오.
- 라인이 5 μL의 차량으로 백필되고 효율적으로 작동 한 후 5 μL의 약물 / 용액을 해밀턴 주사기에 적재하십시오 (이 기술을 배우거나 연습하는 경우 잉크 또는 염료가 약물 / 용액의 대안으로 사용될 수 있음).
- 경막 상에 투여된 모든 비히클 용액이 pH 7.4로 유지되고 310의 삼투압으로 측정되도록 한다. 이것은 듀라 내의 산 감지 이온 채널 및 다른 삼투압 감지 채널의 잠재적 활성화를 감소시킨다.
- 뇌로 누출되지 않은 마우스에서 테스트 된 최대 부피는 약 10 μL입니다. 이 부피를 가진 주사 후 행동 효과는 테스트되지 않았습니다. 이러한 이유로, 단지 5 μL의 용액만을 듀라 상에 투여한다.
참고: 이러한 관찰은 6-8주령 CD1/ICR 마우스의 마우스 균주/연령/체중을 기준으로 합니다.
2. 듀랄 주사
- 주사기가 준비되고 약물이로드되면 마우스를 복부에 평평하게 놓고 노즈콘을 통해 0.5-1 L / min의 산소 유량으로 짧은 3 % 이소 플루란으로 마취하십시오.
- 마우스가 더 이상 핀치 반사를 표시하지 않으면 마취를 조정하고 1.5 % 이소플루란으로 유지하십시오.
- 마취가 끝나면 멸균 된 안검 연고를 눈에 바르고 동물의 머리를 면도 한 다음 포비돈 요오드와 에탄올로 피부를 소독하십시오. 이 후, 성공적인 주사에 도움이되는 위치에 서십시오.
- 한 손으로 동물의 머리를 안정시키고 다른 손으로 주입기를 잡으십시오.
- 조심스럽게 조사하고 마우스의 두개골에있는 시상과 람도이드 봉합사의 접합부를 찾습니다 (그림 1B, C).
- 피부를 통해이 신중한 접합부를 찾으려면 두개골의 지형 학적 특징을 사용하고 주입기와의 접합부의 일반적인 위치를 부드럽게 조사하십시오.
- 두개골을 따라 주입기를 다시 배치하고 정확한 위치에 대한 느낌을 주어 접합부의 위치를 확인합니다.
- 봉합사가 위치하여 주입기가 제자리에 놓이면 피부를 관통하고 플라스틱 마개까지 접합부로 떨어질 때까지 매우 천천히 부드럽게 인퓨저를 앞뒤로 흔든다.
주: 인퓨저의 전체 0.6mm 팁을 접합부에 삽입하십시오. - 정확성을 확인하려면 잉크 또는 염료를 주사액으로 사용하고 마우스를 안락사시키고 무력화하십시오.
- 두개골 뚜껑을 제거하여 경막 내의 염료를 시각화합니다(그림 1C).
참고 : 염료는 두개골의 뇌 또는 외부에서 관찰되어서는 안됩니다. 마찬가지로, 모든 실험에서 마우스는 주사의 정확성을 검증하고 경막의 무결성이 손상되지 않았 음을 보장하기 위해 사후 검사를 받아야합니다.
- 두개골 뚜껑을 제거하여 경막 내의 염료를 시각화합니다(그림 1C).
- 주사 후 마우스를 마취에서 제거하고 의식을 회복 할 때까지 기다린 다음 케이지로 돌아가거나 원하는 분석을 시작하기 위해 테스트 챔버에 놓습니다.
참고 : 행동 실험을하기 전에 마우스가 최소 30 분 동안 마취에서 회복 할 수 있도록하십시오.
3. 주변 궤도 폰 프레이
- 약 16-20 마리의 마우스 코호트로 연구를 시작하십시오.
- 습관화 전날 한 번, 각 마우스를 적어도 5 분 동안 다루십시오.
- 약 24시간 처리 후, 마우스를 시험실 조건 및 폰 프레이 시험 장치에 습관화시킨다(도 2A).
참고: 아크릴 테스트 장치는 뚜껑이 있는 개별 구획으로 구성되어 있으며 약 3 in x 3.5 in x 5 in (W x H x D)이며 0.25 in 19 G 정사각형 아연 도금 강철 메쉬 와이어를 통해 연결된 알루미늄 스탠드로 지지됩니다.- 마우스를 무취이며 폴리텐 또는 파라핀 왁스가 들어 있지 않은 수평으로 놓인 4-oz 흰색 종이 컵 안에 넣으십시오.
참고: 이러한 유형의 컵은 섭취할 경우 마우스의 위장 장애를 감소시키기 때문에 선호됩니다(그림 2B).
- 마우스를 무취이며 폴리텐 또는 파라핀 왁스가 들어 있지 않은 수평으로 놓인 4-oz 흰색 종이 컵 안에 넣으십시오.
- 동물들이 각각의 방에있는 동안, 동물을 진정시키고 동물에 대한 불필요한 스트레스를 피하기 위해 각 마우스의 개별 챔버에 정상적인 차우 식단의 펠릿을 놓습니다. von Frey 행동 테스트 전에 3 일 동안이 작업을 수행하십시오.
- 생쥐가 챔버에있을 때마다 음식에 접근 할 수 있는지 확인하십시오.
- 번호를 매기고 각 동물을 테스트 랙의 동일한 공간에 할당합니다. 각 동물이 시험 환경에 적응할 수 있도록 시험 기간 중 매일 같은 컵에 마우스를 넣으십시오.
참고 : 마우스는 컵을 g아 먹고 컵을 파괴합니다. 이런 일이 발생하면 컵을 교체하고 해당 마우스 번호로 레이블을 붙입니다.
- 습관화의 초기 3 일 후, 마우스를 개별 챔버에 두십시오.
- 동물이 폰 프레이 (von Frey) 테스트 전에 적어도 1 시간 동안 시험실과 챔버에 적응하여 마우스가 진정되고 나중에 테스트하기가 더 쉬워집니다.
- 시험 당일에 방에 순응 한 후, 컵에있는 동안 하나의 마우스를 각각의 챔버에서 제거하십시오.
- 컵을 수평 위치에 유지하여 마우스가 앞발과 뒷발에 모두 닿도록 하여 체중이 고르게 분배되도록 합니다.
참고 : 불평등 한 체중 분포는 동물의 반응을 변화시키고 심지어 동물이 반응하지 못하게 할 수 있습니다.
- 컵을 수평 위치에 유지하여 마우스가 앞발과 뒷발에 모두 닿도록 하여 체중이 고르게 분배되도록 합니다.
- 마우스가 들어있는 컵을 흡수 패드의 테스트 랙 아래 테이블 위에 놓습니다.
- 주변 궤도 폰 프레이 테스트의 경우, 0.07 g 폰 프레이 필라멘트를 얼굴 중앙과 눈 사이에 직접 놓습니다.
- 필라멘트에 충분한 압력을 가하여 폰 프레이 (von Frey) 머리카락이 "C"자형 형태로 구부러지도록하십시오.
- 적어도 3 초이지만 5 초 이내의 영역과의 접촉을 유지하거나 마우스가 머리를 철회하고 발로 필라멘트를 스 와이프 할 때까지 유지하십시오.
참고 : 필라멘트가 미끄러 지거나 필라멘트의 끝이 테스트 중에 동물에게 닿으면 어떤 반응도 계산해서는 안됩니다. 이러한 반응은 상이한 메카노수용체에 의해 활성화되는 브러시에 대한 반응일 수 있으며, 따라서 정확한 결과를 반영하지 않을 수 있다. - 폰 프레이 필라멘트를 딕슨 "업다운" 방법22,23에 따라 적용한다.
- 처음에는 0.07g의 무게를 가진 폰 프레이 필라멘트를 적용하십시오. 이 연구에서 가능한 가장 낮은 필라멘트와 가장 높은 테스트 된 필라멘트는 각각 0.008g 및 0.6g의 중량을 가진 필라멘트입니다.
- 이 검정을 수행하기 위해 중량 0.008 g, 0.02 g, 0.04 g, 0.07 g, 0.16 g, 0.4 g 및 0.6 g의 필라멘트를 사용한다.
- 이 방법에서 동물이 필라멘트에 대한 반응을 나타내지 않으면 다음으로 높은 그램 무게의 필라멘트를 적용하십시오.
- 마우스가 필라멘트에 반응하는 경우, 마우스가 그 필라멘트에 반응한다고 생각하십시오. 이 경우 다음 낮은 그램 무게의 필라멘트를 적용하십시오.
- 동물이 초기 반응 후 4 번 테스트되거나 동물이 분석에서 테스트 된 필라멘트에 반응하지 않는 것으로 판단 될 때까지이 패턴을 반복하십시오.
참고: 팔이나 손목에서 발생하는 추가 압력을 가하지 마십시오. 스케일은 필라멘트의 적용을 연습하는 데 사용될 수 있습니다.
- 적어도 3 초이지만 5 초 이내의 영역과의 접촉을 유지하거나 마우스가 머리를 철회하고 발로 필라멘트를 스 와이프 할 때까지 유지하십시오.
4. 기준 인출 임계값 테스트
- 실험에 포함시키기 전에, 마우스가 0.5-0.6 g 사이의 기준선 금단 역치에 도달하는지 확인하십시오.
- 마우스는 3.9.2.2단계에서 언급된 시리즈에서 테스트된 필라멘트에 반응하지 않을 경우 기준선에 도달합니다(0.07g, 0.16g, 0.4g 및 0.6g).
- 기준선 금단 역치를 설정할 때 매일 마우스를 테스트하십시오.
- 테스트를 통해 동물들은 폰 프레이 필라멘트의 테스트 조건과 압력에 적응할 수 있습니다.
- 실험 셋째 날 후에도 마우스가 여전히 과민 반응을 보이면 다시 테스트하기 전에 1 ~ 2 일 정도 기다리십시오.
참고: 실험 일 사이에 너무 많은 시간이 걸리면 동물이 주변 궤도 영역에서 필라멘트의 무게에 적응하지 못하여 목표 금단 임계 값에 도달하지 못할 수 있습니다.
- 어떤 동물이 실험에 대한 포함 기준을 충족시키지 못하는지 결정하기 전에 대략 7일 동안 마우스를 시험한다.
참고: 마우스의 약 70%가 목표 기준선 수준에 도달합니다.- 경막 자극 전에, 기준선 데이터를 분석하여 0.5-0.6 그램 이상의 기준선 값에 도달하지 않은 마우스를 제외한다.
- 제외 후 나머지 각 마우스를 테스트 그룹에 무작위로 할당합니다. 컵에서 그리거나 스프레드 시트에 스크립트를 작성하여 숫자를 그룹으로 무작위화하여이를 달성하십시오.
5. 폰 프레이 결과 분석
- 일련의 응답이 획득되면, 델타, k 값, 50% 임계값, 및 인출 임계값을 이전에 공개된 방법(24)에 따라 그램으로 결정한다.
- WT = 10(x*F+B) 공식을 사용하여 인출 임계값을 계산합니다. 여기서 WT = 금단 임계값, F = Chaplan 방법을 통해 계산된 발 금단 임계값, B = 로그의 선형 회귀(굽힘력) = x*필라멘트 수 + B.
- 데이터를 50% 인출 임계값 또는 평균 인출 임계값(그램)으로 플로팅합니다.
결과
이 주사 방법은 후속 행동 검사가 발생할 수 있도록 마우스의 경막에 자극을 투여하는 데 사용됩니다. 이 모델로 측정 된 가장 일반적인 행동 출력은 von Frey12,13,14를 통해 평가 된 피부 안면 과민증입니다. 여기에서는이 모델을 편두통 병리학에 대한 잠재적 인 성별 별 기여도를 평가하는 데 어떻게 사용할 수 있는지 보여줍니다 (그림 3).
이 절차는 기계적으로 유발된 안면과민증 에 대한 경막 프로락틴(PRL)의 효과를 조사하기 위해 사용되어 왔다(그림 3). 이 연구의 결과는 암컷 ICR 마우스가 5 μg의 경막 프로락틴에 대한 반응으로 안면 금단 역치가 현저히 감소한다는 것을 입증했다 (도 3A). 0.5 μg의 프로락틴 (PRL)의 열 배 더 낮은 투여량도 PRL의 고용량과 유사한 반응을 보였다 (도 3B).
이 주사는 또한 grimace를 통해 평가 된 자발적인 통증 관련 행동을 생성하는 것으로 나타났습니다. 0.5 μg의 PRL의 듀랄은 암컷 마우스에서 상당한 슬픔을 일으켰으며(도 3C), 여성 편두통 유사 행동에서 경막 PRL에 대한 명확한 역할을 추가로 입증하였다. 우리는 폰 프레이 필라멘트로 모든 테스트 전에 grimace 분석을 수행했습니다.
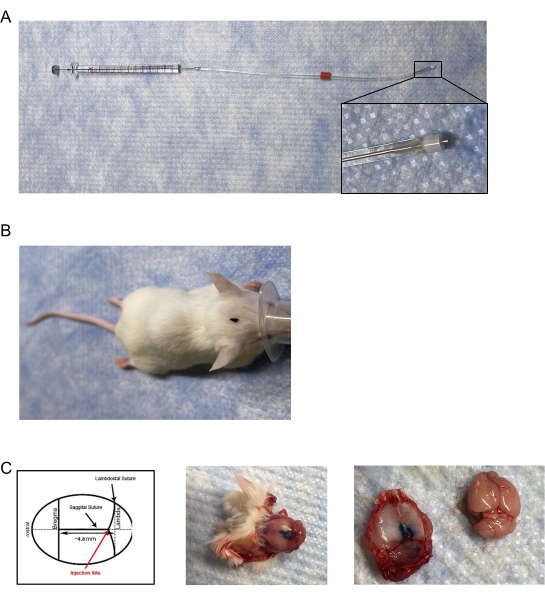
그림 1: 듀랄 주입기 및 주입 배치 . (A) 인젝터/인퓨저는 ~0.5mm-0.65mm의 길이로 조정된 수정된 캐뉼라로 구성되며 타이곤 튜브를 통해 10μL 가스 밀폐 주사기에 시멘트로 고정된 바늘에 부착됩니다. (b) 마우스의 머리에 표시된 주사 부위 위치의 조감도. (C) (좌측 패널) 경막 주사의 위치를 나타낸 도면. 주사제의 배치는 브레그마에 약 4.8mm 후방에서 람도이드와 시상 봉합사의 접합부에 있습니다. (중간 패널) 5 μL의 청색 주사 염료의 경막 주사 후 마우스 두개골의 사후 조감도. (오른쪽 패널) 마우스 두개골 뚜껑을 뇌에서 분리합니다. 뇌에 청색 주사 염료의 관찰 가능한 누출은 없었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: von Frey 테스트 챔버. (A) 와이어 메쉬 랙에 뚜껑이 있는 개별 아크릴 챔버에 3.5 in x 3.5로 구성된 폰 프레이 테스트 챔버. 이들은 2 행으로 구성된 10 개의 챔버 열을 통해 연결됩니다. (b) 폰 프레이 테스트 챔버 내부에 수용된 그들의 개별 컵에 있는 마우스의 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
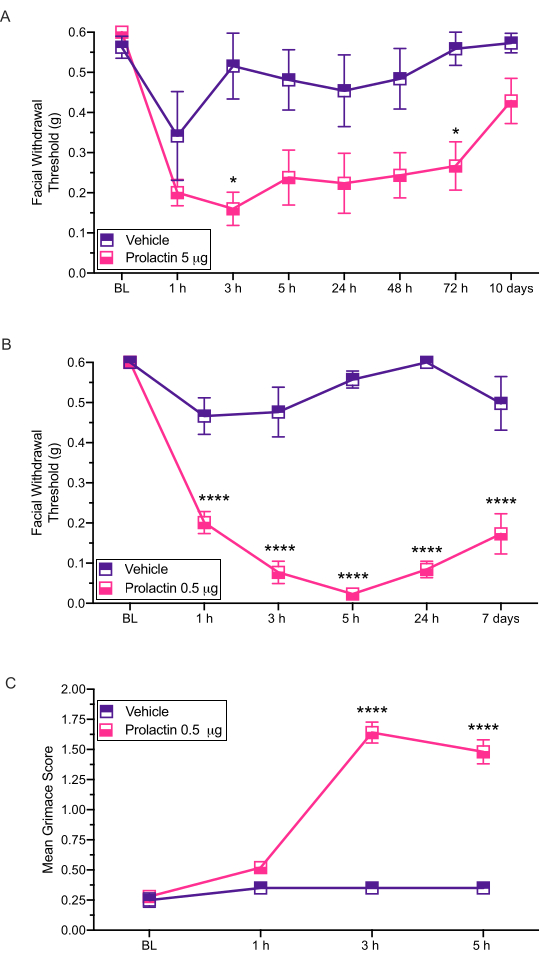
그림 3: 프롤락틴의 Dural 적용은 마우스에서 행동 반응을 유도합니다. 기계적 금단 역치는 암컷 마우스에서 PRL (5 μg 또는 0.5 μg)의 경막 적용 후에 평가되었다. (a) 5 μg의 PRL (n=7 PRL, n=6 비히클)의 적용은 비히클에 비해 안면 과민증을 유도하였다. (b) 0.5 μg의 PRL (n=5 PRL, n=4 비히클)의 적용은 오래 지속되는 안면 과민증을 유도하였다. (c) Grimace는 또한 각 시점에서 0.5 μg의 PRL로 처리된 동일한 마우스에서 평가되었다. 이들 마우스는 비히클로 처리된 마우스에 비해 유의하게 더 높은 grimace 스코어를 나타내었다. 통계: 양방향 ANOVA에 이어 Bonferroni 다중 비교 사후 분석. 데이터는 SEM± 수단으로서 표현된다. *p < 0.05, ****p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
경막에서 국소 nociceptive system의 부적응 변화는 조직 손상의 부족에도 불구하고 편두통 발작의 두통 단계에 중요한 기여자로 간주됩니다25,26. 여기서 연구는 경막의 최소 침습적 자극이 안면 촉각 과민증을 유도할 수 있는 방법을 제시한다. 두개골과 조직에 손상을 일으키지 않고 경막 nociceptor 활성화에 관련된 메커니즘과 사건을 밝히는 것은 전임상 모델에서 편두통 메커니즘을 더 정확하게 반영 할 수 있습니다.
두개골 절제술 및 캐뉼라 이식은 편두통 통증11,12에 기여하는 기능과 메커니즘을 평가하기 위해 오랫동안 사용되어 왔습니다. 그러나, 두개골 절제술이 경막 비만 세포의 활성화를 유도하고 설치류27에서 pial 혈관 투과성을 증가시킬 수 있다는 것이 보고되었다. 경막에서의 비만 세포 활성화가 편두통 7,8,28,29에 매우 연루되어 있다는 것을 감안할 때,이 기술은 해석을 왜곡시킬 수있는 주요한주의 사항을 가지고 있습니다. 시상과 람도이드 봉합사의 접합부를 통해 물질을 투여하는 것은 두개골 절제술 유도 비만 세포 활성화에 의해 매개되는 nociceptors의 활성화를 효과적으로 감소시킨다. 더욱이, 비침습적 경막 자극은 수술 후 회복 및 진통제의 투여를 필요로 하지 않으며, 이는 결과의 해석을 바꿀 수 있다. 경막에 물질을 국부적으로 적용하면 연구자는 작용 부위가 쉽게 결정되지 않는 약물의 전신 투여와는 달리이 특정 표적 조직에 집중할 수 있습니다12,13,14. 니트로글리세린 및 칼시토닌 유전자 관련 펩티드와 같은 물질의 전신 투여는 편두통과 유사한 인간에서 실험적 공격을 유발하지만, 설치류 모델에서 작용 위치의 평가를 허용하지 않는다; 보다 표적화된 조직-특이적 모델은 대안적인 접근법을 제공한다.
여기에 설명 된이 기술은 두개골의 시상과 람도이드 봉합사가 만나는 접합부를 통해 수막의 경막에 약물 또는 기타 용액을 직접 주입하는 것을 포함합니다. 최상의 결과를 얻으려면 6-8 주령의 ICR (CD-1) 또는 C57 / BL6 마우스를 이러한 실험에 사용해야합니다. 더 어린 마우스가 사용될 수 있고; 그러나 8 주 이상 된 ICR (CD-1) 마우스의 사용은 두개골 판 봉합사가이 나이에 의해 일반적으로 완전히 융합되어 두개골을 손상시키지 않고 주입 할 수 없기 때문에 권장되지 않습니다. 이 절차를 거칠 각 마우스의 무게/크기를 고려하는 것도 중요합니다. 두개골은 일반적으로 더 낮은 무게에서 매우 얇고 주사 중에 가해지는 압력을 견딜 수 없기 때문에 체중이 19g 이상인 동물에 대해 이러한 주사를 수행하는 것이 좋습니다. 중요한 것은 두개골 판 융합이 발생하는 연령 / 체중에 기여하는 요인 (예 : 동물 시설에서 사용되는 실험실 차우의 구성)에도 기여할 가능성이 큽니다. 따라서 실험자는 자신의 조건에서 적합한 연령 / 체중 범위를 결정해야 할 수도 있습니다. 상이한 연령 범위 및 동물 중량은 다른 마우스 균주 또는 유전자형에 대해 요구될 수 있으며, 두개골 플레이트가 이들 동물에서 융합되는 시기에 따라, 또한 주사 자체의 최적화를 필요로 할 수 있다.
이 기술을 배우거나 연습 할 때, 안락사 된 마우스에서 봉합사 접합부를 찾아 편안함을 얻는 것이 좋습니다. 이 마우스에서 두피를 적출하거나 껍질을 벗긴 상태에서 먼저 연습하고 천천히 피부를 통해 접합부를 찾는 것이 가장 좋습니다. 정확한 위치를 확립하면 잉크와 염료를 경막에 주입하여 위치 정확도와 주입 깊이를 확인할 수 있습니다. 이 기술은 ICR (CD-1) 마우스 (30-35 g) 및 C57 / BL6 마우스 (25-30 g)를 사용하여 개발 및 최적화되었습니다. 주입기 길이 0.5-0.6mm는 25-35g 범위 내에서 체중을 측정하는 마우스를 주입하기에 충분합니다. 그러나, 이 기술을 최적화하기 위해 사용된 마우스와 상당히 상이한 마우스를 주입하는 경우 주입기의 길이를 교정해야 할 수도 있다. 예를 들어, 25g보다 작은 마우스는 길이가 0.5mm 미만인 주입기를 사용할 가능성이 큽니다. 이 기술을 습득하고 나이에 적합한 마우스에서 수행 할 때이 주사의 성공률은 100 %에 가깝습니다. 그러나 주사로 인한 합병증은 주입기를 삽입하는 데 너무 많은 힘을 가하여 두개골을 부러 뜨리는 것과 같은 문제뿐만 아니라 수막 혈관 손상으로 인한 비정상적인 출혈로 인해 발생할 수 있습니다.
촉각 감도의 변화는 설치류의 통증 행동을 평가할 때 중요한 측정입니다. 여기서 우리는 전임상 편두통 모델에서 이러한 행동을 평가하기 위해 주변 궤도 폰 프레이 테스트의 사용을 시연합니다. 편두통 모델에서이 기술을 사용하는 가장 큰 장점은 발과 같은 다른 비 두개골 위치보다 관련성이 높은 머리의 과민증을 평가할 수 있다는 것입니다. 재현 가능한 결과를 보장하는 중요한 단계는 마우스가 완전히 기준선인지 확인하는 것입니다. 이를 위해서는 폰 프레이 필라멘트를 정확하게 적용 할 수있는 잘 훈련 된 실험자가 필요합니다. 동물이 기준선에 도달하는 데 약 7 일이 걸릴 수 있습니다. 그러나 모든 동물이 목표 기준선에 도달하는 것은 아닙니다. 우리의 경험에 비추어 볼 때, 생쥐와 함께 일한 지 약 7 일 후에 동물의 60 % -70 %만이 주변 궤도 영역에서 0.6g의 기준선에 도달하지만 이것은 동물 코호트에 달려 있습니다. 이 타이밍은 실험을 시작하기 전에 고려되어야 하며, 탈락을 설명하기 위해 충분한 숫자가 사용되고, 동물들이 듀라를 자극하기 위해 이 비침습적 방법을 사용하기 위한 기준선 이후의 적절한 연령인지 확인해야 한다. 기준선을 결정하는 단계는 프로토콜 섹션 4에 요약되어 있습니다.
폰 프레이 검사의 한계는 통증 반응과 일상적인 손질 / 가려움을 구별하기가 어려울 수 있다는 것입니다. 통증과 손질을 구별하는 데 도움이하려면이 행동이 발생하는 시간을 알아 차리는 것이 중요합니다. 일반적으로 통증 반응은 필라멘트 적용 후 한 번 스 와이프하는 반면, 손질 동작은 연장되는 경향이 있으며 몇 초에서 몇 분 동안 지속될 수 있습니다. 손질/가려움 행동을 과민성 반응과 구별할 수 없는 경우, 이를 반응으로 기록하지 않는 것이 가장 좋습니다. 또한, 부적절한 필라멘트 배치 (예 : 필라멘트 미끄러짐)는 동물의 장기간 손질로 이어질 수 있으므로 제대로 테스트하기가 어려울 수 있습니다. 이런 일이 발생하면 실험자는 손질이 멈추고 마우스가 테스트 할 수있을 정도로 침착 할 때까지 기다려야합니다. 손질 동작이 시작되기 전에 사용 된 것과 동일한 필라멘트에서 계속하십시오. 마우스가 매우 긴 시간 동안 계속되면 마우스를 약 5분 동안 테스트 챔버에 다시 놓습니다. 5분이 지나면 마우스를 다시 테스트해 보십시오. 이 행동이 해결되지 않고 계속되면 마우스를 연구에서 제거해야합니다. 중요한 것은 모발이 제거 된 후 마우스 피부가 동일한 감도를 유지하는지 여부가 불분명하고 제모 과정 (면도, 탈모 크림)이 피부 민감성에 영향을 줄 수 있으므로 얼굴에 모피를 면도하는 것은 권장하지 않습니다.
대부분의 경우, 마우스가 기준선에 도달 한 후 24 시간 이내에 경막에 물질을 투여하는 것이 이상적입니다. 마우스는 한 시간에 한 번 폰 프레이 필라멘트 검사를받는 것이 좋습니다. 가능하다면, 격년마다 테스트하면 실험 후 동물들이 진정 될 수있는 충분한 시간을 제공합니다. 또한 실험은 일주기 패턴을 방해하지 않도록 시간을 정해야합니다. 생쥐의 일주기 리듬의 변화는 행동 표현형을 변화시킬 수 있으며 궁극적으로 재현 할 수없는 결과를 초래할 수 있습니다.
Periorbital von Frey 검사는 실험 결론을 강화하기 위해 다른 행동 분석과 함께 사용할 수 있습니다. grimace 척도는 반응18,19을 불러 일으키기보다는 설치류의 자발적인 얼굴 표정에 의존합니다. 이 방법은 급성 통증 행동을 평가하고 정량화 할 때 높은 정확도와 신뢰성을 가지며 편두통12,30의 많은 전임상 모델에서 사용되었습니다. grimace 및 periorbital von Frey assays를 모두 사용할 때, 실험자는 마우스의 주변 궤도 영역에 폰 프레이 필라멘트를 적용하기 전에 grimace에 대한 스코어링을 고려해야 한다. 이것은 찡그린 행동이 자발적이며 필라멘트 적용에 의해 유발되지 않도록합니다. Hindpaw 기계적 과민증은 또한 periorbital von Frey 테스트와 함께 사용할 수 있습니다. grimace 채점과는 달리, 뒷발 과민증을 평가하기 전에 안면 과민증을 테스트하는 것이 가장 좋습니다. 뒷발 검사는 주변 궤도 폰 프레이 테스트가 완료된 후 마우스를 컵없이 챔버에 다시 배치해야합니다.
결론적으로, 마우스에서의 전궤도 폰 프레이 테스트 및 비침습적 경막 자극은 편두통의 전임상 모델의 현재 범위에 귀중한 옵션을 추가합니다. 올바르게 수행 될 때,이 기술은 캐뉼라의 외과 적 이식이 필요하지 않기 때문에 설치류에서 두통과 같은 표현형을 생성하는 세련된 접근법을 제시합니다. 쥐에서 캐뉼라는 박테리아 감염에 걸리기 쉽고, 막히고, 떨어질 수 있으며, 각 동물을 단일 수용하여 동물에게 불필요한 스트레스를 유발합니다. 더욱이, 경막 자극 프로토콜은 여러 약물 적용과 함께 사용하도록 쉽게 변형될 수 있다. Periorbital von Frey 테스트 패러다임은 실험 사양에 가장 잘 맞도록 수정할 수도 있습니다. 또한, 주변 궤도 폰 프레이 검사는 다른 구강 안면 통증 장애에 사용할 수 있습니다. 이러한 기술은 편두통 통증의 복잡한 기본 메커니즘을 더 잘 이해하는 데 도움이되는 중요한 도구입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 국립 보건원 (NS104200 및 NS072204에서 GD)에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4 oz Hot Paper Cups | Choice Paper Company | 5004W | https://www.webstaurantstore.com/choice-4-oz-white-poly-paper-hot-cup-case/5004W.html |
| Absorbent Underpads | Fisherbrand | 14-206-65 | https://www.fishersci.com/shop/products/fisherbrand-absorbent-underpads-8/p-306048 |
| C313I/SPC Internal 28 G cannula | P1 Technologies (formerly Plastics One) | 8IC313ISPCXC | I.D. 18 mm, O.D. 35 mm |
| Gastight Model 1701 SN Syringes | Hamilton | 80008 | https://www.hamiltoncompany.com/laboratory-products/syringes/80008 |
| Ismatec Pump Tubing, 0.19 mm | Cole-Palmer | EW-96460-10 | https://www.coleparmer.com/i/ismatec-pump-tubing-2-stop-tygon-s3-e-lab-0-19-mm-id-12-pk/9646010 |
| Stand with chicken wire | Custom | The galvanized steel chicken wire dimensions are 0.25 in. x 19-gauge | |
| Testing Rack with individual Chambers | Custom | Each chamber should have a division between each mouse and lids to contain the mouse. The chambers should also be large enough to hold a 4 oz. paper cup. | |
| von Frey Filaments | Touch test/Stoelting | 58011 | https://www.stoeltingco.com/touch-test.html |
참고문헌
- GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 390 (10100), 1211-1259 (2017).
- Woldeamanuel, Y. W., Cowan, R. P. Migraine affects 1 in 10 people worldwide featuring recent rise: A systematic review and meta-analysis of community-based studies involving 6 million participants. Journal of the Neurological Sciences. 372, 307-315 (2017).
- Burch, R. C., Loder, S., Loder, E., Smitherman, T. A. The prevalence and burden of migraine and severe headache in the United States: updated statistics from government health surveillance studies. Headache. 55 (1), 21-34 (2015).
- Ashina, M. Migraine. New England Journal of Medicine. 383 (19), 1866-1876 (2020).
- Ashina, M., et al. Migraine: integrated approaches to clinical management and emerging treatments. Lancet. 397 (10283), 1505-1518 (2021).
- Jacobs, B., Dussor, G. Neurovascular contributions to migraine: Moving beyond vasodilation. Neuroscience. 338, 130-144 (2016).
- Koyuncu Irmak, D., Kilinc, E., Tore, F. Shared Fate of Meningeal Mast Cells and Sensory Neurons in Migraine. Frontiers in Cellular Neuroscience. 13, 136(2019).
- Levy, D. Migraine pain, meningeal inflammation, and mast cells. Current Pain and Headache Reports. 13 (3), 237-240 (2009).
- Levy, D., Labastida-Ramirez, A., MaassenVanDenBrink, A. Current understanding of meningeal and cerebral vascular function underlying migraine headache. Cephalalgia. 39 (13), 1606-1622 (2019).
- Phebus, L. A., Johnson, K. W. Dural inflammation model of migraine pain. Current Protocols in Neuroscience. , Chapter 9, Unit 9.1 (2001).
- Fried, N. T., Maxwell, C. R., Elliott, M. B., Oshinsky, M. L. Region-specific disruption of the blood-brain barrier following repeated inflammatory dural stimulation in a rat model of chronic trigeminal allodynia. Cephalalgia. 38 (4), 674-689 (2018).
- Avona, A., et al. Dural calcitonin gene-related peptide produces female-specific responses in rodent migraine models. The Journal of Neuroscience. 39 (22), 4323-4331 (2019).
- Burgos-Vega, C. C., et al. Non-invasive dural stimulation in mice: A novel preclinical model of migraine. Cephalalgia. 39 (1), 123-134 (2019).
- Avona, A., et al. Meningeal CGRP-Prolactin interaction evokes female-specific migraine behavior. Annals of Neurology. 89 (6), 1129-1144 (2021).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- Lipton, R. B., et al. Cutaneous allodynia in the migraine population. Annals of Neurology. 63 (2), 148-158 (2008).
- Goadsby, P. J. Migraine, allodynia, sensitisation and all of that. European Neurology. 53, Suppl 1 10-16 (2005).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-449 (2010).
- Mogil, J. S., Pang, D. S. J., Silva Dutra, G. G., Chambers, C. T. The development and use of facial grimace scales for pain measurement in animals. Neuroscience & Biobehavioral Reviews. 116, 480-493 (2020).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. The Journal of Headache and Pain. 20 (1), 11(2019).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central CGRP mechanisms. The journal of Neuroscience. 37 (1), 204-216 (2017).
- Dixon, W. J., Mood, A. M. A method for obtaining and analyzing sensitivity data. The Journal of the American Statistical Association. 43 (241), 109-126 (1948).
- Dixon, W. The up-and-down method for small samples. The Journal of the American Statistical Association. 60, (1965).
- Bonin, R. P., Bories, C., De Koninck, Y. A simplified up-down method (SUDO) for measuring mechanical nociception in rodents using von Frey filaments. Molecular Pain. 10, 26(2014).
- Ramachandran, R. Neurogenic inflammation and its role in migraine. Seminars in Immunopathology. 40 (3), 301-314 (2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K. Does inflammation have a role in migraine. Nature Reviews Neurology. 15 (8), 483-490 (2019).
- Stokely, M. E., Orr, E. L. Acute effects of calvarial damage on dural mast cells, pial vascular permeability, and cerebral cortical histamine levels in rats and mice. Journal of Neurotrauma. 25 (1), 52-61 (2008).
- Theoharides, T. C., Donelan, J., Kandere-Grzybowska, K., Konstantinidou, A. The role of mast cells in migraine pathophysiology. Brain Research Reviews. 49 (1), 65-76 (2005).
- Conti, P., et al. Progression in migraine: Role of mast cells and pro-inflammatory and anti-inflammatory cytokines. European Journal of Pharmacology. 844, 87-94 (2019).
- Rea, B. J., et al. Peripherally administered calcitonin gene-related peptide induces spontaneous pain in mice: implications for migraine. Pain. 159 (11), 2306-2317 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유