Method Article
頭痛の前臨床モデルとしてのマウスにおける硬膜刺激および眼窩周囲フォンフレイ試験
要約
片頭痛の最も顕著な症状は重度の頭部痛であり、これは髄膜を神経支配する感覚ニューロンによって媒介されるという仮説が立てられている。ここでは、顔面過敏症をアウトプットとして、低侵襲で硬膜に物質を局所的に塗布する方法を提示する。
要約
硬膜、くも膜、およびピアマットからなる頭蓋髄膜は、主に神経系の構造的機能を果たすと考えられている。 例えば、それらは頭蓋骨から脳を保護し、皮質の血管およびニューロン供給を固定/組織化する。しかし、髄膜はまた、片頭痛の間に経験される痛みが局所的な無菌炎症およびそれに続く局所侵害受容性求心性の活性化に起因する片頭痛などの神経系障害にも関与している。髄膜の層のうち、硬膜は片頭痛の病態生理学において特に興味深い。それは高度に血管化され、局所的な侵害受容性ニューロンを保有し、免疫細胞などの多様な常在細胞の本拠地である。局所髄膜微小環境の微妙な変化は、硬膜血管周囲侵害受容器の活性化および感作をもたらし、したがって片頭痛の痛みをもたらし得る。研究は、硬膜求心性心理がin vivo電気生理学、イメージング技術、または行動モデルのいずれかを使用して活性化/感作される方法に対処しようとしてきましたが、これらは一般的に非常に侵襲的な手術を必要とします。このプロトコルは、マウスの硬膜上に化合物を比較的非侵襲的に適用するための方法と、硬膜刺激後の眼窩周囲フォンフライ試験を用いて頭痛様触覚感受性を測定するための適切な方法を提示する。この方法は、硬膜および頭蓋骨の完全性を維持し、融合していない矢状縫合糸およびラムドイド縫合糸の接合部に0.65mmの改変カニューレを介して物質を注入することによって、侵襲的技術による交絡効果を低減する。この前臨床モデルにより、研究者は、頭蓋骨および髄膜に傷害のない状態を維持しながら、侵害受容器の活性化、免疫細胞の活性化、血管の変化、および疼痛行動などの片頭痛の病理学的進行における広範囲の硬膜刺激およびそれらの役割を調査することを可能にする。
概要
片頭痛の痛みは、世界中の主要な公衆衛生上の問題のままです。世界保健機関(WHO)は、地球人口の15%弱を苦しめ、社会にかなりの社会経済的負担を引き起こしている、世界で6番目に流行している病気としてランク付けしています2,3。治療の選択肢とその有効性は最適ではなく、症候性の軽減を提供するだけであり、片頭痛の発生の根底にある病態生理学的事象を有意に変化させない4,5。治療の成功の欠如は、片頭痛が病理があまり理解されていない多因子性障害であり、限られた数の治療標的につながる可能性が高い。片頭痛はまた、特に片頭痛の診断が、オーラ、頭痛、光恐怖症、およびアロディニアなどの片頭痛の特徴に関する経験を説明する患者との口頭でのコミュニケーションに基づいて行われることを考えると、動物モデルで完全に捕捉することも困難である。それにもかかわらず、片頭痛治療における最近の進歩は、現在、前臨床モデルによって十分に検証された多くの神経学的状態の治療を上回っていることに注意することが重要です。例えば、カルシトニン遺伝子関連ペプチドまたはその受容体を標的とするモノクローナル抗体および小分子は、片頭痛患者の生活の質を改善するのに非常に成功しており、片頭痛の臨床管理を潜在的に変革することができる。この障害の理解は進歩してきましたが、まだ解明されていないことがたくさんあります。
前臨床動物モデルおよびヒト研究に基づいて、片頭痛は、三叉神経および上部子宮頸部背根神経節を介して信号を送る髄膜内の侵害受容性線維の異常な活性化によって開始されることが広く受け入れられている6、7、8、9、10。この理論にもかかわらず、多くの研究は依然として片頭痛の根底にある寄与メカニズムを理解するために薬物の全身投与を使用しています。薬物の全身投与は我々の理解を実質的に強化したが、これらの知見は、標的組織内の局所作用が片頭痛において役割を果たすかどうかを直接評価するものではない。逆に、いくつかの研究は硬膜を刺激するアプローチを取っています。しかし、これらの実験では、侵襲的開頭術によるカニューレ移植と回復時間の延長が必要です11,12。これらの制限のために、我々は、開頭術の欠如が手術後の回復を排除し、覚醒した動物における即時検査を可能にする硬膜を局所的に刺激するための低侵襲アプローチを開発しました12,13,14。これらの注射は、軽いイソフルラン麻酔下で行われ、マウスの矢状縫合糸およびラムドイド縫合糸の接合部で投与される。
げっ歯類における侵害受容性行動応答を評価するために、いくつかのアプローチが開発されている15。皮膚異痛症は片頭痛患者の約80%で報告されており16,17、げっ歯類に使用するための潜在的な翻訳エンドポイントを表しています。前臨床モデルでは、げっ歯類の足底領域へのフォン・フレイフィラメントの適用が、前臨床片頭痛モデルにおける疼痛挙動を評価するために用いられてきた。このアプローチの主な制限は、頭蓋領域をテストしないことです。顔面グリマススコアリングは、疼痛刺激の誘発後の表情を分析することによって、げっ歯類の疼痛行動を捉えるために使用されている18,19。しかし、その限界には、急性刺激に対する応答の捕捉のみが含まれ、慢性口腔顔面疼痛状態は含まれない。顔面グルーミングおよび飼育の減少もまた、片頭痛の前臨床モデルにおける行動応答の出力と考えられている20,21。前者の限界には、疼痛反応を通常の日常的なグルーミングおよびかゆみなどの他の感覚と区別することの難しさが含まれる。後者の場合、飼育行動は通常、げっ歯類を新しい環境に導入した後すぐに減少する。これらの行動エンドポイントのそれぞれは、疼痛状態に寄与する様々なメカニズムの理解において価値があるが、片頭痛などの疼痛障害の前臨床モデルが、頭蓋過敏症応答を特異的に捕捉するエンドポイントを含むことが決定的に必要である。硬膜刺激後の眼窩周囲皮膚の触覚過敏症を評価することは、感覚症状が本質的に主に頭蓋骨である片頭痛に寄与するメカニズムについてのより良い洞察を提供する方法である。ここで、片頭痛の前臨床モデルとしてマウス硬膜上に物質を投与する方法について説明する。硬膜適用に続いて、我々はまた、Dixonアップダウン法で適用された較正されたフォンフレイフィラメントを使用して眼窩周囲触覚過敏症を試験するための詳細な方法を提示する。
プロトコル
すべての手続きは、テキサス大学ダラス校の機関動物ケアおよび使用委員会の事前承認を得て実施されました。ICR(CD-1)(30-35g)およびC57/BL6(25-30g)マウスを6~8週齢で本試験に使用した。
1. 硬膜注入器
- マウス注入器/注入器を作成するには、調整可能な非金属溶融シリカプラスチックキャップで片側注射用の市販の内部カニューレと注入器を変更し、内径(I.D.)が0.18mm、外径(O.D.)が0.35mmの28Gガイドカニューレに挿入/下に挿入/延長します(図1A)。
- ノギスまたはその他の測定装置を使用して、注入器の溶融シリカプラスチックキャップを0.6mmの長さに調整します。注入器の先端からシリカプラスチックキャップの端まで測定する。
- プラスチックキャップを調整するときは、注入器を曲げたり鈍らせたりしないように注意してください。
- 以前に硬膜注射に使用されていない他のマウス系統については、長さを0.6mmに設定し、インクまたは染料でパイロット注射を行い、染料が硬膜にのみあり、脳または頭蓋骨にはないことが観察されるまで注入器の長さを調整することによって、最適な注入器の長さを決定する。
- 調整された注入器の長端(または0.6mmと測定されなかった端)をプラスチックチューブ(ポンプチューブ、2ストップ、内径0.19mm、長さ406mm)に取り付けます。
- チューブを最小の長さの 8 インチに切断して、5 μL の容量を保持するのに十分なラインがあることを確認します。
- チューブが注入器の金属部分とプラスチックストッパーの上部を覆っていることを確認してください。これにより、ラインに気泡が溜まるのを防ぐことができます。
- チューブのもう一方の端を10 μLのガラス製マイクロシリンジ(気密、接合針、10 mm突起付きで21 G)に取り付け、シリンジの金属部分にしっかりとシールを貼ってください(図1A)。
- ラインが接続されたら、シリンジに5 μLのリン酸緩衝生理食塩水(PBS)、合成間質液(SIF)、または気泡の形成を防ぐために選択した他のビヒクルをバックフィルします。
- ラインに気泡が観測された場合は、気泡が消えるまで車両でラインを溢れさせます。
注:シリンジをラインに取り付ける前に車両を充填し、接続後に液体をラインに押し込むと役立つ場合があります。
- ラインに気泡が観測された場合は、気泡が消えるまで車両でラインを溢れさせます。
- ラインに5 μLのビヒクルがバックフィルされ、効率的に作業した後、5 μLの薬物/溶液をハミルトンシリンジにロードします(この技術を学習または実践する場合は、インクまたは染料を薬物/溶液の代替として使用できます)。
- 硬膜に投与されたすべてのビヒクル溶液がpH 7.4に維持され、オスモル濃度が310まで測定されていることを確認します。これは、硬膜内の酸感知イオンチャネルおよび他の浸透圧感受性チャネルの潜在的な活性化を減少させる。
- 脳への漏出を引き起こさなかったマウスで試験された最大体積は約10μLである。この体積の注射後の行動効果は試験されていない。このため、硬膜上に5μLの溶液のみを投与する。
注:これらの観察は、6〜8週齢のCD1 / ICRマウスのマウス系統/年齢/体重に基づいています。
2.硬膜注射
- シリンジが準備され、薬物が装填されたら、マウスを腹部に平らに置き、ノーズコーンを介して酸素流量0.5〜1L /分の短い3%イソフルラン下で麻酔する。
- マウスがピンチ反射を表示しなくなったら、麻酔を調整し、1.5%イソフルランで維持します。
- 麻酔をかけたら、滅菌眼軟膏を目に塗り、動物の頭を剃り、ポビドンヨードとエタノールで皮膚を消毒します。これに続いて、注射を成功させるのに役立つ位置に着きます。
- 片手で動物の頭を固定し、もう片方の手で注入器を持ちます。
- マウスの頭蓋骨上の矢状縫合糸と羊根状縫合糸の接合部を注意深く調べて見つけます(図1B、C)。
- 皮膚を通してこの目立たない接合部を見つけるには、頭蓋骨の地形学的特徴を使用し、注入器との接合部の一般的な位置を静かにプローブする。
- 頭蓋骨に沿って注入器を再配置し、正確な位置を感じて、接合部の位置を確認します。
- 縫合糸が位置し、注入器が所定の位置に収まったら、注入器が皮膚を貫通し、プラスチックストッパーまで接合部に落ちるまで、非常にゆっくりと静かに前後に揺れます。
メモ: インフューザーの 0.6 mm 先端全体を必ず接合部に挿入してください。 - 精度を検証するには、インクまたは染料を注射液として使用し、マウスを安楽死させて首を切ってください。
- 頭蓋骨キャップを取り外して、硬膜内の色素を視覚化します(図1C)。
注:染料は頭蓋骨の脳や外側に観察しないでください。同様に、いずれの実験においても、マウスは、注射の精度を検証し、硬膜の完全性が損傷を受けていないことを確認するために、死後にチェックされるべきである。
- 頭蓋骨キャップを取り外して、硬膜内の色素を視覚化します(図1C)。
- 注射後、マウスを麻酔から取り出し、意識を取り戻すのを待ってからケージに戻るか、試験室に入れて目的のアッセイを開始します。
メモ: 行動実験を行う前に、マウスが麻酔から回復するまで最低 30 分間待ってください。
3. 眼窩周囲フォン・フレイ
- 約16〜20匹のマウスのコホートで研究を開始する。
- 馴化の前日に1回、各マウスを少なくとも5分間取り扱います。
- 取り扱いから約24時間後に、マウスを試験室条件およびフォンフライ試験装置に慣れさせる(図2A)。
注:アクリル試験装置は、約3 in x 3.5 in x 5インチ(W x H x D)の蓋付きの個々のコンパートメントで構成され、0.25 in 19 G角形亜鉛メッキスチールメッシュワイヤを介して接続されたアルミニウムスタンドによって支えられています。- マウスを、無臭でポリエチレンやパラフィンワックスを含まない水平に配置された4オンスの白い紙コップの中に置きます。
注:これらのタイプのカップは、摂取するとマウスの胃腸の不調を軽減するため、好ましい(図2B)。
- マウスを、無臭でポリエチレンやパラフィンワックスを含まない水平に配置された4オンスの白い紙コップの中に置きます。
- 動物がそれぞれの部屋にいる間、動物を落ち着かせ、動物への不必要なストレスを避けるために、各マウスの個々の部屋に通常の固形飼料のペレットを置きます。フォン・フレイの動作テストの前に3日間これを行います。
- マウスがチャンバーにいるたびに、食物にアクセスできることを確認してください。
- 各動物に番号を付け、テストラック内の同じスペースに割り当てます。試験期間中の毎日同じカップにマウスを入れて、各動物がその試験環境に順応することを確認します。
注:マウスはカップをかじり、その後カップを破壊します。このような場合は、カップを交換し、対応するマウス番号でラベルを付けます。
- 最初の3日間の馴化に続いて、マウスを個々の部屋に入れる。
- フォン・フライ試験の前に動物を試験室およびチャンバーに少なくとも1時間順応させて、マウスが落ち着き、その後試験が容易になるようにする。
- 試験日に部屋に順応した後、カップに入れたままマウスを1匹ずつそれぞれのチャンバーから取り出します。
- マウスが前足と後足の両方にあるようにカップを水平位置に保ち、体重を均等に分散させます。
注:体重分布が等しくないと、動物の反応が変化し、動物の反応を妨げることさえあります。
- マウスが前足と後足の両方にあるようにカップを水平位置に保ち、体重を均等に分散させます。
- マウスを入れたカップを、吸収パッドのテストラックの下のテーブルの上に置きます。
- 眼窩周囲フォンフレイ試験では、0.07gフォンフレイフィラメントを顔の中心と目の間に直接置きます。
- フィラメントに十分な圧力をかけて、フォン・フレイの毛を「C」字型に曲げます。
- 少なくとも3秒以上5秒以内に、またはマウスが頭を引っ込めて足でフィラメントをスワイプするまで、領域との接触を維持します。
注:試験中にフィラメントが滑ったり、フィラメントの先端が動物に触れたりした場合、反応はカウントされません。これらの応答は、異なるメカノレセプターによって活性化されるブラシに応答している可能性があり、したがって正確な結果を反映していない可能性がある。 - フォン・フレイ・フィラメントをディクソンの「アップダウン」法22,23に従って塗布する。
- 最初に、0.07gの重量を有するフォン・フライフィラメントを塗布する。この研究で可能な最低フィラメントと最も高い試験フィラメントは、それぞれ0.008gおよび0.6gの重量を有するフィラメントである。
- このアッセイを実行するために、重量0.008g、0.02g、0.04g、0.07g、0.16g、0.4g、および0.6gのフィラメントを使用する。
- この方法では、動物がフィラメントに応答しない場合、次に高いグラム重量のフィラメントを適用する。
- マウスがフィラメントに応答する場合は、そのマウスがそのフィラメントに応答すると考えてください。この場合、次に低いグラム重量のフィラメントを塗布する。
- 動物が初期応答の4回後に試験されるまで、または動物がアッセイで試験されたフィラメントに応答しないと判断されるまで、このパターンを繰り返す。
メモ: 腕や手首にこれ以上の圧力をかけないでください。スケールは、フィラメントの適用を練習するために使用され得る。
- 少なくとも3秒以上5秒以内に、またはマウスが頭を引っ込めて足でフィラメントをスワイプするまで、領域との接触を維持します。
4. ベースライン引き出ししきい値のテスト
- 実験に含める前に、マウスが0.5〜0.6gの間のベースライン離脱閾値に達していることを確認してください。
- マウスは、ステップ 3.9.2.2 で説明したシリーズでテストされたフィラメント (0.07 g、0.16 g、0.4 g、および 0.6 g) に応答しない場合、ベースラインに到達します。
- ベースライン離脱閾値を確立する際にマウスを毎日試験する。
- 試験により、動物は試験条件とフォンフライフィラメントの圧力に順応することができます。
- テストの3日目以降もマウスが依然として非常に過敏である場合は、再度テストする前に1〜2日待ってみてください。
注:試験日数が長すぎると、動物が眼窩周囲領域のフィラメントの重量に適応できず、目標とする離脱閾値に達しない可能性があります。
- 試験マウスを約7日間観察してから、どの動物が実験の包含基準を満たしていないかを決定する。
注:マウスの約70%が目標ベースラインレベルに達する。- 硬膜刺激の前に、ベースラインデータを分析して、0.5〜0.6グラム以上のベースライン値に達していないマウスを除外する。
- 除外後、残りの各マウスをテストグループにランダムに割り当てます。これを実現するには、カップから引き出すか、スプレッドシートにスクリプトを書いて、数字をグループにランダム化します。
5. フォン・フライ結果の解析
- 一連の応答が得られたら、以前に公開された方法24に従って、デルタ、k値、50%閾値、および離脱閾値をグラム単位で決定する。
- この式WT = 10(x*F+B)を使用して離脱しきい値を計算します。ここで、WT = 離脱しきい値、F = シャプラン法で計算された足の離脱しきい値、B = 対数(曲げ力)の線形回帰 = x*フィラメント数 + B
- データを50%の離脱しきい値または平均引き出ししきい値(グラム単位)としてプロットします。
結果
この注射方法は、マウスの硬膜に刺激を投与し、その後の行動試験が行われるようにするために使用される。このモデルで測定された最も一般的な行動出力は、von Frey12,13,14を介して評価された皮膚顔面過敏症である。ここでは、片頭痛病理に対する潜在的な性別特異的寄与を評価するためにこのモデルをどのように使用できるかを示す(図3)。
この手順は、機械的に誘発された顔面過敏症に対する硬膜プロラクチン(PRL)の影響を調べるために使用されてきました14 (図3)。この研究の結果は、雌ICRマウスが5μgの硬膜プロラクチンに応答して顔面離脱閾値を有意に低下させることを実証した(図3A)。0.5μgのプロラクチン(PRL)の10倍の低用量も、高用量のPRLと同様の応答を示した(図3B)。
これらの注射はまた、グリマスを介して評価された自発的な痛み関連行動を引き起こすことが示されている。硬膜0.5μgのPRLは、雌マウスにおいて有意なグリマシングを引き起こし(図3C)、さらに、雌片頭痛様行動における硬膜PRLの明確な役割を実証した。我々は、フォン・フレイフィラメントを用いたすべての試験の前にグリマスアッセイを実施した。
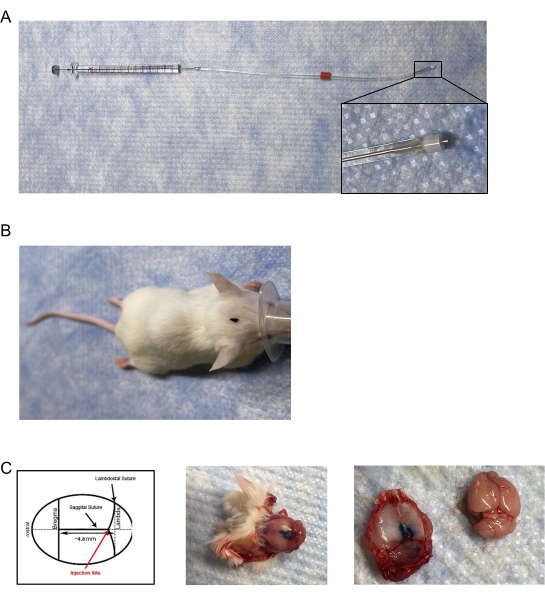
図1:硬膜注入器および注射配置。 (A)注射器/注入器は、〜0.5mm〜0.65mmの長さに調整された改質カニューレで構成され、タイゴンチューブを介して10μLの気密シリンジに接合された針に取り付けられた。(B)マウスの頭部上のマークされた注射部位位置の航空写真。(c)(左パネル)硬膜注射の位置の図。注射の配置は、ブレグマの後約4.8mmのラムドイドおよび矢状縫合糸の接合部にある。(中央パネル)5 μLの青色注射色素の硬膜注射後のマウス頭蓋骨の死後航空写真。(右パネル)マウスの頭蓋骨を脳から分離する。脳上の青色注射色素の観察可能な漏れはなかった。 この図の拡大版を表示するには、ここをクリックしてください。

図2:フォン・フレイ 試験室(A)フォン・フライ試験室は、金網ラック上に蓋が置かれた個々のアクリル室の3.5インチx 3.5インチで構成されています。これらは、2列に編成された10室の列を介して接続されています。(b)フォン・フライ試験室の内部に収容された個々のカップ内のマウスの例。 この図の拡大版を表示するには、ここをクリックしてください。
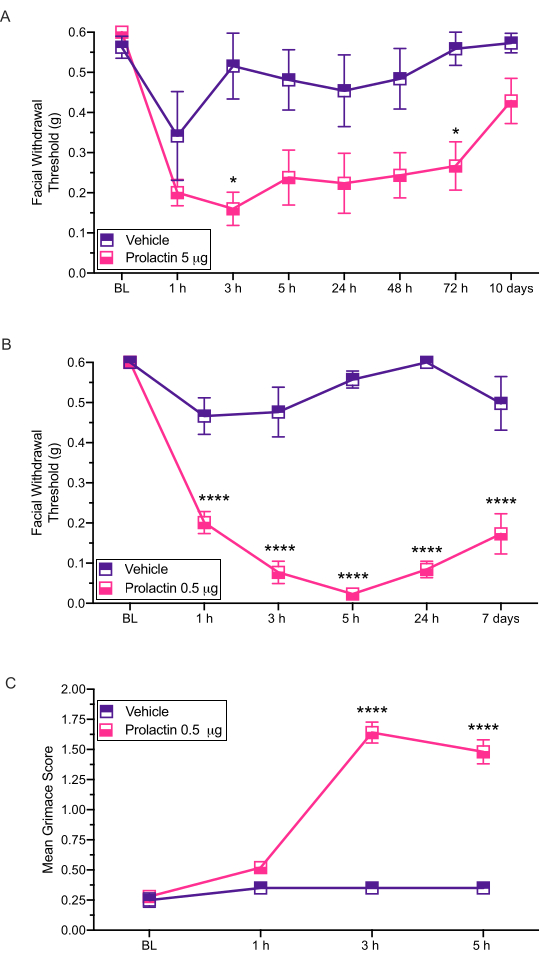
図3:プロラクチンの硬膜適用は、マウスにおける行動応答を誘導する。 機械的離脱閾値は、雌マウスにおけるPRL(5μgまたは0.5μg)の硬膜適用後に評価した。(A)5μgのPRL(n=7PRL、n=6ビヒクル)の適用は、ビヒクルと比較して顔面過敏症を誘発した。(B)0.5μgのPRL(n = 5 PRL、n = 4ビヒクル)の適用は、長期間持続する顔面過敏症を誘発した。(c)グリマスも、各時点で0.5μgのPRLで処置した同じマウスで評価した。これらのマウスは、ビヒクルで処置したマウスと比較して有意に高いグリマススコアを示した。統計: 二元配置分散分析の後にボンフェローニ多重比較ポストホック分析が続きます。データはSEM±平均として表されます。*p <0.05、****p <0.0001。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
硬膜における局所侵害受容系における不適応変化は、組織損傷の欠如にもかかわらず、片頭痛発作の頭痛期への主要な寄与と考えられている25,26。ここでの研究は、硬膜の低侵襲刺激が顔面触覚過敏症を誘発し得る方法を提示する。頭蓋や組織に損傷を与えることなく硬膜侵害受容器の活性化に関与するメカニズムや事象を解明することは、前臨床モデルにおける片頭痛のメカニズムをより正確に反映する可能性がある。
開頭術とカニューレ移植は、片頭痛の痛みに寄与する機能とメカニズムを評価するために長い間使用されてきました11,12。しかし、開頭術は硬膜肥満細胞の活性化を誘導し、げっ歯類の真珠膜血管透過性を増加させることが報告されている27。硬膜における肥満細胞の活性化が片頭痛7、8、28、29に大きく関与していることを考えると、この技術には解釈を歪める可能性のある大きな警告があります。矢状縫合糸とラムドイド縫合糸の接合部を介して物質を投与することは、開頭術誘発肥満細胞活性化によって媒介される侵害受容器の活性化を効果的に減少させる。さらに、非侵襲的硬膜刺激は、手術後の回復および結果の解釈を変える可能性のある鎮痛薬の投与を必要としない。硬膜への物質の局所適用により、研究者は、作用部位が容易に決定されない薬物の全身投与とは対照的に、この特定の標的組織に集中することができる12,13,14。ニトログリセリンやカルシトニン遺伝子関連ペプチドなどの物質の全身投与は、片頭痛に類似したヒトにおける実験的攻撃を引き起こすが、げっ歯類モデルにおける作用位置の評価は可能ではない。より標的化された組織特異的モデルは、代替アプローチを提供する。
ここで説明するこの技術は、頭蓋骨の矢状縫合糸とランドイド縫合糸が出会う接合部を通って髄膜の硬膜に直接薬物または他の溶液を注入することを含む。最良の結果を得るには、6〜8週齢のICR(CD-1)またはC57/BL6マウスをこれらの実験に使用する必要があります。若いマウスを使用することができる;しかし、8週間以上経過したICR(CD-1)マウスの使用は、頭蓋骨プレート縫合糸が通常この年齢で完全に融合し、頭蓋骨を損傷せずに注射することが不可能であるため、推奨されない。また、この手順を実行する各マウスの重量/サイズを考慮することも重要です。頭蓋骨は通常、より低い重量で非常に薄く、注射中に加えられた圧力に耐えられない可能性があるため、これらの注射は19gを超える体重を有する動物に対して行われることが推奨される。重要なのは、頭蓋骨プレート融合が起こる年齢/体重に寄与する可能性のある要因(例えば、動物施設で使用される実験室の固形飼料の組成)もある。したがって、実験者は、自分の条件に適した年齢/体重範囲を決定する必要があるかもしれません。他のマウス系統または遺伝子型には、頭蓋骨プレートがそれらの動物でいつ融合するかに応じて、異なる年齢範囲および動物の体重が必要な場合があり、注射自体の最適化も必要になる可能性がある。
この技術を学習または実践するときは、安楽死させたマウスの縫合接合部を見つけることである程度の快適さを得ることを強くお勧めします。これらのマウスで頭皮を切除または剥がして最初に練習し、ゆっくりと皮膚を通して接合部の位置を特定するのが最善かもしれません。正確な位置を確立したら、インクと染料を硬膜に注入して、位置の精度と注入の深さを検証できます。この技術は、ICR(CD-1)マウス(30-35g)およびC57/BL6マウス(25-30g)を用いて開発され、最適化された。0.5〜0.6mmの注入器の長さは、25〜35gの範囲内の体重のマウスを注入するのに十分である。しかしながら、注入器の長さは、この技術を最適化するために使用されるマウスと有意に異なるマウスを注射する場合、較正される必要があるかもしれない。たとえば、マウスが 25 g より小さい場合、長さが 0.5 mm 未満の注入器が使用される可能性があります。この技術を習得し、年齢に適したマウスで行った場合、この注射の成功率は100%に近くなる可能性があります。しかし、注射の合併症は、注入器を挿入するにはあまりにも多くの力を加えることによる頭蓋骨の骨折や、髄膜血管の損傷によって引き起こされる異常な出血などの問題に起因する可能性がある。
触覚感度の変化は、げっ歯類の疼痛行動を評価する際の重要な測定値です。ここでは、前臨床片頭痛モデルにおけるこれらの挙動を評価するための眼窩周囲フォンフライ試験の使用を実証する。片頭痛モデルでこの技術を使用する主な利点は、足などの他の非頭蓋位置よりも関連性が高い頭部の過敏症を評価できることです。再現性のある結果を確実にするための重要なステップは、マウスが完全にベースライン化されていることを確認することです。これには、フォン・フライ・フィラメントを正確に適用できるよく訓練された実験者が必要です。動物がベースラインに達するまでに約7日かかる可能性があります。しかし、すべての動物が目標とするベースラインに達するわけではない可能性があります。我々の経験では、マウスを用いて約7日間作業した後、動物の60%〜70%のみが眼窩周囲領域で0.6gのベースラインに達するが、これは動物のコホートに依存する。このタイミングは、実験を開始する前に考慮して、脱落を説明するために十分な数が使用され、動物がこの非侵襲的方法を使用して硬膜を刺激するためのベースライン後の適切な年齢であることを確認する必要があります。ベースラインを決定するための手順は、プロトコルセクション4で概説されています。
フォン・フレイ検査の限界は、疼痛反応と日常的なグルーミング/かゆみを区別するのが難しいことです。痛みとグルーミングを区別するために、この行動が起こる時間の長さに注意することが重要です。通常、疼痛反応はフィラメント塗布後の1回のスワイプですが、グルーミング行動は延長される傾向があり、数秒から数分続くことがあります。グルーミング/かゆみの行動が過敏反応と区別できない場合は、これを応答として記録しないのが最善です。さらに、不適切なフィラメントの配置(フィラメントの滑りなど)は、動物のグルーミングを長期間招き、適切なテストを困難にする可能性があります。このような場合、実験者はグルーミングが停止し、マウスがテストするのに十分なほど落ち着くまで待つ必要があります。グルーミング動作の開始前に使用したのと同じフィラメントから続行します。マウスが非常に長い時間続く場合は、マウスを試験室に約5分間戻します。5分が経過したら、マウスをもう一度テストしてみてください。この動作が解決せずに続く場合、マウスは研究から削除する必要があります。重要なのは、マウスの皮膚が脱毛後に同じ感受性を保持するかどうかは不明であり、脱毛のプロセス(シェービング、脱毛クリーム)も皮膚の感受性に影響を与える可能性があるため、顔の毛皮を剃ることは推奨されません。
ほとんどの状況では、マウスがベースラインに達してから24時間以内に硬膜に物質を投与するのに理想的です。マウスは1時間に1回フォンフライフィラメント試験を受けることをお勧めします。可能であれば、1時間おきにテストすることで、テスト後に動物が落ち着くのに十分な時間が与えられます。さらに、実験は概日パターンを妨げないようにタイミングを合わせる必要があります。マウスの概日リズムの変化は、行動表現型を変化させ、最終的には再現不可能な結果をもたらす可能性がある。
眼窩周囲フォンフレイ試験は、実験的結論を強化するために他の行動アッセイと組み合わせて使用することができる。グリマススケールは、誘発された反応ではなく、げっ歯類の自発的な表情に依存しています18,19。この方法は、急性疼痛行動を評価および定量化する際に高い精度および信頼性を有し、片頭痛の多くの前臨床モデルにおいて使用されている12,30。グリマスアッセイと眼窩周囲フォンフレイアッセイの両方を使用する場合、実験者は、フォンフレイフィラメントをマウスの眼窩周囲領域に適用する前に、グリマスのスコアリングを考慮する必要があります。これにより、グリマシング動作が自発的であり、フィラメントの塗布によって誘発されないことが保証されます。後肢の機械的過敏症は、眼窩周囲フォンフライ試験と組み合わせて使用することもできる。グリマススコアリングとは対照的に、後肢過敏症を評価する前に顔面過敏症をテストするのが最善です。後肢試験では、眼窩周囲フォンフライ試験が完了した後、マウスをカップなしでチャンバーに戻す必要があります。
結論として、マウスにおける眼窩周囲フォンフレイ試験および非侵襲的硬膜刺激は、片頭痛の前臨床モデルの現在の範囲に貴重な選択肢を追加する。正しく実行されると、この技術は、カニューレの外科的移植を必要としないため、げっ歯類に頭痛様表現型を生成するための洗練されたアプローチを提示する。ラットでは、カニューレは細菌感染を起こしやすく、目詰まりを起こしたり、脱落したりする可能性があり、各動物を1匹飼育する必要があり、動物に不必要なストレスを与えます。さらに、硬膜刺激プロトコルは、いくつかの薬物用途で使用するように容易に変更することができる。眼窩周囲フォンフレイ試験パラダイムは、実験仕様に最も適合するように変更することもできます。さらに、眼窩周囲フォンフレイ検査は、他の口腔顔面疼痛障害に使用することができる。これらの技術は、片頭痛の痛みの複雑な根底にあるメカニズムをさらに理解するのに役立つ重要なツールです。
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、米国国立衛生研究所(NS104200およびNS072204~GD)の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| 4 oz Hot Paper Cups | Choice Paper Company | 5004W | https://www.webstaurantstore.com/choice-4-oz-white-poly-paper-hot-cup-case/5004W.html |
| Absorbent Underpads | Fisherbrand | 14-206-65 | https://www.fishersci.com/shop/products/fisherbrand-absorbent-underpads-8/p-306048 |
| C313I/SPC Internal 28 G cannula | P1 Technologies (formerly Plastics One) | 8IC313ISPCXC | I.D. 18 mm, O.D. 35 mm |
| Gastight Model 1701 SN Syringes | Hamilton | 80008 | https://www.hamiltoncompany.com/laboratory-products/syringes/80008 |
| Ismatec Pump Tubing, 0.19 mm | Cole-Palmer | EW-96460-10 | https://www.coleparmer.com/i/ismatec-pump-tubing-2-stop-tygon-s3-e-lab-0-19-mm-id-12-pk/9646010 |
| Stand with chicken wire | Custom | The galvanized steel chicken wire dimensions are 0.25 in. x 19-gauge | |
| Testing Rack with individual Chambers | Custom | Each chamber should have a division between each mouse and lids to contain the mouse. The chambers should also be large enough to hold a 4 oz. paper cup. | |
| von Frey Filaments | Touch test/Stoelting | 58011 | https://www.stoeltingco.com/touch-test.html |
参考文献
- GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 390 (10100), 1211-1259 (2017).
- Woldeamanuel, Y. W., Cowan, R. P. Migraine affects 1 in 10 people worldwide featuring recent rise: A systematic review and meta-analysis of community-based studies involving 6 million participants. Journal of the Neurological Sciences. 372, 307-315 (2017).
- Burch, R. C., Loder, S., Loder, E., Smitherman, T. A. The prevalence and burden of migraine and severe headache in the United States: updated statistics from government health surveillance studies. Headache. 55 (1), 21-34 (2015).
- Ashina, M. Migraine. New England Journal of Medicine. 383 (19), 1866-1876 (2020).
- Ashina, M., et al. Migraine: integrated approaches to clinical management and emerging treatments. Lancet. 397 (10283), 1505-1518 (2021).
- Jacobs, B., Dussor, G. Neurovascular contributions to migraine: Moving beyond vasodilation. Neuroscience. 338, 130-144 (2016).
- Koyuncu Irmak, D., Kilinc, E., Tore, F. Shared Fate of Meningeal Mast Cells and Sensory Neurons in Migraine. Frontiers in Cellular Neuroscience. 13, 136(2019).
- Levy, D. Migraine pain, meningeal inflammation, and mast cells. Current Pain and Headache Reports. 13 (3), 237-240 (2009).
- Levy, D., Labastida-Ramirez, A., MaassenVanDenBrink, A. Current understanding of meningeal and cerebral vascular function underlying migraine headache. Cephalalgia. 39 (13), 1606-1622 (2019).
- Phebus, L. A., Johnson, K. W. Dural inflammation model of migraine pain. Current Protocols in Neuroscience. , Chapter 9, Unit 9.1 (2001).
- Fried, N. T., Maxwell, C. R., Elliott, M. B., Oshinsky, M. L. Region-specific disruption of the blood-brain barrier following repeated inflammatory dural stimulation in a rat model of chronic trigeminal allodynia. Cephalalgia. 38 (4), 674-689 (2018).
- Avona, A., et al. Dural calcitonin gene-related peptide produces female-specific responses in rodent migraine models. The Journal of Neuroscience. 39 (22), 4323-4331 (2019).
- Burgos-Vega, C. C., et al. Non-invasive dural stimulation in mice: A novel preclinical model of migraine. Cephalalgia. 39 (1), 123-134 (2019).
- Avona, A., et al. Meningeal CGRP-Prolactin interaction evokes female-specific migraine behavior. Annals of Neurology. 89 (6), 1129-1144 (2021).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- Lipton, R. B., et al. Cutaneous allodynia in the migraine population. Annals of Neurology. 63 (2), 148-158 (2008).
- Goadsby, P. J. Migraine, allodynia, sensitisation and all of that. European Neurology. 53, Suppl 1 10-16 (2005).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-449 (2010).
- Mogil, J. S., Pang, D. S. J., Silva Dutra, G. G., Chambers, C. T. The development and use of facial grimace scales for pain measurement in animals. Neuroscience & Biobehavioral Reviews. 116, 480-493 (2020).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. The Journal of Headache and Pain. 20 (1), 11(2019).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central CGRP mechanisms. The journal of Neuroscience. 37 (1), 204-216 (2017).
- Dixon, W. J., Mood, A. M. A method for obtaining and analyzing sensitivity data. The Journal of the American Statistical Association. 43 (241), 109-126 (1948).
- Dixon, W. The up-and-down method for small samples. The Journal of the American Statistical Association. 60, (1965).
- Bonin, R. P., Bories, C., De Koninck, Y. A simplified up-down method (SUDO) for measuring mechanical nociception in rodents using von Frey filaments. Molecular Pain. 10, 26(2014).
- Ramachandran, R. Neurogenic inflammation and its role in migraine. Seminars in Immunopathology. 40 (3), 301-314 (2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K. Does inflammation have a role in migraine. Nature Reviews Neurology. 15 (8), 483-490 (2019).
- Stokely, M. E., Orr, E. L. Acute effects of calvarial damage on dural mast cells, pial vascular permeability, and cerebral cortical histamine levels in rats and mice. Journal of Neurotrauma. 25 (1), 52-61 (2008).
- Theoharides, T. C., Donelan, J., Kandere-Grzybowska, K., Konstantinidou, A. The role of mast cells in migraine pathophysiology. Brain Research Reviews. 49 (1), 65-76 (2005).
- Conti, P., et al. Progression in migraine: Role of mast cells and pro-inflammatory and anti-inflammatory cytokines. European Journal of Pharmacology. 844, 87-94 (2019).
- Rea, B. J., et al. Peripherally administered calcitonin gene-related peptide induces spontaneous pain in mice: implications for migraine. Pain. 159 (11), 2306-2317 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved