Method Article
تحفيز الجافية واختبار فون فراي حول الحجاج في الفئران كنموذج قبل سريري للصداع
In This Article
Summary
أبرز أعراض الصداع النصفي هو ألم شديد في الرأس ، ويفترض أن هذا يتم بوساطة الخلايا العصبية الحسية التي تعصب السحايا. هنا ، نقدم طريقة لتطبيق المواد محليا على الجافية بطريقة طفيفة التوغل أثناء استخدام فرط الحساسية للوجه كمخرج.
Abstract
ويعتقد أن السحايا القحفية، التي تتألف من الأم الجافية والعنكبوتية والبيا ماتر، تخدم في المقام الأول الوظائف الهيكلية للجهاز العصبي. على سبيل المثال ، فإنها تحمي الدماغ من الجمجمة وترسو / تنظم إمدادات الأوعية الدموية والعصبية للقشرة. ومع ذلك ، فإن السحايا متورطة أيضا في اضطرابات الجهاز العصبي مثل الصداع النصفي ، حيث يعزى الألم الذي يحدث أثناء الصداع النصفي إلى التهاب معقم موضعي والتنشيط اللاحق للمؤثرين المحليين المسبب للألم. من بين الطبقات في السحايا ، فإن الأم الجافية لها أهمية خاصة في الفيزيولوجيا المرضية للصداع النصفي. وهي شديدة الأوعية الدموية ، وتؤوي الخلايا العصبية المحلية المسببة للألم ، وهي موطن لمجموعة متنوعة من الخلايا المقيمة مثل الخلايا المناعية. قد تؤدي التغيرات الطفيفة في البيئة المجهرية السحائية المحلية إلى تنشيط وتحسس مستقبلات nociceptors الجافية المحيطة بالأوعية الدموية ، مما يؤدي إلى ألم الصداع النصفي. سعت الدراسات إلى معالجة كيفية تنشيط / تحسس المؤثرات الجافية باستخدام إما في الفيزيولوجيا الكهربية في الجسم الحي أو تقنيات التصوير أو النماذج السلوكية ، ولكن هذه تتطلب عادة عمليات جراحية غازية للغاية. يقدم هذا البروتوكول طريقة للتطبيق غير الغازي نسبيا للمركبات على الأم الجافية في الفئران وطريقة مناسبة لقياس الحساسية اللمسية الشبيهة بالصداع باستخدام اختبار فون فراي حول الحجاج بعد التحفيز الجافية . تحافظ هذه الطريقة على سلامة الجافية والجمجمة وتقلل من الآثار المربكة الناجمة عن التقنيات الغازية عن طريق حقن المواد من خلال قنية معدلة مقاس 0.65 مم عند تقاطع الغرز السهمية ولامبدويد غير المنصهرة. سيسمح هذا النموذج قبل السريري للباحثين بالتحقيق في مجموعة واسعة من المحفزات الجافية ودورها في التطور المرضي للصداع النصفي ، مثل تنشيط nociceptor ، وتنشيط الخلايا المناعية ، والتغيرات الوعائية ، وسلوكيات الألم ، كل ذلك مع الحفاظ على ظروف خالية من الإصابات في الجمجمة والسحايا.
Introduction
لا يزال ألم الصداع النصفي مشكلة صحية عامة رئيسية في جميع أنحاء العالم. تصنفه منظمة الصحة العالمية على أنه سادس أكثر الأمراض انتشارا في العالم ، حيث يصيب أقل بقليل من 15٪ من سكان الأرض1 ويسبب عبئا اجتماعيا واقتصاديا كبيرا على المجتمع 2,3. كانت خيارات العلاج وفعاليتها دون المستوى الأمثل وتوفر فقط تخفيف الأعراض ولا تعدل بشكل كبير الأحداث الفسيولوجية المرضية التي تكمن وراء حدوث الصداع النصفي 4,5. من المحتمل أن يكون عدم نجاح العلاج بسبب الصداع النصفي كونه اضطرابا متعدد العوامل لا يفهم علم أمراضه بشكل جيد ، مما يؤدي إلى عدد محدود من الأهداف العلاجية. من الصعب أيضا التقاط الصداع النصفي بشكل كامل في النماذج الحيوانية ، خاصة بالنظر إلى أن تشخيص الصداع النصفي يتم بناء على التواصل اللفظي مع المرضى الذين يصفون تجربتهم مع السمات المميزة للصداع النصفي مثل الهالة والصداع ورهاب الضوء والألودنيا. على الرغم من ذلك ، من المهم ملاحظة أن التطورات الحديثة في علاجات الصداع النصفي تتفوق حاليا على العلاجات للعديد من الحالات العصبية التي تم التحقق منها بشكل جيد من خلال النماذج قبل السريرية. على سبيل المثال ، كانت الأجسام المضادة وحيدة النسيلة والجزيئات الصغيرة التي تستهدف الببتيد المرتبط بجين الكالسيتونين ، أو مستقبلاته ناجحة جدا في تحسين نوعية حياة مرضى الصداع النصفي ويمكن أن تحول الإدارة السريرية للصداع النصفي. في حين كان هناك تقدم في فهم هذا الاضطراب ، لا يزال هناك الكثير الذي لم يتم توضيحه بعد.
استنادا إلى النماذج الحيوانية قبل السريرية والدراسات البشرية ، من المقبول على نطاق واسع أن الصداع النصفي يبدأ عن طريق التنشيط الشاذ للألياف المسببة للألم داخل السحايا التي تشير من خلال العقد الظهرية الظهرية ثلاثية التوائم وعنق الرحم العلوي6،7،8،9،10. على الرغم من هذه النظرية ، لا تزال العديد من الدراسات تستخدم الإدارة النظامية للأدوية لفهم الآليات المساهمة الأساسية في الصداع النصفي. في حين أن الجرعات النظامية من الأدوية قد عززت فهمنا بشكل كبير ، فإن هذه النتائج لا تقيم بشكل مباشر ما إذا كانت الإجراءات المحلية داخل الأنسجة المستهدفة ذات الاهتمام تلعب دورا في الصداع النصفي. على العكس من ذلك ، اتخذت العديد من الدراسات نهجا لتحفيز الجافية. ومع ذلك ، تتطلب هذه التجارب زرع القنية عن طريق بضع القحف الغازي وأوقات الشفاء الموسعة11,12. وبسبب هذه القيود، طورنا نهجا طفيف التوغل لتحفيز الجافية محليا حيث يؤدي عدم وجود بضع القحف إلى القضاء على التعافي بعد الجراحة ويسمح بإجراء اختبار فوري في الحيوانات المستيقظة12،13،14. يتم إجراء هذه الحقن تحت تخدير الأيزوفلوران الخفيف وتدار عند تقاطع الغرز السهمية و lambdoid في الفئران.
تم تطوير العديد من الأساليب لتقييم الاستجابات السلوكية المسببة للألم في القوارض15. تم الإبلاغ عن الألودينيا الجلدية في حوالي 80٪ من الذين يعانون من الصداع النصفي16,17 ويمثل نقطة نهاية انتقالية محتملة للاستخدام في القوارض. في النماذج قبل السريرية ، تم استخدام تطبيق خيوط فون فراي على المنطقة الأخمصية من مخلب القوارض لتقييم سلوكيات الألم في نماذج الصداع النصفي قبل السريرية. القيد الأساسي لهذا النهج هو أنه لا يختبر المنطقة الرأسية. تم استخدام تسجيل كآبة الوجه لالتقاط سلوكيات الألم في القوارض من خلال تحليل تعبيرات الوجه بعد تحريض محفزات الألم18,19. ومع ذلك ، فإن قيوده تشمل فقط التقاط الاستجابات للمحفزات الحادة وليس حالات الألم الفموي الوجهي المزمن. يعتبر استمالة الوجه وانخفاض التربية أيضا مخرجات للاستجابات السلوكية في النماذج قبل السريرية للصداع النصفي20,21. تشمل قيود الأول صعوبة في التمييز بين استجابات الألم والاستمالة الروتينية الطبيعية والأحاسيس الأخرى مثل الحكة. في حالة هذا الأخير ، عادة ما تنخفض سلوكيات التربية بسرعة بعد إدخال القوارض إلى بيئات جديدة. على الرغم من أن كل نقطة من نقاط النهاية السلوكية هذه ذات قيمة في فهم الآليات المختلفة التي تسهم في حالات الألم ، إلا أن هناك حاجة ماسة إلى نماذج ما قبل السريرية لاضطرابات الألم مثل الصداع النصفي لتشمل نقاط النهاية التي تلتقط على وجه التحديد استجابات فرط الحساسية الرأسية. يعد تقييم فرط الحساسية اللمسية للجلد حول الحجاج بعد التحفيز الجافية طريقة قد توفر رؤية أفضل للآليات التي تساهم في الصداع النصفي حيث تكون الأعراض الحسية في الغالب رأسية بطبيعتها. هنا ، نصف طريقة لإدارة المواد على الفأر الجافية كنموذج ما قبل السريري للصداع النصفي. بعد تطبيق الجافية ، نقدم أيضا طريقة مفصلة لاختبار فرط الحساسية اللمسية حول الحجاج باستخدام خيوط فون فراي المعايرة المطبقة في طريقة ديكسون من أعلى إلى أسفل.
Protocol
تم إجراء جميع الإجراءات بموافقة مسبقة من اللجنة المؤسسية لرعاية الحيوانات واستخدامها في جامعة تكساس في دالاس. تم استخدام ICR (CD-1) (30-35 جم) و C57 / BL6 (25-30 جم) من الفئران التي تتراوح أعمارهم بين 6-8 أسابيع في هذه الدراسة.
1. الجافية infuser
- قم بإنشاء منقوعات/حاقنات الماوس عن طريق تعديل قنية داخلية متاحة تجاريا ومنقوع للحقن من جانب واحد مع غطاء بلاستيكي سيليكا غير معدني منصهر قابل للتعديل ويدخل في/يمتد أسفل قنية إرشادية بوزن 28 جم بقطر داخلي (ID) يبلغ 0.18 مم وقطر خارجي (O.D) يبلغ 0.35 مم (الشكل 1A).
- استخدم الفرجار أو جهاز قياس آخر لضبط غطاء السيليكا البلاستيكي المنصهر على جهاز الحفر بطول 0.6 مم ؛ تقاس من طرف المنقوع إلى حافة غطاء السيليكا البلاستيكي.
- احذر من ثني أو مملة المنقوع عند ضبط الغطاء البلاستيكي.
- بالنسبة لسلالات الفئران الأخرى التي لم يتم استخدامها من قبل للحقن الجافية ، حدد طول المنقوع الأمثل عن طريق ضبط الطول على 0.6 مم وإجراء الحقن التجريبي بالحبر أو الصبغة ، وضبط طول المنقوع حتى يلاحظ أن الصبغة موجودة فقط في الأم الجافية وليس على الدماغ أو الجمجمة.
- قم بتوصيل الطرف الطويل (أو الطرف الذي لم يتم قياسه ليكون 0.6 مم) للمنقوع المعدل بالأنابيب البلاستيكية (أنابيب المضخة ، 2-stop ، I.D. 0.19 مم ، الطول 406 مم).
- قطع الأنابيب إلى الحد الأدنى من طول 8 في لضمان وجود خط كاف لعقد حجم 5 ميكرولتر.
- تأكد من أن الأنابيب تغطي الجزء المعدني والجزء العلوي من السدادة البلاستيكية الموجودة على المنقوع . هذا سوف يساعد على منع فقاعات الهواء من التراكم في الخط.
- قم بتوصيل الطرف الآخر من الأنبوب بحقنة زجاجية صغيرة سعة 10 ميكرولتر (محكمة الإغلاق بالغاز ؛ إبرة أسمنتية ؛ 21 جم مع إسقاط 10 مم) ، مرة أخرى ، مع التأكد من وجود ختم محكم على الجزء المعدني من المحقنة (الشكل 1A).
- بمجرد توصيل الخط ، قم بردم المحقنة ب 5 ميكرولتر من المياه المالحة العازلة بالفوسفات (PBS) ، أو السائل الخلالي الاصطناعي (SIF) ، أو المركبات الأخرى المفضلة لمنع تشكل فقاعات الهواء.
- إذا لوحظت فقاعات الهواء في الخط ، فقم بإغراق الخط بالسيارة حتى تتبدد الفقاعات.
ملاحظة: قد يساعد ملء المحقنة بالسيارة قبل توصيلها بالخط ثم دفع السائل عبر الخط بمجرد توصيله.
- إذا لوحظت فقاعات الهواء في الخط ، فقم بإغراق الخط بالسيارة حتى تتبدد الفقاعات.
- بعد ردم الخط ب 5 ميكرولتر من السيارة وعمله بكفاءة ، قم بتحميل 5 ميكرولتر من الدواء / المحلول في حقنة هاميلتون (يمكن استخدام الحبر أو الصبغة كبديل للدواء / الحل إذا تعلمت أو مارست هذه التقنية).
- تأكد من الحفاظ على جميع حلول المركبات التي تدار على الجافية عند درجة الحموضة 7.4 وقياسها إلى أسمولية 310. هذا يقلل من التنشيط المحتمل للقنوات الأيونية المستشعرة للحمض والقنوات الحساسة للتناضح الأخرى داخل الجافية.
- الحد الأقصى للحجم الذي تم اختباره في الفئران التي لم تتسبب في تسرب إلى الدماغ هو حوالي 10 ميكرولتر. لم يتم اختبار الآثار السلوكية بعد الحقن بهذا الحجم. لهذا السبب ، قم بإدارة 5 ميكرولتر فقط من المحلول على الجافية.
ملاحظة: تستند هذه الملاحظات إلى سلالات/أعمار/أوزان الفئران التي يبلغ عمرها 6-8 أسابيع من الفئران CD1/ICR.
2. حقن الجافية
- بمجرد تحضير المحقنة وتحميل الدواء ، ضع فأرا مسطحا على بطنه وقم بتخديره تحت إيسوفلوران قصير بنسبة 3٪ بمعدل تدفق أكسجين يتراوح بين 0.5-1 لتر / دقيقة عبر مخروط الأنف.
- بعد أن توقف الماوس عن عرض رد فعل قرصة ، اضبط التخدير وحافظ عليه عند 1.5٪ isoflurane.
- بمجرد تخديره ، ضع مرهم العيون المعقم على العينين وحلق رأس الحيوان ، ثم قم بتطهير الجلد بالبوفيدون اليود والإيثانول. بعد ذلك ، احصل على وضع يفضي إلى حقن ناجح.
- استخدم إحدى اليدين لتثبيت رأس الحيوان وأمسك المبخر باليد الأخرى.
- التحقيق بعناية وتحديد موقع تقاطع الغرز السهمية و lambdoidal على جمجمة الفأر (الشكل 1B ، C).
- لتحديد موقع هذا التقاطع السري عبر الجلد ، استخدم السمات الطبوغرافية للجمجمة وقم بفحص الموقع العام للتقاطع بلطف مع المنقوع.
- تحقق من موضع التقاطع عن طريق إعادة وضع المنقوع على طول الجمجمة والشعور بالموقع الدقيق.
- بمجرد تحديد موقع الخيط ووجود المنقوع في مكانه ، قم بتحريك المنقوع ببطء شديد وبلطف ذهابا وإيابا حتى يخترق الجلد ويسقط في التقاطع على طول الطريق حتى السدادة البلاستيكية.
ملاحظة: تأكد من إدخال طرف المنقوع بالكامل بحجم 0.6 مم في الوصلة. - للتحقق من الدقة ، استخدم الحبر أو الصبغة كمحلول حقن والقتل الرحيم وقطع رأس الماوس.
- قم بإزالة غطاء الجمجمة لتصور الصبغة داخل الأم الجافية (الشكل 1C).
ملاحظة: لا ينبغي ملاحظة الصبغة على الدماغ أو خارج الجمجمة. وبالمثل ، يجب فحص الفئران في أي تجربة بعد الوفاة للتحقق من دقة الحقن وكذلك لضمان سلامة الأم الجافية غير التالفة.
- قم بإزالة غطاء الجمجمة لتصور الصبغة داخل الأم الجافية (الشكل 1C).
- بعد الحقن ، قم بإزالة الماوس من التخدير ، وانتظر حتى يستعيد وعيه ثم يعود إلى قفصه أو ضعه في غرفة اختبار لبدء الفحوصات المطلوبة.
ملاحظة: اسمح للفأر بالتعافي من التخدير لمدة لا تقل عن 30 دقيقة قبل إجراء أي تجارب سلوكية.
3. فون فراي حول الحجاج
- ابدأ الدراسة مع مجموعة من حوالي 16-20 فأرا.
- في اليوم السابق للتعود ، تعامل مع كل ماوس لمدة 5 دقائق على الأقل.
- بعد حوالي 24 ساعة من المناولة ، اعتاد الفئران على ظروف غرفة الاختبار وجهاز اختبار فون فراي (الشكل 2A).
ملاحظة: يتكون جهاز اختبار الأكريليك من مقصورات فردية ذات أغطية تبلغ حوالي 3 بوصات × 3.5 بوصة × 5 بوصات (العرض × الارتفاع × العمق) وتدعمها حوامل من الألومنيوم متصلة عبر سلك شبكي فولاذي مجلفن مربع بسعة 0.25 بوصة بسعة 19 جم.- ضع الفئران داخل كوب ورقي أبيض 4 أونصات يوضع أفقيا وعديم الرائحة ولا يحتوي على شمع البوليثين أو البارافين.
ملاحظة: يفضل تناول هذه الأنواع من الكؤوس لأنها تقلل من اضطراب الجهاز الهضمي لدى الفئران إذا تم تناولها (الشكل 2B).
- ضع الفئران داخل كوب ورقي أبيض 4 أونصات يوضع أفقيا وعديم الرائحة ولا يحتوي على شمع البوليثين أو البارافين.
- أثناء وجود الحيوانات في غرفها الخاصة ، ضع كريات من النظام الغذائي العادي للتشاو في الغرفة الفردية لكل فأر لتهدئة الحيوانات وتجنب أي إجهاد غير ضروري للحيوانات. قم بذلك لمدة 3 أيام قبل أي اختبار سلوك فون فراي.
- تأكد من أنه في كل مرة تكون فيها الفئران في الغرفة ، يمكن الوصول إلى الطعام.
- قم بترقيم وتعيين كل إلى نفس المساحة في رف الاختبار. ضع الفأر في نفس الكوب كل يوم من فترة الاختبار لضمان تأقلم كل مع بيئة الاختبار الخاصة به.
ملاحظة: سوف تقضم الفئران على الكؤوس وتدمر الكؤوس لاحقا. إذا حدث هذا ، فاستبدل الكوب وقم بتسميته برقم الماوس المقابل.
- بعد 3 أيام من التعود ، ضع الفئران في غرفها الفردية.
- اسمح للحيوانات بالتأقلم مع غرفة الاختبار والغرف لمدة 1 ساعة على الأقل قبل أي اختبار فون فراي للسماح للفئران بالهدوء وبالتالي يسهل اختبارها.
- بعد التأقلم مع الغرفة في يوم الاختبار ، قم بإزالة ماوس واحد بينما لا يزال في كأسه من غرفته المعنية.
- حافظ على الكأس في الوضع الأفقي بحيث يكون الماوس على كل من الكفوف الأمامية والخلفية للمساعدة في الحفاظ على وزنه موزعا بالتساوي.
ملاحظة: قد يؤدي التوزيع غير المتكافئ للوزن إلى تغيير استجابات الحيوانات وحتى منع الحيوانات من الاستجابة.
- حافظ على الكأس في الوضع الأفقي بحيث يكون الماوس على كل من الكفوف الأمامية والخلفية للمساعدة في الحفاظ على وزنه موزعا بالتساوي.
- ضع الكوب مع الماوس في الداخل على الطاولة أسفل رف الاختبار على لوحة الماصة.
- لاختبار فون فراي حول الحجاج، ضع خيوط فون فراي 0.07 غرام مباشرة في وسط الوجه وبين العينين.
- ضع ضغطا كافيا على الخيوط لجعل شعر فون فراي ينحني إلى تشكيل على شكل حرف "C".
- حافظ على الاتصال مع المنطقة على الأقل 3 ثوان ولكن ليس أكثر من 5 ثوان أو حتى يسحب الفأر رأسه ويمرر على الخيط بمخلبه.
ملاحظة: إذا كانت الخيوط تنزلق أو أكثر من طرف الخيط تلامس الحيوان أثناء الاختبار ، فلا ينبغي حساب أي استجابات. قد تكون هذه الاستجابات استجابة للفرشاة التي يتم تنشيطها بواسطة مستقبلات ميكانيكية مختلفة وبالتالي قد لا تعكس نتائج دقيقة. - تطبيق خيوط فون فراي وفقا لطريقة ديكسون "من أعلى إلى أسفل"22,23.
- في البداية ، ضع خيوط فون فراي التي يبلغ وزنها 0.07 جم. أقل خيوط ممكنة وأعلى خيوط تم اختبارها في هذه الدراسة هي خيوط بأوزان 0.008 جم و 0.6 جم على التوالي.
- استخدم خيوط الوزن 0.008 جم و 0.02 جم و 0.04 جم و 0.07 جم و 0.16 جم و 0.4 جم و 0.6 جم لإجراء هذا الفحص.
- في هذه الطريقة ، إذا لم يظهر الحيوان استجابة للخيوط ، فقم بتطبيق خيوط وزن الجرام الأعلى التالي.
- إذا كان الماوس يستجيب لخيط، ففكر في أن الماوس يستجيب لهذا الخيوط. إذا كان هذا هو الحال ، فقم بتطبيق خيوط وزن الجرام المنخفض التالي.
- كرر هذا النمط حتى يتم اختبار الحيوان 4 مرات بعد الاستجابة الأولية أو يتم تحديد الحيوان على أنه لا يستجيب لأي خيوط تم اختبارها في الفحص.
ملاحظة: الامتناع عن تطبيق أي ضغط إضافي نابع من الذراع أو المعصم. يمكن استخدام مقياس لممارسة تطبيق الخيوط.
- حافظ على الاتصال مع المنطقة على الأقل 3 ثوان ولكن ليس أكثر من 5 ثوان أو حتى يسحب الفأر رأسه ويمرر على الخيط بمخلبه.
4. اختبار عتبات الانسحاب الأساسية
- قبل الإدراج في التجربة، تأكد من وصول الفئران إلى عتبة الانسحاب الأساسية بين 0.5-0.6 جم.
- يصل الماوس إلى خط الأساس إذا فشل في الاستجابة لأي خيوط تم اختبارها في السلسلة المذكورة في الخطوة 3.9.2.2 (0.07 جم و 0.16 جم و 0.4 جم و 0.6 جم).
- اختبار الفئران يوميا عند وضع عتبات الانسحاب الأساسية.
- يسمح الاختبار للحيوانات بالتأقلم مع ظروف الاختبار وضغط خيوط فون فراي.
- إذا كانت الفئران لا تزال شديدة الحساسية بعد اليوم الثالث من الاختبار ، فحاول الانتظار لمدة 1 أو 2 أيام قبل الاختبار مرة أخرى.
ملاحظة: قد يؤدي الوقت الزائد بين أيام الاختبار إلى فشل الحيوان في التكيف مع وزن الخيوط في منطقته المحيطة بالحجاج ، وبالتالي عدم الوصول إلى عتبة الانسحاب المستهدفة.
- اختبر الفئران لمدة 7 أيام تقريبا قبل تحديد الحيوانات التي لا تفي بمعايير التضمين للتجربة.
ملاحظة: سيصل ما يقرب من 70٪ من الفئران إلى مستوى خط الأساس المستهدف.- قبل التحفيز الجافية ، قم بتحليل بيانات خط الأساس لاستبعاد أي ماوس لم يصل إلى قيمة خط الأساس من 0.5-0.6 جرام أو أعلى.
- بعد الاستبعاد، قم بتخصيص كل ماوس متبقي عشوائيا لمجموعة اختبار. حقق ذلك عن طريق السحب من كوب أو كتابة نص نصي على جدول بيانات لتوزيع الأرقام عشوائيا على مجموعة.
5. تحليل نتائج فون فراي
- بمجرد الحصول على سلسلة الردود ، حدد دلتا ، قيمة k ، عتبة 50٪ ، وعتبة السحب بالجرام وفقا للطرق المنشورة سابقا24.
- احسب عتبة السحب باستخدام هذه الصيغة WT = 10 (x * F + B) ، حيث WT = عتبة السحب ، F = عتبة سحب مخلب محسوبة عبر طريقة Chaplan ، و B = الانحدار الخطي للسجل (قوة الانحناء) = x * رقم الشعيرة + B.
- ارسم البيانات إما كحد سحب 50٪ أو متوسط عتبة السحب بالجرام.
النتائج
تستخدم طريقة الحقن هذه لإدارة المحفزات على الجافية للفئران بحيث يمكن إجراء اختبارات سلوكية لاحقة. الناتج السلوكي الأكثر شيوعا الذي تم قياسه باستخدام هذا النموذج هو فرط حساسية الوجه الجلدي الذي تم تقييمه عبر فون فراي12،13،14. نوضح هنا كيف يمكن استخدام هذا النموذج لتقييم المساهمات المحتملة الخاصة بالجنس في أمراض الصداع النصفي (الشكل 3).
تم استخدام هذا الإجراء لفحص آثار البرولاكتين الجافية (PRL) على فرط الحساسية الميكانيكية للوجه14 (الشكل 3). أظهرت نتائج هذه الدراسة أن إناث الفئران ICR تظهر انخفاضا كبيرا في عتبات انسحاب الوجه استجابة ل 5 ميكروغرام من البرولاكتين الجافية (الشكل 3A). كما أظهرت جرعة أقل بمقدار عشرة أضعاف من 0.5 ميكروغرام من البرولاكتين (PRL) استجابات مماثلة للجرعة العالية من PRL (الشكل 3B).
وقد ثبت أيضا أن هذه الحقن تنتج سلوكيات عفوية مرتبطة بالألم يتم تقييمها عن طريق الكآبة. تسببت الجافية 0.5 ميكروغرام من PRL في تجهم كبير في الفئران الإناث (الشكل 3C) ، مما يدل على دور واضح ل PRL الجافية في السلوكيات الشبيهة بالصداع النصفي للإناث. أجرينا فحوصات كئيبة قبل إجراء جميع الاختبارات باستخدام خيوط فون فراي.
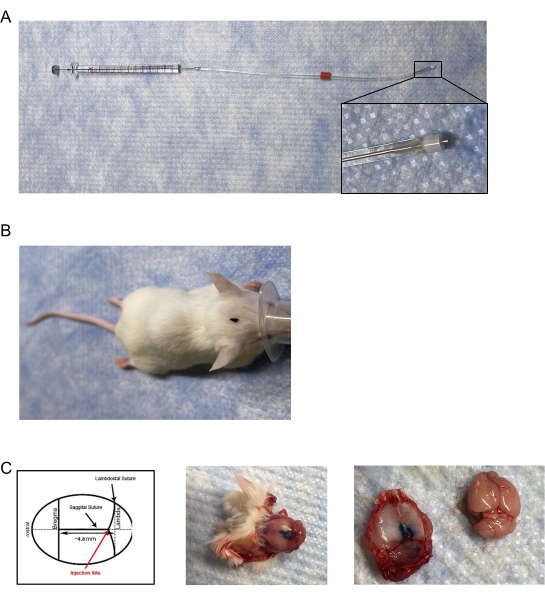
الشكل 1: غرس الجافية ووضع الحقن . (أ) تتكون الحقن / المنقوع من قنية معدلة معدلة بطول ~ 0.5 مم - 0.65 مم وتعلق على إبرة مثبتة على حقنة محكمة الإغلاق بالغاز سعة 10 ميكرولتر عبر أنابيب tygon. (ب) منظر جوي لموقع الحقن المحدد على رأس الماوس. (C) (اللوحة اليسرى) رسم تخطيطي لموقع الحقن الجافية. يتم وضع الحقن على تقاطع الغرز اللامبدودية والسهمية عند حوالي 4.8 مم من الخلف إلى bregma. (اللوحة الوسطى) منظر جوي بعد الوفاة لجمجمة فأر بعد الحقن الجافية ل 5 ميكرولتر من صبغة الحقن الزرقاء. (اللوحة اليمنى) فصل قلنسوة الفأر عن الدماغ. لم يكن هناك تسرب ملحوظ لصبغة الحقن الزرقاء على الدماغ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: غرف اختبار فون فراي. (أ) غرفة اختبار فون فراي تتكون من 3.5 بوصة × 3.5 في غرف أكريليك فردية مع أغطية موضوعة على رف شبكي سلكي. يتم توصيل هذه عبر أعمدة من 10 غرف منظمة في 2 صفوف. (ب) مثال على الفئران في أكوابها الفردية الموجودة داخل غرف اختبار فون فراي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
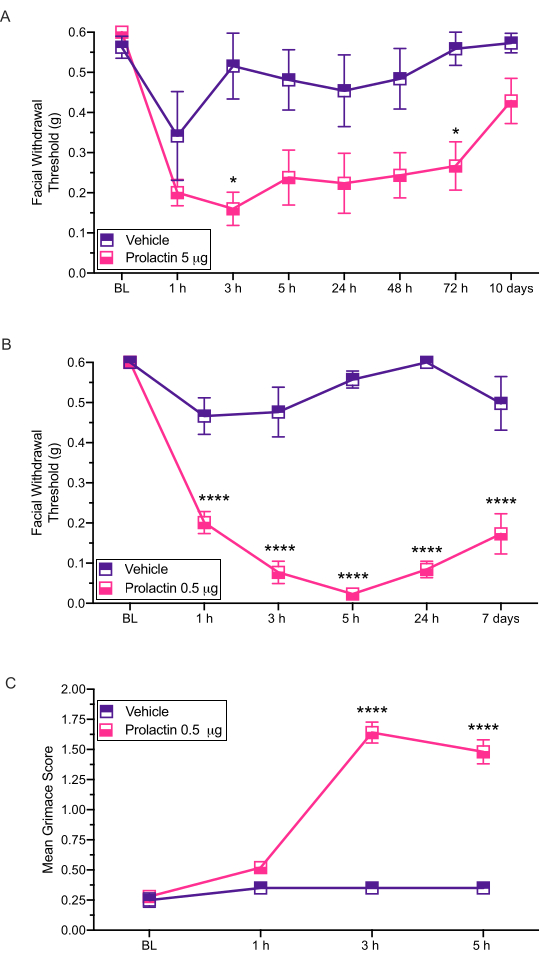
الشكل 3: تطبيق الجافية للبرولاكتين يحفز الاستجابات السلوكية في الفئران. تم تقييم عتبات الانسحاب الميكانيكية بعد التطبيق الجافية ل PRL (5 ميكروغرام أو 0.5 ميكروغرام) في إناث الفئران. (أ) تطبيق 5 ميكروغرام من PRL (n = 7 PRL ، n = 6 مركبة) فرط الحساسية الناجم عن الوجه مقارنة بالمركبة. (ب) تطبيق 0.5 ميكروغرام من PRL (n = 5 PRL ، n = 4 مركبة) الناجم عن فرط الحساسية للوجه طويل الأمد. (ج) تم تقييم Grimace أيضا في نفس الفئران التي عولجت ب 0.5 ميكروغرام من PRL في كل نقطة زمنية. أظهرت هذه الفئران درجات أعلى بكثير من الكآبة مقارنة بالفئران المعالجة بالمركبة. الإحصاءات: ANOVA ثنائي الاتجاه متبوعا بتحليل Bonferroni متعدد المقارنة بعد التخصيص. يتم تمثيل البيانات كوسيلة ± SEM. * p < 0.05 ، * ***p < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تعتبر التغيرات غير التكيفية في نظام مسبب للألم المحلي في الجافية مساهما رئيسيا في مرحلة الصداع من نوبات الصداع النصفي على الرغم من عدم وجود إصابة في الأنسجة25,26. هنا تقدم الدراسة طريقة يمكن من خلالها للتحفيز الأقل بضعا للجافا أن يحفز فرط الحساسية اللمسية للوجه. إن توضيح الآليات والأحداث التي ينطوي عليها تنشيط مستقبلات الألم الجافية دون التسبب في تلف الجمجمة والأنسجة قد يعكس بشكل أكثر دقة آليات الصداع النصفي في نموذج ما قبل السريرية.
منذ فترة طويلة تستخدم بضع القحف وزرع القنية لتقييم الوظائف والآليات التي تسهم في آلام الصداع النصفي11,12. ومع ذلك ، فقد أفيد أن بضع القحف يمكن أن يحفز تنشيط الخلايا البدينة الجافية ويزيد من نفاذية الأوعية الدموية في القوارض27. بالنظر إلى أن تنشيط الخلايا البدينة في الجفافة متورط بشكل كبير في الصداع النصفي7،8،28،29 ، فإن هذه التقنية لها محاذير رئيسية قد تشوه التفسير. إن إدارة المواد من خلال تقاطع الغرز السهمية و lambdoidal يقلل بشكل فعال من تنشيط مستقبلات nociceptors بوساطة تنشيط الخلايا البدينة التي يسببها بضع القحف. علاوة على ذلك ، لا يتطلب التحفيز الجافية غير الغازية الشفاء بعد الجراحة وإدارة المسكنات التي قد تغير تفسير النتائج. يسمح التطبيق المحلي للمواد على الجافية للباحثين بالتركيز على هذا النسيج المستهدف المحدد ، بدلا من الإدارة الجهازية للأدوية حيث لا يمكن تحديد موقع العمل بسهولة12،13،14. في حين أن الإدارة المنهجية لمواد مثل النتروجليسرين والببتيد المرتبط بجين الكالسيتونين تؤدي إلى هجمات تجريبية في البشر تشبه الصداع النصفي ، فإنها لا تسمح بتقييم موقع العمل في نماذج القوارض ؛ توفر النماذج الأكثر استهدافا الخاصة بالأنسجة نهجا بديلا.
تتضمن هذه التقنية الموصوفة هنا حقن دواء أو محلول آخر مباشرة على الأم الجافية للسحايا من خلال التقاطع حيث تلتقي الغرز السهمية والخناجر في الجمجمة. للحصول على أفضل النتائج ، يجب استخدام الفئران ICR (CD-1) أو C57 / BL6 التي تتراوح أعمارها بين 6-8 أسابيع لهذه التجارب. يمكن استخدام الفئران الأصغر سنا. ومع ذلك ، لا ينصح باستخدام الفئران ICR (CD-1) التي يزيد عمرها عن 8 أسابيع لأن خيوط صفيحة الجمجمة الخاصة بها عادة ما يتم دمجها بالكامل بحلول هذا العصر ، مما يجعل من المستحيل حقنها دون إتلاف الجمجمة. من الأهمية بمكان أيضا مراعاة وزن / حجم كل ماوس سيخضع لهذا الإجراء. يوصى بإجراء هذه الحقن على الحيوانات التي يزيد وزنها عن 19 جم لأن الجمجمة عادة ما تكون رقيقة جدا بأوزان أقل وقد لا تتحمل الضغط المطبق أثناء الحقن. من الأهمية بمكان ، هناك أيضا عوامل محتملة تساهم في العمر / الوزن الذي يحدث فيه اندماج صفيحة الجمجمة (على سبيل المثال ، تكوين تشاو المختبر المستخدم في المرافق الحيوانية). لذلك ، قد يحتاج المجربون إلى تحديد نطاق العمر / الوزن المناسب في ظل ظروفهم الخاصة. قد تكون هناك حاجة إلى نطاقات عمرية وأوزان حيوانية مختلفة لسلالات الفئران الأخرى أو الأنماط الجينية ، اعتمادا على وقت اندماج ألواح الجمجمة في تلك الحيوانات ، وقد تتطلب أيضا تحسين الحقن نفسه.
عند تعلم أو ممارسة هذه التقنية ، يوصى بشدة بالحصول على مستوى من الراحة مع تحديد موقع تقاطع الخياطة في الفئران التي تم قتلها رحيما. قد يكون من الأفضل التدرب أولا على استئصال فروة الرأس أو تقشيرها مرة أخرى في هذه الفئران والتقدم ببطء لتحديد موقع التقاطع عبر الجلد. بمجرد تحديد الموقع الدقيق ، يمكن حقن الأحبار والأصباغ في الجافية للتحقق من دقة الموقع وعمق الحقن. تم تطوير هذه التقنية وتحسينها باستخدام فئران ICR (CD-1) (30-35 جم) وفئران C57 / BL6 (25-30 جم). طول المنقوع من 0.5-0.6 مم يكفي لحقن ماوس يزن في حدود 25-35 جم. ومع ذلك ، قد تحتاج إلى معايرة طول المفاعل إذا حقنت الفئران التي تختلف اختلافا كبيرا عن الفئران المستخدمة لتحسين هذه التقنية. على سبيل المثال ، من المحتمل أن يؤدي الماوس الأصغر من 25 جم إلى استخدام منقوع يقل طوله عن 0.5 مم. عند إتقان هذه التقنية وعند تنفيذها في الفئران المناسبة للعمر ، يمكن أن يكون معدل نجاح هذا الحقن قريبا من 100٪ ؛ ومع ذلك ، قد تنبع مضاعفات الحقن من مشاكل مثل كسر الجمجمة بسبب تطبيق الكثير من القوة لإدخال المنقوع وكذلك النزيف غير الطبيعي الناجم عن تلف الأوعية الدموية السحائية.
تعد التغيرات في الحساسية اللمسية مقياسا مهما عند تقييم سلوكيات الألم في القوارض. هنا نوضح استخدام اختبار فون فراي حول الحجاج لتقييم هذه السلوكيات في نموذج الصداع النصفي قبل السريري. الميزة الرئيسية لاستخدام هذه التقنية في نماذج الصداع النصفي هي أنه يمكننا تقييم فرط الحساسية للرأس ، والذي له أهمية أكبر من المواقع الأخرى غير القحفية مثل الكفوف. الخطوة الحاسمة لضمان نتائج قابلة للتكرار هي التأكد من أن الفئران محددة بشكل كامل. سيتطلب ذلك مجربا مدربا تدريبا جيدا يمكنه تطبيق خيوط فون فراي بدقة. من المحتمل أن يستغرق الأمر حوالي 7 أيام حتى يصل الحيوان إلى خط الأساس. ومع ذلك ، فمن الممكن ألا يصل كل إلى خط الأساس المستهدف. في تجربتنا ، بعد حوالي 7 أيام من العمل مع الفئران ، سيصل 60٪ -70٪ فقط من الحيوانات إلى خط أساس يبلغ 0.6 جم في المنطقة المحيطة بالمدار ، ولكن هذا يعتمد على مجموعة الحيوانات. يجب النظر في هذا التوقيت قبل بدء التجربة لضمان استخدام أعداد كافية لحساب التسرب وأن الحيوانات هي العمر المناسب بعد خط الأساس لاستخدام هذه الطريقة غير الغازية لتحفيز الجافية. وترد خطوات تحديد خط الأساس في القسم 4 من البروتوكول.
أحد القيود المفروضة على اختبار فون فراي هو أنه قد يكون من الصعب التمييز بين استجابات الألم والاستمالة / الحكة الروتينية. للمساعدة في التمييز بين الألم والاستمالة ، من المهم ملاحظة طول الوقت الذي يحدث فيه هذا السلوك. عادة ما تكون استجابة الألم عبارة عن ضربة واحدة بعد تطبيق الخيوط ، في حين أن سلوكيات الاستمالة تميل إلى أن تكون طويلة ويمكن أن تستمر لعدة ثوان إلى دقائق. إذا كان سلوك الاستمالة / الحكة لا يمكن تمييزه عن استجابة شديدة الحساسية ، فمن الأفضل عدم تسجيل ذلك كاستجابة. بالإضافة إلى ذلك ، يمكن أن يؤدي وضع الخيوط بشكل غير صحيح (على سبيل المثال ، انزلاق الخيوط) إلى الاستمالة المطولة للحيوان ، مما يجعل من الصعب اختباره بشكل صحيح. إذا حدث هذا ، يجب على المجرب الانتظار حتى يتوقف الاستمالة ويكون الماوس هادئا بما يكفي للاختبار. استمر من نفس الخيط المستخدم قبل بداية سلوك الاستمالة. إذا استمر الماوس لنوبات طويلة جدا من الوقت ، فضع الماوس مرة أخرى في غرفة الاختبار لمدة 5 دقائق تقريبا. بمجرد مرور 5 دقائق ، حاول اختبار الماوس مرة أخرى. إذا استمر هذا السلوك دون حل ، فيجب إزالة الفئران من الدراسة. من الأهمية بمكان ، لا ينصح بحلق الفراء على الوجه لأنه من غير الواضح ما إذا كان جلد الفأر يحتفظ بنفس الحساسية بعد إزالة الشعر ، وقد تؤثر عملية إزالة الشعر (الحلاقة ، كريمات إزالة الشعر) أيضا على حساسية الجلد.
في معظم الحالات ، يكون مثاليا لإدارة المواد على الجافية بما لا يزيد عن 24 ساعة بعد وصول الماوس إلى خط الأساس. يوصى بأن تخضع الفئران لاختبار خيوط فون فراي مرة واحدة في الساعة. إذا كان ذلك ممكنا ، فإن الاختبار كل ساعة أخرى يعطي وقتا كافيا للحيوانات لتهدأ بعد الاختبار. بالإضافة إلى ذلك ، يجب توقيت التجارب بحيث لا تتداخل مع أنماطها اليومية. قد تؤدي التعديلات في إيقاع الساعة البيولوجية لدى الفئران إلى تغيير الأنماط الظاهرية السلوكية وتؤدي في النهاية إلى نتائج غير قابلة للتكرار.
يمكن استخدام اختبار فون فراي حول الحجاج مع الفحوصات السلوكية الأخرى لتعزيز الاستنتاجات التجريبية. يعتمد مقياس الكآبة على تعبيرات الوجه العفوية في القوارض بدلا من الاستحضار للاستجابات18,19. تتميز هذه الطريقة بدقة وموثوقية عالية عند تقييم سلوكيات الألم الحاد وتحديدها كميا وقد استخدمت في العديد من النماذج قبل السريرية للصداع النصفي12,30. عند استخدام كل من مقايسات فون فراي حول الحجاج ، يجب على المجرب النظر في تسجيل درجات الكآبة قبل تطبيق خيوط فون فراي على المنطقة المحيطة بالحجاج من الماوس. وهذا يضمن أن يكون سلوك التجهم عفويا ولا يستحضره تطبيق الخيوط. يمكن أيضا استخدام فرط الحساسية الميكانيكية Hindpaw بالتزامن مع اختبار فون فراي حول الحجاج. على عكس تسجيل الكآبة ، من الأفضل اختبار فرط الحساسية للوجه قبل تقييم فرط الحساسية للمخلب الخلفي. يتطلب اختبار Hindpaw وضع الماوس مرة أخرى في الغرفة بدون الكأس بعد اكتمال اختبار فون فراي حول الحجاج.
في الختام ، يضيف اختبار فون فراي حول الحجاج والتحفيز الجافية غير الغازية في الفئران خيارات قيمة إلى المجموعة الحالية من النماذج قبل السريرية للصداع النصفي. عندما يتم تنفيذها بشكل صحيح ، تقدم هذه التقنية نهجا مكررا لتوليد نمط ظاهري يشبه الصداع في القوارض ، لأنها لا تتطلب زرعا جراحيا للقنية. في الفئران ، تكون القنية عرضة للعدوى البكتيرية ، ويمكن أن تصبح مسدودة ، وقد تسقط ، وتتطلب أن يكون كل في منزل واحد ، مما يخلق ضغطا غير ضروري على الحيوان. علاوة على ذلك ، يمكن بسهولة تعديل بروتوكول التحفيز الجافية للاستخدام مع العديد من تطبيقات الأدوية. يمكن أيضا تعديل نماذج اختبار فون فراي حول المدار لتناسب المواصفات التجريبية على أفضل وجه. بالإضافة إلى ذلك، يمكن استخدام اختبار فون فراي حول الحجاج في اضطرابات الألم الفموي الوجهي الأخرى. هذه التقنيات هي أداة مهمة للمساعدة في زيادة فهم الآليات الأساسية المعقدة لألم الصداع النصفي.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل المعاهد الوطنية للصحة (NS104200 و NS072204 إلى GD).
Materials
| Name | Company | Catalog Number | Comments |
| 4 oz Hot Paper Cups | Choice Paper Company | 5004W | https://www.webstaurantstore.com/choice-4-oz-white-poly-paper-hot-cup-case/5004W.html |
| Absorbent Underpads | Fisherbrand | 14-206-65 | https://www.fishersci.com/shop/products/fisherbrand-absorbent-underpads-8/p-306048 |
| C313I/SPC Internal 28 G cannula | P1 Technologies (formerly Plastics One) | 8IC313ISPCXC | I.D. 18 mm, O.D. 35 mm |
| Gastight Model 1701 SN Syringes | Hamilton | 80008 | https://www.hamiltoncompany.com/laboratory-products/syringes/80008 |
| Ismatec Pump Tubing, 0.19 mm | Cole-Palmer | EW-96460-10 | https://www.coleparmer.com/i/ismatec-pump-tubing-2-stop-tygon-s3-e-lab-0-19-mm-id-12-pk/9646010 |
| Stand with chicken wire | Custom | The galvanized steel chicken wire dimensions are 0.25 in. x 19-gauge | |
| Testing Rack with individual Chambers | Custom | Each chamber should have a division between each mouse and lids to contain the mouse. The chambers should also be large enough to hold a 4 oz. paper cup. | |
| von Frey Filaments | Touch test/Stoelting | 58011 | https://www.stoeltingco.com/touch-test.html |
References
- GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 390 (10100), 1211-1259 (2017).
- Woldeamanuel, Y. W., Cowan, R. P. Migraine affects 1 in 10 people worldwide featuring recent rise: A systematic review and meta-analysis of community-based studies involving 6 million participants. Journal of the Neurological Sciences. 372, 307-315 (2017).
- Burch, R. C., Loder, S., Loder, E., Smitherman, T. A. The prevalence and burden of migraine and severe headache in the United States: updated statistics from government health surveillance studies. Headache. 55 (1), 21-34 (2015).
- Ashina, M. Migraine. New England Journal of Medicine. 383 (19), 1866-1876 (2020).
- Ashina, M., et al. Migraine: integrated approaches to clinical management and emerging treatments. Lancet. 397 (10283), 1505-1518 (2021).
- Jacobs, B., Dussor, G. Neurovascular contributions to migraine: Moving beyond vasodilation. Neuroscience. 338, 130-144 (2016).
- Koyuncu Irmak, D., Kilinc, E., Tore, F. Shared Fate of Meningeal Mast Cells and Sensory Neurons in Migraine. Frontiers in Cellular Neuroscience. 13, 136(2019).
- Levy, D. Migraine pain, meningeal inflammation, and mast cells. Current Pain and Headache Reports. 13 (3), 237-240 (2009).
- Levy, D., Labastida-Ramirez, A., MaassenVanDenBrink, A. Current understanding of meningeal and cerebral vascular function underlying migraine headache. Cephalalgia. 39 (13), 1606-1622 (2019).
- Phebus, L. A., Johnson, K. W. Dural inflammation model of migraine pain. Current Protocols in Neuroscience. , Chapter 9, Unit 9.1 (2001).
- Fried, N. T., Maxwell, C. R., Elliott, M. B., Oshinsky, M. L. Region-specific disruption of the blood-brain barrier following repeated inflammatory dural stimulation in a rat model of chronic trigeminal allodynia. Cephalalgia. 38 (4), 674-689 (2018).
- Avona, A., et al. Dural calcitonin gene-related peptide produces female-specific responses in rodent migraine models. The Journal of Neuroscience. 39 (22), 4323-4331 (2019).
- Burgos-Vega, C. C., et al. Non-invasive dural stimulation in mice: A novel preclinical model of migraine. Cephalalgia. 39 (1), 123-134 (2019).
- Avona, A., et al. Meningeal CGRP-Prolactin interaction evokes female-specific migraine behavior. Annals of Neurology. 89 (6), 1129-1144 (2021).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- Lipton, R. B., et al. Cutaneous allodynia in the migraine population. Annals of Neurology. 63 (2), 148-158 (2008).
- Goadsby, P. J. Migraine, allodynia, sensitisation and all of that. European Neurology. 53, Suppl 1 10-16 (2005).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-449 (2010).
- Mogil, J. S., Pang, D. S. J., Silva Dutra, G. G., Chambers, C. T. The development and use of facial grimace scales for pain measurement in animals. Neuroscience & Biobehavioral Reviews. 116, 480-493 (2020).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. The Journal of Headache and Pain. 20 (1), 11(2019).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central CGRP mechanisms. The journal of Neuroscience. 37 (1), 204-216 (2017).
- Dixon, W. J., Mood, A. M. A method for obtaining and analyzing sensitivity data. The Journal of the American Statistical Association. 43 (241), 109-126 (1948).
- Dixon, W. The up-and-down method for small samples. The Journal of the American Statistical Association. 60, (1965).
- Bonin, R. P., Bories, C., De Koninck, Y. A simplified up-down method (SUDO) for measuring mechanical nociception in rodents using von Frey filaments. Molecular Pain. 10, 26(2014).
- Ramachandran, R. Neurogenic inflammation and its role in migraine. Seminars in Immunopathology. 40 (3), 301-314 (2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K. Does inflammation have a role in migraine. Nature Reviews Neurology. 15 (8), 483-490 (2019).
- Stokely, M. E., Orr, E. L. Acute effects of calvarial damage on dural mast cells, pial vascular permeability, and cerebral cortical histamine levels in rats and mice. Journal of Neurotrauma. 25 (1), 52-61 (2008).
- Theoharides, T. C., Donelan, J., Kandere-Grzybowska, K., Konstantinidou, A. The role of mast cells in migraine pathophysiology. Brain Research Reviews. 49 (1), 65-76 (2005).
- Conti, P., et al. Progression in migraine: Role of mast cells and pro-inflammatory and anti-inflammatory cytokines. European Journal of Pharmacology. 844, 87-94 (2019).
- Rea, B. J., et al. Peripherally administered calcitonin gene-related peptide induces spontaneous pain in mice: implications for migraine. Pain. 159 (11), 2306-2317 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved