Method Article
小鼠硬脑膜刺激和眶周冯弗雷测试作为头痛的临床前模型
摘要
偏头痛最显着的症状是严重的头部疼痛,据推测这是由支配脑膜的感觉神经元介导的。在这里,我们提出了一种以微创方式局部将物质应用于硬脑膜的方法,同时使用面部超敏反应作为输出。
摘要
颅脑膜由硬脑膜、蛛网膜和软脑膜组成,被认为主要服务于神经系统的结构功能。 例如,它们保护大脑免受颅骨的侵害,并锚定/组织皮层的血管和神经元供应。然而,脑膜也与偏头痛等神经系统疾病有关,偏头痛期间经历的疼痛归因于局部无菌炎症和随后局部伤害感受传入物的激活。在脑膜的各层中,硬脑膜在偏头痛的病理生理学中特别重要。它是高度血管化的,含有局部伤害感受神经元,并且是各种常驻细胞(如免疫细胞)的家园。局部脑膜微环境的细微变化可能导致硬膜血管周围伤害感受器的激活和致敏,从而导致偏头痛。研究试图通过使用体内电生理学,成像技术或行为模型来解决硬脑膜传入物如何被激活/致敏,但这些通常需要非常侵入性的手术。该协议提出了一种在小鼠硬脑膜上相对非侵入性地应用化合物的方法,以及一种在硬膜刺激后使用眶周von Frey测试测量头痛样触觉敏感性的合适方法。该方法保持硬脑膜和颅骨的完整性,并通过未融合的矢状和兰类缝合线交界处的0.65mm改性套管注射物质,从而减少侵入性技术的混杂效应。这种临床前模型将使研究人员能够研究广泛的硬膜刺激及其在偏头痛病理进展中的作用,例如伤害感受器激活,免疫细胞激活,血管变化和疼痛行为,同时保持颅骨和脑膜的无损伤条件。
引言
偏头痛仍然是世界范围内的一个主要公共卫生问题。世界卫生组织将其列为世界上第六大流行疾病,折磨着地球人口的不到15%1 ,并对社会造成巨大的社会经济负担2,3。治疗方案及其疗效并不理想,只能缓解症状,不会显著改变偏头痛发生率以下的病理生理学事件4,5。缺乏治疗成功可能是由于偏头痛是一种多因素疾病,其病理学知之甚少,导致治疗靶点数量有限。在动物模型中完全捕获偏头痛也具有挑战性,特别是考虑到偏头痛诊断是基于与患者进行口头交流,这些患者描述了他们对偏头痛特征(如先兆,头痛,畏光和异常疼痛)的经历。尽管如此,重要的是要注意,偏头痛治疗的最新进展目前优于许多神经系统疾病的治疗,这些疾病已被临床前模型充分验证。例如,靶向降钙素基因相关肽或其受体的单克隆抗体和小分子在改善偏头痛患者的生活质量方面非常成功,并可能改变偏头痛的临床管理。虽然在理解这种疾病方面取得了进展,但仍有许多问题有待阐明。
根据临床前动物模型和人类研究,人们普遍认为偏头痛是由脑膜内伤害性纤维的异常激活引起的,这些纤维通过三叉神经和上颈背根神经节6,7,8,9,10发出信号。尽管有这一理论,许多研究仍然使用全身给药来了解偏头痛的潜在促成机制。虽然药物的全身给药大大加强了我们的理解,但这些发现并没有直接评估目标组织内的局部作用是否在偏头痛中起作用。相反,有几项研究采取了刺激硬脑膜的方法;然而,这些实验需要通过侵入性开颅术植入套管,并将恢复时间延长11,12。由于这些局限性,我们开发了一种微创方法来局部刺激硬脑膜,其中缺乏开颅手术消除了手术后的恢复,并允许在清醒的动物中立即进行测试12,13,14。这些注射在轻度异氟醚麻醉下进行,并在小鼠矢状和兰类缝合线的交界处施用。
已经开发了几种方法来评估啮齿动物的伤害感受行为反应15。据报道,大约80%的偏头痛患者的皮肤异常痛16,17 ,代表了用于啮齿动物的潜在转化终点。在临床前模型中,冯弗雷细丝在啮齿动物爪子足底区域的应用已被用于评估临床前偏头痛模型中的疼痛行为。这种方法的主要局限性是它不测试头区域。面部鬼脸评分已用于通过分析诱导疼痛刺激后的面部表情来捕获啮齿动物的疼痛行为18,19。然而,其局限性包括仅捕获对急性刺激的反应,而不是慢性口面部疼痛状况。面部修饰和减少饲养也被认为是偏头痛临床前模型中行为反应的输出20,21。前者的局限性包括难以将疼痛反应与正常的常规修饰和其他感觉(如瘙痒)区分开来。在后者的情况下,在将啮齿动物引入新环境后,饲养行为通常会迅速下降。虽然这些行为终点中的每一个在理解导致疼痛状况的各种机制方面都很有价值,但迫切需要偏头痛等疼痛疾病的临床前模型包括专门捕获头部超敏反应的终点。评估硬膜刺激后眶周皮肤的触觉超敏反应是一种可以更好地了解导致偏头痛的机制的方法,其中感觉症状主要是头部性。在这里,我们描述了一种将物质施用到小鼠硬脑膜上的方法,作为偏头痛的临床前模型。在硬膜应用之后,我们还提出了一种详细的方法,用于测试眶周触觉超敏反应,使用Dixon上下法中应用的校准von Frey细丝。
研究方案
所有程序都是在德克萨斯大学达拉斯分校动物护理和使用委员会的事先批准下进行的。本研究使用ICR(CD-1)(30-35g)和C57 / BL6(25-30g)小鼠,年龄在6-8周。
1. 硬脑膜浸泡器
- 通过修改市售的用于单侧注射的市售内套管和注入器来创建小鼠注射器/注射器,该盖子可调节并插入/延伸到内径(I.D.)为0.18 mm,外径(O.D.)为0.35 mm的28 G导向套管下方(图1A)。
- 使用卡尺或其它测量装置将熔融石英塑料盖在注入器上调节至0.6毫米的长度;从注入器的尖端到硅塑料盖的边缘测量。
- 在调整塑料盖时,请注意不要弯曲或使注入器变钝。
- 对于以前未用于硬脑膜注射的其他小鼠菌株,通过将长度设置为0.6 mm并用墨水或染料进行先导注射来确定最佳浸泡器长度,调整浸泡器长度,直到观察到染料仅在硬脑膜中,而不是在大脑或颅骨上。
- 将调整后的注水器的长端(或未测量为 0.6 mm 的末端)连接到塑料管(泵管,2 档,内径 0.19 mm,长度 406 mm)。
- 将管子切割至最小长度 8 in,以确保有足够的管路容纳 5 μL 的体积。
- 确保管道覆盖金属部件和位于注入器上的塑料塞子的顶部。这将有助于防止气泡积聚在管路中。
- 将管道的另一端连接到10μL玻璃微量注射器(气密性;胶合针;21G,10mm投影),再次确保在注射器的金属部分上紧密密封(图1A)。
- 连接管路后,用5μL磷酸盐缓冲盐水(PBS),合成间质液(SIF)或其他选择的载体回填注射器,以防止形成气泡。
- 如果在线路中观察到气泡,请用车辆淹没线路,直到气泡消散。
注意:在将注射器连接到管路之前,用车辆填充注射器,然后在连接后将液体推过管路可能会有所帮助。
- 如果在线路中观察到气泡,请用车辆淹没线路,直到气泡消散。
- 在管路回填5μL载体并有效工作后,将5μL药物/溶液加载到Hamilton注射器中(如果学习或实践该技术,可以使用墨水或染料作为药物/溶液的替代品)。
- 确保在硬脑膜上施用的所有车辆溶液保持在pH 7.4,并测量到310的渗透压。这减少了硬脑膜内酸感应离子通道和其他渗透素敏感通道的潜在激活。
- 在未导致泄漏到大脑中的小鼠中测试的最大体积约为10μL。注射该体积后的行为影响尚未经过测试。因此,仅将5μL溶液施用于硬脑膜。
注意:这些观察结果基于6-8周龄CD1 / ICR小鼠的小鼠菌株/年龄/体重。
2. 硬脑膜注射
- 一旦制备注射器并上样药物,将小鼠平放在腹部,并在短暂的3%异氟醚下麻醉,通过鼻锥以0.5-1 L / min的氧气流速麻醉。
- 在鼠标不再显示捏合反射后,调整麻醉并将其维持在1.5%异氟醚。
- 麻醉后,将无菌眼药膏涂抹在眼睛上并剃掉动物的头部,然后用聚维酮碘和乙醇消毒皮肤。在此之后,进入有利于成功注射的位置。
- 用一只手稳定动物的头部,用另一只手握住注入器。
- 仔细探测并定位小鼠颅骨上矢状和兰氏缝合线的交界处(图1B,C)。
- 要通过皮肤定位这个隐蔽的连接点,请使用头骨的地形特征,并使用注入器轻轻探测连接点的一般位置。
- 通过沿着颅骨重新定位注入器并感觉确切的位置来验证连接点的位置。
- 一旦找到缝合线并且注入器就位,非常缓慢和轻轻地来回摆动注入器,直到它穿过皮肤并下降到连接处,一直到塑料塞子。
注:确保将整个 0.6 mm 的注入器尖端插入液络部。 - 为了验证准确性,使用墨水或染料作为注射溶液,并对小鼠进行安乐死和斩首。
- 取下颅盖以观察硬脑膜内的染料(图1C)。
注意:不应在大脑或颅骨外部观察到染料。同样,在任何实验中,小鼠都应在事后进行检查,以验证注射的准确性以及确保硬脑膜的完整性未受损。
- 取下颅盖以观察硬脑膜内的染料(图1C)。
- 注射后,将小鼠从麻醉中取出,等待其恢复意识,然后返回其笼子或将其放入测试室以开始所需的测定。
注意:在进行任何行为实验之前,让小鼠从麻醉中恢复至少30分钟。
3. 眶周冯·弗雷
- 从大约16-20只小鼠的队列开始研究。
- 在习惯化前一天,处理每只小鼠至少5分钟。
- 处理后约24小时,将小鼠习惯到测试室条件和von Frey测试设备(图2A)。
注意:亚克力测试设备由单独的隔间组成,其盖子约为3英寸x 3.5英寸x 5英寸(宽x高x深),并由铝支架支撑,通过0.25英寸19 G方形镀锌钢丝连接。- 将小鼠放入水平放置的4盎司白色纸杯中,该纸杯无味且不含聚乙烯或石蜡。
注意:这些类型的杯子是优选的,因为它可以减少摄入小鼠的胃肠道不适(图2B)。
- 将小鼠放入水平放置的4盎司白色纸杯中,该纸杯无味且不含聚乙烯或石蜡。
- 当动物在各自的腔室中时,在每只小鼠的单个腔室中放置正常食物的颗粒,以使动物平静下来,并避免对动物造成任何不必要的压力。在进行任何冯·弗雷行为测试之前,请先进行3天。
- 确保每次小鼠在腔室中时都可以获得食物。
- 对每只动物进行编号并分配到测试架中的相同空间。在测试期间,每天将小鼠放在同一个杯子中,以确保每只动物适应其测试环境。
注意:老鼠会啃食杯子,然后破坏杯子。如果发生这种情况,请更换杯子并用相应的鼠标编号标记。
- 在习惯化的最初3天后,将小鼠放在各自的腔室中。
- 在任何von Frey测试之前,让动物适应测试室和腔室至少1小时,以使小鼠平静下来,随后更容易测试。
- 在测试当天适应房间后,从各自的腔室中取出一只仍在杯子中的小鼠。
- 将杯子保持在水平位置,使鼠标同时位于前爪和后爪上,以帮助保持其重量均匀分布。
注意:体重分布不均可能会改变动物的反应,甚至阻止动物做出反应。
- 将杯子保持在水平位置,使鼠标同时位于前爪和后爪上,以帮助保持其重量均匀分布。
- 将装有鼠标的杯子放在吸水垫上测试架下方的桌子上。
- 对于眶周冯弗雷测试,将0.07克冯弗雷丝直接放在面部中心和眼睛之间。
- 在细丝上施加足够的压力,使冯·弗雷的头发弯曲成"C"形。
- 与该区域保持至少3秒但不超过5秒的接触,或者直到鼠标抬起头部并用爪子在细丝上滑动。
注意:如果在测试期间,长丝滑落或超过细丝的尖端接触到动物,则不应计算任何反应。这些反应可能是对由不同机械感受器激活的刷子的反应,因此可能无法反映准确的结果。 - 根据Dixon"up-down"方法22,23应用von Frey细丝。
- 最初,应用重量为0.07克的von Frey细丝。在本研究中,可能的最低细丝和测试最高的细丝分别是重量分别为0.008 g和0.6 g的细丝。
- 使用重量为0.008g,0.02g,0.04g,0.07g,0.16g,0.4g和0.6g的细丝进行该测定。
- 在这种方法中,如果动物对细丝没有表现出反应,则应用下一个更高克重的细丝。
- 如果鼠标确实对一根细丝有反应,请考虑该鼠标对该细丝有响应。如果是这种情况,请应用下一个较低克重的灯丝。
- 重复此模式,直到在初始反应后对动物进行测试4次,或者确定动物对测定中测试的任何细丝无反应。
注意:不要施加来自手臂或手腕的任何额外压力。可以使用刻度来练习细丝的应用。
- 与该区域保持至少3秒但不超过5秒的接触,或者直到鼠标抬起头部并用爪子在细丝上滑动。
4. 测试基线戒断阈值
- 在纳入实验之前,确保小鼠达到0.5-0.6g之间的基线戒断阈值。
- 如果小鼠对步骤3.9.2.2中提到的系列测试的任何细丝(0.07 g,0.16g,0.4g和0.6g)中测试的任何细丝没有反应,则达到基线。
- 在建立基线戒断阈值时,每天测试小鼠。
- 测试允许动物适应测试条件和冯弗雷细丝的压力。
- 如果小鼠在测试的第三天后仍然非常敏感,请尝试等待1或2天,然后再进行测试。
注意:测试日之间的时间过长可能导致动物无法适应眶周区域细丝的重量,从而无法达到目标戒断阈值。
- 在确定哪些动物不符合实验的纳入标准之前,对小鼠进行约7天测试。
注意:大约70%的小鼠将达到目标基线水平。- 在硬脑膜刺激之前,分析基线数据以排除任何未达到0.5-0.6克或更高基线值的小鼠。
- 排除后,将剩余的每个鼠标随机分配到测试组。通过从杯子中抽出或在电子表格上编写脚本以将数字随机化到组中来实现此目的。
5. 冯·弗雷结果分析
- 一旦获得一系列响应,根据先前发布的方法24确定delta,k值,50%阈值和以克为单位的戒断阈值。
- 使用此公式WT = 10(x * F + B)计算退出阈值,其中WT =退出阈值,F =通过Chaplan方法计算的爪子提取阈值,B =对数(弯曲力)= x *灯丝数+ B的线性回归。
- 将数据绘制为50%的提款阈值或平均提款阈值(以克为单位)。
结果
这种注射方法用于在小鼠的硬脑膜上施用刺激,以便可能发生随后的行为测试。用这个模型测量的最常见的行为输出是通过von Frey 12,13,14评估的皮肤面部超敏反应。在这里,我们展示了如何使用该模型来评估偏头痛病理学的潜在性别特异性贡献(图3)。
该手术已用于检查硬膜催乳素(PRL)对机械诱发的面部超敏反应的影响14 (图3)。这项研究的结果表明,雌性ICR小鼠对5μg硬膜催乳素的反应显示出显着降低的面部戒断阈值(图3A)。低十倍剂量的0.5μg催乳素(PRL)也显示出类似于高剂量PRL的反应(图3B)。
这些注射也被证明会产生通过鬼脸评估的自发性疼痛相关行为。硬脑膜0.5μgPRL在雌性小鼠中引起显着的鬼脸(图3C),进一步证明了硬脑膜PRL在雌性偏头痛样行为中的明确作用。在用von Frey细丝进行所有测试之前,我们进行了鬼脸分析。
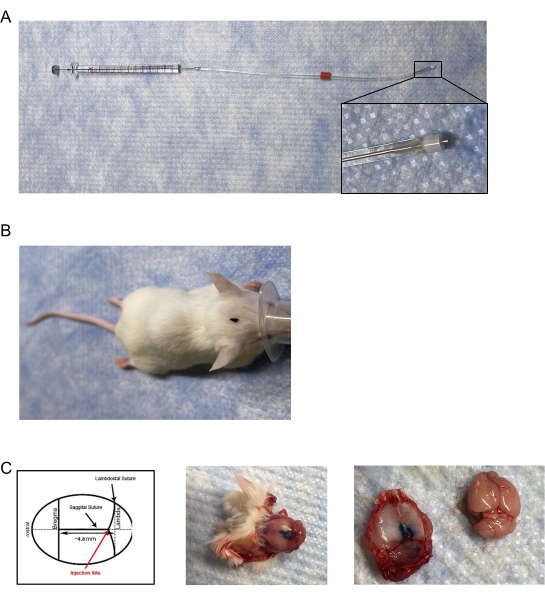
图 1:硬脑膜注射器和注射器放置。 (A) 注射器/注射器由一个改良的套管组成,该套管的长度调整为 ~0.5 mm- 0.65 mm,并通过 tygon 管连接到粘合在 10 μL 气密注射器上的针头上。(B)在鼠标头部标记注射部位位置的鸟瞰图。(C)(左面板)硬膜注射位置图。注射液位于兰氏缝合线和矢状缝合线的交界处,位于前后约 4.8 mm 处。(中间面板)硬脑膜注射5μL蓝色注射染料后小鼠颅骨的死后鸟瞰图。(右面板)将小鼠颅盖与大脑分离。没有观察到蓝色注射染料在大脑上的泄漏。 请点击此处查看此图的大图。

图2:von Frey测试室(A)von Frey测试室由3.5 in x 3.5 in个单独的丙烯酸腔室组成,盖子放在金属丝网架上。它们通过2行组织的10个腔室的列连接。(B)小鼠在von Frey测试室内的单个杯子中的示例。请点击此处查看此图的大图。
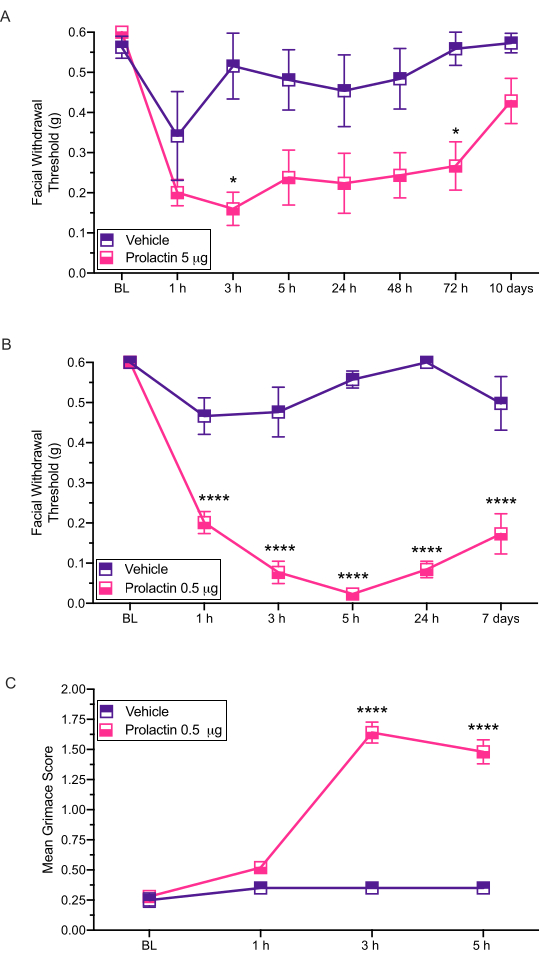
图3:硬脑膜上催乳素的应用诱导小鼠的行为反应。在雌性小鼠中硬膜施用PRL(5μg或0.5μg)后评估机械戒断阈值。(A)与载体相比,应用5μgPRL(n = 7 PRL,n = 6载体)诱导面部超敏反应。(B)应用0.5μgPRL(n = 5 PRL,n = 4载体)诱导持久的面部超敏反应。(C)在每个时间点用0.5μgPRL处理的相同小鼠中也评估了Grimace。与用载体治疗的小鼠相比,这些小鼠表现出显着更高的鬼脸评分。统计数据:双向方差分析,然后是Bonferroni多重比较事后分析。*p < 0.05, ****p < 0.0001 表示为 SEM ±均值。请点击此处查看此图的大图。
讨论
尽管缺乏组织损伤,但硬脑膜中局部伤害感受系统的适应不良变化被认为是偏头痛发作头痛阶段的关键因素25,26。在这里,该研究提出了一种方法,其中对硬脑膜的微创刺激可以诱导面部触觉过敏。阐明硬膜伤害感受器激活所涉及的机制和事件而不对颅骨和组织造成损害,可以更准确地反映临床前模型中的偏头痛机制。
开颅术和插管植入术长期以来一直用于评估导致偏头痛的功能和机制11,12.然而,据报道,开颅术可以诱导硬膜肥大细胞的活化并增加啮齿动物的pial血管通透性27。鉴于硬脑膜中的肥大细胞活化与偏头痛高度相关7,8,28,29,该技术具有可能扭曲解释的主要警告。通过矢状和兰氏缝合线的连接处施用物质可有效减少由开颅术诱导的肥大细胞活化介导的伤害感受器的活化。此外,非侵入性硬膜刺激不需要术后恢复和镇痛药的施用,这可能会改变结果的解释。物质在硬脑膜上的局部应用使研究人员能够专注于这种特定的靶组织,而不是全身施用药物,其中作用部位不容易确定12,13,14。虽然系统施用硝酸甘油和降钙素基因相关肽等物质会引发与偏头痛相似的人类实验攻击,但它们不允许评估啮齿动物模型中的作用位置;更有针对性的组织特异性模型提供了另一种方法。
这里描述的这种技术涉及通过颅骨的矢状和兰氏缝合线相遇的交界处将药物或其他溶液直接注射到脑膜的硬脑膜上。为了获得最佳结果,应将这些实验用于6-8周的ICR(CD-1)或C57 / BL6小鼠。可以使用年轻的小鼠;然而,不建议使用年龄超过8周的ICR(CD-1)小鼠,因为它们的颅板缝合线通常在这个年龄完全融合,使得不可能在不损伤颅骨的情况下注射。考虑将经历此过程的每只小鼠的重量/大小也至关重要。建议在体重大于19g的动物上进行这些注射,因为头骨通常在较低重量下非常薄,并且可能无法承受注射过程中施加的压力。重要的是,还有一些因素可能导致颅底板融合的年龄/体重(例如,动物设施中使用的实验室食物的组成)。因此,实验人员可能需要确定适合自己条件下的年龄/体重范围。其他小鼠品系或基因型可能需要不同的年龄范围和动物体重,这取决于颅底何时在这些动物中融合,并且可能还需要优化注射本身。
在学习或练习这种技术时,强烈建议在安乐死小鼠中定位缝合连接处以获得一定程度的舒适感。最好首先在这些小鼠中切除或剥离头皮,然后慢慢通过皮肤定位连接处。一旦确定了精确的位置,就可以将油墨和染料注入硬脑膜中,以验证注射的位置精度和深度。该技术是使用ICR(CD-1)小鼠(30-35g)和C57 / BL6小鼠(25-30g)开发和优化的。0.5-0.6 mm的注入器长度足以注射25-35g范围内的小鼠重量。然而,如果注射的小鼠与用于优化该技术的小鼠明显不同,则可能需要校准注入器的长度。例如,小于25 g的鼠标可能会导致使用长度小于0.5 mm的注入器。掌握该技术并在适合年龄的小鼠中进行时,该注射的成功率可以接近100%;然而,注射的并发症可能源于诸如由于施加太大的力插入注入注入器而导致颅骨破裂以及由损伤脑膜血管引起的异常出血等问题。
触觉敏感性的改变是评估啮齿动物疼痛行为的重要衡量标准。在这里,我们演示了使用眶周von Frey测试在临床前偏头痛模型中评估这些行为。在偏头痛模型中使用这种技术的一个主要优点是,我们可以评估头部的超敏反应,这比其他非颅骨位置(如爪子)更具相关性。确保结果可重复的关键步骤是确保小鼠完全基线。这将需要一个训练有素的实验者,可以精确地应用冯·弗雷细丝。动物可能需要大约7天才能达到基线。但是,可能并非每只动物都能达到目标基线。根据我们的经验,在与小鼠一起工作约7天后,只有60%-70%的动物在眶周区域达到0.6克的基线,但这取决于动物的队列。在开始实验之前,应考虑这一时间,以确保使用足够的数字来解释辍学,并且动物是使用这种非侵入性方法刺激硬脑膜的基线后的适当年龄。协议第 4 节中概述了确定基线的步骤。
von Frey测试的局限性在于很难区分疼痛反应和常规修饰/瘙痒。为了帮助区分疼痛和梳理,重要的是要注意这种行为发生的时间长度。通常,疼痛反应是在细丝应用后滑动一次,而梳理行为往往会延长,并且可以持续几秒钟到几分钟。如果梳理/瘙痒行为无法与超敏反应区分开来,最好不要将其记录为反应。此外,不正确的细丝放置(例如,长丝滑落)可能导致动物长时间梳理,使其难以正确测试。如果发生这种情况,实验者应该等到梳理停止,鼠标足够平静来测试。从梳理行为开始之前使用的相同细丝继续。如果小鼠持续很长时间,将小鼠放回测试室约5分钟。5分钟后,再次尝试测试鼠标。如果这种行为继续没有解决,则必须将小鼠从研究中移除。重要的是,不建议剃掉脸上的毛皮,因为不清楚毛发去除后小鼠皮肤是否保持相同的敏感性,脱毛过程(剃须,脱毛膏)也可能影响皮肤敏感性。
在大多数情况下,它是在小鼠达到基线后不超过24小时将物质施用到硬脑膜上的理想选择。建议小鼠每小时进行一次冯弗雷丝状物测试。如果可能的话,每隔一小时测试一次,让动物有足够的时间在测试后冷静下来。此外,实验应定时,以免干扰其昼夜节律模式。小鼠昼夜节律的改变可能会改变行为表型,并最终导致不可复制的结果。
眶周冯弗雷试验可以与其他行为测定结合使用,以加强实验结论。鬼脸量表依赖于啮齿动物的自发面部表情,而不是诱发的反应18,19。该方法在评估和量化急性疼痛行为时具有很高的准确性和可靠性,并且已用于偏头痛12,30的许多临床前模型。当同时使用鬼脸和眶周von Frey测定时,实验者应考虑在将von Frey细丝应用于小鼠的眶周区域之前对鬼脸进行评分。这确保了鬼脸行为是自发的,不会被细丝应用引起。Hindpaw 机械性超敏反应也可与眶周 von Frey 试验联合使用。与鬼脸评分相反,最好在评估后爪超敏反应之前测试面部超敏反应。Hindpaw测试要求在眶周von Frey测试完成后将小鼠放回没有杯子的腔室中。
总之,眶周von Frey试验和小鼠的非侵入性硬膜刺激为目前偏头痛的临床前模型范围增加了有价值的选择。如果操作正确,该技术提供了一种在啮齿动物中产生头痛样表型的改进方法,因为它不需要手术植入插管。在大鼠中,插管容易发生细菌感染,可能堵塞,可能脱落,并要求每只动物都是单宿主的,对动物造成不必要的压力。此外,硬膜刺激方案可以很容易地修改为与几种药物应用一起使用。眶周冯弗雷测试范式也可以修改,以最好地适应实验规范。此外,眶周冯弗雷试验可用于其他口面部疼痛疾病。这些技术是帮助进一步了解偏头痛的复杂潜在机制的重要工具。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了美国国立卫生研究院的支持(NS104200和NS072204至GD)。
材料
| Name | Company | Catalog Number | Comments |
| 4 oz Hot Paper Cups | Choice Paper Company | 5004W | https://www.webstaurantstore.com/choice-4-oz-white-poly-paper-hot-cup-case/5004W.html |
| Absorbent Underpads | Fisherbrand | 14-206-65 | https://www.fishersci.com/shop/products/fisherbrand-absorbent-underpads-8/p-306048 |
| C313I/SPC Internal 28 G cannula | P1 Technologies (formerly Plastics One) | 8IC313ISPCXC | I.D. 18 mm, O.D. 35 mm |
| Gastight Model 1701 SN Syringes | Hamilton | 80008 | https://www.hamiltoncompany.com/laboratory-products/syringes/80008 |
| Ismatec Pump Tubing, 0.19 mm | Cole-Palmer | EW-96460-10 | https://www.coleparmer.com/i/ismatec-pump-tubing-2-stop-tygon-s3-e-lab-0-19-mm-id-12-pk/9646010 |
| Stand with chicken wire | Custom | The galvanized steel chicken wire dimensions are 0.25 in. x 19-gauge | |
| Testing Rack with individual Chambers | Custom | Each chamber should have a division between each mouse and lids to contain the mouse. The chambers should also be large enough to hold a 4 oz. paper cup. | |
| von Frey Filaments | Touch test/Stoelting | 58011 | https://www.stoeltingco.com/touch-test.html |
参考文献
- GBD 2016 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 390 (10100), 1211-1259 (2017).
- Woldeamanuel, Y. W., Cowan, R. P. Migraine affects 1 in 10 people worldwide featuring recent rise: A systematic review and meta-analysis of community-based studies involving 6 million participants. Journal of the Neurological Sciences. 372, 307-315 (2017).
- Burch, R. C., Loder, S., Loder, E., Smitherman, T. A. The prevalence and burden of migraine and severe headache in the United States: updated statistics from government health surveillance studies. Headache. 55 (1), 21-34 (2015).
- Ashina, M. Migraine. New England Journal of Medicine. 383 (19), 1866-1876 (2020).
- Ashina, M., et al. Migraine: integrated approaches to clinical management and emerging treatments. Lancet. 397 (10283), 1505-1518 (2021).
- Jacobs, B., Dussor, G. Neurovascular contributions to migraine: Moving beyond vasodilation. Neuroscience. 338, 130-144 (2016).
- Koyuncu Irmak, D., Kilinc, E., Tore, F. Shared Fate of Meningeal Mast Cells and Sensory Neurons in Migraine. Frontiers in Cellular Neuroscience. 13, 136(2019).
- Levy, D. Migraine pain, meningeal inflammation, and mast cells. Current Pain and Headache Reports. 13 (3), 237-240 (2009).
- Levy, D., Labastida-Ramirez, A., MaassenVanDenBrink, A. Current understanding of meningeal and cerebral vascular function underlying migraine headache. Cephalalgia. 39 (13), 1606-1622 (2019).
- Phebus, L. A., Johnson, K. W. Dural inflammation model of migraine pain. Current Protocols in Neuroscience. , Chapter 9, Unit 9.1 (2001).
- Fried, N. T., Maxwell, C. R., Elliott, M. B., Oshinsky, M. L. Region-specific disruption of the blood-brain barrier following repeated inflammatory dural stimulation in a rat model of chronic trigeminal allodynia. Cephalalgia. 38 (4), 674-689 (2018).
- Avona, A., et al. Dural calcitonin gene-related peptide produces female-specific responses in rodent migraine models. The Journal of Neuroscience. 39 (22), 4323-4331 (2019).
- Burgos-Vega, C. C., et al. Non-invasive dural stimulation in mice: A novel preclinical model of migraine. Cephalalgia. 39 (1), 123-134 (2019).
- Avona, A., et al. Meningeal CGRP-Prolactin interaction evokes female-specific migraine behavior. Annals of Neurology. 89 (6), 1129-1144 (2021).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284(2017).
- Lipton, R. B., et al. Cutaneous allodynia in the migraine population. Annals of Neurology. 63 (2), 148-158 (2008).
- Goadsby, P. J. Migraine, allodynia, sensitisation and all of that. European Neurology. 53, Suppl 1 10-16 (2005).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-449 (2010).
- Mogil, J. S., Pang, D. S. J., Silva Dutra, G. G., Chambers, C. T. The development and use of facial grimace scales for pain measurement in animals. Neuroscience & Biobehavioral Reviews. 116, 480-493 (2020).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. The Journal of Headache and Pain. 20 (1), 11(2019).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central CGRP mechanisms. The journal of Neuroscience. 37 (1), 204-216 (2017).
- Dixon, W. J., Mood, A. M. A method for obtaining and analyzing sensitivity data. The Journal of the American Statistical Association. 43 (241), 109-126 (1948).
- Dixon, W. The up-and-down method for small samples. The Journal of the American Statistical Association. 60, (1965).
- Bonin, R. P., Bories, C., De Koninck, Y. A simplified up-down method (SUDO) for measuring mechanical nociception in rodents using von Frey filaments. Molecular Pain. 10, 26(2014).
- Ramachandran, R. Neurogenic inflammation and its role in migraine. Seminars in Immunopathology. 40 (3), 301-314 (2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K. Does inflammation have a role in migraine. Nature Reviews Neurology. 15 (8), 483-490 (2019).
- Stokely, M. E., Orr, E. L. Acute effects of calvarial damage on dural mast cells, pial vascular permeability, and cerebral cortical histamine levels in rats and mice. Journal of Neurotrauma. 25 (1), 52-61 (2008).
- Theoharides, T. C., Donelan, J., Kandere-Grzybowska, K., Konstantinidou, A. The role of mast cells in migraine pathophysiology. Brain Research Reviews. 49 (1), 65-76 (2005).
- Conti, P., et al. Progression in migraine: Role of mast cells and pro-inflammatory and anti-inflammatory cytokines. European Journal of Pharmacology. 844, 87-94 (2019).
- Rea, B. J., et al. Peripherally administered calcitonin gene-related peptide induces spontaneous pain in mice: implications for migraine. Pain. 159 (11), 2306-2317 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。