Method Article
미생물 마이크로액적 배양 시스템(MMC)을 이용한 자동화된 미생물 배양 및 적응 진화
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 미생물 마이크로액적 배양 시스템(MMC)을 사용하여 자동화된 미생물 배양 및 적응 진화를 수행하는 방법을 설명합니다. MMC는 미생물을 자동으로 지속적으로 재배 및 하위 재배 할 수 있으며 상대적으로 높은 처리량과 우수한 병렬화로 온라인으로 성장을 모니터링하여 노동 및 시약 소비를 줄일 수 있습니다.
초록
기존의 미생물 재배 방법은 일반적으로 번거로운 작업, 낮은 처리량, 낮은 효율 및 노동 및 시약의 큰 소비를 가지고 있습니다. 더욱이, 최근 개발된 마이크로플레이트 기반의 고처리량 재배 방법은 낮은 용존산소, 불량한 혼합물, 심한 증발 및 열 효과로 인해 미생물 성장 상태 및 실험 병렬화가 불량하다. 작은 부피, 높은 처리량 및 강력한 제어 가능성과 같은 마이크로 액적의 많은 장점으로 인해 액적 기반 미세 유체 기술은 이러한 문제를 극복 할 수 있으며, 이는 고처리량 미생물 재배, 스크리닝 및 진화에 대한 많은 종류의 연구에 사용되었습니다. 그러나 대부분의 선행 연구는 실험실 건설 및 적용 단계에 남아 있습니다. 높은 운영 요구 사항, 높은 건설 어려움 및 자동화 된 통합 기술의 부족과 같은 몇 가지 주요 문제는 미생물 연구에서 액적 미세 유체 기술의 광범위한 적용을 제한합니다. 여기에서는 액적 미세유체 기술을 기반으로 자동화된 미생물 마이크로액적 배양 시스템(MMC)이 성공적으로 개발되어 미생물 액적 재배 과정에서 필요한 접종, 재배, 온라인 모니터링, 하위 재배, 분류 및 샘플링과 같은 기능의 통합을 달성했습니다. 본 프로토콜에서는 야생형 대장 균(E. coli) MG1655 및 메탄올-필수 대장균 균주(MeSV2.2)를 예로 들어 MMC를 사용하여 자동화되고 상대적으로 높은 처리량의 미생물 배양 및 적응 진화를 수행하는 방법을 상세히 소개하였다. 이 방법은 작동하기 쉽고 노동력과 시약을 덜 소비하며 실험 처리량이 높고 데이터 병렬성이 우수하여 기존 재배 방법에 비해 큰 장점이 있습니다. 과학 연구자가 관련 미생물 연구를 수행 할 수있는 저렴한 비용, 작동 친화적이며 결과 신뢰할 수있는 실험 플랫폼을 제공합니다.
서문
미생물 재배는 미생물 과학 연구 및 산업 응용을위한 중요한 토대 이며, 미생물 1,2,3의 격리, 식별, 재구성, 스크리닝 및 진화에 널리 사용됩니다. 기존의 미생물 재배 방법은 주로 시험관, 진탕 플라스크 및 고체 플레이트를 재배 용기로 사용하며 진탕 배양기, 분광 광도계, 마이크로 플레이트 판독기 및 미생물 재배, 검출 및 스크리닝을위한 기타 장비와 결합됩니다. 그러나 이러한 방법에는 번거로운 작업, 낮은 처리량, 낮은 효율 및 많은 노동 및 시약 소비와 같은 많은 문제가 있습니다. 최근 몇 년 동안 개발 된 고처리량 재배 방법은 주로 마이크로 플레이트를 기반으로합니다. 그러나 마이크로플레이트는 낮은 수준의 용존 산소, 열악한 혼합 특성, 심한 증발 및 열 효과를 가지며, 이는 종종 불량 한 성장 상태 및 미생물 4,5,6,7의 실험 병렬화로 이어진다; 반면에 자동 재배 및 공정 검출 8,9를 달성하기 위해서는 액체 처리 워크 스테이션 및 마이크로 플레이트 판독기와 같은 값 비싼 장비를 장착해야합니다.
미세 유체 기술의 중요한 분야로서, 액적 미세 유체 학은 전통적인 연속 유동 미세 유체 시스템을 기반으로 최근 몇 년 동안 개발되었습니다. 두 개의 비혼화성 액체상(보통 오일-물)을 사용하여 분산된 마이크로액적을 생성하고 이들(10)에서 작동하는 이산 유동 미세유체 기술이다. 마이크로 액적은 작은 부피, 큰 비표면적, 높은 내부 질량 전달 속도, 구획화로 인한 교차 오염이 없으며 강력한 제어 가능성과 액적의 높은 처리량의 장점을 가지고 있기 때문에 미생물의 고처리량 재배, 선별 및 진화에 액적 미세 유체 기술을 적용하는 많은 종류의 연구가있었습니다11 . 그러나 액적 미세 유체 기술을 대중화하고 널리 적용하기위한 일련의 주요 문제가 여전히 있습니다. 첫째, 액적 미세 유체 공학의 작동은 번거롭고 복잡하여 작업자에게 높은 기술 요구 사항을 초래합니다. 둘째, 액적 미세 유체 기술은 광학, 기계 및 전기 구성 요소를 결합하고 생명 공학 응용 시나리오와 관련되어야합니다. 여러 분야의 협력이 없다면 단일 실험실 또는 팀이 효율적인 액적 미세 유체 제어 시스템을 구축하는 것은 어렵습니다. 셋째, 소량의 마이크로액적(피콜리터(pL)에서 마이크로리터(μL)까지)으로 인해, 서브재배, 분류 및 샘플링과 같은 일부 기본적인 미생물 작업을 위한 액적의 정확한 자동 제어 및 실시간 온라인 검출을 실현하는 데 많은 어려움이 소요되며, 통합 장비 시스템(12)을 구축하는 것도 어렵다.
상기 문제점을 해결하기 위하여, 액적 미세유체 기술(13)에 기초한 자동 미생물 마이크로액적 배양 시스템(MMC)이 성공적으로 개발되었다. MMC는 액적 인식 모듈, 액적 스펙트럼 감지 모듈, 미세유체 칩 모듈 및 샘플링 모듈의 네 가지 기능 모듈로 구성됩니다. 모든 모듈의 시스템 통합 및 제어를 통해 생성, 재배, 측정 (광학 밀도 (OD) 및 형광), 분리, 융합, 물방울 분류를 포함한 자동화 된 운영 시스템이 정확하게 확립되어 미생물 액적 재배 과정에서 필요한 접종, 재배, 모니터링, 하위 재배, 분류 및 샘플링과 같은 기능의 통합을 달성합니다. MMC는 2-3 μL 부피의 최대 200개의 복제 액적 배양 단위를 보유할 수 있으며, 이는 200개의 진탕 플라스크 배양 단위에 해당한다. 마이크로 액적 재배 시스템은 미생물의 성장 동안 비 오염, 용존 산소, 혼합 및 질량 에너지 교환의 요구 사항을 충족시킬 수 있으며 성장 곡선 측정, 적응 진화, 단일 요인 다단계 분석 및 대사 산물 연구 및 분석 (형광 검출 기준)13,14과 같은 여러 통합 기능을 통해 미생물 연구의 다양한 요구를 충족시킬 수 있습니다.
여기서, 프로토콜은 MMC를 사용하여 자동화 및 미생물 배양 및 적응 진화를 수행하는 방법을 자세히 소개한다(도 1). MMC에서의 적응 진화를 입증하기 위해 야생형 대장 균(E. coli) MG1655를 일례로 하여 성장 곡선 측정 및 메탄올-필수 대장균 균주 MeSV2.215를 수득하였다. MMC 용 운영 소프트웨어가 개발되어 작업을 매우 간단하고 명확하게 만듭니다. 전체 과정에서 사용자는 초기 박테리아 용액을 준비하고 MMC의 조건을 설정 한 다음 박테리아 용액 및 관련 시약을 MMC에 주입해야합니다. 그 후, MMC는 액적 생성, 인식 및 번호 매기기, 재배 및 적응 진화와 같은 작업을 자동으로 수행합니다. 또한 높은 시간 분해능을 가진 물방울의 온라인 검출 (OD 및 형광)을 수행하고 소프트웨어에 관련 데이터 (내보낼 수 있음)를 표시합니다. 작업자는 결과에 따라 언제든지 재배 과정을 중단하고 후속 실험을 위해 표적 액적을 추출 할 수 있습니다. MMC는 작동하기 쉽고 노동력과 시약을 덜 소비하며 상대적으로 높은 실험 처리량과 우수한 데이터 병렬 성을 가지며 이는 기존 재배 방법에 비해 상당한 이점을 가지고 있습니다. 연구자들이 관련 미생물 연구를 수행 할 수있는 저렴한 비용, 작동 친화적이고 강력한 실험 플랫폼을 제공합니다.
프로토콜
1. 계기 및 소프트웨어 설치
- 깨끗하고 멸균 된 환경 (예 : 깨끗한 벤치)을 MMC를위한 전용 영구 공간으로 선택하십시오. MMC를 공간에 꾸준히 설치하십시오.
참고: MMC를 강한 전기장, 자기장 및 강한 방열원의 간섭으로부터 멀리하십시오. 심한 진동이 광학 감지 부품에 영향을 미치지 않도록 하십시오. MMC에 AC220 V, 50 HZ의 전원 공급 장치를 제공하십시오. MMC에 대한 자세한 내용은 자료 표 및 MMC16 웹 사이트를 참조하십시오. - MMC.zip 파일에서 작업 소프트웨어를 설치합니다.
참고: MMC.zip 파일에 대해서는 작성자에게 문의하십시오.- 전용 폴더를 만들고 zip 파일을 저장하십시오.
- 다른 전용 폴더를 "설치 디렉토리"로 만듭니다. MMC.zip의 압축을 풀고 새 폴더에 파일을 저장합니다.
참고: 컴퓨터 구성이 가장 적합합니다: (1) Windows 7 64비트 운영 체제 이상; (2) CPU: i5 이상; (3) 메모리: 4GB 이상; (4) 하드 디스크: 300GB 이상 (회전 속도가 7200rpm 이상 또는 솔리드 스테이트 디스크).
2. 준비
- 주사기 바늘(내경은 0.41mm, 외경은 0.71mm), 퀵 커넥터 A 및 시약 병(그림 2C)을 연결하고, 이를 121°C에서 15분 동안 오토클레이브한다.
주: 멸균 중에 시약 병의 뚜껑을 약간 풉니다. 사용할 때마다 몇 가지 시약 병을 더 준비 할 수 있습니다. - 0.22 μm 폴리비닐리덴플루오라이드(PVDF) 필터를 사용하여 MMC 오일을 필터링합니다. 미세유동 칩(도 2B)과 MMC 오일을 미리 깨끗한 벤치에 넣고 사용 전에 30분 동안 자외선 조사로 멸균한다.
참고: 퀵 커넥터 A, 시약 병, MMC 오일 및 미세유체 칩에 대한 자세한 내용은 재료 표를 참조하십시오. - 미세 유체 칩 설치
- 작동 챔버의 도어를 열고(그림 2A) 광섬유 프로브를 들어올립니다.
- 전기장 구멍을 전기장 바늘에 맞추고 칩을 칩 받침대에 부드럽게 놓습니다. 그런 다음 두 개의 위치 결정 열을 위치 결정 구멍에 삽입하고 광섬유 프로브를 내려 놓습니다(그림 2D).
- 칩의 퀵 커넥터 A를 위치 번호(C5-O5, C4-O4, C6-O6, C2-O2, CF-OF, C1-O1, C3-O3)에 따라 MMC의 해당 포트에 연결합니다. 그런 다음 수술실의 문을 닫으십시오.
- 기름 병에 MMC 오일(약 80 mL까지)을 보충하고 사용 전에 폐병에 폐액을 비우십시오.
참고 : 폐액은 일반적으로 유기 폐기물입니다. 지역 법률 및 폐기 규정을 참조하시기 바랍니다, 실험 설정에 따라 변경에 따라.
3. MMC에서의 성장 곡선 측정
- 초기 박테리아 용액 준비
- 관련 표준 규정에 따라 Luria-Bertani (LB) 배지 및 오토클레이브를 121 ° C에서 15 분 동안 준비하십시오.
참고: LB 배지의 성분: NaCl (10 g/L), 효모 추출물 (5 g/L) 및 트립톤 (10 g/L). - 글리세롤 스톡으로부터 대장균 MG1655 균주를 꺼내어 LB 배지 10 mL가 있는 50 mL 진탕 플라스크에서 37°C에서 5-8시간 동안 진탕 인큐베이터(200 rpm)에서 배양한다.
참고 : 재배 시간은 특정 균주에 따라 다릅니다. 대수 기간 / 단계로 균주를 배양하는 것이 가장 좋습니다. - 배양된 대장균 MG1655 용액을 신선한 배지로 희석하여0.05-0.1의 OD600에 초기 박테리아 용액(약 10 mL 준비)을 얻었다.
- 관련 표준 규정에 따라 Luria-Bertani (LB) 배지 및 오토클레이브를 121 ° C에서 15 분 동안 준비하십시오.
- 초기화를 클릭하여 MMC를 초기화합니다. 초기화 인터페이스가 나타나면 배양 온도를 37°C로 설정하고 광전 신호 값을 0.6으로 설정합니다(그림 3A). 초기화에는 약 20 분이 소요됩니다.
- 초기화하는 동안 UV 램프(파장 254nm)를 켭니다.
- 초기 박테리아 용액과 MMC 오일을 시약 병에 주입하십시오.
- 깨끗한 벤치에서 멸균 된 시약 병을 꺼내 뚜껑을 조이십시오.
- 10 mL 멸균 주사기를 사용하여 측면 튜브의 주사기 바늘에서 3-5 mL의 MMC 오일을 주입하십시오. 시약 병을 천천히 기울이고 회전시켜 오일이 내벽에 완전히 침투하도록하십시오.
- 초기 박테리아 용액 약 5 mL를 주입 한 다음 다시 오일 5-7 mL를 주입하여 시약 병을 채 웁니다.
- 독립적인 퀵 커넥터 A를 당기고 시약 병의 퀵 커넥터 A를 퀵 커넥터 B에 삽입하여 샘플 주입 작업을 완료합니다(그림 4A).
- 초기화가 끝날 때까지 기다린 다음 UV 램프 (파장 254nm)를 끕니다.
- 수술실의 문을 열고 시약 병을 금속 욕조에 넣으십시오.
- 칩의 C2 커넥터와 시약 병의 빠른 커넥터 A를 당깁니다. 시약 병의 측면 튜브 커넥터를 C2 커넥터에 연결하고 상단 튜브 커넥터를 O2 커넥터에 연결합니다. 그런 다음 수술실의 문을 닫으십시오.
- 성장 곡선을 클릭하여 성장 곡선 측정 기능을 선택합니다(그림 3A). 매개 변수 설정 인터페이스에서 숫자를 15로 입력하고 OD 감지 스위치를 켜고 파장을 600nm로 설정합니다. 시작을 클릭하여 드롭릿 생성을 시작합니다. 약 10 분이 소요됩니다.
참고: 여기서 숫자는 생성될 액적의 수를 나타냅니다. 파장은 검출되는 OD의 파장을 의미한다. 실험 요구 사항에 따라 수 (최대 200) 및 파장 (350-800nm)을 설정합니다. - 메인 인터페이스에 "C2와 O2 사이의 시약 병을 제거한 다음 완료 후 OK 버튼을 클릭하십시오"라는 팝업 창이 나타나면 수술실의 문을 열어 시약 병을 꺼내고 C2 및 O2 커넥터를 연결하십시오.
- 문을 닫고 팝업 창에서 확인 버튼을 클릭하여 자동으로 물방울을 재배하고 OD 값을 감지합니다.
참고: MMC는 액적이 광섬유 프로브를 통과할 때 OD 값을 감지합니다. 따라서 감지 기간은 생성 된 액적의 수에 따라 다릅니다. - 성장 곡선이 고정 단계에 도달하면 데이터 내보내기 단추를 클릭하여 OD 데이터를 내보냅니다. 데이터 저장 경로를 선택하고 재배 기간 동안 기록된 OD 값을 적절한 소프트웨어(예: Microsoft Excel)에 의해 열 수 있는 .csv 형식으로 내보냅니다. 그런 다음 매핑 소프트웨어(예: EXCEL 및 Origin 9.0)를 사용하여 성장 곡선을 플로팅합니다.
참고: 재배 과정에서 언제든지 데이터 내보내기 를 클릭하여 현재 모든 액적의 OD 데이터를 내보낼 수 있습니다.
4. MMC의 적응형 진화
- 초기 박테리아 용액 준비
- 관련 표준 규정에 따라 MeSV2.2 및 오토클레이브를 위한 특수 액체 매질 및 고체 플레이트를 121°C에서 15분 동안 준비한다.
참고: 특수 매체의 구성 요소에 대해서는 표 1 및 재료 표를 참조하십시오. - MeSV2.2를 고체 플레이트(직경 = 90 mm)를 사용하여 37°C 항온 배양기에서 72시간 동안 배양한다. 그 다음 독립적인 콜로니를 골라 37°C에서 72시간 동안 진탕 인큐베이터(200 rpm)에서 10 mL의 특수 액체 배지와 함께 50 mL 진탕 플라스크에서 배양한다.
- 배양된 MeSV2.2 용액을 배지와 함께0.1-0.2의 OD600에 희석하고(총 부피가 10 mL 이상인지 확인) 진탕 플라스크에서 5시간 동안 계속 배양하여 초기 박테리아 용액을 얻었다.
참고: MeSV2.2는 메탄올-필수 대장균 균주이다. 특수 액체 배지에는 500 mmol / L 메탄올이 포함되어 있으며, 이는 MeSV2.2에 강한 스트레스이므로 매우 느린 성장을 초래합니다. 여기서 초기 박테리아 용액을 얻는 것은 단계 3.1에서 설명한 것과 다르다는 점에 유의하십시오.
- 관련 표준 규정에 따라 MeSV2.2 및 오토클레이브를 위한 특수 액체 매질 및 고체 플레이트를 121°C에서 15분 동안 준비한다.
- 3.2, 3.3 및 3.5단계에서 설명한 대로 MMC를 초기화합니다.
- 두 개의 멸균 된 시약 병을 꺼내십시오.이 중 하나는 초기 박테리아 용액을위한 것이고 다른 하나는 신선한 배지를위한 것입니다. 단계 3.4에서 설명된 바와 같이 초기 박테리아 용액 (5 mL), 신선한 배지 (12-15 mL), 및 MMC 오일을 시약 병에 주입한다.
참고 : 적응 진화는 여러 하위 재배를 포함하는 장기적인 과정이므로 MMC에 가능한 한 많은 신선한 배지를 저장하십시오. 배지는 실험 실행 중에 보충할 수 없습니다. - 3.6단계에서 설명한 대로 두 개의 시약 병을 MMC에 설치합니다. 하나는 C2와 O2 커넥터 사이에 초기 박테리아 용액을, 다른 하나는 C4와 O4 커넥터 사이의 새 배지에 설치하십시오.
- ALE를 클릭하여 적응 진화 기능을 선택합니다(그림 3B). 매개 변수 설정 인터페이스에서 OD 감지 스위치를 켭니다.
- 숫자를 50, 파장을 600nm, 농도를 0%, 시간으로 입력, 파라미터를 30h, 반복을 99로 설정합니다. 시작을 클릭하여 드롭릿 생성을 시작합니다. 약 25 분이 소요됩니다.
참고: 여기서 "농도"는 적응 진화를 위한 화학적 요인의 최대 농도를 의미한다. 다른 액적의 경우, MMC에서 다른 성장 조건을 제공하기 위해 다양한 농도의 화학 인자를 도입하는 것이 실현 가능합니다. 다음 방정식을 사용하여 도입된 농도를 계산합니다.
여기서 "C" 는 액적에 도입된 화학적 인자의 농도를 지칭하고; "a"는 C4 및 O4 커넥터 사이의 시약 병 내의 화학적 인자의 농도를 지칭하고; "b"는 C6 및 O6 커넥터 사이의 시약 병 내의 화학적 인자의 농도를 지칭하고; 및 "i"는 이용가능한 농도를 지칭한다. MMC에서 사용할 수있는 여덟 가지 농도가 있습니다. 여기의 화학 인자는 단일 농도 (500 mmol / L 메탄올)를 가지며 배지의 성분 중 하나이기 때문에 화학 인자를 함유 한 시약 병 하나만 여기에 설치되고 농도 는 0 %로 설정됩니다. 유형은 세 가지 유형으로 나뉘어지는 하위 재배 모드를 말합니다 : 시간 모드, OD 값 모드 및 형광 모드. 전자는 일정한 시간 동안 물방울을 재배 한 다음 하위 재배하는 것을 의미하고, 후자의 두 가지는 미리 정의 된 OD 값 / 형광 강도로 물방울을 재배 한 다음 하위 재배하는 것을 의미합니다. 매개 변수는 하위 재배 모드를 선택할 때 필요한 관련 매개 변수를 나타냅니다. 반복은 하위 재배의 수를 나타냅니다. - 3.8단계에서 설명한 대로 C2와 O2 커넥터 사이에 놓인 시약 병을 분리합니다.
- 각 서브 재배 기간 동안 액적의 최대 OD 값이 크게 증가했는지 관찰하십시오. 증가가 발생하고 실험 요구 사항을 충족하는 경우 데이터 내보내기 단추를 클릭하여 3.9단계에서 설명한 대로 OD 데이터를 내보냅니다.
참고: 여기서 하위 재배 기간은 매개 변수에 따라 다릅니다. 예를 들어, 유형을 시간 및 매개 변수 로 설정하는 경우 하위 재배 기간은 30h입니다. 각 하위 재배 기간 동안, 액적의 최대 OD 값이 있습니다. 적응형 진화가 최대 OD 값의 증가에 의해 실험 요건을 충족하는지 여부를 추정한다(증가는 균주의 실제 재배 과정에 의존하며, 예를 들어, 20% 이상 증가함).
주의: 저장된 새 매체가 고갈되었는지 여부를 주의하십시오. 배지가 소진된 후에도 상당한 증가가 일어나지 않았다면, 더 잘 자라는 물방울을 추출하고 적응 진화의 새로운 라운드를 수행하십시오. - MMC에서 표적 액적을 추출합니다.
- 스크리닝 버튼을 클릭하여 액적 추출 기능을 선택합니다(그림 3C). 수집 옵션을 선택하고 대상 물방울의 수를 클릭 한 다음 확인을 클릭하십시오.
참고: 액적 스크리닝에는 "수집", "폐기" 및 "종자 용액 추출"이 포함됩니다. "추출 종자 용액"은 서브 재배 작업 후에 남은 액적(13)을 수집하는 것을 의미한다. - 팝업 창이 "CF 퀵 커넥터를 꺼내 EP 튜브에 넣으십시오"라는 메시지가 나타날 때까지 기다립니다. CF 퀵 커넥터를 소프트웨어 프롬프트에 따라 수집을 위해 마이크로 원심분리 튜브에 넣은 다음 확인을 클릭합니다(그림 4D).
- 1-2 분 후에 소프트웨어 인터페이스는 "커넥터를 다시 삽입하고 완료되면 확인을 클릭하십시오"라는 새 창을 팝업합니다. 그런 다음 CF 퀵 커넥터를 다시 삽입하고 확인을 클릭하여 MMC가 계속 실행되도록 합니다(그림 4D). 다음 대상 액적이 액적 인식 사이트에 도달하면 4.9.2-4.9.3을 반복하여 수집합니다.
참고: 모든 표적 물방울이 수집된 후, MMC는 나머지 물방울을 계속 배양합니다. 재배가 필요하지 않은 경우 중지를 클릭하여 작업을 직접 종료하십시오. - 2.5 μL 피펫을 사용하여 액적을 추출하고, 90 mm 아가로스 플레이트에 떨어뜨린 다음, 측면 길이 3 cm의 삼각형 유리 확산 막대로 골고루 퍼뜨린다. 그런 다음 37 °C 항온 배양기에서 72 시간 동안 배양하십시오.
- 3-5개의 독립적인 콜로니를 골라서 이를 신선한 배지 10 mL와 함께 50 mL 진탕 플라스크에서 37°C에서 48-72시간 동안 진탕 인큐베이터(200 rpm)에서 개별적으로 배양한다. 후속 실험을 위해 배양된 박테리아 용액을 글리세롤 튜브에 저장하기 위해 관련 표준 규정을 따르십시오.
- 스크리닝 버튼을 클릭하여 액적 추출 기능을 선택합니다(그림 3C). 수집 옵션을 선택하고 대상 물방울의 수를 클릭 한 다음 확인을 클릭하십시오.
5. MMC의 청소
- 실험이 완료되면 중지를 클릭하여 모든 작업을 중지 합니다. 그런 다음 정리 를 클릭하여 칩과 튜브를 청소하십시오. 약 15 분이 소요됩니다.
결과
이 프로토콜은 대장균 MG1655 및 MeSV2.2 균주를 예로 사용하여 MMC에서 자동화되고 상대적으로 높은 처리량 전략을 갖는 미생물 배양 및 메탄올 필수 적응 진화를 입증합니다. 성장 곡선 측정은 주로 미생물 재배를 특성화하기 위해 사용되었다. 적응 진화는 자동화된 연속 서브 재배에 의해 수행되었고, 각각의 서브 재배 동안 선택적 압력으로서 고농도의 메탄올을 첨가하였다. 적응 진화가 실현되었는지 여부는 각 서브 재배 기간 동안 액적의 최대 OD 값의 변동 추세를 통해 추정되었다. MMC의 조정 가능한 파라미터 및 정확도 파라미터는 표 2에 나타내었다.
성장 곡선 측정 결과
배양 과정 중에 검출된 15개의 액적의OD600 값을 약 20 h 동안 배양한 후에 MMC로부터 내보냈다(도 5A). 검출은 대략 매 14분마다 진행된 것을 관찰할 수 있다. 이 검출 기간은 배양을 위해 튜브에서 액적이 앞뒤로 순환되기 때문에 생성되는 액적의 수에 따라 달라지며, 검출 모듈은 액적이 광섬유 프로브를 통과할 때 OD 값(OD 값의 검출 및 계산은 보충 그림 1에 나타남)만을 검출한다. 따라서, 14분은 매우 짧은 검출 기간이며, 미생물의 성장을 보다 정확하게 반영할 수 있는 높은 시간 분해능 검출 과정을 제공한다.
내보낸 데이터에 따라, 각 시점에서 15개의 액적의 평균 OD600 값과 표준편차(SD)를 계산하고, 대장균 MG1655의 성장 곡선을 플롯팅하였다(도 5B). 결과는 성장 곡선이 지연 단계, 로그 상 및 고정상을 포함한 "S"모양을 나타내며 이는 고전적인 미생물 성장 모델과 매우 일치합니다. 동시에 15 방울의 표준 편차는 매우 작아서 양호한 성장 일관성과 병렬성을 나타냅니다. 따라서, MMC의 우수한 미생물 배양 및 검출 성능을 충분히 입증한다. 또한, 배양 중에 액적 사이에 누화가 거의 없는 것도 확인되었다(보충 그림 2 및 보충 표 1).
적응 진화의 결과
우리는 MMC에서 MeSV2.2의 장기적인 적응 진화를 수행했습니다. 18일째 날에, 소프트웨어 인터페이스에 표시된 성장 곡선으로부터 각 서브 재배 기간 동안 액적의 최대OD600 값의 증가 추세에 따라, 우리는 50개의 액적에서 양호한 적응 진화가 달성되었다고 믿었다. OD600 데이터를 내보내고 비교적 양호한 성장 성능을 가진 8 방울 (액적 6 포함)을13 추출했습니다. 도 6A는 전체 적응 진화 과정에서 50 방울의 성장 곡선을 도시한다. 18 일 만에 MMC는 자동으로 13 개의 하위 재배 작업을 수행했습니다. 도 6A 로부터 MeSV2.2가 천천히 먼저 그리고 그 후에 빠르게 성장한다는 것을 알 수 있으며, 이는 MeSV2.2에서의 적응 진화의 궤도를 나타낸다. 선택 압력을 공급하기 위해, 메탄올을 MeSV2.2 배지에 첨가하였다. 초기에, 메탄올은 세포 성장을 억제하였다. 적응 진화 후에, 메탄올에 적응된 농축된 세포는 더 높은 성장 속도를 가졌다. 전체 적응 진화 과정에서 액적 6의 성장 곡선을 개별적으로 플롯팅하였다(도 6B). 첫 번째 세대와 마지막 하위 재배 기간의 최대OD600 값은 각각 0.37과 0.58이었으며 56.8 % 증가했습니다. 이는 액적(6)의 변형이 명백한 적응 진화를 실현했음을 나타낸다.
이어서, 진탕 플라스크에서 액적 6 균주 및 초기 균주를 배양하고, 이들의 성장 곡선을 비교하였다 (도 6C). 문헌17,18에 제시된 방법에 따라, 액적 6 균주 및 초기 균주의 최대 비 생장률 (μmax)을 계산하였고, 이는 각각 0.096 h-1 및 0.072 h-1이었다. 도 6C는 액적 6 균주가 진탕 플라스크에서 재배되었을 때 초기 균주보다 더 높은 최대 비 생장률 (54.8 %만큼 증가)과 정지기에서 더 높은 세포 농도 (20.0 % 증가)를 나타냈다는 것을 보여 주며, 이는 MeSV2.2에서의 적응 진화가 실현되었음을 추가로 시사한다.
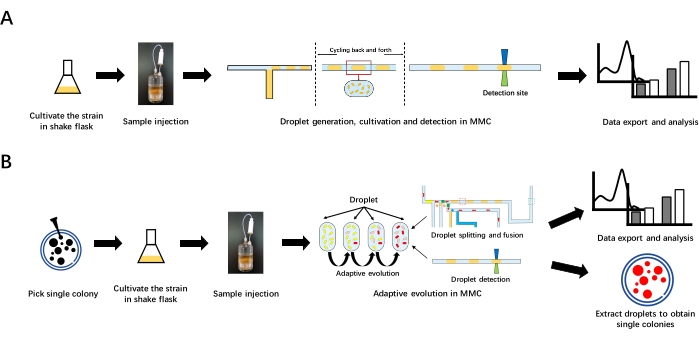
그림 1: MMC의 성장 곡선 측정 및 적응 진화의 전반적인 워크플로우. (a) MMC에서의 성장 곡선 측정. 먼저, 균주를 진탕 플라스크에서 배양하여 초기 박테리아 용액을 제조한다. 그런 다음 초기 박테리아 용액을 시약 병에 주입하십시오. 그런 다음 MMC에서 물방울을 생성합니다. MMC는 미세 유체 칩과 튜브에서 물방울을 앞뒤로 순환시켜 배양합니다. 액적이 감지 사이트를 통과하면 OD 데이터가 감지되고 기록됩니다. 마지막으로 분석을 위해 데이터를 내보냅니다. (B) MMC에서의 적응 진화. 아가로스 플레이트에서 단일 콜로니를 골라 진탕 플라스크에서 배양하여 초기 박테리아 용액을 준비하십시오. 초기 박테리아 용액을 시약 병에 주입 한 후 MMC에서 적응 진화를 수행하십시오. 적응 진화는 물방울 분할과 융합을 통해 자동으로 작동 할 수있는 지속적인 하위 재배를 포함합니다. 적응형 진화 후 분석을 위해 데이터를 내보냅니다. 표적 액적은 추출된 후 플레이트 상에 확산되어 단일 콜로니를 얻을 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : MMC의 구조 및 필수 도구. (A) MMC의 외부 및 작동 챔버. (b) MMC의 미세유체 칩. 칩에는 7 개의 채널 (C1-C6 및 CF)이 있습니다. (C) 시약 병. 그것은 상단 튜브와 측면 튜브가 있습니다. 샘플을 시약 병에 주입하기 전에 먼저 주사기 바늘을 퀵 커넥터 A에 연결 한 다음 퀵 커넥터 A를 측면 튜브에 연결해야합니다. (d) 미세유체 칩의 설치. 미세 유체 칩은 받침대에 설치됩니다. 그런 다음 일곱 채널 (C1-C6 및 CF)이 MMC (O1-O6 및 OF)의 해당 포트에 각각 연결됩니다.
1 - MMC의 작동 챔버.
2 - MMC 오일을 함유하는 오일 병.
3 - 폐액을 수집하기위한 폐기물 병.
4 - 살균을위한 UV 램프 (파장 254 nm). 이 램프는 칩과 튜브를 살균하기 위해 미리 켤 수 있습니다.
5 - 액적 인식을 위한 레이저(620nm) 레이저가 칩에 조사되는 지점은 액적 인식 부위입니다.
6 - 작동 챔버 내부의 온도를 측정하는 온도 프로브.
7 - 작동 챔버 용 히터. 미생물 재배의 온도를 유지하는 데 사용할 수 있습니다. 설정할 수 있는 온도 범위는 25± 0.5°C ~ 40± 0.5°C입니다.
8 - 액적의 OD 또는 형광을 측정하는 광섬유 프로브.
9 - 마이크로유체 칩을 설치하는 칩 받침대.
10 - 시약 병을 고정시키고 가열하여 시약의 온도를 미생물 재배 온도로 빠르게 올리는 금속 욕조.
11 - 미세유체 칩용 포트(O1-O6 및 OF). 미세유동 칩은 이러한 포트를 통해 MMC에 연결된다.
12 - 액적 저장 및 재배를위한 튜브.
13 - 설치 중에 미세 유체 칩을 신속하게 찾을 수있는 자석 블록.
14 - 시약 병에 샘플을 주입하는 주사기 바늘. 내경은 0.41mm이고 외경은 0.71mm입니다.
15 - 퀵 커넥터 A. 퀵 커넥터 B와 연결합니다.
16 - 빠른 커넥터 B. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
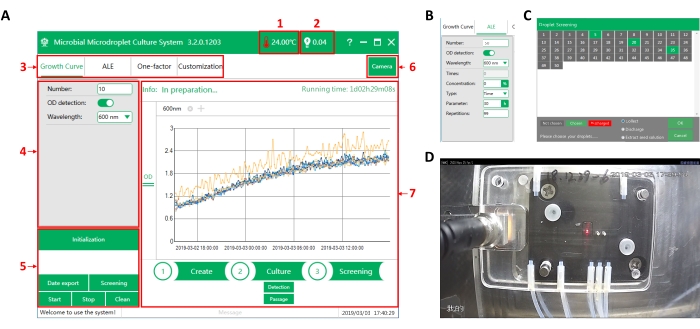
그림 3: MMC의 작동 소프트웨어 인터페이스. (A) 소프트웨어의 기본 인터페이스. (1) 작동 챔버 내의 온도. (2) 액적 인식의 광전 신호 값. 액적이 지나갈 때 신호 값은 하이(>2V)입니다. 오일이 통과하면 신호 값은 로우(<1V)입니다. (3) 기능 선택. 성장 곡선 측정(성장 곡선), 적응형 실험실 진화(ALE), 단일 요인 다단계 분석(단일 요인) 및 실험 요구에 따른 작업 사용자 지정(사용자 지정) 등 네 가지 기능 중에서 선택할 수 있습니다. (4) 매개 변수 설정 인터페이스. 하나의 함수를 선택한 후 여기에 해당하는 실험 매개 변수를 설정하십시오. (5) 명령 실행 영역. (6) 카메라의 전환. 카메라는 칩 바로 위에 설치되며, 칩의 물방울을 온라인으로 관찰하는 데 사용할 수 있습니다. (7) 프로세스 표시 영역. 실행 시간, 모니터링 데이터 및 실행 중인 작업을 표시합니다. (B) 적응 진화의 파라미터 설정 인터페이스. (c) 액적 스크리닝 인터페이스. MMC는 자동으로 액적에 번호를 매길 수 있습니다. 여기서 표적 액적들은 MMC로부터 선택되고 추출될 수 있다. (D) 카메라 관찰 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 시료 주입, 액적 생성 및 액적 추출. (a) 박테리아 용액과 MMC 오일을 주입한 후 시약 병. 박테리아 용액과 MMC 오일은 모두 측면 튜브로부터 주입된다. 오일 상은 상층에 있고 박테리아 용액은 하층에 있습니다. 주입 후 퀵 커넥터 A와 B를 연결한 다음 MMC에 설치합니다. (b) 미세유체 칩에서의 액적 생성. 액적의 가시성을 향상시키기 위해, 적색 안료 용액을 사용하여 액적 생성 과정을 입증하였다. (c) 현미경으로 관찰한 튜브에 저장된 액적. 스케일 바: 400 μm. (D) 팝업 창 프롬프트 및 해당 작업. "CF 퀵 커넥터를 꺼내 EP 튜브에 넣으십시오"라는 메시지가 나타나면 CF 커넥터를 꺼내 EP 튜브에 넣어 대상 물방울을 수집하십시오. "커넥터를 다시 삽입하십시오"라는 메시지가 나타나면 액적 수집이 완료되면 CF 커넥터를 OF 포트에 다시 삽입하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 성장 곡선의 데이터 내보내기 및 그림 플로팅. (A) 내보낸 데이터의 일부에 대한 스크린샷. 내보낸 데이터에는 생성된 15개의 액적의 각 감지 시점과 해당 OD600 값이 포함됩니다. (b) 수출된 데이터에 기초하여 플롯팅된 대장균 MG1655의 성장 곡선. 각 시점에서 15 액적의 평균OD600 값과 표준 편차 (SD)를 계산하고 성장 곡선을 플로팅하십시오. 이 성장 곡선에는 지연 단계, 로그 단계 및 고정 단계가 포함되어 있음이 분명합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
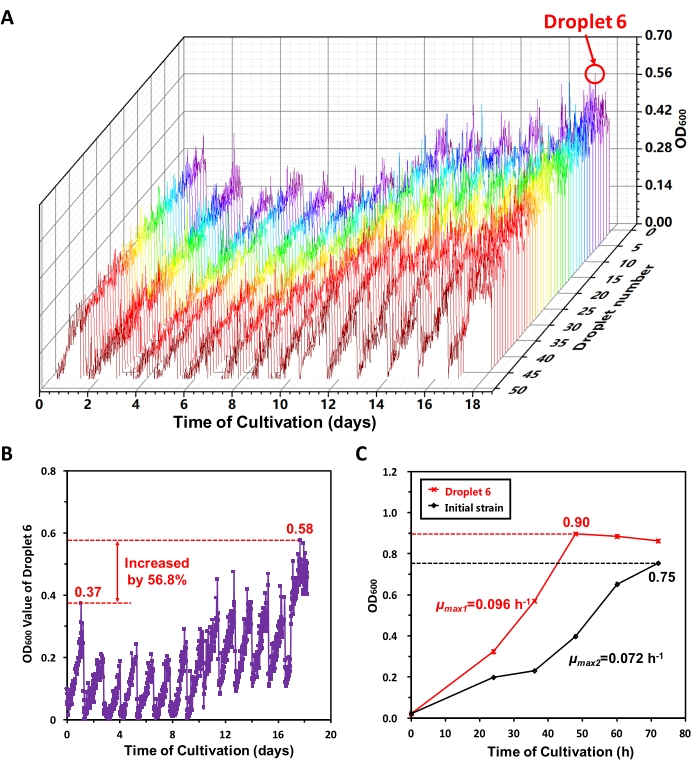
도 6: MMC에서 MeSV 2.2의 적응 진화의 결과. (A) 전체 적응 진화 과정에서 50 방울의 성장 곡선. 18일 적응 진화 과정 동안 50개의 액적의OD600 검출 데이터를 MMC로부터 내보내고 플롯팅하였다. 18일째에, 액적 6개를 포함한 8개의 물방울이 추출되었다. (b) 전체 적응 진화 과정에서 액적(6)의 성장 곡선. 첫 번째 세대와 마지막 하위 재배 기간의 최대OD600 값은 각각 0.37과 0.58이었으며 56.8 % 증가했습니다. (c) 액적 6 균주와 진탕 플라스크 내의 초기 균주의 비교. 균주 액적 6 및 초기 균주를 진탕 플라스크에서 배양하고, 성장 곡선(SD, n=3 포함)을 측정하였다. 이 수치는 Jian X. J. et al.13에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 구성 요소 | 농도 |
| Na2HPO4·12H2O | 6.78 g / L |
| KH2PO4 | 3 g / L |
| 나클 | 0.5 g / L |
| NH4Cl | 1 g / L |
| 비타민 B1 (여과에 의해 살균) | 0.34 g / L |
| MgSO4·7H2O | 0.049 g / L |
| CaCl2·2H2O | 1.5 밀리그램/L |
| 미량원소: | |
| FeCl3·6H2O | 0.5 밀리그램/L |
| ZnSO4·7H2O | 0.09 밀리그램/L |
| CuSO4·5H2O | 0.088 밀리그램/L |
| MnCl2 | 0.045 밀리그램/L |
| CoCl2·6H2O | 0.09 밀리그램/L |
| 글루콘산 | 1.09 g / L |
| 메탄올 | 500 밀리몰/L |
| 이소프로필-β-d-티오갈락토피라노사이드 | 0.1 밀리몰 / L |
| 스트렙토마이신 설페이트 | 20 μg/mL |
| 카나마이신 설페이트 | 50 μg/mL |
| 여분의 15 g / L 아가로스를 첨가하여 고체 배지를 준비하십시오. | |
표 1: MeSV2.2에 대한 특수 배지의 성분.
| 조정 가능한 매개변수 | |
| 매개 변수 | 레인지 |
| 재배 온도 | 25–40 °C ± 0.5 °C |
| 물방울의 수 | 0–200 |
| 접종의 농도 | 13.3–86.7 % |
| 화학 인자의 농도 | 8 가지 농도, 저장된 화학 인자의 최대 농도까지 |
| 하위 재배의 시간 | 최대 사용자 |
| 하위 재배의 수 | 최대 사용자 |
| OD 검출의 파장 | 350-800 nm |
| 형광 검출의 파장 | 여기: 470, 528 nm 방출: 350-800 nm |
| 정확도 파라미터 | |
| 매개 변수 | 증권 시세 표시기 |
| 물방울의 양 | 1.88% |
| 접종의 농도 | <5.0% |
표 2 : MMC의 조정 가능한 매개 변수 및 정확도 매개 변수. 조정 가능한 매개 변수는 사용자의 특정 요구 사항에 따라 조정할 수있는 매개 변수를 나타냅니다. 정확도 파라미터는 다양한 유체 작업의 정확성과 재현성을 반영하는 파라미터를 나타냅니다.
보충 그림 1: MMC에서 물방울의 인식 및 감지. (A) MMC에서 액적의 파형. 이 파형은 MMC 분광계의 원시 스펙트럼 데이터에서 비롯됩니다. 원시 스펙트럼 데이터를 백그라운드에서 처리한 후, MMC는 측정된 OD 값을 제공할 것이다. (b) MMC에서 액적의 OD 계산. 액적의 파형에서 'a'는 액적의 최대 길이를 나타내고, 'c'는 유상과 수상에 의해 형성된 아크 모양의 계면을 나타내고, 'b'는 액적의 주요 부분을 나타냅니다. 램버트-맥주 법칙에 기초하여, 액적의 OD 값은 다음 공식을 사용하여 계산된다: OD 값 = lg(E/D) × 10. 'E'는 오일상의 평균 스펙트럼 신호 값을 지칭하고; 'D'는 액적의 주요 부분 b의 평균 스펙트럼 신호 값을 나타냅니다. MMC에 의해 측정된 OD 값은 분광광도계에 의해 측정된 것과 다르다는 점에 유의해야 한다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2 : 물방울 사이의 누화 테스트. 장기간 배양 동안 액적 사이에 누화가 있는지 여부를 확인하기 위해, 대장균 MG1655 용액을 매우 낮은 농도로 희석한 다음(푸아송 분포에 따라, λ=0.1), 200개의 액적을 생성하고 5일 동안 배양하였다. OD를 측정한 후, 대장균 MG1655가 적은 수의 액적에서 자라는 것을 알 수 있었다. 그리고이 물방울 주위의 물방울에는 박테리아가 거의 성장하지 않았습니다. 결과는 또한 물방울 사이에 누화가 거의 없다는 것을 미리 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: MMC에서 액적 생성의 안정성. 보충 그림 1에서 볼 수 있듯이 액적에는 고정 파형이 있습니다. MMC의 분광계는 초당 특정 수의 데이터 포인트를 생성하므로 액적 파형의 데이터 포인트 수는 액적의 크기를 반영 할 수 있습니다. 적색 염료 용액을 사용하여 MMC에서 397 액적을 생성하고, OD 값을 측정하였다. 원시 스펙트럼 데이터를 내보내고, 각 액적 파형의 데이터 포인트를 계산하고, 액적 데이터 포인트의 변동 계수(C.V)를 계산했습니다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: MMC에서의 액적 증발. 여기에 적색 염료 용액을 사용하여 MMC에서 액적을 생성하고 액적을 배양 튜브에 저장하였다. 이어서, 튜브를 37°C 항온 인큐베이터에 30일 동안 두고, 액적 길이를 규칙적으로 측정하였다(현미경으로 사진을 찍고 스케일 바로 길이를 측정). 이는 액적의 부피가 30일 후에 약 12.3% 감소하였음을 보여주며, 이는 액적의 증발이 MMC에서 매우 작다는 것을 나타낸다. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 미생물 마이크로액적 배양 시스템(MMC)을 사용하여 자동화된 미생물 배양 및 장기 적응 진화를 수행하는 방법을 제시합니다. MMC는 소형화, 자동화 및 고처리량 미생물 배양 시스템입니다. 기존의 미생물 고처리량 배양 방법 및 장비와 비교하여 MMC는 낮은 노동력 및 시약 소비, 간단한 조작, 온라인 검출 (OD 및 형광), 고분해능 데이터 수집 및 우수한 병렬화와 같은 많은 장점을 가지고 있습니다. MMC는 또한 일반적으로 pL 및 nL 액적을 사용하는 기존의 액적 미세 유체 기술과 다른 몇 가지 특별한 장점을 가지고 있습니다. pL 및 nL 물방울을 사용한 이전에 보고된 대부분의 시스템은 재배 성능이 좋지 않으며 검출 가능한 파라미터가 거의 없습니다(일반적으로 형광만 해당)18,19,20,21. 더 나은 재배 성능과 다중 매개 변수 감지를 달성 할 수있는 플랫폼이 있었지만 어렵고 많은 노력이 필요합니다. 예를 들어, 일부 연구자들은 pL 방울의 OD 검출을보고했습니다. 이는 이미지 인식을 기반으로 하며, 이는 가양성뿐만 아니라 정확도(22)에 대한 추가 검증을 필요로 한다. 그러나, MMC는 비교적 간단한 방식으로 이들을 달성할 수 있다. MMC는 거의 보고되지 않는 마이크로리터(μL) 물방울을 사용합니다. MMC의 우수한 미생물 배양 성능이 검증되었으며, OD 및 형광을 직접 검출할 수도 있다. μL 액적의 부피가 크기 때문에, 액적 생성은 간섭에 덜 민감하며, 이는 더 높은 안정성을 갖는다. 한편, 마이크로 리터 액적에서보다 다양한 작업을 수행 할 수있어 자동화 된 작업의 실현에 도움이됩니다. 더욱이, 액적들은 인클로저 공간이기 때문에, 내용물의 휘발성이 억제될 수 있고(보충 표 2), 휘발성 물질이 배지(14)에 존재할 때 장기간 미생물 배양 및 적응 진화를 수행하는 데 도움이 된다. 이것은 쉐이크 플라스크와 마이크로 플레이트에서 달성하기가 어렵습니다.
그러나 프로토콜의 특정 중요한 점은 강조 할 가치가 있습니다. 첫째, MMC에 의해 측정된 OD 값은 OD 측정의 그들의 광 경로 길이가 다르기 때문에 분광 광도계의 OD 값과 다르다는 점에 유의해야 한다(각각 1mm 및 10 mm). 따라서, MMC의 OD 값을 진탕 플라스크의 OD 값과 비교할 때, 보정 곡선(13)을 측정할 필요가 있다. 다행스럽게도 적응 진화 과정은 성장 곡선 간의 상대적 추세에 초점을 맞추기 때문에 보정 곡선이 필요하지 않습니다. 다음으로, 특정 미생물은 MMC에서 재배되지 않습니다. 액적들은 안정성(23)을 유지하기 위해 오일-물 계면의 표면 장력에 의존한다. 미생물이 계면활성제(24)를 생산하는 일부 바실러스 서브틸리스 균주와 같이 오일-물 계면의 표면 장력을 방해하는 특정 물질을 생성하면, 액적은 안정성을 유지할 수 없다. 더욱이, 배지 자체가 액적의 생성에 장애물이라면, MMC, 예를 들어, 매우 점성이 높은 배지 또는 큰 입자를 함유하는 매질에서 사용되는 것은 실행 가능하지 않다. 현재 MMC에서 성공적으로 재배 한 종에는 대장균, 락토바실러스 질경이, 코리네박테리움 글루타미쿰, 효모, 메틸 오박테리움 extorquens, Aspergillus oryzae, 미세조류 등이 포함됩니다. 예비 실험을 위해 MMC에서 균주를 배양하는 것이 좋습니다. 마지막으로, 칩, 시약 병 및 MMC 사이의 커넥터와 포트는 프로토콜에 따라 엄격하게 연결되어야합니다. 그렇지 않으면, 박테리아 용액이 MMC로 유입되어 내부를 오염시킬 수 있다. 또한, MMC의 현재 처리량은 하위 재배 작업에 걸리는 시간 때문에 제한된다는 점을 지적해야합니다 (0-200). 앞으로는 제어 소프트웨어와 칩 크기를 최적화하여 시간을 단축하고 처리량을 향상시킬 것입니다. MMC는 모듈형 시스템이기 때문에 새로운 장비의 요구 없이 관련 부품이나 소프트웨어만 교체하면 됩니다.
현재 MMC는 성장 곡선 측정, 적응형 실험실 진화 및 단일 요인 다단계 분석을 수행 할 수있을뿐만 아니라 실험 요구를 충족시키기 위해 다양한 액적 작동 절차를 사용자 정의하는 데 사용할 수 있습니다. 앞으로는 다단계 다단계 직교 실험 수행, 다중 박테리아 종의 성장 곡선을 동시에 측정하는 다중 샘플 자동 샘플링 기술, 더 많은 매개 변수 (예 : 용존 산소 (DO) 및 pH)를 정확하게 검출하고 제어하는 것과 같은 미생물 연구의 다양한 요구에 부응하여 MMC 시스템의 적용 기능을 더욱 풍부하게 할 필요가 있습니다. 동시에 배지 조성 최적화, 최소 억제 농도 (MIC) 결정, 미생물25 공동 배양 등과 같은보다 실용적인 시나리오에 MMC를 적용하기 위해 미생물학 분야에서 더 많은 기능을 개발할 필요가 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 중국의 국가 핵심 연구 개발 프로그램 (2018YFA0901500), 중국 국립 자연 과학 재단 (21627812)의 국가 핵심 과학 기기 및 장비 프로젝트 및 칭화 대학 이니셔티브 과학 연구 프로그램 (20161080108)의 지원을 받았다. 또한 메탄올 필수 대장균 균주 버전 2.2(MeSV2.2)의 제공을 위해 Julia A. Vorholt 교수(미생물학 연구소, 생물학과, 취리히 취리히, 취리히 8093, 스위스)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm PVDF filter membrane | Merck Millipore Ltd. | SLGPR33RB | Sterilize the MMC oil |
| 4 °C refrigerator | Haier | BCD-289BSW | For reagent storage |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| CaCl2·2H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20011160 | Component of the special medium for MeSV2.2. |
| Clean bench | Beijing Donglian Har Instrument Manufacture Co., Ltd. | DL-CJ-INDII | For aseptic operation and UV sterilization |
| CoCl2·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10007216 | Component of the special medium for MeSV2.2. |
| Computer | Lenovo | E450 | Software installation and MMC control |
| Constant temperature incubator | Shanghai qixin scientific instrument co., LTD | LRH 250 | For the microbial cultivation using solid medium |
| CuSO4·5H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10008218 | Component of the special medium for MeSV2.2. |
| Electronic balance | OHAUS | AR 3130 | For reagent weighing |
| EP tube | Thermo Fisher | 1.5 mL | For droplet collection |
| FeCl3·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10011928 | Component of the special medium for MeSV2.2. |
| Freezing Tube | Thermo Fisher | 2.0 mL | For strain preservation |
| Gluconate | Sigma-Aldrich | S2054 | Component of the special medium for MeSV2.2. |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| High-Pressure Steam Sterilization Pot | SANYO Electric | MLS3020 | For autoclaved sterilization |
| isopropyl-β-d-thiogalactopyranoside (IPTG) | Biotopped | 420322 | Component of the special medium for MeSV2.2. |
| Kanamycin sulfate | Solarbio | K8020 | Component of the special medium for MeSV2.2. |
| KH2PO4 | MACKLIN | P815661 | Component of the special medium for MeSV2.2. |
| Methanol | MACKLIN | M813895 | Component of the special medium for MeSV2.2. |
| MgSO4·7H2O | BIOBYING | 1305715 | Component of the special medium for MeSV2.2. |
| Microbial Microdroplet Culture System (MMC) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-I | Performing growth curve determination and adaptive evolution. Please refer to http://www.tmaxtree.com/en/index.php?v=news&id=110 |
| Microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-ALE-OD | For various droplet operations. Please refer to http://www.tmaxtree.com/en/ |
| MMC oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-M/S-OD | The oil phase for droplet microfluidics. Please refer to http://www.tmaxtree.com/en/ |
| MnCl2 | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20026118 | Component of the special medium for MeSV2.2. |
| NaCl | GENERAL-REAGENT | G81793J | Component of the LB medium |
| Na2HPO4·12H2O | GENERAL-REAGENT | G10267B | Component of the special medium for MeSV2.2. |
| NH4Cl | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10001518 | Component of the special medium for MeSV2.2. |
| Petri dish | Corning Incorporated | 90 mm | For the preparation of solid medium |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Quick connector A | Luoyang TMAXTREE Biotechnology Co., Ltd. | — | For the connection of each joint. Please refer to http://www.tmaxtree.com/en/ |
| Reagent bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-PCB | Sampling and storage of bacteria solution and reagents. Please refer to http://www.tmaxtree.com/en/ |
| Shake flask | Union-Biotech | 50 mL | For microbial cultivation |
| Shaking incubator | Shanghai Sukun Industrial Co., Ltd. | SKY-210 2B | For the microbial cultivation in shake flask |
| Streptomycin sulfate | Solarbio | S8290 | Component of the special medium for MeSV2.2. |
| Syringe | JIANGSU ZHIYU MEDICAL INSTRUCTMENT CO., LTD | 10 mL | Draw liquid and inject it into the reagent bottle |
| Syringe needle | OUBEL Hardware Store | 22G | Inner diameter is 0.41 mm and outer diameter is 0.71 mm. |
| Tryptone | Oxoid Ltd. | LP0042 | Component of the LB medium |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
| UV–Vis spectrophotometer | General Electric Company | Ultrospec 3100 pro | For the measurement of OD values |
| Vitamin B1 | Solarbio | SV8080 | Component of the special medium for MeSV2.2. |
| Yeast extract | Oxoid Ltd. | LP0021 | Component of the LB medium |
| ZnSO4·7H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10024018 | Component of the special medium for MeSV2.2. |
참고문헌
- Lewis, W. H., et al. Innovations to culturing the uncultured microbial majority. Nature Reviews Microbiology. 19 (4), 225-240 (2020).
- Feist, A. M., Herrgard, M. J., Thiele, I., Reed, J. L., Palsson, B. O. Reconstruction of biochemical networks in microorganisms. Nature Reviews Microbiology. 7 (2), 129-143 (2009).
- Zeng, W. Z., Guo, L. K., Xu, S., Chen, J., Zhou, J. W. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Kim, J., Shin, H., et al. Microbiota analysis for the optimization of Campylobacter isolation from chicken carcasses using selective media. Frontiers in Microbiology. 10, 1381 (2019).
- Doig, S. D., Pickering, S. C. R., Lye, G. J., Woodley, J. M. The use of microscale processing technologies for quantification of biocatalytic Baeyer-Villiger oxidation kinetics. Biotechnology and Bioengineering. 80 (1), 42-49 (2002).
- Harms, P., et al. Design and performance of a 24-station high throughput microbioreactor. Biotechnology and Bioengineering. 93 (1), 6-13 (2006).
- Chen, A., Chitta, R., Chang, D., Anianullah, A. Twenty-four well plate miniature bioreactor system as a scale-down model for cell culture process development. Biotechnology and Bioengineering. 102 (1), 148-160 (2009).
- Huber, R., et al. Robo-Lector - a novel platform for automated high-throughput cultivations in microtiter plates with high information content. Microbial Cell Factories. 8, 788-791 (2009).
- Hasegawa, T., et al. High-throughput method for a kinetics analysis of the high-pressure inactivation of microorganisms using microplates. Journal of Bioscience and Bioengineering. 113 (6), 788-791 (2012).
- Teh, S. Y., Lin, R., Hung, L. H., Lee, A. P. Droplet microfluidics. Lab on a Chip. 8 (2), 198-220 (2008).
- Kaminski, T. S., Scheler, O., Garstecki, P. Droplet microfluidics for microbiology: techniques, applications and challenges. Lab on a Chip. 16 (12), 2168-2187 (2016).
- Liao, P. Y., Huang, Y. Y. Divide and conquer: analytical chemistry of nucleic acids in droplets. Scientia Sinica Chimica. 50 (10), 1439-1448 (2020).
- Jian, X. J., et al. Microbial microdroplet culture system (MMC): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnology and Bioengineering. 117 (6), 1724-1737 (2020).
- Wang, J., Jian, X. J., Xing, X. H., Zhang, C., Fei, Q. Empowering a methanol-dependent Escherichia coli via adaptive evolution using a high-throughput microbial microdroplet culture system. Frontiers in Bioengineering and Biotechnology. 8, 570 (2020).
- Meyer, F., et al. Methanol-essential growth of Escherichia coli. Nature Communications. 9, 1508 (2018).
- Grünberger, A., et al. Beyond growth rate 0.6: Corynebacterium glutamicum cultivated in highly diluted environments. Biotechnology and Bioengineering. 110 (1), 220-228 (2013).
- Kaganovitch, E., et al. Microbial single-cell analysis in picoliter-sized batch cultivation chambers. New Biotechnology. 47, 50-59 (2018).
- Baraban, L., et al. Millifluidic droplet analyser for microbiology. Lab on a Chip. 11 (23), 4057-4062 (2011).
- Jakiela, S., Kaminski, T. S., Cybulski, O., Weibel, D. B., Garstecki, P. Bacterial growth and adaptation in microdroplet chemostats. Angewandte Chemie International Edition. 52 (34), 8908-8911 (2013).
- Cedillo-Alcantar, D. F., Han, Y. D., Choi, J., Garcia-Cordero, J. L., Revzin, A. Automated droplet-based microfluidic platform for multiplexed analysis of biochemical markers in small volumes. Analytical Chemistry. 91 (8), 5133-5141 (2019).
- Watterson, W. J., et al. Droplet-based high-throughput cultivation for accurate screening of antibiotic resistant gut microbes. eLife. 9, 56998 (2020).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Nitschke, M., Pastore, G. M. Production and properties of a surfactant obtained from Bacillus subtilis grown on cassava wastewater. Bioresource Technology. 97 (2), 336-341 (2006).
- Jiang, Y. J., et al. Recent advances of biofuels and biochemicals production from sustainable resources using co-cultivation systems. Biotechnology for Biofuels. 12, 155 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유