Method Article
Coltivazione microbica automatizzata ed evoluzione adattiva utilizzando il sistema di coltura microbica di microgoccioline (MMC)
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive come utilizzare il sistema di coltura microbica di microgoccioline (MMC) per condurre la coltivazione microbica automatizzata e l'evoluzione adattativa. MMC può coltivare e sub-coltivare microrganismi automaticamente e continuamente e monitorare online la loro crescita con una produttività relativamente elevata e una buona parallelizzazione, riducendo il consumo di manodopera e reagenti.
Abstract
I metodi di coltivazione microbica convenzionali di solito hanno operazioni ingombranti, bassa produttività, bassa efficienza e grande consumo di manodopera e reagenti. Inoltre, i metodi di coltivazione ad alto rendimento basati su micropiastre sviluppati negli ultimi anni hanno uno scarso stato di crescita microbica e sperimentano la parallelizzazione a causa del loro basso livello di ossigeno disciolto, della scarsa miscela e della grave evaporazione e dell'effetto termico. A causa dei numerosi vantaggi delle micro-goccioline, come il piccolo volume, l'elevata produttività e la forte controllabilità, la tecnologia microfluidica a base di goccioline può superare questi problemi, che è stata utilizzata in molti tipi di ricerca di coltivazione, screening ed evoluzione microbica ad alto rendimento. Tuttavia, la maggior parte degli studi precedenti rimane nella fase di costruzione e applicazione del laboratorio. Alcune questioni chiave, come gli elevati requisiti operativi, l'elevata difficoltà di costruzione e la mancanza di tecnologia di integrazione automatizzata, limitano l'ampia applicazione della tecnologia microfluidica a goccioline nella ricerca microbica. Qui, un sistema automatizzato di coltura microbica a microgoccioline (MMC) è stato sviluppato con successo basato sulla tecnologia microfluidica delle goccioline, ottenendo l'integrazione di funzioni come l'inoculazione, la coltivazione, il monitoraggio online, la sottocoltivazione, lo smistamento e il campionamento richiesti dal processo di coltivazione microbica delle goccioline. In questo protocollo, l'Escherichia coli (E. coli) MG1655 wild-type e un ceppo di E. coli essenziale per il metanolo (MeSV2.2) sono stati presi come esempi per introdurre come utilizzare l'MMC per condurre in dettaglio la coltivazione microbica automatizzata e relativamente ad alto rendimento e l'evoluzione adattativa. Questo metodo è facile da usare, consuma meno manodopera e reagenti e ha un'elevata produttività sperimentale e una buona parallelità dei dati, che presenta grandi vantaggi rispetto ai metodi di coltivazione convenzionali. Fornisce una piattaforma sperimentale a basso costo, favorevole alle operazioni e affidabile in termini di risultati per i ricercatori scientifici per condurre ricerche microbiche correlate.
Introduzione
La coltivazione microbica è una base importante per la ricerca scientifica microbiologica e le applicazioni industriali, che è ampiamente utilizzata nell'isolamento, identificazione, ricostruzione, screening ed evoluzione dei microrganismi 1,2,3. I metodi di coltivazione microbica convenzionali utilizzano principalmente provette, fiaschi di scuotimento e piastre solide come contenitori di coltivazione, combinati con incubatori vibranti, spettrofotometri, lettori di micropiastre e altre attrezzature per la coltivazione, il rilevamento e lo screening microbico. Tuttavia, questi metodi hanno molti problemi, come operazioni ingombranti, bassa produttività, bassa efficienza e grande consumo di manodopera e reagenti. I metodi di coltivazione ad alto rendimento sviluppati negli ultimi anni si basano principalmente sulla micropiastra. Ma la micropiastra ha un basso livello di ossigeno disciolto, scarsa proprietà di miscelazione e grave evaporazione ed effetto termico, che spesso portano a uno scarso stato di crescita e alla parallelizzazione sperimentale di microrganismi 4,5,6,7; d'altra parte, deve essere dotato di attrezzature costose, come stazioni di lavoro per la gestione dei liquidi e lettori di micropiastre, per ottenere la coltivazione automatizzata e il rilevamento dei processi 8,9.
Come importante branca della tecnologia microfluidica, la microfluidica a goccioline è stata sviluppata negli ultimi anni sulla base di sistemi microfluidici tradizionali a flusso continuo. Si tratta di una tecnologia microfluidica a flusso discreto che utilizza due fasi liquide immiscibili (solitamente olio-acqua) per generare micro-goccioline disperse e operare su di esse10. Poiché le micro-goccioline hanno le caratteristiche di un piccolo volume, un'ampia superficie specifica, un'elevata velocità di trasferimento di massa interna e nessuna contaminazione incrociata causata dalla compartimentazione, e i vantaggi di una forte controllabilità e di un'elevata produttività delle goccioline, ci sono stati molti tipi di ricerca che applicano la tecnologia microfluidica delle goccioline nella coltivazione, nello screening e nell'evoluzione dei microrganismi ad alto rendimento11 . Tuttavia, ci sono ancora una serie di questioni chiave per rendere la tecnologia microfluidica a goccioline popolare e ampiamente applicata. In primo luogo, il funzionamento della microfluidica delle goccioline è ingombrante e complesso, con conseguenti elevati requisiti tecnici per gli operatori. In secondo luogo, la tecnologia microfluidica a goccioline combina componenti ottici, meccanici ed elettrici e deve essere associata a scenari applicativi biotecnologici. È difficile per un singolo laboratorio o team costruire sistemi di controllo microfluidici a goccia efficienti se non esiste una collaborazione multidisciplinare. In terzo luogo, a causa del piccolo volume di micro-goccioline (dal picoliter (pL) al microlitro (μL)), ci vuole molta difficoltà per realizzare il controllo automatizzato preciso e il rilevamento online in tempo reale delle goccioline per alcune operazioni microbiche di base come la sottocoltura, la cernita e il campionamento, ed è anche difficile costruire un sistema di apparecchiature integrato12.
Al fine di affrontare i problemi di cui sopra, è stato sviluppato con successo un sistema automatico di coltura microbica di microgoccioline (MMC) basato sulla tecnologia microfluidica delle goccioline13. L'MMC è costituito da quattro moduli funzionali: un modulo di riconoscimento delle goccioline, un modulo di rilevamento dello spettro delle goccioline, un modulo chip microfluidico e un modulo di campionamento. Attraverso l'integrazione e il controllo del sistema di tutti i moduli, viene stabilito con precisione il sistema operativo automatizzato che include la generazione, la coltivazione, la misurazione (densità ottica (OD) e fluorescenza), la scissione, la fusione, lo smistamento delle goccioline, ottenendo l'integrazione di funzioni come l'inoculazione, la coltivazione, il monitoraggio, la sottocoltura, lo smistamento e il campionamento richiesti dal processo di coltivazione microbica delle goccioline. MMC può contenere fino a 200 unità di coltivazione di goccioline replicate di 2-3 μL di volume, che equivale a 200 unità di coltivazione del pallone shake. Il sistema di coltivazione a micro-goccioline può soddisfare i requisiti di non contaminazione, ossigeno disciolto, miscelazione e scambio massa-energia durante la crescita di microrganismi e soddisfare le varie esigenze della ricerca microbica attraverso molteplici funzioni integrate, ad esempio la misurazione della curva di crescita, l'evoluzione adattativa, l'analisi multilivello a fattore singolo e la ricerca e l'analisi dei metaboliti (basata sul rilevamento della fluorescenza)13,14.
Qui, il protocollo introduce in dettaglio come utilizzare l'MMC per condurre la coltivazione automatizzata e microbica e l'evoluzione adattiva (Figura 1). Abbiamo preso eseguito come esempio Escherichia coli (E. coli) MG1655 per dimostrare la misurazione della curva di crescita e un ceppo di E. coli meSV2.215 essenziale per il metanolo per dimostrare l'evoluzione adattativa in MMC. È stato sviluppato un software operativo per MMC, che rende l'operazione molto semplice e chiara. Nell'intero processo, l'utente deve preparare la soluzione batterica iniziale, impostare le condizioni dell'MMC e quindi iniettare la soluzione batterica e i relativi reagenti nell'MMC. Successivamente, l'MMC eseguirà automaticamente operazioni come la generazione di goccioline, il riconoscimento e la numerazione, la coltivazione e l'evoluzione adattiva. Eseguirà inoltre il rilevamento online (OD e fluorescenza) delle goccioline con alta risoluzione temporale e visualizzerà i relativi dati (che possono essere esportati) nel software. L'operatore può interrompere il processo di coltivazione in qualsiasi momento in base ai risultati ed estrarre le goccioline target per gli esperimenti successivi. L'MMC è facile da usare, consuma meno manodopera e reagenti e ha un throughput sperimentale relativamente elevato e una buona parallelità dei dati, che presenta vantaggi significativi rispetto ai metodi di coltivazione convenzionali. Fornisce una piattaforma sperimentale a basso costo, favorevole alle operazioni e robusta per i ricercatori per condurre ricerche microbiche correlate.
Protocollo
1. Installazione di strumenti e software
- Scegli un ambiente pulito e sterile (come un banco pulito) come spazio permanente dedicato per MMC. Installare MMC in modo costante nello spazio.
NOTA: tenere l'MMC lontano dall'interferenza di forti campi elettrici, campi magnetici e forti sorgenti di radiazioni termiche. Evitare che forti vibrazioni influenzino i componenti di rilevamento ottico. Fornire l'alimentazione di AC220 V, 50 HZ all'MMC. Per informazioni dettagliate su MMC, fare riferimento alla Tabella dei materiali e al sito Web di MMC16. - Installare il software operativo dal file MMC.zip
NOTA: contattare gli autori per il file MMC.zip.- Crea una cartella dedicata e salva il file zip al suo interno.
- Creare un'altra cartella dedicata come "Directory di installazione". Decomprimere mmc.zip e salvare i file nella nuova cartella.
NOTA: la configurazione del computer è la migliore per soddisfare: (1) Sistema operativo Windows 7 a 64 bit o superiore; (2) CPU: i5 o superiore; (3) memoria: 4 GB o superiore; (4) disco rigido: 300 GB o superiore (velocità di rotazione superiore a 7200 rpm o disco a stato solido).
2. Preparativi
- Collegare l'ago della siringa (diametro interno è 0,41 mm e il diametro esterno è 0,71 mm), il connettore rapido A e il flacone del reagente (Figura 2C) e autoclave a 121 °C per 15 minuti.
NOTA: svitare leggermente il tappo del flacone del reagente durante la sterilizzazione. Alcuni altri flaconi di reagente possono essere preparati ogni volta per l'uso. - Utilizzare un filtro al fluoruro di polivinilidene (PVDF) da 0,22 μm per filtrare l'olio MMC. Mettere il chip microfluidico (Figura 2B) e l'olio MMC nel banco pulito in anticipo e sterilizzarli mediante irradiazione ultravioletta per 30 minuti prima dell'uso.
NOTA: Per i dettagli del connettore rapido A, del flacone del reagente, dell'olio MMC e del chip microfluidico fare riferimento alla Tabella dei materiali. - Installare il chip microfluidico
- Aprire la porta della camera operativa (Figura 2A) e sollevare la sonda in fibra ottica.
- Allineare i fori del campo elettrico con gli aghi del campo elettrico e posizionare delicatamente il chip sul piedistallo del chip. Quindi inserire le due colonne di posizionamento nei fori di posizionamento e posizionare la sonda in fibra ottica (Figura 2D).
- Collegare il connettore rapido A sul chip alla porta corrispondente della MMC in base al numero di posizione (C5-O5, C4-O4, C6-O6, C2-O2, CF-OF, C1-O1, C3-O3). Quindi chiudere la porta della camera operativa.
- Ricostituire l'olio MMC (fino a circa 80 ml) nella bottiglia dell'olio e svuotare il liquido di scarto nella bottiglia di scarico prima dell'uso.
NOTA: Il liquido di scarto è solitamente un rifiuto organico. Si prega di fare riferimento alla legge e ai regolamenti regionali al momento dello smaltimento, soggetti a modifiche in base all'impostazione sperimentale.
3. Misurazione della curva di crescita in MMC
- Preparazione per la soluzione batterica iniziale
- Seguire le relative normative standard per preparare il mezzo Luria-Bertani (LB) e l'autoclave a 121°C per 15 min.
NOTA: Componenti del mezzo LB: NaCl (10 g / L), estratto di lievito (5 g / L) e triptone (10 g / L). - Estrarre il ceppo E. coli MG1655 dal brodo di glicerolo e coltivarlo in un matraccio da 50 ml con 10 mL di LB medium in un incubatore vibrante (200 giri/ min) a 37 °C per 5-8 ore.
NOTA: Il tempo di coltivazione dipende dai ceppi specifici. È ottimale coltivare il ceppo fino al periodo/fase logaritmica. - Diluire la soluzione di E. coli MG1655 in coltura con mezzo fresco a un OD600 di 0,05-0,1 per ottenere una soluzione batterica iniziale (preparare circa 10 ml).
- Seguire le relative normative standard per preparare il mezzo Luria-Bertani (LB) e l'autoclave a 121°C per 15 min.
- Fare clic su Inizializzazione per inizializzare MMC. Dopo aver visualizzato l'interfaccia di inizializzazione, impostare la temperatura di coltivazione su 37 °C e il valore del segnale fotoelettrico su 0,6 (Figura 3A). L'inizializzazione richiederà circa 20 minuti.
- Accendere la lampada UV (lunghezza d'onda 254 nm) durante l'inizializzazione.
- Iniettare la soluzione batterica iniziale e l'olio MMC nel flacone del reagente.
- Estrarre un flacone di reagente sterilizzato sul banco pulito e stringere il tappo.
- Utilizzare una siringa sterile da 10 mL per iniettare 3-5 mL di olio MMC dall'ago della siringa del tubo laterale. Inclinare e ruotare lentamente il flacone del reagente per far sì che l'olio si infiltri completamente nella parete interna.
- Iniettare circa 5 ml di soluzione batterica iniziale, quindi riempire il flacone del reagente iniettando nuovamente 5-7 ml di olio.
- Estrarre il connettore rapido indipendente A e inserire il connettore rapido A del flacone del reagente nel connettore rapido B per completare l'operazione di iniezione del campione (Figura 4A).
- Attendere la fine dell'inizializzazione e quindi spegnere la lampada UV (lunghezza d'onda 254 nm).
- Aprire la porta della camera operativa e mettere il flacone del reagente nel bagno metallico.
- Estrarre il connettore C2 del chip e il connettore rapido A del flacone del reagente. Collegare il connettore del tubo laterale del flacone del reagente al connettore C2 e il connettore del tubo superiore al connettore O2. Quindi chiudere la porta della camera operativa.
- Fare clic su Curva di crescita per scegliere la funzione di misurazione della curva di crescita (Figura 3A). Nell'interfaccia di impostazione dei parametri, immettere il numero come 15, attivare l'interruttore di rilevamento OD e impostare la lunghezza d'onda su 600 nm. Fare clic su Start per avviare la generazione di droplet. Ci vorranno circa 10 minuti.
NOTA: Qui, Numero si riferisce al numero di goccioline da generare. La lunghezza d'onda si riferisce alla lunghezza d'onda dell'OD da rilevare. Impostare il numero (massimo 200) e la lunghezza d'onda (350-800 nm) in base ai requisiti dell'esperimento. - Quando viene visualizzata una finestra pop-up sull'interfaccia principale che richiede "Rimuovere il flacone del reagente tra C2 e O2, quindi fare clic sul pulsante OK dopo il completamento", aprire la porta della camera operativa per estrarre il flacone del reagente e collegare i connettori C2 e O2.
- Chiudi la porta e fai clic sul pulsante OK nella finestra pop-up per coltivare automaticamente le goccioline e rilevare i valori OD.
NOTA: MMC rileva il valore OD quando la goccia passa la sonda in fibra ottica. Pertanto, il periodo di rilevamento dipende dal numero di goccioline generate. - Quando la curva di crescita raggiunge la fase stazionaria, fare clic sul pulsante Esportazione dati per esportare i dati OD. Selezionare il percorso di salvataggio dei dati ed esportare il valore OD registrato durante il periodo di coltivazione nel formato .csv, che può essere aperto da un software appropriato (ad esempio, Microsoft Excel). Quindi utilizzare un software di mappatura (ad esempio, EXCEL e Origin 9.0) per tracciare la curva di crescita.
NOTA: Durante il processo di coltivazione, è possibile fare clic su Esportazione dati in qualsiasi momento per esportare i dati OD di tutte le goccioline correnti.
4. Evoluzione adattiva in MMC
- Preparazione per la soluzione batterica iniziale
- Seguire le relative normative standard per preparare le piastre liquide speciali medie e solide per il MeSV2.2 e l'autoclave a 121 °C per 15 min.
NOTA: Per i componenti del supporto speciale fare riferimento alla Tabella 1 e alla Tabella dei Materiali. - Coltivare il MeSV2.2 utilizzando la piastra solida (diametro = 90 mm) in un incubatore a temperatura costante a 37 °C per 72 ore. Quindi raccogliere una colonia indipendente e coltivarla in un matraccio da 50 mL con 10 mL dello speciale mezzo liquido in un incubatore vibrante (200 giri/ min) a 37 °C per 72 ore.
- Diluire la soluzione di MeSV2.2 coltivata con il mezzo a un OD600 di 0,1-0,2 (assicurarsi che il volume totale non sia inferiore a 10 ml) e continuare a coltivarla nel matraccio per 5 ore per ottenere la soluzione batterica iniziale.
NOTA: Il MeSV2.2 è un ceppo di E. coli essenziale per il metanolo. Lo speciale mezzo liquido contiene 500 mmol / L di metanolo, che è un forte stress per MeSV2.2, con conseguente crescita molto lenta. Si noti che ottenere la soluzione iniziale di batteri qui è diverso da quello descritto nel passaggio 3.1.
- Seguire le relative normative standard per preparare le piastre liquide speciali medie e solide per il MeSV2.2 e l'autoclave a 121 °C per 15 min.
- Inizializzare MMC come illustrato nei passaggi 3.2, 3.3 e 3.5.
- Estrarre due flaconi di reagente sterilizzati, uno dei quali è per la soluzione batterica iniziale e l'altro è per il mezzo fresco. Iniettare la soluzione batterica iniziale (5 mL), il mezzo fresco (12-15 ml) e l'olio MMC nei flaconi del reagente come spiegato al punto 3.4.
NOTA: poiché l'evoluzione adattiva è un processo a lungo termine che coinvolge più sottocolture, conservare il maggior numero possibile di mezzi freschi in MMC. Il mezzo non può essere reintegrato durante l'esecuzione dell'esperimento. - Installare i due flaconi di reagente in MMC come spiegato nel passaggio 3.6. Installare quello per la soluzione batterica iniziale tra il connettore C2 e O2 e l'altro per il mezzo fresco tra il connettore C4 e O4.
- Cliccare su ALE per scegliere la funzione di evoluzione adattiva (Figura 3B). Nell'interfaccia di impostazione dei parametri, attivare l'opzione OD Detection .
- Impostare Il numero come 50, Lunghezza d'onda come 600 nm, Concentrazione come 0%, Digita come Tempo, Parametro come 30 ore e Ripetizioni come 99. Fare clic su Start per avviare la generazione di droplet. Ci vorranno circa 25 minuti.
NOTA: Qui, "Concentrazione" si riferisce alla concentrazione massima di fattori chimici per l'evoluzione adattativa. Per diverse goccioline, è realizzabile in MMC introdurre diverse concentrazioni di fattori chimici per fornire diverse condizioni di crescita. Calcolare le concentrazioni introdotte utilizzando la seguente equazione:
Qui "C" si riferisce alla concentrazione di fattori chimici introdotti nelle goccioline; "a" si riferisce alla concentrazione di fattori chimici nei flaconi di reagente tra il connettore C4 e O4; "b" si riferisce alla concentrazione di fattori chimici nei flaconi di reagente tra il connettore C6 e O6; e "i" si riferisce alla concentrazione disponibile. Ci sono otto concentrazioni disponibili in MMC. Poiché il fattore chimico qui ha una singola concentrazione (500 mmol / L metanolo) ed è uno degli ingredienti del mezzo, qui è installato un solo flacone di reagente contenente il fattore chimico e la concentrazione è impostata su 0%. Il tipo si riferisce alla modalità di sub-coltivazione, che è divisa in tre tipi: modalità tempo, modalità valore OD e modalità fluorescenza. Il primo significa coltivare le goccioline per un tempo fisso e poi sub-coltivare, mentre gli ultimi due significa coltivare le goccioline a valore OD predefinito / intensità di fluorescenza e quindi sub-coltivare. Il parametro si riferisce al parametro correlato richiesto quando si sceglie una modalità di sottocoltivazione. Le ripetizioni si riferiscono al numero di sotto-coltivazioni. - Rimuovere il flacone del reagente posto tra il connettore C2 e O2 come spiegato nel passaggio 3.8.
- Osservare se i valori massimi di OD delle goccioline durante ogni periodo di sottocoltura sono aumentati in modo significativo. Se l'aumento si verifica e soddisfa i requisiti dell'esperimento, fare clic sul pulsante Esportazione dati per esportare i dati OD come spiegato nel passaggio 3.9.
NOTA: Qui, il periodo di sotto-coltivazione dipende dal parametro. Ad esempio, quando si imposta Tipo come Tempo e Parametro come 30 h, il periodo di sottocoltivazione è 30 h. Durante ogni periodo di sotto-coltivazione, ci sono i valori massimi di OD delle goccioline. Stimare se l'evoluzione adattativa soddisfa i requisiti dell'esperimento aumentando i valori massimi di OD (L'aumento dipende dall'effettivo processo di coltivazione del ceppo, ad esempio, aumentato di oltre il 20%).
ATTENZIONE: Prestare attenzione se il mezzo fresco immagazzinato è esaurito. Se l'aumento significativo non si è verificato anche dopo che il mezzo è esaurito, estrarre le goccioline che crescono meglio ed effettuare un nuovo ciclo di evoluzione adattiva. - Estrarre le goccioline di destinazione da MMC.
- Fare clic sul pulsante Screening per scegliere la funzione di estrazione delle goccioline (Figura 3C). Scegliere l'opzione Raccogli , fare clic sul numero di droplet di destinazione, quindi fare clic su OK.
NOTA: lo screening delle goccioline include "Raccogli", "Scarta" e "Estrai soluzione di semi". Per "soluzione di semi estratti" si intende la raccolta delle goccioline rimanenti13 dopo l'operazione di sottocoltura. - Attendi che la finestra pop-up richieda "Estrai il connettore rapido CF e inseriscilo nel tubo EP". Inserire il connettore rapido CF nel tubo microcentrifuga per la raccolta in base al prompt del software, quindi fare clic su OK (Figura 4D).
- Dopo 1-2 minuti, l'interfaccia del software aprirà una nuova finestra che chiede: "Inserire nuovamente il connettore e fare clic su OK se terminato". Quindi, inserire nuovamente il connettore rapido CF e fare clic su OK per continuare l'esecuzione di MMC (Figura 4D). Quando il droplet di destinazione successivo raggiunge il sito di riconoscimento delle goccioline, ripetere 4.9.2-4.9.3 per raccoglierlo.
NOTA: dopo aver raccolto tutte le goccioline di destinazione, MMC continuerà a coltivare le goccioline rimanenti. Se la coltivazione non è necessaria, clicca su Stop per terminare direttamente l'operazione. - Estrarre la goccia utilizzando una pipetta da 2,5 μL, farla cadere sulla piastra di agarosio da 90 mm e distribuirla uniformemente con un'asta di spandimento triangolare in vetro con una lunghezza laterale di 3 cm. Quindi coltivarlo in un incubatore a temperatura costante a 37 °C per 72 ore.
- Raccogliere 3-5 colonie indipendenti e coltivarle separatamente nei palloni da 50 mL con 10 mL di terreno fresco in un incubatore vibrante (200 giri/min) a 37 °C per 48-72 h. Seguire le relative normative standard per conservare la soluzione di batteri in coltura nel tubo di glicerolo per esperimenti successivi.
- Fare clic sul pulsante Screening per scegliere la funzione di estrazione delle goccioline (Figura 3C). Scegliere l'opzione Raccogli , fare clic sul numero di droplet di destinazione, quindi fare clic su OK.
5. Pulizia della MMC
- Dopo aver completato l'esperimento, fare clic su Stop per interrompere tutte le operazioni. Quindi fare clic su Pulisci per pulire il chip e i tubi. Ci vorranno circa 15 minuti.
Risultati
Questo protocollo utilizza E. coli MG1655 e un ceppo MeSV2.2 come esempi per dimostrare la coltivazione microbica e l'evoluzione adattativa essenziale del metanolo con una strategia automatizzata e relativamente elevata in MMC. La misurazione della curva di crescita è stata utilizzata principalmente per caratterizzare la coltivazione microbica. L'evoluzione adattativa è stata condotta mediante sottocoltura continua automatizzata e aggiungendo un'alta concentrazione di metanolo come pressione selettiva durante ogni sottocoltivazione. Se l'evoluzione adattativa fosse stata realizzata è stato stimato attraverso l'andamento della variazione del valore massimo di OD delle goccioline durante ogni periodo di sotto-coltivazione. I parametri sintonizzabili e i parametri di precisione di MMC sono mostrati nella Tabella 2.
Risultati della misurazione della curva di crescita
I valori OD600 delle 15 goccioline rilevate durante il processo di coltivazione sono stati esportati dalla MMC dopo aver coltivato per circa 20 ore (Figura 5A). Si può osservare che il rilevamento è stato condotto approssimativamente ogni 14 minuti. Questo periodo di rilevamento dipende dal numero di goccioline generate perché le goccioline vengono pedalate avanti e indietro nei tubi per la coltivazione e il modulo di rilevamento rileva solo i valori OD (il rilevamento e il calcolo del valore OD sono mostrati nella Figura supplementare 1) quando le goccioline passano la sonda in fibra ottica. Pertanto, i 14 minuti sono un periodo di rilevamento molto breve, che fornisce un processo di rilevamento ad alta risoluzione temporale per riflettere la crescita dei microrganismi in modo più accurato.
Secondo i dati esportati, sono stati calcolati i valori medi di OD600 e la deviazione standard (SD) di 15 goccioline in ogni punto temporale e la curva di crescita di E. coli MG1655 è stata tracciata (Figura 5B). I risultati mostrano che la curva di crescita presenta una forma a "S", che include la fase di ritardo, la fase logaritmica e la fase stazionaria, che è molto coerente con il classico modello di crescita microbica. Allo stesso tempo, le deviazioni standard di 15 goccioline sono molto piccole, indicando una buona coerenza e parallelità di crescita. Pertanto, dimostra pienamente le buone prestazioni di coltivazione e rilevamento microbico di MMC. Inoltre, è stato anche verificato che c'è poca diafonia tra le goccioline durante la coltivazione (Figura supplementare 2 e Tabella supplementare 1).
Risultati dell'evoluzione adattiva
Abbiamo eseguito un'evoluzione adattiva a lungo termine di MeSV2.2 in MMC. Il 18° giorno, secondo l'andamento crescente dei valori massimi di OD600 delle goccioline durante ogni periodo di sotto-coltivazione dalle curve di crescita visualizzate sull'interfaccia software, abbiamo creduto che una buona evoluzione adattiva fosse stata raggiunta nelle 50 goccioline. I dati OD600 sono stati esportati e sono state estratte 8 goccioline (tra cui la goccia 6) con prestazioni di crescita relativamente buone13. La Figura 6A mostra le curve di crescita di 50 goccioline nell'intero processo di evoluzione adattiva. In 18 giorni, MMC ha effettuato automaticamente 13 operazioni di sottocoltura. Si può vedere dalla Figura 6A che MeSV2.2 cresce lentamente prima e velocemente dopo, il che indica la traccia dell'evoluzione adattiva in MeSV2.2. Per fornire una pressione di selezione, il metanolo è stato aggiunto al mezzo MeSV2.2. Inizialmente, il metanolo ha inibito la crescita cellulare. Dopo l'evoluzione adattativa, le cellule arricchite adattate al metanolo hanno avuto un tasso di crescita più elevato. La curva di crescita della goccia 6 nell'intero processo di evoluzione adattativa è stata tracciata separatamente (Figura 6B). I valori massimi di OD600 nella prima generazione e nell'ultimo periodo di sottocoltura sono stati rispettivamente di 0,37 e 0,58, aumentati del 56,8%. Indica che la deformazione in goccia 6 ha realizzato un'ovvia evoluzione adattativa.
Successivamente, sono stati coltivati il ceppo droplet 6 e il ceppo iniziale nei palloni shake e sono state confrontate le loro curve di crescita (Figura 6C). Secondo i metodi indicati in letteratura17,18, sono stati calcolati i tassi di crescita specifici massimi (μmax) del ceppo droplet 6 e il ceppo iniziale, che erano rispettivamente 0,096 h-1 e 0,072 h-1. La figura 6C rivela che il ceppo droplet 6 ha mostrato un tasso di crescita specifico massimo più elevato (aumentando del 54,8%) e ha avuto una concentrazione cellulare più elevata nella fase stazionaria (aumentando del 20,0%) rispetto al ceppo iniziale quando coltivato in palloni shake, il che ha ulteriormente suggerito che l'evoluzione adattativa in MeSV2.2 è stata realizzata.
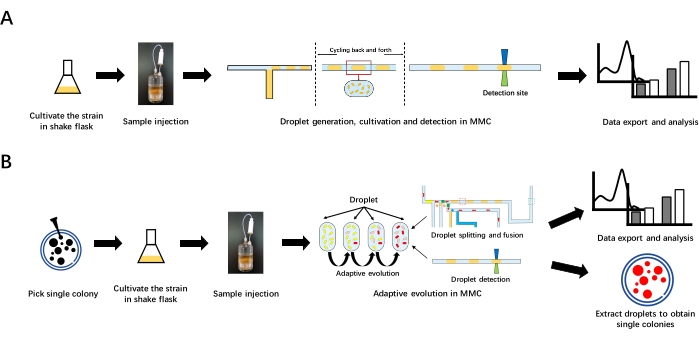
Figura 1: Flusso di lavoro complessivo della misurazione della curva di crescita ed evoluzione adattiva in MMC. (A) Misurazione della curva di crescita in MMC. In primo luogo, coltivare il ceppo in un pallone agitato per preparare la soluzione batterica iniziale. Quindi, iniettare la soluzione batterica iniziale nel flacone del reagente. Generare quindi le goccioline in MMC. MMC fa scorrere le goccioline avanti e indietro nel chip e nei tubi microfluidici per coltivarle. Quando le goccioline passano il sito di rilevamento, i dati OD verranno rilevati e registrati. Infine, esporta i dati per l'analisi. (B) Evoluzione adattiva in MMC. Raccogliere una singola colonia dal piatto di agarosio e coltivarla in un matraccio per preparare la soluzione batterica iniziale. Dopo aver iniettato la soluzione batterica iniziale nel flacone del reagente, condurre l'evoluzione adattativa in MMC. L'evoluzione adattiva comporta una sotto-coltivazione continua, che può essere azionata automaticamente attraverso la scissione e la fusione delle goccioline. Dopo l'evoluzione adattiva, esportare i dati per l'analisi. Le goccioline bersaglio possono essere estratte e poi distribuite sul piatto per ottenere singole colonie. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Struttura e strumenti essenziali di MMC. (A) Camera esterna e operativa di MMC. (B) Il chip microfluidico di MMC. Il chip ha sette canali (C1-C6 e CF). (C) Flacone di reagente. Ha un tubo orizzontale e un tubo laterale. Prima di iniettare il campione nel flacone del reagente, è necessario collegare prima un ago della siringa a un connettore rapido A e quindi collegare il connettore rapido A al tubo laterale. (D) Installazione del chip microfluidico. Il chip microfluidico è installato sul piedistallo. Quindi i sette canali (C1-C6 e CF) sono rispettivamente collegati alle porte corrispondenti di MMC (O1-O6 e OF).
1 - Camera operativa di MMC.
2 - Bottiglia di olio contenente l'olio MMC.
3 - Bottiglia per la raccolta dei rifiuti liquidi.
4 - Lampada UV (lunghezza d'onda 254 nm) per sterilizzazione. Questa lampada può essere accesa in anticipo per sterilizzare il chip e i tubi.
5 - Laser (620 nm) per il riconoscimento delle goccioline. Il punto in cui il laser viene irradiato sul chip è il sito di riconoscimento delle gocce.
6 - Sonda di temperatura per misurare la temperatura all'interno della camera operativa.
7 - Riscaldatore per la camera operatoria. Può essere utilizzato per mantenere la temperatura della coltivazione microbica. L'intervallo di temperatura che può essere impostato è compreso tra 25 ± 0,5 °C e 40 ± 0,5 °C.
8 - Sonda in fibra ottica per misurare l'OD o la fluorescenza delle goccioline.
9 - Piedistallo a chip per installare il chip microfluidico.
10 - Bagno metallico per fissare le bottiglie di reagente e riscaldarle per aumentare rapidamente la temperatura di un reagente alla temperatura della coltivazione microbica.
11 - Porte per il chip microfluidico (O1-O6 e OF). Il chip microfluidico è collegato alla MMC attraverso queste porte.
12 - Tubi per lo stoccaggio e la coltivazione delle goccioline.
13 - Blocchi magnetici per localizzare rapidamente il chip microfluidico durante l'installazione.
14 - Ago per siringa per iniettare i campioni nei flaconi del reagente. Il suo diametro interno è di 0,41 mm e il suo diametro esterno è di 0,71 mm.
15 - Connettore rapido A. Collegamento con connettore rapido B.
16 - Connettore rapido B. Fare clic qui per visualizzare una versione più grande di questa figura.
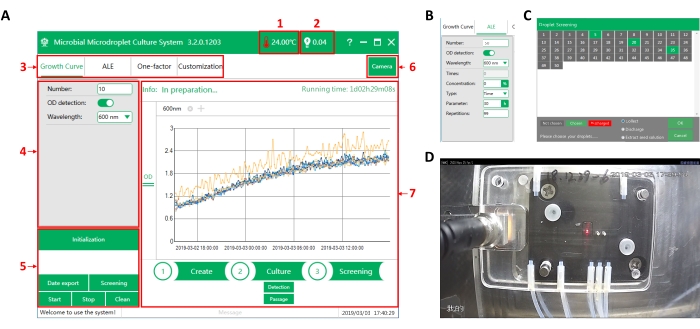
Figura 3: Interfaccia software operativadi MMC. (A) L'interfaccia principale del software. (1) Temperatura nella camera operatoria. (2) Valore del segnale fotoelettrico del riconoscimento delle goccioline. Quando la goccia passa, il valore del segnale è alto (>2 V). Quando l'olio passa, il valore del segnale è basso (<1 V). (3) Selezione della funzione. Quattro sono le funzioni tra cui scegliere: misurazione della curva di crescita (Growth Curve), adaptive laboratory evolution (ALE), analisi multilivello a fattore singolo (One-factor) e personalizzazione delle operazioni in base alle esigenze sperimentali (Customization). (4) Interfaccia di impostazione dei parametri. Impostare qui i parametri sperimentali corrispondenti dopo aver scelto una funzione. (5) Area di esecuzione dei comandi. (6) Interruttore della fotocamera. La telecamera è installata direttamente sopra il chip, che può essere utilizzato per osservare online le goccioline nel chip. (7) Area di visualizzazione del processo. Mostra il tempo di esecuzione, i dati di monitoraggio e l'operazione in esecuzione. (B) L'interfaccia di impostazione dei parametri dell'evoluzione adattiva. (C) L'interfaccia di screening delle goccioline. MMC può numerare automaticamente le goccioline. Qui le goccioline di destinazione possono essere selezionate ed estratte da MMC. (D) Interfaccia di osservazione della telecamera. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Iniezione del campione, generazione di goccioline ed estrazione di goccioline. (A) Il flacone del reagente dopo l'iniezione della soluzione batterica e dell'olio MMC. Sia la soluzione batterica che l'olio MMC vengono iniettati dal tubo laterale. La fase oleosa è nello strato superiore e la soluzione batterica è nello strato inferiore. Dopo l'iniezione, collegare il connettore rapido A e B, quindi installarlo in MMC. (B) Generazione di goccioline nel chip microfluidico. Per migliorare la visibilità delle goccioline, è stata utilizzata una soluzione di pigmento rosso per dimostrare il processo di generazione delle goccioline. (C) Goccioline immagazzinate nel tubo osservato al microscopio. Barra della scala: 400 μm. (D) Prompt della finestra pop-up e le operazioni corrispondenti. Quando viene visualizzato il messaggio "Estrarre il connettore rapido CF e inserirlo nel tubo EP", estrarre il connettore CF e inserirlo nel tubo EP per raccogliere la goccia target; quando viene visualizzato il messaggio "Inserire il connettore indietro", la raccolta delle goccioline è completa, inserire nuovamente il connettore CF nella porta OF. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Esportazione dei dati e grafici della curva di crescita. (A) Screenshot di parte dei dati esportati. I dati esportati includono ogni punto temporale di rilevamento delle 15 goccioline generate e i corrispondenti valori OD600. (B) Curva di crescita di E. coli MG1655 tracciata sulla base dei dati esportati. Calcola i valori medi di OD600 e la deviazione standard (SD) di 15 goccioline in ogni punto temporale e traccia la curva di crescita. È chiaro che questa curva di crescita include la fase di ritardo, la fase logaritmica e la fase stazionaria. Fare clic qui per visualizzare una versione più grande di questa figura.
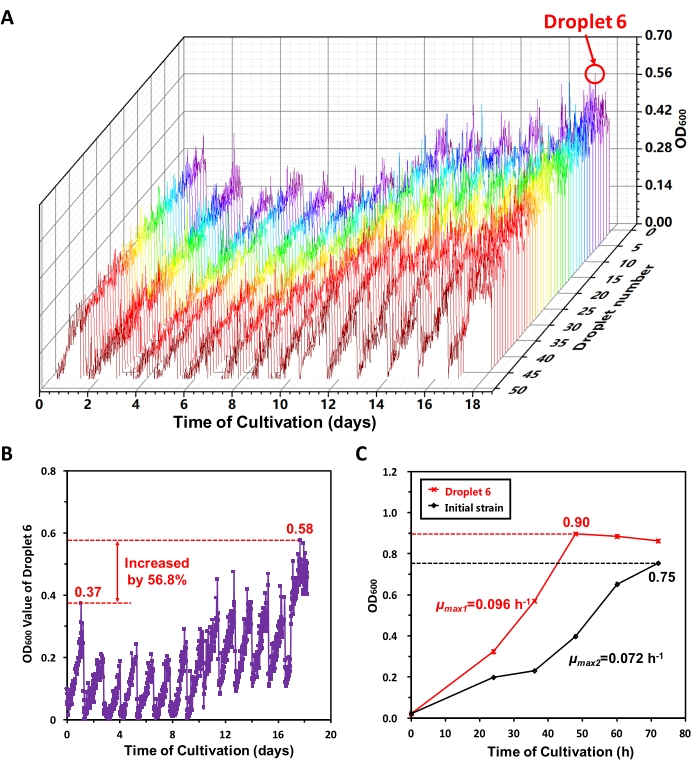
Figura 6: Risultati dell'evoluzione adattiva di MeSV2.2 in MMC. (A) Curve di crescita di 50 goccioline nell'intero processo di evoluzione adattativa. I dati di rilevamento OD600 di 50 goccioline durante il processo di evoluzione adattiva di 18 giorni sono stati esportati dalla MMC e tracciati. Il 18 ° giorno, sono state estratte 8 goccioline, tra cui goccioline 6. (B) Curva di crescita della goccia 6 nell'intero processo di evoluzione adattativa. I valori massimi di OD600 nella prima generazione e nell'ultimo periodo di sottocoltura sono stati rispettivamente di 0,37 e 0,58, aumentati del 56,8%. C) Confronto tra il ceppo di goccioline 6 e il ceppo iniziale nel matraccio di shake. Il ceppo di goccioline 6 e il ceppo iniziale sono stati coltivati in palloni shake e sono state misurate le curve di crescita (tra cui SD, n = 3). Questa figura è stata modificata da Jian X. J. et al.13. Fare clic qui per visualizzare una versione più grande di questa figura.
| Componenti | Concentrazione |
| Na2HPO4·12H2O | 6,78 g/L |
| KH2PO4 | 3 g/L |
| NaCl | 0,5 g/L |
| NH4Cl | 1 g/L |
| vitamina B1 (sterilizzata per filtrazione) | 0,34 g/L |
| MgSO4·7H2O | 0,049 g/L |
| CaCl2·2H2O | 1,5 mg/L |
| Microelementi: | |
| FeCl3·6H2O | 0,5 mg/L |
| ZnSO4·7H2O | 0,09 mg/L |
| CuSO4·5H2O | 0,088 mg/L |
| MnCl2 · | 0,045 mg/L |
| CoCl2·6H2O | 0,09 mg/L |
| gluconato | 1,09 g/L |
| metanolo | 500 mmol/L |
| isopropil-β-d-tiogalattopiranoside | 0,1 mmol/L |
| streptomicina solfato | 20 μg/mL |
| kanamicina solfato | 50 μg/mL |
| Aggiungere 15 g/L extra di agarosio per preparare il mezzo solido. | |
Tabella 1: Componenti del supporto speciale per MeSV2.2.
| Parametri sintonizzabili | |
| Parametro | Gamma |
| Temperatura di coltivazione | 25–40 °C ± 0,5 °C |
| Numero di goccioline | 0–200 |
| Concentrazione di inoculo | 13.3–86.7 % |
| Concentrazione del fattore chimico | 8 diverse concentrazioni, fino alla concentrazione massima di fattore chimico immagazzinato |
| Il tempo della sub-coltivazione | Fino all'utente |
| Il numero di sottocoltivazioni | Fino all'utente |
| Lunghezza d'onda del rilevamento OD | 350–800 nm |
| Lunghezza d'onda del rilevamento della fluorescenza | Eccitazione: 470, 528 nm Emissione: 350–800 nm |
| Parametri di precisione | |
| Parametro | C.V. |
| Volume delle goccioline | 1.88% |
| Concentrazione di inoculo | <5,0% |
Tabella 2: Parametri sintonizzabili e parametri di precisione di MMC. I parametri sintonizzabili si riferiscono ai parametri che possono essere regolati in base alle specifiche esigenze degli utenti; i parametri di accuratezza si riferiscono ai parametri che riflettono l'accuratezza e la riproducibilità delle diverse operazioni fluidiche.
Figura 1 supplementare: Riconoscimento e rilevamento di goccioline in MMC. (A) La forma d'onda di una goccia in MMC. Questa forma d'onda proviene dai dati spettrali grezzi dello spettrometro MMC. Dopo aver elaborato i dati spettrali non elaborati in background, MMC fornirà il valore OD misurato. (B) Calcolo OD delle goccioline in MMC. Nella forma d'onda della goccia, 'a' rappresenta la lunghezza massima della goccia, 'c' rappresenta l'interfaccia a forma di arco formata dalla fase dell'olio e dalla fase dell'acqua, e 'b' rappresenta la parte principale della goccia. Sulla base della legge di Lambert-Beer, il valore OD della goccia viene calcolato utilizzando la seguente formula: valore OD = lg(E/D) × 10. 'E' si riferisce al valore medio del segnale spettrale della fase oleosa; 'D' si riferisce al valore medio del segnale spettrale della parte principale b della goccia. Va notato che il valore OD misurato da MMC è diverso da quello misurato da uno spettrofotometro. Fare clic qui per scaricare questo file.
Figura supplementare 2: Test di diafonia tra le goccioline. Per verificare se c'è diafonia tra le goccioline durante la coltivazione a lungo termine, la soluzione di E. coli MG1655 è stata diluita a una concentrazione molto bassa (secondo la distribuzione di Poisson, λ = 0,1), e quindi sono state generate e coltivate 200 goccioline per 5 giorni. Dopo aver misurato l'OD, si è scoperto che l'E. coli MG1655 cresceva in un piccolo numero di goccioline. E non c'era quasi nessuna crescita batterica nelle goccioline intorno a queste goccioline. Il risultato mostra anche preliminarmente che c'è poca diafonia tra le goccioline. Fare clic qui per scaricare questo file.
Tabella supplementare 1: Stabilità della generazione di goccioline in MMC. Come mostrato nella Figura supplementare 1, la goccia ha una forma d'onda fissa. Lo spettrometro di MMC genera un certo numero di punti dati al secondo, quindi il numero di punti dati della forma d'onda della goccia può riflettere la dimensione della goccia. La soluzione di colorante rosso è stata utilizzata per generare 397 goccioline nella MMC ed è stato misurato il valore OD. I dati spettrali grezzi sono stati esportati, i punti dati di ciascuna forma d'onda di goccioline sono stati contati ed è stato calcolato il coefficiente di variazione (C.V) dei punti dati delle goccioline. Fare clic qui per scaricare questa tabella.
Tabella supplementare 2: Evaporazione delle goccioline in MMC. Qui la soluzione di colorante rosso è stata utilizzata per generare goccioline nel MMC e le goccioline sono state immagazzinate nel tubo di coltivazione. Il tubo è stato quindi posto in un incubatore a temperatura costante a 37 °C per 30 giorni e la lunghezza della goccia è stata regolarmente misurata (scattare foto al microscopio e misurare la lunghezza con una barra di scala). Mostra che il volume della goccia è stato ridotto di circa il 12,3% dopo 30 giorni, il che indica che l'evaporazione della goccia è molto piccola in MMC. Fare clic qui per scaricare questa tabella.
Discussione
Questo protocollo presenta come utilizzare il sistema di coltura microbica di microgoccioline (MMC) per eseguire la coltivazione microbica automatizzata e l'evoluzione adattiva a lungo termine. MMC è un sistema di coltivazione microbica miniaturizzato, automatizzato e ad alto rendimento. Rispetto ai metodi e agli strumenti di coltivazione microbici convenzionali ad alta produttività, MMC presenta molti vantaggi come il basso consumo di manodopera e reagenti, il funzionamento semplice, il rilevamento online (OD e fluorescenza), la raccolta di dati ad alta risoluzione temporale e la parallelizzazione superiore. MMC ha anche alcuni vantaggi speciali diversi dalla tecnologia microfluidica a goccioline convenzionale, che di solito utilizza le goccioline pL e nL. La maggior parte dei sistemi precedentemente segnalati che utilizzavano goccioline pL e nL hanno scarse prestazioni di coltivazione e pochi parametri rilevabili (di solito solo fluorescenza)18,19,20,21. Sebbene ci siano state alcune piattaforme in grado di ottenere migliori prestazioni di coltivazione e rilevamento di più parametri, è difficile e richiede molto sforzo. Ad esempio, alcuni ricercatori hanno riportato il rilevamento OD di goccioline pL. Si basa sul riconoscimento delle immagini, che non ha solo falsi positivi, ma richiede anche un'ulteriore verifica dell'accuratezza22. Tuttavia, MMC può eseguire queste operazioni in modo relativamente semplice. MMC utilizza goccioline di microlitro (μL) che vengono raramente segnalate. Sono state verificate le prestazioni di coltivazione microbica superiori di MMC e possono anche rilevare direttamente OD e fluorescenza. A causa del grande volume delle goccioline μL, la generazione di goccioline è meno suscettibile alle interferenze, il che ha una maggiore stabilità. Nel frattempo, operazioni più diversificate possono essere eseguite nelle goccioline di microlitri, favorevoli alla realizzazione di operazioni automatizzate. Inoltre, poiché le goccioline sono spazi di recinzione, la volatilità del contenuto può essere soppressa (Tabella supplementare 2), favorendo l'esecuzione della coltivazione microbica a lungo termine e l'evoluzione adattativa quando esistono sostanze volatili nel mezzo14. Questo è difficile da ottenere in flaconi e micropiastre.
Tuttavia, alcuni punti critici del protocollo meritano di essere sottolineati. In primo luogo, va notato che il valore OD misurato da MMC è diverso da quello di uno spettrofotometro perché le loro lunghezze del percorso ottico della misurazione OD sono diverse (1 mm e 10 mm, rispettivamente). Pertanto, quando si confronta il valore OD di MMC con quello del pallone shake, è necessario misurare la curva di calibrazione13. Fortunatamente, il processo di evoluzione adattiva non richiede curve di calibrazione perché ci concentriamo sulle tendenze relative tra le curve di crescita. Successivamente, alcuni microrganismi sono incolti in MMC. Le goccioline si basano sulla tensione superficiale dell'interfaccia olio-acqua per mantenere la stabilità23. Se i microrganismi producono determinate sostanze che interrompono la tensione superficiale dell'interfaccia olio-acqua, come alcuni ceppi di Bacillus subtilis che producono tensioattivi24, le goccioline non possono mantenere la stabilità. Inoltre, se il mezzo stesso è un ostacolo alla generazione di goccioline, non è praticabile per essere utilizzato in MMC, ad esempio, mezzo molto viscoso o mezzo contenente particelle di grandi dimensioni. Allo stato attuale, le specie che abbiamo coltivato con successo in MMC includono E. coli, Lactobacillus plantarum, Corynebacterium glutamicum, lieviti, Methylobacterium extorquens, Aspergillus oryzae, microalghe e così via. Si raccomanda di coltivare il ceppo in MMC per l'esperimento preliminare. Infine, i connettori e le porte tra il chip, il flacone del reagente e l'MMC devono essere collegati in stretta conformità con il protocollo. Altrimenti, la soluzione batterica potrebbe fluire nella MMC e contaminare l'interno. Inoltre, va sottolineato che l'attuale throughput di MMC è limitato (0-200), a causa del tempo impiegato per le operazioni di sub-coltivazione. In futuro, ottimizzeremo il software di controllo e le dimensioni del chip per abbreviare i tempi e migliorare il throughput. Poiché MMC è un sistema modulare, solo le parti o il software correlati devono essere sostituiti senza la necessità di nuove apparecchiature.
Allo stato attuale, MMC può non solo condurre misurazioni della curva di crescita, evoluzione adattiva del laboratorio e analisi multilivello a fattore singolo, ma anche essere utilizzato per personalizzare diverse procedure operative delle goccioline per soddisfare le esigenze sperimentali. In futuro, è necessario arricchire ulteriormente le funzioni applicative del sistema MMC in risposta alle diverse esigenze della ricerca microbica, come la conduzione di esperimenti ortogonali multi-fattore multi-livello, la tecnologia di campionamento automatico multi-campione per misurare contemporaneamente le curve di crescita di più specie batteriche e rilevare e controllare con precisione più parametri (ad esempio, ossigeno disciolto (DO) e pH). Allo stesso tempo, è anche necessario sviluppare più funzioni nel campo della microbiologia per applicare MMC a scenari più pratici, come l'ottimizzazione delle composizioni dei mezzi, la determinazione della concentrazione minima inibitoria (MIC), la co-coltivazione di microrganismi25, ecc.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato dal National Key Research and Development Program of China (2018YFA0901500), dal National Key Scientific Instrument and Equipment Project della National Natural Science Foundation of China (21627812) e dal Tsinghua University Initiative Scientific Research Program (20161080108). Ringraziamo anche la Prof.ssa Julia A. Vorholt (Istituto di Microbiologia, Dipartimento di Biologia, ETH Zurigo, Zurigo 8093, Svizzera) per la fornitura del ceppo di E. coli essenziale per metanolo versione 2.2 (MeSV2.2).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 μm PVDF filter membrane | Merck Millipore Ltd. | SLGPR33RB | Sterilize the MMC oil |
| 4 °C refrigerator | Haier | BCD-289BSW | For reagent storage |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| CaCl2·2H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20011160 | Component of the special medium for MeSV2.2. |
| Clean bench | Beijing Donglian Har Instrument Manufacture Co., Ltd. | DL-CJ-INDII | For aseptic operation and UV sterilization |
| CoCl2·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10007216 | Component of the special medium for MeSV2.2. |
| Computer | Lenovo | E450 | Software installation and MMC control |
| Constant temperature incubator | Shanghai qixin scientific instrument co., LTD | LRH 250 | For the microbial cultivation using solid medium |
| CuSO4·5H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10008218 | Component of the special medium for MeSV2.2. |
| Electronic balance | OHAUS | AR 3130 | For reagent weighing |
| EP tube | Thermo Fisher | 1.5 mL | For droplet collection |
| FeCl3·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10011928 | Component of the special medium for MeSV2.2. |
| Freezing Tube | Thermo Fisher | 2.0 mL | For strain preservation |
| Gluconate | Sigma-Aldrich | S2054 | Component of the special medium for MeSV2.2. |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| High-Pressure Steam Sterilization Pot | SANYO Electric | MLS3020 | For autoclaved sterilization |
| isopropyl-β-d-thiogalactopyranoside (IPTG) | Biotopped | 420322 | Component of the special medium for MeSV2.2. |
| Kanamycin sulfate | Solarbio | K8020 | Component of the special medium for MeSV2.2. |
| KH2PO4 | MACKLIN | P815661 | Component of the special medium for MeSV2.2. |
| Methanol | MACKLIN | M813895 | Component of the special medium for MeSV2.2. |
| MgSO4·7H2O | BIOBYING | 1305715 | Component of the special medium for MeSV2.2. |
| Microbial Microdroplet Culture System (MMC) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-I | Performing growth curve determination and adaptive evolution. Please refer to http://www.tmaxtree.com/en/index.php?v=news&id=110 |
| Microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-ALE-OD | For various droplet operations. Please refer to http://www.tmaxtree.com/en/ |
| MMC oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-M/S-OD | The oil phase for droplet microfluidics. Please refer to http://www.tmaxtree.com/en/ |
| MnCl2 | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20026118 | Component of the special medium for MeSV2.2. |
| NaCl | GENERAL-REAGENT | G81793J | Component of the LB medium |
| Na2HPO4·12H2O | GENERAL-REAGENT | G10267B | Component of the special medium for MeSV2.2. |
| NH4Cl | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10001518 | Component of the special medium for MeSV2.2. |
| Petri dish | Corning Incorporated | 90 mm | For the preparation of solid medium |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Quick connector A | Luoyang TMAXTREE Biotechnology Co., Ltd. | — | For the connection of each joint. Please refer to http://www.tmaxtree.com/en/ |
| Reagent bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-PCB | Sampling and storage of bacteria solution and reagents. Please refer to http://www.tmaxtree.com/en/ |
| Shake flask | Union-Biotech | 50 mL | For microbial cultivation |
| Shaking incubator | Shanghai Sukun Industrial Co., Ltd. | SKY-210 2B | For the microbial cultivation in shake flask |
| Streptomycin sulfate | Solarbio | S8290 | Component of the special medium for MeSV2.2. |
| Syringe | JIANGSU ZHIYU MEDICAL INSTRUCTMENT CO., LTD | 10 mL | Draw liquid and inject it into the reagent bottle |
| Syringe needle | OUBEL Hardware Store | 22G | Inner diameter is 0.41 mm and outer diameter is 0.71 mm. |
| Tryptone | Oxoid Ltd. | LP0042 | Component of the LB medium |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
| UV–Vis spectrophotometer | General Electric Company | Ultrospec 3100 pro | For the measurement of OD values |
| Vitamin B1 | Solarbio | SV8080 | Component of the special medium for MeSV2.2. |
| Yeast extract | Oxoid Ltd. | LP0021 | Component of the LB medium |
| ZnSO4·7H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10024018 | Component of the special medium for MeSV2.2. |
Riferimenti
- Lewis, W. H., et al. Innovations to culturing the uncultured microbial majority. Nature Reviews Microbiology. 19 (4), 225-240 (2020).
- Feist, A. M., Herrgard, M. J., Thiele, I., Reed, J. L., Palsson, B. O. Reconstruction of biochemical networks in microorganisms. Nature Reviews Microbiology. 7 (2), 129-143 (2009).
- Zeng, W. Z., Guo, L. K., Xu, S., Chen, J., Zhou, J. W. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Kim, J., Shin, H., et al. Microbiota analysis for the optimization of Campylobacter isolation from chicken carcasses using selective media. Frontiers in Microbiology. 10, 1381 (2019).
- Doig, S. D., Pickering, S. C. R., Lye, G. J., Woodley, J. M. The use of microscale processing technologies for quantification of biocatalytic Baeyer-Villiger oxidation kinetics. Biotechnology and Bioengineering. 80 (1), 42-49 (2002).
- Harms, P., et al. Design and performance of a 24-station high throughput microbioreactor. Biotechnology and Bioengineering. 93 (1), 6-13 (2006).
- Chen, A., Chitta, R., Chang, D., Anianullah, A. Twenty-four well plate miniature bioreactor system as a scale-down model for cell culture process development. Biotechnology and Bioengineering. 102 (1), 148-160 (2009).
- Huber, R., et al. Robo-Lector - a novel platform for automated high-throughput cultivations in microtiter plates with high information content. Microbial Cell Factories. 8, 788-791 (2009).
- Hasegawa, T., et al. High-throughput method for a kinetics analysis of the high-pressure inactivation of microorganisms using microplates. Journal of Bioscience and Bioengineering. 113 (6), 788-791 (2012).
- Teh, S. Y., Lin, R., Hung, L. H., Lee, A. P. Droplet microfluidics. Lab on a Chip. 8 (2), 198-220 (2008).
- Kaminski, T. S., Scheler, O., Garstecki, P. Droplet microfluidics for microbiology: techniques, applications and challenges. Lab on a Chip. 16 (12), 2168-2187 (2016).
- Liao, P. Y., Huang, Y. Y. Divide and conquer: analytical chemistry of nucleic acids in droplets. Scientia Sinica Chimica. 50 (10), 1439-1448 (2020).
- Jian, X. J., et al. Microbial microdroplet culture system (MMC): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnology and Bioengineering. 117 (6), 1724-1737 (2020).
- Wang, J., Jian, X. J., Xing, X. H., Zhang, C., Fei, Q. Empowering a methanol-dependent Escherichia coli via adaptive evolution using a high-throughput microbial microdroplet culture system. Frontiers in Bioengineering and Biotechnology. 8, 570 (2020).
- Meyer, F., et al. Methanol-essential growth of Escherichia coli. Nature Communications. 9, 1508 (2018).
- Grünberger, A., et al. Beyond growth rate 0.6: Corynebacterium glutamicum cultivated in highly diluted environments. Biotechnology and Bioengineering. 110 (1), 220-228 (2013).
- Kaganovitch, E., et al. Microbial single-cell analysis in picoliter-sized batch cultivation chambers. New Biotechnology. 47, 50-59 (2018).
- Baraban, L., et al. Millifluidic droplet analyser for microbiology. Lab on a Chip. 11 (23), 4057-4062 (2011).
- Jakiela, S., Kaminski, T. S., Cybulski, O., Weibel, D. B., Garstecki, P. Bacterial growth and adaptation in microdroplet chemostats. Angewandte Chemie International Edition. 52 (34), 8908-8911 (2013).
- Cedillo-Alcantar, D. F., Han, Y. D., Choi, J., Garcia-Cordero, J. L., Revzin, A. Automated droplet-based microfluidic platform for multiplexed analysis of biochemical markers in small volumes. Analytical Chemistry. 91 (8), 5133-5141 (2019).
- Watterson, W. J., et al. Droplet-based high-throughput cultivation for accurate screening of antibiotic resistant gut microbes. eLife. 9, 56998 (2020).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Nitschke, M., Pastore, G. M. Production and properties of a surfactant obtained from Bacillus subtilis grown on cassava wastewater. Bioresource Technology. 97 (2), 336-341 (2006).
- Jiang, Y. J., et al. Recent advances of biofuels and biochemicals production from sustainable resources using co-cultivation systems. Biotechnology for Biofuels. 12, 155 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon