Method Article
微生物微小液滴培養システム(MMC)を用いた微生物の自動培養と適応進化
* これらの著者は同等に貢献しました
要約
このプロトコルは、微生物微小液滴培養システム(MMC)を使用して、自動微生物培養および適応進化を行う方法を説明しています。MMCは、微生物を自動的かつ継続的に培養および再培養し、比較的高いスループットと良好な並列化で微生物の成長をオンラインで監視し、労力と試薬の消費を削減することができます。
要約
従来の微生物培養方法は、通常、煩雑な操作、低スループット、低効率、および労力および試薬の大量消費を有する。また、近年開発されたマイクロプレートベースのハイスループット培養法は、溶存酸素が低く、混合性が悪く、蒸発や熱の影響が激しいため、微生物の生育状況や実験の並列化が劣っています。小容量、高スループット、強力な制御性などの微小液滴の多くの利点により、液滴ベースのマイクロ流体技術は、ハイスループット微生物培養、スクリーニング、および進化の多くの種類の研究に使用されているこれらの問題を克服することができます。しかし、ほとんどの先行研究は実験室の建設と応用の段階にとどまっています。高い運用要件、高い建設難易度、自動統合技術の欠如などのいくつかの重要な問題は、微生物研究における液滴マイクロ流体技術の幅広い適用を制限しています。ここでは、液滴マイクロ流体技術をベースとした自動微生物微小液滴培養システム(MMC)の開発に成功し、微生物液滴培養の過程で必要な接種、培養、オンラインモニタリング、副耕栽培、選別、サンプリングなどの機能の統合を実現しました。本プロトコールでは、野生型大腸菌(E. coli)MG1655とメタノール必須大腸菌株(MeSV2.2)を例にとり、MMCを用いて自動化された比較的ハイスループットな微生物培養と適応進化を行う方法を詳細に紹介した。この方法は、操作が容易であり、労力および試薬の消費が少なく、高い実験スループットおよび良好なデータ並列性を有し、従来の培養方法と比較して大きな利点を有する。これは、科学研究者が関連する微生物研究を行うための低コストで操作に優しく、結果信頼性の高い実験プラットフォームを提供します。
概要
微生物培養は、微生物の単離、同定、再構成、スクリーニング、および進化に広く使用されている微生物学的科学的研究および産業応用のための重要な基盤である1,2,3。従来の微生物培養方法は、主に試験管、振とうフラスコ、固体プレートを培養容器として使用し、振とう培養器、分光光度計、マイクロプレートリーダーなどの微生物培養・検出・スクリーニング装置と組み合わせていました。しかしながら、これらの方法は、煩雑な操作、低スループット、低効率、および労力および試薬の大量消費など、多くの問題を有する。近年開発されているハイスループット栽培法は、主にマイクロプレートをベースとしています。しかし、マイクロプレートは、低レベルの溶存酸素、貧弱な混合特性、および重度の蒸発および熱効果を有し、これはしばしば微生物の増殖状態および実験並列化をもたらす4,5,6,7;一方、自動栽培とプロセス検出を達成するためには、液体処理ワークステーションやマイクロプレートリーダーなどの高価な機器を装備する必要があります8,9。
マイクロ流体技術の重要な分野として、液滴マイクロ流体は、従来の連続流マイクロ流体システムに基づいて近年開発されている。これは、2つの非混和性液相(通常は油水)を使用して分散マイクロ液滴を生成し、それらを操作する離散流マイクロ流体技術です10。微小液滴は、小体積、大比表面積、高い内部物質移動速度、区画化による交差汚染がないという特徴と、液滴の強力な制御性と高スループットの利点を有するため、微生物のハイスループット培養、スクリーニング、進化に液滴マイクロ流体技術を適用した多くの種類の研究が行われています11.しかし、液滴マイクロ流体技術を普及させ、広く適用するための一連の重要な課題がまだあります。第一に、液滴マイクロフルイディクスの操作は煩雑で複雑であり、オペレータにとって高い技術的要件をもたらす。第二に、液滴マイクロ流体技術は、光学、機械、および電気コンポーネントを組み合わせており、バイオテクノロジーの応用シナリオに関連付ける必要があります。学際的なコラボレーションがなければ、単一の研究室やチームが効率的な液滴マイクロ流体制御システムを構築することは困難です。第3に、微小液滴量(ピコリター(pL)からマイクロリットル(μL)まで)が少ないため、転耕栽培、選別、サンプリングなどのいくつかの基本的な微生物操作において、液滴の正確な自動制御とリアルタイムのオンライン検出を実現することは非常に困難であり、統合機器システム12を構築することも困難である。
上記課題に対処するため、液滴マイクロ流体技術13に基づく微生物自動微小液滴培養システム(MMC)の開発に成功した。MMCは、液滴認識モジュール、液滴スペクトル検出モジュール、マイクロ流体チップモジュール、サンプリングモジュールの4つの機能モジュールで構成されています。すべてのモジュールのシステム統合と制御により、液滴の生成、培養、測定(光学密度(OD)と蛍光)、分割、融合、選別などの自動操作システムを正確に確立し、微生物液滴培養の過程で必要な接種、培養、監視、副耕作、選別、サンプリングなどの機能の統合を実現します。MMCは、2〜3μL容量の200複製液滴培養ユニットまで保持することができ、これは200シェイクフラスコ栽培ユニットに相当する。微小液滴培養システムは、微生物の増殖中の非汚染、溶存酸素、混合、および質量エネルギー交換の要件を満たすことができ、成長曲線測定、適応進化、単一因子マルチレベル分析、代謝産物研究および分析(蛍光検出に基づく)13,14などの複数の統合機能を通じて微生物研究のさまざまなニーズを満たすことができます。
ここでは、MMCを使用して自動微生物培養と適応進化を行う方法を詳細に紹介しています(図1)。増殖曲線測定を実証するために野生型大腸菌(E. coli)MG1655を例にとり、MMCにおける適応進化を実証するためにメタノール必須大腸菌株MeSV2.215を採った。MMC用の操作ソフトウェアを開発し、操作を非常に簡単で明確にしました。全プロセスにおいて、ユーザーは最初の細菌溶液を調製し、MMCの条件を設定し、次いで細菌溶液および関連試薬をMMCに注入する必要がある。その後、MMCは液滴生成、認識とナンバリング、栽培、適応進化などの操作を自動的に実行します。また、液滴のオンライン検出(ODおよび蛍光)を高い時間分解能で実行し、関連データ(エクスポート可能)をソフトウェアに表示します。操作者は、結果に応じていつでも培養工程を停止し、その後の実験のために標的液滴を抽出することができる。MMCは操作が容易で、労力と試薬の消費が少なく、比較的高い実験スループットと良好なデータ並列性を有し、従来の培養方法と比較して大きな利点を有する。これは、研究者が関連する微生物研究を行うための低コストで操作に優しく、堅牢な実験プラットフォームを提供します。
プロトコル
1. 機器とソフトウェアのインストール
- MMC専用の恒久的なスペースとして、清潔で無菌な環境(クリーンベンチなど)を選択してください。MMCをスペースにどんどん設置してください。
メモ: MMC は、強い電界、磁場、および強い熱放射源の干渉から遠ざけてください。光学検出部品に影響を与える激しい振動を避けてください。MMC に AC220 V、50 HZ の電源を供給します。MMCの詳細については、 資料表 およびMMC16のウェブサイトを参照してください。 - MMC.zipファイルから操作ソフトウェアをインストールする
メモ: MMC.zip ファイルの作成者に問い合わせてください。- 専用のフォルダを作成し、その中にzipファイルを保存します。
- 別の専用フォルダを「インストールディレクトリ」として作成します。MMC を解凍し.zipファイルを新しいフォルダーに保存します。
メモ: コンピュータ構成は、(1) Windows 7 64 ビットオペレーティングシステム以上を満たすのに最適です。(2) CPU: i5 以上(3)メモリ:4GB以上。(4)ハードディスク:300GB以上(回転数7200rpm以上またはソリッドステートディスク)
2. 準備
- シリンジ針(内径0.41mm、外径0.71mm)、クイックコネクタA、試薬ボトル(図2C)を接続し、121°Cで15分間オートクレーブ処理します。
メモ:滅菌中は、試薬ボトルのキャップを少し緩めてください。使用するたびにさらにいくつかの試薬ボトルを準備することができます。 - 0.22 μm のポリフッ化ビニリデン (PVDF) フィルターを使用して、MMC オイルをろ過します。マイクロ流体チップ(図2B)とMMCオイルを予めクリーンベンチに入れ、使用前に30分間紫外線照射して殺菌してください。
注:クイックコネクタA、試薬ボトル、MMCオイル、マイクロ流体チップの詳細については、 材料表を参照してください。 - マイクロ流体チップの取り付け
- 操作室のドアを開け(図2A)、光ファイバプローブを持ち上げます。
- 電界穴を電界針に合わせ、チップをチップ台座にそっと置きます。次に、2つの位置決め列を位置決め穴に挿入し、光ファイバプローブを下に置きます(図2D)。
- チップ上のクイックコネクタAを、位置番号(C5-O5、C4-O4、C6-O6、C2-O2、CF-OF、C1-O1、C3-O3)に従ってMMCの対応するポートに接続します。その後、操作室のドアを閉めます。
- オイルボトル内のMMCオイル(約80mLまで)を補充し、使用前に廃液を空にしてください。
注:廃液は通常有機廃棄物です。処分に関する地域の法律や規制をご参照ください(実験設定により変更される場合があります)。
3. MMCにおける成長曲線測定
- 初期菌液の調製
- 関連する標準規制に従って、ルリア・ベルターニ(LB)培地とオートクレーブを121°Cで15分間調製します。
注:LB培地の成分:NaCl(10 g / L)、酵母エキス(5 g / L)およびトリプトン(10 g / L)。 - グリセロールストックから 大腸菌 MG1655株を取り出し、10mLのLB培地を入れた50mL振とうフラスコで、37°Cの振とう培養器(200rpm)で5~8時間培養する。
注:栽培時間は特定の株によって異なります。株を対数周期/位相に培養することが最適である。 - 培養した 大腸菌 MG1655溶液を新鮮な培地でOD600が0.05~0.1となるように希釈し、初期菌液を得た(約10mL調製)。
- 関連する標準規制に従って、ルリア・ベルターニ(LB)培地とオートクレーブを121°Cで15分間調製します。
- [ 初期化] をクリックして MMC を初期化します。初期化インターフェースが表示されたら、栽培温度を37°C、光電信号値を0.6に設定します(図3A)。初期化には約 20 分かかります。
- 初期化中にUVランプ(波長254 nm)をオンにします。
- 初期細菌溶液とMMCオイルを試薬ボトルに注入する。
- クリーンベンチの滅菌試薬ボトルを取り出し、キャップを締めます。
- 10 mLの滅菌シリンジを使用して、サイドチューブのシリンジ針から3〜5 mLのMMCオイルを注入します。試薬ボトルをゆっくりと傾けて回転させ、オイルが内壁に完全に浸透するようにします。
- 約5 mLの初期細菌溶液を注入し、次に5〜7 mLの油を再び注入することによって試薬ボトルを充填する。
- 独立したクイックコネクタAを引き出し、試薬ボトルのクイックコネクタAをクイックコネクタBに挿入して、サンプル注入操作を完了します(図4A)。
- 初期化が終了するのを待ってから、UVランプ(波長254nm)をオフにします。
- 操作室の扉を開き、試薬ボトルを金属浴に入れた。
- チップのC2コネクターと試薬ボトルのクイックコネクターAを引き出します。試薬ボトルのサイドチューブコネクタをC2コネクタに接続し、トップチューブコネクタをO2コネクタに接続します。その後、操作室のドアを閉めます。
- [成長曲線]をクリックして、 成長曲線 測定の機能を選択します(図3A)。パラメータ設定インターフェースで、 数値 を15として入力し、 OD検出 スイッチをオンにして 、波長 を600nmに設定します。[ 開始 ]をクリックしてドロップレットの生成を開始します。所要時間は約10分です。
注:ここで、 数値 とは、生成される液滴の数を指す。波長は、検出対象のODの 波長 をいう。実験要件に応じて 、数 (最大200)と 波長 (350-800nm)を設定します。 - メインインターフェイスに「C2とO2の間の試薬ボトルを取り出し、完了後にOKボタンをクリックしてください」というポップアップウィンドウが表示されたら、操作室のドアを開けて試薬ボトルを取り出し、C2コネクタとO2コネクタを接続します。
- ドアを閉じ、ポップアップ ウィンドウの[OK ]ボタンをクリックすると、自動的に液滴が起動され、OD値が検出されます。
メモ: MMC は、液滴が光ファイバプローブを通過するときに OD 値を検出します。したがって、検出期間は、発生する液滴の数に依存する。 - 成長曲線が定常段階に達したら、[ データのエクスポート] ボタンをクリックして OD データをエクスポートします。データ保存パスを選択し、栽培期間中に記録されたOD値を.csv形式でエクスポートし、適切なソフトウェア(Microsoft Excelなど)で開くことができます。次に、マッピングソフトウェア(EXCELやOrigin 9.0など)を使用して、成長曲線をプロットします。
注: 耕作プロセス中は、いつでも [データのエクスポート] をクリックして、現在のすべてのドロップレットの OD データをエクスポートできます。
4. MMCにおける適応進化
- 初期菌液の調製
- 関連する標準規制に従って、MeSV2.2用の特別な液体媒体および固体プレートを121°Cで15分間オートクレーブで調製します。
メモ:特殊媒体のコンポーネントについては、表 1および 材料表を参照してください。 - MeSV2.2を固体プレート(直径=90mm)を用いて37°Cの恒温インキュベーター内で72時間培養する。次いで、独立したコロニーを選び、10mLの特殊液体培地を入れた50mL振とうフラスコ中で、37°Cの振とう培養器(200rpm)で72時間培養する。
- 培養したMeSV2.2溶液を培地でOD6000000に希釈し(全量が10mL以上であることを確認してください)、振とうフラスコ内で5時間培養を続け、初期菌液を得た。
注:MeSV2.2はメタノール必須 の大腸菌 株です。特殊な液体培地には500ミリモル/Lのメタノールが含まれており、これはMeSV2.2にとって強いストレスであり、成長が非常に遅い。ここで初期菌液を得ることは、ステップ3.1で説明したものとは異なることに注意してください。
- 関連する標準規制に従って、MeSV2.2用の特別な液体媒体および固体プレートを121°Cで15分間オートクレーブで調製します。
- 手順 3.2、3.3、および 3.5 の説明に従って MMC を初期化します。
- 滅菌された試薬ボトルを2本取り出し、そのうちの1本は初期細菌溶液用、もう1本は新鮮な培地用です。ステップ3.4で説明したように、初期細菌溶液(5mL)、新鮮な培地(12〜15mL)、およびMMCオイルを試薬ボトルに注入します。
注:適応進化は複数の転耕栽培を伴う長期的なプロセスであるため、MMCにはできるだけ多くの新鮮な培地を保管してください。実験の実行中に培地を補充することはできません。 - 手順 3.6 で説明したように、2 つの試薬ボトルを MMC に取り付けます。1つはC2コネクタとO2コネクタの間に初期バクテリア溶液用、もう1つはC4コネクタとO4コネクタ間の新鮮な培地用に取り付けます。
- ALEをクリックして適応進化の機能を選択します(図3B)。パラメータ設定インタフェースで、OD検出スイッチをオンにします。
- 数値を 50、波長を 600 nm、濃度を 0%、タイプを時間、パラメータを 30 時間、繰り返しを 99 に設定します。[開始]をクリックしてドロップレットの生成を開始します。所要時間は約25分です。
注:ここで、「濃度」とは、適応進化のための化学的因子の最大濃度を指す。異なる液滴に対して、異なる成長条件を提供するために異なる濃度の化学的因子を導入することはMMCにおいて実現可能である。導入された濃度は、次の式を使用して計算します。
ここで「C」 は、液滴に導入された化学因子の濃度を指す;「a」は、C4コネクタとO4コネクタの間の試薬ボトル中の化学因子の濃度を指す。「b」は、C6コネクタとO6コネクタとの間の試薬ボトル中の化学的因子の濃度を指す。「i」とは、利用可能な濃度をいう。MMCには8つの濃度があります。ここでいう化学因子は単一濃度(500ミリモル/Lメタノール)で培地の原料の一つであるため、化学因子を入れた試薬ボトルを1本だけ設置し、 濃度 を0%としています。タイプは、時間モード、OD値モード、蛍光モードの3つの タイプ に分けられる亜分化培養のモードを指す。前者は液滴を一定時間培養してから再耕作することを意味し、後者の2つは液滴を予め定義されたOD値/蛍光強度に培養してから再耕作することを意味する。パラメータは、サブカルチャのモードを選択する際に必要な関連 パラメータ を指す。 繰り返しは 、継耕栽培の数を指します。 - 手順 3.8 の説明に従って、C2 コネクタと O2 コネクタの間にある試薬ボトルを取り外します。
- 各副耕栽培期間中の液滴の最大OD値が有意に増加したかどうかを観察する。増加が発生し、実験の要件を満たしている場合は、[ データのエクスポート] ボタンをクリックして、手順 3.9 で説明したように OD データをエクスポートします。
注:ここで、サブ栽培期間は パラメータによって異なります。例えば、 タイプ を時間、 パラメータ を30時間に設定した場合、サブ栽培期間は30時間となる。各亜耕作期間中、液滴の最大OD値がある。適応進化が最大OD値の増加によって実験要件を満たしているかどうかを推定する(この増加は、株の実際の栽培プロセスに依存し、例えば、20%以上増加する)。
警告: 保管されている新鮮な培地が使い果たされていないか注意してください。培地が枯渇した後でも有意な増加が起こらなかった場合は、よりよく成長する液滴を抽出し、適応進化の新しいラウンドを実行します。 - MMC からターゲット液滴を抽出します。
- [スクリーニング]ボタンをクリックして、液滴抽出の機能を選択します(図3C)。[収集]オプションを選択し、ターゲットドロップレットの数をクリックしてから、[OK]をクリックします。
注:液滴スクリーニングには、「収集」、「廃棄」および「種子溶液の抽出」が含まれる。「抽出種子溶液」は、継代培養操作後に残りの液滴13を採取することを意味する。 - ポップアップウィンドウが「CFクイックコネクタを引き出し、EPチューブに入れてください」というプロンプトが表示されるのを待ちます。ソフトウェアプロンプトに従って収集するためにCFクイックコネクタをマイクロ遠心チューブに入れ、 OK をクリックします(図4D)。
- 1〜2分後、ソフトウェアインターフェイスに新しいウィンドウがポップアップ表示され、「コネクタを後ろに挿入し、終了したら [OK ]をクリックしてください」というプロンプトが表示されます。次に、CFクイックコネクタを挿入し、 OK をクリックしてMMCの実行を続行します(図4D)。次のターゲット液滴が液滴認識部位に到達したら、4.9.2~4.9.3を繰り返して収集します。
注: すべてのターゲット液滴が収集された後、MMC は残りの液滴の培養を続けます。耕作が必要ない場合は、[停止]をクリックして操作を直接終了します。 - 2.5 μLのピペットを使用して液滴を抽出し、90 mmのアガロースプレートに滴下し、一辺の長さ3cmの三角形のガラス拡散棒で均等に広げます。その後、37°Cの恒温インキュベーターで72時間培養する。
- 3〜5個の独立したコロニーをピックし、37°Cの振とうインキュベーター(200rpm)で48〜72時間、10mLの新鮮な培地を含む50mL振とうフラスコで別々に培養する。関連する標準規制に従って、その後の実験のために培養細菌溶液をグリセロールチューブに保存する。
- [スクリーニング]ボタンをクリックして、液滴抽出の機能を選択します(図3C)。[収集]オプションを選択し、ターゲットドロップレットの数をクリックしてから、[OK]をクリックします。
5. MMCのクリーン化
- 実験が完了したら、[ 停止 ] をクリックしてすべての操作を停止します。次に、[ クリーン] をクリックしてチップとチューブをクリーニングします。所要時間は約15分です。
結果
このプロトコルは 、大腸菌 MG1655およびMeSV2.2株を例として使用し、MMCにおける自動化された比較的高スループット戦略による微生物培養およびメタノール必須の適応進化を実証する。成長曲線測定は、主に微生物培養を特徴付けるために使用された。適応進化は、自動連続継耕栽培により行い、各継代培養中に選択圧として高濃度のメタノールを添加した。適応進化が実現したか否かは、各副耕作期間中の液滴の最大OD値の変動傾向から推定した。MMC のチューナブル・パラメーターおよび精度パラメーターを 表 2 に示します。
成長曲線測定結果
培養工程中に検出された15滴のOD600 値を、約20時間培養した後にMMCから輸出した(図5A)。検出は約14分ごとに行われたことが観察できる。この検出期間は、液滴が培養用チューブ内を行き来するため発生する液滴の数に依存し、検出モジュールは、液滴が光ファイバプローブを通過したときにのみOD値を検出する(OD値の検出および計算は 補足図 1に示す)。したがって、14分は非常に短い検出期間であり、微生物の増殖をより正確に反映するための高い時間分解能検出プロセスを提供する。
エクスポートされたデータに従って、各時点における15個の液滴の平均OD600値および標準偏差(SD)を計算し、大腸菌MG1655の増殖曲線をプロットした(図5B)。この結果は、成長曲線がラグ期、対数期、および固定期を含む「S」形状を示すことを示しており、これは古典的な微生物増殖モデルと非常に一致している。同時に、15個の液滴の標準偏差は非常に小さく、良好な成長一貫性および平行性を示す。これにより、MMCの良好な微生物培養・検出性能を十分に発揮できる。また、培養中に液滴間のクロストークがほとんどないことも確認できた(補足図2及び補足表1)。
適応進化の結果
我々はMMCでMeSV2.2の長期的な適応進化を行った。18日目 に、ソフトウェアインターフェース上に表示された増殖曲線から各転耕栽培期間中の液滴の最大OD600値の増加傾向に従って、50液滴において良好な適応進化が達成されたと考えられる。OD600データをエクスポートし、比較的良好な成長性能を有する8つの液滴(液滴6を含む)を抽出した13。 図6A は、適応進化過程全体における50個の液滴の成長曲線を示す。18日間で、MMCは自動的に13の継代培養操作を実施しました。 図6A から、MeSV2.2は最初はゆっくりと成長し、その後は急速に成長することがわかりますが、これはMeSV2.2の適応進化の軌跡を示しています。選択圧力を供給するために、メタノールをMeSV2.2培地に添加した。当初、メタノールは細胞増殖を阻害した。適応進化の後、メタノールに適応した濃縮細胞はより高い増殖速度を有した。全適応進化過程における液滴6の成長曲線を別々にプロットした(図6B)。第一世代および最終従属栽培期間における最大OD600値は、それぞれ0.37および0.58であり、56.8%増加した。これは、液滴6中のひずみが明らかな適応進化を実現したことを示す。
続いて、振とうフラスコ内で液滴6株と初期株を培養し、それらの生育曲線を比較した(図6C)。文献17、18に与えられた方法に従って、液滴6株および初期株の最大比増殖速度(μ最大)を計算し、それぞれ0.096h−1および0.072h−1であった。図6Cは、液滴6株が振とうフラスコで培養した場合、初期株よりも高い最大比増殖速度(54.8%増加)を示し、固定期の細胞濃度が高い(20.0%増加)ことを明らかにし、MeSV2.2の適応進化がさらに実現されたことを示唆している。
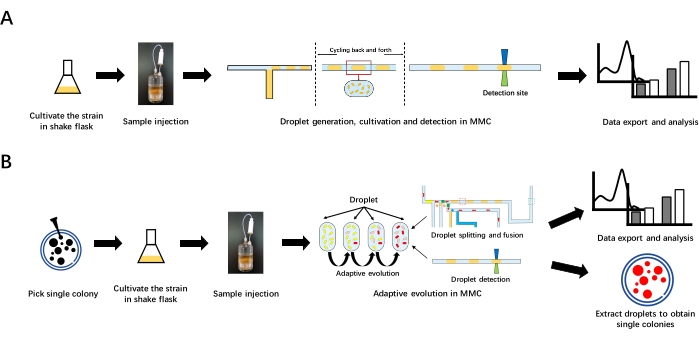
図1:MMCにおける成長曲線測定と適応進化の全体的なワークフロー (A)MMCにおける成長曲線測定。まず、振とうフラスコで菌株を培養し、初期菌液を調製した。次いで、初期細菌溶液を試薬ボトルに注入する。次に、MMCで液滴を生成します。MMCは、液滴をマイクロ流体チップとチューブ内で前後に循環させて培養します。ドロップレットが検出サイトを通過すると、OD データが検出されて記録されます。最後に、分析用にデータをエクスポートします。(B) MMCにおける適応進化アガロースプレートから単一のコロニーを選び、それを振とうフラスコで培養して初期細菌溶液を調製する。初期細菌溶液を試薬ボトルに注入した後、MMCで適応進化を行う。適応進化は連続的な再耕作を含み、液滴の分裂と融合によって自動的に操作することができます。適応進化の後、分析のためにデータをエクスポートします。標的液滴を抽出し、プレート上に広げて単一のコロニーを得ることができる。 この図の拡大版を表示するには、ここをクリックしてください。

図2: MMCの構造と必須ツール(a)MMCの外部および操作室。(b)MMCのマイクロ流体チップ。チップには7つのチャネル(C1-C6およびCF)があります。(c)試薬ボトル。それはトップチューブとサイドチューブを持っています。試薬ボトルにサンプルを注入する前に、まずシリンジ針をクイックコネクタAに接続し、次にクイックコネクタAをサイドチューブに接続する必要があります。 (D)マイクロ流体チップの設置。マイクロ流体チップは台座に設置されている。次に、7 つのチャネル(C1 ~ C6 および CF)がそれぞれ MMC の対応するポート(O1 ~ O6、および OF)に接続されます。
1 - MMCの操作室。
2 - MMCオイルを入れたオイルボトル。
3 - 廃液を回収するための廃液ボトル。
4 - 滅菌用のUVランプ(波長254nm)。このランプは、チップとチューブを滅菌するために事前にオンにすることができます。
5 - 液滴認識のためのレーザー(620nm)。チップ上にレーザーが照射される点が液滴認識部位である。
6 - 操作チャンバ内の温度を測定するための温度プローブ。
7 - 操作室用のヒーター。微生物培養の温度を維持するために使用することができる。設定できる温度範囲は25±0.5°C~40±0.5°Cです。
8 - 液滴のODまたは蛍光を測定するための光ファイバプローブ。
9 - マイクロ流体チップを取り付けるためのチップ台座。
10 - 試薬ボトルを固定し、それらを加熱して試薬の温度を微生物培養の温度に迅速に上昇させるための金属浴。
11 - マイクロ流体チップ (O1 ~ O6、および OF) のポート。マイクロ流体チップは、これらのポートを介してMMCに接続される。
12 - 液滴の貯蔵および栽培のためのチューブ。
13 - マグネットブロックは、設置中にマイクロ流体チップをすばやく見つけます。
14 - シリンジ針は、試薬ボトルにサンプルを注入する。その内径は0.41ミリメートルであり、その外径は0.71ミリメートルである。
15 - クイックコネクタA. クイックコネクタBで接続します。
16 - クイック コネクタ B. この図の拡大版を表示するには、ここをクリックしてください。
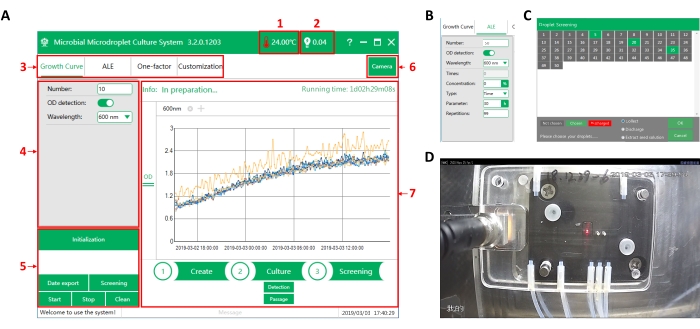
図3:MMCの操作ソフトウェアインタフェース(A) ソフトウェアのメインインターフェイス。(1)操作室内の温度(2)液滴認識の光電信号値。液滴が通過すると、信号値は高くなる(>2V)。オイルが通過すると、信号値は低くなります(<1 V)。(3) 機能選択成長曲線測定(成長曲線)、適応実験室進化(ALE)、単一因子マルチレベル分析(1因子)、実験ニーズに応じた操作のカスタマイズ(カスタマイズ)の4つの機能から選択できます。(4) パラメータ設定インタフェース1つの関数を選択した後、対応する実験パラメータをここで設定します。(5) コマンド実行領域。(6)カメラのスイッチ。カメラはチップの真上に取り付けられており、チップ内の液滴をオンラインで観察するために使用できます。(7) プロセス表示領域。実行時間、監視データ、および実行中の操作が表示されます。(B) 適応進化のパラメータ設定インターフェース。(C)液滴スクリーニングインターフェース。MMC は、自動的にドロップレットに番号を付けることができます。ここで、標的液滴を選択し、MMCから抽出することができる。(D)カメラ観察インターフェース。この図の拡大版を表示するには、ここをクリックしてください。

図4: サンプル注入、液滴生成、液滴抽出(a)菌液及びMMC油の注入後の試薬ボトル。バクテリア溶液とMMCオイルの両方がサイドチューブから注入されます。油相は上層にあり、細菌溶液は下層にある。注入後、クイックコネクタAとBを接続し、MMCに取り付けます。(b)マイクロ流体チップにおける液滴発生。液滴の視認性を高めるために、赤色顔料溶液を用いて液滴生成のプロセスを実証した。(c)チューブ内に貯留された液滴を顕微鏡で観察する。スケール バー: 400 μm. (D) ポップアップ ウィンドウのプロンプトとそれに対応する操作。「CFクイックコネクタを抜いてEPチューブに入れてください」というプロンプトが表示されたら、CFコネクタを抜いてEPチューブに入れ、ターゲット液滴を集めます。「コネクタを元に戻してください」というプロンプトが表示されたら、ドロップレットの収集が完了し、CFコネクタをOFポートに挿入し直します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:データエクスポートと成長曲線の図プロット。(A) エクスポートされたデータの一部を示すスクリーンショット。エクスポートされたデータには、生成された 15 個の液滴の各検出時点と、対応する OD600 値が含まれます。(b)エクスポートされたデータに基づいてプロットされた大腸菌MG1655の増殖曲線。各時点における15個の液滴の平均OD600値および標準偏差(SD)を計算し、成長曲線をプロットする。この成長曲線には、ラグ期、対数期、および定常期が含まれていることがわかります。この図の拡大版を表示するには、ここをクリックしてください。
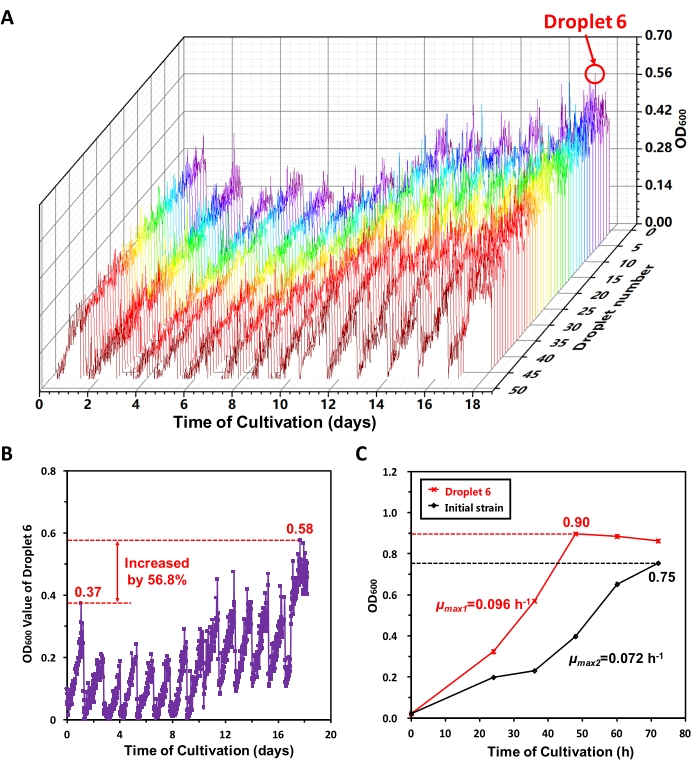
図6:MMCにおけるMeSV 2.2の適応進化の結果。(A)適応進化過程全体における50個の液滴の成長曲線。18日間の適応進化プロセス中の50個の液滴のOD600検出データをMMCからエクスポートし、プロットした。18日目に、液滴6を含む8個の液滴が抽出された。(b)全適応進化過程における液滴6の成長曲線。第一世代および最終従属栽培期間における最大OD600値は、それぞれ0.37および0.58であり、56.8%増加した。(c)振とうフラスコ内の液滴6株と初期株の比較。液滴6の株と初期株を振とうフラスコで培養し、生育曲線(SDを含む、n=3)を測定した。この図は、Jian X. J. et al.13から修正されたものである。この図の拡大版を表示するには、ここをクリックしてください。
| コンポーネント | 濃度 |
| Na2HPO4・12H2O | 6.78グラム/L |
| KH2PO4 | 3グラム/L |
| ナクル | 0.5グラム/L |
| NH4Cl | 1グラム/リットル |
| ビタミンB1(ろ過滅菌) | 0.34グラム/L |
| MgSO4·7H2O | 0.049グラム/L |
| CaCl 2·2H2O | 1.5ミリグラム/リットル |
| 微量元素: | |
| FeCl3·6H2O | 0.5ミリグラム/リットル |
| ZnSO4·7H2O | 0.09 ミリグラム/リットル |
| CuSO4・5H2O | 0.088 ミリグラム/リットル |
| MnCl2 | 0.045 ミリグラム/リットル |
| CoCl2·6H2O | 0.09 ミリグラム/リットル |
| グルコン 酸 | 1.09グラム/リットル |
| メタノール | 500ミリモル/リットル |
| イソプロピル-β-d-チオガラクトピラノシド | 0.1ミリモル/リットル |
| 硫酸ストレプトマイシン | 20 μg/mL |
| 硫酸カナマイシン | 50 μg/mL |
| さらに15 g/Lのアガロースを加えて固体培地を調製する。 | |
表 1: MeSV2.2 用の特殊メディアのコンポーネント。
| チューナブル・パラメーター | |
| パラメーター | 範囲 |
| 栽培温度 | 25 ~ 40 °C ± 0.5 °C |
| 液滴の数 | 0–200 |
| 種菌の濃度 | 13.3–86.7 % |
| 化学因子の濃度 | 8つの異なる濃度、保存された化学因子の最大濃度まで |
| 転耕栽培の時期 | ユーザーまで |
| 転耕栽培回数 | ユーザーまで |
| OD検出の波長 | 350–800 nm |
| 蛍光検出の波長 | 励起: 470, 528 nm 放出: 350–800 nm |
| 精度パラメータ | |
| パラメーター | 中華人民共和国 |
| 液滴の体積 | 1.88% |
| 種菌の濃度 | <5.0% |
表 2: MMC のチューナブル パラメーターと精度パラメーター。チューナブル・パラメーターとは、ユーザーの特定の要件に応じて調整できるパラメーターのことです。精度パラメータは、異なる流体操作の精度と再現性を反映するパラメータを指します。
補足図1:MMCにおける液滴の認識および検出。 (a)MMCにおける液滴の波形。この波形は、MMC分光器の生のスペクトルデータから得られます。バックグラウンドで生のスペクトルデータを処理した後、MMCは測定されたOD値を与える。(b)MMCにおける液滴のOD計算。液滴の波形において、「a」は液滴の最大長を表し、「c」は油相と水相によって形成される円弧状の界面を表し、「b」は液滴の主要部分を表す。ランバート・ビールの法則に基づいて、液滴のOD値は、OD値= lg(E/D)×10の式を使用して計算されます。「E」は、油相の平均スペクトル信号値を指し;'D'は、液滴の主要部bの平均スペクトル信号値をいう。なお、MMCで測定したOD値は分光光度計で測定したOD値とは異なる。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:液滴間のクロストークの検定。 長期培養中に液滴間にクロストークがあるかどうかを確認するために、大腸菌MG1655溶液を非常に低濃度(ポアソン分布によればλ=0.1)に希釈し、次いで200個の液滴を生成し、5日間培養した。ODを測定した後、大腸菌MG1655が少数の液滴で増殖することがわかった。そして、これらの液滴の周りの液滴にはほとんど細菌の増殖はなかった。この結果はまた、液滴間のクロストークがほとんどないことを予備的に示している。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1:MMCにおける液滴生成の安定性。 補足図1に示すように、液滴の波形は固定されています。MMCの分光器は毎秒一定数のデータポイントを生成するので、液滴波形のデータポイントの数は液滴のサイズを反映することができます。赤色色素溶液を用いてMMCに397滴を発生させ、OD値を測定した。生のスペクトルデータをエクスポートし、各液滴波形のデータポイントをカウントし、液滴データポイントの変動係数(C.V)を計算した。この表をダウンロードするには、ここをクリックしてください。
補足表2:MMCにおける液滴蒸発。 ここでは、赤色色素溶液を用いてMMCに液滴を発生させ、液滴を栽培管に貯留した。次いで、チューブを37°Cの恒温インキュベーター内に30日間入れ、液滴長を定期的に測定した(顕微鏡下で写真を撮り、スケールバーで長さを測定した)。これは、液滴の体積が30日後に約12.3%減少したことを示し、これは、液滴の蒸発がMMCにおいて非常に小さいことを示している。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、微生物微小液滴培養システム(MMC)を使用して、自動微生物培養および長期的な適応進化を実行する方法を提示する。MMCは、小型化、自動化、ハイスループットの微生物培養システムです。従来の微生物ハイスループット培養方法や機器と比較して、MMCは、低労力および試薬消費、簡単な操作、オンライン検出(ODおよび蛍光)、高時間分解能データ収集、および優れた並列化などの多くの利点を有する。MMCはまた、通常pLおよびnL液滴を使用する従来の液滴マイクロ流体技術とは異なるいくつかの特別な利点を有する。pLおよびnL液滴を使用した以前に報告されたほとんどのシステムは、培養性能が低く、検出可能なパラメータがほとんどなく(通常は蛍光のみ)、18、19、20、21。より良い栽培性能と複数のパラメータ検出を実現できるプラットフォームはいくつかありましたが、それは困難であり、多くの労力を必要とします。例えば、一部の研究者はpL液滴のOD検出を報告した。これは、偽陽性を有するだけでなく、精度22のさらなる検証を必要とする画像認識に基づいている。しかし、MMCは比較的簡単な方法でこれらを達成することができます。MMCは、めったに報告されないマイクロリットル(μL)の液滴を使用する。MMCの優れた微生物培養性能が検証されており、ODや蛍光を直接検出することもできます。μL液滴の体積が大きいため、液滴生成は干渉の影響を受けにくく、より高い安定性を有する。一方、マイクロリットルの液滴ではより多様な操作を行うことができ、自動化操作の実現に資する。さらに、液滴は囲い込み空間であるため、内容物の揮発性を抑制でき(補足表2)、培地14中に揮発性物質が存在する場合に長期間の微生物培養および適応進化を行うのに役立つ。これは、振とうフラスコおよびマイクロプレートで達成することは困難である。
ただし、プロトコルの特定の重要なポイントは強調する価値があります。まず、MMCで測定したOD値は、OD測定の光路長が異なるため(それぞれ1mmと10mm)、分光光度計のOD値とは異なることに注意する必要があります。そのため、MMCのOD値を振とうフラスコのOD値と比較する場合には、検量線13を測定する必要がある。幸いなことに、適応進化プロセスは、成長曲線間の相対的な傾向に焦点を当てているため、検量線を必要としません。次に、特定の微生物はMMCにおいて未培養である。液滴は、安定性23を維持するために油水界面の表面張力に依存する。微生物が、界面活性剤24を産生するいくつかの枯草菌株のような、油水界面の表面張力を破壊する特定の物質を産生する場合、液滴は安定性を維持できない。さらに、培地自体が液滴の発生の障害である場合、MMCにおいて、例えば非常に粘性の高い培地または大きな粒子を含む培地に使用することは実行可能ではない。現在、MMCで栽培に成功した種には、大腸菌、ラクトバチルス・プランタラム、コリネバクテリウム・グルタミカム、酵母、メチロバクテリウム・エクストルクン、アスペルギルス・オリゼー、微細藻類などがあります。予備実験のためにMMCで株を培養することが推奨される。最後に、チップ、試薬ボトル、およびMMC間のコネクタおよびポートは、プロトコルに厳密に従って接続する必要があります。さもなければ、細菌溶液はMMCに流れ込み、内部を汚染する可能性がある。さらに、MMCの現在のスループットは、サブカルチャーの操作にかかる時間のために、制限されている(0〜200)ことを指摘しなければならない。将来的には、制御ソフトウェアとチップのサイズを最適化して、時間を短縮し、スループットを向上させます。MMCはモジュラーシステムであるため、新しい機器を必要とせずに、関連する部品やソフトウェアのみを交換する必要があります。
現在、MMCは、成長曲線測定、適応実験室進化、および単因子マルチレベル分析を行うだけでなく、実験ニーズを満たすために異なる液滴操作手順をカスタマイズするためにも使用することができる。今後は、多因子多段階直交実験の実施、複数の菌種の増殖曲線を同時に測定するマルチサンプル自動サンプリング技術、より多くのパラメータ(溶存酸素(DO)やpHなど)を正確に検出・制御するなど、微生物研究のさまざまなニーズに応えてMMCシステムの応用機能を一層充実させる必要があります。同時に、培地組成の最適化、最小阻害濃度(MIC)の決定、微生物の共培養25など、より実用的なシナリオにMMCを適用するために、微生物学の分野でより多くの機能を開発することも必要です。
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、中国国家基幹研究開発プログラム(2018YFA0901500)、中国国家自然科学財団国家基幹科学機器プロジェクト(21627812)、清華大学イニシアチブ科学研究プログラム(20161080108)の支援を受けた。我々はまた、メタノール必須 大腸菌 株バージョン2.2(MeSV2.2)の提供について、ジュリア・A・フォルホルト教授(微生物学研究所、生物学部、ETHチューリッヒ、チューリッヒ8093、スイス)にも感謝する。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 μm PVDF filter membrane | Merck Millipore Ltd. | SLGPR33RB | Sterilize the MMC oil |
| 4 °C refrigerator | Haier | BCD-289BSW | For reagent storage |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| CaCl2·2H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20011160 | Component of the special medium for MeSV2.2. |
| Clean bench | Beijing Donglian Har Instrument Manufacture Co., Ltd. | DL-CJ-INDII | For aseptic operation and UV sterilization |
| CoCl2·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10007216 | Component of the special medium for MeSV2.2. |
| Computer | Lenovo | E450 | Software installation and MMC control |
| Constant temperature incubator | Shanghai qixin scientific instrument co., LTD | LRH 250 | For the microbial cultivation using solid medium |
| CuSO4·5H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10008218 | Component of the special medium for MeSV2.2. |
| Electronic balance | OHAUS | AR 3130 | For reagent weighing |
| EP tube | Thermo Fisher | 1.5 mL | For droplet collection |
| FeCl3·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10011928 | Component of the special medium for MeSV2.2. |
| Freezing Tube | Thermo Fisher | 2.0 mL | For strain preservation |
| Gluconate | Sigma-Aldrich | S2054 | Component of the special medium for MeSV2.2. |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| High-Pressure Steam Sterilization Pot | SANYO Electric | MLS3020 | For autoclaved sterilization |
| isopropyl-β-d-thiogalactopyranoside (IPTG) | Biotopped | 420322 | Component of the special medium for MeSV2.2. |
| Kanamycin sulfate | Solarbio | K8020 | Component of the special medium for MeSV2.2. |
| KH2PO4 | MACKLIN | P815661 | Component of the special medium for MeSV2.2. |
| Methanol | MACKLIN | M813895 | Component of the special medium for MeSV2.2. |
| MgSO4·7H2O | BIOBYING | 1305715 | Component of the special medium for MeSV2.2. |
| Microbial Microdroplet Culture System (MMC) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-I | Performing growth curve determination and adaptive evolution. Please refer to http://www.tmaxtree.com/en/index.php?v=news&id=110 |
| Microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-ALE-OD | For various droplet operations. Please refer to http://www.tmaxtree.com/en/ |
| MMC oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-M/S-OD | The oil phase for droplet microfluidics. Please refer to http://www.tmaxtree.com/en/ |
| MnCl2 | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20026118 | Component of the special medium for MeSV2.2. |
| NaCl | GENERAL-REAGENT | G81793J | Component of the LB medium |
| Na2HPO4·12H2O | GENERAL-REAGENT | G10267B | Component of the special medium for MeSV2.2. |
| NH4Cl | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10001518 | Component of the special medium for MeSV2.2. |
| Petri dish | Corning Incorporated | 90 mm | For the preparation of solid medium |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Quick connector A | Luoyang TMAXTREE Biotechnology Co., Ltd. | — | For the connection of each joint. Please refer to http://www.tmaxtree.com/en/ |
| Reagent bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-PCB | Sampling and storage of bacteria solution and reagents. Please refer to http://www.tmaxtree.com/en/ |
| Shake flask | Union-Biotech | 50 mL | For microbial cultivation |
| Shaking incubator | Shanghai Sukun Industrial Co., Ltd. | SKY-210 2B | For the microbial cultivation in shake flask |
| Streptomycin sulfate | Solarbio | S8290 | Component of the special medium for MeSV2.2. |
| Syringe | JIANGSU ZHIYU MEDICAL INSTRUCTMENT CO., LTD | 10 mL | Draw liquid and inject it into the reagent bottle |
| Syringe needle | OUBEL Hardware Store | 22G | Inner diameter is 0.41 mm and outer diameter is 0.71 mm. |
| Tryptone | Oxoid Ltd. | LP0042 | Component of the LB medium |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
| UV–Vis spectrophotometer | General Electric Company | Ultrospec 3100 pro | For the measurement of OD values |
| Vitamin B1 | Solarbio | SV8080 | Component of the special medium for MeSV2.2. |
| Yeast extract | Oxoid Ltd. | LP0021 | Component of the LB medium |
| ZnSO4·7H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10024018 | Component of the special medium for MeSV2.2. |
参考文献
- Lewis, W. H., et al. Innovations to culturing the uncultured microbial majority. Nature Reviews Microbiology. 19 (4), 225-240 (2020).
- Feist, A. M., Herrgard, M. J., Thiele, I., Reed, J. L., Palsson, B. O. Reconstruction of biochemical networks in microorganisms. Nature Reviews Microbiology. 7 (2), 129-143 (2009).
- Zeng, W. Z., Guo, L. K., Xu, S., Chen, J., Zhou, J. W. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Kim, J., Shin, H., et al. Microbiota analysis for the optimization of Campylobacter isolation from chicken carcasses using selective media. Frontiers in Microbiology. 10, 1381 (2019).
- Doig, S. D., Pickering, S. C. R., Lye, G. J., Woodley, J. M. The use of microscale processing technologies for quantification of biocatalytic Baeyer-Villiger oxidation kinetics. Biotechnology and Bioengineering. 80 (1), 42-49 (2002).
- Harms, P., et al. Design and performance of a 24-station high throughput microbioreactor. Biotechnology and Bioengineering. 93 (1), 6-13 (2006).
- Chen, A., Chitta, R., Chang, D., Anianullah, A. Twenty-four well plate miniature bioreactor system as a scale-down model for cell culture process development. Biotechnology and Bioengineering. 102 (1), 148-160 (2009).
- Huber, R., et al. Robo-Lector - a novel platform for automated high-throughput cultivations in microtiter plates with high information content. Microbial Cell Factories. 8, 788-791 (2009).
- Hasegawa, T., et al. High-throughput method for a kinetics analysis of the high-pressure inactivation of microorganisms using microplates. Journal of Bioscience and Bioengineering. 113 (6), 788-791 (2012).
- Teh, S. Y., Lin, R., Hung, L. H., Lee, A. P. Droplet microfluidics. Lab on a Chip. 8 (2), 198-220 (2008).
- Kaminski, T. S., Scheler, O., Garstecki, P. Droplet microfluidics for microbiology: techniques, applications and challenges. Lab on a Chip. 16 (12), 2168-2187 (2016).
- Liao, P. Y., Huang, Y. Y. Divide and conquer: analytical chemistry of nucleic acids in droplets. Scientia Sinica Chimica. 50 (10), 1439-1448 (2020).
- Jian, X. J., et al. Microbial microdroplet culture system (MMC): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnology and Bioengineering. 117 (6), 1724-1737 (2020).
- Wang, J., Jian, X. J., Xing, X. H., Zhang, C., Fei, Q. Empowering a methanol-dependent Escherichia coli via adaptive evolution using a high-throughput microbial microdroplet culture system. Frontiers in Bioengineering and Biotechnology. 8, 570 (2020).
- Meyer, F., et al. Methanol-essential growth of Escherichia coli. Nature Communications. 9, 1508 (2018).
- Grünberger, A., et al. Beyond growth rate 0.6: Corynebacterium glutamicum cultivated in highly diluted environments. Biotechnology and Bioengineering. 110 (1), 220-228 (2013).
- Kaganovitch, E., et al. Microbial single-cell analysis in picoliter-sized batch cultivation chambers. New Biotechnology. 47, 50-59 (2018).
- Baraban, L., et al. Millifluidic droplet analyser for microbiology. Lab on a Chip. 11 (23), 4057-4062 (2011).
- Jakiela, S., Kaminski, T. S., Cybulski, O., Weibel, D. B., Garstecki, P. Bacterial growth and adaptation in microdroplet chemostats. Angewandte Chemie International Edition. 52 (34), 8908-8911 (2013).
- Cedillo-Alcantar, D. F., Han, Y. D., Choi, J., Garcia-Cordero, J. L., Revzin, A. Automated droplet-based microfluidic platform for multiplexed analysis of biochemical markers in small volumes. Analytical Chemistry. 91 (8), 5133-5141 (2019).
- Watterson, W. J., et al. Droplet-based high-throughput cultivation for accurate screening of antibiotic resistant gut microbes. eLife. 9, 56998 (2020).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Nitschke, M., Pastore, G. M. Production and properties of a surfactant obtained from Bacillus subtilis grown on cassava wastewater. Bioresource Technology. 97 (2), 336-341 (2006).
- Jiang, Y. J., et al. Recent advances of biofuels and biochemicals production from sustainable resources using co-cultivation systems. Biotechnology for Biofuels. 12, 155 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved