Method Article
Automatisierte mikrobielle Kultivierung und adaptive Evolution mit mikrobiellem Mikrotröpfchenkultursystem (MMC)
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie das mikrobielle Mikrotröpfchenkultursystem (MMC) verwendet wird, um eine automatisierte mikrobielle Kultivierung und adaptive Evolution durchzuführen. MMC kann Mikroorganismen automatisch und kontinuierlich kultivieren und subkultivieren und ihr Wachstum online mit relativ hohem Durchsatz und guter Parallelisierung überwachen, wodurch der Arbeits- und Reagenzienverbrauch reduziert wird.
Zusammenfassung
Herkömmliche mikrobielle Kultivierungsmethoden haben in der Regel umständliche Operationen, einen geringen Durchsatz, eine geringe Effizienz und einen hohen Verbrauch an Arbeitskräften und Reagenzien. Darüber hinaus haben mikrotiterplattenbasierte Hochdurchsatz-Kultivierungsmethoden, die in den letzten Jahren entwickelt wurden, aufgrund ihres geringen gelösten Sauerstoffs, ihrer schlechten Mischung und ihrer starken Verdunstungs- und Wärmewirkung einen schlechten mikrobiellen Wachstumsstatus und eine schlechte Experimentparallelisierung. Aufgrund vieler Vorteile von Mikrotröpfchen, wie z. B. geringes Volumen, hoher Durchsatz und starke Kontrollierbarkeit, kann die tröpfchenbasierte mikrofluidische Technologie diese Probleme überwinden, die in vielen Arten der Erforschung der mikrobiellen Kultivierung, des Screenings und der Evolution mit hohem Durchsatz eingesetzt wurde. Die meisten früheren Studien befinden sich jedoch noch im Stadium des Laboraufbaus und der Anwendung. Einige Schlüsselthemen, wie hohe betriebliche Anforderungen, hohe Bauschwierigkeiten und das Fehlen automatisierter Integrationstechnologie, schränken die breite Anwendung der Tröpfchenmikrofluidik-Technologie in der mikrobiellen Forschung ein. Hier wurde erfolgreich ein automatisiertes mikrobielles Mikrotropfenkultursystem (MMC) entwickelt, das auf der Tröpfchenmikrofluidik-Technologie basiert und die Integration von Funktionen wie Impfung, Kultivierung, Online-Überwachung, Subkultivierung, Sortierung und Probenahme erreicht, die für den Prozess der mikrobiellen Tröpfchenkultivierung erforderlich sind. In diesem Protokoll wurden Wildtyp-Escherichia coli (E. coli) MG1655 und ein Methanol-essentieller E. coli-Stamm (MeSV2.2) als Beispiele genommen, um vorzustellen, wie die MMC verwendet werden kann, um automatisierte und relativ durchsatzfähige mikrobielle Kultivierung und adaptive Evolution im Detail durchzuführen. Diese Methode ist einfach zu bedienen, verbraucht weniger Arbeit und Reagenzien und hat einen hohen experimentellen Durchsatz und eine gute Datenparallelität, was im Vergleich zu herkömmlichen Anbaumethoden große Vorteile hat. Es bietet eine kostengünstige, betriebsfreundliche und ergebnissichere experimentelle Plattform für wissenschaftliche Forscher, um verwandte mikrobielle Forschung durchzuführen.
Einleitung
Die mikrobielle Kultivierung ist eine wichtige Grundlage für die mikrobiologische wissenschaftliche Forschung und industrielle Anwendungen, die bei der Isolierung, Identifizierung, Rekonstruktion, dem Screening und der Evolution von Mikroorganismen weit verbreitet ist 1,2,3. Herkömmliche mikrobielle Kultivierungsmethoden verwenden hauptsächlich Reagenzgläser, Schüttelkolben und feste Platten als Kultivierungsbehälter, kombiniert mit Schüttelinkubatoren, Spektralphotometern, Mikroplattenlesern und anderen Geräten für die mikrobielle Kultivierung, Detektion und das Screening. Diese Methoden haben jedoch viele Probleme, wie umständliche Operationen, geringen Durchsatz, geringe Effizienz und großen Verbrauch von Arbeit und Reagenzien. Die in den letzten Jahren entwickelten Hochdurchsatz-Anbaumethoden basieren hauptsächlich auf der Mikrotiterplatte. Aber die Mikrotiterplatte hat einen geringen Gehalt an gelöstem Sauerstoff, eine schlechte Mischeigenschaft und eine starke Verdampfung und thermische Wirkung, die oft zu einem schlechten Wachstumsstatus und einer Experimentparallelisierung von Mikroorganismen führen 4,5,6,7; Auf der anderen Seite muss es mit teuren Geräten wie Liquid-Handling-Arbeitsplätzen und Mikroplattenlesern ausgestattet werden, um eine automatisierte Kultivierung und Prozesserkennung zu erreichen 8,9.
Als wichtiger Zweig der mikrofluidischen Technologie wurde die Tröpfchenmikrofluidik in den letzten Jahren auf der Grundlage traditioneller mikrofluidischer Systeme mit kontinuierlicher Strömung entwickelt. Es ist eine diskrete mikrofluidische Technologie, die zwei nicht mischbare flüssige Phasen (normalerweise Öl-Wasser) verwendet, um dispergierte Mikrotröpfchen zu erzeugen und an ihnenzu arbeiten 10. Da Mikrotröpfchen die Eigenschaften eines kleinen Volumens, einer großen spezifischen Oberfläche, einer hohen internen Stoffaustauschrate und keiner Kreuzkontamination durch Kompartimentierung sowie die Vorteile einer starken Kontrollierbarkeit und eines hohen Durchsatzes von Tröpfchen aufweisen, gab es viele Arten von Forschungen, die die Tröpfchenmikrofluidik-Technologie in der Hochdurchsatzkultivierung, dem Screening und der Evolution von Mikroorganismen anwenden11 . Es gibt jedoch immer noch eine Reihe von Schlüsselfragen, um die mikrofluidische Tröpfchentechnologie populär und weit verbreitet zu machen. Erstens ist die Bedienung der Tröpfchenmikrofluidik umständlich und kompliziert, was zu hohen technischen Anforderungen an die Bediener führt. Zweitens kombiniert die Tröpfchenmikrofluidik-Technologie optische, mechanische und elektrische Komponenten und muss mit biotechnologischen Anwendungsszenarien in Verbindung gebracht werden. Es ist schwierig für ein einzelnes Labor oder Team, effiziente mikrofluidische Tröpfchenkontrollsysteme zu bauen, wenn es keine multidisziplinäre Zusammenarbeit gibt. Drittens ist es aufgrund des geringen Volumens an Mikrotröpfchen (von Picolitor (pL) bis Mikroliter (μL)) sehr schwierig, die präzise automatisierte Steuerung und Echtzeit-Online-Erkennung von Tröpfchen für einige grundlegende mikrobielle Operationen wie Subkultivierung, Sortierung und Probenahme zu realisieren, und es ist auch schwierig, ein integriertes Ausrüstungssystemzu konstruieren 12.
Um die oben genannten Probleme anzugehen, wurde erfolgreich ein automatisches mikrobielles Tröpfchenkultursystem (MMC) entwickelt, das auf der Tröpfchenmikrofluidik-Technologie13 basiert. Das MMC besteht aus vier Funktionsmodulen: einem Tröpfchenerkennungsmodul, einem Tröpfchenspektrum-Detektionsmodul, einem mikrofluidischen Chipmodul und einem Probenahmemodul. Durch die Systemintegration und Steuerung aller Module wird ein automatisiertes Betriebssystem einschließlich der Erzeugung, Kultivierung, Messung (optische Dichte (OD) und Fluoreszenz), Spaltung, Fusion und Sortierung von Tröpfchen genau etabliert, wodurch die Integration von Funktionen wie Impfung, Kultivierung, Überwachung, Subkultivierung, Sortierung und Probenahme erreicht wird, die für den Prozess der mikrobiellen Tröpfchenkultivierung erforderlich sind. MMC kann bis zu 200 Replikat-Tröpfchen-Kultivierungseinheiten mit einem Volumen von 2-3 μL aufnehmen, was 200 Schüttelkolben-Anbaueinheiten entspricht. Das Mikrotröpfchen-Kultivierungssystem kann die Anforderungen an Nichtkontamination, gelösten Sauerstoff, Vermischung und Massen-Energie-Austausch während des Wachstums von Mikroorganismen erfüllen und die verschiedenen Anforderungen der mikrobiellen Forschung durch mehrere integrierte Funktionen erfüllen, z. B. Wachstumskurvenmessung, adaptive Evolution, Einzelfaktor-Mehrebenenanalyse und Metabolitenforschung und -analyse (basierend auf Fluoreszenzdetektion)13,14.
Hier stellt das Protokoll vor, wie die MMC verwendet werden kann, um automatisierte und mikrobielle Kultivierung und adaptive Evolution im Detail durchzuführen (Abbildung 1). Wir nahmen den Wildtyp-Escherichia coli (E. coli) MG1655 als Beispiel, um die Messung der Wachstumskurve zu demonstrieren, und einen methanolessentiellen E. coli-Stamm MeSV2.215, um die adaptive Entwicklung in MMC zu demonstrieren. Für MMC wurde eine Bediensoftware entwickelt, die die Bedienung sehr einfach und übersichtlich macht. Während des gesamten Prozesses muss der Benutzer die anfängliche Bakterienlösung vorbereiten, die Bedingungen der MMC festlegen und dann die Bakterienlösung und die zugehörigen Reagenzien in die MMC injizieren. Anschließend führt die MMC automatisch Operationen wie Tröpfchengenerierung, Erkennung und Nummerierung, Kultivierung und adaptive Evolution durch. Es wird auch eine Online-Detektion (OD und Fluoreszenz) der Tröpfchen mit hoher Zeitauflösung durchführen und die zugehörigen Daten (die exportiert werden können) in der Software anzeigen. Der Bediener kann den Kultivierungsprozess je nach den Ergebnissen jederzeit stoppen und die Zieltröpfchen für nachfolgende Experimente extrahieren. Die MMC ist einfach zu bedienen, verbraucht weniger Arbeit und Reagenzien und verfügt über einen relativ hohen experimentellen Durchsatz und eine gute Datenparallelität, was im Vergleich zu herkömmlichen Anbaumethoden erhebliche Vorteile hat. Es bietet eine kostengünstige, betriebsfreundliche und robuste experimentelle Plattform für Forscher, um verwandte mikrobielle Forschung durchzuführen.
Protokoll
1. Geräte- und Softwareinstallation
- Wählen Sie eine saubere und sterile Umgebung (z. B. eine saubere Bank) als dedizierten permanenten Raum für MMC. Installieren Sie die MMC stetig im Raum.
HINWEIS: Halten Sie die MMC von der Interferenz starker elektrischer Felder, Magnetfelder und starker Wärmestrahlungsquellen fern. Vermeiden Sie starke Vibrationen, die die optischen Detektionskomponenten beeinträchtigen. Stellen Sie die Stromversorgung von AC220 V, 50 HZ für die MMC bereit. Weitere Informationen zu MMC finden Sie in der Materialtabelle und auf der Website von MMC16. - Installieren Sie die Betriebssoftware aus der MMC.zip Datei
Hinweis: Wenden Sie sich an die Autoren der MMC.zip-Datei.- Erstellen Sie einen dedizierten Ordner und speichern Sie die ZIP-Datei darin.
- Erstellen Sie einen weiteren dedizierten Ordner als "Installationsverzeichnis". Entpacken Sie die MMC.zip und speichern Sie die Dateien im neuen Ordner.
HINWEIS: Die Computerkonfiguration ist am besten zu erfüllen: (1) Windows 7 64-Bit-Betriebssystem oder höher; (2) CPU: i5 oder höher; (3) Speicher: 4 GB oder mehr; (4) Festplatte: 300 GB oder mehr (Drehzahl größer als 7200 U/min oder Solid-State-Festplatte).
2. Vorbereitungen
- Schließen Sie die Spritzennadel (Innendurchmesser 0,41 mm und der Außendurchmesser 0,71 mm), den Schnellverbinder A und die Reagenzflasche (Abbildung 2C) an und autoklavieren Sie sie bei 121 °C für 15 min.
HINWEIS: Schrauben Sie die Kappe der Reagenzflasche während der Sterilisation leicht ab. Ein paar weitere Reagenzflaschen können jedes Mal für den Gebrauch vorbereitet werden. - Verwenden Sie einen 0,22 μm Polyvinylidenfluorid (PVDF)-Filter, um MMC-Öl zu filtern. Legen Sie den Mikrofluidikchip (Abbildung 2B) und das MMC-Öl im Voraus in die Reinbank und sterilisieren Sie sie 30 Minuten lang durch ultraviolette Bestrahlung vor dem Gebrauch.
HINWEIS: Details zu Schnellverbinder A, Reagenzflasche, MMC-Öl und Mikrofluidik-Chip finden Sie in der Materialtabelle. - Installieren Sie den Mikrofluidik-Chip
- Öffnen Sie die Tür der Operationskammer (Abbildung 2A), und heben Sie die optische Fasersonde an.
- Richten Sie die elektrischen Feldlöcher mit den elektrischen Feldnadeln aus und legen Sie den Chip vorsichtig auf den Chipsockel. Setzen Sie dann die beiden Positionierungssäulen in die Positionierungslöcher ein und legen Sie die optische Fasersonde ab (Abbildung 2D).
- Verbinden Sie den Schnellverbinder A am Chip entsprechend der Positionsnummer (C5-O5, C4-O4, C6-O6, C2-O2, CF-OF, C1-O1, C3-O3) mit dem entsprechenden Port der MMC. Schließen Sie dann die Tür der Operationskammer.
- Füllen Sie das MMC-Öl (auf ca. 80 ml) in der Ölflasche auf und entleeren Sie die Abfallflüssigkeit in der Abfallflasche vor dem Gebrauch.
HINWEIS: Die Abfallflüssigkeit ist in der Regel organischer Abfall. Bitte beachten Sie bei der Entsorgung die Landesgesetze und -verordnungen, Änderungen aufgrund des Versuchsaufbaus vorbehalten.
3. Wachstumskurvenmessung in MMC
- Vorbereitung für die anfängliche bakterielle Lösung
- Befolgen Sie die entsprechenden Standardvorschriften, um Luria-Bertani (LB) Medium vorzubereiten und bei 121 ° C für 15 Minuten zu autoklavieren.
HINWEIS: Bestandteile von LB-Medium: NaCl (10 g/L), Hefeextrakt (5 g/L) und Trypton (10 g/L). - Nehmen Sie den E. coli MG1655 Stamm aus Glycerinmaterial heraus und kultivieren Sie ihn in einem 50 ml Schüttelkolben mit 10 mL LB-Medium in einem Schüttelinkubator (200 U/min) bei 37 °C für 5-8 h.
HINWEIS: Die Kultivierungszeit hängt von den spezifischen Sorten ab. Es ist optimal, die Belastung bis zur logarithmischen Periode/Phase zu kultivieren. - Die kultivierte E. coli MG1655-Lösung wird mit frischem Medium auf ein OD600 von 0,05-0,1 verdünnt, um eine anfängliche Bakterienlösung zu erhalten (etwa 10 ml herstellen).
- Befolgen Sie die entsprechenden Standardvorschriften, um Luria-Bertani (LB) Medium vorzubereiten und bei 121 ° C für 15 Minuten zu autoklavieren.
- Klicken Sie auf Initialisierung , um die MMC zu initialisieren. Nachdem die Initialisierungsschnittstelle angezeigt wird, stellen Sie die Kultivierungstemperatur auf 37 °C und den photoelektrischen Signalwert auf 0,6 ein (Abbildung 3A). Die Initialisierung dauert ca. 20 Minuten.
- Schalten Sie die UV-Lampe (Wellenlänge 254 nm) während der Initialisierung ein.
- Injizieren Sie die anfängliche Bakterienlösung und das MMC-Öl in die Reagenzflasche.
- Nehmen Sie eine sterilisierte Reagenzflasche auf der sauberen Bank heraus und ziehen Sie die Kappe fest.
- Verwenden Sie eine sterile 10-ml-Spritze, um 3-5 ml MMC-Öl aus der Spritzennadel des Seitenrohrs zu injizieren. Kippen und drehen Sie die Reagenzflasche langsam, damit das Öl vollständig in die Innenwand eindringt.
- Injizieren Sie etwa 5 ml anfängliche Bakterienlösung und füllen Sie dann die Reagenzflasche, indem Sie erneut 5-7 ml des Öls injizieren.
- Ziehen Sie den unabhängigen Schnellverbinder A heraus, und setzen Sie den Schnellverbinder A der Reagenzflasche in den Schnellverbinder B ein, um die Probeninjektion abzuschließen (Abbildung 4A).
- Warten Sie, bis die Initialisierung beendet ist, und schalten Sie dann die UV-Lampe (Wellenlänge 254 nm) aus.
- Öffnen Sie die Tür der Operationskammer und legen Sie die Reagenzflasche in das Metallbad.
- Ziehen Sie den C2-Stecker des Chips und den Schnellverbinder A der Reagenzflasche heraus. Schließen Sie den Seitenrohranschluss der Reagenzflasche an den C2-Stecker und den oberen Rohranschluss an den O2-Anschluss an. Schließen Sie dann die Tür der Operationskammer.
- Klicken Sie auf Wachstumskurve , um die Funktion der Wachstumskurvenmessung auszuwählen (Abbildung 3A). Geben Sie in der Schnittstelle zur Parametrierung die Zahl als 15 ein, schalten Sie den OD-Erkennungsschalter ein und stellen Sie die Wellenlänge auf 600 nm ein. Klicken Sie auf Start , um die Droplet-Generierung zu starten. Es dauert ca. 10 min.
HINWEIS: Hier bezieht sich Zahl auf die Anzahl der zu erzeugenden Tröpfchen. Die Wellenlänge bezieht sich auf die Wellenlänge des zu erfassenden OD. Stellen Sie die Anzahl (maximal 200) und die Wellenlänge (350-800 nm) entsprechend den Experimentanforderungen ein. - Wenn auf der Hauptoberfläche ein Popup-Fenster mit der Aufforderung: "Entfernen Sie die Reagenzflasche zwischen C2 und O2, dann klicken Sie bitte nach Abschluss auf die Schaltfläche OK" angezeigt wird, öffnen Sie die Tür der Operationskammer, um die Reagenzflasche herauszunehmen und die C2- und O2-Anschlüsse anzuschließen.
- Schließen Sie die Tür und klicken Sie im Popup-Fenster auf die Schaltfläche OK, um die Tröpfchen automatisch zu kultivieren und die OD-Werte zu erkennen.
HINWEIS: Die MMC erkennt den OD-Wert, wenn der Tropfen die Glasfasersonde passiert. Daher hängt die Nachweisdauer von der Anzahl der erzeugten Tröpfchen ab. - Wenn die Wachstumskurve die stationäre Phase erreicht, klicken Sie auf die Schaltfläche Datenexport , um die OD-Daten zu exportieren. Wählen Sie den Datenspeicherpfad aus und exportieren Sie den während des Anbauzeitraums erfassten OD-Wert im .csv-Format, der von entsprechender Software (z.B. Microsoft Excel) geöffnet werden kann. Verwenden Sie dann eine Mapping-Software (z. B. EXCEL und Origin 9.0), um die Wachstumskurve darzustellen.
HINWEIS: Während des Kultivierungsprozesses ist es jederzeit möglich, auf den Datenexport zu klicken, um die OD-Daten aller aktuellen Tröpfchen zu exportieren.
4. Adaptive Entwicklung in MMC
- Vorbereitung für die anfängliche bakterielle Lösung
- Befolgen Sie die entsprechenden Standardvorschriften, um das spezielle flüssige Medium und die festen Platten für die MeSV2.2 vorzubereiten und bei 121 °C für 15 min zu autoklavieren.
HINWEIS: Für die Komponenten des Spezialmediums siehe Tabelle 1 und die Materialtabelle. - Kultivieren Sie die MeSV2.2 mit der festen Platte (Durchmesser = 90 mm) in einem 37 °C Konstanttemperatur-Inkubator für 72 h. Dann pflücken Sie eine unabhängige Kolonie und kultivieren Sie sie in einem 50 ml Schüttelkolben mit 10 ml des speziellen flüssigen Mediums in einem Schüttelinkubator (200 U / min) bei 37 ° C für 72 h.
- Verdünnen Sie die kultivierte MeSV2.2-Lösung mit dem Medium auf einen OD600 von 0,1-0,2 (stellen Sie sicher, dass das Gesamtvolumen nicht weniger als 10 ml beträgt) und kultivieren Sie es im Schüttelkolben für 5 h weiter, um die anfängliche Bakterienlösung zu erhalten.
HINWEIS: Der MeSV2.2 ist ein Methanol-essentieller E. coli-Stamm. Das spezielle flüssige Medium enthält 500 mmol/L Methanol, was eine starke Belastung für MeSV2.2 darstellt, was zu einem sehr langsamen Wachstum führt. Beachten Sie, dass sich der Erhalt der anfänglichen Bakterienlösung hier von der in Schritt 3.1 beschriebenen unterscheidet.
- Befolgen Sie die entsprechenden Standardvorschriften, um das spezielle flüssige Medium und die festen Platten für die MeSV2.2 vorzubereiten und bei 121 °C für 15 min zu autoklavieren.
- Initialisieren Sie die MMC wie in den Schritten 3.2, 3.3 und 3.5 erläutert.
- Nehmen Sie zwei sterilisierte Reagenzflaschen heraus, von denen eine für die anfängliche Bakterienlösung und die andere für das frische Medium bestimmt ist. Injizieren Sie die anfängliche Bakterienlösung (5 ml), das frische Medium (12-15 ml) und das MMC-Öl in die Reagenzflaschen, wie in Schritt 3.4 erläutert.
HINWEIS: Da die adaptive Evolution ein langfristiger Prozess ist, an dem mehrere Teilkulturen beteiligt sind, lagern Sie so viel frisches Medium wie möglich in MMC. Das Medium kann während des laufenden Experiments nicht wieder aufgefüllt werden. - Installieren Sie die beiden Reagenzflaschen in MMC, wie in Schritt 3.6 erläutert. Installieren Sie die eine für die anfängliche Bakterienlösung zwischen dem C2- und O2-Steckverbinder und die andere für das frische Medium zwischen dem C4- und O4-Stecker.
- Klicken Sie auf ALE , um die Funktion der adaptiven Evolution auszuwählen (Abbildung 3B). Schalten Sie in der Parametrierschnittstelle den Schalter OD-Erkennung ein.
- Legen Sie die Zahl auf 50, die Wellenlänge auf 600 nm, die Konzentration auf 0%, den Typ auf die Zeit, den Parameter auf 30 h und die Wiederholungen auf 99 fest. Klicken Sie auf Start, um die Droplet-Generierung zu starten. Es dauert ca. 25 min.
HINWEIS: Hier bezieht sich "Konzentration" auf die maximale Konzentration chemischer Faktoren für die adaptive Evolution. Für verschiedene Tröpfchen ist es in MMC realisierbar, unterschiedliche Konzentrationen chemischer Faktoren einzuführen, um unterschiedliche Wachstumsbedingungen zu schaffen. Berechnen Sie die eingeführten Konzentrationen mit der folgenden Gleichung:
Hier bezieht sich "C" auf die Konzentration chemischer Faktoren, die in Tröpfchen eingebracht werden; "a" bezieht sich auf die Konzentration chemischer Faktoren in den Reagenzflaschen zwischen dem C4- und O4-Verbinder; "b" bezieht sich auf die Konzentration chemischer Faktoren in den Reagenzflaschen zwischen dem C6- und O6-Verbinder; und "i" bezieht sich auf die verfügbare Konzentration. In MMC stehen acht Konzentrationen zur Verfügung. Da der chemische Faktor hier eine einzige Konzentration (500 mmol/L Methanol) hat und einer der Inhaltsstoffe des Mediums ist, wird hier nur eine Reagenzflasche mit dem chemischen Faktor installiert, und die Konzentration wird auf 0% festgelegt. Typ bezieht sich auf den Modus der Subkultivierung, der in drei Typen unterteilt ist: Zeitmodus, OD-Wertmodus und Fluoreszenzmodus. Ersteres bedeutet, die Tröpfchen für eine bestimmte Zeit zu kultivieren und dann zu subkultivieren, während die beiden letzteren bedeuten, die Tröpfchen zu einem vordefinierten OD-Wert / Fluoreszenzintensität zu kultivieren und dann zu subkultivieren. Parameter bezieht sich auf den zugehörigen Parameter , der bei der Auswahl eines Teilkultivierungsmodus erforderlich ist. Wiederholungen beziehen sich auf die Anzahl der Teilkultivierungen. - Entfernen Sie die Reagenzflasche, die zwischen dem C2- und dem O2-Anschluss platziert ist, wie in Schritt 3.8 erläutert.
- Beobachten Sie, ob die maximalen OD-Werte der Tröpfchen während jeder Teilkultivierungsperiode signifikant gestiegen sind. Wenn die Erhöhung auftritt und die Testanforderungen erfüllt, klicken Sie auf die Schaltfläche Datenexport , um die OD-Daten wie in Schritt 3.9 beschrieben zu exportieren.
HINWEIS: Hier hängt der Teilanbauzeitraum vom Parameter ab. Wenn Sie beispielsweise Typ als Zeit und Parameter als 30 h festlegen, beträgt der Subkultivierungszeitraum 30 h. Während jeder Teilkultivierungsperiode gibt es die maximalen OD-Werte der Tröpfchen. Schätzen Sie, ob die adaptive Evolution die experimentellen Anforderungen durch die Erhöhung der maximalen OD-Werte erfüllt (Die Zunahme hängt vom tatsächlichen Kultivierungsprozess der Sorte ab, z. B. um mehr als 20% erhöht).
ACHTUNG: Achten Sie darauf, ob das gespeicherte frische Medium erschöpft ist. Wenn der signifikante Anstieg auch nach Erschöpfung des Mediums nicht eingetreten ist, extrahieren Sie die besser wachsenden Tröpfchen und führen Sie eine neue Runde der adaptiven Evolution durch. - Extrahieren Sie die Zieltröpfchen aus der MMC.
- Klicken Sie auf die Schaltfläche Screening, um die Funktion der Tröpfchenextraktion auszuwählen (Abbildung 3C). Wählen Sie die Option Sammeln, klicken Sie auf die Anzahl der Zieltröpfchen und klicken Sie dann auf OK.
HINWEIS: Das Tröpfchenscreening umfasst "Collect", "Discard" und "Extract seed solution". "Extraktsamenlösung" bedeutet, die verbleibenden Tröpfchen13 nach dem Teilanbauvorgang zu sammeln. - Warten Sie, bis das Popup-Fenster aufgefordert wird: "Bitte ziehen Sie den CF-Schnellverbinder heraus und stecken Sie ihn in den EP-Schlauch ein". Stecken Sie den CF-Schnellverbinder zur Abholung gemäß der Software-Eingabeaufforderung in das Mikrozentrifugenröhrchen und klicken Sie dann auf OK (Abbildung 4D).
- Nach 1-2 Minuten öffnet die Softwareoberfläche ein neues Fenster mit der Aufforderung: "Bitte setzen Sie den Stecker wieder ein und klicken Sie auf OK, wenn Sie fertig sind". Setzen Sie dann den CF-Schnellverbinder wieder ein und klicken Sie auf OK, damit MMC weiterhin ausgeführt wird (Abbildung 4D). Wenn das nächste Zieltröpfchen die Tröpfchenerkennungsstelle erreicht, wiederholen Sie 4.9.2-4.9.3, um es zu sammeln.
HINWEIS: Nachdem alle Zieltröpfchen gesammelt wurden, wird die MMC die verbleibenden Tröpfchen weiter kultivieren. Wenn der Anbau nicht notwendig ist, klicken Sie auf Stopp, um den Vorgang direkt zu beenden. - Extrahieren Sie das Tröpfchen mit einer 2,5 μL Pipette, lassen Sie es auf die 90 mm Agaroseplatte fallen und verteilen Sie es gleichmäßig mit einem dreieckigen Glasstreustab mit einer Seitenlänge von 3 cm. Dann kultivieren Sie es in einem 37 °C Konstanttemperatur-Inkubator für 72 h.
- Pflücken Sie 3-5 unabhängige Kolonien und kultivieren Sie sie separat in den 50 ml Schüttelkolben mit 10 ml frischem Medium in einem Schüttelinkubator (200 U / min) bei 37 ° C für 48-72 h. Befolgen Sie die entsprechenden Standardvorschriften, um die kultivierte Bakterienlösung für nachfolgende Experimente im Glycerinröhrchen zu lagern.
- Klicken Sie auf die Schaltfläche Screening, um die Funktion der Tröpfchenextraktion auszuwählen (Abbildung 3C). Wählen Sie die Option Sammeln, klicken Sie auf die Anzahl der Zieltröpfchen und klicken Sie dann auf OK.
5. Reinigung der MMC
- Klicken Sie nach Abschluss des Experiments auf Stopp , um alle Vorgänge zu stoppen. Klicken Sie dann auf Reinigen , um den Chip und die Rohre zu reinigen. Es dauert ca. 15 min.
Ergebnisse
Dieses Protokoll verwendet E. coli MG1655 und einen MeSV2.2-Stamm als Beispiele, um die mikrobielle Kultivierung und die methanolessentielle adaptive Evolution mit einer automatisierten und relativ hohen Durchsatzstrategie in MMC zu demonstrieren. Die Messung der Wachstumskurve wurde hauptsächlich zur Charakterisierung der mikrobiellen Kultivierung verwendet. Die adaptive Evolution wurde durch automatisierte kontinuierliche Subkultivierung und Zugabe einer hohen Konzentration von Methanol als Selektionsdruck während jeder Subkultivierung durchgeführt. Ob eine adaptive Evolution realisiert worden war, wurde durch den Variationstrend des maximalen OD-Wertes der Tröpfchen während jeder Teilkultivierungsperiode geschätzt. Die abstimmbaren Parameter und Genauigkeitsparameter von MMC sind in Tabelle 2 dargestellt.
Ergebnisse der Wachstumskurvenmessung
Die OD600-Werte der 15 Tröpfchen, die während des Kultivierungsprozesses entdeckt wurden, wurden nach einer Kultivierung von etwa 20 h aus der MMC exportiert (Abbildung 5A). Es kann beobachtet werden, dass der Nachweis etwa alle 14 Minuten durchgeführt wurde. Diese Nachweisdauer hängt von der Anzahl der erzeugten Tröpfchen ab, da die Tröpfchen in den Röhrchen für die Kultivierung hin und her gezirkelt werden und das Detektionsmodul die OD-Werte (die Erkennung und Berechnung des OD-Wertes sind in Ergänzungsabbildung 1 dargestellt) nur erkennt, wenn die Tröpfchen die Lichtwellenleitersonde passieren. Daher sind die 14 Minuten eine sehr kurze Nachweisdauer, die einen Nachweisprozess mit hoher Zeitauflösung bietet, um das Wachstum von Mikroorganismen genauer widerzuspiegeln.
Nach den exportierten Daten wurden die durchschnittlichen OD600-Werte und die Standardabweichung (SD) von 15 Tröpfchen zu jedem Zeitpunkt berechnet und die Wachstumskurve von E. coli MG1655 dargestellt (Abbildung 5B). Die Ergebnisse zeigen, dass die Wachstumskurve eine "S" -Form aufweist, einschließlich Verzögerungsphase, logarithmischer Phase und stationärer Phase, die sehr konsistent mit dem klassischen mikrobiellen Wachstumsmodell ist. Gleichzeitig sind die Standardabweichungen von 15 Tröpfchen sehr gering, was auf eine gute Wachstumskonsistenz und Parallelität hinweist. Damit demonstriert es die gute mikrobielle Kultivierungs- und Detektionsleistung von MMC. Darüber hinaus wurde auch nachgewiesen, dass es während des Anbaus wenig Übersprechen zwischen Tröpfchen gibt (Ergänzende Abbildung 2 und Ergänzende Tabelle 1).
Ergebnisse der adaptiven Evolution
Wir haben eine langfristige adaptive Evolution von MeSV2.2 in MMC durchgeführt. Am 18. Tag, entsprechend dem zunehmenden Trend der maximalen OD600-Werte der Tröpfchen während jeder Teilkultivierungsperiode aus den Wachstumskurven, die auf der Softwareoberfläche angezeigt werden, glaubten wir, dass eine gute adaptive Entwicklung in den 50 Tröpfchen erreichtwurde. Die OD600-Daten wurden exportiert und 8 Tröpfchen (einschließlich Tröpfchen 6) mit relativ guter Wachstumsleistungextrahiert 13. Abbildung 6A zeigt die Wachstumskurven von 50 Tröpfchen im gesamten adaptiven Evolutionsprozess. In 18 Tagen hat MMC automatisch 13 Teilkultivierungsvorgänge durchgeführt. Aus Abbildung 6A geht hervor, dass MeSV2.2 zuerst langsam und danach schnell wächst, was auf die Spur der adaptiven Evolution in MeSV2.2 hinweist. Um einen Selektionsdruck zu liefern, wurde das Methanol dem MeSV2.2-Medium zugegeben. Anfangs hemmte Methanol das Zellwachstum. Nach der adaptiven Evolution hatten die angereicherten Zellen, die an Methanol angepasst waren, eine höhere Wachstumsrate. Die Wachstumskurve von Tropfen 6 im gesamten adaptiven Evolutionsprozess wurde separat dargestellt (Abbildung 6B). Die maximalen OD600-Werte in der ersten Generation und der letzten Teilanbauperiode betrugen 0,37 bzw. 0,58, was einem Anstieg um 56,8% entspricht. Es deutet darauf hin, dass die Belastung in Tropfen 6 eine offensichtliche adaptive Entwicklung erreicht hat.
Anschließend wurden die Tröpfchensorte 6 und die Anfangssorte in Schüttelkolben kultiviert und ihre Wachstumskurven verglichen (Abbildung 6C). Nach den in der Literatur 17,18 angegebenen Methoden wurden die maximalen spezifischen Wachstumsraten (μmax) des Tröpfchenstamms 6 und der Anfangsdehnung berechnet, die 0,096 h-1 bzw. 0,072 h-1 betrugen. Abbildung 6C zeigt, dass der Tropfenstamm 6 eine höhere maximale spezifische Wachstumsrate (Anstieg um 54,8%) und eine höhere Zellkonzentration in der stationären Phase (um 20,0%) aufwies als der Anfangsstamm, wenn er in Schüttelkolben kultiviert wurde, was weiter darauf hindeutete, dass die adaptive Evolution in MeSV2.2 realisiert wurde.
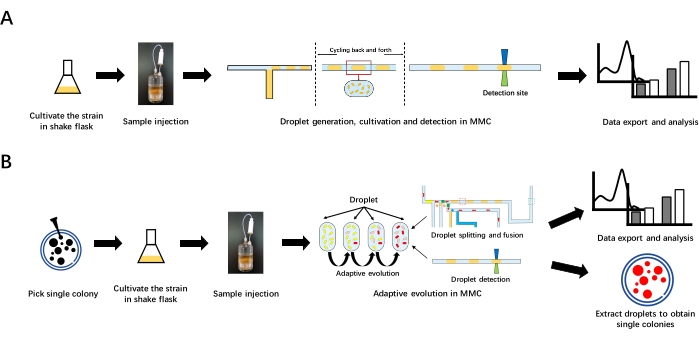
Abbildung 1: Gesamtablauf der Wachstumskurvenmessung und adaptiven Entwicklung in MMC. (A) Messung der Wachstumskurve in MMC. Kultivieren Sie zunächst den Stamm in einem Schüttelkolben, um die anfängliche bakterielle Lösung vorzubereiten. Injizieren Sie dann die anfängliche Bakterienlösung in die Reagenzflasche. Generieren Sie als Nächstes die Tröpfchen in MMC. MMC lässt die Tröpfchen im mikrofluidischen Chip und in den Röhren hin und her wechseln, um sie zu kultivieren. Wenn Tröpfchen die Erkennungsstelle passieren, werden die OD-Daten erkannt und aufgezeichnet. Exportieren Sie schließlich die Daten zur Analyse. (B) Adaptive Entwicklung in MMC. Pflücken Sie eine einzelne Kolonie aus der Agaroseplatte und kultivieren Sie sie in einem Schüttelkolben, um die anfängliche Bakterienlösung zuzubereiten. Nachdem Sie die anfängliche Bakterienlösung in die Reagenzflasche injiziert haben, führen Sie die adaptive Evolution in MMC durch. Adaptive Evolution beinhaltet eine kontinuierliche Subkultivierung, die automatisch durch Tröpfchenspaltung und Fusion betrieben werden kann. Exportieren Sie nach der adaptiven Entwicklung die Daten zur Analyse. Zieltröpfchen können extrahiert und dann auf dem Teller verteilt werden, um einzelne Kolonien zu erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Aufbau und wesentliche Werkzeuge von MMC. (A) Außen- und Betriebskammer der MMC. (B) Der mikrofluidische Chip von MMC. Der Chip verfügt über sieben Kanäle (C1-C6 und CF). (C) Reagenzflasche. Es hat ein Oberrohr und ein Seitenrohr. Bevor die Probe in die Reagenzflasche injiziert wird, muss zuerst eine Spritzennadel an einen Schnellverbinder A und dann der Schnellverbinder A an das Seitenrohr angeschlossen werden. (D) Einbau des Mikrofluidik-Chips. Der Mikrofluidik-Chip ist auf dem Sockel installiert. Dann werden die sieben Kanäle (C1-C6 und CF) jeweils an die entsprechenden Ports von MMC (O1-O6 und OF) angeschlossen.
1 - Operationskammer der MMC.
2 - Ölflasche mit dem MMC-Öl.
3 - Abfallflasche zum Sammeln von Abfallflüssigkeit.
4 - UV-Lampe (Wellenlänge 254 nm) zur Sterilisation. Diese Lampe kann im Voraus eingeschaltet werden, um den Chip und die Schläuche zu sterilisieren.
5 - Laser (620 nm) zur Tröpfchenerkennung. Der Punkt, an dem der Laser auf den Chip bestrahlt wird, ist die Tröpfchenerkennungsstelle.
6 - Temperaturfühler zur Messung der Temperatur in der Operationskammer.
7 - Heizung für die Operationskammer. Es kann verwendet werden, um die Temperatur der mikrobiellen Kultivierung aufrechtzuerhalten. Der Temperaturbereich, der eingestellt werden kann, beträgt 25 ± 0,5 °C bis 40 ± 0,5 °C.
8 - Glasfasersonde zur Messung der OD oder Fluoreszenz von Tröpfchen.
9 - Chip-Sockel zur Installation des Mikrofluidik-Chips.
10 - Metallbad, um die Reagenzflaschen zu fixieren und sie zu erhitzen, um die Temperatur eines Reagenzes schnell auf die Temperatur der mikrobiellen Kultivierung zu erhöhen.
11 - Anschlüsse für den Mikrofluidikchip (O1-O6 und OF). Der Mikrofluidik-Chip ist über diese Ports mit der MMC verbunden.
12 - Röhrchen für die Lagerung und Kultivierung von Tröpfchen.
13 - Magnetblöcke zur schnellen Lokalisierung des Mikrofluidik-Chips während der Installation.
14 - Spritzennadel, um die Proben in die Reagenzflaschen zu injizieren. Sein Innendurchmesser beträgt 0,41 mm und sein Außendurchmesser 0,71 mm.
15 - Schnellverbinder A. Verbinden Sie sich mit Schnellverbinder B.
16 - Schnellverbinder B. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
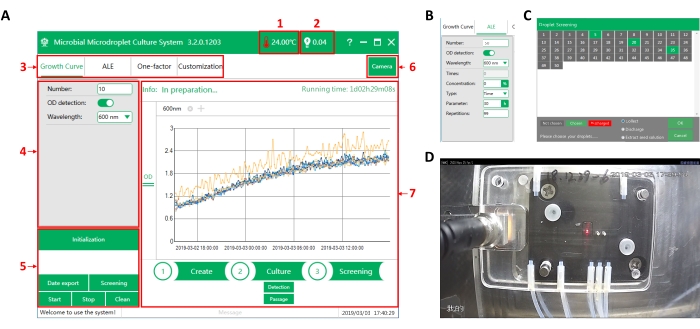
Abbildung 3: Bediensoftwareschnittstelle von MMC. (A) Die Hauptschnittstelle der Software. (1) Temperatur in der Operationskammer. (2) Optoelektronischer Signalwert der Tröpfchenerkennung. Wenn der Tropfen passiert, ist der Signalwert hoch (>2 V). Wenn das Öl passiert, ist der Signalwert niedrig (<1 V). (3) Funktionsauswahl. Es stehen vier Funktionen zur Auswahl: Wachstumskurvenmessung (Wachstumskurve), adaptive Laborentwicklung (ALE), Einfaktor-Mehrebenenanalyse (Ein-Faktor) und Anpassung der Operationen an experimentelle Anforderungen (Customization). (4) Schnittstelle zur Parametrierung. Setzen Sie hier die entsprechenden experimentellen Parameter nach Auswahl einer Funktion. (5) Befehlsausführungsbereich. (6) Schalter der Kamera. Die Kamera ist direkt über dem Chip installiert, mit dem die Tröpfchen im Chip online beobachtet werden können. (7) Prozessanzeigebereich. Zeigt die Laufzeit, Überwachungsdaten und den auszuführenden Vorgang an. (B) Die Parametereinstellungsschnittstelle der adaptiven Evolution. (C) Die Tröpfchen-Screening-Schnittstelle. Die MMC kann die Tröpfchen automatisch nummerieren. Hier können die Zieltröpfchen ausgewählt und aus der MMC extrahiert werden. (D) Kamerabeobachtungsschnittstelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Probeninjektion, Tröpfchenerzeugung und Tröpfchenextraktion. (A) Die Reagenzflasche nach der Injektion von Bakterienlösung und MMC-Öl. Sowohl die Bakterienlösung als auch das MMC-Öl werden aus dem Seitenrohr injiziert. Die Ölphase befindet sich in der oberen Schicht und die Bakterienlösung in der unteren Schicht. Schließen Sie nach der Einspritzung die Schnellverbinder A und B an, und installieren Sie sie dann in der MMC. (B) Tröpfchenerzeugung im Mikrofluidikchip. Um die Sichtbarkeit von Tröpfchen zu verbessern, wurde eine rote Pigmentlösung verwendet, um den Prozess der Tröpfchenerzeugung zu demonstrieren. C) Tröpfchen, das in dem mit dem Mikroskop beobachteten Röhrchen gelagert wird. Skalierungsbalken: 400 μm. (D) Popup-Fensteraufforderungen und die entsprechenden Operationen. Wenn die Aufforderung "Bitte ziehen Sie den CF-Schnellverbinder heraus und stecken Sie ihn in das EP-Rohr" angezeigt wird, ziehen Sie den CF-Stecker heraus und stecken Sie ihn in das EP-Rohr, um den Zieltropfen aufzunehmen. Wenn die Eingabeaufforderung "Please insert the connector back" angezeigt wird, die Dropletsammlung abgeschlossen ist, setzen Sie den CF-Stecker wieder in den OF-Port ein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Datenexport und Abbildung der Wachstumskurve. (A) Screenshot eines Teils der exportierten Daten. Die exportierten Daten umfassen jeden Erkennungszeitpunkt der 15 erzeugten Tröpfchen und die entsprechenden OD600-Werte. (B) Wachstumskurve von E. coli MG1655, dargestellt auf der Grundlage der exportierten Daten. Berechnen Sie die durchschnittlichen OD600-Werte und die Standardabweichung (SD) von 15 Tröpfchen zu jedem Zeitpunkt und zeichnen Sie die Wachstumskurve auf. Es ist klar zu sehen, dass diese Wachstumskurve die Lag-Phase, die logarithmische Phase und die stationäre Phase umfasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
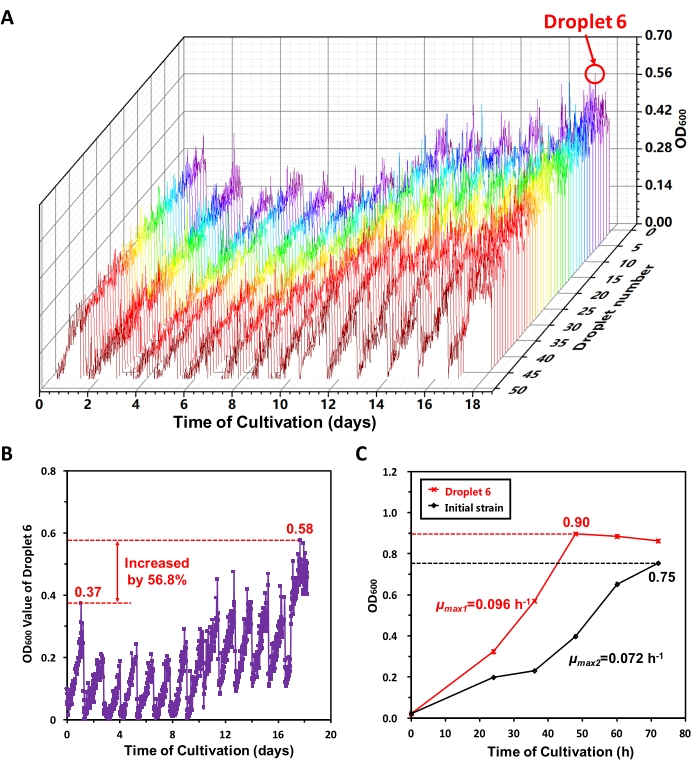
Abbildung 6: Ergebnisse der adaptiven Entwicklung von MeSV2.2 in MMC. (A) Wachstumskurven von 50 Tröpfchen während des gesamten adaptiven Evolutionsprozesses. Die OD 600-Erkennungsdaten von 50 Tröpfchen während des18-tägigen adaptiven Evolutionsprozesses wurden aus der MMC exportiert und aufgetragen. Am 18. Tag wurden 8 Tröpfchen, darunter Tröpfchen 6, extrahiert. (B) Wachstumskurve des Tröpfchens 6 im gesamten adaptiven Evolutionsprozess. Die maximalen OD600-Werte in der ersten Generation und der letzten Teilanbauperiode betrugen 0,37 bzw. 0,58, was einem Anstieg um 56,8% entspricht. (C) Vergleich der Tropfensorte 6 und der Anfangsdehnung im Schüttelkolben. Der Stamm von Tropfen 6 und der Anfangsstamm wurden in Schüttelkolben kultiviert, und die Wachstumskurven (einschließlich SD, n = 3) wurden gemessen. Diese Figur wurde von Jian X. J. et al.13 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Komponenten | Konzentration |
| Na2HPO4·12H2O | 6,78 g/l |
| KH2PO4 | 3 g/l |
| NaCl | 0,5 g/l |
| NH4Cl | 1 g/l |
| Vitamin B1 (durch Filtration sterilisiert) | 0,34 g/l |
| MgSO4·7H2O | 0,049 g/l |
| CaCl2·2H2O | 1,5 mg/l |
| Mikroelemente: | |
| FeCl3·6H2O | 0,5 mg/l |
| ZnSO4·7H2O | 0,09 mg/l |
| CuSO4·5H2O | 0,088 mg/l |
| MnCl2 | 0,045 mg/l |
| CoCl2·6H2O | 0,09 mg/l |
| Gluconat | 1,09 g/l |
| Methanol | 500 mmol/l |
| Isopropyl-β-D-Thiogalactopyranosid | 0,1 mmol/l |
| Streptomycinsulfat | 20 μg/ml |
| Kanamycinsulfat | 50 μg/ml |
| Fügen Sie zusätzliche 15 g / L Agarose hinzu, um festes Medium herzustellen. | |
Tabelle 1: Komponenten des Spezialmediums für MeSV2.2.
| Abstimmbare Parameter | |
| Parameter | Bereich |
| Temperatur des Anbaus | 25–40 °C ± 0,5 °C |
| Anzahl der Tröpfchen | 0–200 |
| Konzentration von Inokulum | 13.3–86.7 % |
| Konzentration des chemischen Faktors | 8 verschiedene Konzentrationen, bis zur maximalen Konzentration des gespeicherten chemischen Faktors |
| Die Zeit der Subkultivierung | Bis zum Anwender |
| Die Anzahl der Teilkulturen | Bis zum Anwender |
| Wellenlänge der OD-Detektion | 350–800 nm |
| Wellenlänge der Fluoreszenzdetektion | Anregung: 470, 528 nm Emission: 350–800 nm |
| Genauigkeitsparameter | |
| Parameter | C.V. |
| Volumen der Tröpfchen | 1.88% |
| Konzentration von Inokulum | <5,0 % |
Tabelle 2: Abstimmbare Parameter und Genauigkeitsparameter von MMC. Abstimmbare Parameter beziehen sich auf die Parameter, die entsprechend den spezifischen Anforderungen der Benutzer angepasst werden können; Genauigkeitsparameter beziehen sich auf die Parameter, die die Genauigkeit und Reproduzierbarkeit der verschiedenen fluidischen Operationen widerspiegeln.
Ergänzende Abbildung 1: Erkennung und Detektion von Tröpfchen in MMC. (A) Die Wellenform eines Tröpfchens in MMC. Diese Wellenform stammt aus den spektralen Rohdaten des MMC-Spektrometers. Nach der Verarbeitung der spektralen Rohdaten im Hintergrund gibt MMC den gemessenen OD-Wert an. (B) OD-Berechnung von Tröpfchen in MMC. In der Wellenform des Tröpfchens steht "a" für die maximale Länge des Tröpfchens, "c" für die bogenförmige Grenzfläche, die durch Ölphase und Wasserphase gebildet wird, und "b" für den Hauptteil des Tröpfchens. Basierend auf dem Lambert-Beer-Gesetz wird der OD-Wert des Tropfens nach folgender Formel berechnet: OD-Wert = lg(E/D) × 10. "E" bezieht sich auf den durchschnittlichen spektralen Signalwert der Ölphase; "D" bezieht sich auf den durchschnittlichen spektralen Signalwert des Hauptteils b des Tröpfchens. Es ist zu beachten, dass sich der von MMC gemessene OD-Wert von dem eines Spektralphotometers unterscheidet. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Test des Übersprechens zwischen den Tröpfchen. Um zu überprüfen, ob es während der Langzeitkultivierung zu Übersprechen zwischen den Tröpfchen kommt, wurde die E. coli MG1655-Lösung auf eine sehr niedrige Konzentration (gemäß Poisson-Verteilung, λ = 0,1) verdünnt und dann 200 Tröpfchen erzeugt und für 5 Tage kultiviert. Nach der Messung des OD wurde festgestellt, dass der E. coli MG1655 in einer kleinen Anzahl von Tröpfchen wuchs. Und es gab fast kein bakterielles Wachstum in den Tröpfchen um diese Tröpfchen. Das Ergebnis zeigt auch vorläufig, dass es wenig Übersprechen zwischen Tröpfchen gibt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Stabilität der Tröpfchenerzeugung in MMC. Wie in Ergänzende Abbildung 1 gezeigt, hat der Tropfen eine feste Wellenform. Das Spektrometer von MMC erzeugt eine bestimmte Anzahl von Datenpunkten pro Sekunde, so dass die Anzahl der Datenpunkte der Tröpfchenwellenform die Größe des Tröpfchens widerspiegeln kann. Die rote Farbstofflösung wurde verwendet, um 397 Tröpfchen in der MMC zu erzeugen, und der OD-Wert wurde gemessen. Die Spektralrohdaten wurden exportiert, die Datenpunkte jeder Tröpfchenwellenform gezählt und der Variationskoeffizient (C.V) der Tröpfchendatenpunkte berechnet. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2: Tröpfchenverdampfung in MMC. Hier wurde die rote Farbstofflösung verwendet, um Tröpfchen in der MMC zu erzeugen und die Tröpfchen wurden im Kultivierungsröhrchen gespeichert. Das Rohr wurde dann 30 Tage lang in einen Inkubator mit einer konstanten Temperatur von 37 ° C gegeben und die Tröpfchenlänge wurde regelmäßig gemessen (Fotos unter dem Mikroskop aufnehmen und die Länge mit einer Skalierungsleiste messen). Es zeigt, dass das Volumen des Tröpfchens nach 30 Tagen um etwa 12,3% reduziert wurde, was darauf hindeutet, dass die Verdunstung des Tröpfchens in MMC sehr gering ist. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Dieses Protokoll zeigt, wie das mikrobielle Tröpfchenkultursystem (MMC) verwendet werden kann, um eine automatisierte mikrobielle Kultivierung und langfristige adaptive Evolution durchzuführen. MMC ist ein miniaturisiertes, automatisiertes und mikrobielles Hochdurchsatz-Kultivierungssystem. Im Vergleich zu herkömmlichen mikrobiellen Hochdurchsatz-Kultivierungsmethoden und -instrumenten bietet MMC viele Vorteile wie geringen Arbeits- und Reagenzverbrauch, einfache Bedienung, Online-Detektion (OD und Fluoreszenz), hochzeitauflösende Datenerfassung und überlegene Parallelisierung. MMC hat auch einige besondere Vorteile, die sich von der herkömmlichen Tröpfchenmikrofluidik-Technologie unterscheiden, die normalerweise die pL- und nL-Tröpfchen verwendet. Die meisten zuvor berichteten Systeme, die pL- und nL-Tröpfchen verwendeten, haben eine schlechte Kultivierungsleistung und wenige nachweisbare Parameter (normalerweise nur Fluoreszenz)18,19,20,21. Obwohl es einige Plattformen gibt, die eine bessere Kultivierungsleistung und die Erkennung mehrerer Parameter erreichen können, ist dies schwierig und erfordert viel Aufwand. Zum Beispiel berichteten einige Forscher über den OD-Nachweis von pL-Tröpfchen. Es basiert auf der Bilderkennung, die nicht nur Fehlalarme aufweist, sondern auch eine weitere Überprüfung der Genauigkeiterfordert 22. MMC kann dies jedoch auf relativ einfache Weise erreichen. MMC verwendet Mikroliter (μL) Tröpfchen, die selten gemeldet werden. Die überlegene mikrobielle Kultivierungsleistung von MMC wurde verifiziert und kann auch OD und Fluoreszenz direkt nachweisen. Aufgrund des großen Volumens der μL-Tröpfchen ist die Tröpfchenerzeugung weniger störanfällig, was eine höhere Stabilität aufweist. In der Zwischenzeit können vielfältigere Operationen in den Mikrolitertröpfchen durchgeführt werden, was der Realisierung automatisierter Operationen förderlich ist. Da es sich bei den Tröpfchen um Einschließungsräume handelt, kann außerdem die Flüchtigkeit des Inhalts unterdrückt werden (Ergänzende Tabelle 2), was für die Durchführung der langfristigen mikrobiellen Kultivierung und adaptiven Evolution förderlich ist, wenn flüchtige Substanzen im Medium14 vorhanden sind. Dies ist in Schüttelkolben und Mikrotiterplatten nur schwer zu erreichen.
Bestimmte kritische Punkte im Protokoll sind es jedoch wert, hervorgehoben zu werden. Zunächst ist zu beachten, dass sich der von MMC gemessene OD-Wert von dem eines Spektralphotometers unterscheidet, da sich die optischen Weglängen der OD-Messung unterscheiden (1 mm bzw. 10 mm). Daher ist es beim Vergleich des OD-Wertes von MMC mit dem von Schüttelkolben notwendig, die Kalibrierkurve13 zu messen. Glücklicherweise erfordert der adaptive Evolutionsprozess keine Kalibrierkurven, da wir uns auf die relativen Trends zwischen den Wachstumskurven konzentrieren. Als nächstes werden bestimmte Mikroorganismen in MMC nicht kultiviert. Die Tröpfchen sind auf die Oberflächenspannung der Öl-Wasser-Grenzfläche angewiesen, um die Stabilitätaufrechtzuerhalten 23. Wenn die Mikroorganismen bestimmte Substanzen produzieren, die die Oberflächenspannung der Öl-Wasser-Grenzfläche stören, wie z. B. einige Bacillus subtilis-Stämme , die Tenside produzieren24, können die Tröpfchen die Stabilität nicht aufrechterhalten. Wenn das Medium selbst ein Hindernis für die Erzeugung von Tröpfchen darstellt, ist es nicht möglich, in MMC verwendet zu werden, beispielsweise in einem sehr viskosen Medium oder Medium, das große Partikel enthält. Zu den Arten, die wir in MMC erfolgreich kultiviert haben, gehören derzeit E. coli, Lactobacillus plantarum, Corynebacterium glutamicum, Hefen, Methylobacterium extorquens, Aspergillus oryzae, Mikroalgen und so weiter. Es wird empfohlen, die Sorte in MMC für Vorversuche zu kultivieren. Schließlich müssen die Anschlüsse und Ports zwischen dem Chip, der Reagenzflasche und der MMC in strikter Übereinstimmung mit dem Protokoll verbunden werden. Andernfalls kann die Bakterienlösung in die MMC fließen und das Innere kontaminieren. Darüber hinaus muss darauf hingewiesen werden, dass der aktuelle Durchsatz von MMC aufgrund der Zeit, die für den Betrieb der Subkultivierung benötigt wird, begrenzt ist (0-200). In Zukunft werden wir die Steuerungssoftware und die Größe des Chips optimieren, um die Zeit zu verkürzen und den Durchsatz zu verbessern. Da es sich bei MMC um ein modulares System handelt, müssen nur zugehörige Teile oder Software ausgetauscht werden, ohne dass neue Geräte erforderlich sind.
Gegenwärtig kann MMC nicht nur Wachstumskurvenmessungen, adaptive Laborentwicklung und Ein-Faktor-Mehrebenenanalysen durchführen, sondern auch verwendet werden, um verschiedene Tröpfchenbetriebsverfahren an die experimentellen Anforderungen anzupassen. In Zukunft ist es notwendig, die Anwendungsfunktionen des MMC-Systems als Reaktion auf die unterschiedlichen Bedürfnisse der mikrobiellen Forschung weiter zu bereichern, wie z.B. die Durchführung der mehrstufigen orthogonalen Multi-Level-Experimente, die automatische Probenahmetechnologie für mehrere Proben zur gleichzeitigen Messung der Wachstumskurven mehrerer Bakterienarten und die genaue Erkennung und Kontrolle weiterer Parameter (z. B. gelöster Sauerstoff (DO) und pH-Wert). Gleichzeitig ist es auch notwendig, mehr Funktionen im Bereich der Mikrobiologie zu entwickeln, um MMC auf praktischere Szenarien anzuwenden, wie z.B. die Optimierung von Medienzusammensetzungen, die Bestimmung der minimalen inhibitorischen Konzentration (MIC), die gemeinsame Kultivierung von Mikroorganismen25 usw.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde vom National Key Research and Development Program of China (2018YFA0901500), dem National Key Scientific Instrument and Equipment Project der National Natural Science Foundation of China (21627812) und dem Tsinghua University Initiative Scientific Research Program (20161080108) unterstützt. Wir danken auch Prof. Julia A. Vorholt (Institut für Mikrobiologie, Departement Biologie, ETH Zürich, Zürich 8093, Schweiz) für die Bereitstellung des methanolessentiellen E. coli-Stammes Version 2.2 (MeSV2.2).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 μm PVDF filter membrane | Merck Millipore Ltd. | SLGPR33RB | Sterilize the MMC oil |
| 4 °C refrigerator | Haier | BCD-289BSW | For reagent storage |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| CaCl2·2H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20011160 | Component of the special medium for MeSV2.2. |
| Clean bench | Beijing Donglian Har Instrument Manufacture Co., Ltd. | DL-CJ-INDII | For aseptic operation and UV sterilization |
| CoCl2·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10007216 | Component of the special medium for MeSV2.2. |
| Computer | Lenovo | E450 | Software installation and MMC control |
| Constant temperature incubator | Shanghai qixin scientific instrument co., LTD | LRH 250 | For the microbial cultivation using solid medium |
| CuSO4·5H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10008218 | Component of the special medium for MeSV2.2. |
| Electronic balance | OHAUS | AR 3130 | For reagent weighing |
| EP tube | Thermo Fisher | 1.5 mL | For droplet collection |
| FeCl3·6H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10011928 | Component of the special medium for MeSV2.2. |
| Freezing Tube | Thermo Fisher | 2.0 mL | For strain preservation |
| Gluconate | Sigma-Aldrich | S2054 | Component of the special medium for MeSV2.2. |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| High-Pressure Steam Sterilization Pot | SANYO Electric | MLS3020 | For autoclaved sterilization |
| isopropyl-β-d-thiogalactopyranoside (IPTG) | Biotopped | 420322 | Component of the special medium for MeSV2.2. |
| Kanamycin sulfate | Solarbio | K8020 | Component of the special medium for MeSV2.2. |
| KH2PO4 | MACKLIN | P815661 | Component of the special medium for MeSV2.2. |
| Methanol | MACKLIN | M813895 | Component of the special medium for MeSV2.2. |
| MgSO4·7H2O | BIOBYING | 1305715 | Component of the special medium for MeSV2.2. |
| Microbial Microdroplet Culture System (MMC) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-I | Performing growth curve determination and adaptive evolution. Please refer to http://www.tmaxtree.com/en/index.php?v=news&id=110 |
| Microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-ALE-OD | For various droplet operations. Please refer to http://www.tmaxtree.com/en/ |
| MMC oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-M/S-OD | The oil phase for droplet microfluidics. Please refer to http://www.tmaxtree.com/en/ |
| MnCl2 | Sinopharm Chemical Reagent Beijing Co., Ltd. | 20026118 | Component of the special medium for MeSV2.2. |
| NaCl | GENERAL-REAGENT | G81793J | Component of the LB medium |
| Na2HPO4·12H2O | GENERAL-REAGENT | G10267B | Component of the special medium for MeSV2.2. |
| NH4Cl | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10001518 | Component of the special medium for MeSV2.2. |
| Petri dish | Corning Incorporated | 90 mm | For the preparation of solid medium |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Quick connector A | Luoyang TMAXTREE Biotechnology Co., Ltd. | — | For the connection of each joint. Please refer to http://www.tmaxtree.com/en/ |
| Reagent bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MMC-PCB | Sampling and storage of bacteria solution and reagents. Please refer to http://www.tmaxtree.com/en/ |
| Shake flask | Union-Biotech | 50 mL | For microbial cultivation |
| Shaking incubator | Shanghai Sukun Industrial Co., Ltd. | SKY-210 2B | For the microbial cultivation in shake flask |
| Streptomycin sulfate | Solarbio | S8290 | Component of the special medium for MeSV2.2. |
| Syringe | JIANGSU ZHIYU MEDICAL INSTRUCTMENT CO., LTD | 10 mL | Draw liquid and inject it into the reagent bottle |
| Syringe needle | OUBEL Hardware Store | 22G | Inner diameter is 0.41 mm and outer diameter is 0.71 mm. |
| Tryptone | Oxoid Ltd. | LP0042 | Component of the LB medium |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
| UV–Vis spectrophotometer | General Electric Company | Ultrospec 3100 pro | For the measurement of OD values |
| Vitamin B1 | Solarbio | SV8080 | Component of the special medium for MeSV2.2. |
| Yeast extract | Oxoid Ltd. | LP0021 | Component of the LB medium |
| ZnSO4·7H2O | Sinopharm Chemical Reagent Beijing Co., Ltd. | 10024018 | Component of the special medium for MeSV2.2. |
Referenzen
- Lewis, W. H., et al. Innovations to culturing the uncultured microbial majority. Nature Reviews Microbiology. 19 (4), 225-240 (2020).
- Feist, A. M., Herrgard, M. J., Thiele, I., Reed, J. L., Palsson, B. O. Reconstruction of biochemical networks in microorganisms. Nature Reviews Microbiology. 7 (2), 129-143 (2009).
- Zeng, W. Z., Guo, L. K., Xu, S., Chen, J., Zhou, J. W. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Kim, J., Shin, H., et al. Microbiota analysis for the optimization of Campylobacter isolation from chicken carcasses using selective media. Frontiers in Microbiology. 10, 1381 (2019).
- Doig, S. D., Pickering, S. C. R., Lye, G. J., Woodley, J. M. The use of microscale processing technologies for quantification of biocatalytic Baeyer-Villiger oxidation kinetics. Biotechnology and Bioengineering. 80 (1), 42-49 (2002).
- Harms, P., et al. Design and performance of a 24-station high throughput microbioreactor. Biotechnology and Bioengineering. 93 (1), 6-13 (2006).
- Chen, A., Chitta, R., Chang, D., Anianullah, A. Twenty-four well plate miniature bioreactor system as a scale-down model for cell culture process development. Biotechnology and Bioengineering. 102 (1), 148-160 (2009).
- Huber, R., et al. Robo-Lector - a novel platform for automated high-throughput cultivations in microtiter plates with high information content. Microbial Cell Factories. 8, 788-791 (2009).
- Hasegawa, T., et al. High-throughput method for a kinetics analysis of the high-pressure inactivation of microorganisms using microplates. Journal of Bioscience and Bioengineering. 113 (6), 788-791 (2012).
- Teh, S. Y., Lin, R., Hung, L. H., Lee, A. P. Droplet microfluidics. Lab on a Chip. 8 (2), 198-220 (2008).
- Kaminski, T. S., Scheler, O., Garstecki, P. Droplet microfluidics for microbiology: techniques, applications and challenges. Lab on a Chip. 16 (12), 2168-2187 (2016).
- Liao, P. Y., Huang, Y. Y. Divide and conquer: analytical chemistry of nucleic acids in droplets. Scientia Sinica Chimica. 50 (10), 1439-1448 (2020).
- Jian, X. J., et al. Microbial microdroplet culture system (MMC): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnology and Bioengineering. 117 (6), 1724-1737 (2020).
- Wang, J., Jian, X. J., Xing, X. H., Zhang, C., Fei, Q. Empowering a methanol-dependent Escherichia coli via adaptive evolution using a high-throughput microbial microdroplet culture system. Frontiers in Bioengineering and Biotechnology. 8, 570 (2020).
- Meyer, F., et al. Methanol-essential growth of Escherichia coli. Nature Communications. 9, 1508 (2018).
- Grünberger, A., et al. Beyond growth rate 0.6: Corynebacterium glutamicum cultivated in highly diluted environments. Biotechnology and Bioengineering. 110 (1), 220-228 (2013).
- Kaganovitch, E., et al. Microbial single-cell analysis in picoliter-sized batch cultivation chambers. New Biotechnology. 47, 50-59 (2018).
- Baraban, L., et al. Millifluidic droplet analyser for microbiology. Lab on a Chip. 11 (23), 4057-4062 (2011).
- Jakiela, S., Kaminski, T. S., Cybulski, O., Weibel, D. B., Garstecki, P. Bacterial growth and adaptation in microdroplet chemostats. Angewandte Chemie International Edition. 52 (34), 8908-8911 (2013).
- Cedillo-Alcantar, D. F., Han, Y. D., Choi, J., Garcia-Cordero, J. L., Revzin, A. Automated droplet-based microfluidic platform for multiplexed analysis of biochemical markers in small volumes. Analytical Chemistry. 91 (8), 5133-5141 (2019).
- Watterson, W. J., et al. Droplet-based high-throughput cultivation for accurate screening of antibiotic resistant gut microbes. eLife. 9, 56998 (2020).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Nitschke, M., Pastore, G. M. Production and properties of a surfactant obtained from Bacillus subtilis grown on cassava wastewater. Bioresource Technology. 97 (2), 336-341 (2006).
- Jiang, Y. J., et al. Recent advances of biofuels and biochemicals production from sustainable resources using co-cultivation systems. Biotechnology for Biofuels. 12, 155 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten