Method Article
대만의 코호트 효과를 추정하기 위해 가중 회귀 모델을 사용한 간세포 암종 사망률 예측(Forecasting Hepatocellular Carcinoma Mortality using a Weighted Regression Model to Estimate Cohort Effects in Taiwan)
요약
연령 데이터로 코호트 효과를 측정하는 다단계 방법을 묘사하여 데이터 품질을 희생하지 않고 많은 상황에서 데이터를 제거할 수 있습니다. 이 프로토콜은 전략을 보여주고 간세포 암종 데이터를 분석하기 위한 가중 회귀 모델을 제공합니다.
초록
연령 주기 분할표 데이터에서 연령과 기간의 영향을 제거하기 위해 다단계 방법을 채택하여 코호트 효과를 평가했습니다. 간에서 가장 흔한 원발성 악성종양은 간세포암종(HCC)이다. 간세포암은 간경변과 알코올 및 바이러스 병인과 관련이 있습니다. 역학에서는 간암 사망률의 장기 추세를 연령-기간-코호트(APC) 모델을 사용하여 기술(또는 예측)했습니다. 간세포암 사망률은 가중 영향도에 따라 각 코호트에 대해 결정되었다. 가중 평균의 신뢰 구간(CI)은 (동일 가중 추정치와 비교하여) 상당히 좁습니다. CI가 상당히 좁고 불확실성이 적기 때문에 가중 평균 추정이 예측 수단으로 사용되었습니다. 다단계 방법을 사용하는 경우, 회귀 모델을 기반으로 한 가중 평균 추정을 사용하여 연령-기간 분할표 데이터의 코호트 효과를 평가하는 것이 좋습니다.
서문
간에서 가장 흔한 원발성 악성 종양은 간세포암종(HCC)입니다. 사망률은 전 세계 모든 악성 종 양 중 남성 에서 5위, 여성에서 8위(남성 6%, 여성 3%)1입니다. 대만에서는 남성에게 가장 흔한 암이며 여성에게 두 번째로 흔한 암이다(남성 21.8%, 여성 14.2 %)2. 2000년 이후 전 세계적으로 연간 진단된 간세포암 환자 수는 564,000명으로 추산되며, 이 중 남성은 398,000명, 여성은 166,000명이다 3. 역학에서 연령, 기간 및 코호트(APC) 변수 간의 관계를 설명하는 가장 일반적인 방법은 연령과 기간이 서로 영향을 미쳐 조사된 질병 추세에 대한 고유한 세대 경험을 생성한다는 것입니다.
이 개념화는 여전히 연령 + 코호트 = 기간의 정확한 선형 연결을 가지고 있지만, 노출(예측 변수)은 출생 코호트의 고유한 요소가 아닙니다. 대신, 우리는 변화가 질병의 다른 분포를 야기할 때 코호트 효과가 있다고 제안합니다. 그럼에도 불구하고 연령 + 코호트 = 기간이므로 이 세 변수는 선형적으로 관련되어 있습니다. 다른 제한이 적용되는 경우에만 연령, 기간 및 코호트의 선형 효과를 사용하여 추정된 APC(Age-Period-Cohort) 모델을 생성할 수 없습니다. 이 연구에서는 이 문제와 이전 출판물 4,5,6,7에서 부과한 잠재적 제한 사항을 명확히 했습니다.
분할표 데이터에 대한 약간의 추측과 함께 다단계 방법 8 은 코호트 효과를 평가하기 위한 세 단계를 제공합니다. 또한 median polish는 특정 분포나 프레임워크에 의존하지 않기 때문에 ratios, logarithmic ratios, counts 등 다양한 유형의 데이터에 사용되었습니다. 중간 연마는 다상 방법에 사용되는 주요 기술입니다.
양방향 분할표 9 의 데이터를 사용하여 연마된 중앙값의 전개를 생성했습니다. median polishing 절차는 각 행과 각 열에서 중앙값을 반복적으로 빼서 age(즉, 행)와 마침표(즉, column)의 누적 효과를 제거하는 데 사용됩니다. 이 절차는 역학 데이터 분석 10에 자주 사용된다. 이 기술의 한 가지 장점은 양방향 분할표에 있는 데이터의 분포 또는 구조에 대한 가정이 필요하지 않다는 것입니다. 따라서 이 기술은 자살 데이터 11과 같이 테이블에 포함된 모든 유형의 데이터에 광범위하게 사용되었습니다. APC 모델은 질병 발병률 또는 사망률의 장기적인 추세를 설명하기 위해서도 사용되어 왔다 5. APC 모델은 종종 연령, 기간 및 코호트가 질병/사망률의 로그 변환에 부가적인 영향을 미친다고 가정합니다. 코호트 효과를 평가하기 위해 설명된 프로토콜은 가중 회귀를 사용하여 완전한 간세포 암종(HCC) 사망률 분석을 위한 APC 모델을 생성함으로써 신뢰할 수 있는 예측과 치료 효과에 대한 중간 정도의 평가를 지원합니다.
프로토콜
1. 데이터 소스
계산을 입증하기 위해 1976년부터 2015년까지 대만 남성과 여성의 간암 사망률에 대한 연간 데이터를 사용했다. 본 연구의 프로토콜을 실행하기 위해 Windows 및 Microsoft Excel용 SPSS(Statistical Package for Social Sciences) 버전 24.0을 사용했습니다.
- 간세포암 의사가 환자의 임상 증상, 실험실 검사 및 의료 영상 결과를 분류하여 국제 질병 분류(ICD) 코드, ICD 150에 따라 진단 코드를 제공하도록 합니다.
- 데이터 파일(CSV로 저장됨)에 연도(즉, 기간), 연령, 코호트, 사망 수, 중반 인구 수 및 사망률이 열로 포함되어 있는지 확인합니다.
- File(파일) | 데이터 가져오기 | CSV 데이터 | 열기. Read variable names from the first row of the data(데이터의 첫 번째 행에서 변수 이름 읽기) 옆의 상자에 확인 표시가 선택되어 있는지 확인하고 OK(확인)를 클릭합니다. 데이터 파일을 SPSS로 가져왔는지 확인하십시오.
- SPSS를 통해 연령-기간 그룹별로 교차하는 분할표 데이터를 구성합니다. 일반적으로 행 변수는 age로, 열 변수는 period로 정의했습니다. 데이터가 단일 기간 연도(또는 단일 연령 연도) 데이터를 포함하는 경우 이를 기간 그룹(또는 연령 그룹)으로 통합해야 했습니다. 그런 다음, 설문조사 연도에 걸쳐 특정 연령대에 대한 태도를 교차 분석했습니다.
- Analyze(분석) | 기술 통계량 | 크로스탭을 클릭하고 row(s) 옆의 상자에서 연령 변수를 선택하고 column(s) 옆의 상자에서 기간 변수를 선택합니다. Cells(셀)를 클릭하고 Observed(관찰됨) 옆의 상자에 확인 표시가 있는지 확인합니다. 사망자 수(또는 연중 인구 수 또는 사망률)의 분할표는 위의 단계를 통해 SPSS에서 수행할 수 있습니다.
- 다른 소프트웨어를 통해 분석하기 위해 CSV 형식으로 입력된 분할표 데이터를 내보냅니다. File(파일) | 데이터 내보내기 | 원하는 데이터 형식을 CSV로 확인 | 위치. 이 편집할 수 없는 필드에는 내보낸 파일의 안전한 위치가 표시됩니다.
- 파일 이름: 선택을 클릭하여 파일 이름을 변경합니다.
- 형식으로 내보내기: 드롭다운 메뉴에서 CSV 파일 형식을 선택합니다. 변수를 클릭하여 사용 가능한 변수를 표시하고 변수 테이블을 선택합니다. 기본적으로 소스 데이터 세트의 모든 변수는 내보낸 파일에 대해 유지됩니다. 연구자는 테이블을 사용하여 내보낸 파일에 포함할 소스 변수를 지정할 수 있습니다. 내보내기를 클릭합니다.
2. 모델 설정
참고: 다단계 방법은 Keys와 Li 8 이 그래픽 조사를 통해 제안했습니다. 연령과 기간의 누적 효과를 제거하기 위해 중앙값 광택 분석이 수행되었습니다. 마지막으로, 선형 회귀 모델의 코호트 범주에서 중간 광택 단계의 이러한 잔차를 회귀 분석하고 분할표의 데이터를 사용하여 코호트 효과를 평가했습니다.
- 첫 번째 단계로서의 그래픽 표현
- 연령 그룹과 기간 그룹의 선 플롯을 만듭니다. 연령 그룹 또는 출생 코호트에 걸쳐 출생 코호트를 검사하려면 꺾은선형 차트에 연령 또는 주기에 걸쳐 출생 코호트를 그립니다.
- 분할표 사망률 데이터가 포함된 CSV 파일을 가져옵니다. File(파일) | 열기 | 폴더에서 CSV 파일을 찾아 선택합니다. 파일 이름 상자 옆에 있는 드롭다운 목록에서 모든 파일을 선택하는 것을 잊지 마십시오.
- 열기를 클릭하여 CSV 파일을 엽니다. 사망률 비상 데이터의 행과 열을 강조 표시하고 Insert(삽입) | 차트 | 선 그래프.
- 두 번째 단계로서의 중간 광택 분석
- 각 행과 각 열에서 중앙값을 반복적으로 빼서 연령과 기간의 누적 효과를 제거합니다. 중앙값 마무리 단계 후에는 코호트 효과를 평가하기 위해 회귀 분석 절차의 잔차를 유지합니다.
- 전체 중앙값 및 잔차 테이블을 계산합니다. 분할표 사망률 데이터가 포함된 CSV 파일을 가져옵니다(2.1.1.2 참조).
- LN은 분할표 사망률 데이터의 각 셀에 대해 사용되었습니다. Click Formulas(수식) | 수학 및 삼각법 함수를 선택하고 LN을 선택합니다.
- 번호: 각 셀의 위치 레이블을 입력합니다. 분할표 사망률 데이터의 각 셀이 LN을 사용했는지 확인합니다. Click Formulas(수식) | 더 많은 기능 | 통계를 선택하고 MEDIAN을 선택합니다.
- 번호1: 첫 번째 셀 위치 레이블을 입력합니다.
- 번호2: 마지막 셀 위치 레이블을 입력합니다. 결과 중앙값이 분할표의 왼쪽 위 여백에 저장되어 있는지 확인합니다. 원래 값(즉, LN 사망률 데이터)과 전체 중앙값 간의 차이를 취하여 잔차 테이블이 생성되었는지 확인합니다.
- 행 중앙값(즉, 각 연령 그룹의 중앙값)을 계산하고 응답 연령 그룹에 대한 행 중앙값을 계산했는지 확인합니다. Click Formulas(수식) | 더 많은 기능 | 통계 | 중앙값을 선택합니다.
- 번호 1: 원시 샘플의 첫 번째 셀 위치 레이블을 입력합니다.
- 번호 2: 원료의 마지막 셀 위치 레이블을 입력합니다. 결과 행 중앙값이 분할표의 왼쪽 여백에 저장되어 있는지 확인합니다.
- 행 중앙값에서 뺀 후 새 잔차 테이블을 만듭니다. 행 중위수에서 새 잔차 값 집합이 생성되었는지 확인하고, 여기서 각 셀은 해당 행의 각 반응 변수에서 행 중위수의 빼기 값을 사용합니다. =를 클릭하고 각 행의 전체 셀 위치 레이블이 왼쪽 여백 중앙값의 레이블을 뺀 지 확인합니다.
- 열 중앙값(즉, 각 기간 그룹의 중앙값)을 계산하고 응답 기간 그룹에 대한 열 중앙값을 계산하는지 확인합니다. Click Formulas(수식) | 더 많은 기능 | 통계 | 중앙값을 선택합니다.
- 숫자 1: 열의 첫 번째 셀 위치 레이블을 입력합니다. 번호 2: 열의 마지막 셀 위치 레이블을 입력합니다. 결과 열 중앙값이 분할표의 위쪽 여백에 저장되어 있는지 확인합니다.
- 열 중앙값에서 뺀 후 새 잔차 테이블을 만듭니다. 열 중앙값에서 새로운 잔차 값 집합이 생성되었는지 확인하고, 여기서 각 셀은 해당 열의 각 반응 변수에서 열 중앙값의 뺀 값을 사용합니다. =를 클릭하고 각 열의 전체 셀 위치 레이블이 위쪽 여백 중앙값의 레이블을 뺀 지 확인합니다.
- 행과 열 중앙값이 0에 근접할 때까지 2.1.2.7에서 2.1.2.10까지의 단계를 반복합니다. Click Formulas(수식) | 더 많은 기능 | 통계 | 중앙값을 선택합니다. 행과 열 중앙값이 거의 0인지 확인합니다. 최종 잔차 테이블을 CSV 형식으로 저장합니다.
- 가중치를 세 번째 단계로 사용하는 회귀 프로시저
참고: 종속 변수를 각 코호트에 대한 잔차로 계산했으며 사망 수를 가중치로 계산했습니다. 다음으로, 코호트 효과를 계산하기 위해 선형 회귀를 실행했습니다.- Excel 용 Kutools가 설치되어 있는지 확인하고 테이블 차원 전치 도구를 사용하여 크로스 테이블을 플랫 목록으로 빠르게 변환하십시오. 분할표 잔여 데이터가 포함된 CSV 파일을 가져옵니다(2.1.2.11 참조).
- 목록으로 변환할 테이블을 선택합니다. 클릭 Kutools | 수정 | 테이블 차원을 전치합니다. 테이블 차원 전치 대화 상자에서 크로스 테이블 목록 옆의 상자에 확인 표시가 있는지 확인하고 결과 범위를 선택하여 잔차를 목록 형식으로 저장합니다.
- 초기 데이터 파일(1.2 참조)에 잔여 목록 형식 데이터(2.1.3.1 참조)와 함께 열을 삽입합니다. 잔여 목록 형식 데이터에 지원 열을 삽입했는지 확인합니다(2.1.3.1 참조). = age & period variables(연령 및 기간 변수)를 클릭하고 Enter(입력)를 클릭합니다. 지원 열을 사용하여 잔차 목록 형식 데이터의 연령 및 기간 그룹 레이블을 조회하고 초기 데이터 파일에 응답 잔여 열을 삽입합니다(1.2 참조).
- Click Formulas(수식) | 조회 및 참조 | VLOOKUP을 선택합니다. VLOOKUP(기간의 셀 위치 레이블 및 기간의 셀 위치 레이블, 지원 열의 첫 번째 셀 위치 레이블: 잔여 열의 마지막 셀 위치 레이블, 4, 0)을 설정합니다. 선택 범위에 지원 열, 연령, 기간 및 잔여 열(즉, 잔여 목록으로 4번째 열)이 포함되어 있는지 확인합니다.
- 잔차가 초기 데이터 파일(1.2 참조)에 삽입되었는지 확인하고 다음 단계를 위해 잔차 목록 형식 데이터(2.1.3.1 참조)를 찾습니다. 가중치가 적용되지 않은 최소 제곱으로 회귀 모델을 적합하고 잔차를 분석합니다.
- Analyze(분석) | 회귀 분석 | 선형. 독립 변수인 코호트 범주(즉, 17개의 출생 코호트)를 독립 변수(Independent(s), 상자로, 종속 변수인 잔차(Residuals)를 종속(Dependent): 상자로 옮깁니다. 확인을 클릭합니다. 가중치가 적용되지 않은 코호트 효과의 결과를 생성하도록 합니다.
- 잔차가 초기 Excel 데이터 파일(1.2 참조)에 삽입되었는지 확인하고 다음 단계에서 잔차 목록 형식 데이터(2.1.3.1 참조)를 찾습니다. 가중 최소 제곱으로 회귀 모형을 적합하고 잔차를 분석합니다. Analyze(분석) | 회귀 분석 | 선형.
- 독립 변수 및 코호트 범주(즉, 17개의 출생 코호트)를 독립 상자로 옮기고 종속 변수와 잔차를 종속: 상자로 옮깁니다. 사망 번호를 WLS 웨이트 박스로 옮깁니다. 확인을 클릭합니다. 코호트 효과의 가중 평균의 결과를 생성하는지 확인합니다.
결과
사망률 데이터는 10개의 5년 연령 그룹(40-44세, 45-49세, 50-54세, 55-59세, 60-64세, 65-69세, 70-74세, 75-79세, 80-84세, 85+)과 8개의 5년 기간(1976-1980년, 1981-1985년, 1986-1990년, 1991-1995년, 1996-2000년, 2001-2005년, 2006-2010년, 2011-2015년)에 대해 입증되었습니다. 코호트 그룹의 수는 총 연령 기간 그룹 수에서 1을 빼서 선택되었습니다: 10 (5년 연령 그룹) + 8 (5년 기간) -1 = 17개의 출생 코호트, 출생 코호트 그룹은 1891년, 1896년, 1901년, 1906년, 1911년, 1916년, 1921년, 1926년, 1931년, 1936년, 1941년, 1946년, 1951년, 1956년, 1961년, 1966년, 1971년. 우리는 간세포암을 앓고 있는 남성과 여성의 연령 그룹 우발성 형식을 제공합니다( 보충 표 1). 그림 1 과 그림 2 는 연령 및 기간 그룹 내의 간암 사망률을 보여줍니다. 이러한 변동은 여성보다 남성에서 더 두드러졌다. 연령 분포에 기초한 비율은 40-44세 연령 그룹의 하단에서 간암 사망률이 증가하고 있음을 보여준다(그림 1). 대조적으로, 그림 2 는 ≥60세 그룹에서 간암 사망률이 점진적으로 증가했음을 명확하게 보여줍니다. 그러나 연령에 따른 간암 사망률은 시간이 지남에 따라 크게 변했으며, 이는 정상적인 연령 기간 교차 분류된 생명 통계 표에 숨겨진 현저한 코호트 효과가 미래의 어느 시점까지는 분명하지 않을 것임을 의미합니다.
로그 변환된 HCC 사망률에 대한 중앙값 연마 절차를 구현했습니다. 남성과 여성의 간암 사망률에 대한 APC 모델에 대한 추정 코호트 효과는 각각 표 1 및 2에 나타나 있습니다. 또한, 가중 추정치를 얻기 전에 두 가지 성별 가중 평균 절차의 계산은 표 1 및 2에 보고되어 있습니다. 가중 추정치는 가중 추정치의 신뢰 구간(CI)의 최소 편차(동일 가중치 추정치 비교)를 기반으로 이전에 추정된 코호트 효과보다 데이터를 더 잘 준수합니다.
남성의 경우, 표 1 의 왼쪽 패널은 출생 코호트의 코호트 효과를 보여준다. 코호트 효과는 0.73(1891년 가장 빠른 코호트 효과)에서 1.20(1936년 가장 큰 코호트 효과)으로 증가합니다. 여성의 경우 코호트 효과는 0.68(1891년 가장 빠른 코호트 효과)에서 1.35(1936년 가장 큰 코호트 효과)로 증가합니다. 1891년 코호트와 비교했을 때, 남성과 여성의 코호트 효과가 각각 약 64%와 98% 증가했다는 점을 강조하는 것이 중요하다. 증가분은 표 2의 오른쪽 패널에 균등하게 분포되어 있었습니다. 여기서 코호트 효과는 0.71(1891년 가장 빠른 코호트 효과)에서 1.11(1936년 가장 큰 코호트 효과)으로 증가했습니다. 여성의 경우, 분포 증가의 유사한 효과가 표 2의 오른쪽 열에서 입증되었습니다. 코호트 효과는 0.64(1891년 가장 빠른 코호트 효과)에서 1.11(1926년 가장 큰 코호트 효과)으로 증가했습니다. 따라서 남성과 여성으로 구성된 초기 코호트와 비교했을 때 사망률이 각각 약 57%와 73%씩 증가한 것을 관찰했다.
출생 코호트 중에서, 대략 1936년에 태어난 남성이 간암 사망률에 대한 가장 높은 위험을 보였다(보충 표 1). 따라서, 가중 추정치의 경우, 1921년 기준 출생 코호트와 비교하여 1936년 출생 코호트의 영향은 1.11이었다(95% CI: 1.08-1.14). 이와는 대조적으로, 1891년의 초기 코호트는 급격히 증가하는 경향을 보였다. 또한, 1936년 코호트 이후 효과가 역전되었다. 표 1에서, 1916년의 참조 출생 코호트와 비교했을 때, 가중 효과는 1.11이었다(95% CI: 1.07-1.16). 또한, 남성과 여성을 대상으로 각각 95% 신뢰 구간으로 동일한 가중치 및 가중치 코호트 효과를 모델링했습니다. 두 수치 모두 동일한 가중치를 부여한 코호트 효과가 95% CI의 거의 모든 너비보다 더 넓다는 것을 보여줍니다.
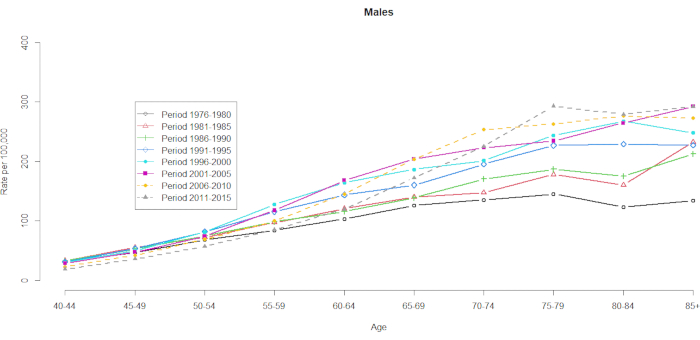
그림 1. 연령 및 기간별 100,000명당 간암 사망률, 남성, 대만, 1976-2015. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
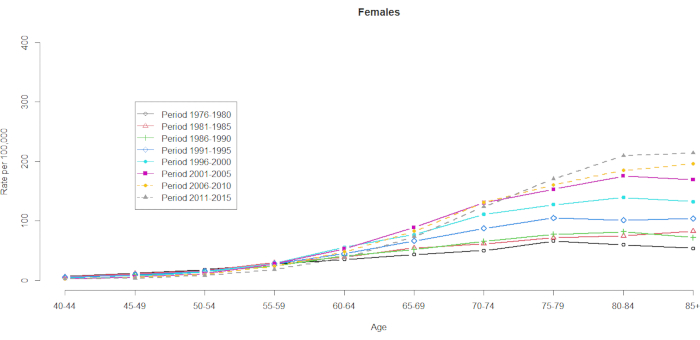
그림 2. 연령 및 기간별 100,000명당 간암 사망률, 여성, 대만, 1976-2015. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
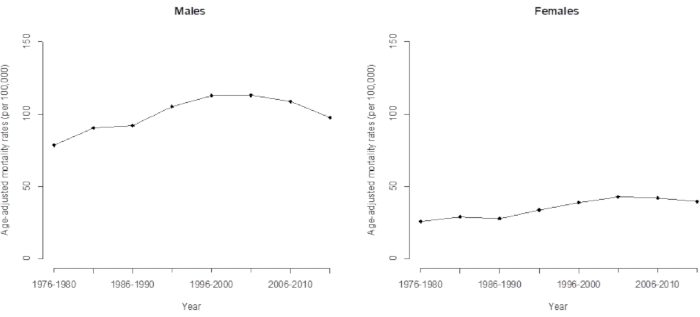
그림 3. 대만의 남성과 여성의 간세포 암종으로 인한 연령 조정 사망률. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 가중치 없음 | 가중치 | |||
| 효과 | 효과에 대한 95% CI | 효과 | 효과에 대한 95% CI | |
| 일대 | ||||
| (1891년~1971년) | ||||
| 1891 | 0.73 | 0.59-0.90 | 0.71 | 0.57- 0.88 |
| 1896 | 0.88 | 0.79-0.99 | 0.87 | 0.78- 0.97 |
| 1901 | 0.89 | 0.83-0.96 | 0.81 | 0.71- 0.92 |
| 1906 | 0.91 | 0.86- 0.97 | 0.85 | 0.78- 0.94 |
| 1911 | 0.95 | 0.90-1.00 | 0.89 | 0.83- 0.96 |
| 1916 | 1.01 | 0.97-1.06 | 0.99 | 0.95- 1.03 |
| 1921 | 1 | 참조 | 1 | 참조 |
| 1926 | 1.04 | 1.00-1.08 | 1.03 | 1.01- 1.06 |
| 1931 | 1.1 | 1.06-1.14 | 1.08 | 1.06- 1.11 |
| 1936 | 1.2 | 1.15- 1.24 | 1.11 | 1.08- 1.14 |
| 1941 | 1.14 | 1.09- 1.19 | 1.1 | 1.07- 1.13 |
| 1946 | 1.04 | 1.00-1.09 | 1.06 | 1.04- 1.09 |
| 1951 | 0.91 | 0.87-0.96 | 1 | 0.98- 1.03 |
| 1956 | 0.87 | 0.82-0.92 | 0.96 | 0.93- 0.98 |
| 1961 | 0.82 | 0.76-0.88 | 0.88 | 0.85- 0.92 |
| 1966 | 0.76 | 0.68- 0.85 | 0.79 | 0.74- 0.83 |
| 1971 | 0.71 | 0.57-0.87 | 0.83 | 0.80- 0.87 |
| 참고: REF = 참조; CI = 신뢰 구간. | ||||
표 1. 1891-1971년 대만 남성의 간세포 암종 사망률에 대한 출생 코호트의 효과에 대한 추정 비율 비율 및 95% 회의 간격.
| 가중치 없음 | 가중치 | |||
| 효과 | 효과에 대한 95% CI | 효과 | 효과에 대한 95% CI | |
| 일대 | ||||
| (1891년~1971년) | ||||
| 1891 | 0.68 | 0.42- 1.10 | 0.64 | 0.38-1.09 |
| 1896 | 0.81 | 0.63-1.04 | 0.75 | 0.56- 1.00 |
| 1901 | 0.8 | 0.67- 0.95 | 0.7 | 0.52- 0.94 |
| 1906 | 0.83 | 0.72- 0.95 | 0.76 | 0.65- 0.88 |
| 1911 | 0.88 | 0.78- 0.99 | 0.85 | 0.78- 0.93 |
| 1916 | 1 | 참조 | 1 | 참조 |
| 1921 | 1.12 | 1.01-1.24 | 1.08 | 1.03- 1.13 |
| 1926 | 1.29 | 1.17-1.42 | 1.11 | 1.07- 1.12 |
| 1931 | 1.3 | 1.18-1.43 | 1.1 | 1.05- 1.15 |
| 1936 | 1.35 | 1.22-1.49 | 1.1 | 1.04- 1.14 |
| 1941 | 1.19 | 1.07-1.32 | 1.09 | 1.03-1.13 |
| 1946 | 1.05 | 0.94-1.17 | 1.06 | 1.02-1.11 |
| 1951 | 0.83 | 0.73-0.94 | 1 | 0.96-1.05 |
| 1956 | 0.67 | 0.58-0.77 | 0.93 | 0.89-0.98 |
| 1961 | 0.58 | 0.49-0.70 | 0.79 | 0.74-0.84 |
| 1966 | 0.59 | 0.46-0.75 | 0.58 | 0.49-0.69 |
| 1971 | 0.63 | 0.40-1.02 | 0.64 | 0.58-0.72 |
| 참고: REF = 참조; CI = 신뢰 구간. | ||||
표 2. 1891-1971년 대만 여성의 간세포 암종 사망률에 대한 출생 코호트의 효과에 대한 추정 비율 비율 및 95% 회의 간격.
보충 표 1. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
간암 사망률의 시간 추세로 인해 기존 모델은 데이터에 숨겨진 몇 가지 중요한 기능(예: 코호트 효과)을 과소평가하며, 관찰된 로그 연령 보정률의 단순 선형 외삽을 사용하는 기존 분석은 예측의 정확도가 크게 감소한 것으로 나타났습니다. 이러한 추세는 35년 동안 지속되어 왔으며 1976년부터 2015년까지 대만의 간암 사망률의 장기 추세를 직접 관찰하면 향후 몇 년 동안 상승 추세를 보일 것이 분명합니다(그림 3). 실제로, 최근 대만의 간암 사망률은 감소하고 있으며, 이는 앞서 언급한 바와 같이 1936년 코호트 이후 감소한 코호트 효과(APC 분석에 의해 결정됨)에 의해 주도되고 있습니다. 이 연구는 APC 모델의 적용이 추세 변화에 대한 보다 정확하고 고급 경고를 제공한다는 것을 보여줍니다.
임상적 관점에서 볼 때, 약 20억 명의 사람들이 B형 간염 바이러스(HBV) 12에 감염되어 있으며, 약 3억 5천만 명이 그로 인해 고통을 겪고 있습니다. 결과적으로, 이는 전 세계적으로 높은 이환율을 가진 심각한 건강 문제입니다. HBV 감염은 간염, 간경변 또는 간세포 암을 유발하는 비효율적인 보균자 상태를 포함하여 광범위한 임상 문제를 일으킵니다. 가장 효과적인 예방 방법은 개인에게 B형 간염 백신을 접종하는 것입니다. 대만은 1984년 세계 최초로 B형 간염 집단 예방접종 계획을 시행했다 13. 이 프로그램에서는 임산부를 대상으로 B형 간염 표면 항원(HBsAg) 및 B형 간염 외피 항원(HBeAg) 14에 대한 선별 검사를 받았습니다. 이 프로그램의 첫 2년 동안은 면역 프로그램이 HBsAg를 가진 산모의 아기만을 대상으로 했습니다. 그러나 백신 접종 프로그램 3년차부터 모든 아기가 보장되었습니다. B형 간염 백신의 접종률은 최근 몇 년 동안 99%에 달했다 15. 거의 90%에서 95%의 사람들이 백신을 3회 접종한 후 평생 면역을 경험하게 됩니다. 우리는 대만의 소아 간세포암 감소가 주로 이러한 글로벌 백신 접종 프로그램에 기인한다는 점을 강조합니다.
이 문서에 설명된 APC 모델링은 이러한 (증가된) 추세 변화(가까운 장래에 감소할 예정)에 대한 고급 경고를 제공합니다. 코호트 효과(표 1 및 2)와 연령 조정 사망률(그림 3)의 추세를 비교했을 때, 직접 연령 조정 사망률(또는 연령 표준화 사망률)은 가중 평균과 동일했다. 이 연구에서 2000년 세계 표준 인구 16 을 기준으로 관심 연령 그룹의 비율에 따라 연령 사망률에 가중치를 부여합니다. 코호트 효과의 검증이 최신 간암 사망률 패턴을 지배했기 때문에 최신 데이터(2011-2015년까지)에 대한 연령 조정 간암 사망률을 계산했습니다. 우리는 이를 코호트의 가중 평균 추정치가 신뢰할 수 있는 정보를 제공하는 반면 연구가 미래의 간암 사망률을 예측할 준비가 되어 있다는 의미로 해석했습니다. 간암 사망률 예측에 대한 자세한 내용은 이전 연구 5에서 확인할 수 있다.
일반적인 가설은 데이터 내의 각 값이 모델의 매개변수를 평가하기 위해 동일한 정보를 제공한다는 것입니다. 이 접근 방식은 대부분의 모델링 방법(예: 선형 또는 비선형 회귀 모델)에서 사용되었으며 오류 항의 표준 편차가 상수의 기본 예측 변수임을 의미합니다. 그러나 문헌 검토에 따르면 이 가설은 매개변수를 경험적으로 추정하기 위한 모델링에 적합하지 않습니다. 알 수 없는 매개변수는 데이터 포인트에 대한 정확도가 낮은 더 작은 가중치를 생성하고 데이터 포인트에 대해 더 높은 정확도로 큰 가중치를 생성하는 가중 회귀를 사용할 때 추정됩니다. 가중치 부여 과정은 추정기의 표준 편차를 감소시켰습니다. 그럼에도 불구하고 가중 회귀 분석법의 단점은 실증적 관행에서 거의 알려지지 않았습니다. 정확한 가중치는 알려져 있지 않기 때문에 추정된 가중치를 사용하여 매개변수를 추정했습니다. 또한, 이전의 경험에 의하면 추정에 기초한 가중치는 회귀분석이나 그 해석에 유의한 변화가 없거나 일반적으로 영향을 미친다는 것이 입증되었다 17. 가설적으로, APC 모델은 발병률이 연령, 기간 및 코호트에 의해 영향을 받는 모든 질병에 적합할 수 있습니다. 또한, 예측 18,19,20에 대해 가 중 평균 추정치를 사용할 수 있었습니다. CI가 비교적 좁으면 불확실성이 작습니다. CI가 이러한 유형의 평가에 내재된 불확실성과 그 안의 가치를 나타낸다는 사실에 비추어 볼 때, 우리는 일반적으로 CI를 사용하는 것이 상당한 영향을 미친다는 결론을 내립니다.
경피적 동맥 화학색전술(TACE)은 간세포암을 임상적으로 조절하는 가장 효율적인 방법 중 하나입니다. 그러나 이 방법은 개복 수술이 필요하지 않기 때문에 프라임 또는 보조 요법으로 선택하기 어렵습니다. 간은 일반적으로 간문맥을 통해 혈액과 영양분의 75%를 제공하는 반면, 간동맥은 혈액과 영양분의 25%를 제공합니다. 대부분의 간맥에서 추출한 간동맥 혈액과 달리, 이 액체는 빠르게 증가하며 간문맥에서 나오는 경우는 드뭅니다. 더욱이, 원발성 간암은 신체의 다른 부위로 전이되는 경우가 거의 없기 때문에 이러한 효과는 TACE에 매우 적합합니다. 간세포 악성 종양은 전이될 가능성은 낮지만 근절하기는 어렵습니다. 임상에서는 간세포암 환자에 대한 추적 관찰이 2-3개월마다 실시됩니다. 알파태아단백(AFP)의 비정상적인 상승 또는 비정상적인 초음파 검사가 감지되면 컴퓨터 단층 촬영 및 자기 공명 영상이 수행됩니다. 새로운 종양이 발견되면 TACE를 고려합니다. HBV DNA 정량적 시간 지수(HDQTI)와 같은 HBV 관련 간세포암의 재발을 감지하기 위한 새로운 바이오마커도 개발되었습니다 21. 추적 관찰 결과와 검출된 정상 HBV DNA 부하 비율의 로그의 곱은 HDQTI의 합계입니다. HDQTI는 HBV 관련 간세포암 재발의 독립적인 예후 지표로 사용된다 21.
본 연구에는 몇 가지 한계가 있다. 첫째, 우리는 관찰된 변화의 병인에 대해 단순히 가설을 세웠을 뿐입니다. APC 모델을 사용하여 연령, 기간 및 코호트 효과에 따른 HCC 사망률을 재검토했습니다. 그럼에도 불구하고, 이 연구에서는 중앙값 폴리싱 설정을 가정으로 사용했습니다. 둘째, APC 분석은 개발도상국 또는 최근 선진국의 역학 분야에서 장기적인 코호트 연구를 위해 널리 사용되어 왔습니다. 셋째, 동반질환이나 생활습관과 같은 APC 모델의 교란 요인을 조정하기 위해 누적된 형식 데이터 세트에서 정보를 얻지 못했습니다. 이 한계를 해결하기 위한 향후 연구를 위해 격리된 데이터가 필요합니다. 넷째, 다단계 방식에서 회귀 분석 절차를 수정하기 위해 HCC로 인한 사망자 수를 가중치로 사용하였다. 정확한 가중치는 알려져 있지 않기 때문에 다양한 가중치를 사용하면 추정된 코호트 효과 내에서 약간의 인플레이션이 발생합니다. 궁극적으로 인식할 수 없는 문제를 해결하기 위한 다양한 APC 추정 방법이 있습니다(예: Holford는 선형 및 곡률 추세를 사용하여 인식할 수 없는 문제 22를 해결합니다). 동시에 중앙값 다듬기는 APC 모델 간의 개념적 변환 형태로 복잡한 가정을 제공하여 가장 적은 가정으로 코호트 효과를 평가하고 분할표에 대한 공통 형식을 쉽게 적용합니다.
전반적으로, 각 코호트의 CI가 비교적 좁은 가중 평균 효과는 회귀 모델을 수정하기 위해 가중 추정에 의해 허용되었습니다. 간단히 말해서, 다단계 방법의 경우 회귀 모델의 가중 추정치를 사용하여 연령 기간 분할표 데이터의 코호트 효과를 평가하는 것이 좋습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 타이페이 쯔쯔 병원 TCRD-TPE-109-RT-8 (2/3) 및 TCRD-TPE-109-39 (2/2)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| not applicable | not applicable | not applicable | not applicable |
참고문헌
- Kuntz, E., Kuntz, H. D. Hepatology: Principles and Practice. , Springer. New York. 774(2006).
- McGlynn, K. A., et al. International trends and patterns of primary liver cancer. International Journal of Cancer. 94 (2), 290-296 (2001).
- Bosch, F. X., Ribes, J., Diaz, M., Cleries, R. Primary liver cancer: worldwide incidence and trends. Gastroenterology. 127, 5-16 (2004).
- Tzeng, I. S., Ng, C. Y., Chen, J. Y., Chen, L. S., Wu, C. C. Using weighted regression model for estimating cohort effect in age-period contingency table data. Oncotarget. 9 (28), 19826-19835 (2018).
- Tzeng, I. S., Lee, W. C. Forecasting hepatocellular carcinoma mortality in Taiwan using an age-period-cohort model. Asia-Pacific Journal of PublicHealth. 27, 65-73 (2015).
- Tzeng, I. S., et al. Predicting emergency departments visit rates from septicemia in Taiwan using an age-period-cohort model, 1998 to 2012. Medicine. 95, 5598(2016).
- Chen, S. H., et al. Period and Cohort Analysis of Rates of Emergency Department Visits Due to Pneumonia in Taiwan, 1998-2012. Risk Management and Healthcare Policy. 13, 1459-1466 (2020).
- Keyes, K. M., Li, G. A multiphase method for estimating cohort effects in age-period contingency table data. Annals of Epidemiology. 20, 779-785 (2010).
- Tukey, J. Exploratory data analysis Reading: MS. , Addison-Wesley Publishing Company. (1977).
- Selvin, S. Statistical analysis of epidemiologic data. , University Press. New York: Oxford. (1996).
- Légaré, G., Hamel, D. An age-period-cohort approach to analyzing trends in suicide in Quebec between 1950 and 2009. Canadian Journal of Public Health. 104, 118-123 (2013).
- Lavanchy, D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. Journal of Viral Hepatitis. 11, 97-107 (2004).
- Chang, M. H., et al. Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Childhood Hepatoma Study Group. New England Journal of Medicine. 336, 1855-1859 (1997).
- Lu, F. T., Ni, Y. H. Elimination of mother-to-infant transmission of hepatitis B virus: 35 years of experience. Pediatric Gastroenterology, Hepatology & Nutrition. 23 (4), 311-318 (2020).
- Chien, Y. C., Jan, C. F., Kuo, H. S., Chen, C. J. Nationwide hepatitis B vaccination program in Taiwan: effectiveness in the 20 years after it was launched. Epidemiologic Reviews. 28, 126-135 (2006).
- Ahmad, O. B., et al. Age standardization of rates: a new WHO standard. Geneva: GPE Discussion Paper Series. World Health Organization. , 31(2005).
- da Silva, C. P., Emídio, E. S., de Marchi, M. R. Method validation using weighted linear regression models for quantification of UV filters in water samples. Talanta. 131, 221-227 (2015).
- Dawes, R. M. The robust beauty of improper linear models in decision making. American Psychologist. 34, 571-582 (1979).
- Dawes, R. M., Corrigan, B. Linear models in decision making. Psychological Bulletin. 81, 95-106 (1974).
- Einhorn, H. J., Hogarth, R. M. Unit weighting schemes for decision making. Organizational Behavior and Human Performance. 13, 171-192 (1975).
- Wang, W., et al. Association of hepatitis B virus DNA level and follow-up interval with hepatocellular carcinoma recurrence. JAMA Network Open. 3 (4), 203707(2020).
- Holford, T. R. The estimation of age, period and cohort effects for vital rates. Biometrics. 39, 311-324 (1983).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유