Method Article
Multiplex Fluorescence In Situ Hybridization with Fluorescent Immunohistochemistry on Fresh Frozen or Fixed Mouse Brain Section(신선 냉동 또는 고정 마우스 뇌 절편에서 Multiplex Fluorescence In Situ Hybridization과 형광 면역조직화학의 결합)
요약
이 프로토콜은 다중 표지 FISH 및 형광 IHC 신호를 달성하는 것을 목표로 신선 냉동 및 고정 마우스 뇌 절편 모두에서 형광 in situ hybridization(FISH)과 형광 면역조직화학(IHC)을 결합하는 방법을 설명합니다. IHC는 세포질 및 막 부착 단백질을 표적으로 삼았습니다.
초록
형광 in situ hybridization(FISH)은 세포 내 특정 RNA 전사체의 존재 및 공간 분포를 식별하는 분자 기술입니다. 기능적으로 식별된 뉴런의 신경화학적 표현형은 일반적으로 면역조직화학(IHC)을 사용하는 여러 항체(표적 단백질)와의 동시 표지와 현장 교잡(표적 RNA)의 최적화를 동시에 필요로 합니다. 특정 뉴런을 특성화하기 위한 "신경화학적 서명"을 달성할 수 있지만 복잡한 요인에는 방법을 결합하기 전에 FISH 및 IHC 표적을 확인해야 할 필요성과 동일한 조직 섹션 내에서 동시에 표적화될 수 있는 제한된 수의 RNA 및 단백질이 포함됩니다.
여기서는 RNAscope FISH와 형광 면역염색을 각각 사용하여 동일한 뇌 절편에서 여러 mRNA와 단백질을 검출하는 신선 냉동 및 고정 마우스 뇌 제제를 모두 사용하는 프로토콜을 설명합니다. 면역조직화학적으로 확인된 뇌간 핵에서 저농도 mRNA(예: 갈라닌 수용체 1)와 고농도 mRNA(예: 글리신 수송체 2)의 발현 패턴을 설명하기 위해 결합된 방법을 사용합니다.
FISH 분석의 다운스트림 단백질 라벨링에 대한 주요 고려 사항은 조직 준비 및 FISH 프로브 라벨링의 최적화를 넘어섭니다. 예를 들어, 항체 결합 및 표지 특이성은 FISH 프로브 분석 내에서 단백질 분해 효소 단계에 의해 해로운 영향을 받을 수 있음을 발견했습니다. 프로테아제는 펩타이드 결합의 가수분해 절단을 촉진하여 FISH 프로브가 세포에 쉽게 진입할 수 있도록 하지만, 후속 IHC 분석에서 표적이 되는 단백질을 분해하여 표적 결합을 생성할 수도 있습니다. 표적 단백질의 세포 내 위치는 FISH 프로브 분석 후 IHC 성공에 기여하는 또 다른 요소입니다. 표적 단백질이 막 결합되어 있을 때 IHC 특이성이 유지되는 것을 관찰한 반면, IHC 표적 세포질 단백질은 광범위한 문제 해결이 필요했습니다. 마지막으로, 슬라이드 장착형 고정 냉동 조직의 취급이 신선 냉동 조직보다 더 어렵다는 것을 발견했지만, RNAscope와 결합했을 때 IHC 품질은 고정 냉동 조직에서 전반적으로 더 좋았습니다.
서문
신경화학적으로 뉴런의 하위 집단을 정의하는 단백질과 mRNA는 일반적으로 각각 면역조직화학(IHC) 및/또는 제자리 교잡(ISH)의 조합으로 식별됩니다. ISH와 IHC 기법을 결합하면 다중 라벨링 용량을 극대화하여 기능적 뉴런(신경화학적 코딩)에 고유한 공동 국소화 패턴의 특성화를 용이하게 할 수 있습니다.
RNAscope를 포함한 형광 ISH(FISH) 분석법은 방사성 ISH 및 비방사성 발색 ISH와 같은 이전 RNA 검출 방법에 비해 감도와 특이도가 더 높습니다. FISH는 단일 mRNA 전사체를 반점 염색 지점으로 시각화할 수 있습니다1. 또한 RNAscope 분석을 통해 다양한 형광단 태그를 사용하여 한 번에 더 많은 수의 RNA 표적을 라벨링할 수 있습니다. 이러한 장점에도 불구하고 기술적 한계는 단일 실험에서 사용할 수 있는 형광단/염색체의 수에 영향을 미칠 수 있습니다. 여기에는 현미경 필터 세트의 가용성이 포함됩니다. 이러한 고려 사항은 신경화학적 식별이 FISH와 IHC를 결합한 것을 사용할 때 각 기술을 개별적으로 사용하는 것과 비교할 때 복잡해지는데, 이는 한 방법에 최적화된 고유한 단계가 다른 방법에 해로울 수 있기 때문입니다.
IHC와 결합된 FISH의 이전 적용은 인간 B세포 림프종2, 병아리 배아3, 제브라피시 배아4, 마우스 망막5 및 마우스 내이 세포6에서 특정 세포 표적의 발현을 입증했다. 이 연구에서 조직 준비는 포르말린 고정 파라핀 포매(FFPE)2,3,5 또는 신선한 전체 마운트 4,6이었습니다. 다른 연구에서는 고정 마우스 및 쥐 뇌 제제에 발색 RNAscope를 적용했습니다 7,8,9. 특히, Baleriola et al.도 8은 ISH-IHC 병용을 위한 두 가지 상이한 조직 제제를 설명하였다; 고정 마우스 뇌 절편 및 FFPE 인간 뇌 절편. 최근 간행물에서 우리는 신선 냉동 절편에 FISH와 형광 IHC를 결합하여 뇌간 망상 형성에서 저농도 mRNA(갈라닌 수용체 1, GalR1), 고농도 mRNA(글리신 수송체 2, GlyT2) 및 소포성 아세틸콜린 수송체(vAChT) 단백질10을 동시에 시각화했습니다.
고독관의 핵(NTS)은 자율 신경 기능에 관여하는 주요 뇌 영역입니다. 후뇌에 위치한 이 이질적인 뉴런 집단은 호흡을 조절하는 신호를 포함하여 방대한 수의 자율 신경 신호를 수신하고 통합합니다. NTS는 여러 신경 세포 집단을 보유하고 있으며, 이는 GalR1 및 GlyT2를 포함한 mRNA 표적의 발현 패턴과 효소 티로신 하이드록실라제(TH) 및 전사 인자 쌍 유사 호메오박스 2b(Phox2b)에 대한 단백질 마커에 의해 표현형적으로 특징지어질 수 있습니다.
RNAscope 소유자는 신선한 냉동 조직 준비를 권장하지만 고정 냉동 조직 절편의 장기 냉동 보호(-20°C에서 보관)와 함께 전체 동물 심내 관류 고정으로 준비된 조직은 많은 실험실에서 일반적입니다. 따라서 우리는 신선 냉동 및 고정 냉동 조직 제제를 사용하여 IHC와 함께 FISH에 대한 프로토콜을 수립하고자 했습니다. 여기에서는 신선 냉동 및 고정 냉동 뇌 절편을 제공합니다: (1) FISH 및 형광 IHC의 결합을 위한 프로토콜 (2) 각 제제를 사용할 때 생산된 mRNA 및 단백질 라벨링의 품질에 대한 설명 (3) NTS에서 GalR1 및 GlyT2의 발현에 대한 설명.
우리의 연구는 RNAscope 방법론과 결합했을 때 IHC의 성공은 신선 냉동 및 고정 냉동 제제에서 다양했으며 세포 내 표적 단백질의 국소화에 따라 달라진다는 것을 밝혔습니다. 우리 손에서는 멤브레인 결합 단백질 라벨링이 항상 성공적이었습니다. 대조적으로, 세포질 단백질에 대한 IHC는 형질전환 동물(Phox2b-GFP)에서 세포질 단백질이 과발현된 경우에도 문제 해결이 필요했습니다(Phox2b-GFP)11. 마지막으로, GalR1은 NTS에서 비-카테콜아민성 뉴런에서 발현되는 반면, GlyT2 발현은 NTS에서 존재하지 않는다.
프로토콜
조직 전처리 단계의 요약은 그림 1에서 찾을 수 있습니다. 모든 절차는 과학적 목적을 위한 동물의 사용 및 관리에 대한 지침(호주 국립 보건 및 의료 연구 위원회)에 따라 뉴사우스웨일즈 대학교의 동물 관리 및 윤리 위원회에 따라 수행되었습니다.
1. 신선 냉동 뇌 조직의 샘플 준비
- 심 관류
- 헤파린화 (2500 U / L) 0.1M 인산염 완충액 (PB), pH 7.5를 준비합니다. 드라이 아이스와 에탄올을 혼합하여 드라이 아이스 에탄올 슬러리를 만듭니다. 이것은 약 -72 °C의 온도를 가지며 수확된 조직의 즉각적인 동결에 사용됩니다.
- 27.5인치 바늘 게이지를 사용하여 펜토바르비탈나트륨(70mg/kg, ip)으로 마취하여 성체 C57BL/6 및 Phox2b-GFP11(Mouse Genome Informatics database ID MGI:5776545) 마우스를 안락사시킵니다.
주의: 펜토바르비탈은 바르비투르산염입니다. 과다 복용 시 급성 독성이 있으며 호흡 정지로 사망할 수 있습니다. 사용하기 전에 현지 의료, 법률 및 물질 안전 지침을 참조하십시오. - 심장을 노출시키고 드로잉 업 바늘(23인치 게이지)로 좌심실을 캐뉼레이션합니다. 0.1-1mL/분의 유속으로 혈액이 맑아질 때까지(2-3분) 헤파린화된 13M PB로 심경 관류를 수행합니다. 간의 착색과 우심방의 삼출액을 모니터링하여 혈액 청소를 결정합니다12.
- 두개강에서 뇌를 분리하고 즉시 크라이오몰드 또는 알루미늄 호일에 넣어 최적 절단 온도 화합물(OCT)에 넣고 드라이아이스 에탄올 수조에 놓습니다. 냉동 내장 조직을 -80°C의 밀폐 용기에 최대 3개월 동안 보관합니다.
- 신선 냉동 조직의 절편
- 저온 유지 장치 온도를 -20°C로 설정합니다. OCT가 내장된 조직과 저온 유지 장치 척을 저온 유지 장치에 ~30분 동안 두어 새 온도와 평형을 이룹니다.
알림: 조직을 항상 냉동 상태로 유지하십시오. -80°C 냉동고에서 드라이아이스로 조직을 저온 유지 장치로 운반합니다. - OCT 화합물을 사용하여 미리 냉각된 저온 유지 장치 척에 조직을 고정합니다. 이 프로토콜에서는 조직 블록이 코로나 평면의 척에 장착되었습니다.
알림: 면도날을 사용하여 조직에서 과도한 OCT를 잘라내어 저온 유지 장치에 의해 절단된 OCT의 양을 최소화하고 유리 슬라이드로 옮깁니다. - 14μm 두께의 코로나 절편을 절단하여 하전된 유리 현미경 슬라이드에 장착합니다.
- 섹션을 장착하기 전에 슬라이드를 실온으로 데우십시오. 섹션이 장착되면 슬라이드를 저온 유지 장치의 슬라이드 상자에 보관합니다.
- 하나의 슬라이드에 둘 이상의 섹션을 장착해야 하는 경우 슬라이드의 반대쪽에 손가락을 5-10초 동안 놓아 섹션을 슬라이드에 고정하는 데 도움을 주어 두 번째 섹션의 영역을 따뜻하게 합니다. 차가운 티슈 섹션은 차가운 미끄럼틀에 부착되지 않습니다. 섹션은 슬라이드에 평평하게 부착되어야 합니다. 접으면 세탁 단계에서 슬라이드에서 떨어질 수 있습니다.
- 섹션에 균열이 발견되면 이를 방지하기 위해 저온 유지 장치 온도를 1-5°C 높이십시오. 조직 절편을 동일한 슬라이드에서 서로 가깝게 배치하는 것이 특히 중요합니다. 이렇게 하면 분석 중 FISH 프로브 및 시약의 낭비를 방지할 수 있습니다.
- 유리 슬라이드에 장착된 티슈 절편을 -80°C의 밀폐 용기에 담아 최대 6개월 동안 보관합니다.
알림: RNA 분해를 방지하기 위해 섹션을 항상 냉동 상태로 유지하고 동결 해동 주기를 피하십시오. 슬라이드 박스를 냉동 유지 장치 내부에서 드라이아이스로 -80°C 냉동고로 운반합니다.
- 저온 유지 장치 온도를 -20°C로 설정합니다. OCT가 내장된 조직과 저온 유지 장치 척을 저온 유지 장치에 ~30분 동안 두어 새 온도와 평형을 이룹니다.
- 신선한 냉동 조직의 고정
- FISH 프로브 분석을 수행할 당일에 0.1M PB, pH 7.5(4% PFA 용액)에서 4% 파라포름알데히드(PFA)를 준비합니다. Buchner 깔때기 또는 도가니 필터에서 여과지(1등급: 11μm, 재료 표)를 통과시켜 필터링합니다.
주의 : PFA는 피부 접촉이나 흡입에 의해 유해하고 독성이 있습니다. PFA 용액을 사용하는 모든 절차는 흄 후드 캐비닛에서 수행해야 합니다. PFA 용액 폐기물은 기관 안전 프로토콜에 따라 신중하게 처리해야 합니다. - 4% PFA 용액을 4°C로 식힙니다. -80°C 냉동실에서 슬라이드 장착 티슈를 드라이아이스에 담아 운반하고 즉시 미리 식힌 정착액에 15분 동안 담그십시오.
알림: 과도하게 고정하면 불특정 배경 라벨링이 발생하므로 이 고정 단계는 15분을 초과하지 않는 것이 중요합니다.
- FISH 프로브 분석을 수행할 당일에 0.1M PB, pH 7.5(4% PFA 용액)에서 4% 파라포름알데히드(PFA)를 준비합니다. Buchner 깔때기 또는 도가니 필터에서 여과지(1등급: 11μm, 재료 표)를 통과시켜 필터링합니다.
- 신선 냉동 조직의 탈수
- 슬라이드를 등급별 농도의 에탄올에 담가 조직 절편을 탈수합니다. 코플린 병에 먼저 50%, 70%, 마지막으로 절대 에탄올을 실온에서 각각 5분 동안 담그십시오. 최종 절대 에탄올 배양을 두 번째로 반복합니다.
- 공기 건조 슬라이드와 소수성 배리어 펜을 사용하여 섹션 그룹의 윤곽을 그려 내부 영역이 최소한으로 유지되도록 합니다.
알림: 소수성 장벽을 그리기 전에 유리 슬라이드가 완전히 건조되었는지 확인하십시오. 소수성 장벽은 틈 없이 조직 절편을 완전히 둘러싸야 하며 추가 처리 전에 건조되어야 합니다.
2. 고정된 동결 뇌 조직의 샘플 준비
- 심내막 관류 고정
- 펜토바르비탈나트륨(70mg/kg, i.p)으로 마취한 후 먼저 0.1M PB로 심내준 다음 4% PFA 용액으로 심 관류하여 마우스를 안락사시킵니다. 11-13mL/분에서 10분 동안 관류하여 고정합니다.
- 관류 고정 후 두개골강에서 뇌를 분리하고 4°C에서 4% PFA 용액에 밤새 담그십시오.
- 고정 조직의 조직 절편
- 미세한 집게를 사용하여 해부 현미경을 사용하여 수막층을 제거하기 전에 멸균 0.1M 인산염 완충 식염수(PBS)로 뇌를 헹굽니다.
- 뇌 매트릭스(재료 표)를 사용하여 뇌를 블록으로 정밀하게 절단합니다(비브라톰 절편 전에 뇌간을 전뇌에서 분리). 구체적으로는 피라미드 모양의 뇌간을 꼬리 모양으로 자르고 소뇌를 절개한다. 마찬가지로, 시신경 chiasm에 즉시 전뇌를 자릅니다.
- 시아노아크릴레이트를 사용하여 진동하는 마이크로톰 척에 조직을 고정하고 2% 한천 용액에 넣습니다.
- 진동 마이크로톰을 사용하여 30μm 두께의 조직 절편을 절단하고 절단된 절편을 동결 보호제 용액(30% RNase free sucrose, 30% 에틸렌 글리콜, 1% 폴리비닐피롤리돈(PVP-40), 0.1M PB, pH 7.4)에 보관합니다. 조직 절편은 -20°C에서 최대 6개월 동안 동결 보호제에 보관할 수 있습니다.
- FISH 전에 고정 섹션 준비
- FISH의 당일에는 세척 당 10 분 동안 부유 부분을 3 회 세척하여 동결 보호 용액을 제거합니다. 세척하려면 12웰 세포 배양 플레이트에 0.1M PBS의 절편을 놓고 회전하는 플랫폼 셰이커(90 - 100rpm)에서 교반합니다.
- 세척 후 페인트 브러시를 사용하여 유리 현미경 슬라이드에 섹션을 장착하고 최소 2시간 동안 자연 건조합니다.
알림: 섹션은 슬라이드에 평평하게 부착되어야 하며, 접힌 부분이 있으면 세탁 중에 분리될 수 있습니다. - 소수성 배리어 펜을 사용하여 섹션 주위에 장벽을 그려 FISH 시약을 섹션으로 제한합니다. 다시 한 번, 배리어 펜으로 그린 윤곽선의 내부 영역을 최소화하는 것이 중요합니다.
가능한 중단점: 절편을 실온에서 하룻밤 동안 보관하여 다음날 분석을 계속할 수 있습니다.
3. 물고기 분석
참고: 프로토콜의 나머지 부분은 신선 냉동 조직과 고정 냉동 조직 모두에 적용됩니다.
- 하이브리드화 및 증폭 단계를 위한 시약과 기기를 준비합니다.
- 벤치탑 인큐베이터와 수조를 40°C로 설정합니다.
- 슬라이드를 배양하기 위해 가습되고 빛으로 보호되는 챔버를 준비합니다. 가습은 조직의 건조를 방지합니다 - 슬라이드는 습한 저장소 위에 안전하게 위치합니다. 이상적으로, 챔버는 견고한 폴리스티렌으로 만들어지며, 포화 수증기 분위기를 유지하기 위해 차광 및 밀폐 되어 있습니다. 챔버의 폐쇄는 움직임을 피하기 위해 최소한의 마찰에 의존합니다. 우리는 바닥에 젖은 실험실 물티슈(재료 표)가 늘어선 슬라이드 박스를 사용했습니다. 슬라이드 박스를 인큐베이터 안에 넣어 40°C로 예열합니다.
- 수조를 사용하여 50x 세척 버퍼(재료 표)와 프로브를 40°C로 10분 동안 데운 다음 실온으로 식힙니다.
- 1x 스톡 농도에서 1x 세척 버퍼 50L를 준비합니다.
- 프로브 혼합물 준비(재료 표): C1 프로브는 재고 농도에서 바로 사용할 수 있는 반면 C2 및 C3 프로브는 50배 농도로 배송되며 키트에 제공된 희석제로 희석해야 합니다.
알림: 프로브 혼합물은 4°C에서 최대 6개월 동안 보관할 수 있습니다.
- 프로테아제 치료
- Protease III(Table of Materials)로 절편을 실온에서 30분 동안 배양합니다.
참고: 다운스트림 공정(프로브 혼합물, 증폭 용액, 차단 완충액 및 항체 혈청)의 프로테아제 III 및 배양 시약이 섹션을 완전히 덮는지 확인하십시오. 피펫 팁을 사용하여 소수성 장벽 내부의 전체 영역을 덮기 위해 시약을 섹션에 퍼뜨릴 수 있습니다. - 큰 플라스틱 사각형 페트리 접시에 0.1M PBS로 매번 2분 동안 슬라이드를 두 번 세척합니다. 여기서는 245mm x 245mm 정사각형 생물검정 접시를 사용하였다(Table of Materials). 접시의 한쪽에서 잡고 부드럽게 3-5회 기울입니다. 세척 후 슬라이드에서 초과 0.1M PBS를 튕기고 즉시 다음 시약을 추가합니다. 티슈 부분을 건조시키지 마십시오.
알림: 세척할 때마다 슬라이드는 실온의 용액에 담급니다. 이것은 모든 후속 세척 단계에 대한 워크플로입니다. 고정된 30μm 두께의 섹션은 14μm 두께의 섹션보다 슬라이드에서 더 쉽게 제거되며 세척 중에 부드럽습니다.
- Protease III(Table of Materials)로 절편을 실온에서 30분 동안 배양합니다.
- 하이브리드화 및 증폭
- 프로테아제 용액을 씻어낸 후 슬라이드를 가습되고 예열된 챔버에 넣습니다. benchtop 인큐베이터 내부에서 40°C에서 2시간 동안 프로브 혼합물(재료 표)로 섹션을 배양합니다.
참고: 샘플 RNA 품질과 최적의 투과성을 평가하기 위해 양성 및 음성 대조군 프로브를 위해 최소 2개의 섹션이 따로 마련되어 있는지 확인하십시오. 양성 대조군 프로브는 가사 유전자를 표적으로 합니다. 여기서는 유비퀴틴 C(UBC, 고농도), 펩티딜프로필 이소머라제 B(PPIB, 중간 정도) 및 RNA 중합효소 2a(POLR2A, 저농도)를 표적으로 하는 RNA의 칵테일이었습니다. 음성 대조군 프로브는 일반적으로 쥐 뇌 샘플에는 없는 박테리아 4-하이드록시-테트라하이드로디피콜리네이트 환원효소(DapB) 유전자를 표적으로 합니다. 양성 DapB 신호는 샘플의 비특이적 신호 및/또는 박테리아 오염을 나타냅니다. - 프로브 혼합물과의 혼성화 후 신호 증폭 단계는 각각 40°C에서 Amp 1-FL(30분), Amp 2-FL(15분), Amp 3-FL(30분) 및 Amp 4-FL(15분)을 사용한 배양으로 구성됩니다. 제공된 스포이드 병을 사용하여 증폭 용액으로 조직 부분을 덮습니다. 마지막 증폭 단계에 따라 IHC 분석을 진행합니다.
- 프로브 하이브리드화와 각 증폭 단계 사이에 2분 동안 세척 버퍼로 슬라이드를 두 번 헹굽니다.
- 프로테아제 용액을 씻어낸 후 슬라이드를 가습되고 예열된 챔버에 넣습니다. benchtop 인큐베이터 내부에서 40°C에서 2시간 동안 프로브 혼합물(재료 표)로 섹션을 배양합니다.
4. IHC 분석
- IHC 차단 단계
- 항체의 비특이적 결합을 방지하기 위해 FISH 분석 후 1x TBSm(50mM Tris-Cl, pH 7.5, 150mM NaCl, 0.05% merthiolate)에서 10% 정상 말 혈청, 0.3% Tween20을 포함하는 차단 용액으로 실온에서 절편을 1시간 동안 배양합니다. 1x TBSm, 5% 정상 말 혈청 및 0.1% Tween20을 포함하는 희석 완충액에 1차 항체를 준비합니다. 1차 항체 공급업체는 재료 표에 나열되어 있습니다.
- 면역조직화학(Immunohistochemistry)
- 슬라이드를 튕겨 과도한 차단 완충액을 제거하고 4°C에서 하룻밤 동안 1차 항체로 절편을 배양합니다.
- 슬라이드를 1x TBSm으로 3회(각 5분) 세척하고 1x TBSm, 1% 정상 말 혈청 및 0.1% Tween20을 함유한 희석액에 2차 항체를 넣고 실온에서 2시간 동안 배양합니다. 이 프로토콜에 사용되는 2차 항체는 재료 표에 나열되어 있습니다.
- DAPI(Table of Materials)를 사용하거나 사용하지 않고 장착 매체로 커버슬립하기 전에 3x TBSm(각 1분)으로 슬라이드를 5번 세척합니다.
5. 이미징
- 카메라가 장착된 형광 현미경으로 면역염색을 검사합니다(자세한 내용은 재료 표 참조). 대표 이미지를 20배 배율로 획득하고 TIFF 파일로 저장할 수 있습니다.
- 대표 이미지를 이미지 처리 소프트웨어(Table of Materials)로 내보내 밝기/대비를 조정하여 선명도를 높이고 실제 렌더링을 반영합니다.
6. 선택 사항: 표적 전사체의 정량 분석
참고: 이 기사는 방법 문서이며 정량적 결과는 제공되지 않습니다. 여기에 제시된 정량화 방법은 Dereli et al.에서 가져온 것입니다.10.
- 5.1에 설명된 대로 관심 영역에서 이미지를 획득하고 동일한 형광단의 모든 이미지에 동일한 현미경 및 카메라 설정(예: 노출 시간 및 광도)을 적용합니다.
- 이미지 분석 소프트웨어(Table of Materials)를 사용하여 신경 세포 프로파일을 플로팅합니다.
- 입체 뇌 아틀라스13에 따라 Bregma 수준을 참조하여 섹션을 정렬합니다.
- 동일한 형광단의 모든 이미지에 동일한 밝기와 대비를 적용합니다. DAPI 염색 핵이 있는 뉴런만 고려하십시오.
- 관심 영역 내에서 mRNA, 단백질 발현, mRNA/mRNA, 단백질/단백질 및 mRNA/단백질 동시 발현 세포의 수를 수동으로 계산합니다.
- 실험 결과의 편향을 줄이려면 실험 결과를 정량화하는 사람이 실험 그룹에 대해 눈가림을 받도록 합니다.
- 다음 Abercombie 방정식을 사용하여 Abercrombie 보정14 를 총 세포 수에 적용합니다.
수정된 셀 수 = 수동 셀 수 x 단면 두께 / (단면 두께 + 핵 크기)
예를 들어, 14μm 두께의 단면에 대하여, 평균 핵 폭은 7.7 ± 0.3 μm로 계산되고, 평균 단면 두께는 14 ± 1 μm로 계산되며, 5마리의 동물(10)에서 각각 30개의 세포 및10개의 단면을 기준으로 한다. Abercrombie 방정식에 따르면 수정된 셀 수는 수동 셀 수 x 14/(14+7.7)입니다.

그림 1: 신선 냉동 조직과 파라포름알데히드 고정 조직 모두에 대한 조직 전처리 단계의 병렬 워크플로우. 신선 냉동 조직의 처리 단계는 빨간색 윤곽선이 있는 상자에 표시되는 반면, 파라포름알데히드(PFA) 고정 조직의 처리 단계는 파란색 윤곽선이 있는 상자에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 결합된 FISH 프로브와 면역조직화학 절차의 요약. 조직 전처리 후, 첫 번째 프레임에서 볼 수 있듯이 슬라이드 장착 조직을 소수성 배리어 펜을 사용하여 둘러싸고 실온에서 프로테아제 용액에서 배양합니다. 세척 후, 조직을 순차적 증폭 단계 전에 2시간 동안 하이브리드화를 위해 벤치탑 인큐베이터로 옮깁니다. in situ hybridization 시스템은 프레임 3-66에서 볼 수 있듯이 독점적인 'Z 프로브' 설계, 프리앰프 및 앰프를 활용합니다. 조직이 FISH 프로브 처리를 거치면 일반 말 혈청으로 차단하기 전에 세척합니다. 1차 항체 배양은 항체-항원 결합을 최대화하기 위해 4°C에서 밤새 수행됩니다. 2차 항체 배양(2시간)은 실온에서 실시하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
여기에서는 마우스 NTS에서 각각 신선 냉동 및 파라포름알데히드 고정 조직을 사용하여 GalR1 및 GlyT2에 대한 mRNA 발현을 국소화하기 위해 멀티플렉스 FISH와 형광 IHC를 결합하는 방법을 간략하게 설명합니다. 분석법에 설명된 조직 처리, FISH 및 IHC 절차의 파이프라인은 그림 1 및 그림 2에 표시되어 있습니다. 표 1 은 각 그림에 사용된 FISH 프로브 및 항체 조합에 대한 요약을 제공합니다.
대조군 프로브는 워크플로우의 무결성을 보장하고 시료 품질을 확인하기 위해 표적 프로브와 동시에 일상적으로 분석됩니다. DapB 라벨링이 없으면 건전한 조직 품질과 무결성, 박테리아 오염이 없음을 확인할 수 있습니다(그림 3A). 유비퀴틴 C(UBC, 높은 존재비), 펩티딜프로필 이소머라제 B(PPIB, 중간 정도의 존재비) 및 RNA 중합효소 2a(POLR2A, 낮은 존재비) mRNA를 표적으로 하는 양성 대조군 프로브의 표지는 RNA 무결성을 확인하며, 분석 간에 관찰된 신호는 분석 간 변동성을 보정하는 데 사용할 수 있습니다(그림 3B). FISH 프로브 발현을 검증하기 위해 mRNA 전사체를 발현하기 위해 이전에 설명된 대조군 조직을 사용했습니다. 예를 들어, GalR1 mRNA 발현은 앞서 기술된 바와 같이 시상에서 양성인 것으로 확인되었다10,15. Phox2b mRNA 분포는 Phox2b 항체와 함께 colabelling하여 추가로 검증하였다; FISH 라벨링은 Phox2b 항체를 사용하여 양성으로 염색된 뉴런에서만 존재함을 확인했습니다(그림 5).
NTS의 GalR1+ 뉴런을 인접 핵과 구별하기 위해 추가 신경화학적 마커를 사용했습니다. TH, Phox2b 또는 Phox2b-GFP 면역 반응 (그림 4-6) 및 Phox2b FISH (그림 5 및 그림 6)는 NTS 뉴런이 이전에 Phox2b 및 TH 16,17을 발현하는 것으로 보고되었기 때문에 등쪽 뇌간의 다른 핵과 NTS를 구별했습니다. NTS는 콜린성 핵(cholinergic nuclei)에 의해 자리 잡고 있기 때문에(미주신경의 설하핵(hypoglossal nucleus)과 배쪽 운동핵(dorsal motor nucleus of the vagus, DMNX)의 등쪽에 위치하고, 전정핵(vestibular nucleus)의 복부에 위치하기 때문에 콜린성 마커 vAChT18과 함께 표지했습니다(그림 4). 따라서 NTS 내에서 GalR1의 발현은 TH 및 Phox2b와 관련하여 평가되었으며, vAChT 표지는 rostrocaudal, dorsoventral 및 mediolateral 좌표에 대한 공간 배향을 도왔습니다. NTS의 모든 TH 면역 활성 및 GalR1 mRNA 양성 뉴런은 Phox2b-GFP 면역 활성이었지만 NTS의 모든 Phox2b-GFP 면역 활성 뉴런이 TH 면역 활성 또는 GalR1 mRNA 양성은 아니었습니다(그림 4). 또한, 저밀도 수용체 GalR1에 대한 mRNA가 TH 및 vAChT 면역반응성 뉴런에 없음을 입증했습니다.
신선 냉동 제제에서 FISH 프로브 분석과 결합했을 때 IHC 성공은 표적 단백질의 세포 내 위치에 따라 달라졌습니다. 예를 들어, vAChT(시냅스 소포막 결합 단백질)는 명확하게 면역 표지된 반면, TH 및 GFP(세포질 단백질)는 무기한 면역 표지되어 희미하게만 관찰되었습니다(그림 4). 우리는 이 불명확한 표지를 '응집성'이라고 설명하는데, 이는 세포가 명확한 윤곽이 없고 배경과 구별하기 어렵다는 것이 입증되었기 때문입니다. 동일한 신선 냉동 조직 절편에서 세포질 GalR1 mRNA의 GalR1 FISH 프로브 라벨링이 반점적이고 명확하게 관찰되었습니다(그림 4).
또한, TH 및 vAChT 항체가 동일한 숙주에서 발생하기 때문에 두 단백질은 동일한 2차 항체를 사용하여 표지되었으므로 동일한 색상의 형광단(여기광: 594)을 사용하여 표지되었습니다. 그들은 두 가지 이유로 쉽게 구별됩니다 : 그들은 결코 동일한 뉴런에서 공동 라벨링하지 않으며, 세포 내 국소화는 이러한 단백질에 대해 다릅니다. 반점 모양을 나타내는 소포의 vAChT와 세포질 및 신경 돌기의 TH.
IHC 품질(신선 냉동 제제에서)이 단백질 세포 내 국소화에 의존한다는 가설을 뒷받침하기 위해 뉴런에서 Phox2b mRNA(세포질에 위치), GFP(세포질에서 과발현) 및 Phox2b 단백질(주로 핵에서 발견)에 대한 표지를 비교했습니다. 예상대로, 우리의 결과는 NTS의 개별 뉴런에서 Phox2b mRNA, GFP 및 Phox2b 항체 표지의 중첩을 보여줍니다(그림 5). 세포질 mRNA 표지가 있는 세포는 Phox2b 단백질의 핵 표지를 나타내는 세포와 일치하여 결합된 FISH-IHC 방법의 검증을 제공했습니다. 세포질 Phox2b-GFP는 응집 모양을 가졌지만 핵 Phox2b 단백질 신호는 명확하고 특이적이었습니다. 결론적으로, 신선 냉동 제제에서 FISH와 결합하면 vAChT 및 Phox2B를 포함한 막 결합 단백질이 세포질 단백질보다 더 높은 품질의 면역 표지를 나타냅니다.
대조적으로, IHC는 FISH와 함께 고정된 냉동 절편에서 수행되었을 때 세포 내 국소화에 관계없이 신뢰할 수 있었습니다. 그림 6과 같이 GlyT2 mRNA 및 Phox2b mRNA에 대한 멀티플렉스 FISH는 성공적이었습니다. GlyT2 mRNA 양성 뉴런은 NTS 내에서가 아니라 NTS의 복부에 위치했습니다. GlyT2+ 및 Phox2b+ 뉴런은 공동 국소화되지 않았습니다. Phox2b+ NTS 뉴런의 하위 집단은 TH 면역 활성이었고 GlyT2 mRNA를 포함하지 않았습니다. TH 면역 활성 뉴런은 동일한 조직 섹션에서 뚜렷하며 양성으로 표지된 체세포 및 신경 돌기를 나타냅니다(그림 6). 이것은 신선하게 동결된 조직 절편에서 TH 면역 반응성 뉴런의 '응집성' 모양과 대조됩니다. 따라서 여기에 설명된 고정 냉동 제제는 RNAscope와 함께 면역조직화학적으로 세포질 단백질을 안정적으로 표적화할 수 있는 대체 조직 전처리 방법입니다.

그림 3: 측면 중격 수준(Bregma 1.1 - -0.1)에서 코로나 마우스 전뇌 절편의 대표적인 현미경 이미지는 양성 및 음성 대조군 프로브의 표지를 보여줍니다 . (A) 박테리아 4-하이드록시-테트라하이드로디피콜리네이트 환원효소(DapB)를 사용한 ISH 후 신호 부족은 배경 신호가 없음을 확인합니다. (B) 유비퀴틴 C(UBC), 펩티딜프로필 이소머라제 B(PPIB) 및 RNA 중합효소 2a(POLR2A)를 표적으로 하는 양성 대조군 프로브를 사용한 표지는 각각 높음, 중간 및 낮은 존재비 표적에서 예상되는 신호를 보여줍니다. 스케일 바는 50 μm입니다. 모든 이미지는 20x 대물렌즈로 획득되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
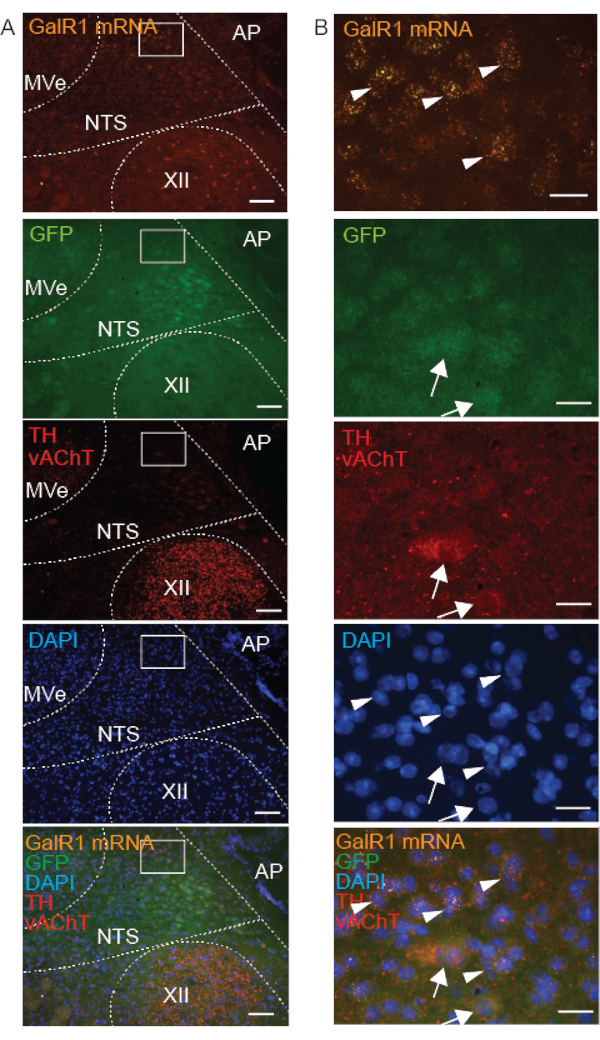
그림 4: Phox2b-GFP 마우스의 신선하게 얼어붙은 관상 뇌간 절편의 대표적인 현미경 이미지는 단독 관로(NTS) 영역의 핵에서 GalR1 mRNA(FISH)와 3개 단백질(IHC)의 결합된 표지 를 보여줍니다. A의 삽입은 B에서 확대됩니다. GalR1 mRNA는 반점 FISH 프로브 라벨링(화살촉)으로 표시됩니다. 세포질 단백질 GFP 및 티로신 하이드록실라아제(TH)를 표적으로 하는 항체는 "응집성" 표지(화살표)를 나타냈습니다. 수포성 아세틸콜린 수송체(vAChT) 면역 반응은 설하핵(XII)에서 입증되었습니다(빨간색 반점 표지). 스케일 바는 A에서 100μm, B에서 25μm입니다. 모든 이미지는 20x 대물렌즈로 획득되었습니다. 다른 약어: area postrema(AP), medial vestibular nucleus(MVe). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
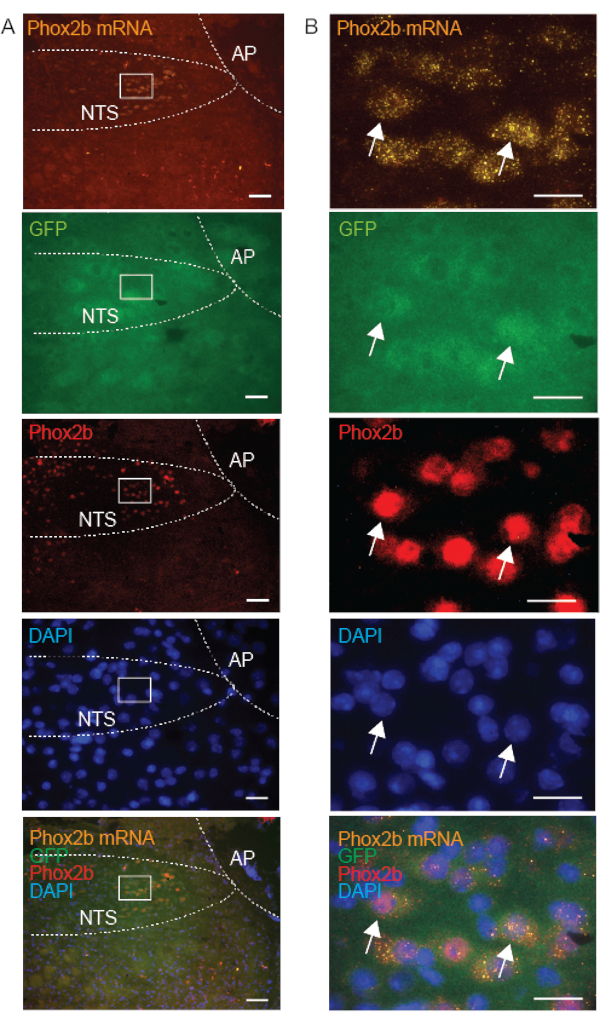
그림 5: Phox2b-GFP 마우스의 신선 냉동 관상 뇌간 절편의 대표적인 현미경 이미지로, Phox2b mRNA(물고기), GFP(IHC) 및 Phox2b 단백질(IHC)의 세 가지 접근 방식을 사용하여 고독관(NTS)의 핵에서 Phox2b를 표적으로 하는 것을 보여줍니다. Phox2b 단백질은 핵에 국한되어 있습니다. A의 삽입은 B에서 확대됩니다. 화살표는 Phox2b 프로브(주황색-550), GFP 항체(녹색-488) 및 Phox2b 항체(빨간색-647)로 삼중 표지된 뉴런을 나타냅니다. 스케일 바는 A에서 100μm, B에서 25μm입니다. 모든 이미지는 20x 대물렌즈로 획득됩니다. 다른 약어 : area postrema (AP). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 세포질 단백질(티로신 하이드록실라아제[TH])의 신뢰할 수 있는 면역 표지와 결합된 성공적인 FISH를 보여주는 고정된 동결 관상 뇌간 절편의 대표 이미지. 독방관(NTS) 영역의 핵에서 글리신 수송체 2(GlyT2-red-647, 채워진 화살촉) 및 Phox2b(노란색-550, 화살표) mRNA 표지를 보여주는 이중 FISH. FISH는 TH 단백질(청색-346, 빈 화살촉)을 위해 IHC와 결합되었습니다. A의 삽입은 B에서 확대됩니다. 눈금 막대는 25μm입니다. 모든 이미지는 20x 대물렌즈로 획득되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 1차 항체 또는 RNAscope 프로브 | 2차 항체 또는 Amp 4-FL-Alt 디스플레이 모듈 | 여기(nm) | 조직 준비 | ||
| 그림 3 | 탐침 | 폴런2A(C1) | Amp 4-FL-Alt B 디스플레이 모듈 | 647 | 신선 냉동 |
| 탐침 | PPIB(C2) | Amp 4-FL-Alt B 디스플레이 모듈 | 488 | ||
| 탐침 | UBC(C3) | Amp 4-FL-Alt B 디스플레이 모듈 | 550 | ||
| 탐침 | DapB(C1, C2, C3) | Amp 4-FL-Alt B 디스플레이 모듈 | 647, 488, 550 | ||
| 다피 | 346 | ||||
| 그림 4 | 항체 | 토끼 안티 GFP | 당나귀 안티 토끼 | 488 | 신선 냉동 |
| 항체 | 양 안티 TH | 당나귀 안티 양 | 647 | ||
| 항체 | 염소 안티 vAChT | 당나귀 안티 염소 | 647 | ||
| 탐침 | 갈R1 (C1) | Amp 4-FL-Alt B 디스플레이 모듈 | 550 | ||
| 다피 | 346 | ||||
| 그림 5 | 항체 | 토끼 안티 GFP | 당나귀 안티 토끼 | 488 | 신선 냉동 |
| 항체 | 마우스 안티 Phox2b | 당나귀 안티 마우스 | 647 | ||
| 탐침 | 폭스2b(C2) | Amp 4-FL-Alt A 디스플레이 모듈 | 550 | ||
| 다피 | 346 | ||||
| 그림 6 | 항체 | 마우스 안티 TH | 당나귀 안티 마우스 | 346 | 부정하게 결정된 |
| 탐침 | 글라이티2 | Amp 4-FL-Alt A 디스플레이 모듈 | 647 | ||
| 탐침 | 폭스2b | Amp 4-FL-Alt A 디스플레이 모듈 | 550 |
표 1: 그림 3-6에 사용된 FISH 프로브, 항체 및 해당 형광단 조합.
토론
신경 과학에서 FISH와 IHC는 신경 하위 집단 내에서 mRNA 또는 단백질의 공간 조직 및 기능적 중요성을 조사하는 데 일상적으로 사용됩니다. 이 연구에서 설명된 프로토콜은 뇌 절편에서 mRNA와 단백질을 동시에 검출할 수 있는 능력을 향상시킵니다. 당사의 결합된 다중 FISH-IHC 분석은 신선 냉동 및 고정 뇌 제제 모두에서 NTS의 뚜렷한 신경 하위 집단의 표현형 식별을 가능하게 했습니다. 고정 냉동 조직 제제에서 FISH-IHC는 신뢰할 수 있는 IHC 결과를 생성했습니다. 예를 들어, 저농도 및 고농도 mRNA(각각 GalR1 및 GlyT2) 및 IHC(표적 티로신 하이드록실라아제)에 대한 멀티플렉스 FISH는 GalR1 및 GlyT2가 비카테콜아민성 NTS 뉴런에서 발현됨을 밝혔습니다. TH에 대한 IHC는 신선 냉동 조직에서 성공하지 못했으며, 이는 신선 냉동 제제에서 FISH-IHC의 제한된 용량을 강조합니다.
ISH는 다양한 시나리오에서 IHC보다 더 적합할 수 있습니다. 첫째, IHC는 수용체와 같은 저농도 단백질을 검출할 때 잘 수행되지 않을 수 있습니다. ISH를 사용하여 이러한 단백질에 대해 상대적으로 더 높은 농도의 mRNA를 표적화하면 검출 가능성이 향상됩니다1. 둘째, 신경 펩티드와 같은 단백질은 종종 세포 소마19에서 번역된 후 축삭 말단으로 이동한다. 신경 펩타이드가 IHC로 표적화되면 세포의 축삭돌기와 말단은 항체로 표지되지만 소마는 표지되지 않아 기원 세포를 식별하거나 세포 수의 정량 분석을 수행하는 능력이 감소합니다. 그러나 모든 단백질을 암호화하는 mRNA가 소마에 국한된 것으로 밝혀지기 때문에 ISH 기술이 유리합니다. 마지막으로, 항체는 일부 단백질 종에 대해 쉽게 이용할 수 없거나, 이용 가능한 항체가 다른 단백질체학 기술(예를 들어, 웨스턴 블롯)에는 적합하지만 IHC에는 적합하지 않습니다. 이러한 상황에서는 mRNA 표지 방법이 유용한 것으로 입증되었습니다. 주의할 점은 mRNA가 항상 단백질로 번역되는 것은 아니기 때문에 단백질 식별을 위한 대리물만 제공한다는 것입니다. 상용 FISH 키트는 비용이 많이 들 수 있고 ISH 프로브는 항체에 비해 상업적으로 이용 가능할 가능성이 낮기 때문에 FISH와 IHC를 결합하면 동시에 라벨링할 수 있는 표적의 수를 늘릴 수 있는 비용 및 시간 효율적인 전략을 제시할 수 있습니다.
신선 냉동 조직 준비와 고정 조직 준비는 FISH 프로브 분석 후 성공적인 IHC를 부여하는 요소였습니다. 핵, 소포 및 세포질 단백질을 표적으로 하는 항체를 사용하여 IHC를 테스트한 결과, 세포질 단백질(TH 및 GFP)이 아닌 신선 냉동 샘플에서 막 결합 단백질(vAChT 및 Phox2b)의 신뢰할 수 있는 표지를 발견했습니다. Phox2b 단백질과 mRNA의 '응집성' Phox2b-GFP 표지의 동시 발현은 전사체를 발현하는 뉴런이 관련 단백질도 발현한다는 것을 검증하여 뉴런의 신경화학적 정체성을 확인했습니다(그림 5). 대조적으로, 고정된 동결 조직 제제는 항원의 세포 내 국소화에 관계없이 신뢰할 수 있는 IHC 표지를 생성했습니다. 이전 연구에서는 프로테아제(예: 프로나제 8,20) 전처리가 IHC에 해로운 영향을 미칠 수 있음을 입증했습니다. RNAscope 프로토콜에 사용되는 프로테아제 용액의 내용물은 독점적이며, RNAscope 프로브가 세포에 접근하려면 프로테아제에 의한 투과화가 권장됩니다. 여기에 기술된 항체를 이용한 세포질 단백질의 표지는 자유 부유 30μm 고정 동결 마우스 뇌 절편 10,21,22에서 이전에 검증되었다. 30μm 두께의 고정 샘플을 슬라이드 장착하고 제조업체에서 권장하는 14μm 두께의 신선 냉동 섹션과 달리 FISH-IHC 프로토콜을 수행했습니다. 분석 수정 또는 다른 변수(항원 회수, 더 높은 항체 농도, 프로테아제 변화)의 변경이 없는 경우, FISH 프로브 라벨링과 함께 세포질 및 축삭 돌기의 입증된 라벨링과 함께 두껍고 고정된 샘플에서 신뢰할 수 있는 IHC를 달성했습니다(그림 6). 다른 연구 그룹에서도 유사한 접근법을 사용했지만(7,8,9), 이번 연구는 뉴런과 형광 설정에서 결합된 ISH-IHC를 달성했습니다.
기록해야 할 방법에는 일련의 중요한 단계가 있었습니다. 신선한 냉동 준비의 경우 고정 시간은 15분을 초과해서는 안 됩니다. 고정 시간이 길수록 배경 라벨링이 더 높아졌습니다. 프로테아제 단계는 상이한 두께의 조직과 다양한 기관으로부터의 조직이 투과성을 달성하기 위해 상이한 유형의 프로테아제를 필요로 하기 때문에 최적화되었다. 고정된 동결 섹션은 유리 슬라이드에 덜 부착되고 세척 단계에서 더 쉽게 제거됩니다. 따라서 조직 손실이나 손상을 방지하기 위해 고정된 동결 부분을 수동으로 처리할 때 각별한 주의를 기울여야 합니다.
FISH와 IHC를 결합하는 것이 효과적인 전략이라는 것을 알았지만 두 방법을 결합할 때 비용과 기술적으로 까다로운 분석이라는 단점이 있습니다. 이 연구의 한 가지 한계는 두 조직 준비 프로토콜을 나란히 비교하지 않았다는 것입니다. 또한 결과에 대한 평가는 형광 현미경이 수용할 수 있는 채널 수에 의해 제한되었습니다. 이 설정은 주어진 시간에 최대 4개의 채널(346, 488, 550 및 647nm(여기광))을 허용했습니다. 동일한 형광단을 사용하여 서로 다른 세포 내 국소화를 가진 두 개의 단백질을 라벨링하여 5개의 표적에 대한 다중 라벨링을 달성할 수 있었습니다(그림 4, 표 1). 컨포칼 현미경을 사용하면 IHC를 통한 개별 단백질 라벨링 또는 전이유전자에 의해 발현되는 형광 분자의 이미징에 많은 추가 형광단의 개별 여기(discrete excitation)를 사용할 수 있습니다.
FISH와 형광 IHC를 결합하면 각 기술의 신뢰성을 단독으로 떨어뜨릴 수 있습니다. 향후에는 항원 회수 처리를 통해 신선 냉동 조직의 세포질 단백질 표지를 개선하는 것을 목표로하고 있습니다 23. 이전 연구는 열 유도 항원 회수가 단백질 에피토프24,25,26의 접근성을 증가시킨다는 것을 보여줍니다. 열처리는 단백질의 가교결합과 메틸올기를 절단하고 조직의 항원을 펼쳐 생물학적 조건에서 3차 단백질 구조에 숨겨져 있을 항원결정기를 노출시킵니다. 이러한 접근성은 단백질 라벨링의 성공을 향상시킬 수있습니다 26,27. 또한 동일한 세포질 단백질의 다른 에피토프를 표적으로 삼아 단백질-항체 라벨링의 성공 여부가 사용된 특정 항체 클론에 따라 달라지는지 확인합니다.
결론적으로, FISH와 IHC의 결합은 NTS와 같은 뇌의 이질적인 세포 집단의 신경화학적 식별에 유용합니다. 이 연구는 mRNA와 단백질의 동시 다중 형광 표지를 위해 서로 다른 쥐 뇌간 조직 제제(신선 냉동 또는 고정)를 분석하는 두 가지 프로토콜을 제시합니다. 두 프로토콜 모두 GalR1과 같은 저농도 mRNA의 발현 패턴을 검출하는 데 널리 적용될 수 있습니다. 단백질 분해 효소가 투과된 두꺼운(30μm) 고정 냉동 제제는 얇은(14μm) 신선 냉동 제제와 비교할 때 더 신뢰할 수 있는 세포질 단백질 검출과 더 많은 조직 처리 문제를 제공했습니다.
감사의 말
이 연구는 호주 연구 위원회 디스커버리 프로젝트 보조금 DP180101890와 Rebecca L Cooper Medical Research Foundation 프로젝트 보조금 PG2018110
자료
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| C57BL/6 mouse | Australian BioResources, Moss Vale | MGI: 2159769 | |
| Phox2b-eGFP mouse | Australian BioResources, Moss Vale | MGI: 5776545 | |
| REAGENTS | |||
| Cyanoacrylate | Loctite | ||
| Ethylene Glycol | Sigma-Aldrich | 324558 | |
| Heparin-Sodium | Clifford Hallam Healthcare | 1070760 | Consult local veterinary supplier or pharmacy. |
| Lethabarb (Sodium Pentabarbitol) Euthanasia Injection | Virbac (Australia) Pty Ltd | N/A | Consult a veterinarian for local pharmaceutical regulations regarding Sodium Pentabarbitol |
| Molecular grade agarose powder | Sigma Aldrich | 5077 | |
| OCT Compound, 118mL | Scigen Ltd | 4586 | |
| Paraformaldehyde, prilled, 95% | Sigma-Aldrich | 441244-1KG | |
| Polyvinylpyrrolidone, average mol wt 40,000 (PVP-40) | Sigma-Aldrich | PVP40 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | With or without DAPI |
| RNAscope Multiplex Fluorescent Reagent Kit (up to 3-plex capability) | Advanced Cell Diagnostics, Inc. (ACD Bio) | ADV320850 | Includes 50x Wash buffer and Protease III |
| RNase Away | Thermo-Fisher Scientific | 7003 | |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | |
| Tween-20, for molecular biology | Sigma-Aldrich | P9416 | |
| EQUIPMENT | |||
| Benchtop incubator | Thermoline scientific micro incubator | Model: TEI-13G | |
| Brain Matrix, Mouse, 30g Adult, Coronal, 1mm | Ted Pella | 15050 | |
| Cryostat | Leica | CM1950 | |
| Drawing-up needle (23 inch gauge) | BD | 0288U07 | |
| Hydrophobic Barrier Pen | Vector labs | H-4000 | |
| Kimtech Science Kimwipes Delicate Task Wipes | Kimberley Clark Professional | 34120 | |
| Olympus BX51 | Olympus | BX-51 | |
| Peristaltic pump | Coleparmer Masterflex | L/S Series | |
| Retiga 2000R Digital Camera | QImaging | RET-2000R-F-CLR | colour camera |
| SuperFrost Plus Glass Slides (White) | Thermo-Fisher Scientific | 4951PLUS4 | |
| Vibrating Microtome (Vibratome) | Leica | VT1200S | |
| Whatman qualitative filter paper, Grade 1, 110 mm diameter | Merck | WHA1001110 | |
| SOFTWARES | |||
| CorelDRAW | Corel Corporation | Version 7 | |
| FIJI (ImageJ Distribution) | Open Source/GNU General Public Licence (GPL) | N/A | ImageJ 2.x: Rueden, C. T.; Schindelin, J. & Hiner, M. C. et al. (2017), "ImageJ2: ImageJ for the next generation of scientific image data", BMC Bioinformatics 18:529, PMID 29187165, doi:10.1186/s12859-017-1934-z and Fiji: Schindelin, J.; Arganda-Carreras, I. & Frise, E. et al. (2012), "Fiji: an open-source platform for biological-image analysis", Nature methods 9(7): 676-682, PMID 22743772, doi:10.1038/nmeth.2019 |
| PRIMARY ANTIBODIES | |||
| Anti-Tyrosine Hydroxylase Antibody | Millipore Sigma | AB1542 | Sheep polyclonal (1:1000 dilution), RRID: AB_90755 |
| Anti-Tyrosine Hydroxylase Antibody, clone LNC1 | Millipore Sigma | MAB318 | Mouse monoclonal (1:1000 dilution), RRID: AB_2201528 |
| Anti-Vesicular Acetylcholine Transporter (VAchT) Antibody | Sigma-Aldrich | ABN100 | Goat polyclonal (1:1000 dilution), RRID: AB_2630394 |
| GFP Antibody | Novus Biologicals | NB600-308 | Rabbit polyclonal (1:1000 dilution), RRID: AB_10003058 |
| Phox2b Antibody (B-11) | Santa Cruz Biotechnology | sc-376997 | Mouse monoclonal (1:1000 dilution), RRID: AB_2813765 |
| SECONDARY ANTIBODIES | |||
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 711-545-152 | Donkey anti-Rabbit (1:400 dilution), RRID: AB_2313584 |
| AMCA AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-155-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_AB_2340725 |
| Cy5 AffiniPure Donkey Anti-Goat IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 705-175-147 | Donkey anti-Goat (1:400 dilution), RRID: AB_2340415 |
| Cy5 AffiniPure Donkey Anti-Mouse IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Rb, Rat, Shp Sr Prot) | Jackson ImmunoResearch | 715-175-151 | Donkey anti-Mouse (1:400 dilution), RRID: AB_2619678 |
| Cy5 AffiniPure Donkey Anti-Sheep IgG (H+L) (min X Ck, GP, Sy Hms, Hrs, Hu, Ms, Rb, Rat Sr Prot) | Jackson ImmunoResearch | 713-175-147 | Donkey anti-Sheep (1:400 dilution), RRID: AB_2340730 |
| RNASCOPE PROBES | |||
| Galanin Receptor 1 oligonucleotide probe | ACDBio | 448821-C1 | targets bp 482 - 1669 (Genebank ref: NM_008082.2) |
| Glycine transporter 2 oligonucleotide probe | ACDBio | 409741-C3 | targets bp 925 - 2153 (Genebank ref: NM_148931.3) |
| Phox2b oligonucleotide probe | ACDBio | 407861-C2 | targets bp 1617 - 2790 (Genebank ref: NM_008888.3) |
참고문헌
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Annese, T., et al. RNAscope dual ISH-IHC technology to study angiogenesis in diffuse large B-cell lymphomas. Histochemistry and Cell Biology. 153 (3), 185-192 (2020).
- Morrison, J. A., McKinney, M. C., Kulesa, P. M. Resolving in vivo gene expression during collective cell migration using an integrated RNAscope, immunohistochemistry and tissue clearing method. Mechanisms of Development. 148, 100-106 (2017).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, 55(2014).
- Stempel, A. J., Morgans, C. W., Stout, J. T., Appukuttan, B. Simultaneous visualization and cell-specific confirmation of RNA and protein in the mouse retina. Molecular Vision. 20, 1366-1373 (2014).
- Kersigo, J., et al. A RNAscope whole mount approach that can be combined with immunofluorescence to quantify differential distribution of mRNA. Cell and Tissue Research. 374 (2), 251-262 (2018).
- Grabinski, T. M., Kneynsberg, A., Manfredsson, F. P., Kanaan, N. M. A method for combining RNAscope in situ hybridization with immunohistochemistry in thick free-floating brain sections and primary neuronal cultures. PLoS One. 10 (3), 0120120(2015).
- Baleriola, J., Jean, Y., Troy, C., Hengst, U. Detection of axonally localized mRNAs in brain sections using high-resolution in situ hybridization. Journal of Visualized Experiments. (100), e52799(2015).
- Fe Lanfranco, M., Loane, D. J., Mocchetti, I., Burns, M. P., Villapol, S. Combination of fluorescent in situ hybridization (FISH) and immunofluorescence imaging for detection of cytokine expression in microglia/macrophage cells. Bio-Protocol. 7 (22), (2017).
- Dereli, A. S., Yaseen, Z., Carrive, P., Kumar, N. N. Adaptation of respiratory-related brain regions to long-term hypercapnia: focus on neuropeptides in the RTN. Frontiers in Neuroscience. 13, 1343(2019).
- Lazarenko, R. M., et al. Acid sensitivity and ultrastructure of the retrotrapezoid nucleus in Phox2b-EGFP transgenic mice. Journal of Comparative Neurology. 517 (1), 69-86 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Academic Press. (2004).
- Abercrombie, M. Estimation of nuclear population from microtome sections. Anatomical Records. 94, 239-247 (1946).
- Kerr, N., et al. The generation of knock-in mice expressing fluorescently tagged galanin receptors 1 and 2. Molecular and Cellular Neurosciences. 68, 258-271 (2015).
- Kachidian, P., Pickel, V. M. Localization of tyrosine hydroxylase in neuronal targets and efferents of the area postrema in the nucleus tractus solitarii of the rat. Journal of Comparative Neurology. 329 (3), 337-353 (1993).
- Stornetta, R. L., et al. Expression of Phox2b by brainstem neurons involved in chemosensory integration in the adult rat. Journal of Neuroscience. 26 (40), 10305-10314 (2006).
- Gilmor, M. L., et al. Expression of the putative vesicular acetylcholine transporter in rat brain and localization in cholinergic synaptic vesicles. Journal of Neuroscience. 16 (7), 2179-2190 (1996).
- Fisher, J. M., Sossin, W., Newcomb, R., Scheller, R. H. Multiple neuropeptides derived from a common precursor are differentially packaged and transported. Cell. 54 (6), 813-822 (1988).
- Towle, A. C., Lauder, J. M., Joh, T. H. Optimization of tyrosine-hydroxylase immunocytochemistry in paraffin sections using pretreatment with proteolytic-enzymes. Journal of Histochemistry and Cytochemistry. 32 (7), 766-770 (1984).
- Biancardi, V., et al. Mapping of the excitatory, inhibitory, and modulatory afferent projections to the anatomically defined active expiratory oscillator in adult male rats. Journal of Comparative Neurology. 529 (4), 853-884 (2021).
- Matthews, D. W., et al. Feedback in the brainstem: an excitatory disynaptic pathway for control of whisking. Journal of Comparative Neurology. 523 (6), 921-942 (2015).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Shi, S. R., Key, M. E., Kalra, K. L. Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. Journal of Histochemistry and Cytochemistry. 39 (6), 741-748 (1991).
- Yamashita, S., Katsumata, O. Heat-induced antigen retrieval in immunohistochemistry: mechanisms and applications. Methods in Molecular Biology. 1560, 147-161 (2017).
- Yamashita, S., Okada, Y. Mechanisms of heat-induced antigen retrieval: analyses in vitro employing SDS-PAGE and immunohistochemistry. Journal of Histochemistry and Cytochemistry. 53 (1), 13-21 (2005).
- Yamashita, S. Heat-induced antigen retrieval: mechanisms and application to histochemistry. Progress in Histochemistry and Cytochemistry. 41 (3), 141-200 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유